质谱流式细胞仪工作原理
重组人粒细胞巨噬细胞集落刺激因子的生物质谱和毛细管电泳法
做cell biology实验,细胞铺板大概是最常见的一个实验了。但是有很多人不是很得要领,铺得不是均匀: 要么中间密周围稀,要么周围密中间秃顶。以下是我的一些技巧,希望可以帮助到大家。1. 一般96孔板我每孔是加100微升细胞悬液,从孔的左边靠近底部加入,加完半边板后,将未加的细胞悬液混一下再,继续加剩余的半边板子,都加完后盖上盖子,左手轻轻扶住板的左边,右手轻轻敲击板的右边缘,注意把握力度(我一般轻巧敲三下),太强或次数太多会导致细胞集中成堆,将板顺时针旋转(逆时针效果不好),依次敲击剩余三个边,静置约5分钟,放入37度培养箱。 6孔板12孔板或24孔板,我均采用将第一个孔加入少量无血清培养基,晃动浸润整个孔底,然后用移液枪吸至第二孔,同样方法浸润孔底,其它孔一次类推,这样整个孔底都是湿润的,细胞悬液会平铺在整个孔底,加细胞悬液的时候可以避免加在中间中间细胞多,而加在周边晃匀后周边细胞多中间少的现象,细胞分散较均匀,注意加完细胞悬液后要放工作台静置一下。这个方法就是有点慢,但操作熟练了也不慢。也可以采用轻拍的方式,但力度没有96孔板好掌握,效果没有96孔板好,所以我放弃改用浸润孔底的方法。2.细胞悬液加完后,将细胞培养板抬高,对着灯光,从底部往上看,看细胞有没有抱团。然后从底部敲击,使之分散。3. 如果实验室有平板振荡器的话,我建议用这个仪器稍振荡一下,效果不错,就是振幅小,频率高的那种。4. 细胞要尽量打散,大部分呈单个状态。离心后,要充分悬浮!还有转移到六孔板后,是要晃得!晃的时候最好不要让那个细胞液转圈,不然细胞就全被带到中间去了,就会不均匀!5. 一瓶细胞长满后,正常处理,在培养瓶里吹匀,然后铺6孔板,每孔2毫升,铺完之后不用观察直接用酒精棉擦拭,然后放到培养箱里,轻微的左三圈右三圈 前三圈 后三圈。基本上24小时之后观察 每孔的细胞都会很均匀。6.计算好所需要的全部液体量和细胞量,混匀后,加到六孔板里,六孔板按横8字型晃,显微镜下观察,如果不均匀,按上述方法再晃。如果细胞未计数直接种的话,在种六孔板的过程中,随时晃一下混匀用的瓶子,瓶子我通常是顺时针或逆时针转圈。7.放在水平板面上先上下移动,再左右移动,每个方向5到6次,但关键的是摇完后最好直接放入培养箱中,不要再做过多的运动,例如放到镜下去看,否则很容易就又聚到中间去了。
[b][url=http://www.f-lab.cn/cell-analyzers/puncher.html][b]单细胞转移分离系统[/b][/url]是可用于单细胞转移,单细胞分离和单细胞隔离,单细胞成像应用的多功能单细胞分离操作仪器,它可以实现从微孔芯片转移单细胞到细胞收集管中。单细胞转移分离系统[/b][color=#666666]集单细胞成像,单细胞隔离,单细胞选择功能于一体,自动聚焦成像。[/color][b]单细胞转移分离系统转移单细胞到Eppendorf微管,PCR微孔板或其它反应微管中,[/b][color=#666666]在隔离单细胞后,它可以对选定收集的细胞进行扫描并成像。[/color][b]单细胞转移分离系统[/b][color=#666666]采用Nikon Ti-2倒置荧光显微镜,配备自动扫描显微镜载物台,自动聚焦器件,高灵敏度荧光CCD相机和LED激发光源组建而成。[/color][img=单细胞转移分离系统]http://www.f-lab.cn/Upload/single-cell-isolation.JPG[/img][b]单细胞转移分离系统[/b]特点完全自动化,步进系统高质量单细胞荧光成像单细胞分离的效率超过90% 超过70%分离的细胞增殖 分离后兼容所有的单细胞的WGA工具包(放大器的‐1,picoplex,复制‐G)实惠微Wells基于硅微孔微腔。由薄膜封闭70µ m,井底直径(1µ m),包含一个单孔。样品流体进入威尔斯并从底部的孔隙中流出。单个细胞被拖着走。一旦单个细胞降落到孔隙上,流动停止,其他细胞就不会进入井内。有用的细胞被识别出来。选定的细胞穿孔从微孔到384孔PCR板或离心管等等。单细胞转移分离系统:[url]http://www.f-lab.cn/cell-analyzers/puncher.html[/url]
[font=宋体][font=宋体]在生物学和医学研究中,细胞增殖是一个关键过程,对于理解生命活动的基本规律以及疾病的发病机理具有重要意义。随着科技的发展,流式细胞仪作为一种高效、灵敏的分析工具,广泛应用于细胞增殖的检测。流式细胞仪通过快速分析单个细胞,可以对细胞周期、细胞增殖活性、细胞凋亡等多个方面进行研究。本文将探讨流式细胞仪在检测细胞增殖方面的主要方法,包括但不限于溴脱氧尿苷([/font][font=Calibri]BrdU[/font][font=宋体])掺入法、细胞周期蛋白检测法以及细胞大小分析法等,以期为读者提供全面的技术应用概览。流式细胞仪检测细胞增殖方法:[/font][/font][b][font=宋体][font=Calibri]1[/font][font=宋体]、[/font][font=Calibri]3H[/font][font=宋体](氚离子)掺入法[/font][/font][/b][font=宋体][font=宋体]原理:是在细胞[/font][font=Calibri]DNA[/font][font=宋体]合成时,用[/font][font=Calibri]3H[/font][font=宋体]脱氧胸腺嘧啶核苷代替普通的脱氧胸腺嘧啶核苷掺入新合成的[/font][font=Calibri]DNA[/font][font=宋体]中,增殖的细胞因为掺入[/font][font=Calibri]3H[/font][font=宋体]而具有放射性,通过定量检测样品细胞的放射性大小而反映细胞的增值活性[/font][/font][font=宋体][font=宋体]缺点:[/font][font=Calibri]1[/font][font=宋体])使用的是具有放射性的同位素,操作较为复杂,同时需要采取放射性保护措施 [/font][font=Calibri]2[/font][font=宋体])低比例高活跃增殖和高比例低活跃增殖可能得到的是相同的结果,用此方法无法进行鉴别 [/font][font=Calibri]3[/font][font=宋体])此方法无法进一步得到具有活性的增值细胞用于下一步的研究 [/font][font=Calibri]4[/font][font=宋体]) 此方法时间较短,无法检测加入前细胞的增殖情况,而且检测到放射性只能说明细胞[/font][font=Calibri]DNA[/font][font=宋体]合成,而不能提供合成[/font][font=Calibri]DNA[/font][font=宋体]的细胞是否进入增殖阶段的信息[/font][/font][b][font=宋体][font=Calibri]2[/font][font=宋体]、相对计数法[/font][/font][/b][font=宋体]原理:将对照组和各实验组控制在相同条件下直接计数然后比较计数结果得到增殖结论[/font][font=宋体]注意点:[/font][font=宋体][font=宋体]对照组与实验组每种细胞所加浓度必须相同,每组至少设置[/font][font=Calibri]3[/font][font=宋体]个复孔,这样每个孔可以得到[/font][font=Calibri]1[/font][font=宋体]个细胞数,将[/font][font=Calibri]3[/font][font=宋体]个复孔取平均值后就是这个组的结果。如果同时需要得到每孔目标细胞增殖后的绝对参数,在每孔细胞中加入[/font][font=Calibri]1*105PE[/font][font=宋体]标记的人工微球作为内参[/font][/font][font=宋体] [/font][font=宋体][font=宋体]收集各组的细胞于[/font][font=Calibri]EP[/font][font=宋体]管中,注意必须尽量将各组的所有细胞都收集起来。标记需要计数细胞的标志表型的荧光素偶联抗体,[/font][font=Calibri]4[/font][font=宋体]℃静置[/font][font=Calibri]30min[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]PBS[/font][font=宋体]洗涤一次,洗去游离的抗体[/font][/font][b][font=宋体][font=Calibri]3[/font][font=宋体]、示踪染料标记法[/font][/font][/b][font=宋体][font=宋体]示踪染料与细胞结合的方式:[/font][font=Calibri]1[/font][font=宋体])能够与细胞内的蛋白质上的氨基发生非特异性的共价结合 [/font][font=Calibri]2[/font][font=宋体])能够非特异性地嵌入细胞膜的脂质双分子层中与细胞发生非共价性结合[/font][/font][font=宋体] [/font][font=宋体][font=宋体]原理:示踪染料的荧光信号都很强,当细胞分裂时,母细胞内的染料会被平均分配到子细胞中,细胞荧光信号会被减弱一半,所以通过检测减弱的、发射示踪染料荧光信号的细胞比例就可以判断细胞增殖的强弱。当荧光强度减弱到标记时的[/font][font=Calibri]1/2[/font][font=宋体]以及以下的细胞都是增殖后的细胞,这些细胞所占比例越高则代表细胞增殖越活跃[/font][/font][font=宋体] [/font][font=宋体]标记方法:[/font][font=宋体][font=宋体]①纯化增殖反应的目标细胞,将细胞的浓度调整为[/font][font=Calibri]1*106/ml[/font][font=宋体],加入[/font][font=Calibri]CFSE[/font][font=宋体],其标记浓度为[/font][font=Calibri]5[/font][font=宋体]微摩尔[/font][font=Calibri]/[/font][font=宋体]升。置于[/font][font=Calibri]37[/font][font=宋体]℃水浴中标记[/font][font=Calibri]15min[/font][font=宋体],在标记过程中每隔一段时间混匀细胞一次[/font][/font][font=宋体] [/font][font=宋体][font=宋体]②加入预冷、含有血清的培养基终止标记,在[/font][font=Calibri]4[/font][font=宋体]℃冰箱中静置[/font][font=Calibri]5min[/font][font=宋体],离心沉淀[/font][/font][font=宋体] [/font][font=宋体][font=宋体]③用培养基再洗涤一次,尽量洗净未结合的游离的[/font][font=Calibri]CFSE[/font][font=宋体],然后将目标细胞静置在增殖体系中[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]4[/font][font=宋体]、[/font][font=Calibri]BrdU[/font][font=宋体]和[/font][font=Calibri]EdU[/font][font=宋体]掺入法[/font][/font][/b][font=宋体][font=Calibri]BrdU[/font][font=宋体]:[/font][font=Calibri]5-[/font][font=宋体]溴脱氧尿嘧啶核苷是胸腺嘧啶核苷的类似物,其特点是胸腺嘧啶环上[/font][font=Calibri]5[/font][font=宋体]位[/font][font=Calibri]C[/font][font=宋体]连接的甲基被溴取代,在细胞增殖[/font][font=Calibri]DNA[/font][font=宋体]合成时可以与内源性的胸腺嘧啶核苷竞争掺入到新合成的[/font][font=Calibri]DNA[/font][font=宋体]中,而[/font][font=Calibri]BrdU[/font][font=宋体]抗体可以特异性的识别[/font][font=Calibri]BrdU[/font][font=宋体],不与胸腺嘧啶核苷结合,所以可以用于检测细胞增殖[/font][/font][font=宋体][font=宋体]适用范围:适用于体内检测目标细胞的增殖,一般将[/font][font=Calibri]BrdU[/font][font=宋体]掺入小鼠的应用水中或经腹腔注射,经过一段时间后,取出目标细胞制成单细胞悬液然后用多聚甲醛固定细胞,后用打孔剂皂苷在细胞膜上打孔,最后标记荧光素偶联抗[/font][font=Calibri]BrdU[/font][font=宋体]抗体,目标细胞的[/font][font=Calibri]BrdU[/font][font=宋体]阳性细胞就是增殖的细胞,阳性比例越高,增殖越活跃。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]5[/font][font=宋体]、其他方法[/font][/font][/b][font=宋体][font=宋体]细胞周期法检测细胞增殖:流式细胞术能够检测细胞内[/font][font=Calibri]DNA[/font][font=宋体]的含量,所以可以检测细胞周期。处于[/font][font=Calibri]S[/font][font=宋体]期的细胞,[/font][font=Calibri]DNA[/font][font=宋体]的量处于二倍体和四倍体之间[/font][font=Calibri] [/font][font=宋体]处于[/font][font=Calibri]G2/M[/font][font=宋体]期时,[/font][font=Calibri]DNA[/font][font=宋体]量为四倍体。处于[/font][font=Calibri]S[/font][font=宋体]期和[/font][font=Calibri]G2/M[/font][font=宋体]期的细胞比例越高说明细胞增殖越活跃[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]PCNA[/font][font=宋体]检测细胞增殖:[/font][font=Calibri]PCNA[/font][font=宋体](增殖细胞核抗原),在细胞核合成且只存在于细胞核内,是[/font][font=Calibri]DNA[/font][font=宋体]聚合酶的辅助蛋白,所以与细胞[/font][font=Calibri]DNA[/font][font=宋体]的合成关系密切,是反映细胞增殖状态的良好指标[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Ki-67[/font][font=宋体]检测细胞增殖:是一种与细胞增殖特异相关的核抗原[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]CD71[/font][font=宋体]检测细胞增殖:是转铁蛋白受体,表达于细胞的表面,该受体广泛表达于各种恶性肿瘤细胞表面,正常细胞表达较少,与肿瘤细胞的增殖密切相关[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/flow-cytometry-service][b]流式细胞检测技术服务[/b][/url],更多关于流式细胞仪检测细胞增殖详情欢迎咨询,详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/flow-cytometry-service[/font][/font][b][font=宋体] [/font][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
我将做一个用光谱仪来测量细胞的散射光谱实验。现在有一台海洋公司的型号是hr4000cg-uv-nir的光谱仪。不知可不可以用来测量细胞的散射光谱。 对你们的提议,我太感谢了
各位朋友: 您们好! 我最近在使用Renishaw公司的拉曼光谱仪,是共聚焦的,来测试单细胞的拉曼光谱,采用785nm光源,但每次测试的效果都非常不好! 我是将细胞种在盖波片上,或者直接将细胞溶液滴在载波片上,直接用显微镜看到细胞之后,再打光测试,但每次总是打在载物台上,而且基本上测不到细胞的拉曼光谱... 请问有哪位朋友能为在下指点迷津啊,我这也试了许多次了,但总是没有效果...
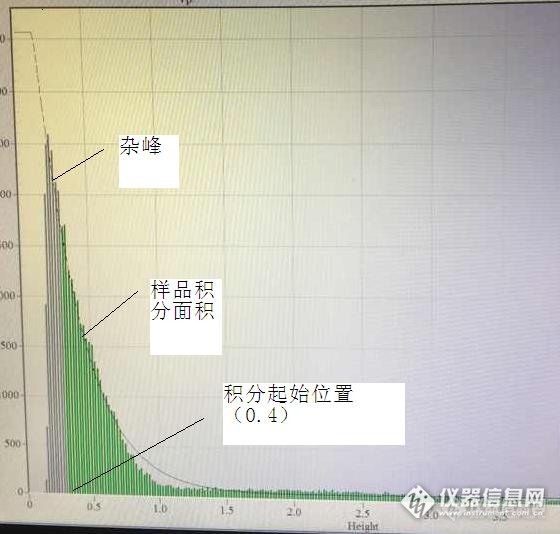
流式细胞仪测试的结果,在仪器内是标明荧光强度,前向角散射光强度,侧向角散射光强度,或其他参量的电压值或电流值。本特利微生物测定仪的样品经过染色后,被液流系统送到样品室,激光照射染色后的样品溶液后产生荧光,被检测器光电倍增管检测,将光信号转化为电信号,通过数模转换在计算机上存储结果,数据以CSV格式存储在c/data文件夹下。 一个数字文件,有易于加工处理和分析的优点,但通常缺乏直观性,如能用一组图形来表明各个参量的相互关系,对操作者来说更为直观。本特利流式细胞仪数据的显示为单参数直方图(histogram)和二维点图(dot plot)两种。 微生物测定仪有三个谱图,见图1。http://ng1.17img.cn/bbsfiles/images/2014/12/201412251429_528941_2648817_3.jpg图1仪器显示谱图1、脉冲高度图(pulseheight/intensity)http://ng1.17img.cn/bbsfiles/images/2014/12/201412251430_528942_2648817_3.jpg图2 脉冲高度图 脉冲高度图以脉冲高度为横坐标,细胞数量为纵坐标作图。2、脉冲宽度图(pulsewidth/duration)http://ng1.17img.cn/bbsfiles/images/2014/12/201412251430_528943_2648817_3.jpg图3 脉冲宽度图 脉冲高度图以脉冲高度为横坐标,细胞数量为纵坐标作图。3、二维点图(dot plot)http://ng1.17img.cn/bbsfiles/images/2014/12/201412251430_528944_2648817_3.jpg图4 二维点图 单参数直方图的限制是:只能表明一个参数与细胞数量间的关系,不能显示两个独立参数与细胞的关系。当需要研究两个或更多测定量关系时,可采用二维点图的显示方式。 在图1中,我们可以把二维点图和对应的直方图都画在一起。点图横坐标表示脉冲高度(height),纵坐标表示脉冲宽度(width)。二维点图上每个点代表一个细胞,每个点与横坐标的距离表示该点的脉冲高度,每个点与纵坐标的距离表示该点的脉冲宽度。 绘制全部细胞群体的脉冲高度图,即图2中的脉冲高度图,同理绘制脉冲宽度图。我们可以由点图得到两个直方图,但由两个直方图无法反演成一个二维点图,这说明一个点图所携带的信息量大于两个直方图所携带的信息量。 从三个谱图的坐标位置,我们很明显能看出三者之间的关系。4、软件中的设置及结果显示http://ng1.17img.cn/bbsfiles/images/2014/12/201412251430_528945_2648817_3.jpg图5 软件设置积分起始位置 选择TOOLS-OPTIONS-CALIBRATION,可以看出脉冲高度积分范围设置和脉冲宽度的积分范围设置。 对于以上三个图而言,最终的结果为脉冲高度的积分面积来表示。所以,其样品的测试结果严重依赖于积分范围,尤其是积分的起始位置。仪器上设置的积分起始位置为0.4。http://ng1.17img.cn/bbsfiles/images/2014/12/201412251430_528946_2648817_3.jpg图
求助各位大侠,有没有测过细胞的拉曼光谱。我们用的雷尼绍的仪器,785nm激发光,背景信号太强,一点细胞的信号都测不出,怀疑激光没有聚焦在细胞上。1. 细胞测量前要怎么处理?2. 细胞放在什么样的载玻片上测量,怎样减小背景影响?3. 仪器参数设置上有什么需要注意的么?怎样确定把光聚焦到细胞上?老板逼得紧,谢谢各位啊!
近日,来自加利福尼亚大学的研究者发现了在人类骨髓干细胞和所有的免疫细胞之间存在一类“环节缺失”(missing link)的细胞。这或许为我们深入理解免疫系统以及免疫系统疾病发生的分子机制提供帮助。相关研究刊登在了9月2日的国际杂志Nature Immunology上。这项研究是在人类骨髓中进行的,因为其包含了产生人类自出生后所需血液的所有的干细胞。理解成人正常血液的形成是揭开白血病发病机制关键的一步。之前的研究中,研究者重点研究了骨髓中的血液干细胞,这种干细胞生存时间比较久,可以再生,而且可以产生所有的血液细胞。在这过程中,干细胞可以分裂产生其发育的中间状态体,称为前体干细胞,前体干细胞可以产生血液的不同谱系,比如产生红细胞或者血小板等。和干细胞一样,祖细胞也非常稀少,因此研究就好比海里捞针一样,研究者Lisa这样说,此前的研究工作中,他们发现了一种具有部分分化能力、相当成熟的淋巴祖细胞。在这项最新的研究中,研究者描述了一种更为原始的可以分化为整个免疫系统所需细胞的祖细胞。
生物质谱技术在细胞生物学中的应用桑志红 王红霞 综述 概 论 蛋白分离与显色 蛋白质鉴定 数据库查寻 灵敏度 具体示例 展望未来(相关文献)摘 要 基因组计划的飞速发展使我们提早进入"后基因组时代",而质谱技术的重要进展使得通过酶解、质量分析、序列分析及其数据库检索对蛋白质进行高通量快速鉴定的技术方法应运而生,并成为"后基因组时代"的关键核心技术。这种技术的应用范围已经从细胞,组织以及整个有机体中蛋白质的表达到蛋白质翻译后修饰等等方面。本文简要综述生物质谱技术在细胞生物学等学科中的应用。 过去的十年经历并见证了生命科学革命性的变化. 大规模基因组测序技术的问世使人类基因组计划最终目标的实现比预期一再提前。与此同时,近几年间已有10余种模式生物的基因组序列测定告罄,3年内还将有40种左右生物的基因组全序列问世。因此大多数人同意我们现在已经提早进入"后基因组时代"(post-genome era), 目前我们所面临的挑战是如何破解基因组计划已获得的大量序列信息并加以应用。这个问题的关键是基因的生物学功能不能只通过对核酸一级结构(序列)的检测来确定。研判一个未知基因的功能、与其他基因产物及其亚细胞结构之间的功能联系, 最终都必须通过在蛋白水平对基因产物的研究才能确定。蛋白质组这个名词是近几年才提出来的,它用来描述一个细胞的全部蛋白质,而在蛋白水平上进行大规模的研究引出了新的术语蛋白质组学。蛋白质表达图谱是依靠蛋白质显示技术和精确定量技术对细胞或组织中蛋白质表达总况进行比较(2), 这个领域最近已有综述(11)。细胞图谱蛋白质组学是指应用生物质谱技术鉴定蛋白质及其相互作用并确定在亚细胞中的定位。本文的目的是 简要综述生物质谱技术在细胞生物学领域中越来越多的应用,并为该领域正考虑应用这种技术的研究者提供一些的有用的信息。 作为一个新的研究领域,蛋白质组学发展的关键是近年来质谱技术的革新。这种革新极大地促进了质谱技术在生命科学研究中的应用。质谱现在可以作为将各种蛋白质与序列数据库联系起来的桥梁。生物质谱根据质量数和所载电荷数不同的多肽片断在磁场中产生不同轨道而以质荷比(m/z)方式来分离它们。80年代末,随着两种崭新的尤其适合蛋白质研究的软电离方式ESI(电喷雾电离)和MALDI(基质辅助激光解吸附电离)的出现,质谱成为现代蛋白质科学中最重要和不可缺少的组成部分。 生物质谱最强大的应用功能之一是能够鉴定蛋白质复合物的组成成分(19)。细胞中一些最重要的生命过程都是通过多蛋白质复合体来执行和调节的,但由于蛋白质鉴定的困难,大多数上述蛋白复合体都是未知的。生物质谱灵敏度的不断提高显著地促进了对具有生物学功能和治疗潜力的蛋白复合体的鉴定,例如,NF-k B信号通路,CD95(FAS/APO-1)介导的细胞死亡途径,和核受体介导的转录信号传导过程中形成的蛋白复合体。在某些情况下,复合物可通过常规蛋白纯化的方法进行纯化,如剪接体复合(25),酵母纺锤体复合物(29)及VHL肿瘤抑制复合物(18)。然而,更常见的是,复合物中的组成成分通过一步免疫沉淀或免疫亲和步骤后就可纯化,这种方法甚至可以用于鉴定那些用常规蛋白纯化和鉴定技术所不及的一些过渡态或不稳定的复合物。因为生物质谱技术的介入,现在已经不再需要通过抗体进行免疫印迹实验,而是通过生物质谱技术对免疫沉淀获得的蛋白复合体组分直接进行蛋白序列分析。以酵母P24复合物鉴定为例,应用上游表位标签策略有可能不需制备抗目标蛋白的抗体就能对蛋白质复合物进行鉴定(13)。这种方法(36)对于基因组序列已完全清楚和遗传稳定的生物(如芽殖酵母,啤酒酵母)尤为简便, 例如对RENT复合物和促有丝分裂后期复合物(49)。因为这种方法的成功应用,使人们对上游表位标签策略-蛋白纯化-生物质谱分析的方法兴趣倍增。值得一提的是,将能被特殊蛋白酶切除的连接子(接头)掺入表位标签是尤为有利的(如下所述)。 上述方法是通过识别蛋白复合物中相互作用和配对的各组分而达到对蛋白鉴定的目的,另一种策略则是通过对分离纯化的细胞器蛋白组成进行鉴定而在亚细胞水平对蛋白质定位. 用这种方法确定蛋白质位置, 对评价蛋白质潜在的功能将是大有帮助的. 应用这种方法,我们称为细胞器蛋白质组学, 已经发现正常工作状态下的细胞器含有比我们以前所知道的数量多得多的蛋白种类。然而实际上,由于质谱极高的分辨率和灵敏度,纯化后的细胞器组分即使只有微量的混杂,也能被质谱分辨并误认为是细胞器的组成部分。因此,如何充分的纯化以保证至少绝大多数被鉴定的蛋白质都来自同一种细胞器,成为制约上述工作的瓶颈。 蛋白质翻译后修饰也是蛋白鉴定工作中的一个重要方面。根据DNA序列信息并不能可靠预测或推导出蛋白质翻译后的修饰。而质谱技术已经被证明对研究蛋白质翻译后的修饰(例如磷酸化和糖基化)是极为有用的,特别是对序列已知的蛋白的鉴定。例如:Betts等人(1a)用这种方法成功地鉴定了从小鼠大脑中分离的神经纤维蛋白体内磷酸化位点。同样方法, Wong等人(45)确定了钙联蛋白质(calnexin)C未端的磷酸化位点。在糖基化的例子中, Carr等人(5)采用液相色谱与质谱联用技术选择性地鉴定了糖蛋白中N- 和O-联接的寡糖. 稍后, 本文将会通过对E-选择素中糖基化位点的鉴定来进一步说明这种方法.
何为细胞外泌体? 外泌体最早发现于体外培养的绵羊红细胞上清液中,是细胞主动分泌的大小较为均一,直径为40~100纳米,密度1.10~1.18 g/ml的囊泡样小体。细胞外泌体携带多种蛋白质、mRNA、miRNA,参与细胞通讯、细胞迁移、血管新生和肿瘤细胞生长等过程并且有可能成为药物的天然载体,应用于临床治疗。 然而,测量技术手段的局限限制了外泌体在这些领域的研究进展。所以,在这篇文章中,作者总结了外泌体的纯化方法(离心法、过滤离心法、密度梯度离心法、免疫磁珠法以及色谱法),比较了现存各种外泌体测量技术(电子显微镜、动态光散射技术及纳米微粒追踪分析术)在外泌体尺寸和表征研究中的应用。原文点击——综述:细胞外泌体颗粒表征测量技术新进展
如何用普通生物显微镜拍清楚非小细胞肺癌细胞的细胞膜呢
我想做一下肿瘤细胞的P谱,但以前没有做过,制备样品是把肿瘤细胞制成细胞悬液就行了吗?内标和普通样品的内标一样吗?是不是应该先做一下细胞培养液的P谱?求大神帮助!!
[b][font=宋体][font=宋体]细胞周期[/font][font=Calibri]cell cycle [/font][/font][/b][font=宋体]是指从一次细胞分裂形成子细胞开始到下一次细胞分裂形成子细胞为止所经历的过程,它反映了细胞增殖的速度。在临床上,有很多研究证明,细胞周期分析对人肿瘤的诊断预后具有很高的价值。[/font][font=宋体] [/font][font=宋体][font=宋体]一个完整的细胞周期包含间期和分裂期([/font][font=Calibri]M[/font][font=宋体]期)两个阶段,间期又分为[/font][font=Calibri]DNA[/font][font=宋体]合成前期([/font][font=Calibri]G1[/font][font=宋体]期)、[/font][font=Calibri]DNA[/font][font=宋体]合成期([/font][font=Calibri]S[/font][font=宋体]期)和[/font][font=Calibri]DNA[/font][font=宋体]合成后期([/font][font=Calibri]G2[/font][font=宋体]期),处于不同时期的细胞的[/font][font=Calibri]DNA [/font][font=宋体]含量存在差异。一般认为,[/font][font=Calibri]G 1 [/font][font=宋体]期细胞具有增殖活性,参与细胞周期循环,是二倍体细胞;[/font][font=Calibri]S [/font][font=宋体]期细胞,[/font][font=Calibri]DNA [/font][font=宋体]含量逐渐增加,从二倍体变成四倍体,随后进入 [/font][font=Calibri]G 2 [/font][font=宋体]期,最终进入 [/font][font=Calibri]M [/font][font=宋体]期。检测细胞周期常用的方法是检测[/font][font=Calibri]DNA[/font][font=宋体]含量,可以选择能与[/font][font=Calibri]DNA[/font][font=宋体]结合的荧光染料(如[/font][font=Calibri]PI[/font][font=宋体]等),再根据细胞各个时期[/font][font=Calibri]DNA[/font][font=宋体]含量不同从而荧光强度不同的方法,分析各个阶段的细胞比例。[/font][/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体][font=宋体]流式细胞仪[/font][font=Calibri]PI[/font][font=宋体]染色法检测细胞周期的原理[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]由于细胞周期各时相的[/font][font=Calibri]DNA[/font][font=宋体]不同[/font][font=Calibri],[/font][font=宋体]通常正常细胞的[/font][font=Calibri]G1/G0[/font][font=宋体]期具有二倍体细胞的[/font][font=Calibri]DNA[/font][font=宋体]含量[/font][font=Calibri](2N),[/font][font=宋体]而[/font][font=Calibri]G2/M[/font][font=宋体]期具有四倍体细胞[/font][font=Calibri]DNA[/font][font=宋体]含量[/font][font=Calibri](4N),[/font][font=宋体]而[/font][font=Calibri]S[/font][font=宋体]期的[/font][font=Calibri]DNA [/font][font=宋体]含量介于二倍体和四倍体之间。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]PI[/font][font=宋体](碘化丙啶)为插入性核酸荧光染料,能选择性嵌入核酸[/font][font=Calibri]DNA[/font][font=宋体]和[/font][font=Calibri]RNA[/font][font=宋体]双螺旋的碱基之间与之结合,结合量与[/font][font=Calibri]DNA[/font][font=宋体]的含量成正比关系,其荧光强度直接能反映细胞内[/font][font=Calibri]DNA[/font][font=宋体]含量。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]因此[/font][font=Calibri],[/font][font=宋体]通过流式细胞仪[/font][font=Calibri]PI[/font][font=宋体]染色法对细胞内[/font][font=Calibri]DNA[/font][font=宋体]含量进行检测时[/font][font=Calibri],[/font][font=宋体]可以将细胞周期各时相区分为[/font][font=Calibri]G1/G0 [/font][font=宋体]期[/font][font=Calibri],S [/font][font=宋体]期和[/font][font=Calibri]G2/M [/font][font=宋体]期[/font][font=Calibri],[/font][font=宋体]获得的流式直方图对应的各细胞周期可通过特殊软件计算各时相的细胞百分率。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]通过定量测定[/font] [font=Calibri]DNA [/font][font=宋体]含量来分析细胞周期是流式细胞术最早的应用之一。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]流式细胞周期([/font][font=Calibri]cell cycle[/font][font=宋体])检测结果分析常用的流式细胞术分析细胞周期的方法是依据细胞[/font][font=Calibri]DNA[/font][font=宋体]含量(横坐标)来分析的:[/font][font=Calibri]G0[/font][font=宋体]期:静止期,有丝分裂完成后,脱离细胞周期暂时停止分裂的一个阶段,胞内[/font][font=Calibri]DNA[/font][font=宋体]含量保持二倍体;[/font][font=Calibri]G1[/font][font=宋体]期:[/font][font=Calibri]DNA[/font][font=宋体]合成前期,从有丝分裂到[/font][font=Calibri]DNA[/font][font=宋体]复制前的一段时期,此期主要合成[/font][font=Calibri]RNA[/font][font=宋体]和核糖体,胞内[/font][font=Calibri]DNA[/font][font=宋体]含量保持二倍体;[/font][font=Calibri]S[/font][font=宋体]期:[/font][font=Calibri]DNA[/font][font=宋体]合成期,在此期,合成[/font][font=Calibri]DNA[/font][font=宋体]及组蛋白,胞内[/font][font=Calibri]DNA[/font][font=宋体]含量介于[/font][font=Calibri]G1[/font][font=宋体]期与[/font][font=Calibri]G2[/font][font=宋体]期之间;[/font][font=Calibri]G2[/font][font=宋体]期:[/font][font=Calibri]DNA[/font][font=宋体]合成后期,是有丝分裂的准备期,合成[/font][font=Calibri]RNA[/font][font=宋体]及蛋白质,[/font][font=Calibri]DNA[/font][font=宋体]合成终止,胞内[/font][font=Calibri]DNA[/font][font=宋体]含量为四倍体;[/font][font=Calibri]M[/font][font=宋体]期:细胞分裂期,胞内[/font][font=Calibri]DNA[/font][font=宋体]含量为四倍体;[/font][/font][font=宋体] [/font][b][font=宋体]流式细胞检测正常范围[/font][/b][font=宋体]流式细胞检测的正常范围通常依赖于被检测细胞或生物粒子的类型以及所测参数的性质。一般而言,正常的细胞数量、细胞大小、细胞形态、细胞内物质的浓度和分布等参数都在一定的范围内。这些正常范围通常是通过对比大量健康个体或样本的流式细胞检测结果而得出的。例如,正常血细胞的计数和比例,各种免疫细胞的分布,以及细胞内的荧光强度等,都有相应的正常范围。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/flow-cytometry-service][b]流式细胞检测技术服务[/b][/url],同时还提供完善的[url=https://cn.sinobiological.com/services/platform/facs-b-cell-sorting][b]流式单[/b][/url][/font][font=Calibri][url=https://cn.sinobiological.com/services/platform/facs-b-cell-sorting][b]B[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/services/platform/facs-b-cell-sorting][b]细胞分选平台[/b][/url],详情关注:[/font][font=Calibri]https://cn.sinobiological.com/services/flow-cytometry-service[/font][/font][font=宋体][font=Calibri]https://cn.sinobiological.com/services/platform/facs-b-cell-sorting[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
全光谱流式细胞仪原理,可以帮忙解答一下吗
细胞,生活中无处不在,我们身体里有细胞:脑细胞,造血细胞……路边的小草也有细胞,就连我们看不到的细菌都是细胞构成的。细胞与生活息息相关,所以说细胞决定人类健康。 [b][url=http://www.xo-yq.net/]智能超声波细胞破碎仪[/url][/b],一款将电能通过转换器变成声能,然后这种能量通过液体介质而变成一个个小气泡,这些小气泡会在短时间内迅速炸裂,产生能量,从而起到破碎细胞的作用。 生病是人之常情,免不了吃药。药品是怎么来的呢? 首先通过观察细菌,通过分析细菌的组成,然后讲细胞提取出小部分,导入化合物,最后确定候选物,漫长的过程肯定需要[b]智能超声波细胞破碎仪[/b]啊。 南京先欧科技,专业制造[b]智能超声波细胞破碎仪[/b],[b]超声波细胞粉碎机、裂解仪[/b]……[img=智能超声波细胞破碎仪,50,50]http://www.xo-yq.net/img/%E6%99%BA%E8%83%BD%E8%B6%85%E5%A3%B0%E6%B3%A2%E7%BB%86%E8%83%9E%E7%A0%B4%E7%A2%8E%E4%BB%AA.jpg[/img]
我们专题主要是研究胶原纤维,费伦有提过胶原纤维存在红外光传输的特征波段,不过在国内外研究极少提到有关细胞与细胞外基质的光传输,大都是提到有关化学反应的过程,现在是想找在胶原纤维的UV与IR光谱里那一个波峰,透过纤连蛋白(fibronectin)传输光讯号到细胞上的受体,之前是有找到有关细胞不含胞器(只剩肌动蛋白丝actin、整键蛋白integrin)也能移动,所以我们就假设细胞的移动可能是胶原纤维所操控,讲得有点多了,因为就只差这一点专题就完成了,可以请专家提出一些意见吗?谢谢[IMG]http://www.cella.cn/book/10/images/image006.jpg[/IMG]
[align=center][size=24px]流式细胞仪监测适配体与靶细胞的结合[/size][/align][align=center]肖书棋 18122884967[/align][align=center][/align]本次说明是基于核酸适配体能与靶标进行特异性结合的原理,利用流式细胞仪监测适配体与靶细胞的结合状况,还能比较不同适配体与靶细胞之间的结合强度的比较;本次所使用的流式分析仪是BD FACSAria III。[font='times new roman'][size=16px]1.原理介绍:[/size][/font][font='times new roman'][size=16px]1.1核酸适配体:[/size][/font]核酸适配体(Aptamer,Apt):是一段寡核苷酸序列(ssDNA或RNA),是利用指数富集的系统进化技术(the Systematic Evolution of Ligands by Exponential Enrichment,SELEX)在多样寡核苷酸序列的文库中,进行体外筛选得到。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026239049_1528_5413603_3.jpeg[/img][/align][align=center][size=13px]Aptamer结合靶标原理[/size][size=13px]图[/size][/align]如图所示,在合适的缓冲液环境下,单链寡核苷酸序列具有弯曲以及折叠成特定的三级空间结构的能力,该结构可以与靶分子特异性结合,SELEX技术就是应用该原理来进行选择的。将信息量巨大且随机的的寡核苷酸文库与靶标孵育,经过多轮的优胜劣汰和PCR扩增,最后得到能与靶标高亲和力性结合的寡核苷酸序列,即核酸适配体(Aptamer)。由于核酸适配体具有靶向特异性的特点,因此应用广泛;那么如何监测适配体靶向细胞亲和力的方法,就需要用到流式细胞术进行表征。[font='times new roman'][size=16px]1.2流式细胞仪原理:[/size][/font]流式细胞术能够快速检测细胞或者生物颗粒的特征,其检测灵敏,能够定性或者定量分析颗粒的参数,还具有细胞分选的功能,功能强大,分析参数多,实用性较强。流式细胞仪(flow cytometer,FCM)的设计应用了光学、细胞化学、电子学等技术,拥有较强大的细胞及微粒分析功能,在临床医学、免疫学、微生物学等等研究领域发挥着巨大的作用。流式分析可以检测细胞表面颗粒复杂程度、核酸以及蛋白质的含量、细胞表面积或者细胞表面的抗体、细胞受体等等,在多种研究领域起到重要作用。在本研究中应用流式分析细胞荧光强度的基本步骤原理是:(1)制备成单细胞悬液:将待测细胞预处理进行荧光标记后制成单细胞悬液,通过气压将流式管中的细胞悬液通过管道压进流动室,同时喷出的鞘液将细胞包裹,形成圆形的鞘流,细胞在鞘液的包被下单行排列,依次通过流动室检测区域。(2)形成光散射:激发光源侧向垂直射向单个细胞,含有荧光的细胞形成两种光:①前向散射光(forward scatter, FSC):激光束照射细胞时,光束偏移量较小(10°以内),散射至前方,可用于检测细胞等粒子的表面信息,颗粒体积越大,信号越强。②侧向散射光(side scatter,SSC)激光束照射颗粒,产生偏移角度为直角的散射光,可反应细胞内含物的信息。(3)光信号转化成电信号:光信号导入到计算机中,依次形成电信号,再转化为数字信息。应用FlowJo软件处理数据,可以获得相应的散点图、直方图等形式,便于直观分析。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026241158_6946_5413603_3.jpeg[/img][/align][align=center][font='times new roman'][size=13px]流式分析基本原理图[/size][/font][/align][font='times new roman'][size=16px]2.分析步骤:[/size][/font][font='times new roman'][size=16px]2.1细胞预处理:[/size][/font]通过流式分析预处理,可以使细胞在特定的环境,与带有FAM荧光的适配体进行特异性结合,通过平行实验使细胞与不同的适配体文库进行标记,最终表征其荧光强度,进行亲和力的分析与比较。如表所示,流式分析条件为:[align=center][size=13px]流式细胞分析条件探寻[/size][/align][table][tr][td][align=center][size=13px][color=#000000]孵育时条件[/color][/size][/align][/td][td][size=13px][color=#000000]孵育时体积[/color][/size][/td][td=2,1][align=center][size=13px][color=#000000]孵育时浓度[/color][/size][/align][align=center][size=13px][color=#000000]细胞浓[/color][/size][size=13px][color=#000000]度 [/color][/size][size=13px][color=#000000]单链DNA浓度[/color][/size][/align][/td][td][align=center][size=13px][color=#000000]第二次洗涤用液[/color][/size][/align][/td][/tr][tr][td][align=center][size=13px][color=#000000]4 ℃,30 min,BB,摇晃[/color][/size][/align][/td][td][align=center][size=13px][color=#000000]500 μL[/color][/size][/align][/td][td][size=13px][color=#000000]2.5×10^6个/mL[/color][/size][/td][td][align=center][size=13px][color=#000000]125 nM[/color][/size][/align][/td][td][align=center][size=13px][color=#000000]PBS x 2[/color][/size][/align][/td][/tr][/table]流式分析的大致步骤为:消化细胞、细胞与文库孵育、润洗重悬、上样分析。最终确定,初始的细胞悬液浓度为5×10[font='times new roman'][size=16px]6[/size][/font] 个/mL,初始文库的浓度为250 nM;孵育时体系的总体积为250 L,细胞浓度为2.5×10[font='times new roman'][size=16px]6[/size][/font]个/mL,适配体浓度为125 nM,环境为4 ℃、30 min,震荡。最后上样的细胞悬液体积为500 L,细胞浓度为2.5×10[font='times new roman'][size=16px]6[/size][/font]个/mL。[align=left][font='times new roman'][size=16px]2.1.1材料准备:[/size][/font][/align][align=center][size=13px] 流式分析主要仪器与试剂[/size][/align][table][tr][td][align=center]名称[/align][/td][td][align=center]规格/型号[/align][/td][td][align=center]作用[/align][/td][/tr][tr][td][align=center]流式细胞仪[/align][/td][td][align=center]FACSAria III[/align][/td][td][align=center]对细胞进行流式分析[/align][/td][/tr][tr][td][align=center]可调式混匀仪[/align][/td][td][align=center]MX-S[/align][/td][td][align=center]混悬适配体悬液[/align][/td][/tr][tr][td][align=center]震荡仪[/align][/td][td][align=center]MX-M[/align][/td][td][align=center]震荡孵育体系,防止细胞贴壁[/align][/td][/tr][tr][td][align=center]制冷恒温金属浴[/align][/td][td][align=center]HX-20L[/align][/td][td][align=center]热击适配体,使核酸变性恢复到自由的无规则卷曲状态[/align][/td][/tr][tr][td][align=center]显微镜[/align][/td][td][align=center]DMI1[/align][/td][td][align=center]观察细胞[/align][/td][/tr][tr][td][align=center]水浴氮吹仪[/align][/td][td][align=center]FY-DCY12S[/align][/td][td][align=center]加热试剂[/align][/td][/tr][tr][td][align=center]电子天平[/align][/td][td][align=center]JA2003[/align][/td][td][align=center]称量药品[/align][/td][/tr][tr][td][align=center]离心管[/align][/td][td][align=center]15 mL×10、50mL×10[/align][/td][td][align=center]分装试剂,装载需离心的细胞[/align][/td][/tr][tr][td][align=center]低吸附离心管[/align][/td][td][align=center]2 mL×20[/align][/td][td][align=center]装适配体悬液,减少适配体与细胞在管壁上的吸附[/align][/td][/tr][tr][td][align=center]一次性使用吸管[/align][/td][td][align=center]3 mL×20[/align][/td][td][align=center]方便地吸取PBS[/align][/td][/tr][tr][td][align=center]细胞刮刀[/align][/td][td][align=center]3010×1[/align][/td][td][align=center]刮下贴壁生长的细胞[/align][/td][/tr][tr][td][align=center]PBS[/align][/td][td][align=center]50 mL×2[/align][/td][td][align=center]ScienCell[/align][/td][/tr][tr][td][align=center]Cell Dissociation Solution[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]消化细胞[/align][/td][/tr][tr][td][align=center]0.25%Trypsin-EDTA[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]Gibco[/align][/td][/tr][tr][td][align=center]1×PBS缓冲液[/align][/td][td][align=center]500 mL[/align][/td][td][align=center]润洗细胞,重悬细胞[/align][/td][/tr][tr][td][align=center]Cell Dissociation Solution[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]消化细胞[/align][/td][/tr][tr][td][align=center]0.25%Trypsin-EDTA[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]Gibco[/align][/td][/tr][tr][td][align=center]1×PBS缓冲液[/align][/td][td][align=center]500 mL[/align][/td][td][align=center]润洗细胞,重悬细胞[/align][/td][/tr][tr][td][align=center]无酶无菌水[/align][/td][td][align=center]500 mL[/align][/td][td][align=center]溶解适配体文库[/align][/td][/tr][tr][td][align=center]DMEM高糖培养基[/align][/td][td][align=center]50 mL[/align][/td][td][align=center]停止消化[/align][/td][/tr][tr][td][align=center]细胞[/align][/td][td][align=center]>5×10[font='times new roman'][size=16px]6[/size][/font]个[/align][/td][td][align=center]作为目的细胞进行流式表征[/align][/td][/tr][/table]①配置Binding buffer(结合缓冲液BB):配置10 g/L BSA:称量0.1g BSA,溶于10 mL Washing Buffer,过膜;取上述溶液5 mL,加入到445 mL Washing Buffer中;再加入500 L鲑精DNA,混匀。②将U盘格式化,提前打开制冰机和金属浴(95℃);③37℃水浴:将无酶消化液、ECM、PBS(1)放入37℃水浴。④4℃冰敷:向泡沫盒中加碎冰,离心管架、温度计,准备4℃孵育环境,放入PBS和BB预冷。⑤打开显微镜(酒精擦拭载物台)。⑥打开离心机:120 g,1 min,25℃。[align=left][font='times new roman'][size=16px]2.1.2[/size][/font][font='times new roman'][size=16px]计数和文库预处理[/size][/font][/align](1)细胞计数(20倍或者40倍显微镜):①采用直接计数法,在显微镜中随机选择五个点进行计数取平均值,根据视野的面积以及T75培养瓶面积计算细胞总数,推出公式:Y为总细胞数;X为视野中细胞平均数;Y=27886.12X(20倍镜下)/Y=111111.11X(40倍镜下)。为了保证流式有足够的细胞,需要保证细胞总数>5×10[font='times new roman'][size=16px]6[/size][/font]个/mL。②计算BB体积:V=Y/(2×10[font='times new roman'][size=16px]7[/size][/font])mL,用V体积的BB重悬细胞沉淀,可获得细胞浓度为5×10[font='times new roman'][size=16px]6[/size][/font]个/mL的初始细胞悬液。(2)文库预处理:①将粉末状适配体文库进行离心:4000 r,5 min,4℃;使适配体粉末聚集在离心管底部,防止打开离心管时干粉状适配体飞出。②按照说明用一定体积的无酶无菌水溶解适配体,使适配体母液浓度在5 M。③取100 L母液,并加入900 LBB,使适配体浓度在500 nM。④再去上述液体500 L,并用BB稀释至浓度为250 nM,最终得到250 nM的适配体文库悬液。⑤95℃热击3 min,热击后放在泡沫盒中冰敷。[align=left][font='times new roman'][size=16px]2.1.3[/size][/font][font='times new roman'][size=16px]细胞处理[/size][/font][/align](1)消化:①PBS(37℃)润洗3次。②无酶消化液3 mL,消化9 min(等待期间准备好孵育用离心管;确认离心机参数为:120 rcf,1 min,25 ℃),吹打细胞使其从培养瓶表面脱落。直接转移至15mL离心管中,吹打混匀约20次(吹散细胞团,分离成单个细胞)。③显微镜观察确认细胞均从培养瓶上脱落,加入2-3 mL ECM至培养瓶中润洗,然后转移至上述离心管中,吹打终止消化。④离心:120 rcf,1 min,25℃。(等待期间各加入250 L待测文库至低吸附离心管中,注意要快速,吸取之前需要先混悬文库)。⑤离心之后小心倒出,用枪吸出剩下的ECM,加入2V L BB,重悬吸打混匀,获得5×10[font='times new roman'][size=16px]6[/size][/font]个/mL的细胞悬液。[align=left][font='times new roman'][size=16px]2.1.4[/size][/font][font='times new roman'][size=16px]细胞与文库结合[/size][/font][/align]①孵育:分别加入250 μL上述细胞悬液至250 μL ssDNA文库中,进行孵育:4℃,30 min,打开摇床第二格。②等待期间离心机调至4℃;用密封袋装好洁净的1000 L枪头准备流式上样用;2.2.2.5 润洗重悬细胞①取出孵育好的体系,进行离心:4℃,120 g,1 min(等待期间准备好4℃ PBS)。②倒掉上清液,用枪头小心吸出管口残留的上清液,每管加500 L PBS(4℃)用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]吸打重悬约20次。③再次离心4℃,120 g,1 min。④第二次重悬:重复①-③步骤。⑤每管加入500 L PBS重悬,忽略实验损失,最后得到理论细胞浓度为2.5×10[font='times new roman'][size=16px]6[/size][/font]个/mL的细胞悬液。[font='times new roman'][size=16px]2.2[/size][/font][font='times new roman'][size=16px]送样分析[/size][/font]FAM荧光染色较弱,在预处理之后应尽快进行流式分析,流式分析上样程序复杂,需要正确进行开机,测样,关机的步骤,才能够得到准确的数据。[align=left](1)准备工作:[/align][align=left]准备1000 mL[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url],1000 mL 洁净枪头,流式管,质控微球。[/align][align=left]①开启液流系统:由上至下打开流式细胞仪开关;再开启计算机,打开FACSDiva软件,在“Cytometer仪器框”中确认流式细胞仪已与电脑连接,启动液流之前,确认液流系统水平,进行补充鞘液、去离子水、乙醇以及漂水,并清空废液。[/align][align=left]在“Cytometer”菜单中,点击“Fluidics Startup(启动液流系统)”,按照提示进行操作:确定气路和液路是从乙醇桶连接到了鞘液桶上:将蓝色液路管接到过滤器下方,透明气路管接到鞘液桶上;确定闭合的喷嘴是在流动检测池上。[/align][align=left]②将70 m的喷嘴放入装有超纯水的烧杯中,超声30 s,用无尘纸蘸干;抽出闭合的喷嘴;插入70 m的喷嘴(红圈朝上)。[/align][align=left]③点击“×steam”,开启液流,出现水滴状,调整使上端横线位于第二个或者第三个水滴的尾部,下端横线位于第三个或者第四个液滴的中部,调整好后关闭液流。[/align][align=left](2)做质控:[/align][align=left]①用CS&T微球,用之前一定将微球甩匀(保证取出的微球呈均匀体系)用涡旋震荡;取一支洁净的流式管加入333 L的鞘液,再加一滴微球(用之前用混悬仪混匀,正常的微球为浑浊状)。[/align][align=left]②打开液流系统,在“Cytometer”菜单下点击“CST”;展开Setup Control窗口:在Characterize菜单中中选择“Check Performence”;在Configuration流式设置中:喷嘴的大小:选择70m,点击左下角“set configuration”,再点击“OK”。[/align][align=left]③选择微球的Lot ID:与微球瓶身上编号对应:10549。[/align][align=left]④敲弹准备好的微球悬液使其混匀,进行上样,打开液流;确认激发光源没问题即可关掉页面并关掉液流。[/align][align=left](3)上样:[/align][align=left]①新建样品,并勾选FITC、SSC、FSC的H、A、W、log数据项。[/align][align=left]②作图:建立散点图,横坐标为FSC-H,纵坐标为SSC-H;再建立一个图:横坐标:FITC-H,纵坐标为:Count。[/align][align=left]③打开液流至3,选择对应样品;吹打混匀并放置样品,点击“LOAD”上样。调整FSC和SSC的电压,使散点图的中的点都集中在所圈的门中。(若散点偏右,则FSC电压过大,调整FSC电压使其变小,若散点偏上,则调整SSC使其变小。)当调整合适时点击“RECORD”记录数据。[/align][align=left]④计数完毕,调低流速,点击“unload”,选择第二个样品并重复第③步。[/align][align=left]⑤上样完毕之后,保存数据。[/align][align=left](4)关机步骤:[/align][align=left]①上一管clean液,高速冲2 min;再上一管去离子水,高速冲5 min;关闭液流,检查液路系统。[/align][align=left]②在“Cytometer”菜单中,选择“shutdown”,根据指示操作:取下70 m的喷嘴,超声清洗,安装闭合喷嘴(红色点朝上)。[/align][align=left]③把液路和气路连接到乙醇桶上,用乙醇冲洗(先拔气路再拔液路)。[/align][align=left]④装一管clean液,清洗上样针和流动池。[/align][align=left]完成上述步骤之后即可关闭界面。[/align][align=left][/align][font='times new roman'][size=16px]2.3数据处理:[/size][/font]将原始数据用Flowjo软件进行处理,得到散点图以及荧光强度直方图,接下来通过举例来说明数据如何分析:(1) 散点图分析:[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026242555_5228_5413603_3.jpeg[/img][size=13px]数据处理分析散点图[/size][/align]该图为散点图,可以看出大体分为两个集团,散点图有两个集团说明体系中有两种细胞粒子,并且在该图片的左下角粒子较少,说明细胞碎片较少,在预处理时较好地保护了细胞的完整性。散点图中可以区分出整个上样的体系中主要含有两种大小的细胞颗粒,在预处理的过程中,无酶消化液的消化能力较弱,并且细胞团密度较大,细胞间黏连较多,在最后孵育结束用PBS进行重悬的时候仍然能够肉眼可见有白色细微絮状物。FSC值越大,代表颗粒的体积越大;SSC值越大,代表颗粒内部的复杂程度越高。故可初步判断,G1门中的颗粒为未消化完全的细胞团,而G2门中的颗粒为分散的单个细胞。(2) 直方图分析:[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026243736_5071_5413603_3.jpeg[/img][size=13px]数据处理分析直方图[/size][/align]图中为G2门选中的样品的荧光强度,该图中有两个峰,横坐标10[font='times new roman'][size=16px]2[/size][/font]附近所产生的荧光峰可以判定是残留的细胞碎片,可视为背景值,横坐标10[font='times new roman'][size=16px]4[/size][/font]~10[font='times new roman'][size=16px]5[/size][/font]附近的峰代表四个适配体分别与细胞结合所产生的荧光强度,SYL3C-Aptamer结合偏移量最大,荧光较强,且高荧光事件次数较多,说明SYL3C-Aptamer与单个细胞的结合能力最强,并且G2门中的颗粒大多数为消化完全的单个细胞,呈现出较好的特异性。总之,该组结果对比体现出,单个细胞靶点较多,适配体与单个细胞结合能力较高,通过荧光强度波峰的偏移所反映的适配体与细胞特异性结合能力的大小依次为SYL3C-Aptamer>EP166-Aptamer>CA2-Aptamer>ARC1172-Aptamer。同时,由图中可以看出:10th-ssDNA pool与SYL3C-Aptamer在10[font='times new roman'][size=16px]4[/size][/font]~10[font='times new roman'][size=16px]5[/size][/font]荧光强度波峰较高,说明二者与单个细胞的结合能力较好,结合位点较多,呈现良好的特异性和亲和性。SYL3-Aptamer荧光波峰明显右移,与单个细胞的结合位点较多。[font='times new roman'][size=16px]三、总结[/size][/font]本次说明旨在利用带荧光的适配体靶向特异性结合目的细胞的原理,利用流式细胞仪监测适配体结合靶细胞能力的强弱,同时还可以应用于不同适配体靶向同一种细胞的结合能力强弱的比较。进一步利用流式细胞仪,还可以测定适配体的Kd值;还可以根据预处理的条件不同,与对照组比较,来测定适配体靶向细胞的受体是位于细胞膜表面还是细胞内,从而进一步测定适配体的生物学稳定性。同时,流式细胞仪还有很多方面的应用,例如鉴定细菌、检测细胞凋亡等,一些抗体-细胞复合物的结合情况也能够由流式细胞仪来进行监测。 在进行流式上样的过程中,预处理、上样以及数据处理阶段都有需要注意的细节,例如:本次所使用的细胞为贴壁生长的内皮细胞,故在细胞预处理时需要先消化细胞;在进行上样前,需要将样品进行吸打混匀,以免细胞沉积在流式管底部,导致未吸取到样品;在应用流式细胞仪的过程中,使用前的维护、质控流程十分重要,该流程会直接影响所得数据的稳定性;不同的流式细胞仪的维护程序稍有不同,本次说明中的使用方法只适用于BD FACSAria III,流式细胞仪具有强大的分析功能,其在细胞研究中具有重要的作用。[align=left][/align][align=left][/align][align=left][/align][align=left][/align]
白细胞与红细胞在此重新定向。白细胞(WBC)和红细胞(RBC)是血液中的重要组成部分,在生命体延续发展和生物治疗中具有不同的功能。红细胞,又称红血球,含有一种蛋白质称作血红蛋白。当血红蛋白从肺部吸收氧气时,血液呈红色。随着血液流经全身,血红蛋白向人体组织释放氧气。红细胞的生命周期为4个月,其形如圆盘,中间下凹,边缘较厚,呈圆饼状。白细胞,又称白血球,具有更加复杂的功能。白细胞构成了人体抵抗感染的一种防御机制。有多种不同类型的白细胞,其生命周期和功能各不相同。白细胞还能够产生一种特殊的蛋白质,称作抗体,能够识别并吞噬入侵人体的外来异物。 红细胞白细胞物理特征红细胞呈双凹圆盘状,无核。尺寸大约为6-8 μm。白细胞呈不规则性,但有一个核和外缓冲层。生命周期120天。几天,但在健康人体中可存活数天至数年不等。类型:血液中只有一种红细胞在血液中存在许多类型的白细胞,其功能各不相同:嗜中性粒细胞、T淋巴细胞、B淋巴细胞(巨噬细胞)、嗜酸性粒细胞、嗜碱性粒细胞。循环系统:心血管系统。心血管和淋巴系统总计红细胞700:1白细胞男性每立方毫米460-6200万个;女性每立方毫米4200-5400万个。每立方毫米4000 – 11000个功能:向身体的不同部位提供氧气,并负责运送二氧化碳和其它废物。产生抗体,对感染形成免疫力,有些具有噬菌功能。血液中含量:
流式细胞仪(Flow Cytometer)的检测原理是通过激光照射单个快速流动中的细胞或颗粒,并检测由此产生的光散射和荧光信号来分析其物理和化学特性。在检测过程中,样品中的细胞或颗粒被逐个激发并通过检测区,每个细胞或颗粒经过激光照射后会产生散射光和荧光信号,这些信号被不同的检测器收集并转换为电信号,再经计算机处理分析,从而实现对细胞或颗粒的定性和定量分析。这种方法广泛应用于细胞计数、细胞表面标记物检测、DNA含量分析等领域。
[font=宋体]在生物医学研究和治疗领域,[/font][url=https://cn.sinobiological.com/resource/antibody-technical/monoclonal-antibody-production][u][font=宋体][color=#0000ff][b][font=宋体]单克隆抗体([/font][font=Calibri]mAbs[/font][font=宋体])[/font][/b][/color][/font][/u][/url][font=宋体][font=宋体]扮演着越来越重要的角色。特别是在癌症和慢性疾病的治疗中,抗体的亲和力[/font][font=宋体]——即其与目标抗原结合的紧密程度[/font][/font][font=宋体],[/font][font=宋体]直接影响[/font][font=宋体]抗体药物的[/font][font=宋体]治疗效果。因此,开发一种既准确又可靠的抗体亲和力测定方法,对于提高治疗效率和开发新型抗体药物至关重要。[/font][b][font=宋体]传统[/font][font=宋体]的亲和力测定[/font][font=宋体]技术[/font][/b][font=宋体]目前存在多种测[/font][font=宋体]定[/font][font=宋体]抗体亲和力的方法,如放射免疫[/font][font=宋体]分析[/font][font=宋体][font=宋体]、表面等离子共振([/font][font=Calibri]SPR[/font][font=宋体])、流式细胞术[/font][/font][font=宋体]、酶联免疫吸附分析和动力学排阻分析[/font][font=宋体]等[/font][font=宋体]。作为一种成功的候选治疗药物,[/font][font=宋体][font=Calibri]mAbs[/font][font=宋体]必须能识别目标抗原上的天然表位,因此需要一种更加快速灵敏、直观简便的测定方法。[/font][/font][b][font=宋体]基于细胞的荧光法:一种新的[/font][font=宋体]检测[/font][font=宋体]技术[/font][/b][font=宋体][font=Calibri]Yu[/font][font=宋体]等人在杜克大学医学中心的研究中,开发了一种基于细胞的荧光[/font][/font][font=宋体]检测[/font][font=宋体]法[/font][font=宋体](如基于细胞的[/font][font=宋体][font=Calibri]ELISA[/font][font=宋体]法[/font][/font][font=宋体])[/font][font=宋体],用于测[/font][font=宋体]定[/font][font=宋体][font=宋体]抗体亲和力。这种方法通过使用荧光标记的抗体,并将其加入到固定在[/font][font=Calibri]96[/font][font=宋体]孔板上的抗原阳性和抗原阴性的细胞系中,通过计算特异性结合和非特异性结合的差值来测量抗体的亲和力。[/font][/font][font=宋体][font=宋体]研究者通过与传统的流式细胞术和放射性([/font][font=Calibri]I[/font][/font][sup][font=宋体][font=Calibri]125[/font][/font][/sup][font=宋体][font=宋体])[/font][font=Calibri]Scatchard[/font][font=宋体]分析方法进行比较,验证了基于细胞的荧光法的有效性。结果显示,新方法得到的解离常数[/font][font=Calibri]KD[/font][font=宋体]值与传统方法相当,证明了这一新技术的准确性和可靠性。[/font][/font][font=宋体]此外,研究还展示了如何使用这种荧光法进行竞争性结合分析,进一步验证了抗体与抗原的特异性结合。这一功能对于研究抗体的结合表位和选择高亲和力抗体具有重要意义。[/font][b][font=宋体]基于细胞的荧光法的优势[/font][/b][font=宋体]与[/font][font=宋体]流式细胞术和[/font][font=宋体][font=Calibri]I[/font][/font][sup][font=宋体][font=Calibri]125[/font][/font][/sup][font=宋体]比色法等[/font][font=宋体]传统方法相比,基于细胞的荧光法具有多项优势。首先,该方法不使用放射性同位素,减少了实验的安全风险。其次,使用完整的细胞而非纯化的蛋白质,能够更真实地模拟抗体与天然抗原的相互作用。此外,该方法操作简便,成本低廉,适合高通量筛选,且能够在短时间内完成大量样本的分析。[/font][font=宋体] [/font][font=宋体]尽管基于细胞的荧光法具有诸多优势,但也存在一些局限性。例如,对于复杂样品的处理可能会产生非特异性结合,导致结果的误判。然而,随着技术的不断优化和发展,这些问题有望得到解决。[/font][font=宋体]尽管目前还未有人利用[/font][font=宋体]基于细胞的荧光法[/font][font=宋体]来评估抗体亲和力,但是其自身具备的优势[/font][font=宋体][color=#182026]表明[/color][/font][font='Segoe UI'][color=#182026]该方法具有作为抗体亲和力检测方法的潜力[/color][/font][font=宋体],为抗体药物的开发和研究提供强有力的支持。[/font][font=宋体] [/font][font=宋体][/font][font=宋体]本篇[/font][font=宋体]文章[/font][font=宋体]由[/font][font=宋体]义翘神州[/font][font=宋体]编辑[/font][font=宋体]整理[/font][font=宋体],[/font][font=宋体]同时[/font][font=宋体]义翘[/font][font=宋体]神州[/font][font=宋体]提供[/font][url=https://cn.sinobiological.com/services/spr-bli-assay-services][u][font=宋体][color=#0000ff][b][font=Calibri]SPR/BLI[/font][font=宋体]亲和力测定服务[/font][/b][/color][/font][/u][/url][font=宋体],[/font][font=宋体]详情[/font][font=宋体]请[/font][font=宋体]点击[/font][font=宋体]![/font][font=宋体][/font][font=宋体] [/font][font=宋体]参考文献:[/font][font=宋体][font=Calibri]Yu X, Pegram CN, Bigner DD, Chandramohan V. Development and validation of a cell-based fluorescent method for measuring antibody affinity. J Immunol Methods. 2017 442:49-53. doi:10.1016/j.jim.2016.12.004[/font][/font][font=Calibri] [/font]
各位朋友: 请问您们可否告诉我一下,上海有哪几所科研机构正在进行单细胞的拉曼光谱的相关研究并取得了一些初步的进展呢? 我们使用的是雷尼绍的显微共焦拉曼光谱仪,但目前为止仍然没有测到单细胞的拉曼光谱... 本人想请教一下,这一方面的相关问题?
分子生物学(基因工程)的实验中,经常要做细胞质粒DNA的提取和检测工作,以便获得运载基因的载体DNA;或用于实行电泳检测分析,了解样品是否含有质粒DNA(包括重组质粒DNA),判断其分子量大小,区别不同质粒等等。因此质粒DNA的提取是基因工程实验中最常用的手段之一。质粒是一种染色体外的稳定遗传银子,大小从1kb到200kb不等,大多数来自细菌的质粒是双链、共价闭合环状的分子,并以超螺旋形式存在于宿主的细胞质中。它是细菌内的共生型遗传因子,主要发现于细菌、放线菌和真菌细胞中,质粒具有自主复制和转录能力,能在子代细胞中保持恒定的拷贝数,并表达所携带的遗传信息。质粒的分离是利用质粒DNA和染色体DNA在变性与复性中的差异来达到的目的。当菌体在NaOH和SDS溶液中裂解时,蛋白质与DNA发生变性,由于染色体DNA与质粒DNA拓扑构型不同,染色体DNA双螺旋结构解开,而共价闭合质粒DNA的氢键虽被断裂,但两条互补链彼此相互盘绕仍会紧密地结合在仪器。当加入中和液后,溶液pH恢复至中性,在高盐浓度的情况下,染色体DNA之间交联形成不溶性网状结构并与蛋白质SDS复合物等形成沉淀;不同的是质粒DNA复性迅速而准确,保持可溶状态而留在上清中。这样,通过离心可沉淀大部分细胞碎片、染色体DNA、RNA及蛋白质。除去沉淀后上清中的质粒可用酚氯仿抽提进一步纯化质粒DNA。前面提取质粒DNA的方法就是实验室常用的碱裂解法,该法的操作过程如下:首先讲含有质粒的细菌接种到培养基,经过大约12小时的恒温摇陪后弃去上清液,加入中和液后用漩涡混匀器将溶液充分混匀,然后加入碱液进行沉淀,这就是变性与复性,最后的操作就是实验室常用的沉淀的分离、纯化。分离、纯化DNA首先取上清液,加入分离液后采用漩涡混匀器混匀溶液,离心取上清液,加入无水乙醇后混匀,离心后弃上清液,干燥DNA即可。这个实验中常用到漩涡混匀器进行溶液混匀,意大利VELP公司推出多种型号的漩涡混匀器可满足每一个实验室的需要和安全标准。特别是红外漩涡混匀器,这是VELP公司的专利,该漩涡混匀器一旦检测到试管即自动开始震动混匀,不需要施加任何外力,震动速度可调,时间可设,漩涡混匀器稳定性高,非常适合细胞质粒提取实验。
超声波细胞破碎仪是利用超声波在液体中的分散效应,使液体产生空化的作用,从而使液体中的固体颗粒或细胞组织破碎。常规使用方法是把要破碎的材料放到烧杯中,开电源设定时间(震动时间和间歇时间),将破碎仪的探头放到材料中。使用过程中,超声波发生器电路将50/60Hz的市电转换成18-21KHz的高频高压电能,因此破碎过程中会大量产热,一般在冰浴下破碎。超声波细胞破碎仪的两大组成部件为超声波发生器和换能器(有的配置有隔音箱)。1、超声波发生器:工作原理:由信号发生器来产生一个特定频率的信号,这个特定频率就是换能器的频率,一般应用在超声波设备中的超声波频率为20KHz、25KHz、28KHz、33KHz、40KHz、60KHz。2、换能器组件:换能器组件主要由换能器和变幅杆组成。3、隔音箱:可以有效地的降低工作过程中的所发出的噪音,保持实验室安静。超声波细胞破碎仪在我国的行业推广已进入成熟阶段,而应用仍不够普及!该仪器(设备)应用范围非常广泛,这是其它仪器设备所不能比拟的。也正因如此,该仪器(设备)的市场潜力很大,所以生产厂家也日趋增多,这也同时造成了超声清洗行业及市场的相对混乱,可以用八个字来形容“鱼龙混杂,良莠不齐”!超声波细胞破碎仪分类如下:一、按探头(“tip”)直径分类处理不用体积的样品需要选择不同“tip”头的超声波破碎仪。由于各制造厂家的产品结构不同,其“tip”头直径不尽相同。一般“tip”头从微量5mm(适合1ml处理量)到25mm(适合1000ml处理量),有连续流探头,处理量可达80升/小时。可能会发生磨损的高能应用中会用到可更换“tip”头。当能量通过“tip”头被传递时,金属表面留下痕迹的地方会发生腐蚀。随着时间的推移,发生腐蚀的地方会产生轻微的蚀损斑。“tip”头可以用砂纸或纱布来打磨,除非是损坏到一定的程度;当这种情况发生时,“tip”头将很难进行调谐频率,取而代之的可能是发出长而尖的噪音,最终产生裂纹。 要有效地加工给定剂量的样品,有两个主要的因素需要考虑:“tip”头尺寸和输出功率。这两个因素必须同时匹配才能获得最佳效果。小功率大“tip”头,则“tip”头无法工作;而太大的功率则“tip”头可能损坏。购买时请注意所需型号附件。二、按功率分类超声波细胞破碎仪的功率大小是客户的首选指标,它决定着被破碎物的数量、大小、质量及效果。所以各生产厂家对此指标也都非常重视。一般情况下,实验室、化验室、研究所、药品检验所等科研单位,使用的功率都不大,(一般在500W以下);而生物公司、制药厂、化工企业等生产单位,所用的功率大都在500W-2000W左右。由于各制造厂家的产品结构不同,其功率的标注方法也不尽相同。不过按照用户常用的惯例,一般有以下几种:50W、100W、150W、250W、300W、350W、500W、1000W、2000W。一般超声波细胞破碎仪输出功率可根据需要适度调节。 标准超声波细胞粉碎机产品的额定工作频率是20千赫兹。一些超声波细胞粉碎机有自动调谐功能可以使频率在一个小的范围内变化。
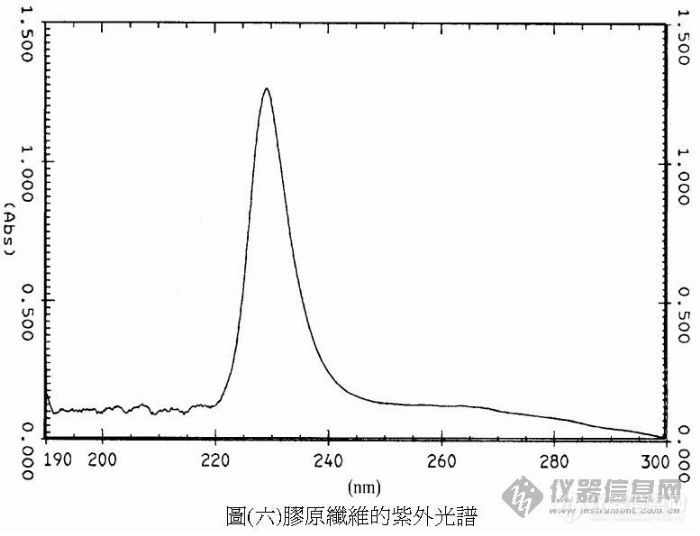
我们专题主要是研究胶原纤维,费伦有提过胶原纤维存在红外光传输的特征波段,不过在国内外研究极少提到有关细胞与细胞外基质的光传输,大都是提到有关化学反应的过程,现在是想找在胶原纤维的[color=#DC143C]UV与IR光谱里那一个波峰[/color]透过纤连蛋白(fibronectin)传输光讯号到细胞上的受体,之前是有找到有关细胞不含胞器(只剩肌动蛋白丝actin、整键蛋白integrin)也能移动,所以我们就假设细胞的移动可能是胶原纤维所操控,讲得有点多了,因为就只差这一点专题就完成了,可以请专家提出一些意见吗?谢谢[IMG]http://www.cella.cn/book/10/images/image006.jpg[/IMG][img]http://ng1.17img.cn/bbsfiles/images/2008/04/200804301729_87430_1025911_3.jpg[/img][img]http://ng1.17img.cn/bbsfiles/images/2008/04/200804301733_87431_1025911_3.jpg[/img]
?流式细胞仪的检测原理?包括以下几个方面: ?液流系统?:流式细胞仪吸取细胞悬液后,细胞在气体的压力下进入流动室;而鞘液在高压下从鞘液管喷出,包裹着细胞高速流动形成鞘流,使细胞排成单列依次经过仪器的测量区?。 ?激光光源及光束形成系统?:流式细胞仪大多采用氩离子气体激光器产生激光(波长488nm),在细胞经过测量区的时候,激光垂直照射被荧光染色的细胞,荧光染料被激发从而产生荧光信号和散射光信号。散射光信号分为前向角散射(FSC)和侧向角散射(SSC),FSC反映细胞的大小,而SSC反映细胞内部的结构和颗粒性质?。 ?光学系统?:当不同的荧光染料受到激光激发后会发射不同波长的荧光,这些荧光与SSC一起沿激光90°方向经过各种滤光片以到达对应的通道。滤光片有长通、短通、带通滤光片,借助滤光片可以把不同波长的荧光信号送入到不同的电子检测器?。
细胞自噬是机体一种重要的防御和保护机制。但是这种自噬“信号”如何传递给细胞从而使其“执行”自噬过程,则一直是科学界的难题。近期,我校生命科学学院林圣彩教授课题组成功找到高等动物细胞在生长因子缺失条件下,启动自噬的部分“密码”,从而在细胞自噬机制研究方面取得重大突破。 4月27日,最新一期的美国《科学》杂志以研究文章的形式刊发了这项研究成果,并配发专门评述。这也是近三年来,我校生命科学学院第二篇发表在这一世界顶级学术刊物上的论文。2009年6月,该院韩家淮教授的一篇有关细胞选择死亡方式机制的研究文章曾“登上”该杂志。 所谓自噬,是指细胞消化自身蛋白质或细胞内的结构(细胞器)的一种自食现象。通过这种现象,细胞可以降解、消除和消化受损、变性、衰老和失去功能的细胞器和变性蛋白质等生物大分子,为细胞的生存和修复提供必须的能量。 科学家们认为,自噬与细胞凋亡、细胞衰老一样,是一种十分重要的生物学现象。有关实验表明,包括肥胖症、糖尿病、神经退行性疾病、免疫失调及癌症在内的人类许多重大疾病的发生都与该过程的异常有关。为此,自噬也是当前生命科学中最热门的研究领域之一。 据林圣彩介绍,对自噬进行分子机制的研究始于上世纪90年代的以单细胞生物酿酒酵母为模型的研究,目前,一系列构成单细胞生物自噬核心机器的基因已被发现并命名。 然而,对自噬在多细胞生物特别是哺乳动物中的调控机制的研究,科学界至今仍在不断探索中。摆在科学家面前的一个根源性的问题是:在多细胞生物中,诱导自噬的各种信号是如何被传递到细胞内自噬“核心机器”从而启动自噬过程的? 研究表明,与单细胞生物不同,在多细胞生物内,外界营养元素要依赖于生长因子的调控才能被转运到细胞内。一旦细胞外的生长因子匮乏,细胞便能启动自噬以维持能量平衡。那么,生长因子缺失这一信号又是如何“传达”的呢? 这也成为长期致力于细胞信号转导研究的林圣彩教授课题组近年来的研究目标之一。经过多年研究,课题组终于成功“**”这一自噬启动“密码”——即通过一种名为GSK3的激酶活性增高后磷酸化并随之激活乙酰转移酶TIP60,进而导致自噬核心机器中的蛋白激酶ULK1的乙酰化水平增强而启动细胞自噬。简言之,这一发现揭示了多细胞生物在生长因子缺失条件下的细胞自噬过程的新的介导分子及其通路。 林圣彩认为,弄清楚了细胞内到底有哪些蛋白分子“参与”了自噬和它们如何串联在一起,将有益于科学界从“源头”上认识相关疾病,并为这些疾病的诊断和治疗提供新的靶点。
用体外方法对机体各种具有免疫反应的细胞分别作鉴定、计数和功能测定,是观察机体免疫状态的一种重要手段。为此,须将各种参与免疫反应的细胞从血液或脏器中分离出来。参与免疫反应的细胞主要包括淋巴细胞、巨噬细胞、中性粒细胞等。由于检测的目的和方法有同,分离细胞的需求和技术也异。有的仅需分离白细胞,有的则需分离单个核细胞(mononuclearcell),其中含淋巴细胞和单核细胞(monocyte),有的则需分离T细胞和B细胞以及其亚群。分离细胞选用的方法应力求简便可行,并能获得高纯度、高获得率、高活力的细胞。现用分离细胞群的原则,一是根据各类细胞的大小、沉降率、粘附和吞噬能力加以组分,另一则按照各类细胞的表面标志,包括细胞表面的抗原和受体加以选择性分离。 一、白细胞的分离 (一)血液中红细胞与白细胞比例约600~1000:1,两者的比重不同其沉降速度亦异,通常用两种方法加以分离。 本法是利用血细胞自然沉降率的分离法,采集血液后应及时抗凝,通常选用肝素抗凝法。肝素能阻止凝血酶原转化为凝血酶,从而抑制纤维蛋白原形成纤维蛋白而防止血液凝固。操作原则是将含抗凝血的试管直立静置室温30~60min后,血液分成明显三层,上层为淡黄色血浆,底层为红细胞,紧贴红细胞层上面的灰白层为白细胞,轻轻吸取即得富含白细胞的细胞群,离心洗涤后加入少量蒸馏水或含氯化铵的Gey溶液,经短时间的低渗处理,使红细胞裂解,经过反复洗涤可得纯度较高的白细胞悬液。 (二)聚合物加速沉淀法 本法是利用高分子量的聚合物如明胶、右旋糖酐、聚乙烯吡喀烷酮(polyvinylpyrolidone,PVP)等使红细胞凝集成串,加速红细胞沉降,使之与白细胞分离。本法的细胞获得率比自然沉降法高。
原标题 “纳米生物间谍”技术能进入活细胞取样 可用于深入揭示线粒体基因组变异的重要性 科技日报讯 据物理学家组织网近日报道,美国加利福尼亚大学圣克鲁兹分校(UCSC)研究人员开发出一种机器人式的“纳米生物间谍”系统,能从单个活细胞内提取出微量样本,进行RNA或DNA测序,而不会杀死细胞。研究人员表示,这种单细胞“纳米生物间谍”技术是一种了解活细胞内部动态过程的有力工具。相关论文发表在最近出版的美国化学协会《纳米》杂志上。 “我们能从活细胞中拿走一个‘生物间谍’,再把它送回该细胞,在几天内这样重复多次而不会杀死细胞。如果用其他技术,你不得不牺牲这个细胞才能分析它。”该生物传感与生物电技术小组负责人、UCSC巴斯金工程学院生物分子工程教授内德·波曼德说。 “纳米生物间谍”平台是研究小组用纳米吸液管开发的最新设备。纳米吸液管是一种小玻璃管,取液端越来越细,至尖端直径仅50到100纳米。波曼德说:“我能在实验室造出纳米吸液管,这不需要昂贵的纳米制造设备。但要进入一个细胞,问题是即使在高倍显微镜下,你也看不见吸液管尖端,不知道它偏离了细胞有多远。” 实验室博士后研究员亚当·赛格尔解决了这一问题。他基于在一台改造过的扫描离子电导显微镜(SICM),开发出一种反馈控制系统。该系统能利用通过纳米吸液管尖端的离子流作为反馈信号,在尖端接近细胞表面时探测其中的液滴。在尖端进入细胞之前,一种自动控制系统能定位它在细胞上面的位置,然后尖端很快插入穿透细胞膜,通过操控电压有控制地提取一小点细胞内物质。由于吸液管尖端极精细,对细胞造成的损害极微小。 研究小组用这种系统从活细胞中提取的微量细胞物质,估计只有50毫微微升(千万亿分之一升),约一个人体细胞百分之一的量。他们从单个人体癌细胞中提取物质并进行RNA测序,还从人类成纤维细胞中提取了线粒体并对其进行了DNA测序。“人们已经知道,线粒体和多种神经退化疾病有关。该技术可用于深入揭示线粒体基因组变异的重要性。”波曼德说。 该技术应用前景广阔。波曼德希望能与其他研究人员合作,探索其更多用途。“对于癌症生物学家、干细胞生物学家等想要了解细胞内部情况的科学家来说,这是一种多功能的平台。”(常丽君)来源:中国科技网-科技日报 2014年01月20日