加热蛋白溶菌酶能杀灭诺如病毒日本东京海洋大学的一个研究小组日前宣布,在实验中发现,加热处理鸡蛋蛋白含有的溶菌酶,能灭活诺如病毒。这是由于溶菌酶能破坏包裹诺如病毒基因的外壳。诺如病毒会引发急性肠胃炎和食物中毒。这种病毒具有强大的感染力,只要有10至100个病毒体进入人体,就会导致感染,目前还没有有效的抗病毒剂。研究小组利用实验鼠的诺如病毒替代人类诺如病毒进行了实验。他们将蛋白中含有的溶菌酶在100摄氏度下加热40分钟,使其变性。接下来,将含有1%加热处理过的溶菌酶的溶液与实验鼠诺如病毒混合在一起,并观察了1分钟之后的变化。溶菌酶是蛋白等含有的一种能水解致病菌中黏多糖的碱性酶。研究人员发现,诺如病毒基因量大幅减少,以致无法检出,并观察到病毒体出现膨胀。他们认为这是由于包裹病毒基因的外壳被破坏导致的。研究人员指出,实验鼠诺如病毒和人类诺如病毒从遗传学上来看非常类似,所以这种加热变性处理的蛋白溶菌酶对人类诺如病毒应该也有效果。他们希望将其制成消毒喷雾剂,在下一年度达到实用化。
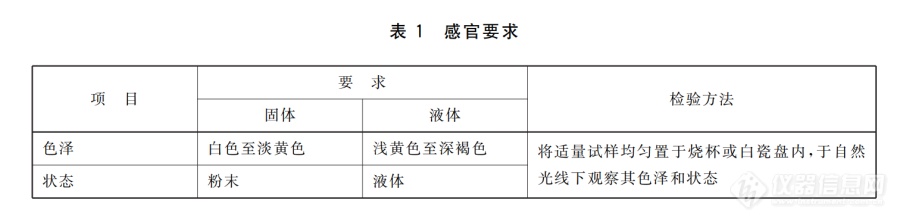
[align=center][font='宋体'][size=29px]溶菌酶[/size][/font][/align][size=24px]赵浩博[/size][size=12px]溶菌酶又称细胞壁质酶或[/size][size=12px] N- 乙酰胞壁质聚糖水解酶。1922 年英国细菌学家 A. Fleming 发现人的唾液、 眼泪中存[/size][size=12px]在有溶解细菌细胞壁的酶,[/size][size=12px] 因其具有溶菌作用, 故命名为溶[/size][size=12px]菌酶。[/size][size=12px] 此后在人和动物的多种组织、 分泌液, 及某些植物、[/size][size=12px]微生物中也发现了溶菌酶的存在。[/size][size=12px] 随着研究的不断深入, 发[/size][size=12px]现不仅有溶解细菌细胞壁的溶菌酶,[/size][size=12px] 还有作用于真菌细胞壁[/size][size=12px]的种类,[/size][size=12px] 同时对其作用机制也有了更进一步的了解。 近几[/size][size=12px]年,[/size][size=12px] 人们根据溶菌酶的溶菌特性, 将其应用于医疗、 食品、[/size][size=12px]畜牧及生物工程中。[/size][size=12px]溶菌酶来源不同,其分子大小不一样,其氨基酸排列顺序也有所不同,如:[/size][size=12px] T4 噬菌体溶菌酶由 164 个[/size][size=12px]氨基酸组成,分子量为[/size][size=12px] 19 ku;鸡蛋溶菌酶只有 129 个[/size][size=12px]氨基酸,其分子量约为[/size][size=12px] 14.3 ku;人溶菌酶由 130 个氨[/size][size=12px]基酸残基组成,分子量为[/size][size=12px] 14.6 ku;植物中分离出的溶[/size][size=12px]菌酶,其分子量较大,约为[/size][size=12px] 24 ku~29 ku。各种溶菌酶[/size][size=12px]的等电点在[/size][size=12px] 10.7~11.5 之间,化学性质十分稳定, pH 在1.2~11.3 范围内剧烈变化时,其结构几乎不变,活性不[/size][size=12px]受影响,此外,溶菌酶对热也极为稳定,在[/size][size=12px] pH3.0 条件[/size][size=12px]下,沸水浴中加热[/size][size=12px] 60 min 其活力仍保持 90 %以上。[/size][size=12px]目前鸡蛋清溶菌酶是研究最清楚的一种溶菌酶并已投入商业化生产。它是由[/size][size=12px] 18 种 129 个氨基酸残基[/size][size=12px]构成的单一肽链,有[/size][size=12px] 4 个 S-S 键的氨基酸 Cys,等电点[/size][size=12px]约为[/size][size=12px] 11.1,最适溶菌温度为 45 ℃~50 ℃, pH 为 6.0~7.0。在酸性环境中,溶菌酶对热的稳定性很强, pH4~7[/size][size=12px]范围内,[/size][size=12px] 100 ℃处理 1 min 仍有近 100 的活力, 210 ℃加[/size][size=12px]热[/size][size=12px] 1.5 h 仍具有活性;在中性水溶液中,溶菌酶可维持[/size][size=12px]数天而不失去活性;在碱性条件下,其稳定性较差[/size][size=12px]。[/size][font='宋体'][size=14px]1. [/size][/font][font='宋体'][size=12px]溶菌酶的理化性质[/size][/font][size=12px]溶菌酶纯品呈白色、微黄或黄色的结晶体或无定形粉末,无异味,微甜,易溶于水,不溶于丙酮、乙醚。溶菌酶遇碱易被破坏,但在酸性环境下,溶菌酶对热的稳定性很强,在[/size][size=12px]pH值为4-7时,100℃处理1min,仍能较好地保持活力:pH值为3时,能耐100℃加热处理45min。 [/size][size=12px]溶菌酶化学性质非常稳定,当[/size][size=12px]pH值在一定范围内剧烈变化时,其结构几乎不变。溶菌酶不可逆变性的临界点是77℃,随溶剂的变化,不可逆变性临界点也发生变化,当溶菌酶所处溶液pH值小于1时,不可逆变性临界点降低到43℃。[/size][size=12px]溶菌酶最适[/size][size=12px]pH为5.3~6.4,可用于低酸性食品防腐;溶菌酶作为防腐剂安全性高,可被冷冻或干燥处理,且活力稳定。 [/size][size=12px]溶菌酶对几种变性剂的敏感程度为[/size][size=12px]:二恶烷二甲基乙酰胺二甲基甲酰胺丙酮,并且随溶剂用量的增加而直线下降。[/size][font='宋体'][size=14px]2. [/size][/font][font='宋体'][size=12px]溶菌酶的制备[/size][/font][size=12px]目前溶菌酶可以以鸡蛋清和蛋壳膜为材料提取制得,常用的方法有亲和层析法、离子交换树脂法、直接结晶法和聚丙烯酸沉淀法等。[/size][size=12px]亲和层析法是利用蛋白质和酶的生物学特异性,即蛋白质或酶与其配体之间所具有的专一性亲和力而设计的色谱技术。酶一底物复合物形成之后,在一定的条件下分离复合物便得到纯净的酶。常常使用的吸附剂为几丁质及其衍生物,如:几丁质粉、羧甲基几丁质、几丁质包埋纤维素、脱氨几丁质粉、[/size][size=12px]N-酰化壳聚糖、脱氨再生几丁质凝胶。[/size][size=12px]离子交换法是利用离子交换剂与溶液中的离子之间所生的交换反应来进行分离的,分离的效果较好,广泛用于微量组分的富集。一般流程为:鲜蛋一预处理一搅拌吸附一上柱洗脱一等电点沉淀一透析一喷雾干燥一成品。[/size][size=12px]溶菌酶在等电点以下较广泛的[/size][size=12px]pH值范围内,分子带正电荷,可吸附于弱酸性阳离子交换树脂上,洗脱后盐析,可得溶菌酶沉淀,再进行精制可得成品。蛋清吸附724树脂,洗涤缓冲液洗脱,硫酸铵溶液盐析透析,用NaOH去碱性蛋白,冻干溶菌酶,冻干粉沉淀干燥得到溶菌酶。在5—10℃下,将新鲜蛋清540kg加入到已处理好的80kg 724树脂中,搅拌吸附6h,在0—5℃静置过夜。倾出上层蛋清,树脂离心甩干,用蒸馏水反复洗去黏附的卵蛋白,然后将树脂装入柱内,用0.15mol/L、pH=6.5磷酸缓冲溶液约150L洗涤树脂,再用约600L的10%硫酸铵溶液洗脱,收集洗脱液。洗脱液中加硫酸铵,使最终含硫酸铵量为40%,有白色沉淀生成,冷处放置过夜。虹吸上层清液,沉淀吸滤抽干,再用1倍蒸馏水溶解沉淀呈稀糊状,然后装入透析袋,在约5℃的条件下,对蒸馏水透析24h左右,中间换水2—3次。离心去除沉淀,沉淀再用少量水洗一次,洗液与离心液合并。再往透析清液中慢慢加入1mol/L氢氧化钠溶液,同时不断搅拌,使pH值上升到8.0—9.0,如有白色沉淀,即离心除去。然后用3mol/L盐酸调pH=5.0,冷冻干燥,即得白色片状溶菌酶。也可将离心液用3mol/L盐酸调pH=3.5,在搅拌下缓慢加入5%的固体氯化钠,在约5℃的温度下静置48h,离心,沉淀用0℃丙酮洗涤,干燥,即得溶菌酶。[/size][size=12px]在蛋清中加入一定量的碘化物或碳酸盐等盐类,并调[/size][size=12px]pH值至9.5—10.0,溶菌酶会以结晶形式慢慢析出,而大多数蛋白质仍然在溶液。在超滤浓缩脱盐后,为获得较纯产品,采用结晶纯化酶液经超滤处理后,用NaOH调整pH 9.5,离心去除。上清液在缓缓搅拌下,加NaCl至5%,静置一周,得粗结晶。结晶溶于pH 4.6醋酸水中,分去不溶物后,进行重结晶,结晶的最终得率为60%左右。即每公斤蛋清中可得重结晶品近1.3 g,活力测定为8000U/mg。 [/size][size=12px]聚丙烯酸沉淀法为将提取过滤后含酶洗脱液,首先经过吸附步骤,即将过滤后的澄清溶液用[/size][size=12px]20%的NaOH溶液调pH至6.0,在调pH值的过程中不停的搅拌。有少量的乳白色沉淀析出,然后加入15%聚丙烯酸,立即有白色沉淀析出,加至pH值为3.0为止,静置17个小时进行静析,得到粘附于底部的乳白色胶状物。第二步解离,将前步得到的溶菌酶聚丙烯酸凝聚物。加入少量蒸馏水并用0.5 mol/L的碳酸钠,将其溶解,转移后,将pH值调到9.5。加入5%CaCl2溶液将溶菌酶聚丙烯酸解离,至无沉淀析出,然后过滤,得到澄清溶液。第三步盐[/size][size=12px]析,将所得澄清溶液加入[/size][size=12px]5%的NaCI溶液搅拌均匀。放入冰箱调温度为0℃。待有晶体析出后,用无水乙醇洗涤数次,置恒温培养箱中40℃条件下干燥称重。[/size][font='宋体'][size=14px]3. [/size][/font][font='宋体'][size=12px]溶菌酶的应用[/size][/font][font='宋体'][size=12px]本文主要从溶菌酶在食品添加剂中的应用展开进行论述。[/size][/font][size=12px]3[/size][size=12px].1 用于水产、肉类的防腐[/size][size=12px]将溶菌酶应用于水产品、肉类的保鲜防腐,目前已做了大量的研究。如早在[/size][size=12px] 2001 年前陈舜胜等就研[/size][size=12px]究了溶菌酶复合保鲜剂在冷藏([/size][size=12px]5 ℃)与冰藏(0 ℃~1 ℃)[/size][size=12px]条件下对虾、带鱼段、扇贝柱和柔鱼的保鲜效果,结果表明,使用溶菌酶([/size][size=12px]0.05 %)复合保鲜液浸泡后冷藏或[/size][size=12px]用溶菌酶([/size][size=12px]0.05 %~0.08 %)复合保鲜液制备保鲜冰冰[/size][size=12px]藏,与常规保鲜方法相比,可将上述水产品的保鲜期延长约一倍的时间。[/size][size=12px]2012 年张观科又报道:采用溶[/size][size=12px]菌酶、[/size][size=12px]Nisin、甘氨酸、VC、山梨酸钾、NaCl 等不同的配比[/size][size=12px]的复合生物保鲜剂在不同温度对牡蛎进行保鲜贮藏研究。结果表明,采用[/size][size=12px] Nisin 和溶菌酶配合的生物保鲜[/size][size=12px]剂的保鲜效果最佳(在[/size][size=12px]-3 ℃微冻条件下,保藏 30 天后[/size][size=12px]感官性状仍然良好)[/size][size=12px] 。而钱曦利用海藻糖、蜂胶、茶多[/size][size=12px]酚、魔芋葡甘露聚糖、[/size][size=12px]Nisin、溶菌酶、壳聚糖和姜汁 8种[/size][size=12px]天然保鲜剂对鹿肉保鲜进行研究,结果表明:单独使用时,溶菌酶对鹿肉样品就有较明显的抑菌作用(最佳抑菌浓度为[/size][size=12px] 0.5 %);而采用复合天然保鲜剂(茶多[/size][size=12px]酚、溶菌酶、海藻糖、[/size][size=12px]Nisin 复合)效果更好,可以有效的[/size][size=12px]提高鹿肉的货架期至[/size][size=12px] 36 d。从以上研究结果来看,溶菌[/size][size=12px]酶尤其是它在与其他保鲜剂按一定比例复合使用时,对水产及肉类能起到较好的防腐保鲜效果。[/size][size=12px]3[/size][size=12px].2 在低度酒类、饮料中的应用[/size][size=12px]日本已成功的使用鸡蛋清溶菌酶代替水杨酸作防腐剂用于清酒的防腐[/size][size=12px]。在国内,倪瑛和钟立人研[/size][size=12px]究了溶菌酶在葡萄酒生产中的应用。因为在葡萄酒生产中乳酸菌会将苹果酸转变为乳酸,但如果在酒精发[/size][size=12px]酵的前期就完成了这种反应,会对葡萄酒的感官产生不良影响,而控制乳酸菌生长的传统方法是使用[/size][size=12px] SO2,[/size][size=12px]但[/size][size=12px] SO2 的使用不仅对人体产生毒性,同样影响葡萄酒[/size][size=12px]的品质。因此,倪瑛等尝试将溶菌酶替代或补充[/size][size=12px] SO2 调[/size][size=12px]控乳酸菌的生长,结果显示,在葡萄原汁中加入[/size][size=12px] 0.1 %~0.15 %的溶菌酶,乳酸菌生长被抑制;在白葡萄酒中溶[/size][size=12px]菌酶剂量加至[/size][size=12px] 0.5 %时,可完全抑制苹果酸向乳酸的转[/size][size=12px]变。此外,将溶菌酶用于饮料防腐也有报道,如常凯等将溶菌酶([/size][size=12px]0.05 %) 、甘氨酸和 NaCl 进行复配用于生[/size][size=12px]产脱脂山核桃乳,其抑菌效果较显著,降低了山核桃乳的杀菌强度,延长了产品货架期。从以上结果看,在葡萄酒的生产中溶菌酶可作为[/size][size=12px]SO2 天然的、安全的替代或补充品来抑制乳酸菌的生[/size][size=12px]长,在其他低度果酒中也可做类似的尝试;同样将溶菌酶用饮料的防腐也有较显著的效果。[/size][size=12px]3[/size][size=12px].3 在乳制品中的应用[/size][size=12px]由于溶菌酶对肠道中腐败性微生物有特殊的杀灭作用,同时可直接或间接地促进肠道中双歧杆菌的增殖[/size][size=12px]。因此,有大量有关溶菌酶应用于婴幼儿奶粉的[/size][size=12px]专题论述[/size][size=12px] 冯棋琴,等:溶菌酶在食品工业中的研究进展[/size][size=12px]35研究报道,如刘浩强等研究了鸡蛋溶菌酶对婴幼儿[/size][size=12px]配方奶粉的抑菌效果,结果表明,婴幼儿配方奶粉在喷雾干燥后添加[/size][size=12px] 10 mg/100 mL~50 mg/100 mL 的鸡蛋[/size][size=12px]溶菌酶效果最好。张明江[/size][size=12px]等关于婴幼儿配方奶粉中[/size][size=12px]溶菌酶的添加工艺的研究也得出了相似的结论,既奶粉喷雾干燥后添加[/size][size=12px] 500 mg/L 的溶菌酶抑菌效果最好。[/size][size=12px]3[/size][size=12px].4 在水果保鲜上的应用[/size][size=12px]水果经过溶菌酶处理,其表面的细菌被有效的抑制或杀灭,从而延长水果的保鲜期。胡晓亮等[/size][size=12px]采用溶[/size][size=12px]菌酶与溶菌酶复合保鲜剂对马陆葡萄进行涂膜保鲜,结果表明:溶菌酶单独使用有一定的保鲜效果,但将溶菌酶([/size][size=12px]0.1 %)和海藻酸钠(1 %)复合使用对抑制马陆[/size][size=12px]葡萄的感官品质下降效果更为显著,在([/size][size=12px]4±1) ℃条件下[/size][size=12px]贮藏[/size][size=12px] 25 d 后,仍保持果实的硬度和组织形态,质量损[/size][size=12px]失率仅为[/size][size=12px] 9.34 %。[/size][size=12px]溶菌酶本身作为一种天然蛋白质,能在胃肠内作为营养物质被消化和吸收,对机体无毒性,也不会在体内残留,安全性很高,加之有效的防腐特性,溶菌酶已受到了食品行业的青睐。但目前实际应用的且已商品化的是鸡蛋清溶菌酶,它的抗菌谱较窄,只对[/size][size=12px] G+细菌起作用,底物特异性[/size][size=12px]强,且投入[/size][size=12px]/效率低,这限制了它们的广泛使用。为了扩[/size][size=12px]大溶菌酶使用领域及防腐效果,可以将鸡蛋清溶菌酶与其他天然保鲜剂(如海藻糖、茶多酚、[/size][size=12px]Nisin、溶菌酶、[/size][size=12px]壳聚糖等)配合使用。[/size][size=12px]此外,随着科学技术的发展,人们还可以采用一些高科技手段(如采用微生物发酵法生产溶菌酶,采用酶修饰法合成溶菌酶复合物如溶菌酶[/size][size=12px]-环糊精、溶菌酶-半乳甘露聚糖等)生产并改良溶[/size][size=12px]菌酶。经过改良的溶菌酶不仅抗菌活性稳定,而且具有良好的乳化性能。当这些杀菌谱广、成本低、安全性高溶菌酶复合剂以及人工合成溶菌酶商品化时,溶菌酶的使用范围定会越来越广,将会在各行业发挥不可估量的作用。[/size][font='宋体'][size=14px]4. [/size][/font][font='宋体'][size=12px]溶菌酶的限量,检测与标准[/size][/font][size=12px]溶菌酶可水解细菌的细胞壁[/size][size=12px], 造成藤黄微球菌的溶解而引起溶液吸光度值的降低。[/size][size=12px]一个溶菌酶活力单位定义为[/size][size=12px]25 ℃ ,pH 6.2 条件下, 使用藤黄微球菌悬浊液在450 nm 处每分钟引[/size][size=12px]起吸光度变化为[/size][size=12px]0.001 所需溶菌酶的量。[/size][size=12px]试剂和材料[/size][size=12px]藤黄微球菌:ATCC4698 或 CICC10680。[/size][size=12px]0.1 mol/L 磷酸盐缓冲液:pH 6.2。[/size][size=12px]称取[/size][size=12px]11.70 g 磷酸二氢钠(NaH[/size][font='宋体'][size=12px]2[/size][/font][size=12px]PO[/size][font='宋体'][size=12px]4[/size][/font][size=12px] 2H[/size][font='宋体'][size=12px]2[/size][/font][size=12px]O) 、7.86 g 磷酸氢二钠(Na[/size][font='宋体'][size=12px]2[/size][/font][size=12px]HPO[/size][font='宋体'][size=12px]4[/size][/font][size=12px]12H[/size][font='宋体'][size=12px]2[/size][/font][size=12px]O) 及0.372 g[/size][size=12px]乙二[/size][size=12px]胺四乙酸二钠 (EDTA-[/size][font='宋体'][size=12px]2[/size][/font][size=12px]Na)于无菌水中并稀释定容至1000mL。调整缓溶液pH至6.2±0.1。[/size][size=12px]注[/size][size=12px]: 用小份缓冲溶液检查pH, 以避免缓冲溶液被污染。如果需要, 通过加入更多的磷酸二氢钠溶液或磷酸氢二钠[/size][size=12px]溶液调整[/size][size=12px]pH。[/size][size=12px]溶菌酶标准品: 蛋清溶菌酶。[/size][size=12px]底物溶液: 用磷酸盐缓冲液制备50 mL 藤黄微球菌悬浊液。 使用前, 底物于37 ℃ 培养30 min。[/size][size=12px]该底物溶液室温下可稳定[/size][size=12px]2 h。 以磷酸盐缓冲液调分光光度计零点, 然后测定底物溶液的吸光度,450 nm 下读数应为0.70±0.1。[/size][size=12px]仪器和设备[/size][size=12px]分光光度计: 精度±0.001。pH 计。[/size][size=12px]注[/size][size=12px]: 所用的器皿应保持无菌, 保证工作环境的清洁。[/size][size=12px]分析步骤[/size][size=12px]试样溶液的制备[/size][size=12px]准确称取[/size][size=12px]100 mg±0.1 mg 试样, 置于50 mL 容量瓶中, 用约25 mL 磷酸盐缓冲液搅拌溶解并稀释[/size][size=12px]定容[/size][size=12px], 充分混匀。 再转移3 mL 上述试样制备溶液至100 mL 容量瓶中, 用磷酸盐缓冲液搅拌溶解并稀[/size][size=12px]释定容。[/size][size=12px]标准溶液的制备[/size][size=12px]精确称取[/size][size=12px]50 mg 蛋清溶菌酶标准品于50 mL 容量瓶中, 用约25 mL 磷酸盐缓冲液搅拌溶解并稀释[/size][size=12px]定容[/size][size=12px], 充分混匀(如果需要, 冷冻该溶液以备后续测定)。转移3 mL 上述标准制备溶液至100 mL容量[/size][size=12px]瓶中[/size][size=12px], 用磷酸盐缓冲液搅拌溶解并稀释定容。测定[/size][size=12px]取[/size][size=12px]3 份标准溶液和3 份试样溶液进行测定。[/size][size=12px]25 ℃ 室温下, 将1 cm 比色皿放入分光光度计, 用磷酸盐缓冲液调整吸光度零点。 吸2.9 mL 底物[/size][size=12px]溶液于比色皿[/size][size=12px], 最初450 nm 处吸光度应为0.70±0.10,3 min 之内初始吸光度值变化应小于或等于0.003 时, 方可开始测定。 吸取0.1 mL 标准溶液加入底物溶液, 充分混合。 记录3 min 吸光度值的变[/size][size=12px]化[/size][size=12px], 每15s 记录一次吸光度值。 每分钟吸光度值变化应在0.03~0.08, 若不在要求范围需调整试样溶液[/size][size=12px]的浓度。[/size][size=12px] 重复操作测定试样溶液。[/size][size=12px]反应[/size][size=12px]1 min 后稳定, 计算时忽略最初1 min 的读数。[/size][size=12px]结果计算[/size][size=12px]酶活力[/size][size=12px] X , 按式计算:[/size][align=center][size=12px]X =(A[/size][font='宋体'][size=12px]1[/size][/font][size=12px] -A[/size][font='宋体'][size=12px]2[/size][/font][size=12px])[/size][size=12px]/([/size][size=12px]2 × m ×0.001[/size][size=12px])[/size][/align][size=12px]式中[/size][size=12px]:[/size][size=12px]A1 ———[/size][size=12px]试样在[/size][size=12px]450 nm [/size][size=12px]处反应[/size][size=12px]1 min [/size][size=12px]时的吸光度[/size][size=12px] [/size][size=12px]A2 ———[/size][size=12px]试样在[/size][size=12px]450 nm [/size][size=12px]处反应[/size][size=12px]3 min [/size][size=12px]时的吸光度[/size][size=12px] [/size][size=12px]m ———用于分析的试样制备溶液中的溶菌酶质量, 单位为毫克(mg) [/size][size=12px]2 ———获得1 min 和3 min 吸光度读数所用的时间, 单位为分钟(min) [/size][size=12px]0.001———由单位溶菌酶每分钟引起的吸光度降低的值。[/size][size=12px]试验结果以平行测定结果的算术平均值为准。[/size][size=12px] 在重复性条件下获得的两次独立测定结果的绝对差[/size][size=12px]值不大于算术平均值的[/size][size=12px]10%。[/size][size=12px]最终对于溶菌酶的检测要求罗列如下:[/size][img]https://ng1.17img.cn/bbsfiles/images/2021/08/202108081546089787_7027_1608728_3.png[/img][align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/08/202108081546090379_7253_1608728_3.png[/img][/align][align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/08/202108081546091326_4621_1608728_3.png[/img][/align][size=12px]注:本标准适用于以鸡蛋清为原料[/size][size=12px], 经提取、精制等工艺制得的食品添加剂溶菌酶。[/size][size=12px]溶菌酶作为一种天然球状蛋白质,[/size][size=12px] 能促进营养物质被人[/size][size=12px]体消化吸收,[/size][size=12px] 对人体无毒性, 也不会在体内残留, 是一种安[/size][size=12px]全性很高的食品保鲜剂、[/size][size=12px] 营养保健品和药品。 由于每一类型[/size][size=12px]的溶菌酶都有其最适的作用条件,[/size][size=12px] 而且底物特异性强, 因[/size][size=12px]此,[/size][size=12px] 在应用溶菌酶时, 必需注意以下几个事项: ①充分掌握[/size][size=12px]溶菌酶的酶学特性,[/size][size=12px] 掌握食品中的营养成分、 pH 值、 食盐[/size][size=12px]浓度等影响溶菌酶效果的因素以及造成某种食品腐败的主要微生物群体,[/size][size=12px] 采用适当的添加量和添加方法才能收到应有的[/size][size=12px]防腐效果。[/size][size=12px] ②为了有效的发挥溶菌酶作用效力, 可以考虑与[/size][size=12px]其它物质配伍使用。[/size][size=12px] 如将溶菌酶与甘氨酸混合使用, 其防腐[/size][size=12px]效果则远远高于单独使用溶菌酶。[/size][size=12px] 因为甘氨酸含量达到一定[/size][size=12px]程度时,[/size][size=12px] 能抑制微生物细胞壁的合成, 这种作用对革兰氏阳[/size][size=12px]性菌和阴性菌均有效,[/size][size=12px] 从而增了溶菌酶效力的发挥。 也可[/size][size=12px]以考虑与植酸、[/size][size=12px] 聚合磷酸盐等配伍使用, 以增强溶菌酶革兰[/size][size=12px]氏阴性细菌的抑菌作用。[/size][size=12px] 不管与哪种物质配伍使用, 使用之[/size][size=12px]前都要进行小试。[/size][size=12px]参考文献:[/size][font='宋体'][size=14px][1] [/size][/font][font='宋体'][size=12px]GB 1886.257-2016,食品安全国家标准 食品添加剂 溶菌酶[s].[/s][/size][/font][font='宋体'][size=14px][2] [/size][/font][font='宋体'][size=12px]范林林[/size][/font][font='宋体'][size=12px], 林楠, 冯叙桥,等. 溶菌酶及其在食品工业中的应用[J]. 食品与发酵工业, 2015, 41(003):248-253.[/size][/font][font='宋体'][size=14px][3] [/size][/font][font='宋体'][size=12px]冯棋琴[/size][/font][font='宋体'][size=12px], 周立梅, 高文功,等. 溶菌酶在食品工业中的研究进展[J]. 食品研究与开发, 2015, 000(005):134-136[/size][/font][font='宋体'][size=14px][4] [/size][/font][font='宋体'][size=12px]张新宝[/size][/font][font='宋体'][size=12px], 陈红兵. 溶菌酶的性质及其在食品防腐中的应用[J]. 江西食品工业, 2008(4):42-45[/size][/font]
[color=#444444]实验需要定量牛血清白蛋白(BSA)和溶菌酶(LYZ)混合溶液中各自的含量是多少,用的是安捷伦1260高效液相,色谱柱C-18,25cm,300A,流动相A 0.1%三氟乙酸水溶液。流动相B 0.1%三氟乙酸乙腈溶液,但是怎么走梯度都分不开啊,总是在间隔不到1分中出峰。求大神指点[/color]
关于批准溶菌酶等物质为食品添加剂及部分食品添加剂和营养强化剂扩大使用范围、用量的公告(2010年 第23号)中华人民共和国卫生部 www.moh.gov.cn 2011-01-05 17:17:58 根据《中华人民共和国食品安全法》和《食品添加剂新品种管理办法》的规定,经审核,现批准溶菌酶等8种物质为食品添加剂,批准环己基氨基磺酸钠等22种食品添加剂和叶酸等3种营养强化剂扩大使用范围及用量。特此公告。附件: 1. 溶菌酶等8种食品添加剂.doc 2.环己基氨基磺酸钠等22种扩大使用范围、用量的食品添加剂.doc 3.叶酸等3种扩大使用范围、用量的食品营养强化剂.doc 二○一○年十二月三十一日
关于批准溶菌酶等物质为食品添加剂及部分食品添加剂和营养强化剂扩大使用范围、用量的公告(2010年 第23号).pdf
不知道各位现在使用的是什么方法检测大肠总大肠菌群、粪大肠菌群(耐热大肠菌群)及大肠埃希氏菌,还是传统的多管发酵还是滤膜法呢,下面我为大家推荐一种新的方法——酶底物法。水质大肠菌群酶底物法检测系统:由LK-2014程控定量封口机、51或97孔定量检测盘、100mL定量瓶、酶底物检测试剂四部分组成。检测水样范围:饮用水、源水、瓶装水、中水、二次供水、管网水、废水、食品水、畜牧用水、医疗用水等。该检测方法采用大肠杆菌产生β-半乳糖苷酶分解色源底物-ONPG(Ortho-nitrophenyl-β-D-galactopyranoside) 使培养液呈黄色。大肠埃希氏菌产生β-葡萄糖醛酸酶(β-glucuronidase)分解MUG(4 - methyl-umbelliferyl-β-glucuronide)使培养液在波长366 nm 紫外光下产生荧光的原理,来定性定量水中总大肠菌群、粪大肠菌群(耐热大肠菌群)及大肠埃希氏菌。序号指标名称技术指标1名称程控定量封口机2用途用于GB5750-2006酶底物法检测水质总大肠菌群、大肠埃希氏菌,粪大肠菌群3可靠性无漏液,无破孔4稳定性可检测40,000个样品以上,使用寿命大于5年5方便性开/关及退格键有定量数显窗口,有保洁窗口6快捷性无需无菌室,24h检测水中总大肠菌群\大肠埃希氏菌\耐热大肠菌群7重量≤16kg8尺寸39cm 长 X 27cm 宽 X 30cm 高9预热时间≤14min10噪音50dba11外罩温度40oC12封口速度 13工作电压AC 220V±10%,50HZ14封口速度51孔、97孔定量检测盘封口时间≤12秒/个15工作环境温度-10oC-50oC16检测范围配合51孔定量检测盘检测范围0-200MPN/100ml(水样不稀释)配合97孔定量检测盘检测范围0-2419MPN/100ml(水样不稀释) 该检测方法是国际上发达国家普遍采用的检测方法,相比我国标准的检测方法,如多管发酵及滤膜法具简便快捷,其选择性培养基具有抑制杂菌的作用,假阳性低,定量准确。由于该方法的方便快速,在实验室日常检测中能提高效率,缩短检测时间,在应急监测中能及时报出数据,避免造成大的公共安全事故。
小编为你解忧,采用酶底物法对地表水水样进行不同倍数的稀释后进行培养检测,观察地表水结果变化。结果表明:地表水水样稀释倍数越小,结果越准确。采用酶底物法测定地表水中的粪大肠菌群具有快速、简便的特点,准确掌握水样稀释倍数对测定结果就越准确。【工作原理】加入含有总大肠菌群细菌的水样,放入程控定量封口机中,目标细菌在Minimal Medium ONPG-MUG培养基中36℃培养,总大肠菌群细菌产生的特异性生物酶β一半乳糖苷酶能分解MinimalMedium ONPG-MUG培养基中的色源底物ONPG,使培养呈现黄色;同时水样中大肠埃希氏菌产生特异性的β一葡萄糖醛酸酶分解Minimal Medium ONPG-MUG培养基中的荧光底物MUG,产生特征性荧光。同样原理,耐热大肠菌群(粪大肠菌群)在44.5℃培养时会分解Minimal Medium ONPG-MUG培养基中的色源底物ONPG,使培养基呈现黄色。程控定量封口机9900Z SEALER PLUS:智能程控定量封口机配合51孔定量盘或97孔定量盘提供简单、快速、准确的定量检测总大肠菌群、大肠埃希氏菌、粪(耐热)大肠菌群、肠球菌和绿脓假单胞菌的实验方案。捷骋牌51孔定量盘和97孔定量盘是基于传统方法最大可能数 (MPN) 统计模型而设计的半自动定量方法。· 通过9900Z sealer PLUS程控定量封口机自动将样品/试剂混合液分配到独立孔中。· 培养结束后,阳性孔数可以转化为 MPN 值。· 51孔定量盘可检测每 100 mL 水样中 1-200MPN 值。· 97孔定量盘可检测每 100 mL 水样中1-2,419 MPN 值。· 整个检测过程手工操作时间小于 1 分钟。【使用方法】定性测试:第一步、在100ml水样中加入试剂,溶解,36℃培养24h;第二步、结果判读 无色=阴性 黄色=总大肠菌群阳性 黄色+荧光=大肠埃希氏菌群阳性注:耐热大肠群菌(粪大肠菌群)需44.5℃培养24h后,观察黄色为阳性定量检测第一步、在100ml水样中加入试剂,溶解;第二步、倒入51孔定量检测盘(定量孔板)或97孔定量检测盘(定量孔板)中;第三步、用程控定量封口机对定量检测盘(定量孔板)进行封装,36 ℃培养24h;第四步、51孔定量检测盘(定量孔板)结果判读: 无色=阴性 黄色格子=总大肠菌群阳性黄色+荧光格子=大肠埃希氏菌群阳性查对照MPN表计数注:耐热大肠群菌(粪大肠菌群)需44.5℃培养24h后,观察黄色格子为阳性结果,查对照MPN表计数。97孔定量检测盘(定量孔板)结果判读无色=阴性 黄色格子=总大肠菌群阳性黄色+荧光格子=大肠埃希氏菌群阳性查对照MPN表计数注:耐热大肠群菌(粪大肠菌群)需44.5℃培养24h后,观察黄色格子为阳性结果,查对照MPN表计数
有做过溶酶体贮积症[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]检测酶活的老师吗?最近在做这个实验,通过酶活反应将底物转化为产物,通过产物的量与酶的体积、反应时间等计算酶活。排查了不少因素,也仿照大量文献报道的酶反应剂都应用到实验中,而得到的酶活却与文献、NCBI上的阈值有一定出入,如果自己买到第三方校准品,自己根据自己的实验结果定正常人水平的酶活阈值可以吗?有哪些需要注意的吗?谢谢!
常用酶的配制 1.溶菌酶 用水配制成50mg/ml的溶菌酶溶液,分装成小份并保存于-20℃。每一小份一经使用后便予丢弃。 2.蛋白水解酶类 贮存液贮存温度反应浓度反应缓冲液温度预处理 0.01mol/L Tris(pH7.8) 链霉蛋白酶a20mg/ml-20℃(溶于水)1mg/ml0.01mol/L EDTA37℃自消化b 0.5% SDS 0.01mol/L Tris(pH7.8) 蛋白酶Kc20mg/ml-20℃(溶于水)50μg/ml0.005mol/L EDTA37~56℃无须预处理 0.5% SDS a:链霉蛋白酶是从链球菌(Streptomyces griseus)中分离到的一种丝氨酸
[font=宋体][size=18px]点击链接查看更多:[url]https://www.woyaoce.cn/service/info-18240.html[/url]抗菌涂料、抗菌漆膜、抗菌粘胶剂、防霉涂料,防霉剂[/size][/font][size=20px] [/size][table][tr][td=1,1,200][align=center][font=宋体][size=18px]检测项目[/size][/font][/align][/td][td=1,1,200][align=center][font=宋体][size=18px]检测依据[/size][/font][/align][/td][/tr][tr][td=1,2][align=center][size=18px]耐微生物性能[/size][/align][/td][td][align=center][font=Times, serif][size=18px]ASTM D 2574-2006[/size][/font][size=18px]容器中乳化漆耐微生物侵蚀的标准试验方法[/size][/align][/td][/tr][tr][td][align=center][font=Times, serif][size=18px] ASTM D 4783-2001[/size][/font][size=18px]([/size][font=Times, serif][size=18px]2013[/size][/font][size=18px])在容器内被细菌、酵母菌和霉菌浸染的粘胶剂制备耐受性的标准试验方法[/size][font=Times, serif][size=18px] [/size][/font][/align][/td][/tr][tr][td=1,2][align=center][size=18px]抗细菌性能[/size][/align][/td][td][align=center][font=Times, serif][size=18px]HG/T 3950-2007[/size][/font][size=18px]抗菌涂料[/size][font=Times, serif][size=18px] [/size][/font][size=18px]附录[/size][font=Times, serif][size=18px]A [/size][/font][size=18px]抗细菌性能试验方法[/size][/align][/td][/tr][tr][td][align=center][font=Times, serif][size=18px]GB/T 21866-2008[/size][/font][size=18px]抗菌涂料(漆膜)抗菌性测定法和抗菌效果[/size][/align][/td][/tr][tr][td=1,3][align=center][size=18px]抗霉菌性能[/size][/align][align=center][size=18px]耐霉菌试验[/size][/align][/td][td][align=center][font=Times, serif][size=18px]HG/T 3950-2007 [/size][/font][size=18px]抗菌涂料[/size][font=Times, serif][size=18px] [/size][/font][size=18px]附录[/size][font=Times, serif][size=18px]B [/size][/font][size=18px]抗霉菌性能试验方法[/size][/align][/td][/tr][tr][td][align=center][font=Times, serif][size=18px]QJ 990.14-1986 2[/size][/font][size=18px]涂层检验方法涂层耐霉菌检验方法[/size][/align][/td][/tr][tr][td][align=center][font=Times, serif][size=18px]GB/T 1741-2007 [/size][/font][size=18px]漆膜耐霉菌测定法[/size][/align][/td][/tr][tr][td][align=center][size=18px]无机抗菌剂抗菌性能[/size][/align][/td][td][align=center][font=Times, serif][size=18px]HG/T 3794-2005 6.2[/size][/font][size=18px]无机抗菌剂[/size][font=Times, serif][size=18px]-[/size][/font][size=18px]性能及评价[/size][/align][/td][/tr][tr][td][align=center][size=18px]含银抗菌溶液抗菌性能[/size][/align][/td][td][align=center][font=Times, serif][size=18px]HG/T 4317-2012 [/size][/font][size=18px]附录[/size][font=Times, serif][size=18px]A [/size][/font][size=18px]含银抗菌溶液[/size][/align][/td][/tr][tr][td][align=center][size=18px]防霉剂防霉效果[/size][/align][/td][td][align=center][font=Times, serif][size=18px]DA/T 26-2000 4[/size][/font][size=18px]挥发性档案防霉剂防霉效果测定方法[/size][/align][/td][/tr][/table]
[size=16px][font=宋体][color=black]点击链接查看更多:[url]https://www.woyaoce.cn/service/info-18240.html[/url]抗菌涂料、抗菌漆膜、抗菌粘胶剂、防霉涂料,防霉剂[/color][/font][/size][table][tr][td=1,1,200][align=center][font=宋体][size=16px]检测项目[/size][/font][/align][/td][td=1,1,200][align=center][font=宋体][size=16px]检测依据[/size][/font][/align][/td][/tr][tr][td=1,2][align=center][size=16px]耐微生物性能[/size][/align][/td][td][align=center][size=16px][font=Times, serif]ASTM D 2574-2006[/font]容器中乳化漆耐微生物侵蚀的标准试验方法[/size][/align][/td][/tr][tr][td][align=center][size=16px][font=Times, serif] ASTM D 4783-2001[/font]([font=Times, serif]2013[/font])在容器内被细菌、酵母菌和霉菌浸染的粘胶剂制备耐受性的标准试验方法[font=Times, serif] [/font][/size][/align][/td][/tr][tr][td=1,2][align=center][size=16px]抗细菌性能[/size][/align][/td][td][align=center][size=16px][font=Times, serif]HG/T 3950-2007[/font]抗菌涂料[font=Times, serif] [/font]附录[font=Times, serif]A [/font]抗细菌性能试验方法[/size][/align][/td][/tr][tr][td][align=center][size=16px][font=Times, serif]GB/T 21866-2008[/font]抗菌涂料(漆膜)抗菌性测定法和抗菌效果[/size][/align][/td][/tr][tr][td=1,3][align=center][size=16px]抗霉菌性能[/size][/align][align=center][size=16px]耐霉菌试验[/size][/align][/td][td][align=center][size=16px][font=Times, serif]HG/T 3950-2007 [/font]抗菌涂料[font=Times, serif] [/font]附录[font=Times, serif]B [/font]抗霉菌性能试验方法[/size][/align][/td][/tr][tr][td][align=center][size=16px][font=Times, serif]QJ 990.14-1986 2[/font]涂层检验方法涂层耐霉菌检验方法[/size][/align][/td][/tr][tr][td][align=center][size=16px][font=Times, serif]GB/T 1741-2007 [/font]漆膜耐霉菌测定法[/size][/align][/td][/tr][tr][td][align=center][size=16px]无机抗菌剂抗菌性能[/size][/align][/td][td][align=center][size=16px][font=Times, serif]HG/T 3794-2005 6.2[/font]无机抗菌剂[font=Times, serif]-[/font]性能及评价[/size][/align][/td][/tr][tr][td][align=center][size=16px]含银抗菌溶液抗菌性能[/size][/align][/td][td][align=center][size=16px][font=Times, serif]HG/T 4317-2012 [/font]附录[font=Times, serif]A [/font]含银抗菌溶液[/size][/align][/td][/tr][tr][td][align=center][size=16px]防霉剂防霉效果[/size][/align][/td][td][align=center][size=16px][font=Times, serif]DA/T 26-2000 4[/font]挥发性档案防霉剂防霉效果测定方法[/size][/align][/td][/tr][/table]
请问各位老师污水中的溶解性镁、总镁,还有高温残留物(600度)都怎么检测啊?
如果靶基因亚克隆在含有T7启动子的表达载体(如质粒载体pET-22b和pET-15b等)上,那么重组质粒应转化入λDE3溶源菌菌株 中,以进行靶基因的表达。 (一) 溶菌酶-DNase I-反复冻融裂解菌体法1. 单菌落接入4ml LB培养液中,过夜培养。再以1:20转接至2管4 ml LB培养液中,当OD600为0.6-0.8时,一管加IPTG诱导,另一管不加IPTG作对照。2. 离心收集菌体,每管加Binding buffer 100 μl,DNase I (2,000 u/ml) 10 μl,溶菌酶 (2 mg/ml) 5 μl。菌体充分悬浮后,在-20℃放置20分钟,室温融化,如此反复冻融8-10次。3. 吸取20 μl加入一洁净的EP管中,12,000 rpm离心10分钟,上清和沉淀分别进行SDS-PAGE电泳,以判断靶蛋白质主要以溶解形式还是以包涵体形式存在。 (二) 超声波裂解菌体法1. 单菌落接入4 ml LB培养液中,过夜培养。其中2 ml过夜培养物用于菌种保存和DNA测序,另
有“退菌特和福美胂"的检测方法和标准吗?
各位大哥、大姐:谁有简易灵敏度高的方法请告知小弟,不甚感激!!!

今天收到客户一个实验,检测奥美拉唑镁肠溶片,溶出度实验,样品中有一个杂质未分开,希望安排售前实验,进行色谱柱的筛选。以辛烷基硅烷键和硅胶为填充剂,流动相是0.01M磷酸氢二钠(磷酸调pH=7.6)-乙腈=75:25,波长302nm,要求奥美拉唑峰与杂质I分离度大于2.0.下面是客户做的结果,实验室色谱柱筛选工作正在进行中……http://ng1.17img.cn/bbsfiles/images/2016/03/201603071349_586166_1987954_3.png
随着对癌症相关研究的深入,化学治疗、靶向治疗、免疫治疗等治疗手段不断推陈出新,癌症治疗水平得到了长足的进步。而癌症患者的精准治疗离不开分子生物学及诊断技术的发展,液态活检作为新兴的检测技术在肺癌临床中的应用日趋成熟。而尿液检测是临床最常见的检测项目之一,不仅可以反映肾脏、肝脏、泌尿系统、内分泌系统等疾病状况,也可间接反映全身代谢性及循环等系统的功能。在生物医学研究中,蛋白质组学被广泛应用于生物标志物(Biomarkers)的发现和鉴定。随着技术的发展,尿液蛋白质组学分析成为备受关注的生物标志物发现研究领域之一。一方面,尿液中含有由肾脏滤过的血浆蛋白质以及由泌尿系统分泌的蛋白质,通过分析尿液中的蛋白质组成,可以了解人体健康状况和疾病状态的变化。另一方面,更重要的是,与变化较为稳定的血液蛋白组相比,尿液蛋白组能够更早期、更敏感地反映身体内由于疾病而产生的变化。再加上尿液作为一种无创可得的样本,使得尿液成为疾病诊断,尤其是早期检测的生物标志物的理想样本之一。[color=#0070c0][b]因此,尿液也被誉为寻找生物标志物的“金矿”,挖掘这个潜在金矿可能会极大地加快精准医疗的发展。[/b][/color][align=center][img]https://img1.17img.cn/17img/images/202401/uepic/73ad66a9-8eec-4eff-be45-3c455d562e13.jpg[/img][/align][align=center]图源:PanGIA[/align]总部位于美国的生物技术公司PanGIA即将完成一个为期三年的关于前列腺癌液体活检的临床研究。同时,PanGIA公司计划启动额外的临床研究,目标是实现各种癌症类型的早期检测,所有这些研究都将由PanGIA液体活检平台提供支持。[b][color=#0070c0]PanGIA液体活检平台是什么?[/color][/b]PanGIA 是一种基于尿液的非侵入性机器学习驱动的生物分子特征液体活检平台,目前该领域还存在很大的空白。这项创新技术[b][color=#0070c0]融合了人工智能(AI)和基于尿液的液体活检技术[/color][/b],旨在[color=#0070c0][b]对癌症进行早期诊断、监测和管[/b][/color]理,从而有可能挽救无数生命。通过在全球范围内提高癌症诊断的可用性和可扩展性,[b][color=#0070c0]PanGIA液体活检平台有望改变癌症检测和治疗方式。[/color][/b]这项研究最初在2020年获得IRB(伦理审查委员会)批准并开始,招募了在美国各地进行前列腺活检的泌尿科医生。虽然研究结果尚未公布,但结果的高灵敏度和特异性催生了PanGIA生物技术公司计划进行进一步研究。[align=center][img]https://img1.17img.cn/17img/images/202401/uepic/487d7def-9056-4234-9d31-3f39293871af.jpg[/img][/align]该公司现在正在准备在另外10种癌症类型上开展后续研究。这些包括乳腺癌、卵巢癌、肺癌、肾癌、膀胱癌、结肠直肠癌、胃癌、胰腺癌、肝癌和脑癌。该公司目前正在全美范围寻找医学专业人员建立临床研究点,并将在ClinicalTrials.gov网站上列出研究结果。这项扩大的研究预计将在2024年年中启动。PanGIA公司的方法结合了分子生物学、计算生物学和机器学习的细微差别。这种结合有助于检测与疾病相关的模式,重点是对一系列疾病的非侵入性检测,这种方法的主要重点是各种癌症的早期第一阶段检测。【1】 BNN Breaking [url]https://bnnbreaking.com/breaking-news/health/pangia-biotech-to-extend-cancer-detection-studies-with-proprietary-liquid-biopsy-platform/[/url][来源:仪器信息网译] 未经授权不得转载[align=right][/align]
90年代初,复旦大学生命科学学院在世界著名生物学家谈家桢院士的领导下,发展生物工程,经十年潜心努力,研制成功了一种具有抗菌、溶菌、抗感染,修复组织,提高机体免疫力等功能的纯天然生物酶,以复旦(Fudan)和酶(Enzyme)英文的首个字母命名为“FE”。 科研人员又应用FE技术针对口腔溃疡,牙龈出血,牙本质敏感,刷牙作呕等口腔问题,攻克了多项技术难题,延伸研发成功“FE生物酶牙膏”。面市的不同款式的FE牙膏标注着2.5-9.8不等的“酶指数”,表示其生物酶含量的高低,“酶指数”越高即活性含量越高,效果越好,价格也就越高。 2009年9月16日 人民网等发布的《改变传统牙膏概念 中国首款“干刷牙膏”面世》称,FE牙膏通过临床验证,对400多种细菌具有抑杀作用。FE牙膏是不含氟的纯天然生物产品,无任何副作用。 2009年9月23日 新华网等发布的《刷牙牙膏不蘸水?“FE”干刷牙膏通过医学鉴定》称,FE牙膏具有抗菌、抗牙结石、防龋、减轻口臭、抑制牙菌斑、显著改善牙龈出血,减轻牙龈炎等功效,值得推广。口腔内不洁物多为蛋白质,很容易被FE牙膏溶解,拥有自主知识产权,技术处于世界领先地位,被誉为天然的“金典牙医”。 据了解,FE生物酶牙膏由“生物溶菌酶”和“生物蛋白酶”等多种生物酶应用现代科技配伍而成,美国一家著名的跨国公司曾以重金要求购买FE牙膏的生产技术,但这是我国的高科技产品,婉言谢绝了美国公司的要求。 FE牙膏投放市场后为消费者口腔健康提供了新的选择。
附件牛乳中非法添加β-内酰胺酶检测方法随着国家对食品安全问题的关注和部分乳制品企业2010年无抗奶目标的提出,抗生素残留问题成为影响乳制品安全的重要因素之一。目前,青霉素作为β- 内酰胺类药物是治疗牛乳腺炎的首选药物,是牛奶中最常见的残留抗生素。由于国内多数乳品企业对抗生素残留超标的牛乳采取降价收购的原则,出于经济利益的驱动,一些不法奶站为了谋求自己的经济利益,人为的使用一些生物制剂去降解牛乳中残留的抗生素,生产人造“无抗奶”。2005年至今,已有数家公司公开宣称出售分解牛乳中残留抗生素的解抗剂。迄今为止,还没有针对这种人造“无抗奶”的相应检测方法、检测标准,无法从源头上监测、把控原奶质量。奶制品中三聚氰胺问题出现后,检科院按照国家局科技司的安排,对奶制品中可能的添加物进行了调查。经过前期的调研工作,初步判断市售解抗剂的主要成分是β-内酰胺酶,它是由革兰氏阳性细菌产生和分泌的,可选择性分解牛奶中残留的β- 内酰胺类抗生素。β-内酰胺酶为我国不允许使用的食品添加剂,该酶的使用掩盖了牛奶中实际含有的抗生素。β-内酰胺酶能够使青霉素内酰胺结构破坏而失去活性,导致青霉素、头孢菌素等抗生素类药物耐药性增高,从而大大降低了人们抵抗传染病的能力,给消费者的身体健康带来危害。微生物方法和理化方法均利用β-内酰胺酶能够裂解青霉素的β-内酰胺环形成青霉噻唑酸的原理检测乳制品中是否添加解抗剂。一、理化方法(一)高效液相色谱法1、间接法方法原理:利用β-内酰胺酶能够酶解青霉素的原理,向牛奶中添加一定量的青霉素,如果牛奶中存在一定浓度的β-内酰胺酶,那么青霉素经β-内酰胺酶酶解后浓度会减少,从而判断牛奶中是否存在β-内酰胺酶。实验步骤:称取20 g试样,在4℃、16000rpm条件下离心10 min。取下层清液10 g于50 mL塑料离心管,并将塑料离心管置于37℃水浴锅中振荡孵育30 min。向孵育后的离心管中加入无水乙醇15 mL。振荡提取30 min后离心,将上层清液过滤纸后收集于梨形瓶中。减压浓缩蒸发掉乙醇。向旋蒸后的梨形瓶中加入10 mL磷酸盐缓冲液(pH=8.5),涡旋1 min后调节pH为8.5。以1 mL/min的速度将提取液通过经过预处理的Oasis HLB固相萃取柱,用2 mL磷酸缓冲液(pH=8.5)淋洗萃取柱,再用2 mL水淋洗。最后用3 mL乙腈洗脱。将洗脱液在40℃下氮气吹干,用0.025 M磷酸盐缓冲液(pH=7.0)定容残渣至1 mL,待上机测定。色谱条件:色谱柱 Agilent Zorbax SB C18,4.6mm×150mm×5μm;流动相 甲醇/0.004 M磷酸二氢钾(pH=4.5)=40/60;检测波长 268 nm讨论:该方法只能给出定性结论即牛奶中是否含有β-内酰胺酶,而无法给出确切定量结果即牛奶中含有β-内酰胺酶的量(U/ml);前处理方法相对复杂、费时。2、直接法方法原理:牛乳中的青霉素钾在β-内酰胺酶的作用下,主要生成青霉噻唑酸钾,并伴随生成少量的青霉胺、青霉醛等物质。经去脂肪、蛋白等前处理后,可以将青霉噻唑酸钾提取出来,经高效液相色谱仪检测确认其是否存在,从而判定该牛乳是否为人造“无抗奶”。实验步骤:称取20 g试样,在4 ℃、16000 rpm条件下离心10 min。取下层清液10 g于50 mL塑料离心管,加入无水乙醇15 mL,振荡提取30 min后离心,取清液经0.45 μm的滤膜过滤,用高效液相色谱仪检测。标准溶液配制:称取0.01 g(精确至0.001 g)青霉素钾于100 ml容量瓶中,加入1ml市售抗生素分解剂,室温放置2h使青霉素钾酶解完全后用去离子水定容,得到青霉噻唑酸钾标准溶液,浓度100 μg/mL。根据实际情况稀释后使用。色谱条件:色谱柱 Agilent Zorbax SB C18,4.6mm×150mm×5μm;流动相 甲醇/0.004 M磷酸二氢钾(pH=4.5)=40/60;检测波长 230 nm讨论:该方法通过检测酶解产物青霉噻唑酸,只能给出定性结论即牛奶中是否含有β-内酰胺酶,而无法给出确切定量结果即牛奶中含有β-内酰胺酶的量(U/ml);青霉噻唑酸钾稳定性尚需进一步考察;实验成本较生物学方法高。
如题, 有做金葡菌 肠毒素监测的没,分享下子,最近想开展这个实验来着。
哪位大侠能赐教一下蔬菜中三氯杀螨醇、咯菌腈、抑霉唑、灭多威、嘧菌胺的检测方法,不胜感激!!
水溶性肥料中中量元素钙镁硫的检测各位是用哪个标准?是用EDTA滴定么说下注意点
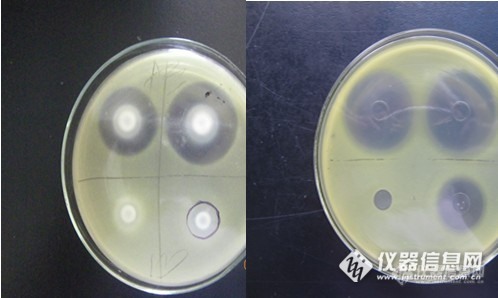
先和大家唠唠青霉素酶的主要来源:奶牛每到换季容易发作乳腺炎等疾病,往往通过注射抗生素进行治疗。凡经治疗过的乳牛,其牛奶在一定时期内残存着青霉素,而在原奶收购检测时,抗生素超标会拒收,奶户为了私利会人为添加青霉素分解酶。别小看这东东,个人认为危害大着呢:1.青霉素酶的安全性以及是否可以在食品中添加尚未有定论。2.在分解青霉素后,可能引进其他有害物质。3.这种做法纵容了奶牛饲养过程中抗生素的滥用。(这三条都个人主义的看法 仅供参考)一.杯碟法检测原理:采用对青霉素类药物绝对敏感的标准菌株,利用舒巴坦特性抑制β-内酰胺酶的活性,并加入青霉素作对照,通过比对加入β-内酰胺酶抑制剂与未加抑制剂的样品所产生的抑菌圈的大小来间接测定样品是否含有β-内酰胺酶类药物。二.实验试剂与材料1 菌种:藤黄微球菌,对青霉素较敏感,有青霉素存在时藤黄微球菌不会生长繁殖(如图)http://ng1.17img.cn/bbsfiles/images/2014/03/201403081621_492377_2227357_3.jpg2 试剂及药品1)磷酸盐缓冲液(配药):取8g磷酸二氢钾和2g磷酸氢二钾,用1000ml溶解,121℃高压灭菌15min。2)舒巴坦标准储备溶液:将舒巴坦标准品用磷酸盐缓冲液溶解并定容为10mg/ml。4℃保存,可使用一周。3)舒巴坦标准工作溶液:吸取100ul舒巴坦标准储备溶液到1ml离心管中,用磷酸盐缓冲液定容,配置成浓度为1mg/ml。4)青霉素标准储备溶液:用磷酸盐缓冲液将青霉素溶解并定容为10mg/ml, 4℃棕色瓶中保存。使用时间根据实验情况而定。5)青霉素标准工作溶液:吸取10ul青霉素标准储备溶液于1ml离心管中,用磷酸盐缓冲液稀释,配置成浓度为0.1mg/ml ,4℃保存,可使用一周。6)生理盐水:称取8.5g氯化钠溶于1000ml蒸馏水中, 121 ℃高压灭菌15min。7)B-内酰胺酶标准储备溶液和工作溶液:方法要求16000U/ML(依据实际检验情况定浓度),目前用的是8千单位。如购买的青霉素酶的单位有IU/L,U/L,单位/ML,它们的换算关系是:1IU/L=609U/L=0.609单位/ML.8)无菌水:121℃高压灭菌15min。9)抗生素1号培养基,营养培养基。注:于配制药品的容器如不能高压灭菌,需用75%的酒精进行2-3次的消毒,再用所使用的无菌溶剂(生理盐水和磷酸盐缓冲液)进行2-3次的润洗后再进行药品的配制.3 主要实验器材http://ng1.17img.cn/bbsfiles/images/2014/03/201403081629_492378_2227357_3.jpg三.实验步骤1.试样处理:把离心管放入微孔中,标记为A、B、C、D,取试样1000ul分别放入A、B、C、D四个1.5ml离心管中,每个样品做三个平行,共12管。同时每次检验应取纯水1ml加入到1.5ml离心管中做对照。如样品为乳粉,则将乳粉按1:10的比例稀释,如样品是酸性乳制品,应调节PH值至6-7后,按顺序加入以下药品后混匀。http://ng1.17img.cn/bbsfiles/images/2014/03/201403081633_492379_2227357_3.jpgA: 5ul青霉素标准工作溶液。B: 25ul舒巴坦标准工作液+ 5ul青霉素标准工作溶液。 C: 25ul β-内酰胺酶标准工作液+ 5ul青霉素标准工作溶液 。D: 25ul β-内酰胺酶标准工作液+ 5ul青霉素标准工作溶液+25ul舒巴坦标准工作液。2.菌悬液的制备1)菌种的制备:将营养琼脂培养基分装到试管中做成斜面,用接种环挑取适量藤黄微球菌在斜面上划线,36 ℃培养22-24h。2)菌悬液的制备:用2ml生理盐水将经过斜面培养的藤黄微球菌洗下,混合均匀,然后将菌悬液以大约2%的比例加入到营养琼脂培养基中。3.检定用平板的制备1) 在无菌培养皿中注入抗生素1号培养基10ml,作为基层培养基,水平静置,待其自然凝固后将皿盖盖好备用.2)2.将灭菌的营养琼脂培养基溶化后在水浴锅中冷却至55℃左右,加入适量的菌悬液,混匀,移取5ml含有浓度为1*108CFU/ml注入铺有基层培养基的培养皿中,均匀摊开,凝固。加入菌悬液的量以能产生17-27mm的抑菌圈为宜。http://ng1.17img.cn/bbsfiles/images/2014/03/201403081639_492380_2227357_3.jpg3).凝固后将皿倒置,用笔在皿上画十字线,将皿平分四份,并标记样品的序列号,与原始记录对应。http://ng1.17img.cn/bbsfiles/images/2014/03/201403081641_492381_2227357_3.jpg4).然后再把皿反转,在每个培养基表面均匀对称放置4个牛津杯。检定平板应为同一批次。放置牛津杯时,必须均匀对称的放置,以免各自产生的抑菌圈有交叉现象。http://ng1.17img.cn/bbsfiles/images/2014/03/201403081642_492382_2227357_3.jpg4. 试样测定 1). 取ABCD四个离心管中的试液各200ul,分别加入到检定平板的四个牛津杯中,每组试验做3 -4个平行样。http://ng1.17img.cn/bbsfiles/images/2014/03/201403081644_492383_2227357_3.jpg2)培养结束后去除牛津杯用游标卡尺精确测量ABCD四个试液的抑菌圈直径。http://ng1.17img.cn/bbsfiles/images/2014/03/201403081646_492384_2227357_3.jpg四.结果判定取ABCD抑菌圈直径的平均值,纯水空白结果应为A、B、D、均产生抑菌圈;A的抑菌圈与B的抑菌圈相比,差异在3mm以内(含3mm),C的抑菌圈小于D的抑菌圈差异在3mm以上(含3mm),且重复性良好。如此结果则系统成立,可对结果进行如下判定。样品结果B和D均产生抑菌圈,且D-C抑菌圈在以上3mm(含3mm)时,可以判定样品中A和B的抑菌圈差异小于3mm ,且重复性良好的青霉素酶结果为阴性;样品中A和B的抑菌圈差异大于3mm (含3mm) ,且重复性良好的青霉素酶结果为阳性;纯水空白对照品系统成立的情况下,为判定样品结果的前提条件。如果A和B均不产生抑菌圈,
求土壤可溶性钾钠钙镁检测方法,得有检测的方法依据
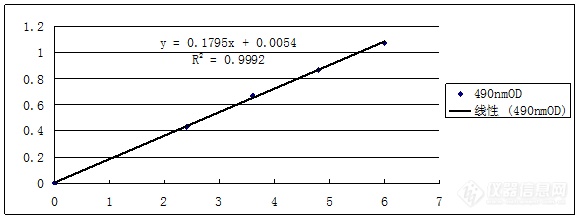
[align=center]几种酶的酶活力检测方法及结果分析[/align][align=center]西安国联质量检测技术股份有限公司[/align][align=center]安评中心:王涛[/align]大蒜属百合科葱属植物蒜的鳞茎,其风味独特,营养丰富,用途十分广泛。在生产上,大蒜不能通过杂交制种,只能采用其鳞茎繁殖,由于长时间的营养繁殖造成植株体内病毒积累,使得蒜头变小,品种退化,产量降低,大大降低了大蒜的商品价值。大蒜在长期的生长过程中,由于受到病原菌的植物的附着与侵入,会产生自身的抗性机制,其中的保护性反应是复杂的新陈代谢的结果,其生理反应是通过酶催化活动来实现的。这些酶包括抗病性酶超氧岐化酶SOD,多酚氧化酶PPO和过氧化物酶POD等,以及感病性酶纤维素酶和果胶酶。本文主要描述了大蒜苗中的SOD,PPO,POD,纤维素酶和果胶酶的酶活力检测方法,并从酶活的角度分析,大蒜茎尖脱毒技术可以有效提高SOD,PPO,POD等与植物抗病性有关的酶的活性,而与植物感病性有关的酶的活性如纤维素酶和果胶酶的活性有所降低,其中脱毒苗中的SOD,PPO和POD的活性分别比未脱毒苗相应地高出93.37 U/g,19.48 U/gmin和382.55 U/gmin,纤维素酶和果胶酶的活性则分别低出18.29 U/gmin和38.08 U/gmin。这就从植物生理的角度上验证了脱毒大蒜苗抗病和高产的原因。[b]1实验药品及仪器1.1缓冲液的配置[/b]1.1.1磷酸缓冲液的配置首先分别配置母液A、B,再根据质量分数分别取对应的母液,调pH即可。母液A:0.2 mol/L Na[sub]2[/sub]HPO[sub]4[/sub]溶液:称量71.63 g Na[sub]2[/sub]HPO[sub]4[/sub]12H[sub]2[/sub]O,定容至1 L。母液B:0.2 mol/L NaH[sub]2[/sub]PO[sub]4[/sub]溶液:称量31.21 g NaH[sub]2[/sub]PO[sub]4[/sub]2H[sub]2[/sub]O,定容至1 L。0.05 mol/L磷酸缓冲液(pH7.8,内含1%PVP):22.875 mL A +2.125 mL l B+1 g聚乙烯吡咯烷酮(PVP),稀释至100 mL。0.05 mol/L磷酸缓冲液(pH6.0):3.075 mL A + 21.925 mL B,稀释至100 mL。0.1 mol/L磷酸缓冲液(pH6.0):12.3 mL A + 87.7 mL B,稀释至200 mL。1.1.2醋酸缓冲液的配置同磷酸缓冲液一样,先配置母液。母液A:0.2 mol/L HAc溶液:吸取11.5 mL 醋酸溶液,定容至1 L。母液B:0.2 mol/L NaAc溶液:称量27.2 g 三水合乙酸钠,定容至1 L。0.2 mol/L (pH4.6) 醋酸缓冲液:51 mL A + 49 mL B混合均匀即可。0.2 mol/L(pH4.8)醋酸缓冲液:40 mL A + 60 mL B混合均匀即可。1.1.3其他试剂的配置100 umol/L EDTA-Na[sub]2[/sub]溶液:称取0.03721 g EDTA-Na[sub]2[/sub],用磷酸缓冲液定容至1 L。20 umol/L核黄素:称取0.00753 g核黄素定容至1 L。130 mmol/L甲硫氨酸(Met):称取1.9399 gMet,用磷酸缓冲液定容至100mL。750 umol/L氮蓝四唑(NBT):称取0.06133 g NBT,用磷酸缓冲液定容至100 mL。0.1 mol/L邻苯二酚:称取1.1011 g邻苯二酚定容至100 mL。20%三氯乙酸(TCA):称取20 g TCA定容至100 mL。二氧甲基酚即愈创木酚30%H[sub]2[/sub]O[sub]2 [/sub]3,5-二硝基水杨酸显色剂(DNS显色剂):称取2.5 g DNS溶于水中,加入2.5 g氢氧化钠、50 g酒石酸钾钠和100 mL水,加热溶解后再加入0.5 g苯酚和0.125 g无水亚硫酸钠,待全部溶解后冷却,定容至500 mL,贮于棕色瓶中,放置一周后使用,用之前过滤[sup][/sup]。葡萄糖标准液:称取0.54 g葡萄糖定容至500 mL。纤维素底物(CMC):称取0.625 g羧甲基纤维素钠溶于0.2 mol/L (pH 4.6) 醋酸缓冲液中,定容至100 mL。果胶底物:称取0.5 g果胶溶于0.2 mol/L (pH 4.8) 醋酸缓冲液中,定容至100 mL,放置冰箱内冷藏。D-半乳糖醛酸标准液:称取0.1 g D-半乳糖醛酸溶于0.2 mol/L (pH 4.8) 醋酸缓冲液中,定容至100 mL。[b]1.2主要实验仪器[/b]紫外分光光度计 上海精密科学仪器有限公司可见光分光光度计 上海第三分析仪器厂TCL-16C型台式离心机 上海安亭科学仪器厂超净工作台 上海博迅实业有限公司医疗设备厂电热恒温水浴锅 上海跃进医疗器材厂灭菌器 上海申安医疗器械厂海尔冰箱 青岛海尔集团电子分析天平 北京赛多莉斯天平有限公司数显pH计;恒温光照培养箱;制冰机;计时器;[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url];试剂瓶;容量瓶。[b]2实验方法2.1材料[/b]大蒜脱毒试管苗:采用大蒜茎尖组织脱毒技术,经过3次继代培养所获得的生长健壮脱毒苗。大蒜苗植株:将市售山东金乡大蒜,分瓣去皮后,栽种于花盆中,日光照射,生长两个月之后所得植株。[b]2.2方法[/b]共测两组植株(第一组为大蒜脱毒苗,第二组为大蒜苗植株即未脱毒苗)的五种酶的酶活,这五种酶分别是超氧化物歧化酶、多酚氧化酶、过氧化物酶、纤维素酶和果胶酶,最后将两组酶活数据分别做对应比较。同一植株做三次平行实验,取平均值。[b]3酶活测定3.1超氧物歧化酶(SOD)活力的测定[/b]本实验依据超氧物歧化酶抑制氮蓝四唑(NBT)在光下的还原作用来确定酶活性的大小。在有氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生超氧阴离子自由基,这种自由基可将氮蓝四唑还原为蓝色的甲腙。后者在560 nm处有最大吸收,而SOD可清除超氧阴离子自由基,从而抑制了甲腙的形成。于是光还原反应后,反应液蓝色愈深,说明酶活性愈低,反之酶活性愈高。3.1.1粗酶液的提取取叶片于预冷的研钵中,加入1 mL 0.05 mol/L磷酸缓冲液(pH 7.8,内含1%PVP)在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心10 min,取上清液,冷藏待用。3.1.2显色反应取7只5 mL透明度好的试管,用记号笔编号,1为空白管,2~4为测定管,5~7为对照管。各管按照表3-1依次添加试剂溶液,混匀后,将空白管置于暗处,其它各管置于4000 lx日光灯下反应20 min。[align=center]表1 测定SOD活性试剂添加量[/align][align=center]Table 1 The add content of reagent to SOD[/align][table][tr][td][align=center]试剂[/align][/td][td][align=center]用量/ mL[/align][/td][td][align=center]备注[/align][/td][/tr][tr][td][align=center]0.05 mol/L磷酸缓冲液[/align][/td][td][align=center]1.5[/align][/td][td][align=center] [/align][/td][/tr][tr][td][align=center]130 mmol/L Met[/align][/td][td][align=center]0.3[/align][/td][td][align=center] [/align][/td][/tr][tr][td][align=center]750 umol/L NBT[/align][/td][td][align=center]0.3[/align][/td][td=1,2][align=center]总体积为3.0 ml,对照管与空白管加入缓冲液代替酶液[/align][/td][/tr][tr][td][align=center]100 umol/L EDTA-Na[sub]2[/sub][/align][/td][td][align=center]0.3[/align][/td][/tr][tr][td][align=center]20 umol/L 核黄素[/align][/td][td][align=center]0.3[/align][/td][td][align=center] [/align][/td][/tr][tr][td][align=center]酶液[/align][/td][td][align=center]0.05[/align][/td][td][align=center] [/align][/td][/tr][tr][td][align=center]蒸馏水[/align][/td][td][align=center]0.25[/align][/td][td][align=center] [/align][/td][/tr][/table]3.1.3活力测定与计算以暗处管为空白,分别测定其它各管在560 nm波长下的吸光度(OD)。以抑制NBT光化还原的50%作为一个酶活性单位(U)表示。按下式计算SOD的总活性:SOD总活性(U/g)=(A[sub]o[/sub]-A[sub]s[/sub])*V[sub]t[/sub]/ A[sub]o[/sub]*0.5*W*V[sub]1 [/sub](公式3-1)式中:SOD总活性以每克鲜质量的酶单位表示(U/g);A[sub]o[/sub]-照光对照管的吸光度;A[sub]s[/sub]-样品管的吸光度;V[sub]t[/sub]-样品液总体积(mL);V[sub]1[/sub]-测定时样品液用量(mL);W-样品鲜质量(g)。[b]3.2多酚氧化酶(PPO)活力的测定[/b]多酚氧化酶是一种含铜的氧化酶,能使一元酚和二元酚氧化生成醌,其活性可以用比色法测量产物的形成,邻苯二酚是其常用的底物。3.2.1粗酶液的提取取叶片于预冷的研钵中,加入2 mL 0.05 mol/L磷酸缓冲液(pH 6.0),在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心15 min,取上清液,冷藏待用。3.2.2活力测定与计算取2支试管,一支为空白对照管,对照管中加入1 mL酶液+3 mL 0.05 mol/L(pH 6.0)磷酸缓冲液;另一支为测定管,测定管中加入1 mL酶液+1 mL 0.1 mol/L邻苯二酚+2 mL 0.05 mol/L(pH 6.0)磷酸缓冲液。然后在37 ℃水浴保温10 min,立即冰浴,冷却下来之后,各管加入2 mL 20% TCA终止反应。立即在410 nm波长下测定吸光度,每min测一次,共测3 min。以每min内吸光度变化0.01为酶活性单位(U)。PPO活性(U/gmin)=ΔA*V[sub]0[/sub]/0.01W*V[sub]1[/sub]*t [sub] [/sub](公式3-2)式中:ΔA = A[sub]s[/sub]-A[sub]o[/sub];A[sub]o[/sub]-对照管的吸光度;A[sub]s[/sub]-测定管的吸光度;V[sub]0[/sub]-酶液提取总量(mL);V[sub]1[/sub]-测定时酶液用量(mL);W-样品鲜重(g);t-反应时间(min)。[b]3.3过氧化物酶(POD)活力的测定[/b]选用愈创木酚法,即在过氧化氢存在下,过氧化物酶能使愈创木酚氧化,生成茶褐色物质,可用分光光度计测量生成物的含量。3.3.1反应混合液的制备量取50 mL 0.1 mol/L磷酸缓冲液(pH6.0),加入28 uL二氧甲基酚,加热搅拌至溶解,冷却后再加入19 uL 30% H[sub]2[/sub]O[sub]2[/sub],混合均匀保存于冰箱中。3.3.2粗酶液的提取取叶片于预冷的研钵中,加入5 mL 0.1 mol/L磷酸缓冲液(pH 6.0),在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心15 min,取上清液,冷藏待用。3.3.3活力测定与计算取2只比色杯,一只加入2 mL反应混合液和1 mL 0.1 mol/L磷酸缓冲液(pH 6.0),作为校零对照;另一只加入2 mL反应混合液和1 mL酶液,立即开启秒表计时器,在470 nm波长下测定吸光度,每隔1 min读数一次。以每min吸光度变化0.01为1个过氧化物酶活性单位(U)。POD活性=△A*Vt /0.01W* V[sub]1[/sub]*t (公式3-3)式中:△A-反应时间内吸光度的变化量;V[sub]t[/sub]-酶液总体积(mL);V[sub]1[/sub]-测定时酶液用量(mL);W-样品鲜重(g);t-反应时间(min)。[b]3.4纤维素酶活力的测定[/b]选用DNS法测定纤维素酶活力。DNS法测定的是纤维素酶对羧甲基纤维素钠(CMC)的糖化能力,其水解产物如纤维二糖和葡萄糖是还原糖,可以将DNS还原成棕红色的氨基化合物,在一定浓度范围内,还原糖的量与该物质溶液颜色的深浅成比例,因此可以用分光光度计进行测定,该方法可表示纤维素酶的总活力。3.4.1绘制葡萄糖标准曲线取5支试管,用记号笔编号后,按表3-2量取试剂,每管分别加入1 mL 2 mol/L氢氧化钠和2 mL DNS显色液,摇匀后置于沸水浴中加热5 min,流水冷却,用蒸馏水定容至10 mL,静置20 min后以1号管为对照于490 nm波长处测吸光度,绘制标准曲线。[align=center]表2葡萄糖标准曲线制作表[/align][align=center]Table 2 Standard curve of Glucose[/align][table][tr][td][align=center]试管号[/align][/td][td]标准葡萄糖溶液(mL)[/td][td]0.2 mol.L[sup]-1[/sup],pH4.6醋酸钠缓冲溶液(mL)[/td][td][align=center]试管中葡萄糖量(umol)[/align][/td][/tr][tr][td][align=center]1[/align][/td][td][align=center]0[/align][/td][td][align=center]5.0[/align][/td][td][align=center]0[/align][/td][/tr][tr][td][align=center]2[/align][/td][td][align=center]0.4[/align][/td][td][align=center]4.6[/align][/td][td][align=center]2.4[/align][/td][/tr][tr][td][align=center]3[/align][/td][td][align=center]0.6[/align][/td][td][align=center]4.4[/align][/td][td][align=center]3.6[/align][/td][/tr][tr][td][align=center]4[/align][/td][td][align=center]0.8[/align][/td][td][align=center]4.2[/align][/td][td][align=center]4.8[/align][/td][/tr][tr][td][align=center]5[/align][/td][td][align=center]1.0[/align][/td][td][align=center]4.0[/align][/td][td][align=center]6.0[/align][/td][/tr][/table]3.4.2粗酶液的提取取叶片于预冷的研钵中,加入2 mL 0.2 mol/L醋酸缓冲液(pH 4.6),在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心15 min,取上清液,装入离心管中再离心10 min,定容至10 mL,冷藏待用。3.4.3活力测定与计算取3支试管,一支作为空白对照,另2支作为平行样品。样品管中加入50℃预热的酶液1 mL,底物溶液(CMC)4 mL;空白对照管加4 mL底物溶液(CMC)。3支试管放入50℃水浴中,5 min后取出,立即加入1 mL 2mol/L NaOH溶液和2 mL DNS显色剂。摇匀后,空白对照管中加入1 mL酶液,立即将3支试管放入沸水浴中,反应5 min后取出,流水冷却,定容至10 mL,在490 nm波长处测吸光度。用测得的OD值在标准曲线上差得相应的葡萄糖的量,代入下面公式计算活力。以每min催化纤维素水解成1 umol葡萄糖的酶量表示酶活大小(U)。纤维素酶活性(U/gmin)=葡萄糖量/5*E* W (公式3-4)式中:5为反应时间(min);Ew为1 mL酶液中含有的酶量(g);W-样品鲜重(g)。[b]3.5果胶酶活力的测定[/b]选用DNS法测定果胶酶活力。该方法是利用果胶酶在一定温度,时间和条件下水解果胶,释放出还原性D-半乳糖醛酸,与3,5-二硝基水杨酸共热产生棕红色的氨基化合物,即发生显色反应。在一定范围内,水解生成D-半乳糖醛酸的量与吸光度成正比,与果胶酶活力成正比,通过分光光度计测定吸光度,可以计算出果胶酶的活力。3.5.1绘制D-半乳糖醛酸标准曲线取6支试管,编号后依次按照表3-3加入试剂,摇匀后置于沸水浴中反应5 min后,冷却,用蒸馏水定容至10 mL,静置20 min后以1号管为对照于540 nm波长处测吸光度,绘制标准曲线。[align=center]表3[b] [/b]D-半乳糖醛酸标准曲线的绘制[/align][align=center]Table 3 Standard curve of D-Galacturonic acid[/align][table][tr][td][align=center]试管号[/align][/td][td]D-半乳糖醛酸标准液(mL)[/td][td]0.2 mol.L[sup]-1[/sup],pH4.8醋酸缓冲液(mL)[/td][td][align=center]DNS显色液(mL)[/align][/td][/tr][tr][td][align=center]1[/align][/td][td][align=center]0[/align][/td][td][align=center]4.0[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]2[/align][/td][td][align=center]0.2[/align][/td][td][align=center]3.8[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]3[/align][/td][td][align=center]0.4[/align][/td][td][align=center]3.6[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]4[/align][/td][td][align=center]0.6[/align][/td][td][align=center]3.4[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]5[/align][/td][td][align=center]0.8[/align][/td][td][align=center]3.2[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]6[/align][/td][td][align=center]1.0[/align][/td][td][align=center]3.0[/align][/td][td][align=center]2.5[/align][/td][/tr][/table]3.5.2粗酶液的提取与提取纤维素酶的方法相同。3.5.3活力测定与计算取5支试管,用记号笔编号。1、2号管为样品管,分别加入1 mL果胶底物,在48℃水浴中预热5 min,再分别加入4 mL 0.2 mol/L醋酸缓冲液(pH 4.8),之后,1号管中加入1 mL酶液,立即摇匀,在48℃水浴中反应30 min;2号管中加入1 mL酶液,立即放入沸水浴中反应5 min,冷却。分别取1、2管中容液各2 mL于3、4管中,并加2 mL水,2.5 mL DNS显色剂,混匀,沸水浴反应5 min,流水冷却。5号管加入4 mL 0.2 mol/L醋酸缓冲液(pH 4.8),2.5 mL DNS显色剂,静置20 min后以5号管为对照校零,在540 nm波长处测3、4管的吸光度;用测得的(OD[sub]3[/sub]-OD[sub]4[/sub])值在标准曲线上查得相应的D-半乳糖醛酸的量,代入下面公式计算活力。以每min酶作用生成的D-半乳糖醛酸的量为一个酶活单位(U)。果胶酶活性(U/ gmin)=Y*3*N/t* W [sub] [/sub](公式3-5)式中:Y-酶作用生成的D-半乳糖醛酸的量;3-测酶活取了反应液的1/3;N-样品稀释倍数;W-样品鲜重(g);t-反应时间(min)[b]4标准曲线的绘制4.1葡萄糖标准曲线[/b]依照3.4.1步骤,最后测得各个试管中的吸光度依次为0,0.432,0.672,0.865,1.073。按照表4,以葡萄糖浓度为横坐标,490 nm处的OD值为纵坐标,绘制葡萄糖标准曲线(如图1)。[align=center]表4葡萄糖标准曲线[/align][align=center]Table 4 Standard curve of Glucose[/align][table][tr][td][align=center]试管号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td][align=center]葡萄糖浓度umol[/align][/td][td][align=center]0[/align][/td][td][align=center]2.4[/align][/td][td][align=center]3.6[/align][/td][td][align=center]4.8[/align][/td][td][align=center]6[/align][/td][/tr][tr][td][align=center]490 nm OD[/align][/td][td][align=center]0[/align][/td][td][align=center]0.432[/align][/td][td][align=center]0.672[/align][/td][td][align=center]0.865[/align][/td][td][align=center]1.073[/align][/td][/tr][/table][align=center][img=,580,219]http://ng1.17img.cn/bbsfiles/images/2018/07/201807010439441511_1108_2904018_3.png!w580x219.jpg[/img] [/align][align=center]图1葡萄糖标准曲线[/align][align=center]Figure 1 Standard curve of Glucose[/align][b]4.2 D-半乳糖醛酸标准曲线[/b]依照3.5.1步骤,最后测得各个试管中的吸光度依次为0,0.211,0.384,0.561,0.743,0.965。按照表5,以D-半乳糖醛酸的量为横坐标,540 nm处的OD值为纵坐标,绘制D-半乳糖醛酸标准曲线(如图2)。[align=center]表5 D-半乳糖醛酸标准曲线[/align][align=center]Table 5 Standard curve of D-Galacturonic acid[/align][table][tr][td][align=center]试管号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][td][align=center]6[/align][/td][/tr][tr][td][align=center]D-半乳糖醛酸的量mL[/align][/td][td][align=center]0[/align][/td][td][align=center]0.2[/align][/td][td][align=center]0.4[/align][/td][td][align=center]0.6[/align][/td][td][align=center]0.8[/align][/td][td][align=center]1.0[/align][/td][/tr][tr][td][align=center]540 nm OD[/align][/td][td][align=center]0[/align][/td][td][align=center]0.211[/align][/td][td][align=center]0.384[/align][/td][td][align=center]0.561[/align][/td][td][align=center]0.743[/align][/td][td][align=center]0.965[/align][/td][/tr][/table][align=center][img=,579,188]http://ng1.17img.cn/bbsfiles/images/2018/07/201807010440011153_826_2904018_3.png!w579x188.jpg[/img] [/align][align=center]图2 D-半乳糖醛酸标准曲线[/align][align=center]Figure 2 Standard curve of D-Galacturonic acid[/align][b]5结果与分析[/b]将所测得的OD值,根据各个公式计算出SOD,PPO,POD,纤维素酶和果胶酶的酶活力,结果如表6所示。再将大蒜脱毒试管苗与未脱毒苗酶活测定结果做成柱状图进行比较,如图3所示。可以看出,脱毒试管苗中的SOD,PPO,POD的活性均高于未脱毒试管苗的对应酶的活性,而这三种酶都与植物的抗病性有关,说明在抗病性上脱毒试管苗强于未脱毒试管苗;纤维素酶和果胶酶的活性则是未脱毒苗比脱毒试管苗高。此外,作为植物抗氧化系统第一道防线的SOD,其活性大小在脱毒试管苗与未脱毒苗中相差93.37 U/g,前者比后者高出约1.5倍,说明经脱毒的试管苗抵御活性氧侵害的能力更高。PPO能催化木质素及其他酚类氧化物的形成,从而构成保护性屏蔽,抵抗抗病菌的入侵,也可以通过形成醌类物质直接发挥抗病作用。脱毒试管苗的PPO活性比未脱毒苗的PPO活性高出19.48 U/gmin,约2.45倍。说明脱毒苗在抵抗抗病菌的入侵方面,能力更强。在植物对病原菌侵染的防卫反应中,POD和SOD都有着极其重要的作用,SOD能有效的清除机体内的超氧自由基,它可以把有害的超氧自由基转化为过氧化氢,而POD可以将过氧化氢分解为完全无害的水,在脱毒试管苗与未脱毒苗中POD的活性均比较大,两者相差382.55 U/gmin,约1.7倍,说明经脱毒的试管苗可以更有效的抵御过氧化氢的毒害。而纤维素酶和果胶酶均与植物的感病性有关,其活性则是未脱毒苗比脱毒试管苗高,分别高出18.29 U/gmin和38.08 U/gmin,约2.4倍和1.2倍,说明脱毒苗的感病几率有所降低。POD不仅可以将过氧化氢分解为完全无害的水,而且还具有多种生理功能,如从叶绿体和细胞质中去除过氧化氢、氧化有毒化合物、合成细胞壁、对各种胁迫的应急、吲哚-3-乙酸的调控、乙烯的生物合成等,还参与了植物酚类的聚合和氧化以及木质素和植保素的合成。因此POD是植物体中活性较高的一种酶,从图3中也可以看出,POD的活性在五种酶中最高。[align=center]表6 大蒜脱毒试管苗与未脱毒苗酶活测定结果[/align][align=center]Table 6 Enzyme activity assay results between virus-free garlic in vitro and not virus-free plantlets[/align][table][tr][td][align=center]酶总活性[/align][/td][td][align=center]SOD[/align][align=center](U/g)[/align][/td][td][align=center]PPO[/align][align=center](U/gmin)[/align][/td][td][align=center]POD[/align][align=center](U/gmin)[/align][/td][td][align=center]纤维素酶[/align][align=center](U/gmin)[/align][/td][td][align=center]果胶酶[/align][align=center](U/gmin)[/align][/td][/tr][tr][td][align=center]脱毒苗[/align][/td][td][align=center]157.46[/align][/td][td][align=center]27.43[/align][/td][td][align=center]610.95[/align][/td][td][align=center]7.77[/align][/td][td][align=center]31.97[/align][/td][/tr][tr][td][align=center]未脱毒苗[/align][/td][td][align=center]64.09[/align][/td][td][align=center]7.95[/align][/td][td][align=center]228.40[/align][/td][td][align=center]26.06[/align][/td][td][align=center]70.05[/align][/td][/tr][/table][align=center][img=,564,289]http://ng1.17img.cn/bbsfiles/images/2018/07/201807010440223303_2970_2904018_3.png!w564x289.jpg[/img] [/align][align=center]图3大蒜脱毒试管苗与未脱毒苗酶活测定结果比较[/align][align=center]Table 3 Comparison of enzyme activity assay results between virus-free garlic in vitro and not virus-free plantlets[/align]
[color=#000000] 杨梅已经开始慢慢销售了,买回家的杨梅发现其中有很多小白虫,清水泡时间一长,全部浮在水面上,看起来怪恶心的,这样的杨梅还能吃吗,有小白虫的杨梅是不是农残超标,相信很多市民心里都会有这些疑问。国联质检[/color][url=http://www.unqdfenxi.com/]食品检测机构[/url][color=#000000]就杨梅[/color][url=http://www.unqdfenxi.com/news_content.php?id=452]农残检测[/url][color=#000000]结果来为大家答疑解惑这些内容。[/color] [align=center][img=农残检测,400,249]http://www.unqdfenxi.com/js/kindeditor/attached/image/20180607/20180607105410_73212.jpg[/img] [/align][color=#000000] 杨梅里面的这些小白虫名字叫果蝇,果蝇不是大家印象中的蛆之类的东西。果蝇是在杨梅成熟时期进入杨梅果实内,吸食杨梅果肉获取营养,直至杨梅成熟售卖。其实农残检测合格的杨梅都会有果蝇存在的。果蝇对人体是没有伤害的,果蝇非但对人体没有伤害,其实果蝇还是一种优质蛋白。[/color][color=#000000] 农残检测发现果蝇有抗菌肽物质。抗菌肽对败血症有良好的预防和保护作用,抗菌肽还可以杀灭细菌。农残检测合格的杨梅可以放心食用,有果蝇也别太担心。可以将杨梅用淡盐水浸泡一段时间后然后用清水反复清洗几遍,果蝇也就是白色小虫子就可以清洗干净了。[/color]

β-内酰胺酶各检测方法优缺点比较[img]http://ng1.17img.cn/bbsfiles/images/2009/08/200908111906_165045_1641058_3.jpg[/img]目前已有的检测β-内酰胺酶方法大体可以分为两类:一类是测定底物分解产物的方法,如碘量法、pH 测定法、产色头孢菌素法;另一类是测定未分解底物的方法,如UV法、羟肟酸测定法、生物测定法等。但是上述检测方法都存在一定的缺陷。测定底物分解产物的方法目前来说还不能做到定量化,而通过未分解底物的方法又存在时间长、成本高的缺陷。
[b]问题:[b][b][b][/b][/b]艾司奥美拉唑镁肠溶片的检测,流动相是?[/b]答案:流动相: A:水-磷酸盐缓冲溶液-乙腈(80:10:10) B:乙腈-磷酸盐缓冲溶液-水(80:1:19)=======================================================================【活动内容】1、每个工作日上午10:00左右发布一个关于应用数据库的应用问答题,版友根据题目给出自己理解的答案。2、每个工作日下午15:10公布参考答案。【活动奖励】幸运奖:抽奖软件,当天随机抽取3个或5个回答正确的版友ID号(最后一个ID号,截止至下午15:00),每人奖励[color=#ff0000]2钻石币[/color](抽奖人数≤10,抽取3个版友;抽奖人数>10,抽取5个版友);中奖名单:lijing320323(注册ID:lijing320323)999youran(注册ID:999youran)dahua1981(注册ID:dahua1981)PAEs(注册ID:v2911392)吕梁山(注册ID:shih20j07)[img=,690,388]https://ng1.17img.cn/bbsfiles/images/2018/09/201809041504163298_6848_1610895_3.png!w690x388.jpg[/img][img=,690,388]https://ng1.17img.cn/bbsfiles/images/2018/09/201809041504189792_3148_1610895_3.png!w690x388.jpg[/img]积分奖励:所有回答正确的版友奖励[color=#ff0000]10个积分[/color](幸运奖获得者除外)。【注意事项】同样的答案,每人只能发一次[/b][align=left][color=#ff0000][b]PS:该贴浏览权限为“回贴仅作者和自己可见”,回复的版友仅能看到版主的题目及自己的回答内容,无法看到其他版友的回复内容。[/b][/color][/align][align=left][color=#ff0000][b] 下午3点之后解除,即可看到正确答案、获奖情况及所有版友的回复内容。[/b][/color][/align][align=center]=======================================================================[/align]方法:HPLC基质:药品应用编号:103783化合物:艾司奥美拉唑色谱柱:[url=http://www.dikma.com.cn/product/details-855.html]Platisil ODS 5μm 250 x 4.6mm[/url]样品前处理:有关物质供试品:精密称取20mg样品置于100mL容量瓶中,加10mL甲醇,振摇,加20mL磷酸盐缓冲溶液(每1000mL水中加入磷酸钠0.0137mol和磷酸氢二钠0.0551mol),超声使其溶解,用水稀释到100mL,混匀,过滤,取续滤液。色谱条件:色谱柱: Platisil ODS 250*4.6 mm,5 μm(Cat#:99503)流动相: A:水-磷酸盐缓冲溶液-乙腈(80:10:10) B:乙腈-磷酸盐缓冲溶液-水(80:1:19)磷酸盐缓冲溶液:1000mL水+磷酸二氢钠0.0052mol+磷酸氢二钠0.0315mol流速: 1.0 mL/min柱温: 30 ℃检测器: 302nm进样量: 20uL文章出处:天津应用实验室关键字:艾司奥美拉唑镁肠溶片、Platisil ODS、99503、HPLC摘要:Platisil ODS检测艾司奥美拉唑镁肠溶片。图谱:[img]http://www.dikma.com.cn/u/image/2017/01/05/1483598227111770.jpg[/img][img]http://www.dikma.com.cn/u/image/2017/01/05/1483598227527569.jpg[/img][img]http://www.dikma.com.cn/u/image/2017/01/05/1483598227109068.jpg[/img]
请问甲基嘧菌胺(嘧霉胺)在ECD检测器上响应值高吗 ?
[align=center]几种酶的酶活力检测方法及结果分析[/align][align=center]西安国联质量检测技术股份有限公司[/align][align=center]安评中心:王涛[/align]大蒜属百合科葱属植物蒜的鳞茎,其风味独特,营养丰富,用途十分广泛。在生产上,大蒜不能通过杂交制种,只能采用其鳞茎繁殖,由于长时间的营养繁殖造成植株体内病毒积累,使得蒜头变小,品种退化,产量降低,大大降低了大蒜的商品价值。大蒜在长期的生长过程中,由于受到病原菌的植物的附着与侵入,会产生自身的抗性机制,其中的保护性反应是复杂的新陈代谢的结果,其生理反应是通过酶催化活动来实现的。这些酶包括抗病性酶超氧岐化酶SOD,多酚氧化酶PPO和过氧化物酶POD等,以及感病性酶纤维素酶和果胶酶。本文主要描述了大蒜苗中的SOD,PPO,POD,纤维素酶和果胶酶的酶活力检测方法,并从酶活的角度分析,大蒜茎尖脱毒技术可以有效提高SOD,PPO,POD等与植物抗病性有关的酶的活性,而与植物感病性有关的酶的活性如纤维素酶和果胶酶的活性有所降低,其中脱毒苗中的SOD,PPO和POD的活性分别比未脱毒苗相应地高出93.37 U/g,19.48 U/gmin和382.55 U/gmin,纤维素酶和果胶酶的活性则分别低出18.29 U/gmin和38.08 U/gmin。这就从植物生理的角度上验证了脱毒大蒜苗抗病和高产的原因。[b]1实验药品及仪器1.1缓冲液的配置[/b]1.1.1磷酸缓冲液的配置首先分别配置母液A、B,再根据质量分数分别取对应的母液,调pH即可。母液A:0.2 mol/L Na[sub]2[/sub]HPO[sub]4[/sub]溶液:称量71.63 g Na[sub]2[/sub]HPO[sub]4[/sub]12H[sub]2[/sub]O,定容至1 L。母液B:0.2 mol/L NaH[sub]2[/sub]PO[sub]4[/sub]溶液:称量31.21 g NaH[sub]2[/sub]PO[sub]4[/sub]2H[sub]2[/sub]O,定容至1 L。0.05 mol/L磷酸缓冲液(pH7.8,内含1%PVP):22.875 mL A +2.125 mL l B+1 g聚乙烯吡咯烷酮(PVP),稀释至100 mL。0.05 mol/L磷酸缓冲液(pH6.0):3.075 mL A + 21.925 mL B,稀释至100 mL。0.1 mol/L磷酸缓冲液(pH6.0):12.3 mL A + 87.7 mL B,稀释至200 mL。1.1.2醋酸缓冲液的配置同磷酸缓冲液一样,先配置母液。母液A:0.2 mol/L HAc溶液:吸取11.5 mL 醋酸溶液,定容至1 L。母液B:0.2 mol/L NaAc溶液:称量27.2 g 三水合乙酸钠,定容至1 L。0.2 mol/L (pH4.6) 醋酸缓冲液:51 mL A + 49 mL B混合均匀即可。0.2 mol/L(pH4.8)醋酸缓冲液:40 mL A + 60 mL B混合均匀即可。1.1.3其他试剂的配置100 umol/L EDTA-Na[sub]2[/sub]溶液:称取0.03721 g EDTA-Na[sub]2[/sub],用磷酸缓冲液定容至1 L。20 umol/L核黄素:称取0.00753 g核黄素定容至1 L。130 mmol/L甲硫氨酸(Met):称取1.9399 gMet,用磷酸缓冲液定容至100mL。750 umol/L氮蓝四唑(NBT):称取0.06133 g NBT,用磷酸缓冲液定容至100 mL。0.1 mol/L邻苯二酚:称取1.1011 g邻苯二酚定容至100 mL。20%三氯乙酸(TCA):称取20 g TCA定容至100 mL。二氧甲基酚即愈创木酚30%H[sub]2[/sub]O[sub]2 [/sub]3,5-二硝基水杨酸显色剂(DNS显色剂):称取2.5 g DNS溶于水中,加入2.5 g氢氧化钠、50 g酒石酸钾钠和100 mL水,加热溶解后再加入0.5 g苯酚和0.125 g无水亚硫酸钠,待全部溶解后冷却,定容至500 mL,贮于棕色瓶中,放置一周后使用,用之前过滤[sup][/sup]。葡萄糖标准液:称取0.54 g葡萄糖定容至500 mL。纤维素底物(CMC):称取0.625 g羧甲基纤维素钠溶于0.2 mol/L (pH 4.6) 醋酸缓冲液中,定容至100 mL。果胶底物:称取0.5 g果胶溶于0.2 mol/L (pH 4.8) 醋酸缓冲液中,定容至100 mL,放置冰箱内冷藏。D-半乳糖醛酸标准液:称取0.1 g D-半乳糖醛酸溶于0.2 mol/L (pH 4.8) 醋酸缓冲液中,定容至100 mL。[b]1.2主要实验仪器[/b]紫外分光光度计 上海精密科学仪器有限公司可见光分光光度计 上海第三分析仪器厂TCL-16C型台式离心机 上海安亭科学仪器厂超净工作台 上海博迅实业有限公司医疗设备厂电热恒温水浴锅 上海跃进医疗器材厂灭菌器 上海申安医疗器械厂海尔冰箱 青岛海尔集团电子分析天平 北京赛多莉斯天平有限公司数显pH计;恒温光照培养箱;制冰机;计时器;[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url];试剂瓶;容量瓶。[b]2实验方法2.1材料[/b]大蒜脱毒试管苗:采用大蒜茎尖组织脱毒技术,经过3次继代培养所获得的生长健壮脱毒苗。大蒜苗植株:将市售山东金乡大蒜,分瓣去皮后,栽种于花盆中,日光照射,生长两个月之后所得植株。[b]2.2方法[/b]共测两组植株(第一组为大蒜脱毒苗,第二组为大蒜苗植株即未脱毒苗)的五种酶的酶活,这五种酶分别是超氧化物歧化酶、多酚氧化酶、过氧化物酶、纤维素酶和果胶酶,最后将两组酶活数据分别做对应比较。同一植株做三次平行实验,取平均值。[b]3酶活测定3.1超氧物歧化酶(SOD)活力的测定[/b]本实验依据超氧物歧化酶抑制氮蓝四唑(NBT)在光下的还原作用来确定酶活性的大小。在有氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生超氧阴离子自由基,这种自由基可将氮蓝四唑还原为蓝色的甲腙。后者在560 nm处有最大吸收,而SOD可清除超氧阴离子自由基,从而抑制了甲腙的形成。于是光还原反应后,反应液蓝色愈深,说明酶活性愈低,反之酶活性愈高。3.1.1粗酶液的提取取叶片于预冷的研钵中,加入1 mL 0.05 mol/L磷酸缓冲液(pH 7.8,内含1%PVP)在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心10 min,取上清液,冷藏待用。3.1.2显色反应取7只5 mL透明度好的试管,用记号笔编号,1为空白管,2~4为测定管,5~7为对照管。各管按照表3-1依次添加试剂溶液,混匀后,将空白管置于暗处,其它各管置于4000 lx日光灯下反应20 min。[align=center]表1 测定SOD活性试剂添加量[/align][align=center]Table 1 The add content of reagent to SOD[/align][table][tr][td][align=center]试剂[/align][/td][td][align=center]用量/ mL[/align][/td][td][align=center]备注[/align][/td][/tr][tr][td][align=center]0.05 mol/L磷酸缓冲液[/align][/td][td][align=center]1.5[/align][/td][td][align=center] [/align][/td][/tr][tr][td][align=center]130 mmol/L Met[/align][/td][td][align=center]0.3[/align][/td][td][align=center] [/align][/td][/tr][tr][td][align=center]750 umol/L NBT[/align][/td][td][align=center]0.3[/align][/td][td=1,2][align=center]总体积为3.0 ml,对照管与空白管加入缓冲液代替酶液[/align][/td][/tr][tr][td][align=center]100 umol/L EDTA-Na[sub]2[/sub][/align][/td][td][align=center]0.3[/align][/td][/tr][tr][td][align=center]20 umol/L 核黄素[/align][/td][td][align=center]0.3[/align][/td][td][align=center] [/align][/td][/tr][tr][td][align=center]酶液[/align][/td][td][align=center]0.05[/align][/td][td][align=center] [/align][/td][/tr][tr][td][align=center]蒸馏水[/align][/td][td][align=center]0.25[/align][/td][td][align=center] [/align][/td][/tr][/table]3.1.3活力测定与计算以暗处管为空白,分别测定其它各管在560 nm波长下的吸光度(OD)。以抑制NBT光化还原的50%作为一个酶活性单位(U)表示。按下式计算SOD的总活性:SOD总活性(U/g)=(A[sub]o[/sub]-A[sub]s[/sub])*V[sub]t[/sub]/ A[sub]o[/sub]*0.5*W*V[sub]1 [/sub](公式3-1)式中:SOD总活性以每克鲜质量的酶单位表示(U/g);A[sub]o[/sub]-照光对照管的吸光度;A[sub]s[/sub]-样品管的吸光度;V[sub]t[/sub]-样品液总体积(mL);V[sub]1[/sub]-测定时样品液用量(mL);W-样品鲜质量(g)。[b]3.2多酚氧化酶(PPO)活力的测定[/b]多酚氧化酶是一种含铜的氧化酶,能使一元酚和二元酚氧化生成醌,其活性可以用比色法测量产物的形成,邻苯二酚是其常用的底物。3.2.1粗酶液的提取取叶片于预冷的研钵中,加入2 mL 0.05 mol/L磷酸缓冲液(pH 6.0),在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心15 min,取上清液,冷藏待用。3.2.2活力测定与计算取2支试管,一支为空白对照管,对照管中加入1 mL酶液+3 mL 0.05 mol/L(pH 6.0)磷酸缓冲液;另一支为测定管,测定管中加入1 mL酶液+1 mL 0.1 mol/L邻苯二酚+2 mL 0.05 mol/L(pH 6.0)磷酸缓冲液。然后在37 ℃水浴保温10 min,立即冰浴,冷却下来之后,各管加入2 mL 20% TCA终止反应。立即在410 nm波长下测定吸光度,每min测一次,共测3 min。以每min内吸光度变化0.01为酶活性单位(U)。PPO活性(U/gmin)=ΔA*V[sub]0[/sub]/0.01W*V[sub]1[/sub]*t [sub] [/sub](公式3-2)式中:ΔA = A[sub]s[/sub]-A[sub]o[/sub];A[sub]o[/sub]-对照管的吸光度;A[sub]s[/sub]-测定管的吸光度;V[sub]0[/sub]-酶液提取总量(mL);V[sub]1[/sub]-测定时酶液用量(mL);W-样品鲜重(g);t-反应时间(min)。[b]3.3过氧化物酶(POD)活力的测定[/b]选用愈创木酚法,即在过氧化氢存在下,过氧化物酶能使愈创木酚氧化,生成茶褐色物质,可用分光光度计测量生成物的含量。3.3.1反应混合液的制备量取50 mL 0.1 mol/L磷酸缓冲液(pH6.0),加入28 uL二氧甲基酚,加热搅拌至溶解,冷却后再加入19 uL 30% H[sub]2[/sub]O[sub]2[/sub],混合均匀保存于冰箱中。3.3.2粗酶液的提取取叶片于预冷的研钵中,加入5 mL 0.1 mol/L磷酸缓冲液(pH 6.0),在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心15 min,取上清液,冷藏待用。3.3.3活力测定与计算取2只比色杯,一只加入2 mL反应混合液和1 mL 0.1 mol/L磷酸缓冲液(pH 6.0),作为校零对照;另一只加入2 mL反应混合液和1 mL酶液,立即开启秒表计时器,在470 nm波长下测定吸光度,每隔1 min读数一次。以每min吸光度变化0.01为1个过氧化物酶活性单位(U)。POD活性=△A*Vt /0.01W* V[sub]1[/sub]*t (公式3-3)式中:△A-反应时间内吸光度的变化量;V[sub]t[/sub]-酶液总体积(mL);V[sub]1[/sub]-测定时酶液用量(mL);W-样品鲜重(g);t-反应时间(min)。[b]3.4纤维素酶活力的测定[/b]选用DNS法测定纤维素酶活力。DNS法测定的是纤维素酶对羧甲基纤维素钠(CMC)的糖化能力,其水解产物如纤维二糖和葡萄糖是还原糖,可以将DNS还原成棕红色的氨基化合物,在一定浓度范围内,还原糖的量与该物质溶液颜色的深浅成比例,因此可以用分光光度计进行测定,该方法可表示纤维素酶的总活力。3.4.1绘制葡萄糖标准曲线取5支试管,用记号笔编号后,按表3-2量取试剂,每管分别加入1 mL 2 mol/L氢氧化钠和2 mL DNS显色液,摇匀后置于沸水浴中加热5 min,流水冷却,用蒸馏水定容至10 mL,静置20 min后以1号管为对照于490 nm波长处测吸光度,绘制标准曲线。[align=center]表2葡萄糖标准曲线制作表[/align][align=center]Table 2 Standard curve of Glucose[/align][table][tr][td][align=center]试管号[/align][/td][td]标准葡萄糖溶液(mL)[/td][td]0.2 mol.L[sup]-1[/sup],pH4.6醋酸钠缓冲溶液(mL)[/td][td][align=center]试管中葡萄糖量(umol)[/align][/td][/tr][tr][td][align=center]1[/align][/td][td][align=center]0[/align][/td][td][align=center]5.0[/align][/td][td][align=center]0[/align][/td][/tr][tr][td][align=center]2[/align][/td][td][align=center]0.4[/align][/td][td][align=center]4.6[/align][/td][td][align=center]2.4[/align][/td][/tr][tr][td][align=center]3[/align][/td][td][align=center]0.6[/align][/td][td][align=center]4.4[/align][/td][td][align=center]3.6[/align][/td][/tr][tr][td][align=center]4[/align][/td][td][align=center]0.8[/align][/td][td][align=center]4.2[/align][/td][td][align=center]4.8[/align][/td][/tr][tr][td][align=center]5[/align][/td][td][align=center]1.0[/align][/td][td][align=center]4.0[/align][/td][td][align=center]6.0[/align][/td][/tr][/table]3.4.2粗酶液的提取取叶片于预冷的研钵中,加入2 mL 0.2 mol/L醋酸缓冲液(pH 4.6),在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心15 min,取上清液,装入离心管中再离心10 min,定容至10 mL,冷藏待用。3.4.3活力测定与计算取3支试管,一支作为空白对照,另2支作为平行样品。样品管中加入50℃预热的酶液1 mL,底物溶液(CMC)4 mL;空白对照管加4 mL底物溶液(CMC)。3支试管放入50℃水浴中,5 min后取出,立即加入1 mL 2mol/L NaOH溶液和2 mL DNS显色剂。摇匀后,空白对照管中加入1 mL酶液,立即将3支试管放入沸水浴中,反应5 min后取出,流水冷却,定容至10 mL,在490 nm波长处测吸光度。用测得的OD值在标准曲线上差得相应的葡萄糖的量,代入下面公式计算活力。以每min催化纤维素水解成1 umol葡萄糖的酶量表示酶活大小(U)。纤维素酶活性(U/gmin)=葡萄糖量/5*E* W (公式3-4)式中:5为反应时间(min);Ew为1 mL酶液中含有的酶量(g);W-样品鲜重(g)。[b]3.5果胶酶活力的测定[/b]选用DNS法测定果胶酶活力。该方法是利用果胶酶在一定温度,时间和条件下水解果胶,释放出还原性D-半乳糖醛酸,与3,5-二硝基水杨酸共热产生棕红色的氨基化合物,即发生显色反应。在一定范围内,水解生成D-半乳糖醛酸的量与吸光度成正比,与果胶酶活力成正比,通过分光光度计测定吸光度,可以计算出果胶酶的活力。3.5.1绘制D-半乳糖醛酸标准曲线取6支试管,编号后依次按照表3-3加入试剂,摇匀后置于沸水浴中反应5 min后,冷却,用蒸馏水定容至10 mL,静置20 min后以1号管为对照于540 nm波长处测吸光度,绘制标准曲线。[align=center]表3[b] [/b]D-半乳糖醛酸标准曲线的绘制[/align][align=center]Table 3 Standard curve of D-Galacturonic acid[/align][table][tr][td][align=center]试管号[/align][/td][td]D-半乳糖醛酸标准液(mL)[/td][td]0.2 mol.L[sup]-1[/sup],pH4.8醋酸缓冲液(mL)[/td][td][align=center]DNS显色液(mL)[/align][/td][/tr][tr][td][align=center]1[/align][/td][td][align=center]0[/align][/td][td][align=center]4.0[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]2[/align][/td][td][align=center]0.2[/align][/td][td][align=center]3.8[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]3[/align][/td][td][align=center]0.4[/align][/td][td][align=center]3.6[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]4[/align][/td][td][align=center]0.6[/align][/td][td][align=center]3.4[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]5[/align][/td][td][align=center]0.8[/align][/td][td][align=center]3.2[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]6[/align][/td][td][align=center]1.0[/align][/td][td][align=center]3.0[/align][/td][td][align=center]2.5[/align][/td][/tr][/table]3.5.2粗酶液的提取与提取纤维素酶的方法相同。3.5.3活力测定与计算取5支试管,用记号笔编号。1、2号管为样品管,分别加入1 mL果胶底物,在48℃水浴中预热5 min,再分别加入4 mL 0.2 mol/L醋酸缓冲液(pH 4.8),之后,1号管中加入1 mL酶液,立即摇匀,在48℃水浴中反应30 min;2号管中加入1 mL酶液,立即放入沸水浴中反应5 min,冷却。分别取1、2管中容液各2 mL于3、4管中,并加2 mL水,2.5 mL DNS显色剂,混匀,沸水浴反应5 min,流水冷却。5号管加入4 mL 0.2 mol/L醋酸缓冲液(pH 4.8),2.5 mL DNS显色剂,静置20 min后以5号管为对照校零,在540 nm波长处测3、4管的吸光度;用测得的(OD[sub]3[/sub]-OD[sub]4[/sub])值在标准曲线上查得相应的D-半乳糖醛酸的量,代入下面公式计算活力。以每min酶作用生成的D-半乳糖醛酸的量为一个酶活单位(U)。果胶酶活性(U/ gmin)=Y*3*N/t* W [sub] [/sub](公式3-5)式中:Y-酶作用生成的D-半乳糖醛酸的量;3-测酶活取了反应液的1/3;N-样品稀释倍数;W-样品鲜重(g);t-反应时间(min)[b]4标准曲线的绘制4.1葡萄糖标准曲线[/b]依照3.4.1步骤,最后测得各个试管中的吸光度依次为0,0.432,0.672,0.865,1.073。按照表4,以葡萄糖浓度为横坐标,490 nm处的OD值为纵坐标,绘制葡萄糖标准曲线(如图1)。[align=center]表4葡萄糖标准曲线[/align][align=center]Table 4 Standard curve of Glucose[/align][table][tr][td][align=center]试管号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td][align=center]葡萄糖浓度umol[/align][/td][td][align=center]0[/align][/td][td][align=center]2.4[/align][/td][td][align=center]3.6[/align][/td][td][align=center]4.8[/align][/td][td][align=center]6[/align][/td][/tr][tr][td][align=center]490 nm OD[/align][/td][td][align=center]0[/align][/td][td][align=center]0.432[/align][/td][td][align=center]0.672[/align][/td][td][align=center]0.865[/align][/td][td][align=center]1.073[/align][/td][/tr][/table][align=center][img=,580,219]http://ng1.17img.cn/bbsfiles/images/2018/07/201807010439441511_1108_2904018_3.png!w580x219.jpg[/img] [/align][align=center]图1葡萄糖标准曲线[/align][align=center]Figure 1 Standard curve of Glucose[/align][b]4.2 D-半乳糖醛酸标准曲线[/b]依照3.5.1步骤,最后测得各个试管中的吸光度依次为0,0.211,0.384,0.561,0.743,0.965。按照表5,以D-半乳糖醛酸的量为横坐标,540 nm处的OD值为纵坐标,绘制D-半乳糖醛酸标准曲线(如图2)。[align=center]表5 D-半乳糖醛酸标准曲线[/align][align=center]Table 5 Standard curve of D-Galacturonic acid[/align][table][tr][td][align=center]试管号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][td][align=center]6[/align][/td][/tr][tr][td][align=center]D-半乳糖醛酸的量mL[/align][/td][td][align=center]0[/align][/td][td][align=center]0.2[/align][/td][td][align=center]0.4[/align][/td][td][align=center]0.6[/align][/td][td][align=center]0.8[/align][/td][td][align=center]1.0[/align][/td][/tr][tr][td][align=center]540 nm OD[/align][/td][td][align=center]0[/align][/td][td][align=center]0.211[/align][/td][td][align=center]0.384[/align][/td][td][align=center]0.561[/align][/td][td][align=center]0.743[/align][/td][td][align=center]0.965[/align][/td][/tr][/table][align=center][img=,579,188]http://ng1.17img.cn/bbsfiles/images/2018/07/201807010440011153_826_2904018_3.png!w579x188.jpg[/img] [/align][align=center]图2 D-半乳糖醛酸标准曲线[/align][align=center]Figure 2 Standard curve of D-Galacturonic acid[/align][b]5结果与分析[/b]将所测得的OD值,根据各个公式计算出SOD,PPO,POD,纤维素酶和果胶酶的酶活力,结果如表6所示。再将大蒜脱毒试管苗与未脱毒苗酶活测定结果做成柱状图进行比较,如图3所示。可以看出,脱毒试管苗中的SOD,PPO,POD的活性均高于未脱毒试管苗的对应酶的活性,而这三种酶都与植物的抗病性有关,说明在抗病性上脱毒试管苗强于未脱毒试管苗;纤维素酶和果胶酶的活性则是未脱毒苗比脱毒试管苗高。此外,作为植物抗氧化系统第一道防线的SOD,其活性大小在脱毒试管苗与未脱毒苗中相差93.37 U/g,前者比后者高出约1.5倍,说明经脱毒的试管苗抵御活性氧侵害的能力更高。PPO能催化木质素及其他酚类氧化物的形成,从而构成保护性屏蔽,抵抗抗病菌的入侵,也可以通过形成醌类物质直接发挥抗病作用。脱毒试管苗的PPO活性比未脱毒苗的PPO活性高出19.48 U/gmin,约2.45倍。说明脱毒苗在抵抗抗病菌的入侵方面,能力更强。在植物对病原菌侵染的防卫反应中,POD和SOD都有着极其重要的作用,SOD能有效的清除机体内的超氧自由基,它可以把有害的超氧自由基转化为过氧化氢,而POD可以将过氧化氢分解为完全无害的水,在脱毒试管苗与未脱毒苗中POD的活性均比较大,两者相差382.55 U/gmin,约1.7倍,说明经脱毒的试管苗可以更有效的抵御过氧化氢的毒害。而纤维素酶和果胶酶均与植物的感病性有关,其活性则是未脱毒苗比脱毒试管苗高,分别高出18.29 U/gmin和38.08 U/gmin,约2.4倍和1.2倍,说明脱毒苗的感病几率有所降低。POD不仅可以将过氧化氢分解为完全无害的水,而且还具有多种生理功能,如从叶绿体和细胞质中去除过氧化氢、氧化有毒化合物、合成细胞壁、对各种胁迫的应急、吲哚-3-乙酸的调控、乙烯的生物合成等,还参与了植物酚类的聚合和氧化以及木质素和植保素的合成。因此POD是植物体中活性较高的一种酶,从图3中也可以看出,POD的活性在五种酶中最高。[align=center]表6 大蒜脱毒试管苗与未脱毒苗酶活测定结果[/align][align=center]Table 6 Enzyme activity assay results between virus-free garlic in vitro and not virus-free plantlets[/align][table][tr][td][align=center]酶总活性[/align][/td][td][align=center]SOD[/align][align=center](U/g)[/align][/td][td][align=center]PPO[/align][align=center](U/gmin)[/align][/td][td][align=center]POD[/align][align=center](U/gmin)[/align][/td][td][align=center]纤维素酶[/align][align=center](U/gmin)[/align][/td][td][align=center]果胶酶[/align][align=center](U/gmin)[/align][/td][/tr][tr][td][align=center]脱毒苗[/align][/td][td][align=center]157.46[/align][/td][td][align=center]27.43[/align][/td][td][align=center]610.95[/align][/td][td][align=center]7.77[/align][/td][td][align=center]31.97[/align][/td][/tr][tr][td][align=center]未脱毒苗[/align][/td][td][align=center]64.09[/align][/td][td][align=center]7.95[/align][/td][td][align=center]228.40[/align][/td][td][align=center]26.06[/align][/td][td][align=center]70.05[/align][/td][/tr][/table][align=center][img=,564,289]http://ng1.17img.cn/bbsfiles/images/2018/07/201807010440223303_2970_2904018_3.png!w564x289.jpg[/img] [/align][align=center]图3大蒜脱毒试管苗与未脱毒苗酶活测定结果比较[/align][align=center]Table 3 Comparison of enzyme activity assay results between virus-free garlic in vitro and not virus-free plantlets[/align]