FDA规定药物制剂的稳定性要做哪些方面的考察?和原料药有什么不同? 感激不尽[em09512]
大家好,在我们做药物分析的时候很多时候会用到各种试液、指示液等,通常我们不是现用现配,而是将其配置好后给它规定个有效期?那么这个有效期怎么得来的呢?想当然的给它个时间吗?还是通过一定的技术手段去考察它的稳定性?那么稳定性怎么来考察呢?欢迎大家交换意见,并把你的经验分享,谢谢!
药品的稳定性是指原料药及制剂保持其物理、化学、生物学和微生物学的性质,通过对原料药和制剂在不同条件(如温度、湿度、光线等)下稳定性的研究,掌握药品质量随时间变化的规律,为药品的生产、包装、贮存条件和有效期的确定提供依据,以确保临床用药的安全性和临床疗效。 稳定性研究是药品质量控制研究的主要内容之一,与药品质量研究和质量标准的建立紧密相关。稳定性研究具有阶段性特点,贯穿药品研究与开发全的过程,一般始于药品的临床前研究,在药品临床研究期间和上市后还应继续进行稳定性研究。 本文为一般性原则,具体的试验设计和评价应遵循具体问题具体分析的原则。 二、稳定性研究设计的考虑要素 稳定性研究的设计应根据不同的研究目的,结合原料药的理化性质、剂型的特点和具体的处方及工艺条件进行。 (一)样品的批次和规模 一般地,影响因素试验采用一批样品进行,加速试验和长期试验采用三批样品进行。 稳定性研究应采用一定规模生产的样品,以能够代表规模生产条件下的产品质量。原料药的合成工艺路线、方法、步骤应与生产规模一致;药物制剂的处方、制备工艺也应与生产规模一致。 稳定性研究中,原料药的供试品量应满足其制剂稳定性试验所要求的用量。口服固体制剂如片剂、胶囊应为10000个制剂单位左右。大体积包装的制剂(如静脉输液等)每批中试规模的数量至少应为各项试验所需总量的10倍。特殊品种、特殊剂型所需数量,视具体情况而定。 (二)包装及放置条件 稳定性试验要求在一定的温度、湿度、光照条件下进行,这些放置条件的设置应充分考虑到药品在贮存、运输及使用过程中可能遇到的环境因素。 原料药的加速试验和长期试验所用包装应采用模拟小包装,所用材料和封装条件应与大包装一致。药物制剂应在影响因素试验结果基础上选择合适的包装,在加速试验和长期试验中的包装应与拟上市包装一致。 稳定性研究中所用设备应能较好地对各项试验条件的要求的环境参数进行控制和监测。 (三)考察时间点 由于稳定性研究目的是考察药品质量随时间变化的规律,因此研究中一般需要设置多个时间点考察样品的质量变化。 考察时间点应基于对药品的理化性质的认识、稳定性趋势评价的要求而设置。如长期试验中,总体考察时间应涵盖所预期的有效期,中间取样点的设置要考虑药品的稳定性特点和剂型特点。对某些环境因素敏感的药品,应适当增加考察时间点。 (四)考察项目 稳定性研究的考察项目应选择在药品保存期间易于变化,并可能会影响到药品的质量、安全性和有效性的项目,以便客观、全面地反映药品的稳定性。根据药品特点和质量控制的要求,尽量选取能灵敏反映药品稳定性的指标。 一般地,考察项目可分为物理、化学、生物学和微生物学等几个方面。具体品种的考察项目设置应结合药品的特性进行。 (五)显著变化 稳定性研究中如样品发生了显著变化,则试验应中止。一般来说,原料药的“显著变化”应包括: 1、性状,如颜色、熔点、溶解度、比旋度超出标准规定,及晶型、水分等变化超出标准规定。 2、含量测定超出标准规定。 3、有关物质,如降解产物、异构体的变化等超出标准规定。 4、结晶水发生变化。 一般来说,药物制剂的“显著变化”包括: 1、含量测定中发生5%的变化;或者不能达到生物学或者免疫学检测过程的效价指标。 2、药品的任何一个降解产物超出标准规定。 3、性状、物理性质以及特殊制剂的功能性试验(如颜色、相分离、再混悬能力、结块、硬度、每揿给药剂量等)超出标准规定。 4、pH值超出标准规定; 5、制剂溶出度或释放度超出标准规定。 (六)分析方法 评价指标所采用的分析方法应经过充分的验证,能满足研究的要求,具有一定的专属性、准确性、灵敏度、重现性等。
我是做药物残留分析的,试验中要求考察药物的稳定性,如何考察才能更简便也更能说明问题呢。当时试验设计时是这样的,采用选定的操作方法,对标准品储备液和标准品工作液及样品添加后储存在特定条件下经过不同时间后进行考察。自新鲜储备液配制起,4度冰箱保存,分别于1,3,6月考察标准品储备液的稳定性。标准品工作液4度条件下每周考察目标化合物的稳定性,空白组织添加混合标准工作液后,-20度冰箱保存,分别于1,2,3月考察目标化合物的稳定性。现在做了试验之后发现无法做的问题:1、储备液如何具体去考察其稳定性呢,浓度那么高,肯定不能直接上质谱,如果稀释应该稀释成多大的浓度,浓度太低根本就说明不了问题;2、标准品工作液配的也是很高的,每周考察其稳定性应稀释成多大的浓度考察;3、我现在想空白组织添加标样考察的目的是什么,有没有必要。其实做了这么长时间的试验还没真正的从开始就考察其稳定性,如果现在从新开始做,所耗时间也太长了,等做完黄花菜都凉了。大家平时都是怎么做的稳定性,可否来此讨论一下呢,感激不尽啊。
各位大神,关于中成药中的重金属限度研究,需要做稳定性考察吗?如果需要做稳定性考察是否可以用加速试验做稳定性考察?(谢谢啦!)
在做一个抗菌药[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LCMS[/color][/url]MS方法学时,待分析物储备液稳定性先考察了6个月的稳定情况,储备液配制时间分别在20200915和20210304(如图1中的蓝色部分),稳定性没有问题。在8个月的时候,又重新配制了一份新的储备液20210510,并继续考察8个月和2个月的稳定性,发现20200915和20210304的峰面积近似,但是与20210510的峰面积想比少了近25%(图2蓝色部分),同时与2个月前想比也少了近25%,这也就是说之前考察6个月稳定性是好的,但是仅仅过了2个月,考察8个月和2个月的稳定性都不好了,这与原来的结果矛盾了,问题是储存条件并没有改变,想问下有哪位遇到类似问题?[img]https://ng1.17img.cn/bbsfiles/images/2021/05/202105110936521974_9937_2360491_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2021/05/202105110936523654_6682_2360491_3.png[/img]
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=7095]相关附件[/url]这是从国家食品药品监督管理局转来的资料!稳定性考察中的热循环(冻融)实验简介黄晓龙新药研究单位在设计药品的稳定性考察实验方案时,往往注意通过一系列的影响因素实验来选定药品的包装与储存条件,通过标准条件下的长期留样实验来确定产品的有效期。但经常会忽略一些特殊的药品在运输或使用过程中因为温度的变化而可能给产品的质量所造成的不利影响。美国FDA1998年6月发表的稳定性指导原则草案对此问题提出了一个解决的办法,即对于易发生物相分离、黏度减小、沉淀或聚集的药品需通过热循环实验来验证其运输或使用过程中的稳定性。作为影响因素实验的一部分,应模拟药品在运输与使用过程中可能碰到的温度条件下循环考察上市包装的药品的稳定性。具体方法如下:1)对于温度变化范围在冰点以上的药品,热循环实验应包括三次循环,每次循环应在2~8℃两天,然后在40℃加速条件下考察两天。2)对于可能暴露于冰点以下的药品,热循环实验应包括三次循环,每次循环应在-10~-20℃两天,然后在40℃加速条件下考察两天。3)对于吸入气雾剂,推荐的热循环实验包括一天内进行三到四次六小时的循环,温度在冰点以下和40℃(75~85%RH)之间,该实验需持续考察六周。4)对于冷冻保存的药品,应考察该药在微波炉或热水浴中加速融化时的稳定性,除非说明书中明确禁止如此操作。如经过验证,也可采用其他的方法进行考察。
俗话说单反穷三代,其实稳定性混乱会毁QC三年... 在看QC台账的时候发现,好多考察数据都是废的,因为考察本身已经废了,废了有各种原因但不能跟QC说不能跟老板说,原因你懂得。 楼主曾经仔细去分辨稳定性考察和持续稳定性考察的区别,考察条件、时间点什么的怎么看怎么一致,后来好不容易觉得自己理解了,面对同事的疑问又忍不住有种大道无形的嘚瑟,觉得一两句话说不清楚。稳定性考察确实是一剂万能药,通过时间能澄清一切疑问。可不是所有的问题都需要稳定性考察来解决啊,有些事老感觉像是秃子头上的虱子,属于不经过稳定性考察依据现有知识也能理解的问题,可这牛太拧了,非此草不吃,于是稳定性考察越用越烂,效率越来越差。车间这么玩:某企业,研发部门专注于注册阶段,有些多年前申报的品种眼看要批产了,可商业化生产还不成熟怎么办?交给车间来吧,有人有设备还不占用研发资源多好,至于检验当然给QC了。车间做这个会去理你设计空间、正交试验神马的?基本上半瓶水一拍脑门就能文思泉涌出一个方案,什么什么结果不好,QC这帮少年会不会检验,哦哦真不好,没关系我在调整一个给你,啥尚可?太好了每个规格来三批稳定性考察吧,于是加速...长期...,XX月之后,什么什么考察结果不理想?那算了我在拟定一个,至于已经考察的爱咋咋的吧,我轻轻地走了留下一大堆考察任务。采购这么玩:XX经理啊,联系了一个XX物料厂家啊,价格很有竞争力哦,做个小试考察下吧?恩恩,来三批稳定性吧,什么什么流动性不好不适于生产?没事你先考察着,毕竟质量合格不是,于是加速...长期...,XX月之后,QA问了:XX经理啊那个物料怎么样能不能用啊?啥啥流动性不好不能用啊,没关系我跟采购说下不买了,至于QC?这个跟QC有啥关系吗?于是我轻轻地走了留下一大堆考察任务。QA这么玩:XX经理啊,哦哦你好,什么你们要变更XX?好说好说走个流程做做稳定性考察吧,每个规格三批哦。只变包装规格?那也不行要考察,咱们公司有规定的必须做?咋咋不影响产品质量,你说不影响就不影响了,不做稳定性怎么知道,做,于是我轻轻地走了留下一大堆考察任务。砖家这么玩:某次认证,专家说你们这个持续稳定性只做一批没有代表性啊,起码三批吗?啥啥法规一批就行,不要死套法规要理解中执行,啥啥不理解,那给你落个条款,必须执行,在执行中加深理解、整改去吧。某企业品种巨多,改为三批留了一年QC留样室爆仓了。领导这么玩:啥啥QC嫌累活多做不完?你妹的糊弄我是吧,销售不好生产的这么少还给你加了人你还完不成?当年XX人又快又好,现在给你2*XX人你干不完,你妹的赶紧死出去。于是QC这么玩:某次认证,专家说你看看你这个稳定性数据,我拿过来一看你就不真实,数据一会大一会小,杂质居然还会越往后考察越小?你自己觉得合理吗?QC满腹牢骚数据不好能赖我么这么多样品柱子都废了设备人员来回换,你妹的其实数据真的真的真的是真的啊,不过这个检测质量确实确实确实不讨人喜欢啊。话说,稳定性考察要不要有个退出机制呢。
一个品种,现在做到了稳定性考察6月,发现加速6月有关物质的单杂和特定的杂质都超过了原来拟定的质量标准。长期6月虽然没超,但看趋势的话,在24月内铁定要超的。我们和参比制剂同比做的稳定性,参比制剂也是这种情况。请问这时候该怎么办呢?更改质量标准有关物质的限度吗?可是这个限度又是怎么定的呢?
我们做很多色谱的工作,都有标准可依据,但是有的标准没有写明你的标准品有效期是多长?如果有一天你做一个项目,你是否会去考察它的稳定性呢?比如:是不是每次都配新标准,对稳定性不在意
稳定性研究的目的是考察药物在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,并确定药品的有效期。药品的稳定性是其质量的重要评价指标之一。中成药稳定性研究的范围一般根据稳定性变化的实质分为化学的、物理的及生物学的三种。中成药在制备和储存过程中,因温度、水分、光线、pH值、微生物等因素的影响,易发生变质,轻则引起制剂外观的变化,重则导致药效降低,甚至毒性增大,影响药品的安全性和有效性。通过研究揭示中药制剂稳定性变化的实质,探讨其影响因素,可采取相应的措施避免或延缓制剂的不稳定性,确定有效期,是中药制剂稳定性研究的基本任务。药品的安全、有效、质量稳定、可控是对药品的基本要求,而稳定性又是保证有效性和安全性的重要因素。因此稳定性研究在中药新药研究中占有重要的地位,是不可缺少的内容。一、中药稳定性研究的现状 1.中药新药稳定性研究技术要求 (1)《中药新药研究指南》中有明确要求。在申报临床时,待测样品于临床试验用包装条件下(在包装材料质地和结构上相当于上市药品的包装)放置,并记录室温和湿度,根据该制剂申报资料临床研究质量标准草案所列性状、鉴别、检查、浸出物、含量测定等项并结合《新药审批办法》“有关中药部分的修订和补充规定“(1992年)以下《补充规定》中附件八之附表中不同剂型的稳定性考察项目要求进行。但需注意检测成分是否能说明该制剂的稳定性。如含大黄的制剂,不能单测总蒽醌,应同时检测游离蒽醌或结合蒽醌才能确定反映其成分的变化。在常温下进行考察,开始考察时间应在样品制备后1个月之内,以开始考察的结果作为0月结果,以后每月考察一次,不得少于3个月。如预测药品远期稳定性,也可在37℃一40℃和相对湿度75%条件下保存,以开始考察的结果作为0月结果,以后每月考察一次,不得少于3个月,如稳定,相当于样品保存2年内质量稳定。但稳定性试验结果,仍以常温下为准。考察样品应在3批以上,各批样品应达中试以上规模,不得将同一批样品分成3份代表3批样品,每批样品均应留有足够在稳定性试验中各次考察所需的数量。在申请生产时,药品在上市包装条件下,根据该制剂生产用质量标准草案所列项目并结合补充规定附件八附表中不同剂型的稳定性考察项目要求进行考察。同时应注意观察直接与药品接触的包装材料对药品稳定性的影响。在常温下进行考察,一般可在初步稳定性考察后继续考察,即在初步稳定性考察3个月后,放置3个月再考察一次,然后每半年一次。药品的稳定性试验在达到规定的考察时间后还可在正常室温下继续考察,每半年一次,不超过5年,为该药品审定使用期限提出依据。(2)1999年底颁布的“中药新药质量稳定性研究技术要求“,其对稳定性的要求与1992年技术要求内容基本相同。稳定性试验结果、有效期的确定,仍以常温下为准。(3)仿制药及增加规格品种,稳定性研究参照新药要求。由于申报时间较短,在提供常温稳定性资料时应同时申报3~6个月加速稳定性试验资料,以暂定有效期。但应继续进行常温试验考察,以常温下为准,最终确定有效期。2.中药稳定性研究状况从上世纪50年代开始,人们对化学药制剂的稳定性进行研究至今已积累了不少丰富的资料和经验,对考察药物制剂的质量、确定有效期、保证临床疗效的发挥起了积极的作用。中成药稳定性研究工作是从液体制剂开始的,且多为单方制剂。最先报道…的是对威灵仙注射液中原白头翁素稳定性的研究。经考察pH值、温度、光线、添加剂等因素对原白头翁素的稳定性均有影响。通过对恒温加速试验数据处理后,认为原白头翁素的化学动力学为伪一级反应,预测有效期t25℃0.9为2.3d。近10余年来,对这方面的研究引起了药学界的普遍重视,有关研究报告逐年增多,研究水平不断提高,尤其在利用稳定性研究来筛选处方、优化工艺、预测有效期等方面取得了可喜的成绩。由于液体制剂溶液的颜色、澄明度等对pH值、温度、光线、添加剂等因素较敏感,经常出现颜色变化、产生沉淀等问题,经研究不仅是物理的变化,还有化学的变化,从而影响到药效的变化,这就促使液体制剂稳定性研究的发展。由于液体制剂的稳定性影响因素较多,不容易控制,所以对液体制剂稳定性的研究报道较多,研究的范围亦较广。固体、半固体制剂一般较液体制剂稳定,但也存在不稳定的问题,且比液体制剂复杂,近几年研究报道亦在逐年增加。由于中药成分的复杂性,1992年《补充规定》要求必须报送稳定性研究资料以来,新药研究中稳定性研究工作向规范、研究内容深度和广度迈进了一大步。1999年又颁布了稳定性技术要求。但中药稳定性研究中仍存在着一些需进一步探讨的问题。如:考察稳定性指标的选择、复方中各成分相互干扰的问题,辅料对稳定性的影响及反应机理等,有些试验方法尚需进一步完善。3.目前存在的主要问题现阶段申报的稳定性资料中仍存在着以下问题:(1)没有说明包装材料的材质及包装情况;(2)没有说明稳定性试验储存条件;(3)0月考察时间表达不准确,开始考察时间应在样品制备后一个月之内,以开始考察的结果作为O月结果;(4)没有按质量标准及制剂要求进行全面检查;(5)对于中药新药注册分类l、5类原料药没有对高温、高湿等与储存条件有关的影响因素进行考察;(6)稳定性考察所用样品不是中试生产样品;(7)没有提供包装材料对药品稳定性影响的研究资料等。
各位大神 我们公司打算上一套药品稳定性考察室 大概30立方左右。不知道大家用过哪一家或者买过哪一家的。帮忙推荐下 要求国产的验证一定要能过,进口的就要求性价比高的。大神现身!!!在线等!!!
如何考察色谱柱的稳定性?自己装的c18色谱柱 如何考察其稳定性?谢谢

[align=center]浅谈[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS药动学方法学考察中的全血稳定性实验[/align]利用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]技术测定药动学时,方法学考察是至关重要的一步,除了比较经典的精密度试验、样品稳定性试验、溶液稳定性实验、专属性试验、基质效应考察、回收率实验和长冻样品稳定性试验等,大多实验者容易忽略的是全血稳定性实验。全血稳定性实验,顾名思义是指全血从动物体内取出,放置一段时间是否会影响药物的浓度。而大多数药物由于自身性质的原因会导致分解,进而影响测定特定时间点下的药物血浆浓度。因此,对于不稳定的药物,我们不仅需要在全血离心得到血浆后考虑药物的稳定性,还需要考察药物在全血中的稳定性。药物在全血中被转化掉了,也就是biotransformation。全血或血浆中的转化一般会发生在具有易水解位点的化合物,如具有酯键或酰胺键的化合物等。原因很简单,全血或血浆中含有水解酶。要搞清楚你的化合物是不是被水解掉了,也很简单。如果你的血是EDTA抗凝的,那么水解反应这个原因就不可能了,因为水解酶要发挥作用是需要金属离子(镁离子)的,而EDTA可以螯合掉金属离子(镁离子)。因此你只需要比较一下肝素钠和EDTA两种抗凝剂的孵育结果就行了。如果肝素钠不下降,EDTA下降就是这个原因了。如果都下降,就不是这个原因了。当然,如果真的是水解反应所造成的话,一般都应该能同时观察到全血和血浆的浓度下降。我们举一个例子为大家演示全血稳定性实验的操作步骤。首先购买无菌抗凝大鼠全血,要求大鼠来源健康,全血由EDTA抗凝。见下图。全血中的红细胞易破裂,应严禁将全血冻存,且远离冰箱壁等低温源。保存期间适时摇晃全血瓶,使红细胞均匀吸收养分和氧气,防止变黑。储存条件:2-6℃保存,无菌取用。[align=center][img=,485,647]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101340033036_8094_3255306_3.jpg!w485x647.jpg[/img][/align]我们的分析物结构不稳定,在水中和甲醇中易水解,主要水解产物我们也购买了标准品,打算利用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]技术同时检测分析物和水解产物的浓度。而分析物由于结构的原因,对pH要求较大,即应在pKa范围内才能稳定存在。因此我们的实验目的也清晰了很多,建立方法改善药物不稳定因素,尽量做到测定药物浓度为真实浓度。那么我们的方法就是在取血前,在抗凝管内加少量酸溶液,改善pH,进而使药物稳定存在。此处实验我们尝试了不同浓度和体积的甲酸、乙酸 ,以及不同稀释液:水、生理盐水、PBS等。最终选择的是10%乙酸的PBS溶液,1 mL全血对应50 mL即可保证分析物稳定不水解。实验开始,我们设计了低、高浓度的分析物在空白血浆、加酸调pH后的血浆条件下,分别在0,1,2,4小时37℃水浴保存后,用4000rpm离心机离心操作将血浆取出,然后将血浆沉淀蛋白,取上清进样分析。见下图。此处需要注意的是全血不能用涡旋仪涡旋,否则红细胞会破裂,我们选用的是摇床,将加了分析物的全血摇匀。见下图。最终实验结果也是符合我们的预期,文章结尾依然要感谢仪器信息网为我们提供原创大赛平台,互相学习,互相进步!Fighting![align=center][img=,282,376]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101340309064_9891_3255306_3.jpg!w282x376.jpg[/img][img=,544,409]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101340311624_1449_3255306_3.jpg!w544x409.jpg[/img][img=,189,393]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101340314680_6766_3255306_3.jpg!w189x393.jpg[/img][img=,333,443]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101340318325_9168_3255306_3.jpg!w333x443.jpg[/img][img=,351,468]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101340320825_7270_3255306_3.jpg!w351x468.jpg[/img][img=,564,423]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101340324325_2157_3255306_3.jpg!w564x423.jpg[/img][img=,468,351]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101340327676_8628_3255306_3.jpg!w468x351.jpg[/img][img=,406,305]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101340330956_1648_3255306_3.jpg!w406x305.jpg[/img][img=,353,471]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101340333596_3676_3255306_3.jpg!w353x471.jpg[/img][/align]
各位大神 我们公司打算上一套药品稳定性考察室 大概30立方左右。不知道大家用过哪一家或者买过哪一家的。帮忙推荐下 要求国产的验证一定要能过,进口的就要求性价比高的。大神现身!!!在线等!!!
现需购 恒温恒湿培养箱(稳定性考察仪),请合适的厂家给个参数及报价。
大家好,请问含量测定的时候稳定性怎么考察,需要考察哪些方面,谢谢
跪求各位大佬解答,请问生物样品稳定性考察的天数是有什么依据确认的呢?
新工艺所生产的产品是必须要做的,后续工作中可能会有一些变更,对于什么样的变更必须重新做加速稳定性考察?
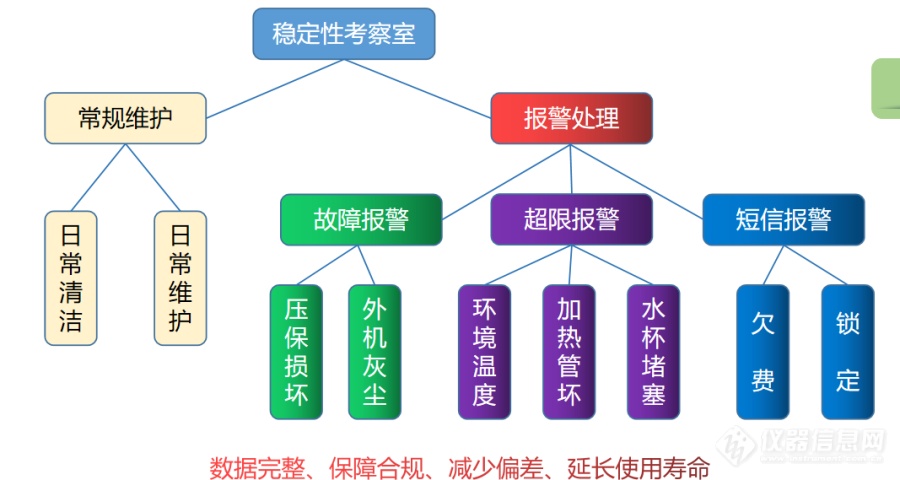
[font='思源黑体 CN Regular']步入式稳定性考察室是考察药品在温度、相对湿度的影响下随时间变化的规律,同时通过试验建立和维护药品的有效期,适用于药品稳定性试验和持续稳定性考察。[/font][font='思源黑体 CN Regular']设备相关数据的可靠性是稳定性考察的基础,为保证稳定性考察可靠并减少异常情况,现对设备常见报警情况及解决办法进行总结,详情如下:[/font][font='思源黑体 CN Regular'] [img=,690,368]https://ng1.17img.cn/bbsfiles/images/2023/08/202308090935111099_8715_5653188_3.png!w690x368.jpg[/img][/font][font='思源黑体 CN Regular']1、[/font][font='思源黑体 CN Regular']常规故障报警[/font][font='Myriad Pro']1.1 [/font][font='思源黑体 CN Regular']压力保护器损坏:[/font][font='思源黑体 CN Regular']a)[/font][font='思源黑体 CN Regular']情况描述:压力保护器识别功能故障,导致设备发生报警,但实际的压力为正常压力范围,且设备正常运行,不会造成考察室内实际温度、相对湿度异常,对样品的稳定性考察无影响。[/font][font='思源黑体 CN Regular']b)[/font][font='思源黑体 CN Regular']控制措施:储备部件、更换部件即可,无需持续关注。[/font][font='Myriad Pro']1.2 [/font][font='思源黑体 CN Regular']外机风扇灰尘过多:[/font][font='思源黑体 CN Regular']a)[/font][font='思源黑体 CN Regular']情况描述:外机风扇置于室外,冷凝器灰尘会随着时间增多,导致冷凝器散热功能差、导致压缩机压力升高。[/font][font='思源黑体 CN Regular']b)[/font][font='思源黑体 CN Regular']控制措施:制定维保计划,定期对外部压缩机除尘,如发生灰尘过多导致的报警则立即除尘;可根据实际情况为外机定制合适的保护装置,减少灰尘和雨、雪、冰雹等恶劣天气对压缩机产生的影响。[/font][font='Myriad Pro'] [/font][font='思源黑体 CN Regular']2、[/font][font='思源黑体 CN Regular']超限报警[/font][font='思源黑体 CN Regular'][font=Myriad Pro]2.1 [/font][font=思源黑体 CN Regular]外部环境影响:[/font][/font][font='思源黑体 CN Regular'][font=Myriad Pro]a[/font][font=思源黑体 CN Regular])情况描述:当室外环境温度过低(北方冬季)或过高(夏季),压缩机压力会有偏低或偏高的情况,从而导致相对湿度超出设定限度范围。[/font][/font][font='思源黑体 CN Regular'][font=Myriad Pro]b[/font][font=思源黑体 CN Regular])控制措施:如雨、雪、冰雹等恶劣天气亦会偶尔导致超限报警,但在几分钟内恢复正常,无需处理;如异常时间较长,可通过调节制冷剂的使用量(加入或放出)以控制压缩机压力在正常范围内,且在此期间应观察实时数据至设备持续稳定(约[/font][font=Myriad Pro]0.5~1h[/font][font=思源黑体 CN Regular])。[/font][/font][font='思源黑体 CN Regular'][font=Myriad Pro]2.2 [/font][font=思源黑体 CN Regular]加热管损坏:[/font][/font][font='思源黑体 CN Regular'][font=Myriad Pro]a[/font][font=思源黑体 CN Regular])情况描述:加热管为设备内部加湿桶中加热部件,是控制相对湿度的主要部件,损坏则导致设备实际参数与设定参数不一致,相对湿度偏低。[/font][/font][font='思源黑体 CN Regular'][font=Myriad Pro]b[/font][font=思源黑体 CN Regular])控制措施:储备加热管,将其作为备件管理;制定维保计划,及时检查部件状态,确保若发生损坏可及时更换。[/font][/font][font='思源黑体 CN Regular'][font=Myriad Pro]2.3 [/font][font=思源黑体 CN Regular]上水杯水管堵塞:[/font][/font][font='思源黑体 CN Regular'][font=Myriad Pro]a[/font][font=思源黑体 CN Regular])情况描述:导致加湿桶缺水,严重时会导致加热管干烧、设备停机;因上水杯功能为向加湿桶输送过滤后的水,故针对此特点对其进行改善。[/font][/font][font='思源黑体 CN Regular'][font=Myriad Pro]b[/font][font=思源黑体 CN Regular])控制措施:进水尽量使用超纯水或注射用水,减少水垢;使用进水口径略大的上水杯,改善其上水堵塞情况,杜绝偏差。[/font][/font][font='思源黑体 CN Regular']3、[/font][font='思源黑体 CN Regular']短信报警异常[/font][font='思源黑体 CN Regular']a)[/font][font='思源黑体 CN Regular']情况描述:短信报警中可能含有会被运营商屏蔽的特殊字符或敏感词汇,运营商不提供白名单功能,无法确认短信报警是否处于正常状态。[/font][font='思源黑体 CN Regular']b)[/font][font='思源黑体 CN Regular']控制措施:需主持卡人定期发送短信,如回复内容,则视为正常状态。[/font][font='思源黑体 CN Regular'] [/font][font='思源黑体 CN Regular'] [font=思源黑体 CN Regular]以上为步入式稳定性考察室常见故障,根据对设备的维修和维护,确认以上故障及对应解决措施适用于所有相同原理的设备。[/font][/font]
药物稳定性实验箱和药物光照实验仪的区别 ,如果药物稳定性实验箱提供0-8000的光照 是否还需要光照实验箱
一、概述原料药或制剂的稳定性是指其保持物理、化学、生物学和微生物学特性的能力。稳定性研究是基于对原料药或制剂及其生产工艺的系统研究和理解,通过设计试验获得原料药或制剂的质量特性在各种环境因素(如温度、湿度、光线照射等)的影响下随时间变化的规律,并据此为药品的处方、工艺、包装、贮藏条件和有效期/复检期的确定提供支持性信息。稳定性研究始于药品研发的初期,并贯穿于药品研发的整个过程。本指导原则为原料药和制剂稳定性研究的一般性原则,其主要适用于新原料药、新制剂及仿制原料药、仿制制剂的上市申请(NDA/ANDA,New Drug Application/Abbreviated New Drug Application)。其他如创新药(NCE,New Chemical Entity)的临床申请(IND,Investigational New Drug Application)、上市后变更申请(Variation Application)等的稳定性研究,应遵循药物研发的规律,参照创新药不同临床阶段质量控制研究、上市后变更研究技术指导原则的具体要求进行。本指导原则是基于目前认知的考虑,其他方法如经证明合理也可采用。二、稳定性研究的基本思路(一)稳定性研究的内容及试验设计稳定性研究是原料药或制剂质量控制研究的重要组成部分,其是通过设计一系列的试验来揭示原料药和制剂的稳定性特征。稳定性试验通常包括影响因素试验、加速试验和长期试验等。影响因素试验主要是考察原料药和制剂对光、湿、热、酸、碱、氧化等的稳定性,了解其对光、湿、热、酸、碱、氧化等的敏感性,主要的降解途径及降解产物,并据此为进一步验证所用分析方法的专属性、确定加速试验的放置条件及选择合适的包装材料提供参考。加速试验是考察原料药或制剂在高于长期贮藏温度和湿度条件下的稳定性,为处方工艺设计、偏离实际贮藏条件其是否依旧能保持质量稳定提供依据,并根据试验结果确定是否需要进行中间条件下的稳定性试验及确定长期试验的放置条件。长期试验则是考察原料药或制剂在拟定贮藏条件下的稳定性,为确认包装、贮藏条件及有效期/复检期提供数据支持。对临用现配的制剂,或是多剂量包装开启后有一定的使用期限的制剂,还应根据其具体的临床使用情况,进行配伍稳定性试验或开启后使用的稳定性试验。稳定性试验设计应围绕相应的试验目的进行。例如,影响因素试验的光照试验是要考察原料药或制剂对光的敏感性,通常应采用去除包装的样品进行试验;如试验结果显示其过度降解,首先要排除是否因光源照射时引起的周围环境温度升高造成的降解,故可增加避光的平行样品作对照,以消除光线照射之外其他因素对试验结果的影响。另外,还应采用有内包装(必要时,甚至是内包装加外包装)的样品进行试验,考察包装对光照的保护作用。(二)稳定性试验样品的要求及考察项目设置的考虑稳定性试验的样品应具有代表性。原料药及制剂注册稳定性试验通常应采用至少中试规模批次的样品进行,其合成路线、处方及生产工艺应与商业化生产的产品一致或与商业化生产产品的关键工艺步骤一致,试验样品的质量应与商业化生产产品的质量一致;包装容器应与商业化生产产品相同或相似。影响因素试验通常只需1个批次的样品;如试验结果不明确,则应加试2个批次样品。加速试验和长期试验通常采用3个批次的样品进行。稳定性试验的考察项目应能反映产品质量的变化情况,即在放置过程中易发生变化的,可能影响其质量、安全性和/或有效性的指标,并应涵盖物理、化学、生物学和微生物学的特性。另外,还应根据高湿或高温/低湿等试验条件,增加吸湿增重或失水等项目。原料药的考察项目通常包括:性状(外观、旋光度或比旋度等)、酸碱度、溶液的澄清度与颜色、杂质(工艺杂质、降解产物等)、对映异构体、晶型、粒度、干燥失重/水分、含量等。另外,还应根据品种的具体情况,有针对性地设置考察项目;如聚合物的黏度、分子量及分子量分布等;无菌原料药的细菌内毒素/热原、无菌、可见异物等。制剂的考察项目通常包括:性状(外观)、杂质(降解产物等)、水分和含量等。另外,还应根据剂型的特点设置能够反映其质量特性的指标;如固体口服制剂的溶出度,缓控释制剂、肠溶制剂、透皮贴剂的释放度,吸入制剂的雾滴(粒)分布,脂质体的包封率及泄漏率等。另外,制剂与包装材料或容器相容性研究的迁移试验和吸附试验,通常是通过在加速和/或长期稳定性试验(注意药品应与包装材料充分接触)增加相应潜在目标浸出物、功能性辅料的含量等检测指标,获得药品中含有的浸出物及包装材料对药物成分的吸附数据;所以,高风险制剂(吸入制剂、注射剂、滴眼剂等)的稳定性试验应考虑与包装材料或容器的相容性试验一并设计。相容性研究的具体内容与试验方法,可参照药品与包装材料或容器相容性研究技术指导原则。三、原料药的稳定性研究(一)影响因素试验影响因素试验是通过给予原料药较为剧烈的试验条件,如高温、高湿、光照、酸、碱、氧化等,考察其在相应条件下的降解情况,以了解试验原料药对光、湿、热、酸、碱、氧化等的敏感性、可能的降解途径及产生的降解产物,并为包装材料的选择提供参考信息。影响因素试验通常只需1个批次的样品,试验条件应考虑原料药本身的物理化学稳定性。高温试验一般高于加速试验温度10℃以上(如50℃、60℃等),高湿试验通常采用相对湿度75%或更高(如92.5% RH等),光照试验的总照度不低于1.2×106Lux·hr、近紫外能量不低于200w·hr/m2。另外,还应评估原料药在溶液或混悬液状态、在较宽pH值范围内对水的敏感度(水解)。如试验结果不能明确该原料药对光、湿、热等的敏感性,则应加试2个批次样品进行相应条件的降解试验。恒湿条件可采用恒温恒湿箱或通过在密闭容器下部放置饱和盐溶液来实现。根据不同的湿度要求,选择NaCl饱和溶液(15.5℃-60℃,75%±1%RH)或KNO3饱和溶液(25℃,92.5%RH)。可采用任何输出相似于D65/ID65发射标准的光源,如具有可见-紫外输出的人造日光荧光灯、氙灯或金属卤化物灯。D65是国际认可的室外日光标准,ID65相当于室内间接日光标准;应滤光除去低于320nm的发射光。也可将样品同时暴露于冷白荧光灯和近紫外灯下。冷白荧光灯应具有ISO 10977(1993)所规定的类似输出功率。近紫外荧光灯应具有320~400nm的光谱范围,并在350~370nm有最大发射能量;在320~360nm及360~400nm二个谱带范围的紫外光均应占有显著的比例。固体原料药样品应取适量放在适宜的开口容器中,分散放置,厚度不超过3mm(疏松原料药厚度可略高些);必要时加透明盖子保护(如挥发、升华等)。液体原料药应放在化学惰性的透明容器中。考察时间点应基于原料药本身的稳定性及影响因素试验条件下稳定性的变化趋势设置。高温、高湿试验,通常可设定为0天、5天、10天、30天等。如样品在较高的试验条件下质量发生了显著变化,则可降低相应的试验条件;例如,温度由50℃或60℃降低为40℃,湿度由92.5%RH降低为75%RH等。(二)加速试验加速试验及必要时进行的中间条件试验,主要用于评估短期偏离标签上的贮藏条件对原料药质量的影响(如在运输途中可能发生的情况),并为长期试验条件的设置及制剂的处方工艺设计提供依据和支持性信息。加速试验通常采用3个批次的样品进行,放置在商业化生产产品相同或相似的包装容器中,试验条件为40℃±2℃/75%RH±5%RH,考察时间为6个月,检测至少包括初始和末次的3个时间点(如0、3、6月)。根据研发经验,预计加速试验结果可能会接近显著变化的限度,则应在试验设计中考虑增加检测时间点,如1.5月,或1、2月。如在25℃±2℃/60%RH±5%RH条件下进行长期试验,当加速试验6个月中任何时间点的质量发生了显著变化,则应进行中间条件试验。中间条件为30℃±2℃/65%RH±5%RH,建议的考察时间为12个月,应包括所有的考察项目,检测至少包括初始和末次的4个时间点(如0、6、9、12月)。原料药如超出了质量标准的规定,即为质量发生了“显著变化"。如长期试验的放置条件为30℃±2℃/65%RH±5%RH,则无需进行中间条件试验。拟冷藏保存(5℃±3℃)的原料药,加速试验条件为25℃±2℃/60%RH±5%RH。新原料药或仿制原料药在注册申报时均应包括至少6个月的试验数据。另外,对拟冷藏保存的原料药,如在加速试验的前3个月内质量发生了显著变化,则应对短期偏离标签上的贮藏条件(如在运输途中或搬运过程中)对其质量的影响进行评估;必要时可加试1批样品进行少于3个月、增加取样检测频度的试验;如前3个月质量已经发生了显著变化,则可终止试验。目前尚无针对冷冻保存(-20℃±5℃)原料药的加速试验的放置条件;研究者可取1批样品,在略高的温度(如5℃±3℃或25℃±2℃)条件下进行放置适当时间的试验,以了解短期偏离标签上的贮藏条件(如在运输途中或搬运过程中)对其质量的影响。对拟在-20℃以下保存的原料药,可参考冷冻保存(-20℃±5℃)的原料药,酌情进行加速试验。(三)长期试验长期试验是考察原料药在拟定贮藏条件下的稳定性,为确认包装、贮藏条件及有效期(复检期)提供数据支持。长期试验通常采用3个批次的样品进行,放
每个公司的质检部门肯定都在做上市药品的稳定性考察,如果是口服药,有效期是3年,长期稳定性考察的频率为3、6、9、12、18、24、36、48个月,那么检测微生物限度的频率是12、24、36、48个月,还是仅在效期的36个月和效期后一年的48个月?如果是注射剂,有效期是2年,无菌检查是12、24、36个月都做,还是仅在效期的24个月和效期后一年的36个月做呢?药典上和GMP中都没有明确说明。
关于重点留样 需要做哪些留样考察?加速?长期?验证留样又做那些考察?
高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法稳定性考察百分比在多少以内?有人知道吗?
刚才看了《如何应对(进行)GMP现场检查-杭州.ppt》,里面提到了稳定性试验箱的验证问题,大家做过这个的验证吗?照个人理解,应该做,但是的确没有做,包括烘箱,都只是检定,看温度的稳定性和准确程度,想问下大家执行了吗?验证吗?
注射液做稳定性考察时,用于可见异物检查的样品该留多少样品呢?有的人说总共留20瓶,每次都用这20瓶检;有的人说留60瓶,每次从中抽20瓶检。请问大家都是怎么留样的?

药品稳定性试验箱就是我们常见的恒温恒湿试验箱,只是不同行业的叫法不同,下面我们也将其称为药品稳定性试验箱。药品稳定性试验箱就是利用了湿热条件来对药品的稳定性进行考察,例如在高温、低温、冷热交替、潮湿等环境下对新药品进行测试,也可以用作某些特殊需要恒定温度和恒定湿度药品的保存箱。[align=center][img=,500,310]http://ng1.17img.cn/bbsfiles/images/2017/06/201706191749_01_3225823_3.jpg[/img][/align][align=center]药品稳定性保存[/align] 药品稳定性试验箱在功能结构上包含了制冷系统、制热系统、加湿系统等三个部分,这三个系统协同作用产生不同的恒定温度或变化温度以及配合不同湿度的环境,其执行技术标准参照 《GB10586-2006湿热箱技术条件》制造。适用于制药企业药品及新药品的稳定性考察试验,满足GMP,FDA,ICH原则中规定的加速试验,长期试验和高低温湿热试验等技术条件。也满足大输液等特殊药类的 40℃,20%R.H低湿度试验。 药品稳定性试验箱用于制药企业对药品及新药加速的试验、长期试验、高温、高湿试验等,满足姚奠中化学物稳定性研究技术原则试验标准。药品稳定性试验箱有快速温变型,可以满足对温度变化更加严苛的稳定性测试。 药品稳定性试验箱不仅仅可以用于药品的稳定性检测,由于其是恒温恒湿试验箱,因此可以进行其他工业材料的高低温湿热交变试验,以检验材料在高温、低温或温度变化的过程中引发的热胀冷缩效应带来的性能下降,并结合的了空气湿度的作用,加速对试验产生影响。在用于工业用品的高低温湿测试时,也主要考验其材料的稳定性。
“通常情况下,每种规格、每种内包装形式的药品,至少每年应考察一个批次,除非当年没有生产”。这里我还是不是很明白。 我们这里有一个问题,同一种药,处方生产都一样,但是有不同的商标或是商品名,那么同一种药,同一种规格、内包装,只是商标或是商品名不同的,也需要分开来留样进行持续稳定性考察吗?
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=11223]药物稳定性研究[/url]