β-乳球蛋白属于乳白蛋白还是属于乳球蛋白里面的一种成分?最近看到有两种版本,其一,说是属于乳白蛋白里面的一种成分,乳白蛋白包括α-乳白蛋白、β-乳球蛋白和血清白蛋白。乳球蛋白即免疫球蛋白。其二,乳白蛋白包括α-乳白蛋白和血清白蛋白,乳球蛋白包括β-乳球蛋白和免疫球蛋白。现在不知道哪种说法对,请各位指教!!!谢谢!!!
[font=SimSun, STSong, &]经过查询,发现免疫球蛋白只是一种普通蛋白质的名称,并不和现有的药品名称相同,且牛初乳里面就含有免疫球蛋白物质,那么添加了牛初乳,产品名称可以叫免疫球蛋白吗?某些地方叫免疫球蛋白的产品,被叫停和查处,请问,如果配料表里面添加了牛初乳,免疫球蛋白可以作为食品名称吗?[/font]
AKATA制备型液相色谱蛋白分析仪纯化蛋白步骤很简单的,比较适合初学者。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=113913]AKATA制备型液相色谱蛋白分析仪纯化蛋白步骤[/url]
请问有小伙伴用上海恒远生物科技有限公司免疫球蛋白的试剂盒吗?
哪位朋友知道奶制品中的IgG (免疫球蛋白 G) 检测方法啊?谢谢!
牛奶蛋白质分析仪可以用于检测乳蛋白制品。以下是详细解释和相关信息: 功能与应用:牛奶蛋白质分析仪是一种专门用于分析牛奶及其制品中蛋白质含量的仪器。它基于先进的生化分析技术,如比色法、光谱法或电化学法等,能够准确、快速地检测样品中的蛋白质含量。 乳蛋白制品的检测:乳蛋白制品,如奶粉、酸奶、奶酪等,其蛋白质含量是产品质量和营养价值的重要指标。牛奶蛋白质分析仪可以有效地检测这些乳蛋白制品中的蛋白质含量,为生产厂家提供准确的质量控制手段。 优点与特点: 准确性高:牛奶蛋白质分析仪具有高灵敏度和高准确性,能够确保测量结果的可靠性。 快速便捷:该仪器操作简单,使用方便,可以快速得出测量结果,提高检测效率。 适用范围广:除了牛奶及其制品外,还可以用于其他含蛋白质样品的检测,如豆类制品、肉制品等。 在乳品工业中的重要性:随着乳品市场的不断扩大和消费者对乳制品质量要求的提高,牛奶蛋白质分析仪在乳品工业中的重要性日益凸显。它可以帮助乳品企业提高产品质量、降低生产成本,同时为消费者提供更加安全、健康的乳制品。 综上所述,牛奶蛋白质分析仪是一种功能强大、应用广泛的检测仪器,完全可以用于检测乳蛋白制品中的蛋白质含量。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/05/202405271615421543_8284_6238082_3.jpg!w690x690.jpg[/img]
10版药典规定人免疫球蛋白中甘氨酸含量要用液相做,以前我们没做过这个实验,现在在研究,求助,一针进去,出的峰都有哪些峰是我们需要的,保留时间大概在什么时候?
静注人免疫球蛋白分子大小分布的峰是怎么样的啊?刚生产出来的产品是不是没有裂解峰出来的啊?放久了才会有的吗?求解
牛血清里的球蛋白有商品化的试剂卖吗?
T/AHFIA 106-2023 β-乳球蛋白
日前,中国农业大学生物学院赵要风教授、李宁院士在9月份出版的两期免疫学杂志(the Journal of Immunology)上连续发表文章探讨动物免疫球蛋白基因的进化问题。通过与澳大利亚、瑞典科学家以及云南大学张亚平院士研究组、本校生物学院张子丁教授的合作,两位教授研究小组在一种原始哺乳动物鸭嘴兽中发现了一种新的免疫球蛋白类型并命名为IgO(the Journal of Immunology,2009,183(5):3285-93)。IgO是近几十年来在哺乳动物中发现的除IgM,IgD,IgG,IgA和IgE外的唯一新类型,它包括四个固定区结构域和一个铰链区结构,在结构表现为低等动物IgY与哺乳动物IgG的中间体形式而且与两者均具有基因序列同源性,明确证明了哺乳动物IgG来源于低等动物的IgY。同时他们发现鸭嘴兽IgD(包含10个固定区结构域,无铰链区)与高等哺乳动物IgD结构(2到3个固定区结构域和一段铰链区)上具有显著差异,但与鱼类、两栖类和爬行类IgD结构上相同。这些结果表明作为最原始的哺乳动物,鸭嘴兽免疫球蛋白基因同时混合了高等哺乳动物与低等脊椎动物的特征。在另外一项研究中(the Journal of Immunology,2009,183(6):3858-64),两位教授与瑞典及美国研究人员合作对爬行类动物绿安蜥的免疫球蛋白基因进行了详细研究,发现这类爬行类动物中缺乏负责黏膜免疫的IgA基因。两位教授在免疫球蛋白基因方面的研究对了解基因在脊椎动物中的进化提供了有意义的线索。
初乳中免疫球蛋白IgG检测一般都用什么方法?
GB/T 5009.194-2003保健食品中免疫球蛋白IgG的测定!有人做过这个方法没,用的什么液相色谱柱啊,我在网上找不到这种色谱柱,求做过的大侠指点下!
[b][font='微软雅黑',sans-serif][color=black][back=white]【序号】:4【作者】: 曹翠岩【题名】:N-糖链/糖肽纯化与免疫球蛋白G Fc糖基化定量分析[/back][/color][/font][/b][align=left][font='微软雅黑',sans-serif][color=black][back=white]【期刊】:大连理工大学 博士论文[/back][/color][/font][font='微软雅黑',sans-serif][color=black][/color][/font][font='微软雅黑',sans-serif][color=black][back=white]【年、卷、期、起止页码】:2022[/back][/color][/font][font='微软雅黑',sans-serif][color=black][/color][/font][font='微软雅黑',sans-serif][color=black][back=white]【全文链接】:[/back][/color][/font][url=https://kns.cnki.net/kcms2/article/abstract?v=3uoqIhG8C447WN1SO36whLpCgh0R0Z-ia63qwICAcC3-s4XdRlECrS5ECsmZMDd20ZXc0ZZUotUGtkXc-cNy_5YsXaID81b6&uniplatform=NZKPT]N-糖链/糖肽纯化与免疫球蛋白GFc糖基化定量分析研究 - 中国知网 (cnki.net)[/url][/align][align=left] [/align]
要做免疫球蛋白的非还原性SDS-PAGE,需要注意什么?1、想用6%的分离胶,4.2%的浓缩胶,是否可以?2、样品处理缓冲液,与通常的还原性上样缓冲液不一样的就是不加DTT或巯基乙醇,对吗?3、电泳时的电压是否要小些,以减少产热,但长时间电泳,是否会破坏胶(6%已经很软了)?4、现在我用的丙烯酰胺的C值为3%(0.9g双叉丙烯酰胺加29.1g丙烯酰胺)是否合适,特别是对于这种低交联度的凝胶是否合适,是否要修改C值?5、将来染色时能否用热的染色液,或者在微波炉中加热?(我们现在12%或15%的胶是在热的染色液中染色的。)
不知有谁使用过这个机器,是否能提供DU530核酸/蛋白分析仪使用说明书,谢谢!
如何增加裂解峰的量,以实现人免疫球蛋白单体峰与裂解峰如何实现分离度大于1.5?
维纶基牛奶蛋白纤维和维纶基大豆蛋白纤维定性分析的研究维纶基大豆蛋白纤维是迄今为止我国获得的唯一完全知识产权的纤维发明,在纺织行业得到了快递的发展,广泛的应用,但与维纶基大豆蛋白纤维一样由我国企业自主研发的维纶基牛奶蛋白纤维也申请到专利好几年了,但迟迟没有相关标准的出台,使这一我国自主研发的新型纤维得不到有效利用新型纤维的不断推出,为我们提供了更多的纤维原料,但同时由于国家标准的相对滞后,给检测工作者带来了很大的难题,下面就目前市场上两种新型蛋白复合纤维给予试验,进行定性分析。主要原理是在观察了维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维显微结构和燃烧性状后,研究两者在常用化学试剂中的溶解性。试验结果表明,维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维在88%甲酸和浓硝酸中都能够部分溶解;在沸腾水浴中,维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维能够完全溶解于75%硫酸和98%硫酸牛奶蛋白纤维是再生蛋白质纤维,是以牛奶为原料经脱水、脱脂、分离、纯化、浓缩制成牛奶酪蛋白,与高分子化合物共混、共聚制成纺丝液,再经湿法纺丝而成;牛奶酪蛋白与聚乙烯醇制得的纤维称为维纶基牛奶蛋白纤维;牛奶酪蛋白与纤维素共聚制得粘胶基牛奶蛋白纤维。牛奶蛋白纤维含有多种氨基酸,具有良好的亲肤性和吸湿导湿性,抗菌防蛀,服用性强,受到消费者的青睐。维纶基牛奶蛋白纤维呈浅黄色,是由牛奶酪蛋白和聚乙烯醇大分子共混、共聚、醛化、揉和、脱泡,湿法纺成的纤维,克服了合成纤维吸湿性差和天然纤维强度低的不足,其比电阻介于天然纤维和合成纤维之间,吸湿性也优于聚乙烯醇纤维,在直接染料、弱酸性染料、活性染料和中性染料中都有良好的上染能力。本文在观察维纶基牛奶蛋白纤维和维纶基大豆蛋白纤维显微结构和燃烧性状后,研究两者在常用化学试剂中的溶解性,为纤维检测提供参数。大豆蛋白纤维属于再生植物蛋白纤维类,是以榨过油的大豆豆粕为原料,利用生物工程技术,提取出豆粕中的球蛋白,通过添加功能性助剂,与腈基、羟基等高聚物接枝、共聚、共混,制成一定浓度的蛋白质纺丝液,改变蛋白质空间结构,经湿法纺丝而成. 其有着羊绒般的柔软手感,蚕丝般的柔和光泽,棉的保暖性和良好的亲肤性等优良性能,还有明显的抑菌功能,被誉为“新世纪的健康舒适纤维”。大豆纤维是以脱去油脂的大豆豆粕作原料,提取植物球蛋白经合成后制成的新型再生植物蛋白纤维,是由我国纺织科技工作者自主开发,并在国际上率先实现了工业化生产的高新技术,也是迄今为止我国获得的唯一完全知识产权的纤维发明。1 试验1. 1试验材料、仪器和试剂纤维细度成分显微分析仪,万分之一电子天平;SHA-C水浴振荡器;鼓风恒温烘箱; 索氏萃取器;酒精灯;具塞三角瓶若干。甲酸(88%);硫酸(75%);浓硫酸(98%);浓硝酸;1MOL/L次氯酸钠溶液;石油醚(馏程为40℃~60℃)。1.2试验方法显微结构试验:用纤维细度成分显微分析仪观察纤维的显微结构。 以下试验维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维同一方法分别做一次燃烧性状试验:点燃酒精灯,用镊子夹取10mg左右纤维束,徐徐靠近火焰,观察试样对热的反应情况。将纤维移入火焰,观察纤维的燃烧情况;然后离开火焰,观察纤维的燃烧情况,并用鼻子闻试样燃烧刚熄灭的气味。最后,待试样熄灭冷却,观察残留物灰分的状态。预处理:取纤维5g左右,用定量滤纸包好,置于索氏萃取器中,用石油醚萃取1h,每小时至少循环6次,待试样中的石油醚挥发后,把试样浸入冷水中浸泡1h,再在(65±5)℃的水中浸泡1h,浸泡过程中时时搅拌。水(mL)与试样(g)之比为100:1。然后抽吸脱水,晾干。溶解性试验:准确称取试样1g置于具塞三角瓶中,加入100mL化学试剂,在搅拌条件下观察不同温度下纤维和试剂随时间的变化情况。待一定时间后,洗涤,抽吸排液,烘干。2 试验结果2.1显微结构在显微镜下观察维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维的横截面呈腰圆形或哑铃形,纵向有沟槽,两种纤维在显微镜下几乎无差别,无法区分这两种纤维。2.2燃烧性状维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维靠近火焰时现象都是熔融并卷曲;进入火焰,熔融、卷曲并燃烧;离开火焰,燃烧,有时会自然熄灭。燃烧过程中散发出蛋白质燃烧时所特有的臭味。纤维燃烧的一端形成黑褐色硬块。两种纤维在燃烧情况下,火焰颜色,气味几乎无差别,无法区分这两种纤维。2.3溶解性取维纶基牛奶蛋白纤维与和维纶基大豆蛋白纤维分别置于88%甲酸、75%硫酸、浓硫酸、浓硝酸和1MOL/L次氯酸钠溶液中进行溶解性试验, 品名/溶液88%甲酸[/ali
T/TDSTIA 026-2022 婴幼儿配方乳粉中α-乳白蛋白、β-乳球蛋白的测定-凝胶渗透色谱法
我现在想检测乳品中的乳球蛋白含量,一般样品的制备是取1ml乳制品样品,依次加入1ml水和2ml样品缓冲液,沸水浴煮3~5分钟,磁力搅拌4小时,离心去除脂肪,取清液分装备用,样品在-20℃可保存6个月。请问标准品怎样制备?一般上样的话,多大浓度比较好?
请教一下各位:用氨基酸分析仪能检测皮革水解蛋白吗?
一、原理:本法系依据特异性抗体(免疫球蛋白)F a b段与红细胞上已包被的相应抗原结合,抗体暴露出F c段补体Clq的结合位点,从而激活后续的补体各成分,最终导致红细胞的细胞膜受到攻击、破裂,释放出血红蛋白。通过溶血反应动力学曲线,计算人免疫球蛋白激活补体活性的功能指数(4 ) ,以此测定供试品F c段生物学活性。二、试剂(1) P B S (pH7.2) 称取无水磷酸氢二钠1.02g,无水磷酸二氢钠0.34g、氣化钠8.77g,加适量水溶解,用lmol/L氢氧化钠溶液或盐酸溶液调p H 值至7.2,再加水稀释至1000ml。( 2 )钙-镁贮备液 称取氯化钙1.10g、氯化镁5. 0 8 g ,加水25ml使溶解。( 3 )巴比妥-钙镁贮备液称取氯化钠51.85g、巴比妥钠6.37g,加水1000ml使溶解,加人钙-镁贮备液3.125ml,用lmol/L盐酸溶液调p H 值至7. 3,再加水稀释至1250ml。除菌过滤后4°C保存备用。( 4 )牛白蛋白-巴比妥缓冲液称取牛血清白蛋白0. 15g加入巴比妥-钙镁贮备液20 m l中,加水溶解并稀释至100ml。临用前配制。(5) 1. 3mg/L 鞣酸 P B S (pH7. 2) 溶液A 液称取鞣酸l m g ,加PBS (pH7.2) 10ml,使溶解。B 液量取 A 液 0.1ml,加 F*BS (pH7. 2) 7.5ml,混匀,即得,临用前配制。(6) 10%氯化铬溶液称取氯化铬5g,加生理氯化钠溶液50ml使溶解。4°C保存(可保存半年)。(7) 1 % 氯化铬溶液取1 0 %氯化铬溶液0. lml,加生理氯化钠溶液0.9ml,混匀。临用前配制。(8)敏化红细胞的制备A 液取健康人抗凝的O 型血3 人份以上混合,用P B S 洗涤3 次,最后一次以每分钟2 0 0 0转离心1 0分钟分离红细胞。取适量压积红细胞悬浮于1 . 3 m g / L鞣酸P B S(1 : 4 0 ) , 置3 7 ° C水浴中轻摇3 0分钟后再用P B S 洗涤3次,最后用P B S 制备成2. 5 % 红细胞悬浮液。B 液用P B S适当稀释的白喉类毒素或腮腺炎病毒与1 % 氯化铬溶液0.25ml混合(1 0 : 1 ) 后,置37°C水浴中轻摇1 5分钟。将A 液、B 液按1 : 4 混合,置37°C水浴中轻摇3 0分钟。离心,去上清液,用P B S将沉淀(敏化红细胞)洗涤3 次,用牛白蛋白-巴比妥缓冲液悬浮红细胞,调节至适宜浓度,使其在波长5 4 1 n m处的吸光度为1.0土0. 1。

今天去给客户安装了液相色谱仪,客户主要用它来检测血浆蛋白粉中免疫球蛋白G的含量,对于液相色谱仪安装已经有一些小小经验,所以仪器送到之后很快的我们就把仪器安装好了,仪器安装好之后呢肯定是要调试和验收的,验收中的安装已经完成,接下来我们运行确认和性能确认,既然要检测血清蛋白,那我们就通过检测它来完成后面的任务吧。首先我们完成运行确认,准备我们实验需要的流动相,流动相A:称取5.6765g磷酸氢二钠和4.6478g磷酸二氢钾至1000mL容量瓶中,加水定容至l000 mL,配制成pH-6.5,浓度为0.05 mol/L的磷酸盐缓冲液。流动相B:称取甘氨酸3.7535g与1000mL容量瓶中,加入800 mL水溶解,再加入4.75 mL6 mol/L的盐酸,用水定容至1000 mL,配制成pH-2.5,浓度为0.05 mol/L的甘氨酸盐酸缓冲液。[img=,255,340]https://ng1.17img.cn/bbsfiles/images/2019/08/201908060953502175_13_3763765_3.jpg!w690x920.jpg[/img] [img=,248,340]https://ng1.17img.cn/bbsfiles/images/2019/08/201908060945498254_8247_3763765_3.jpg!w690x945.jpg[/img] 将两种流动相经过过滤和脱气处理后,连接到我们的输液泵上,输液泵在第一次使用时要打开排液阀,将注射器安装到废液口,用注射器进行手动吸液当衍生试剂进入注射器内,观察并确定进液管内无明显气泡后关闭排气阀,换上废液管后开始运行输液泵。此时必须要确定泵腔内有液体且无气泡才可以运行泵,否则运行泵时会损坏泵头。两个泵都要经过此操作后才可以开始运行。打开我们的泵,查看机器是否可以顺利通过自检,检测泵的流速和流动相混合比例的准确度。随后打开检测器和工作站,我们用的色谱柱是HiTrap[sup]TM [/sup] Protein G HP柱,1mL。设置好实验所需参数:流动相梯度洗脱程序[table][tr][td][align=center]时间(min)[/align][/td][td][align=center]流速(mL/min) )[/align][/td][td][align=center]流动相A(%)[/align][/td][td][align=center]流动相B(%)[/align][/td][/tr][tr][td][align=center]0[/align][/td][td][align=center]0.4[/align][/td][td][align=center]100[/align][/td][td][align=center]0[/align][/td][/tr][tr][td][align=center]4.5[/align][/td][td][align=center]0.4[/align][/td][td][align=center]100[/align][/td][td][align=center]0[/align][/td][/tr][tr][td][align=center]5.5[/align][/td][td][align=center]0.4[/align][/td][td][align=center]0[/align][/td][td][align=center]100[/align][/td][/tr][tr][td][align=center]15.0[/align][/td][td][align=center]0.4[/align][/td][td][align=center]0[/align][/td][td][align=center]100[/align][/td][/tr][tr][td][align=center]15.5[/align][/td][td][align=center]0.4[/align][/td][td][align=center]100[/align][/td][td][align=center]0[/align][/td][/tr][tr][td][align=center]22.0[/align][/td][td][align=center]0.4[/align][/td][td][align=center]100 0[/align][/td][td][align=center]0[/align][/td][/tr][/table]检测波 长280nm。让流动相冲洗整个系统,查看基线,等待基线平稳。[img=,306,340]https://ng1.17img.cn/bbsfiles/images/2019/08/201908060949079532_4842_3763765_3.jpg!w690x765.jpg[/img] [img=,316,340]https://ng1.17img.cn/bbsfiles/images/2019/08/201908060949585645_8170_3763765_3.jpg!w690x742.jpg[/img] [img=,268,340]https://ng1.17img.cn/bbsfiles/images/2019/08/201908060957536288_7365_3763765_3.jpg!w690x874.jpg[/img][img=,321,340]https://ng1.17img.cn/bbsfiles/images/2019/08/201908060944094564_753_3763765_3.jpg!w690x730.jpg[/img] [img=,285,340]https://ng1.17img.cn/bbsfiles/images/2019/08/201908060944599785_6578_3763765_3.jpg!w690x822.jpg[/img] 在这该阶段我们可以把标准品配制出来,首先我们来了解一下免疫球蛋白G,它是血清主要的抗体成分,占血清免疫球蛋白的百分比较多,大约占75%,但它只有40%-50%在血清中,其余在组织当中。它的主要功能是在机体免疫中起到保护作用,它也是唯一可以通过胎盘的免疫球蛋白。通过胎盘获取的母体免疫球蛋白G在出生后数月对防御白喉、[url=https://baike.baidu.com/item/%E9%BA%BB%E7%96%B9][color=#000000]麻疹[/color][/url]、脊髓灰质炎等感染起着重要作用。它的结构想一个“Y”字型,如图:[img=,357,340]https://ng1.17img.cn/bbsfiles/images/2019/08/201908060948093745_2090_3763765_3.jpg!w440x418.jpg[/img] [img=,255,340]https://ng1.17img.cn/bbsfiles/images/2019/08/201908060953036898_4160_3763765_3.jpg!w690x920.jpg[/img] [img=,190,340]https://ng1.17img.cn/bbsfiles/images/2019/08/201908061003393034_7645_3763765_3.jpg!w690x1230.jpg[/img] 称取免疫球蛋白G标准品0.0102g(纯度=97%)置于10mL容量瓶,并用流动相A定容到10mL,摇匀,脱气。浓度为1mg/mL。取配置好的标准溶液母液,用流动相A稀释成浓度为0.2mg/mL、0.4mg/mL、0.6mg/mL、0.8mg/mL的标准工作液。检测进样阀的精密度:将标准溶液母液取20μL在检测波 长280nm条件下进样,连续进样6次,计算其相对标准偏差RSD=0.94%。依次进样标注品工作液20μL,由时间进行定性,峰面积进行定量。得出其平均相关系数r=0.9999。免疫球蛋白G检出质量浓度以3倍信噪比(s/N=3)计算,最低检出质量浓度为0.1 mg/mL。原本还有一步已知浓度样品的检测,前处理方法如下:称取0.1g精确至0.0001曲血浆蛋白粉于15mL的塑料离心管中,准确加入10mL流动相A,涡旋振荡10min,4 000 r/min离心5 min,取上清液经微孔膜(0.22μm)过滤,滤液待测。但是由于今天已知浓度的样品没有到,所以我们无法进行样品进样,但是建议大家在安装仪器时最好用已知浓度的样品进样验证仪器的准确性。好了,今天就到这里啦!
要做免疫球蛋白的非还原性SDS-PAGE,需要注意什么?1、想用6%的分离胶,4.2%的浓缩胶,是否可以?2、样品处理缓冲液,与通常的还原性上样缓冲液不一样的就是不加DTT或巯基乙醇,对吗?3、电泳时的电压是否要小些,以减少产热,但长时间电泳,是否会破坏胶(6%已经很软了)?4、现在我用的丙烯酰胺的C值为3%(0.9g双叉丙烯酰胺加29.1g丙烯酰胺)是否合适,特别是对于这种低交联度的凝胶是否合适,是否要修改C值?5、将来染色时能否用热的染色液,或者在微波炉中加热?(我们现在12%或15%的胶是在热的染色液中染色的。)
牛奶蛋白质分析仪的原理主要基于光学测量技术,特别是光谱分析法。具体地说,它采用红外光谱法来测量牛奶中乳清蛋白和酪蛋白的含量。首先,将牛奶样品制成透明薄片,然后使用近红外光电传感器和光源对其进行扫描。牛奶中的蛋白质对特定波长的红外光有特定的吸收特性,通过测量这些吸收特性,可以分析出牛奶中蛋白质的种类和含量。此外,仪器会将牛奶光谱与事先建立的标准光谱进行比较,通过复杂的算法处理,从而得出各种蛋白质形态的含量。这种比较和计算过程确保了测量结果的准确性和可靠性。总的来说,牛奶蛋白质分析仪通过光学测量和光谱分析技术,能够快速、准确地测定牛奶中蛋白质的含量和种类,为乳制品生产、质量控制和科学研究提供了有力的支持。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/04/202404291701212298_2595_6238082_3.jpg!w690x690.jpg[/img]
保健食品中免疫球蛋白IgG含量测定具体方法在附件中,里面的方法中,样品测定:先用五倍体积重蒸水洗柱,再用10倍体积的流动相A平衡住,进样按下列程序洗脱[table=200][tr][td]时间[/td][td]流速[/td][td]A% [/td][td]B% [/td][td]梯度 [/td][/tr][tr][td] 0.0[/td][td]0.4 [/td][td] 100[/td][td] [/td][td]- [/td][/tr][tr][td] 0.5[/td][td] 0.4[/td][td] 100[/td][td] [/td][td] 11[/td][/tr][tr][td] 4.0[/td][td] 0.4[/td][td] 100[/td][td] [/td][td] 6[/td][/tr][tr][td] 4.5[/td][td] 0.4[/td][td] 0[/td][td]100 [/td][td] 6[/td][/tr][tr][td] 14.5[/td][td] 0.4[/td][td] 0[/td][td] 100[/td][td] 6[/td][/tr][tr][td] 15.0[/td][td] 0.4[/td][td] 100[/td][td] 0[/td][td] 11[/td][/tr][tr][td] 18.0[/td][td] 0.4[/td][td]100 [/td][td] 0[/td][td] 11[/td][/tr][/table]请问大家:1.用五倍体积重蒸水,是谁的五倍体积? 2.里面的梯度怎么设定??我的工作站是LCsolution,梯度表中那个格是梯度?? 谁用过这个方法,我应该注意什么大家帮帮我,经理让我尽快做出数,我快哭了,我没做过~~大家帮帮我
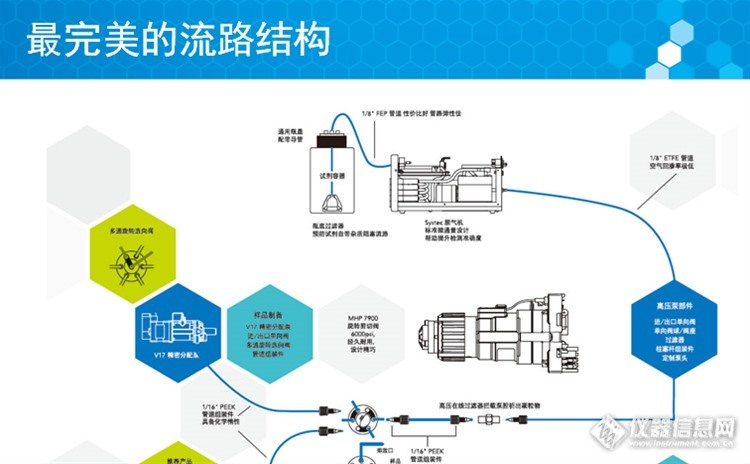
糖尿病是一种慢性病,随着经济生活水平的提高和社会老龄化的加剧,近年来患者人数在全球包括中国逐年递增,目前已严重威胁到国民的健康。对糖尿病的监测也越来越受到国家和人们的重视。作为全球公认的糖尿病检测"金标准",糖化血红蛋白(HbA1c)能够稳定可靠地反映出受检人在检测前90天到120天内的平均血糖水平,不受抽检时间、空腹与否或胰岛素等因素的干扰,经过国际临床化学和实验室医学联盟(IFCC)的技术验证和推广使用,使得糖化血红蛋白检测已成为诊断糖尿病的一种趋势。我们国家也参考国际公认的HPLC-LC-MS/MS方法,已经基本建立了自己的糖化血红蛋白检测一级参考体系。http://ng1.17img.cn/bbsfiles/images/2015/10/201510221629_570638_1587_3.jpg糖尿病检测方法以及主流仪器分析使用最先进的流体技术和产品,为您打造最优秀的HbA1c分析仪项目难度以及如何解决各类流路问题糖化血红蛋白(HbA1c)分析仪市场情况以及前景分析立即报名参与讲座:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/1689
我们实验室有岛津液相,由于要测定免疫球蛋白,我们买了HI-Trap Protein G柱,但是不知道该如何使用,请问各位有使用过的没有,我们该如何是正常像普通柱子那样上到液相上,还是有其他的用法,还有该如何的步骤平衡系统,进完样后,我们又该如何冲洗柱子,如何保存柱子?谢谢各位哈,我们是新手,不会,希望能给我一个详细的方法,谢谢各位啦!
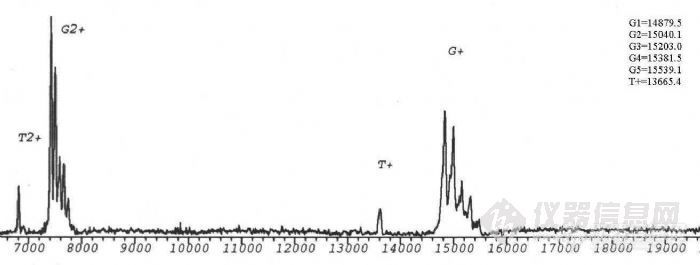
生物质谱在糖蛋白结构分析中的应用项目完成人:桑志红 蔡 耘项目完成单位:国家生物医学分析中心 随着人们对糖蛋白参与生命活动机理的日益深入了解,对天然糖蛋白及重组糖蛋白类药物的分析越来越受到重视。重组糖蛋白类药物的质量控制更是直接关系到药物的疗效及至人类的健康。九十年代以来,随着带有反射功能的基质辅助激光解吸附电离飞行时间质谱(MALDI-TOF-MS)和纳升电喷雾串联质谱(nano-ESI-Q-TOF)等具有软电离方式的现代质谱 技术的发展,质谱以其高灵敏度和强有力的分析混合物的能力,提供了生物大分子的分子量、序列、一级结构信息以及结构转换、修饰等方面的信息,使糖基化分析有了重要的进展。 通常研究糖蛋白的方法是把蛋白链上的寡糖切下来,分别研究蛋白部分和寡糖部分的结构,因此无法研究与两部分共同相关的结构问题,也不能区分不同糖基化位点上切下来的寡糖。自90年代初,国外有人开始用质谱法研究糖蛋白的结构,同时描述了各个位点的不均一性。我们用建立的现代生物质谱技术研究糖蛋白一级结构的方法,将其应用与基因重组糖蛋白的结构分析。为糖蛋白结构分析及基因重组糖蛋白类药物的质量控制提供新的手段。一、 生物质谱研究糖蛋白结构方法的建立实验所用仪器为:1.德国BRUKER 公司的REFLEXIII型基质辅助激光解吸附电离飞行时间质谱仪,N2激光器,波长337nm,线性飞行距离150cm,加速电压2kv。2.英国Micromass 公司Q-TOF型电喷雾串联质谱仪。源温80°C,气体流速40L/h,枪头电压650V,检测频率2.4S,氩气碰撞池压力6*10-5mbar。1. 基质的选择,在MALDI-TOF-MS分析中,基质起着相当重要的作用。不同的基质对不同类的物质响应不同,a-氰基-4-羟基肉桂酸用于测定糖蛋白核糖核酸酶B效果相对较好。2. 糖蛋白分子量的测定,糖蛋白核糖核酸酶B由124个氨基酸组成,在34位Asn处连有一个高甘露糖型N-糖链。由于糖链的微不均一性,与普通蛋白质及核酸不同,其分子离子峰在MALDI-TOF-MS 质谱图上表现为一簇峰,各峰之间约相差一个糖基。正是由于这种微不均一性,使得其分子离子峰变宽,灵敏度降低。糖链分子量越大,峰越宽,灵敏度越低,所以一般只有糖链较短,蛋白的质量不太大的糖蛋白才能测定其平均分子量。用MALDI-TOF可直接测定糖蛋白核糖核酸酶B的平均分子量为 15208.6Da。http://ng1.17img.cn/bbsfiles/images/2011/03/201103211511_284179_1604317_3.jpg3. 糖含量的测定,采用O聚糖酶及内糖苷键酶F分别作用于核糖核酸酶 B,只有内糖苷键酶F能够是其分子量发生变化,表明核糖核酸酶B分子中不存在O-连接糖链存在着N-连接糖链。内糖苷键酶F切断N-糖链五糖核心最内侧的GlcNAc-GlcNAc糖苷键,得到含一个GlcNAc的肽链,减去GlcNAc,可以计算出准确的肽链分子量T=13695.6,与糖蛋白平均分子量之差为糖链的平均分子量G=1513.4,平均糖含量为:(糖链大小/糖蛋白分子量)×100%=9.95%。4. 糖基化位点的确定,研究糖基化类型及糖基化位点的策略:采用蛋白酶酶解与糖苷内切酶酶解相结合的方法,通过酶切前后含糖肽片的位移,结合网上数据库检索,可以确定糖基化类型和糖基化位点。以不同类型的糖苷内切酶作用于糖蛋白(N-糖苷键酶或O-糖苷键酶),在MALDITOF-MS 上观察其质量的变化,可以直接确定糖蛋白中是否含有响应类型的糖链,这是我们确定糖蛋白中糖苷键类型的基础。我们采用先将核糖核酸酶B还原烷基化,加Glu-C酶切,产物再用内糖苷肩酶F酶切,可观察到含糖肽段出现位移,将核糖核酸酶B的肽质量指纹图进行数据库检索,证实发生位移的肽段中含有N-糖链特异连接位点,由此确定34位Asn为糖基化位点。另外我们采用内糖苷键酶F及肽-N-聚糖酶F两种酶进行差位酶切法对含糖肽段进行验证,两种酶酶切后分子离子峰的差值除以GlcNAc的质量,结果就是N-糖基化位点的个数5. 质谱测定氨基酸序列, 我们对核糖核酸酶B肽质量指纹谱中的含糖肽段进行了串联质谱测定,首先在一级质谱图中选择离子4972.23,在串联质谱的碰撞活化室以氩气与其碰撞产生碎片,从碎片的质荷比推算出此肽片中的一段氨基酸序列,检索结果为核糖核酸酶B,从而判断其理论序列是否一致。6. 糖链结构的研究,凝集素对糖肽的亲和提取,进一步分析糖肽序列及糖链结构的关键是含糖肽段的提取。核糖核酸酶B中糖链为高甘露糖型,我们选用对其有特异性吸附的伴刀豆球蛋白对其进行提取利用这种简捷的亲和质谱的方法,对糖肽段进行了分析。建立了亲和质谱分析糖肽类物质的方法,为今后糖肽序列分析及糖链结构分析奠定了基础。二、基因重组糖蛋白人促红细胞生成素(rhEPO)的结构分析。 利用以上建立的方法,我们对样品重组人促红细胞生成素进行了分析,断定此样品为非完全糖基化,样品中只存在N-连接的糖链,无O-糖链。应用酶切法用肽-N-聚糖酶处理后,得到两个含糖肽段,进行数据库检索,测得38位及83位为N-糖基化位点,与文献报道相符,结果可靠。因此,该项课
http://img.dxycdn.com/trademd/upload/asset/meeting/2013/09/06/A1378379551.jpg 氨基酸是蛋白质的基础组成单位,通过研究蛋白质中氨基酸的性质和组成来预测蛋白质的结构和功能,蛋白质氨基酸残基组成分析主要是通过氨基酸分析仪来完成的,本文推荐了2个基于氨基酸组成进行蛋白质预测软件。基于氨基酸组成的蛋白质预测软件根据组成蛋白质的20种氨基酸的物理和化学性质可以辨析电泳等实验中的未知蛋白质,也可以分析已知蛋白质的物化性质。ExPASy工具包包涵的程序:AACompIdent:与把氨基酸序列在SWISS-PROT库中搜索不同,AACompIdent工具利用未知蛋白的氨基酸组成去确认具有相同组成的已知蛋白。该程序分析时需提交的相关信息包括:蛋白质的氨基酸组成、等电点pI和分子量(如果知道)、正确的物种分类及特别的关键词。此外,用户还需在六种氨基酸“组合”中作出选择,这影响到分析如何进行。例如,某种“组合”会把残基Asp/Asn(D/N)和Gln/Glu(Q/E)组合成 Asx(B)和Glx(Z);或者某种残基会在分析中被完全除去。对数据库中的每一个蛋白序列,算法会对其氨基酸组成与所查询的氨基酸组成的差异打分。由电子邮件返回的结果被组织成三级列表:第一张列表中的蛋白都基于特定的物种分类而不考虑pI和分子量;第二张列表包含了不考虑物种分类、pI和分子量的全体蛋白;第三张列表中的蛋白不但基于特定物种分类,并且将 pI和分子量也考虑在内。虽然计算所得结果各不相同,但零分表明了该序列与提出的组成完全相符。AACompSim:AACompIdent的一个变种,AACompSim提供类似的分析,但与前者以实验所得的氨基酸组成为依据进行搜索不同,后者使用SWISS-PROT中的序列为依据。有报道称,氨基酸组成在物种之间是十分保守的(Cordwell等,1995),并且通过分析氨基酸的组成,研究者能从低于25%序列相似性的蛋白之间发现弱相似性(Hobohm和Sander,1995)。因此,在“传统的”数据库搜索基础上辅以组成分析,能为蛋白质之间关系提供更多见解。PROSEARCH:PROPSEARCH也提供基于氨基酸组成的蛋白质辨识功能。用144种不同的物化性质来分析蛋白质,包括分子量、巨大残基的含量、平均疏水性、平均电荷等,把查询序列的这些属性构成的“查询向量”与SWISS-PROT和PIR中预先计算好的各个已知蛋白质的属性向量进行比较。这个工具能有效的发现同一蛋白质家族的成员。可以通过Web使用这个工具,用户只需输入查询序列本身。分子量搜索(MOWSE)分子量搜索(MolecularWeightSearch,MOWSE)算法利用了通过质谱(MS)技术获得的信息。利用完整蛋白质的分子量及其被特定蛋白酶消化后产物的分子量,一种未知蛋白质能被准确无误地确认,给出由若干实验才能决定的结果。由于未知蛋白无需再全部或部分测序,这一方法显著地减少了实验时间。MOWSE的输入是一个纯文本文件,包含一张实验测定的肽段列表,分子量范围在0.7到4.0Kda之间。计算过程基于在OWL非冗余蛋白质序列库中包含的信息。打分基于在一定分子量范围内蛋白中一个片段分子量出现的次数。输出的结果是得分最佳的30个蛋白的列表,包括它们在OWL中的条目名称、相符肽段序列、和其它统计信息。模拟研究得出在使用5个或更少输入肽段分子量时,准确率为99%。该搜索服务可通过向mowse@daresburg.ac.uk发送电子邮件实现。为获得更多关于查询格式的细节信息,可以相该地址发送电子邮件,并在消息正文中写上“help”这个词。蛋白质氨基酸组成分析用盐酸在110 ℃将蛋白或多肽水解成游离的氨基酸,用氨基酸分析仪测定各氨基酸的含量。采用经典的阳离子交换色谱分离、茚三酮柱后衍生法,对蛋白质水解液及各种游离氨基酸的组分含量进行分析。仪器基本结构同普通HPLC相似,但针对氨基酸分析进行了细节优化(例如氮气保护、惰性管路、在线脱气、洗脱梯度及柱温梯度控制等等)通常细分为两种系统:蛋白水解分析系统(钠盐系统)和游离氨基酸分析系统(锂盐系统),利用不同浓度和pH值的柠檬酸钠或柠檬酸锂进行梯度洗脱。其中钠盐系统一次最多分析约25种氨基酸,速度较快,基线平直度好;锂盐系统一次最多分析约50种氨基酸,速度较慢,基线一般不如钠盐系统好。分析效果:从目前已知的氨基酸分析方法比较来看,除灵敏度(即最低检测限)比HPLC柱前衍生方法稍低以外(HPLC:0.5 pmol;氨基酸分析仪:10 pmol),其他如分离度、重现性、操作简便性、运行成本等方面,都优于其他分析方法。蛋白质氨基酸残基组成分析的主要步骤包括:首先是蛋白被水解为氨基酸,其次是采用离子色谱等方法进行游离的氨基酸含量和组成的分析。总之利用蛋白可以分析氨基酸,利用氨基酸也可以研究蛋白质。