Sievers精益实验室 | 同时检测制药用水的阶段1电导率和TOC
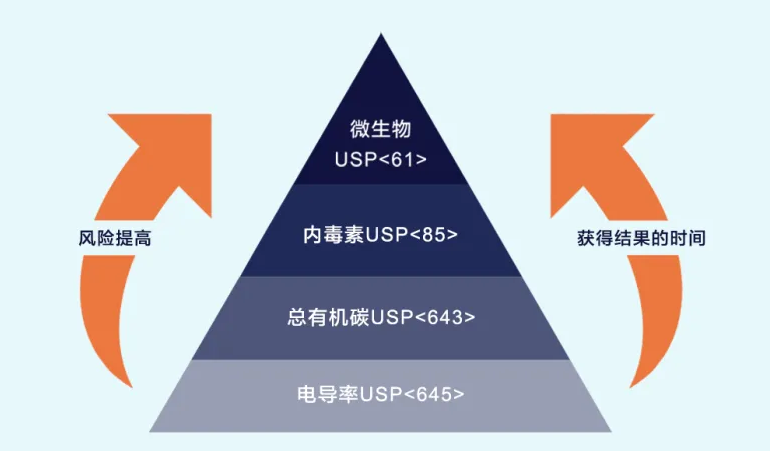
挑战自从1906年“纯净食品药物法案(Pure Food and Drug Act)”颁布以来,美国药典(USP,United States Pharmacopeia)和国家处方(NF,National Formulary)一直是美国食品药物管理局(FDA,United States Food and Drug Administration)的官方药典。1USP和NF要求检测四种制药用水,即超纯水(UPW)、注射用水(WFI)、血液透析用水、纯蒸汽水2。检测这四种水时,要求检测电导率、总有机碳(TOC,Total Organic Carbon)、内毒素、微生物限度(见图1),目的是为了保证产品的可靠性、有效性、安全性。如果检测结果达不到规则要求,就会产生各种后果,轻则被迫召回产品,重则危及患者的生命安全。因此企业高度重视和密切关注能够帮助达标的分析方法。图1:FDA/USP要求的制药用水检测图1中的各种USP规则都给出了具体的接受限值。如果检测结果满足限值,就能达标,但监管机构和行业组织更看重有助于企业深入了解生产工艺的定量检测,以及低于接受限值、但需要采取行动的数据限3。解决方案Sievers® M9 TOC分析仪达到并超过USP 规定的定量分析要求4,不仅可用于基本TOC限值的检测,还能够帮助企业深入了解生产工艺,并给出低于USP 接受限值、但需要采取行动的数据限。5M9分析仪在进行USP 达标所需的TOC定量检测时,还能同时检测阶段1电导率,以满足USP 要求。虽然电导率检测是较基本的检测,但其背后的理论具有相当高的技术性,必须加以了解。有关电导率检测的完整技术解释,以及M9分析仪如何帮助用户达到USP 要求,请参阅我们的白皮书“电导率、温度依赖性、和Sievers M9分析仪(Electrical Conductivity, Temperature Dependence, &Sievers M9 Analyzer)”。6技术总结上述白皮书:电导G是电阻R的倒数。电阻由欧姆定律定义为:其中R是电阻,V是施加电压,I是检测电流。当电阻单位是欧姆(Ω)时,电导率G的单位是西门子(S)。在检测电导率时,使用探针或让水流穿过电导池,检测已知电势差上的电流。电导率探针或电导池在已知电势差上使用两个或更多已知尺寸的电极。直接检测电流,然后计算电导。电导率是基于池常数的归一化电导值,而池常数取决于池尺寸。用手动检测仪和探头检测电导率的原理,同M9分析仪检测穿过电导池的样品流电导率的原理一样(见图2)。从前人们用耗时的手动检测仪和探头来检测电导率,现在用M9分析仪的电导池来检测电导率,虽然两者的技术原理相同,但后者实现了自动化检测,能快速、高效、可靠地完成达标检测。 图2:(A)手动检测仪和探头,(B)M9分析仪的电导池USP 和M9分析仪M9分析仪电导池的性能达到并超过USP 规定的所有的仪器规格和操作参数。M9分析仪通过同时检测非温度补偿样品电导率和温度,来检测阶段1电导率。M9分析仪还提供美国药典(USP)、欧洲药典(EP)、中国药典(CP)、印度药典(IP)的接受标准的列表。有关M9分析仪电导池的准确度、精确度、范围、线性等规格,请参阅表1和图3。7表1:M9分析仪电导率规格图3:M9分析仪的电导率线性USP 还规定了电导率检测的三个阶段:阶段1、阶段2、阶段3。只有阶段1可以在实验室离线或生产流程在线的运行模式下完成。阶段1也是最简单的检测,但它的合格/不合格标准最严格。“阶段1适用于在线检测,也可以在适用容器中离线进行。”- USP 对于离线的阶段1电导率检测,用户只需检测适用容器中的样品温度和原始电导率。USP 按温度索引提供了合格/不合格标准列表。如果样品未能通过阶段1电导率检测,则必须进行额外检测(即阶段2和阶段3检测),以确定过高的电导率是否出自内在因素,如大气中的CO2,或外部离子。在必要的程序步骤中,阶段2电导率检测更要求规范性。操作员必须剧烈搅拌样品,同时使样品的温度保持在25º +/-1º C,直到电导率变化小于每5分钟0.1 μS/cm。等电导率读数稳定后,检测值不得大于2.1 μS/cm,方能通过阶段2检测。用手动检测仪和探头进行阶段2电导率检测的耗时为:每个样品可花费长达30分钟。8对于制药厂来说,最理想的情况是在阶段1电导率检测中达到USP 要求,这时需要的操作最简单,检测每个样品的时间最短。实现自动化的USP 检测之后,就能节省大量时间,并提高数据的可靠性和安全性。适用容器除了考虑M9分析仪电导池的性能之外,还需考虑用于电导率检测的适用容器。USP 特别提到了“适用容器(Suitable Container)”一词,但未具体说明什么样的容器是适用的。9在容器中同时检测阶段1电导率和TOC时,要求容器对电导率或TOC没有任何显著影响。M9分析仪使用“电导率与TOC两用样品瓶(DUCT,Dual Use Conductivity and TOC)”,能够自动进行USP 和的达标检测10。DUCT样品瓶是有专利技术的涂层玻璃样品瓶,带专用瓶盖,已被证明不仅适用于电导率和TOC检测,而且优于目前业界使用的其它许多容器。11结果1111111FDA和USP将TOC和电导率定为制药用水质量保障的四个关键属性中的两个。但这两种属性参数的手动实验室检测需要耗时数小时之久。用手动检测仪和探头检测阶段2电导率所需要的时间为每样品最长30分钟,而且不包括TOC检测。如此耗时的检测过程包括:检测样品、记录数据、等待审核和批准。当自动同时检测阶段1电导率和TOC时,以后就无需再检测电导率,从而节省时间。美国的一家跨国生物技术公司采用能够同时检测TOC和电导率的方案,以提高效率、简化流程、并能将检测结果导出到实验室信息管理系统(LIMS,Laboratory Information Management System)。12这家跨国生物技术公司用M9分析仪和单个DUCT样品瓶来同时检测阶段1电导率和TOC,5年的投资回报率(ROI,Return On Investment)达400%,投资回收期仅为7个月,项目的5年净现值约为40 万美元。ROI最引人注目的地方是,尽管使用DUCT样品瓶增加了些许耗材成本,但每个样品检测的时间和样品数量都有所减少,总成本大大降低。此例很好地说明了,用户用M9实验室型TOC分析仪同时检测TOC和USP阶段1电导率,能节省大量时间和资金,并提高生产工艺质量。在此情况下,用户就能将节省下来的资源用于他处,从而提高总体生产效率。12本文只展示了用M9分析仪在实验室离线模式下检测阶段1电导率。但实验室环境并非唯一选项。按照FDA“ 过程分析技术( PAT , Process Analytical Technology)”指南的规定,用于检测阶段1电导率的M9分析仪也提供便携式配置,可用于旁线(at-line)检测;还提供在线(on-line)配置,可实现最佳工作效率。Sievers为用户的水质和清洁应用提供完善的解决方案、技术服务和支持。从仪器、标样、样品瓶,到技术服务、设备维护、技术支持,Sievers都能满足用户的一切需求。感谢您选择Sievers作为您的解决方案。◆ ◆ ◆联系我们,了解更多!参考文献1.USP and FDA Working Together to Protect Public Health, 2017. Retrieved Jan 19, 2018, from http://www.usp.org/about/public-policy/usp-fda-roles2. Water for Pharmaceutical Purposes, 2007. Retrieved Jan 19, 2018, from https://www.geinstruments.com/sites/default/files/pdf_test/reg_USP_1231_water_for_pharmaceutical_purposes.pdf3. 3. Validation of Compendial Procedures, 2007. Retrieved Jan 19, 2018, from https://www.geinstruments.com/sites/default/files/pdf_test/reg_USP_1225_validation_of_compendial_procedures.pdf.4. Sievers M-Series Performance Specifications, 300 00290, 2015. Retrieved Jan 19, 2018, from https://geinstruments.com/down-media?f_id=262.5. 5. Total Organic Carbon, 2008. Retrieved Jan 19, 2018, from https://www.geinstruments.com/down-media?f_id=1404.6. Electrical Conductivity, Temperature Dependence, & GE M9 Analyzer, 300 00322, 2016. Retrieved Jan 22, 2018, from https://geinstruments.com/down-media?f_id=42654.7. Sievers M9 TOC Analyzers, 300 00064, 2017. Retrieved Jan 19, 2018, from https://geinstruments.com/down-media?f_id=325.8. 8. Water Conductivity, 2008. Retrieved Jan 23, 2018, from https://www.geinstruments.com/down-media?f_id=1405.9. Reserve Sample Bottles for Conductivity and TOC, 300 00299, 2015. Retrieved Jan 23, 2018, from https://geinstruments.com/down-media?f_id=268.10. Selecting the Best TOC Sample Vial for Your Application, 300 00331, 2016. Retrieved Jan 23, 2018, from https://geinstruments.com/down-media?f_id=277.11. DUCT Vial Performance and Stability, 300 00297, 2015. Retrieved Jan 23, 2018, from https://geinstruments.com/down-media?f_id=266.12. Improved efficiency and lower costs using simultaneous testing for TOC and conductivity, 300 00326, 2018. Retrieved Jan 23, 2018, from https://geinstruments.com/down-media?f_id=42078.