四种类型超敏反应发生的机制不同,同一抗原也可在不同条件下引起不同类型的超敏反应。四种类型超敏反应的免疫检测方法有所不同。I型超敏反应主要检测过敏原和测定血清特异性IgE.Ⅱ型超敏反应的检测重点是抗血细胞抗体。Ⅲ型超敏反应主要检测循环免疫复合物。Ⅳ型超敏反应可用皮肤试验来检测。 一、过敏原皮肤试验 皮肤试验简称皮试,是在皮肤上进行的体内免疫学试验。当试验抗原进入致敏者皮肤时,皮肤中结合有IgE的肥大细胞或致敏T细胞就会与试验抗原结合,引发即刻型或迟发型的皮肤超敏反应。试验抗原也可从注射部位进入微血管,与循环中的相应抗体结合,形成的免疫复合物可在局部沉积,激活补体引起炎症。所以皮肤试验主要用于检测I型和Ⅳ型变态反应,有时也用于检测Ⅲ型变态反应。 (一)试验准备 首先应当制备试验用抗原,如有合格商品可直接购买。可以作为变应原的物质种类繁多,例如动物皮毛、家禽羽毛、鸽粪、昆虫、螨类、真菌、花粉、杂草、物理粉尘和各种食品等都可能成为变应原。 不同抗原的制备方法不同,但一般包括以下几个步骤:①收集原料;②粉碎与匀浆;③脱脂与提取;④过滤与分离;⑤分装保存。分装保存之前应对提取产物进行鉴定。首先必须经过无菌试验、急性毒性试验和热原检查,保证提取产物无明显的毒副作用;还要测定产物的蛋白含量,用凯氏定氮法或磷钨酸沉淀法标定出总氮单位或蛋白氮单位。 试验部位应清洗干净,严格消毒,以免皮肤的不洁物引起非特异性反应或感染。当皮肤患湿疹、感染、皮炎或外伤时不宜进行皮肤试验。正在或近日服用免疫抑制剂或抗组胺药物者也不宜进行皮肤试验。
北京易斯威特生物医学科技有限公司产品介绍 铁蛋白(FER)检测试剂盒 (胶体金法)1.国内第一家免疫层析法检测FER的产品。2.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的铁蛋白,适用于急性贫血,肝脏损伤等相关疾病的辅助诊断3.最快速准确的辅助诊断方法。4.血清铁蛋白是血液去铁蛋白和铁核心Fe3+形成的复合物。是检查体内铁缺乏的最灵敏的指标。血清铁蛋白测定在临床上常用于缺铁性贫血的诊断。简单 便捷 快速 灵敏 环保 肌红蛋白/肌酸激酶/心肌肌钙蛋白I,心梗三项检测试剂盒(胶体金法)1.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的肌红蛋白,肌酸激酶,心肌肌钙蛋白I检测,用于临床快速诊断急性心肌梗塞(AMI).2.最快速准确的辅助诊断方法。3.肌红蛋白:是心肌梗死的标志物,增高表示冠状动脉堵塞引起心肌严重缺血造成心肌梗死;4.肌钙蛋白:是一种心肌蛋白,升高见于心肌损伤,多见于心肌梗死,也见于心肌炎和心肺复苏后患者,特异性较高,阳性的话一般可确诊心肌损伤,阴性的话不能排除,因为肌钙蛋白的升高出现在心肌梗塞3-6小时之后,之前可能出现阴性。肌酸激酶敏感性较高,特异性较低,升高也出现在心梗3-8小时之后。5.肌酸激酶:主要存在于骨骼肌和心肌,在脑组织中也存在,是参与体内的能量代谢的一种酶。在临床上主要用于诊断心肌梗塞。心肌梗塞患者发病后2-4小时,血液中此酶活动即开始升高。比血清中谷草转酸酶和乳酸脱氢酶的活力变化都出现得早。 简单 便捷 快速 灵敏 环保 C反应蛋白(CRP)检测试剂盒(胶体金法)1.国内第一家免疫层析法检测CRP的产品。2.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的C反应蛋白,适用于感染,炎性疾病,组织损伤,手术创伤及组织坏死等病变情况的辅助诊断3.最快速准确的辅助诊断方法。4.是一种能与肺炎球菌C多糖体反应形成复合物的急性时相反应蛋白。可用于细菌和病毒感染的鉴别诊断简单 便捷 快速 灵敏 环保
铁蛋白,C反应蛋白,心肌三项检测试剂北京易斯威特生物医学科技有限公司产品介绍 铁蛋白(FER)检测试剂盒 (胶体金法)1.国内第一家免疫层析法检测FER的产品。2.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的铁蛋白,适用于急性贫血,肝脏损伤等相关疾病的辅助诊断3.最快速准确的辅助诊断方法。4.血清铁蛋白是血液去铁蛋白和铁核心Fe3+形成的复合物。是检查体内铁缺乏的最灵敏的指标。血清铁蛋白测定在临床上常用于缺铁性贫血的诊断。简单 便捷 快速 灵敏 环保 肌红蛋白/肌酸激酶/心肌肌钙蛋白I,心梗三项检测试剂盒(胶体金法)1.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的肌红蛋白,肌酸激酶,心肌肌钙蛋白I检测,用于临床快速诊断急性心肌梗塞(AMI).2.最快速准确的辅助诊断方法。3.肌红蛋白:是心肌梗死的标志物,增高表示冠状动脉堵塞引起心肌严重缺血造成心肌梗死;4.肌钙蛋白:是一种心肌蛋白,升高见于心肌损伤,多见于心肌梗死,也见于心肌炎和心肺复苏后患者,特异性较高,阳性的话一般可确诊心肌损伤,阴性的话不能排除,因为肌钙蛋白的升高出现在心肌梗塞3-6小时之后,之前可能出现阴性。肌酸激酶敏感性较高,特异性较低,升高也出现在心梗3-8小时之后。5.肌酸激酶:主要存在于骨骼肌和心肌,在脑组织中也存在,是参与体内的能量代谢的一种酶。在临床上主要用于诊断心肌梗塞。心肌梗塞患者发病后2-4小时,血液中此酶活动即开始升高。比血清中谷草转酸酶和乳酸脱氢酶的活力变化都出现得早。 简单 便捷 快速 灵敏 环保 C反应蛋白(CRP)检测试剂盒(胶体金法)1.国内第一家免疫层析法检测CRP的产品。2.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的C反应蛋白,适用于感染,炎性疾病,组织损伤,手术创伤及组织坏死等病变情况的辅助诊断3.最快速准确的辅助诊断方法。4.是一种能与肺炎球菌C多糖体反应形成复合物的急性时相反应蛋白。可用于细菌和病毒感染的鉴别诊断简单 便捷 快速 灵敏 环保
求助:有什么仪器可以检测啤酒检测啤酒敏感蛋白和敏感多酚的仪器?
原理:C-反应蛋白(C-Reactive protein,简称CRP).早于1930年发现,是一种能与肺炎球菌C多糖体反应形成复合物的急性时相反应蛋白.CRP的检测在八十年代以前作为炎症和组织损伤的非特异性标志物大量应用于临床.问题:由于过去CRP的检测方法较为落后,假阳性和假阴性很高,影响了它在临床上的价值,而逐渐被临床所忽视. 前景:解决假性,前途无量!
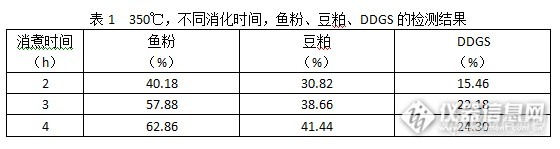
1 设备凯氏定氮蒸馏仪消化炉2 原理试样在催化剂存在下用硫酸消解,反应产物用碱中和后蒸馏。释放出的氨被硼酸溶液吸收,吸收液用硫酸溶液滴定,测定氮含量并计算粗蛋白质含量。3 实验步骤蛋白质的测定常用凯氏定氮法进行检测。凯氏定氮法主要包括试样的消煮、氨的蒸馏、滴定三个环节。本实验主要研究试样的消煮对蛋白质的检测结果的影响。4 消煮时间和温度对检测结果的影响采用温度分别420℃和350℃,时间分别为2h、3h、4h的消化条件,对鱼粉(高蛋白质含量)、豆粕(中蛋白质含量)、DDGS(低蛋白质含量)三种样品进行检测分析。详细如表1和表2。http://ng1.17img.cn/bbsfiles/images/2015/12/201512162213_578369_2721667_3.pnghttp://ng1.17img.cn/bbsfiles/images/2015/12/201512162213_578370_2721667_3.png 4.1 消煮时间对蛋白质的检测结果的影响从表1和表2中可以明显看出,相同消煮温度下,样品的消煮效果随着消煮时间的延长而提高。4.2 消煮温度对蛋白质的检测结果的影响从表1和表2中可以明显看出,相同消煮时间下,样品的消煮效果随着消煮温度的提高而提高。5 结论蛋白质的检测需要足够的消煮时间和温度。建议按420℃消煮4h。6 参考文献 GBT6432-1994 饲料中粗蛋白测定方法
各位网友,在下想征集真蛋白的检测技术。80年代,曾有2种蛋白检测技术的诞生(可能不止两种,请大家集思广益),一种是凯氏定氮法,一种是杜马斯燃烧法。目前我们用的最多的是凯氏定氮法。 大家都知道,这两种方法都是以氮元素的量乘以相应的系数,得出蛋白的含量,是粗蛋白的含量。2008年的三鹿奶粉事件,就是因为不能检测真蛋白而发生的。 现在小弟在这个帖子中,征集各位大侠的检测方案。要求: 原理: 使用仪器: 检一个样的时长: 注意:每发一种新的检测帖,奖励30分,与楼上重复的不得分。各位先到先得了!http://simg.instrument.com.cn/bbs/images/default/em09502.gif==============================================非常感谢:hhciq对本帖的大力支持!送http://simg.instrument.com.cn/bbs/images/brow/em23.gifhttp://simg.instrument.com.cn/bbs/images/brow/em23.gifhttp://simg.instrument.com.cn/bbs/images/brow/em23.gifhttp://simg.instrument.com.cn/bbs/images/brow/em23.gifhttp://simg.instrument.com.cn/bbs/images/brow/em23.gifhttp://simg.instrument.com.cn/bbs/images/brow/em23.gif,感谢xujing0202520的补充。现将hhciq及xujing0202520的回帖整理如下:请hhciq把把关,看有没有什么重复的。1、采用化学发光方法, 结合有效氮吸收装置,测定饲料中的粗蛋白质。静态注射化学发光法选用2.0×10-4mol/L的Luminol溶液,用量为2.00ml,待测液的用量为2.00ml。静态注射化学发光法简化了测试方法,缩短了时间,加标回收率为86.91%~104.60%,RSD5%(n=5),适用于饲料生产部门的质量控制。 2、反相高效液相色谱法 反相高效液相色谱法通常采用低离子强度酸性有机冲洗液和烷基硅胶键合固定相, 影响分离的因素主要有流动相组成、洗脱湿度、洗脱液p H值、离子对试剂和流速等; 有利于分离的条件是低 p H值、流动相、室温或较高的温度及使用乙腈或异丙醇作为有 机部分,三氟乙酸 ( T F A)对于蛋白质及气相色谱公认是一种较好的流动相添加剂。 蛋白质的保留性质和选择性还与键合固定相的性质有关, 采用大孔硅胶和短链烷基 键合固定相在蛋白质分离中具有优势。3、正交轴逆流色谱法是新近发展起来的一种方法。 具体是:以n l ( 质量分数为 1 2 . 5 % 的P E G 8 0 o 0 ) :n l( 质量分数为2 5 %的磷酸氢二钾)=1 :1 或i n( 质量分数为 1 2 . 5 %的 P E G 8 0 0 0 ) : m ( 质量分数为3 0 % 磷酸氢二钾) =1 :1 为溶剂系统,以下相作流动相,上相 作固定相,操作时采用5 0 0 r / m i n的转速和6 0 0 ml / h的流动相流速。该方法在分离度不大 的基础上提高了进样量,适用于分离天然生物大分子。4、微乳液毛细管电动色谱分离法 ( ME E K c) 微乳液毛细管电动色谱分离法是在胶束电动色谱 ( ME K c)基础上发展起来的,在E K C中,分离载体为离子胶束,它由表面活性剂组成,不同的表面活性剂构成不同的胶束,因而具有不同选择性,若以水包油微乳液作为分离载体,则称之为ME E K C法, 该法是一种新型的分离技术,目前多用于小分子中性物质的分离。5、毛细管电泳法 电泳一直是研究蛋白质的重要方法。毛细管电泳除了具备凝胶电泳的高分辨力以 外,以其快速、定量、重复性好。灵敏度高及自动化程度高等诸多优点在近几年内成为 蛋白质分离分析一项崭新且重要的技术。 其分离机理是根据被分离物质的泳动率不同而 将其分开,毛细管电泳仪就是基于这个原理而设计的自动化分离分析样品的仪器,由于 毛细管电泳刚兴起,目前主要应用的模式仍是自由溶液毛细管电泳,虽然此法具备多项 优点,但仍有不足之处。首先它不能用于制备分离,再者当样品较稀时不能象H P L C那 样进样较多体积,使样品吸附在柱上,然后洗脱下来。 6、毛细管导电聚焦法 ( C mF ) C l E F法可用于分离等电点 ( P I )相差0 . 1 2 p H单位的蛋白质,其基本步骤是:先在 毛细管内对蛋白质进行等电聚焦,然后对分离的蛋白质区带进行检测,按照迁移技术的 不同,分离方法可分为两步法、一步法、固定区带法。C l E F分离蛋白质应先解决基本 问题:消除或减少电渗的涂层方法、检测方法和条件,蛋白质区带的迁移及 P I测定方法,影响C I E F分离效能的因素,两性电解质的组成和浓度、毛细管长度、聚焦电压等。 7、反胶团萃取法 反胶团萃取分离蛋白质是一种新型的有发展前途的生物产品的分离技术。 它是利用 表面活性剂在有机溶剂中形成反向胶团,从而实施了对蛋白质的有效萃取,是表面活性 剂在生物工程中的一种成功应用。8、累加进样分离法 它是指导蛋白质在梯度开始后的一段时间内可以多次重复进样而其保留值无可觉 察的变化的方法。实验证明:在洗脱液远离突跃点时,蛋白质可以多次重复进样而其保 留值与常规分离无明显的变化。 这种累加进样分离法在蛋白质的制各纯化中有重要的应 用价值,它可以提高有效柱容器,节省大量时间和消耗,在一次色谱分离中完成聚集和 分离两步操作,可用分析型仪器制各数量较大的样品。9、凯氏( K j e l d a h 1 ) 定氮法 将被测试的样品与浓硫酸在硫酸铜和硫酸钾存在下共热消化, 含氮有机物即分解产生氨、二氧化碳和水, 氨与硫酸反应变成硫酸铵。消化后向消化液中加入强碱碱化使之分解放出氨,用水蒸气将氨蒸至硼酸液中, 用标准强酸溶液滴定收集氨的硼酸溶液, 即可计算出样品的氮含量, 从而折算出样品的蛋白质含量( 通常由含氮量乘以系数 6 . 2 5计算出( 该系数为蛋白质平均含氮量的倒数) , 乳制品通过乘以系数 6 . 3 8计算出( 该系数为乳制品中蛋白质含氮量的倒 数) ) 。这种方法是K j e l d a h l 在 1 8 8 3年发明的, 当时他只使用硫酸分解试样, 测定谷物中的蛋白含量, 需要较长的反应时间。后来 G u n n i n g 搞清楚了消化机理, 在消化时加入 K s O 使反应温度由原来的3 8 0 ~ C( 硫酸沸点) 上升到4 0 0 ~ C, 并加入硫酸铜为催化剂, 提高了消化速度, 改进了凯氏定氮法。该方法的缺点是耗时长, 灵敏度低, 样品中的含氮化合物会影响蛋白含量的测定。要想准确测定出蛋白含量, 可以先测定出总含氮量。再用三氯乙酸将样品溶液中的蛋白沉淀除去, 然后测定溶液的非蛋白含氮量, 最后从总含氮量中扣除非蛋白含氮量就可以比较准确地测定出样品的真正蛋白含量。10、
牛奶蛋白质分析仪可以用于检测乳蛋白制品。以下是详细解释和相关信息: 功能与应用:牛奶蛋白质分析仪是一种专门用于分析牛奶及其制品中蛋白质含量的仪器。它基于先进的生化分析技术,如比色法、光谱法或电化学法等,能够准确、快速地检测样品中的蛋白质含量。 乳蛋白制品的检测:乳蛋白制品,如奶粉、酸奶、奶酪等,其蛋白质含量是产品质量和营养价值的重要指标。牛奶蛋白质分析仪可以有效地检测这些乳蛋白制品中的蛋白质含量,为生产厂家提供准确的质量控制手段。 优点与特点: 准确性高:牛奶蛋白质分析仪具有高灵敏度和高准确性,能够确保测量结果的可靠性。 快速便捷:该仪器操作简单,使用方便,可以快速得出测量结果,提高检测效率。 适用范围广:除了牛奶及其制品外,还可以用于其他含蛋白质样品的检测,如豆类制品、肉制品等。 在乳品工业中的重要性:随着乳品市场的不断扩大和消费者对乳制品质量要求的提高,牛奶蛋白质分析仪在乳品工业中的重要性日益凸显。它可以帮助乳品企业提高产品质量、降低生产成本,同时为消费者提供更加安全、健康的乳制品。 综上所述,牛奶蛋白质分析仪是一种功能强大、应用广泛的检测仪器,完全可以用于检测乳蛋白制品中的蛋白质含量。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/05/202405271615421543_8284_6238082_3.jpg!w690x690.jpg[/img]
我想检测兔子全血的血红蛋白,不知道那个公司有这方面的试剂盒?如果我用血红蛋白计测量,xk-2血红蛋白计怎么样啊?还有就是全血的血红蛋白和血浆的血红蛋白的差别到底在哪啊?请各位老师指教!!
将在药物开发进程中发挥重要作用2011年03月26日 来源: 科技日报 作者: 常丽君 本报讯 据每日科学网近日报道,美国范德堡大学研究人员开发出一种新型激光技术,可检测细胞膜上的蛋白质和其它多种生物分子之间的相互反应。这种检测将在药物开发进程中发挥重要作用。 人类细胞中约有7000种蛋白质,其中30%在细胞膜上,控制细胞分子运作机制的信号有60%—70%由这些膜蛋白产生,因此当前市场上约一半的药物都是瞄准细胞膜蛋白。但因为膜蛋白很难提纯,科学家在研究它们的结构时面临很多困难。现有的检测膜手段大多是将膜蛋白从其所处环境中分离,或用不同方式如荧光标签加以修改,以分析它们的活性。这些方法不仅昂贵耗时,还可能会影响目标膜蛋白的功能。 范德堡大学化学生物研究院化学教授达里尔·波恩霍普领导的研究小组和斯克里普斯研究院合作,开发了一种名为“后向散射干涉仪”(BSI)的新型激光技术,能精确检测出膜蛋白和自然界中各种分子之间的结合力。 BSI操作起来很简单,只要把两种分子混合装入一个充满液体的显微镜小盒中,用一束类似于条形码扫描仪的红色激光照射,就能测出它们之间的结合力。小盒的几何形状调整合适后,激光就会产生干涉图案,而这种干涉图案对分子之间的反应非常敏感。如果分子开始互相作用,图案就开始变换。 为了检验BSI的准确性,研究人员制造了一种含有GM1小蛋白质的合成膜,霍乱毒素要进入细胞,主要结合对象就是这种小蛋白质。他们把霍乱毒素B和这些膜混合,检测出的结合力结果与用其他方法所得到的结果一致。为了进一步确认,他们还用了一种和胸腺癌相关的天然分离膜和3种分别与疼痛、发炎和神经传导素GABA(用于放松、睡眠和调节紧张)相关的蛋白质膜进行检验,把包含这些蛋白质的膜和对应结合分子相混合,用BSI技术测得的值也和用其他方法得到的结果一样。 此外,该技术进入商业化也前景广阔,范德堡大学对新型激光检测技术已申请了专利,并已获得3项批准。他们还专门成立了一家分子传感公司对新技术进行独家开发。
1、C反应蛋白概述 1930年Tillet和Francis在急性大叶性肺炎患者血清中发现一种物质,能在钙离子存在时与肺炎球菌C-多糖起沉淀反应,随后证实这种能与C-多糖反应的物质是一种蛋白质,因而将这种蛋白质命名为C反应蛋白(C-reactive protein,CRP)。 CRP是机体受到微生物入侵或组织损伤等炎症性刺激时肝细胞合成的急性相蛋白(注:急性时相反应包括感染、炎症及创伤时某些血清蛋白浓度的变化,这些蛋白除CRP外,还包括血清淀粉样蛋白A、纤维蛋白原、触珠蛋白、α1酸性糖蛋白、铜蓝蛋白、α1抗胰蛋白酶等。其中CRP在健康人血清中浓度<5mg/L,而在细菌感染或组织损伤时,浓度可升高上千倍,循环中的CRP半衰期为19小时,故被认为其最有价值),由五个相同的亚基依靠非共价键形成的环状五聚体,这一特征性结构使其归类于五聚素(一组具有免疫防御特性的钙结合蛋白)家族。CRP是机体非特异性免疫机制的一部分,它结合C-多糖,在Ca2+存在时可结合细胞膜上磷酸胆碱,可激活补体的经典途径,增强白细胞的吞噬作用,调节淋巴细胞或单核/巨噬系统功能,促进巨噬细胞组织因子的生成,在动脉粥样硬化斑块中也可检测到CRP。 人CRP主要生物学功能: 通过与配体(凋亡与坏死的细胞,或入侵的细菌、真菌、寄生虫等的磷酰胆碱)结合,激活补体和单核吞噬细胞系统,将载有配体的病理物质或病原体清除。 (1)识别外来物质,激活补体系统; (2)增强条理作用,增强吞噬细胞吞噬作用; (3)与血小板激活因子(RAF)结合,降低炎症反应; (4)与染色体结合,消除坏死组织里的细胞DNA。
真蛋白如何检测?
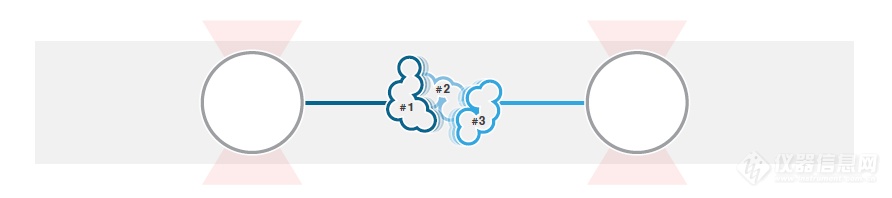
[b]研究多结构域蛋白阶段性去折叠[/b]很多生物大分子的功能与其构象和构象动力学密切相关,如蛋白质的生物功能需要其正确折叠成自然形态。错误折叠或者未折叠的蛋白会(部分)失活或者产生毒性,如错误折叠的蛋白与神经退行性疾病有关。研究蛋白如何正确折叠并改变构象以实现生物功能对理解其机制与疾病发生至关重要。单分子力谱(SMFS)是研究这些分子现象的理想工具,因为其具有独特的分离个体生物分子和实时观察构象变化及去折叠过程的功能。由于SMFS具有高敏感度和施加机械力的能力,可以直接操纵单个蛋白并通过测量其长度变化(亚nm级)观察构象改变。接下来我们使用LUMICKS开发的高分辨率光镊-荧光显微镜C-Trap演示了对钙调蛋白(CaM)的折叠过程的研究。[img=,500,110]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021105519876_1986_981_3.png!w690x153.jpg[/img][img=,218,200]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021106425366_604_981_3.png!w217x199.jpg[/img]1 多结构域蛋白的去折叠实验图解。具有3个结构域的蛋白通过DNA连接至两个被光所捕获的微球。2 通过改变光阱之间的距离可以对蛋白施力并检测断裂的发生。使用层流微流控和自动装载功能,N-端和C-端连接有DNA的单个CaM蛋白可被两个微球捕获(图1)。[img=,227,200]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021108116955_1942_981_3.png!w220x193.jpg[/img]3 10 mM Ca2+浓度下CaM的力-拉伸距离(蓝色)和力-收缩距离(红色)。拉伸与收缩的速度为100 nm/s。微球直径为1.0 μm,光阱的刚度为0.284 pN/nm。[img=,500,161]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021108223351_3734_981_3.png!w638x206.jpg[/img]4 10 mM Ca2+浓度下CaM的多个状态下的动态平衡。图为50 kHz(灰色)和200 kHz(红色)下记录的数据。在右侧直方图中可以看到两个清晰的峰即表现为蛋白最常处于的两个状态。第一个实验,在10 mM Ca2+条件下对CaM的机械拉伸与收缩行为进行了记录。首先对100 nm/s的速度下的拉伸与收缩的相关数据进行了记录(图3)。随着施加的力增加,可观察到两个去折叠的阶段,表现为力的突然下降,与两个螺旋-环-螺旋结构域的去折叠相符合。由此可以得出结论,基于C-Trap设备的力和距离的高分辨率(100 Hz时误差在0.2 pN以下和0.5nm以下),去折叠的发生可以用力谱的力-距离曲线来确定。这种测量非常适合用于比较正常蛋白与发生了改变或损伤的蛋白的折叠的相关数据。接下来研究光阱位置固定时CaM的折叠、去折叠的动态平衡,对蛋白长度的变化进行测量并确定中间态的转变(图4)。对CaM分子施加7.5 pN的力,可以观察到三种状态之间的波动,反映了螺旋-环-螺旋亚结构域的折叠和去折叠,波动的数据图像与之前的研究1,2相符(图4)。仪器所获得的稳定的高质量数据为蛋白的折叠和去折叠之间的动态转变的检测提供了大量有效的信息。通过这种方法可以对不同状态的驻留时间和转变动力学进行测量。这些信息使得我们对特定蛋白的折叠、去折叠过程产生进一步的了解。对折叠和去折叠的动力学以及构象改变的研究表现了一种突破性的生物学和生物物理学研究方法。使用C-Trap光镊-荧光技术可以观察到折叠和去折叠现象还有动态平衡,使得科研人员可以研究去折叠的中间态并获得蛋白的结构与功能信息。对蛋白折叠和构象的进一步研究仰仗于C-Trap的高敏感度和多通道荧光单分子FRET功能,通过检测FRET效率信号与力的波动的变化来进一步检测蛋白构象,可以得到蛋白的机械性质与结构之间的关系。[b][/b]
中国科技网伦敦9月20日电 英国科学家在最近一期《临床调查杂志》上刊发论文称,他们利用新的检测技术证明,导致亨廷顿病的有害蛋白是逐渐在血液细胞中积累起来的。他们在论文中对这些有害细胞是如何损害人的大脑进行了详细阐述,而这一新发现不仅有助于监测亨廷顿病的进展情况,也有助于开发抑制有害蛋白的新药。 亨廷顿病是一种致命的遗传神经疾病。患者由于基因突变导致机体细胞错误地制造一种名为“变异亨廷顿蛋白”的有害物质,这些异常蛋白会损坏部分脑细胞,导致患者神经系统逐渐退化,致使身体出现不可控制的抽搐,并能发展成痴呆,最后导致死亡。 发表论文的研究小组由英国伦敦大学学院、伦敦国王学院以及诺华生物医学研究所的研究人员组成。他们使用一种新的超敏测试技术测量亨廷顿病患者发病不同阶段体内变异亨廷顿蛋白的水平。这种测试技术名为时间分辨荧光共振能量转移(TR-FRET),可对变异亨廷顿蛋白进行极为精确的测量。研究人员发现,在亨廷顿病患者表现出相关症状之前,其体内变异亨廷顿蛋白即开始逐渐积累,而正常的亨廷顿蛋白含量则在整个发病过程中保持不变。核磁共振扫描显示,亨廷顿病患者脑萎缩的速度明显高于常人。而令研究人员惊讶的是,变异亨廷顿蛋白在白血细胞中的数量与脑萎缩的速率极为一致。这一发现表明,未来或许可以利用血检来预测神经退行性疾病患者脑萎缩的速度。 “使用TR-FRET技术测量变异蛋白水平,是治疗亨廷顿病的一个十分有用的新手段,”研究小组的领导者,伦敦大学学院的萨拉·塔布利兹教授说,“如今获得患者的血液样本很方便,这使得我们能够准确地研究变异亨廷顿蛋白的毒性。而变异亨廷顿蛋白水平与脑萎缩间的关联,使我们对亨廷顿病患者大脑退化的过程有了更新的了解。” 塔布利兹教授指出,TR-FRET技术对于未来基因沉默药物的临床试验也十分有用。她表示,基因沉默药物可用来抑制大脑中有毒蛋白的产生,十分有前途,但也极有可能产生副作用,因此了解药物降低变异亨廷顿蛋白水平的过程十分重要。而TR-FRET技术则提供了这样的手段,这对于新药的开发十分有利。(记者刘海英) 《科技日报》(2012-09-22 二版)
核酸蛋白检测仪是层析分析的主要装置,核酸蛋白检测仪配上层析柱、恒流泵、部分收集器、层析谱分析系统(根据需要选配)和电脑打印设备即构成一套完整的核酸蛋白检测仪分离层析系统。它是当今从事生命科学研究、药物测定、化工、食品科学及医学研究等行业的现代分析实验仪器。核酸蛋白检测仪分析系统广泛用于工业、农业、科研和大专院校的科学研究和教学实验。其原理是根据物质(样品)对紫外光有明显吸收的特征,实现对样品成份含量比对分析,以便进行样品蛋白、核酸物质识别检测和含量测定。在生化分析、环保科学、食品研究、毒理研究、新药开发等领域中对核酸、蛋白检测、纯化和提取提供了一种独特的分析手段。
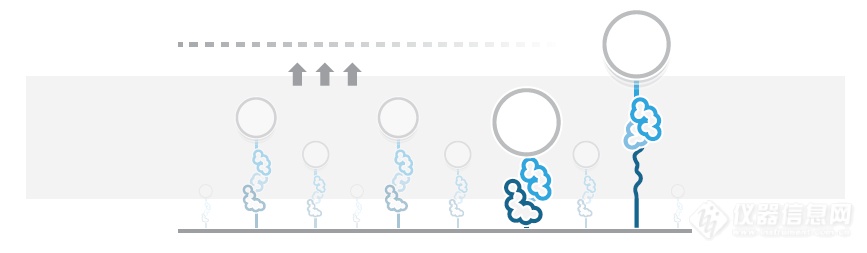
[b]使用声力研究蛋白去折叠[/b]单分子力谱(SMFS)技术是研究蛋白结构与蛋白去折叠中的生物力学性质的有力工具。SMFS能够为研究和药物开发提供有价值的信息。SMFS有助于揭示人类疾病病理的分子机制,而机制往往被认为与错误折叠的蛋白的形成和积聚有关,如阿茲海默症和帕金森氏症。然而现有的SMFS仪器缺少同时并行研究多个蛋白去折叠的功能,使得研究过程耗时很长。使用声波来对数以百计的生物分子施力并操控是非常理想的高通量研究方法。此案例中,声力谱学(AFS)是最新的用于研究蛋白去折叠的单分子操控方法。[img=,500,145]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021031435408_23_981_3.png!w690x201.jpg[/img]1 AFS检测蛋白去折叠的图解。蛋白一端栓住玻璃表面,另一端拴住聚苯乙烯微球。[img=,400,238]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021032257008_8827_981_3.png!w421x251.jpg[/img]2 对视野范围内被蛋白分子拴在玻璃表面的4.5 μm聚苯乙烯微球同时成像。物镜放大倍数为20x。AFS设备使用压电元件共振激发平面声阱穿过微流控芯片。共振波对与周围介质密度不同的微球施力,每个生物分子被单独地由微球拉伸(图1)。仪器可以实时并行操控视野范围内数以百计的微球,获得大量的数据以研究每个生物分子的随机与异质行为(图2)。在Yan Jie(NUS)的实验室的这项试点研究中,我们首次展示了AFS如何对蛋白施力并操控。实验对踝蛋白施力引发(去)折叠同时以高精确度记录蛋白的拉伸。踝蛋白属于机械敏感性大分子,在调控蛋白粘附于胞外基质中起作用。踝蛋白是细胞代谢过程和信号通路中的关键,并能够在力的作用下改变构象,在单分子生物物理学中备受关注。[img=,500,156]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021033524578_3892_981_3.png!w679x212.jpg[/img]3 使用AFS得到的单个踝蛋白分子的去折叠曲线,力变化速率为1 pN/s。轨迹在500 Hz下获得(彩色点),并平衡至50 Hz(黑色线)。3a 单个踝蛋白多次拉伸的力-距离曲线。3b 单个拉伸循环的力-距离曲线。3c 图3b中分子的时间-距离曲线。在这项研究中,连接了DNA的踝蛋白拴在聚苯乙烯微球和玻璃表面。启动声波后形成平面声阱,连接了踝蛋白的微球受到朝向声阱的力。实验中通过调节声波的振幅来改变力的大小。逐渐增加力的大小使得蛋白的结构域按顺序去折叠。实验循环进行拉伸与收缩的过程(力变化速率为1 pN/s)并同时以nm级的分辨率检测每个蛋白的拉伸长度(图3)。通过力-距离曲线(图3a)可以观察到单个踝蛋白的去折叠循环。将单个蛋白的去折叠轨迹叠加即可检测到单个结构域去折叠的发生,研究人员可以得到蛋白结构和蛋白去折叠自由能图谱信息。AFS仪器产生的超声并不会损害生物分子的结构完整性,因此蛋白可以连续去折叠和再折叠长达数小时,并能够得到单个蛋白多次去折叠和再折叠的曲线。相比于其他SMFS方法经过多次拉伸和收缩之后对蛋白造成光学损伤或力学损伤使得实验被迫终止,AFS能够获得更多的信息。图3b: 单个力-距离曲线中截取一小段,表示一个拉伸过程。将力从15 pN增加至19 pN,可以观察到4个去折叠过程,与蛋白的4个结构域相符合,拉伸长度为30 nm至100 nm。AFS的高分辨率检测功能可以很清晰地区分去折叠过程。AFS在x,y方向精度为2 nm,在z方向精度为4 nm(频率为25 Hz),可以大幅提高(去)折叠研究的精密程度。图3c: 图3b中分子的18秒范围内的时间-距离曲线。AFS可以检测短至毫秒级至长达10小时以上的事件,用于研究蛋白的热力学和动力学。通过检测踝蛋白的去折叠步骤并记录连续的高分辨率的去折叠轨迹,可以得出AFS如何用于研究蛋白去折叠。研究蛋白(去)折叠的详细机制能够在生物物理和生物医药领域产生突破性发现。今后的蛋白折叠以及蛋白相互作用的研究中,AFS的多分子并行操控功能将发挥重要作用,用户可以同时并行检测大量的蛋白分子。用户可以获得大量的实验数据,在不影响分辨率的同时对蛋白的机械性质数据作出分析。
用硝酸汞沉淀除去乳酪蛋白,但水解蛋白不会被除去,与饱和苦味酸产生沉淀反应。 试剂配制 除蛋白试剂:硝酸汞14g,加入100mL蒸馏水,加浓硝酸约2.5mL,加热助溶,待试剂全部溶解后加蒸馏水至500mL。溶液出现混浊等污染现象停止使用。 饱和苦味酸溶液:称取2 克固体苦味酸于烧杯中,用冷却的蒸馏水定容至100mL,后将定容好的溶液倒入烧杯中煮沸(沸腾即可),然后将液体冷却,待结晶析出后将上清液倒入试剂瓶中。 样品处理奶粉样品的处理: (1)将样品旋转振荡,使之充分混合; (2)准确称取6g 样品,加入50ml 中性温水(60℃左右),充分溶解样品。 原料奶样品:将样品充分混合即可。 操作方法 取5mL 待检处理过的样品,放入干净干燥的平皿或其他容器内,加除蛋白试剂5mL 混合均匀,边加边摇动,不可产生大体积蓄状物,将摇匀的液体用快速定量滤纸过滤于试管中,收集滤液约3mL左右。 然后沿试管壁慢慢加入饱和苦味酸溶液约0.5mL(每加0.5mL约需要30-40秒),切勿使滤液与苦味酸混合(加入的苦味酸溶液层不超出总液体体积的1/3)。 结果判断 方法判定一(沉淀圈判定):加入苦味酸后,在10 秒内逆光或在黑色背景下)上下左右移动不同方位观察产生沉淀圈情况,无沉淀圈判定为阴性,有明显沉淀圈判定为阳性。 按产生沉淀圈情况进行“阴性、阳性”判定:
原理 用硝酸汞沉淀除去乳酪蛋白,但水解蛋白不会被除去,与饱和苦味酸产生沉淀反应。 试剂配制 除蛋白试剂:硝酸汞14g,加入100mL蒸馏水,加浓硝酸约2.5mL,加热助溶,待试剂全部溶解后加蒸馏水至500mL。溶液出现混浊等污染现象停止使用。 饱和苦味酸溶液:称取2 克固体苦味酸于烧杯中,用冷却的蒸馏水定容至100mL,后将定容好的溶液倒入烧杯中煮沸(沸腾即可),然后将液体冷却,待结晶析出后将上清液倒入试剂瓶中。 样品处理奶粉样品的处理: (1)将样品旋转振荡,使之充分混合; (2)准确称取6g 样品,加入50ml 中性温水(60℃左右),充分溶解样品。 原料奶样品:将样品充分混合即可。 操作方法 取5mL 待检处理过的样品,放入干净干燥的平皿或其他容器内,加除蛋白试剂5mL 混合均匀,边加边摇动,不可产生大体积蓄状物,将摇匀的液体用快速定量滤纸过滤于试管中,收集滤液约3mL左右。 然后沿试管壁慢慢加入饱和苦味酸溶液约0.5mL(每加0.5mL约需要30-40秒),切勿使滤液与苦味酸混合(加入的苦味酸溶液层不超出总液体体积的1/3)。 结果判断 方法判定一(沉淀圈判定):加入苦味酸后,在10 秒内逆光或在黑色背景下)上下左右移动不同方位观察产生沉淀圈情况,无沉淀圈判定为阴性,有明显沉淀圈判定为阳性。 按产生沉淀圈情况进行“阴性、阳性”判定:
我们关注的都是纯牛奶、奶粉,但是近些年乳饮料在市场上也很走俏,特别是双蛋白饮料,其实就是植物蛋白加上乳蛋白,但是在进行这类产品的检测时,特别是脂肪,大家用什么方法进行检测啊?我现在遇到的情况,用盖勃法检测数据偏低。还有植物蛋白饮料国家有没有相关的什么标准啊?我只查到一个农业部的标准。
我们有几个古代样品,通过质谱方法检测到了其中含有牛酪蛋白,但是因为当时的情况特殊,我们对此结果存疑,想进一步验证其中是否含有牛奶,所以想通过ELISA的方法定性检测其中的牛酪蛋白。大家知道,哪里做ELISA实验,能给我们代测牛酪蛋白吗(优先考虑北京的机构)?谢谢了!
我们实验室用的是上海嘉鹏科技有限公司生产的的核算蛋白检测仪,型号为HD-2000,现在急需该仪器的说明书
请教下各位在检测大豆分离蛋白的可溶性蛋白含量,测定其溶解性和测定其氮溶指数的目的有什么区别?
你好,能不能请教个问题。我是做进口胶原蛋白的商家,当时我们在选择这个原料的时候,一个朋友去过检测,具体内容是这样的,他有个朋友赵医生在澳大利亚行医,赵医生的妹妹得了癌症,回国照顾妹妹,带回来了一台仪器,日本产的,在上海有卖的,我们收集了很多种胶原蛋白原料,请赵医生帮忙检测,我的朋友检测后跟我说,赵医生拔了自己的一根头发,然后检测了不同的胶原蛋白原料,得出结果是,有的吸收度(可能表达不准确)是8,有的 22,有的 56,而我们的是 366,非常好,还说,我们说人体一天需要4克不对,检测下来她需要8克。后来赵医生回澳大利亚,联系不上。我想请教的是,您知道这个仪器是什么仪器吗?据说可以做地质检测。还有如果我们还想检测原料。您可以做到赵医生哪样的检测吗?请加我 QQ4567466,或者打我电话13319788283,必有重谢!
对于乳制品中蛋白质及非蛋白氮的检测方法,国家在2008年发布了GB/T 21704-2008《乳与乳制品中非蛋白氮含量的测定》和NY/T1678-2008《乳与乳制品中蛋白质的测定 双缩脲比色法》,但GB/T 21704-2008是采用滴定的方法,NY/T1678-2008是双缩脲比色法,检测时间比较长,均无法实现乳制品中蛋白及非蛋白氮的快速检测,造成在鲜奶收购中检测速度慢,运奶车等待时间比较长的现象,是否有一种方法或仪器可快速定量的检测上述物质呢,最好分析时间控制在15分钟以内。
浙江金华晨园乳业生产的牛奶中被查出使用皮革水解蛋白,以增加产品中蛋白质的含量。想问问这方面的高手,目前国内外有没有皮革水解蛋白的检测方法,可否给个标准号?谢谢了
用0.1%三伏乙酸乙腈和水的反相液相可以检测变性蛋白和未变性蛋白的区别么? 我试了一下,结果未发现两张图谱有什么区别,保留时间没有变化。 变性是通过水煮和尿素变性2中方法分别处理的。 大家有什么好的区分变性非变性蛋白的方法么,求教~~~~~~~[em09508]
分离蛋白检测方法.pdf
http://img3.17img.cn/bbs/upfile/images/20100518/201005181701392921.gifWestern Blot蛋白检测新方法介绍讲座时间:2014年12月09日 14:00主讲人:岳兵毕业于中山大学生物化学与分子生物学专业,于美谷分子仪器(上海)有限公司工作4年多,现任酶标仪产品线高级产品经理,具有丰富的读板机相关功能的研究和使用经验。http://img3.17img.cn/bbs/upfile/images/20100518/201005181701392921.gif【简介】基于时间分辨荧光(TRF)原理的Western Blot蛋白检测特点: 1、 高灵敏度:飞克级 2、 超宽动态检测范围:3-4logs 3、 无需底物、检测灵活、信号稳定(可达数月) 对蛋白质进行准确灵敏的定量检测是很多研究的关键步骤,Molecular Devices系列酶标仪可支持多种蛋白质检测分析方法:从最新的基于TRF的fg级Western Blot分子水平检测到GFP转染表达的细胞水平的检测,从操作繁琐的酶联免疫法(ELISA)到操作简便的均相时间分辨荧光法(HTRF)蛋白检测,同时搭配强大的SoftMax Pro软件,支持简洁明了、客户自定义的数据读取、分析和输出功能。 尊敬的客户,耽误您宝贵的3分钟时间来填写以下webinar注册信息,对于完成注册并当天全程听会的客户,我们会抽取8位听众送出精美小礼品。感谢大家的关注!-------------------------------------------------------------------------------1、报名条件:只要您是仪器网注册用户均可报名参加。2、报名并参会用户有机会获得100元手机充值卡一张哦~3、报名截止时间:2014年12月09日 13:304、报名参会:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/12545、报名及参会咨询:QQ群—231246773
ZHD型紫外蛋白核酸检测仪使用说明 一、系统简介 蛋白核酸检测仪是层析分析的主要装置,配上层析柱、恒流泵、部分收集器(根据需要选配)和电脑打印设备即构成一套完整的液相色谱分离系统。它是当今从事生命科学研究、药物测定、化工、食品科学及医学研究等行业的现代分析实验仪器。广泛用于工业、农业、科研和大专院校的科学研究和教学实验。其原理是根据物质(样品)对紫外光有明显吸收的特征,实现对样品成份含量比对分析,以便进行样品蛋白、核酸物质识别检测和含量测定。然而,目前国内生产的蛋白检测仪虽然种类繁多,但均采用记录仪描谱且预热时间较长。 ZHD型紫外蛋白核酸检测仪的研制成功,为科研和实验人员利用电脑系统实现核酸蛋白检测和分析提供了一种先进的手段,其特点是系统稳定、操作简便、电脑显示谱图、数据分析和打印谱图。 二、系统特点 本系列检测仪有别于其他检测仪,主要有以下特点: 1、预热时间短,一般做实验只要预热10分钟左右。 2、稳定性高,预热后每小时漂移一般小于0.001。 3、操作简洁,开机后仪器自动调整透光率(T)到100%,吸光度(A)调整到0.000。 4、透光率(T)和吸光度(A)对应准确,点两者误差小于1%。 5、双数据显示,仪器适时显示吸光度(A)和透光率(T)。 6、仪器带有电脑接口和记录仪接口(吸光度0—200mv)。 7、工作软件提供谱图采集、分析计算、保存、打印等功能,可将谱图插入文档(word)文件中。 8、一台电脑可配多台检测仪(由电脑有效端口数决定)。 三、 技术性能 1、通过测量选择菜单,在电脑屏幕上可描出吸光度(A)谱图,透过率(T%)谱图以及A-T%谱图。 2、通过图形平移、复读伸缩和压缩选择等菜单,可对谱图并进行幅度、宽度调整和谱图参数计算,预览满意后打印输出。 3、在描谱过程中,电脑会自动将图形左移(也可人工调整),电脑描谱最长时间为20小时。 4、采集数据自动保存。 四、主要参数: 1、波长:254nm,280nm(可根据用户需要调配)。 2、样品池100ul,光程3mm。 3、量程:吸光度(A):0--2.000 透光率(T):1%—100%。 4、分辩率:吸光度(A):0.001 透光率(T):0.1%。 5、电脑分析参数:峰高、峰宽、峰面积、峰面积比、保留时间、面积含量(归一化)、层析柱分辩率等。 6、电源220V±10%,50HZ。 7、主机重量:约3.5Kg。 五、系统安装与操作步骤 1、将仪器背板上的输出端通过一根串行口连接电缆与电脑主机的COM1或COM2串行口相连。 2、打开紫外蛋白核酸检测仪电源,仪器预热10分钟左右。 3、打开电脑后,将应用软件(ZHD.exe)复制到硬盘上。钦一下仪器面板上的复位按钮,待仪器显示0.000A和100%T后,双击ZHD.exe启动应用软件,系统进入采集(分析)状态。 4、在“测量选择”菜单下,用鼠标选择检测项目。 5、在“检测操作”菜单下点击“测量开始”,电脑开始采集。 6、要停止采集,点击“检测操作”下的“测量结束”菜单,然后关闭紫外蛋白酸检检测仪。 六、层析普工作站软件使用 1、 对硬件的基本要求: a、电脑在简体中文Windowsxp操作系统上运行; b、显示器分辩率为1024*768,小字体,256色配置; c、图形打印机; d、电脑系统必须正常工作,并保证串行口(COM2或COM1)有效; 2、系统连接无误后先让检测仪工作,再执行应用软件ZHD.exe; 3、 点击文件操作菜单下的“打开谱图”,出现文件操作对话框,打开随机盘上的数据文件(.ran),图形被打开,熟悉菜单操作。菜单介绍如下: a、“文件操作”菜单下有打开谱图、保存谱图、打印谱图、打印预览等; b、“检测操作”菜单下有测量开始、测量结束(测量结束后,系统在应用程序目录下生成“文件名.TXT”文件,此格式文件可在Excel软件中打开,并可转贴到Word文档中使用); c、“灵敏度选择”菜单下有A、T%、A-T%选项; d、“谱图平移”菜单后有向左慢移动 []和向右快移动[]; e、“谱图重绘”菜单:从起始点描谱;清理屏幕;释放压缩; f、“谱图全貌”菜单:在屏幕上观察全部谱图。 g、“参数选择”菜单:可对谱图进行参数分析计算。方法如下:在吸光度状态下,点击鼠标左键选取基线及时间范围(第一次点击选取第一点,第二次点击选取第二点),点击“选择参数”下拉菜单的峰高、标准差、半峰宽、峰底宽、峰面积、峰面积比、面积含量及保留时间等参数进行计算,还可间接计算出层析柱分辨率;双击鼠标左键,即可取消本次计算。 h、在吸光度(A)或透光率(T%)状态下,单击鼠标右键,屏幕显示该鼠标点的数值;双击鼠标右健,擦除屏幕显示数值。 七、注意事项: a、 更改波长方法:打开样品池挡板后,可见到滤光片的燕尾型支架和印字(245或280代表当前所使用的波长),用手将其轻轻抽出,换向后插入原位,再将样品池挡板装上,拧紧固定螺钉即可。 b、 在检测仪和电脑正常工作后才能运行应用软件; c、 应用软件执行后,十秒钟后不出现采集分析界面,说明电脑未收到数据,需检查系统连接是否正常; d、 在A—T%描谱过程中,开始1小时内,T%谱以实蓝线表示;1小时后(或点击“图形重绘” ),已描过的T%谱会以虚蓝线表示; e、 测量开始后(特别是出峰以后)不要按复位按钮。 f、 要停止采集,请点击“测量结束”后,先点击“EXIT”,再关闭检测仪。 g、 开始测量时,屏幕会弹出保存文件对话框,要求输入数据文件名及存放路径;之后,电脑自动保存数据。 I、基线选取要保证基线与所选峰必须要有两个焦点,并与其他峰无焦点。
谁知道蛋白酶的活力如何进行检测?