求助:哪位大侠能不能告诉我偏振荧光免疫分析仪是属于哪仪类医疗器械,还有就是有哪些厂家生产这类仪器啊,万分感谢
大肠杆菌中带有绿色荧光蛋白的基因,想要拍照的话,是用油镜还是多大倍数的物镜?显微镜是奥林巴斯的,软件是MIE。高手指教一下,谢啦
绿色荧光蛋白等电点是多少?
生物标记三部曲:绿色荧光蛋白(GFP)、辣根过氧化物酶(HRP)和小型单线态氧制造者(MiniSOG)【towersimper注:本文为译文,每篇都有部分改动,仅用作研究之用,不得用作商业开发,转载请标明翻译者towersimper,第一篇来自Sowmya Swaminathan, Nature Cell Biology, "GFP: the green revolution", doi:10.1038/ncb1953, October 1, 2009;第二篇来自Andy, brainslab.wordpress.com,"Horseradish peroxidase as marker for anatomical em", April 3, 2011; 第三篇来自Andy, brainslab.wordpress.com, "MiniSOG, a light and electron microscopy fusable marker", April 16, 2011】 第一篇:绿色荧光蛋白: 绿色革命http://bbs.bioon.net/bbs/data/attachment/album/201107/23/1829154rjsutzjgu2tw4hf.jpg来自秀丽隐杆线虫(Caenorhabditis elegans)的两个触觉感受器神经元的细胞体(cell body)用编码β-微管蛋白的基因表达的绿色荧光蛋白标记,图片来自doi:10.1126/science.8303295.1994年,Chalfie等人在Science杂志发表一篇报道,表明来自维多利亚水母(Aequorea Victoria)的绿色荧光蛋白(green fluorescent protein, GFP),在没有任何A. Victoria的辅助因子存在下,能在活着的细菌和线虫细胞中用作蛋白定位和表达的标记。这种显示GFP作为体内研究蛋白的工具基本上改变了细胞生物学家能够解决的问题的性质和范围。1962年,Shimomura和他的同事们在A. victoria生物发光蛋白水母素(aequorin)的纯化过程中偶然间第一次发现了GFP。1974年,Morise和他的同事们在随后的纯化、晶体形成和从水母素到GFP能量转移的体外重建过程中,为GFP的荧光性质提供启迪,而且证实GFP接受来自水母素的能量转移后发射绿光。在此之后许多年,在外源系统中GFP是否需要水母素和可能来自水母的其他因子发出荧光,这仍然是一个公开的问题。1992年,也就是在GFP发现后的30年,Prasher等人克隆了编码GFP的基因,就为实验上评估它用作蛋白质的体内标记铺平道路。而在两年后,Chalfie等人证实当GFP在细菌和线虫细胞中表达时,它能够发出荧光。在线虫中,GFP是在一个表达β-微管蛋白的基因启动子的控制下表达的。它在线虫特异性神经元中的时空表达模拟了内源性β-微管蛋白基因的表达,因而证明GFP能够作为一种可靠的标记以便监控基因表达模式。此后不久,Roger Tsien的实验室对天然GFP进行改造使之变得更加明亮和耐光,以及在一个与常规显微镜过滤器装置相匹配的波长下激发,因而增加了它的实际适应性。GFP技术的下一个突破便是开发GFP变异体产生蓝色、青色和黄色荧光蛋白,因而能够使得影像实验在细胞和有机体中采用多种标记的蛋白。绿色荧光蛋白(GFP)是由238个氨基酸残基组成,在蓝色波长范围的光线激发下,会发出绿色荧光。而EGFP是增强型的GFP (enhanced GFP),发生了双氨基酸取代,亮氨酸(Leu)取代GFP上第64位苯丙氨酸(Phe),苏氨酸(Thr)取代了GFP上的第65位丝氨酸(Ser),与GFP相比,具有更强更稳定的绿色荧光。黄色荧光蛋白(yellow fluorescent protein, YFP)其序列与GFP基本相同,不同之处就是把第203位Thr以Tyr取代,这样的GFP不发出绿色荧光,而发出较长波长的黄色荧光。青色荧光蛋白(cyan fluorescent protein, CFP)与此类似,也是GFP第66位Tyr(酪氨酸)被Thr(色氨酸)所取代的结果,发青色荧光。由此可见,GFP标签与其它突变体GFP、YFP、EYFP、CFP的序列非常的类似,只有1-2个氨基酸残基的变化。
生物、化学是一家。[em0814]Kary Mullis因为发明PCR技术而获得了1993年的诺贝尔化学奖,但谁都知道PCR的意义在于分子生物领域;15年后Roger Y. Tsien因为绿色荧光蛋白GFP的发现而获得了化学奖,不过GFP还是因为其分子标记能力而在生命科学领域有着广泛的研究和应用。本帖应景请大家谈谈GFP,形式自由,可以发收集的研究进展等资料,也可以谈谈自己对GFP的研究或了解,或者说说感想也行。还是老原则:质优者额外加分。
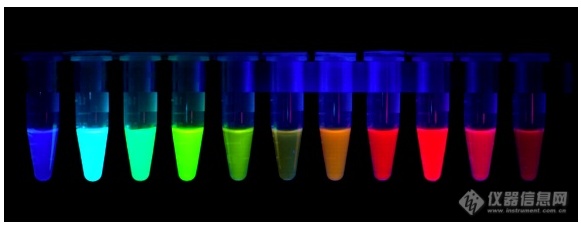
[font='Times New Roman'][font=宋体]引言[/font][/font][i][font='Times New Roman'][font=宋体]无数科学家的努力下,蛰居在水母的绿色荧光蛋白已经被导入到病毒、放线菌、酵母、植物、果蝇、线虫、小鼠、大鼠、人类细胞等几乎所有的模式生物,荧光蛋白的发现与应用被认为是点亮了生命科学,让黑暗中的生命活动被可视化的展示在科学家眼前。[/font][/font][/i][font='Times New Roman'][font=宋体]上期文章中,我们对比了活体光学成像的两种技术,生物发光和荧光成像的不同点。随着荧光标记技术的进一步发展,荧光成像的应用范围已经大大超过了生物发光,荧光成像已经可以满足绝大多数情况下的实验需求。[/font][/font][font='Times New Roman'][color=#ff0000][font=宋体]荧光成像需要对检测的细胞或分子进行荧光标记[/font][/color][/font][font='Times New Roman'][font=宋体]。目前,主要有两种标记方法,第一种利用[/font][/font][font='Times New Roman'][color=#191919][font=Arial]内源荧光信号[/font][/color][/font][font='Times New Roman'][color=#191919][font=宋体],在细胞中表达荧光蛋白进行标记。第二种利用荧光分子对细胞、药物或纳米颗粒等分子进行标记。[/font][/color][/font][font='Times New Roman'][font=宋体]本期将为大家介绍荧光蛋白[/font][/font][font=宋体][font=宋体]的[/font][/font][font='Times New Roman'][font=宋体]选择方法![/font][/font][align=center][img=,581,228]https://ng1.17img.cn/bbsfiles/images/2020/09/202009271417587236_9957_1887_3.png!w581x228.jpg[/img][font='Times New Roman'][color=#191919] [/color][/font][/align][align=center][font='Times New Roman'][color=#191919]Rainbow of fluorescent proteins [Tsien lab][/color][/font][/align][align=center][font='Times New Roman'][color=#191919][font=Arial]选择荧光蛋白建议考虑的参数[/font][/color][/font][/align][font='Times New Roman'][color=#191919]1. [/color][/font][font='Times New Roman'][color=#191919][font=Arial]激发波长[/font]/[font=Arial]发射波长[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]:每一种荧光蛋白都有其独特的激发波长和发射波长,因此,选择的荧光蛋白必须是使用的[/font][/color][/font][font='Times New Roman'][color=#191919][font=宋体]成像[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]系统能够激发和检测到的。比如,使用的[/font][/color][/font][font='Times New Roman'][color=#191919][font=宋体]成像系统只有两个激发光源:[/font][/color][/font][font='Times New Roman'][color=#191919]488 nm[font=Arial]和[/font][font=Times New Roman]561 nm[/font][/color][/font][font='Times New Roman'][color=#191919][font=宋体]。[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]那就不能够选择远红外荧光蛋白。[/font][/color][/font][font='Times New Roman'][color=#191919][font=宋体]同时[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]使用超过一个荧光蛋白时,必须确保发射波长没有重叠。[/font][/color][/font][font='Times New Roman'][color=#ff0000][font=宋体]荧光蛋白应用于活体成像实验时,尽量选择红色或近红外的荧光蛋白,这类荧光蛋白的发射波长较长,具有更好的[/font][/color][/font][font=宋体][color=#ff0000][font=宋体]组织[/font][/color][/font][font='Times New Roman'][color=#ff0000][font=宋体]穿透[/font][/color][/font][font=宋体][color=#ff0000][font=宋体]能力。[/font][/color][/font][font='Times New Roman'][color=#191919]2. [font=Arial]寡聚反应[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]:[/font][/color][/font][font='Times New Roman'][color=#191919][font=宋体]早期开发的[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]荧光蛋白易于寡聚化,[/font][/color][/font][font='Times New Roman'][color=#191919][font=宋体]与[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]目的基因融合表达时可能会影响目的基因蛋白的生物学功能。[/font][/color][/font][font='Times New Roman'][color=#ff0000][font=宋体]因此[/font][/color][/font][font='Times New Roman'][color=#ff0000][font=Arial]建议使用单体的荧光蛋白,比如[/font]mCherry[font=Arial]。[/font][/color][/font][font='Times New Roman'][color=#191919]3[/color][/font][font='Times New Roman'][color=#191919]. [font=Arial]亮度[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]:荧光蛋白的亮度值由消光系数与量子产率的乘积计算得出。在许多情况下,将荧光蛋白的亮度与[/font]EGFP([font=Arial]设定为[/font][font=Times New Roman]1)[/font][font=Arial]进行比较,有一些荧光蛋白非常暗淡(例如[/font][font=Times New Roman]TagRFP657[/font][font=Arial],其具有亮度只有[/font][font=Times New Roman]0.1[/font][font=Arial])[/font][/color][/font][font='Times New Roman'][color=#191919][font=宋体]。[/font][/color][/font][font='Times New Roman'][color=#ff0000][font=Arial]因此[/font][/color][/font][font='Times New Roman'][color=#ff0000][font=宋体]活体成像实验时,[/font][/color][/font][font='Times New Roman'][color=#ff0000][font=Arial]亮度也需要考虑。[/font][/color][/font][font='Times New Roman'][color=#191919]4[/color][/font][font='Times New Roman'][color=#191919]. pH[font=Arial]稳定性[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]:如果计划在酸性环境中表达荧光蛋白,则此参数非常重要,一些荧光蛋白具有不同的[/font][/color][/font][font='Times New Roman'][color=#191919][font=宋体]激发[/font]/[font=宋体]发射[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]光谱(例如[/font]mKeima[font=Arial])或在[/font][font=Times New Roman]pH[/font][font=Arial]变化时荧光强度会发生改变(例如[/font][font=Times New Roman]pHluorin[/font][font=Arial],[/font][font=Times New Roman]pHTomato[/font][font=Arial])。[/font][/color][/font][font=宋体][color=#191919]5.[font=宋体]避免自发荧光:[/font][/color][/font][font=宋体][color=#191919][font=宋体]生物体自身的很多物质具有较强的自发荧光,如指甲、毛发具有强烈的绿色背景信号,因此活体成像时需要对动物进行完全的脱毛处理或尽量避免绿色荧光蛋白,可选[/font][/color][/font][font='Times New Roman'][color=#191919]RFP[font=宋体]、[/font][font=Times New Roman]dsRed, mCherry, mTomato[/font][/color][/font][font=宋体][color=#191919][font=宋体]等荧光蛋白。[/font][/color][/font][b][font='Times New Roman'][color=#ff0000] [/color][/font][font='Times New Roman'][font=Arial]在选择好了荧光蛋白后,后续就是做实验、拿数据、发文章了![/font][/font][/b][font='Times New Roman'][font=Arial]可[/font][/font][font='Times New Roman'][color=#191919][font=Arial]是选用什么成像[/font][/color][/font][font=Arial][color=#191919][font=Arial]设备[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]好呢?[url=http://dwz.date/cwes]点击了解更多详情![/url][/font][/color][/font]
第一篇来自Sowmya Swaminathan, Nature Cell Biology, "GFP: the green revolution", doi:10.1038/ncb1953, October 1, 2009;第二篇来自Andy, brainslab.wordpress.com,"Horseradish peroxidase as marker for anatomical em", April 3, 2011;第三篇来自Andy, brainslab.wordpress.com, "MiniSOG, a light and electron microscopy fusable marker", April 16, 2011第一篇:绿色荧光蛋白: 绿色革命http://www.biomart.cn//upload/userfiles/image/131175417948693.jpg来自秀丽隐杆线虫(Caenorhabditis elegans)的两个触觉感受器神经元的细胞体(cell body)用编码β-微管蛋白的基因表达的绿色荧光蛋白标记,图片来自doi:10.1126/science.8303295.1994年,Chalfie等人在Science杂志发表一篇报道,表明来自维多利亚水母(Aequorea Victoria)的绿色荧光蛋白(green fluorescent protein, GFP),在没有任何A. Victoria的辅助因子存在下,能在活着的细菌和线虫细胞中用作蛋白定位和表达的标记。这种显示GFP作为体内研究蛋白的工具基本上改变了细胞生物学家能够解决的问题的性质和范围。1962年,Shimomura和他的同事们在A. victoria生物发光蛋白水母素(aequorin)的纯化过程中偶然间第一次发现了GFP。1974年,Morise和他的同事们在随后的纯化、晶体形成和从水母素到GFP能量转移的体外重建过程中,为GFP的荧光性质提供启迪,而且证实GFP接受来自水母素的能量转移后发射绿光。在此之后许多年,在外源系统中GFP是否需要水母素和可能来自水母的其他因子发出荧光,这仍然是一个公开的问题。1992年,也就是在GFP发现后的30年,Prasher等人克隆了编码GFP的基因,就为实验上评估它用作蛋白质的体内标记铺平道路。而在两年后,Chalfie等人证实当GFP在细菌和线虫细胞中表达时,它能够发出荧光。在线虫中,GFP是在一个表达β-微管蛋白的基因启动子的控制下表达的。它在线虫特异性神经元中的时空表达模拟了内源性β-微管蛋白基因的表达,因而证明GFP能够作为一种可靠的标记以便监控基因表达模式。此后不久,Roger Tsien的实验室对天然GFP进行改造使之变得更加明亮和耐光,以及在一个与常规显微镜过滤器装置相匹配的波长下激发,因而增加了它的实际适应性。GFP技术的下一个突破便是开发GFP变异体产生蓝色、青色和黄色荧光蛋白,因而能够使得影像实验在细胞和有机体中采用多种标记的蛋白。绿色荧光蛋白(GFP)是由238个氨基酸残基组成,在蓝色波长范围的光线激发下,会发出绿色荧光。而EGFP是增强型的GFP (enhanced GFP),发生了双氨基酸取代,亮氨酸(Leu)取代GFP上第64位苯丙氨酸(Phe),苏氨酸(Thr)取代了GFP上的第65位丝氨酸(Ser),与GFP相比,具有更强更稳定的绿色荧光。黄色荧光蛋白(yellow fluorescent protein, YFP)其序列与GFP基本相同,不同之处就是把第203位Thr以Tyr取代,这样的GFP不发出绿色荧光,而发出较长波长的黄色荧光。青色荧光蛋白(cyan fluorescent protein, CFP)与此类似,也是GFP第66位Tyr(酪氨酸)被Thr(色氨酸)所取代的结果,发青色荧光。由此可见,GFP标签与其它突变体GFP、YFP、EYFP、CFP的序列非常的类似,只有1-2个氨基酸残基的变化。在GFP发现后的将近半个世纪以来,因为发现和开发绿色荧光蛋白,2008年诺贝尔化学奖被授予给Osamu Shimomura, Martin Chalfie和Roger Tsien,来表彰这次发现给后世带来的巨大影响。参考文献:Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W. & Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science 263, 802–805 (1994).Shimomura, O., Johnson, F. H. & Saiga, Y., Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan Aequorea. J. Cell. Comp. Physiol. 59, 223–239 (1962).Morise, H., Shimomura, O., Johnson, F. H. & Winant, J. Intermolecular energy transfer in the bioluminescent system of Aequorea. Biochemistry 13, 2656–2662 (1974).Prasher, D. C., Eckenrode, V. K., Ward, W. W., Prendergast, F. G. & Cormier, M. J. Primary structure of the Aequorea victoria green-fluorescent protein. Gene 111, 229–233 (1992).Tsien, R. Y. The green fluorescent protein. Annu. Rev. Biochem. 67, 509–544 (1998).第二篇:辣根过氧化物酶作为解剖学电子显微镜(anatomical electron microscopy)的标记要绘制诸如视网膜的大容量组织中的突触联系(synaptic connection) James R. Anderson等人于2009年就已经主张应当将分子表达谱(molecular profiling)与电子显微镜图片相关联。如今,这里给出一个例子来说明分子表达谱仪(molecular profiler)如何得到很好的利用。Jianli Li等人采用电穿孔技术产生将携带有靶向到细胞膜的辣根过氧化物酶(membrane-targeted horseradish peroxidase, mHRP)基因的表达构建物导入神经元。辣根过氧化物酶发射可放大的波长为428nm的荧光。这些研究人员就使用它作为解剖学上的标记,与蝌蚪神经元的连续切片电子显微镜图片(serial section electron microscopy, SCEM)在空间上相互关联。辣根过氧化物酶的优势之一在于它在包括线粒体/小泡(vesicle)在内的细胞膜上均匀分布。它也有助于鉴定长轴突(axon)/小直径的树突(dendrite)。但是另一方面,不同于其他的标记,它不得不在动物仍然活着的时候通过电穿孔技术导入细胞才有效果。下面是一系列电子显微镜图片,其中远侧树突分支(distal dendritic branch),蓝色显示;带有轴突末端(axon terminal, 用粉红色显示)的突触,用白色箭头符号指示:http://www.biomart.cn//upload/userfiles/image/131175420478195.jpg比例尺=1微米当从向右观看这一系列图片时,你能够看到树突如何缩减,而研究人员能够在他们的微回路(microcircuit)模型中重构这些图片。
AKATA制备型液相色谱蛋白分析仪纯化蛋白步骤很简单的,比较适合初学者。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=113913]AKATA制备型液相色谱蛋白分析仪纯化蛋白步骤[/url]
牛奶蛋白质分析仪可以用于检测乳蛋白制品。以下是详细解释和相关信息: 功能与应用:牛奶蛋白质分析仪是一种专门用于分析牛奶及其制品中蛋白质含量的仪器。它基于先进的生化分析技术,如比色法、光谱法或电化学法等,能够准确、快速地检测样品中的蛋白质含量。 乳蛋白制品的检测:乳蛋白制品,如奶粉、酸奶、奶酪等,其蛋白质含量是产品质量和营养价值的重要指标。牛奶蛋白质分析仪可以有效地检测这些乳蛋白制品中的蛋白质含量,为生产厂家提供准确的质量控制手段。 优点与特点: 准确性高:牛奶蛋白质分析仪具有高灵敏度和高准确性,能够确保测量结果的可靠性。 快速便捷:该仪器操作简单,使用方便,可以快速得出测量结果,提高检测效率。 适用范围广:除了牛奶及其制品外,还可以用于其他含蛋白质样品的检测,如豆类制品、肉制品等。 在乳品工业中的重要性:随着乳品市场的不断扩大和消费者对乳制品质量要求的提高,牛奶蛋白质分析仪在乳品工业中的重要性日益凸显。它可以帮助乳品企业提高产品质量、降低生产成本,同时为消费者提供更加安全、健康的乳制品。 综上所述,牛奶蛋白质分析仪是一种功能强大、应用广泛的检测仪器,完全可以用于检测乳蛋白制品中的蛋白质含量。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/05/202405271615421543_8284_6238082_3.jpg!w690x690.jpg[/img]
想做一下偏振荧光,但从没做过,不知道怎么做才好。1. 关于偏振片我们这边的荧光仪上都没有偏振附件,我如果单独买用在仪器上会不会不好,会消光过多什么的?2. 问了又一个单位他们的荧光仪上有平行和垂直两种滤片,是不是这就够了?不需要其他角度的滤光片?具体荧光怎么操作呢?先谢过大家。
假设我的物质没有各项异性,那么 垂直偏振和水平偏振测出来就是0?我看了一下文献,类似的东西即使是膜,各向异性也有0.12,我的做出来象一系列的噪声背景。请问这样正常吗?还是我有什么地方设置得不对。请大家指教。我的一个想法,假如物质有荧光,但是没有各向异性,那么偏振荧光做出来,垂直和水平方向应该至少有一条曲线类似自然光下的荧光光谱。不知道对不对。
[b][font=宋体][font=宋体]一、[/font][font=Calibri]EGFP[/font][font=宋体]蛋白全称[/font][/font][/b][font=宋体] [/font][font=宋体][font=Calibri]EGFP[/font][font=宋体],全称为增强型绿色荧光蛋白([/font][font=Calibri]Enhanced Green Fluorescent Protein[/font][font=宋体]),是一种在生物科学研究中广泛应用的荧光报告蛋白。它是由普通绿色荧光蛋白([/font][font=Calibri]GFP[/font][font=宋体])进行突变和优化得到的,相较于原始的[/font][font=Calibri]GFP[/font][font=宋体],[/font][font=Calibri]EGFP[/font][font=宋体]具有更高的荧光亮度和更稳定的性质。[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]二、[/font][font=Calibri]EGFP[/font][font=宋体]蛋白大小[/font][/font][/b][font=宋体] [/font][font=宋体][font=Calibri]EGFP[/font][font=宋体]蛋白的大小为[/font][font=Calibri]238[/font][font=宋体]个氨基酸,分子量约为[/font][font=Calibri]27kDa[/font][font=宋体]。这个分子量相对较小,使其在融合蛋白、抗体标记等生物分子标记领域中具有广泛的应用价值。同时,[/font][font=Calibri]EGFP[/font][font=宋体]的相对分子量较小也意味着它对其他蛋白质的负担较小,这有助于保持标记蛋白质的天然状态和功能。[/font][/font][b][font=宋体] [/font][font=宋体][font=宋体]三、[/font][font=Calibri]EGFP[/font][font=宋体]蛋白序列[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]以下是[/font][font=Calibri]EGFP[/font][font=宋体]蛋白的氨基酸序列:[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]MVHHIQGGGPGMPMPGEEMMMAAN[/font][font=宋体]稚[/font][font=Calibri]TSGSHMVHHIQGGGPGMPMPGEEMMMAAN[/font][font=宋体]稚[/font][font=Calibri]TSGSHMVHHIQGGGPGMPMPGEEMMMAAN[/font][font=宋体]稚[/font][font=Calibri]TSGSHMVHHIQGGGPGMPMPGEEMMMAAN[/font][font=宋体]稚[/font][font=Calibri]TSGSHMEEEEDVMKDVEEETPIPELMLLDMAAQDPIPELMLLDMAAQDPIPELMLLDMAAQDPIPELMLLDMAAQDPIPELMLLDMAAQDP[/font][/font][font=宋体] [/font][font=宋体][font=宋体]通过分析[/font][font=Calibri]EGFP[/font][font=宋体]的氨基酸序列,我们可以发现其中包含一些重要的结构域和功能位点。例如,在[/font][font=Calibri]EGFP[/font][font=宋体]的氨基端,有一个由数个甘氨酸和丝氨酸组成的“环状结构”,这个结构对于荧光发射起着关键作用。在羧基端,我们还可以看到一个“多肽区”,这个区域对于荧光亮度和稳定性也有重要影响。此外,在[/font][font=Calibri]EGFP[/font][font=宋体]的氨基酸序列中还包含多个突变位点,这些位点使得[/font][font=Calibri]EGFP[/font][font=宋体]相较于原始的[/font][font=Calibri]GFP[/font][font=宋体]具有更高的荧光亮度和更稳定的性质。[/font][/font][b][font=宋体] [/font][font=宋体]四、总结[/font][/b][font=宋体] [/font][font=宋体][font=Calibri]EGFP[/font][font=宋体]是一种重要的荧光报告蛋白,通过对其全称、大小和序列的深入了解,我们可以更好地理解其性质和应用。在实际的生物科学研究中,[/font][font=Calibri]EGFP[/font][font=宋体]已被广泛应用于细胞生物学、分子生物学、生物医学等多个领域,为科研工作者提供了强有力的工具,有助于推动生命科学研究的进步。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多[url=https://cn.sinobiological.com/resource/protein-review/protein-tag][b]蛋白标签[/b][/url]详情可以查看义翘神州网:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-tag[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b][font=Calibri] [/font]
对这类仪器我有两个问题,请专家给解释一下,谢谢!1、偏振能量色散型X射线荧光光谱仪中使用偏振光的特点(包括优点和缺点)是什么?2、这种偏振光是指光源是偏振光还是产生的荧光是偏振光?
我的荧光带了偏振附件不知如何使用
X荧光小菜鸟一个,之前有用过斯派克的XEPOS的偏振仪器。从他的元素曲线线性和准确度结果上看,很牛B。对于这一技术很疑惑,有没有大佬帮忙解答一下,特别是他的二次靶怎么能从小Z到后面的重金属都有很好的检测能力。
不知有谁使用过这个机器,是否能提供DU530核酸/蛋白分析仪使用说明书,谢谢!
荧光分光光度计激发偏振器与发射偏振器互相垂直的荧光强度怎么测?(目的是测荧光各项异性)F4500有个荧光偏振附件 两个镜子角度可调 我想问一下 测平行的荧光强度是两个都调到0度, 但测垂直的荧光强度是两个都是90度还是 0°,90°或是90°,0°呢?这样测出的值都不一样啊
蛋白分析系统在我们选择蛋白分析工具的时候,通常是根据不同的蛋白来选择不同的分析手段,如凝胶电泳、化学荧光染色、质谱等等。但是目前已经研制出的蛋白分析工具的种类繁多,从这一方面也在一定程度上反映了蛋白分析的复杂性。以下是一些近期推出的蛋白分析系统,希望能帮助您轻松完成研究工作。
请教一下各位:用氨基酸分析仪能检测皮革水解蛋白吗?
请问大家,F-4500做自动偏振荧光时,Excitation/Emission Mode 时G的测量有两种,一个是Fixed Value,一个是Spectrum,请问这两个有什么区别?
有没有做过荧光偏振方面的大侠,帮讲解一下,偏振片如何选择?对于偏振的原理看了书,但是不太理解
本人在偏振定义中看到,荧光偏振度是吸收矩和发射矩之间的角度。请教各位:吸收矩和发射矩的定义如何,如何确定吸收矩和发射矩的方向及其夹角(在固定的某一分子上,如芳香性物质,芘、蒽等)?多谢各位指教!!
牛奶蛋白质分析仪的原理主要基于光学测量技术,特别是光谱分析法。具体地说,它采用红外光谱法来测量牛奶中乳清蛋白和酪蛋白的含量。首先,将牛奶样品制成透明薄片,然后使用近红外光电传感器和光源对其进行扫描。牛奶中的蛋白质对特定波长的红外光有特定的吸收特性,通过测量这些吸收特性,可以分析出牛奶中蛋白质的种类和含量。此外,仪器会将牛奶光谱与事先建立的标准光谱进行比较,通过复杂的算法处理,从而得出各种蛋白质形态的含量。这种比较和计算过程确保了测量结果的准确性和可靠性。总的来说,牛奶蛋白质分析仪通过光学测量和光谱分析技术,能够快速、准确地测定牛奶中蛋白质的含量和种类,为乳制品生产、质量控制和科学研究提供了有力的支持。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/04/202404291701212298_2595_6238082_3.jpg!w690x690.jpg[/img]
纳米材料与结合蛋白的纳米材料,1.在荧光光度分析上会有什么不同[em01] ?2.蛋白的包覆会影响纳米材料的荧光峰吗?3.纳米材料的结合对蛋白的荧光峰会有影响吗?谢谢
[font=宋体][font=宋体]蛋白标签([/font][font=Calibri]Protein Tag[/font][font=宋体])又称为标签蛋白,是利用[/font][font=Calibri]DNA[/font][font=宋体]体外重组技术,将目的蛋白与其融合表达形成的一种多肽或蛋白。这种标签有助于目的蛋白的表达、检测、示踪和纯化等操作。随着技术的不断进步,研究人员已经成功开发出了具有各种不同功能的蛋白标签。然而,由于不同的蛋白标签具有各自的特性,因此在质粒构建过程中常常会遇到多种问题。今天,我们将深入探讨蛋白标签的各个方面。[/font][/font][font=宋体] [/font][font=宋体][b]蛋白标签类型[/b][/font][font=宋体]蛋白标签主要分为三类,适用于不同的应用场景:表位标签、亲和标签和荧光标签。[/font][font=宋体] [/font][font=宋体][font=宋体]①表位标签往往是短肽序列,可用于免疫学应用,如 [/font][font=Calibri]Western Blot [/font][font=宋体]和免疫共沉淀。最常用的表位标签有[/font][font=Calibri]His[/font][font=宋体]、[/font][font=Calibri]FLAG[/font][font=宋体]、[/font][font=Calibri]HA[/font][font=宋体]等。[/font][/font][font=宋体][font=宋体]②亲和标签一般较长,可增加蛋白溶解度,广泛应用于重组蛋白的纯化,如[/font][font=Calibri]SUMO[/font][font=宋体]、[/font][font=Calibri]Trx[/font][font=宋体]、[/font][font=Calibri]MBP[/font][font=宋体]等。[/font][/font][font=宋体][font=宋体]③荧光标签可用于活细胞和死细胞检测,最常用的荧光蛋白包括绿色荧光蛋白([/font][font=Calibri]GFP[/font][font=宋体])、橙色荧光蛋白([/font][font=Calibri]OFP[/font][font=宋体])、红色荧光蛋白([/font][font=Calibri]RFP[/font][font=宋体])和黄色荧光蛋白([/font][font=Calibri]YFP[/font][font=宋体])。它们被广泛用于影像学研究,如细胞定位和共表达实验。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b][font=宋体]蛋白标签在重组蛋白生产中有什么作用[/font][font=Calibri]?[/font][/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、识别:给蛋白加标签使其易于识别,进而快速鉴定感兴趣的蛋白质。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、纯化:利用标签蛋白对目的蛋白进行纯化。例如,[/font][font=Calibri]His6[/font][font=宋体]是一种由六个组氨酸残基组成的融合标签,可以插入目的蛋白的[/font][font=Calibri]C[/font][font=宋体]末端或[/font][font=Calibri]N[/font][font=宋体]末端。组氨酸残基侧链与固态的镍有强烈的吸引力,这使得[/font][font=Calibri]His6[/font][font=宋体]标签可用于固定化金属螯合层析[/font][font=Calibri](IMAC)[/font][font=宋体],从而对重组蛋白进行分离纯化。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、定量:通过量化标签来确定目的蛋白的存在量。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4[/font][font=宋体]、定位:通过定位标签蛋白定位到目标蛋白在细胞中的特定位置,进而研究其生理功能、信号通路等。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5[/font][font=宋体]、跟踪:在细胞、组织和生物体中,通过追踪标签蛋白质追踪目的蛋白,以研究它们的表达、分布、代谢等生物学过程。[/font][/font][font=宋体] [/font][font=宋体]总之,蛋白标签在重组蛋白生产中扮演着重要的角色,它们不仅提高了生产效率,还为蛋白的检测、纯化和示踪提供了便利。[/font][font=宋体] [/font][font=宋体][font=宋体]常用的[url=https://cn.sinobiological.com/resource/protein-review/protein-tag][b]蛋白标签[/b][/url]有:[/font][font=Calibri]His-Tag[/font][font=宋体]、[/font][font=Calibri]FLAG-Tag[/font][font=宋体]、[/font][font=Calibri]HA-Tag[/font][font=宋体]、[/font][font=Calibri][url=https://cn.sinobiological.com/resource/protein-review/myc-tag-protein-production][b]Myc-Tag[/b][/url][/font][font=宋体]、[/font][font=Calibri]SUMO-Tag[/font][font=宋体]、[/font][font=Calibri]Trx-Tag[/font][font=宋体]、[/font][font=Calibri]GST-Tag[/font][font=宋体]……义翘神州不仅可提供重组蛋白表达定制服务,也可提供对应标签抗体产品及融合蛋白标签切除常用工具酶,如[/font][font=Calibri]EK[/font][font=宋体]蛋白酶、[/font][font=Calibri]3C[/font][font=宋体]蛋白酶等。下图是具体蛋白标签的序列和大小介绍,详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-tag[/font][/font]
请教分子荧光的偏振装置如何使用???
为探究生物进程的分子机制,需要确定介导这个过程的蛋白质-蛋白质间的相互作用。研究蛋白质间相互作用的主要技术总结如下:一、酵母双杂交系统酵母双杂交系统是当前广泛用于蛋白质相互作用组学研究的一种重要方法。其原理是当靶蛋白和诱饵蛋白特异结合后,诱饵蛋白结合于报道基因的启动子,启动报道基因在酵母细胞内的表达,如果检测到报道基因的表达产物,则说明两者之间有相互作用,反之则两者之间没有相互作用。将这种技术微量化、阵列化后则可用于大规模蛋白质之间相互作用的研究。在实际工作中,人们根据需要发展了单杂交系统、三杂交系统和反向杂交系统等。Angermayr等设计了一个SOS蛋白介导的双杂交系统。可以研究膜蛋白的功能,丰富了酵母双杂交系统的功能。此外,酵母双杂交系统的作用也已扩展至对蛋白质的鉴定。二、噬茵体展示技术在编码噬菌体外壳蛋白基因上连接一单克隆抗体的DNA序列,当噬菌体生长时,表面就表达出相应的单抗,再将噬菌体过柱,柱上若含目的蛋白,就会与相应抗体特异性结合,这被称为噬菌体展示技术。此技术也主要用于研究蛋白质之间的相互作用,不仅有高通量及简便的特点,还具有直接得到基因、高选择性的筛选复杂混合物、在筛选过程中通过适当改变条件可以直接评价相互结合的特异性等优点。目前,用优化的噬菌体展示技术,已经展示了人和鼠的两种特殊细胞系的cDNA文库,并分离出了人上皮生长因子信号传导途径中的信号分子。三、等离子共振技术表面等离子共振技术(SurfacePlasmonResonance,SPR)已成为蛋白质相互作用研究中的新手段。它的原理是利用一种纳米级的薄膜吸附上“诱饵蛋白”,当待测蛋白与诱饵蛋白结合后,薄膜的共振性质会发生改变,通过检测便可知这两种蛋白的结合情况。SPR技术的优点是不需标记物或染料,反应过程可实时监控。测定快速且安全,还可用于检测蛋白一核酸及其它生物大分子之间的相互作用。四、荧光能量转移技术荧光共振能量转移(FRET)广泛用于研究分子间的距离及其相互作用;与荧光显微镜结合,可定量获取有关生物活体内蛋白质、脂类、DNA和RNA的时空信息。随着绿色荧光蛋白(GFP)的发展,FRET荧光显微镜有可能实时测量活体细胞内分子的动态性质。提出了一种定量测量FRET效率以及供体与受体间距离的简单方法,仅需使用一组滤光片和测量一个比值,利用供体和受体的发射谱消除光谱间的串扰。该方法简单快速,可实时定量测量FRET的效率和供体与受体间的距离,尤其适用于基于GFP的供体受体对。五、抗体与蛋白质阵列技术蛋白芯片技术的出现给蛋白质组学研究带来新的思路。蛋白质组学研究中一个主要的内容就是研究在不同生理状态下蛋白水平的量变,微型化,集成化,高通量化的抗体芯片就是一个非常好的研究工具,他也是芯片中发展最快的芯片,而且在技术上已经日益成熟。这些抗体芯片有的已经在向临床应用上发展,比如肿瘤标志物抗体芯片等,还有很多已经应用再眼就的各个领域里。六、免疫共沉淀技术免疫共沉淀主要是用来研究蛋白质与蛋白质相互作用的一种技术,其基本原理是,在细胞裂解液中加入抗兴趣蛋白的抗体,孵育后再加入与抗体特异结合的结合于Pansobin珠上的金黄色葡萄球菌蛋白A(SPA),若细胞中有正与兴趣蛋白结合的目的蛋白,就可以形成这样一种复合物:“目的蛋白—兴趣蛋白—抗兴趣蛋白抗体—SPA\|Pansobin”,因为SPA\|Pansobin比较大,这样复合物在离心时就被分离出来。经变性聚丙烯酰胺凝胶电泳,复合物四组分又被分开。然后经Westernblotting法,用抗体检测目的蛋白是什么,是否为预测蛋白。这种方法得到的目的蛋白是在细胞内天然与兴趣蛋白结合的,符合体内实际情况,得到的蛋白可信度高。但这种方法有两个缺陷:一是两种蛋白质的结合可能不是直接结合,而可能有第三者在中间起桥梁作用;二是必须在实验前预测目的蛋白是什么,以选择最后检测的抗体,所以,若预测不正确,实验就得不到结果,方法本身具有冒险性。七、pull-down技术蛋白质相互作用的类型有牢固型相互作用和暂时型相互作用两种。牢固型相互作用以多亚基蛋白复合体常见,最好通过免疫共沉淀(Co-IP)、Pull-down技术或Far-western法研究。Pull-down技术用固相化的、已标记的饵蛋白或标签蛋白(生物素-、PolyHis-或GST-),从细胞裂解液中钓出与之相互作用的蛋白。通过Pull-down技术可以确定已知的蛋白与钓出蛋白或已纯化的相关蛋白间的相互作用关系,从体外传路或翻译体系中检测出蛋白相互作用关系。
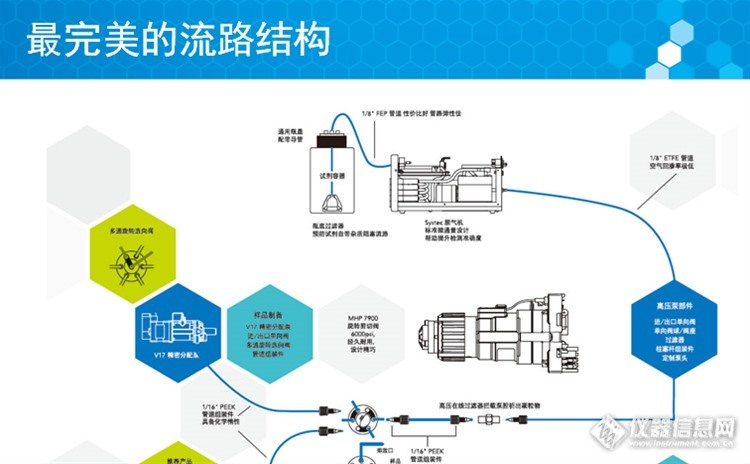
糖尿病是一种慢性病,随着经济生活水平的提高和社会老龄化的加剧,近年来患者人数在全球包括中国逐年递增,目前已严重威胁到国民的健康。对糖尿病的监测也越来越受到国家和人们的重视。作为全球公认的糖尿病检测"金标准",糖化血红蛋白(HbA1c)能够稳定可靠地反映出受检人在检测前90天到120天内的平均血糖水平,不受抽检时间、空腹与否或胰岛素等因素的干扰,经过国际临床化学和实验室医学联盟(IFCC)的技术验证和推广使用,使得糖化血红蛋白检测已成为诊断糖尿病的一种趋势。我们国家也参考国际公认的HPLC-LC-MS/MS方法,已经基本建立了自己的糖化血红蛋白检测一级参考体系。http://ng1.17img.cn/bbsfiles/images/2015/10/201510221629_570638_1587_3.jpg糖尿病检测方法以及主流仪器分析使用最先进的流体技术和产品,为您打造最优秀的HbA1c分析仪项目难度以及如何解决各类流路问题糖化血红蛋白(HbA1c)分析仪市场情况以及前景分析立即报名参与讲座:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/1689
称取研磨后的炉渣试样5.0g,用硼酸8克作粘结剂进行镶边垫底,压制成直径为40mm圆片, 要求压片表面光滑,不能有裂纹;硼酸不能混入测量表面,压制后用吸液球吹去表面浮渣以免掉入光孔损坏Be窗影响测定。试验表明:采用压力为1.96×105N,静压时间为60 s可获得良好的压片效果。经过多次制样分析试验发现,制样时取自然冷却样,破碎后用磁铁吸去渣中金属后过250um(160目)筛,光强值较稳定。因为转炉渣中的成分主要为12-26号的元素,故采用MO和HOPG 2个次级靶即可完成钢渣的分析,为减少轻元素的吸收,两个靶均在真空条件下进行. 用9个标样建立工作曲线,用多重回归的方法同时求取基体校正系数和校准曲线常数,用Luscas-Tooth&Price经验系数法校正元素之间吸收和增强效应。回归曲线方程为 Ci=slope·Ii+corrections+c0,i 式中Ci为分析元素浓度;Ii为分析元素强度;Corrections=∑ajIiIj+∑bkIi2Ik+∑clIiIl2+∑dmIm2 其中Ij, Ik, Il,Im为集体元素强度;aj, bk, cl, dm为校正系数,c0,i为校正偏差。通过实验对各元素校正曲线进行反复拟合,确定了如下系数:Mg(0.9988),Al(0.9996),Si(0.9984),FeO(0.9985)好了,现在你可以用先进的偏振能量色散X射线荧光光谱仪分析转炉渣啦!
[font=宋体][b][font=宋体]什么是[/font][font=Calibri]fc[/font][font=宋体]融合蛋白?[/font][/b][/font][font=宋体] [/font][font=宋体][font=Calibri][url=https://cn.sinobiological.com/resource/protein-review/fc-fusion-proteins][b]Fc[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/fc-fusion-proteins][b]融合蛋白[/b][/url]是一种由免疫球蛋白(如[/font][font=Calibri]IgG[/font][font=宋体]、[/font][font=Calibri]IgA[/font][font=宋体]等)的[/font][font=Calibri]Fc[/font][font=宋体]片段与目标蛋白序列融合而成的新型重组蛋白。通过将[/font][font=Calibri]Fc[/font][font=宋体]区域与其他蛋白质或肽段融合,可以赋予这些蛋白质或肽段新的特性和功能,同时利用[/font][font=Calibri]Fc[/font][font=宋体]区域的稳定性和免疫系统的[/font][font=Calibri]Fc[/font][font=宋体]受体相互作用,增强融合蛋白的稳定性和半衰期。例如,普通重组[/font][font=Calibri]IL-2[/font][font=宋体]的体内半衰期较短,只有[/font][font=Calibri]6.9[/font][font=宋体]分钟,这限制了其在体内的持续作用时间。然而,通过与免疫球蛋白的[/font][font=Calibri]Fc[/font][font=宋体]片段融合,重组[/font][font=Calibri]IL-2/Fc[/font][font=宋体]融合蛋白在体内半衰期延长了近[/font][font=Calibri]700[/font][font=宋体]倍,从而使其能够在体内更长时间地发挥作用。此外,延长半衰期还可以降低药物的剂量和频率,减少潜在的副作用和毒性。[/font][/font][font=宋体][font=Calibri]https://cn.sinobiological.com/resource/protein-review/fc-fusion-proteins[/font][/font][font=宋体] [/font][font=宋体][b]融合蛋白有哪些?[/b][/font][font=宋体] [/font][font=宋体][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/fusion-protein][b]融合蛋白[/b][/url]是一种由至少两个结构域组成的蛋白,这些结构域由被连接起来的独立基因编码,因此能够作为一个单元被转录和翻译,产生单克隆多肽。现在几乎所有的重组蛋白都是利用融合结构域制备,也被称为[/font][font=宋体]“标签”(参阅重组蛋白标签的完整列表)。因此,融合蛋白又称融合标签蛋白或嵌合蛋白。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]大体上有两种类型的融合蛋白:第一种是由两个蛋白或蛋白亚单位端对端融合,通常由一个[/font][font=Calibri]linker[/font][font=宋体]连接,第二种是来自两个供体的氨基酸穿插在融合蛋白产物中。[/font][/font][font=宋体] [/font][font=宋体][b]融合蛋白应用:[/b][/font][font=宋体] [/font][font=宋体]融合蛋白最重要的三个用途是:[/font][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]作为克隆基因纯化的辅助手段[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2.[/font][font=宋体]作为报告的表达水平[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3.[/font][font=宋体]作为组织化学标签,使蛋白质在细胞、组织或生物体中的位置可视化[/font][/font][font=宋体] [/font][font=宋体][font=宋体]融合蛋白在纯化中可以通过亲和层析简单方便地纯化,如葡萄球菌蛋白[/font][font=Calibri]A[/font][font=宋体]、谷胱甘肽[/font][font=Calibri]-S-[/font][font=宋体]转移酶[/font][font=Calibri](gst)[/font][font=宋体]、麦芽糖结合蛋白[/font][font=Calibri](mbp)[/font][font=宋体]和纤维素结合蛋白。 重组融合蛋白最常用作报告构建体的融合伙伴,包括 β[/font][font=Calibri]-[/font][font=宋体]半乳糖苷酶、荧光素酶和绿色荧光蛋白 [/font][font=Calibri](GFP)[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体]荧光融合蛋白[/font][font=宋体] [/font][font=宋体][font=宋体]在融合蛋白中,最多的一类称为荧光蛋白,如绿色荧光蛋白([/font][font=Calibri]GFP[/font][font=宋体])、橙色荧光蛋白([/font][font=Calibri]OFP[/font][font=宋体])和黄色荧光蛋白([/font][font=Calibri]YFP[/font][font=宋体])。 绿色荧光蛋白 [/font][font=Calibri](GFP) [/font][font=宋体]等荧光蛋白能够直接观察动态细胞内过程。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]绿色荧光蛋白([/font][font=Calibri]GFP[/font][font=宋体])是一种荧光蛋白,最初是从水母维多利亚发光管中分离出来的。 与荧光素酶不同,[/font][font=Calibri]GFP [/font][font=宋体]具有不需要任何底物、荧光素以及 [/font][font=Calibri]ATP[/font][font=宋体]、[/font][font=Calibri]O2 [/font][font=宋体]或 [/font][font=Calibri]Mg2+ [/font][font=宋体]的优势。 [/font][font=Calibri]GFP [/font][font=宋体]在被蓝光或紫外线激发时会发出绿光,在许多情况下可用于活的、完整的细胞和生物体,从而确保 [/font][font=Calibri]GFP [/font][font=宋体]作为自发荧光蛋白的功能。[/font][/font][font=宋体] [/font][font=宋体]融合蛋白标签[/font][font=宋体] [/font][font=宋体][font=宋体]在融合标签中,既有短序列(如[/font] [font=Calibri]PolyHis[/font][font=宋体]、[/font][font=Calibri]PolyArg[/font][font=宋体]、[/font][font=Calibri]FLAG[/font][font=宋体]、[/font][font=Calibri]c-Myc[/font][font=宋体]、[/font][font=Calibri]Streptag [/font][font=宋体]等),也有大蛋白([/font][font=Calibri]GST[/font][font=宋体]、[/font][font=Calibri]MBP [/font][font=宋体]等)。 在许多情况下,短序列不会影响分子的三级结构及其生物学特性,而大融合分子更常用于增强所需蛋白质的溶解度。 与短序列标签不同,需要从重组构建体中去除大的融合标签。[/font][/font][font=宋体] [/font][font=宋体]有许多融合标签,既包含经过充分验证的标签,也包含最近开发的具有各种特性和不同优缺点的标签。[/font][font=宋体] [/font][font=宋体][font=宋体]详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/fusion-protein[/font][/font]