“鸟枪法(shotgun)”定量蛋白质组学技术介绍
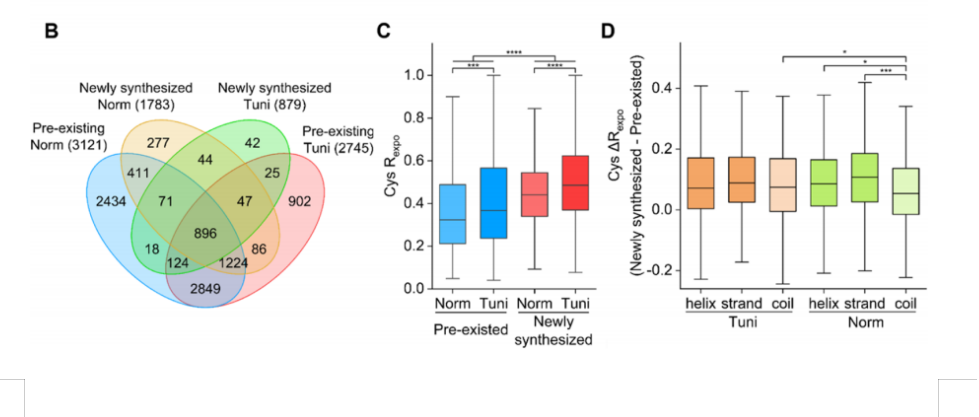
p 简介: /p p 1999年,Yates研究组提出“鸟枪法”(shotgun),其基本技术路线是针对液体或SDS-PAGE条带的复杂混合物用酶(Trypsin)酶解成肽段混合物,然后对肽混合物进行多维毛细管液相色谱分离和串联质谱分析以及数据库检索,从而确定蛋白质的种类,可同时鉴定成百上千种蛋白质。他们把这种思路称为多维蛋白质鉴定技术,即Mud PIT(multidi-mensional protein identification technology)。与传统的双向电泳技术相比具有灵敏度更高,动态检测范围更广等特点。 /p p 鸟枪法(shotgun)可以分析全细胞裂解样品和组织抽提物,也可以分析亚细胞分级组分、分离的细胞器等其他亚蛋白质组。如果样品已经过稳定同位素标记。根据不同标记的信号强度比例就可以精确确定化学上具有均一性的蛋白在不同样品中的相对丰度,这种多重分析可以利用在谱图上产生前后次序的质量标记得以完成。质谱分析以前在样品中加入同位素标记的某种质量校准肽,通过对此肽的相对定量就可以获得绝对定量的信息。实现目的肽段的绝对定量,而这一性质可以被充分应用以提供临床诊断的标准值或阈值。 /p p 差异蛋白质的定量研究是基于肽段水平而非完整的蛋白质,成为该技术最大的技术特色,该技术实现了样品分离与鉴定直接联合,完全自动化操作,可以用于各种蛋白质混合物的蛋白质组学分析,如血清、组织、各种体液以及尿液等。 /p p 技术路线: /p p 鸟枪法为基因组测序,是先将基因组打断,分段测序, 然后利用计算机重组在一起。从而确定一段的基因序列。 /p p 鸟枪法在蛋白质组研究中的应用方式与此相类似,首先将蛋白质混合物酶解成肽段的混合物, 利用质谱进行分析确定该肽段的氨基酸序列,然后计算机根据设定好的运算法则根据肽段的信息在理论蛋白质数据库中检索出这些蛋白质,从而确定该混合物中的蛋白质成分。 /p p style=" text-align: center " img title=" 1.gif" style=" float: none " src=" http://img1.17img.cn/17img/images/201709/insimg/130ae366-baaa-4006-9cf4-2c70b8441925.jpg" / /p p style=" text-align: center " img title=" 2.gif" style=" float: none " src=" http://img1.17img.cn/17img/images/201709/insimg/fe437d70-d969-4f29-a6c9-4e8e1d3e7b65.jpg" / /p p 分析目标: /p p 寻找差异表达蛋白,并分析蛋白功能。 /p p Gene ontology分析 /p p GO数据库包含了基因参与的生物过程,所处的细胞位置,发挥的分子功能三方面功能信息,并将概念粗细不同的功能概念组织成DAG(有向无环图)的结构。Gene Ontology是一个使用有控制的词汇表和严格定义的概念关系,以有向无环图的形式统一表示各物种的基因功能分类体系,从而较全面地概括了基因的功能信息,纠正了传统功能分类体系中常见的维度混淆问题。在基因表达谱分析中,GO常用于提供基因功能分类标签和基因功能研究的背景知识。利用GO的知识体系和结构特点,旨在发掘与基因差异表达现象关联的单个特征基因功能类或多个特征功能类的组合。 /p p 对于每一种表达趋势的基因,选择性的进gene ontology功能分析。对差异表达的所有基因向gene ontology数据库的各节点映射。计算每个节点的基因数目,并结合整个数据库的基因作为背景分部,对于每个节点,得到一个2x2的表格,使用超几何分布检验基因在每个GO节点的富集或贫乏程度。 /p p Pathway enrichment分析 /p p 找出差异表达基因在生物学通路中的位置,以阐明其生物学功能以及不同基因之间的相互作用。 /p p 1)把差异表达基因定位在生物学通路(Pathway)上。 /p p 2)统计分析,确定差异基因可否可以代表某些生物学通路 /p p 优点:信息量大,样本量低,检测低丰度蛋白更多,相对定量 /p p 应用领域: /p p 1)差异蛋白组分析(疾病早期诊断、疗效监测) /p p 2)细胞差异性分析(如正义转染vs空载、目标基因RNAi vs空载) /p p 3)疾病标志检测(肿瘤标志物,如无血清培养后的分泌蛋白质组) /p p 4)治疗检测(术前vs术后) /p p 5)药物开发(给药vs对照) /p p 6)癌症研究(原位肿瘤细胞系vs转移) /p p Shotgun法可以检测动态范围10000:1内的低丰度肽段,是目前蛋白质组学研究最主要的技术路线。 现已成功应用于中大规模蛋白质的分离鉴定,不再依赖于双向凝胶电泳。 /p p 因大部分蛋白质在酶解后总有部分肽段是可用质谱鉴定的,因此,多维蛋白质鉴定技术弥补了碱性、疏水蛋白质、相对分子量极大和极小蛋白质在分离和鉴定方法上的不足。 /p p 该方法可达到对低丰度蛋白、极端等电点、分子量、完整膜蛋白具有与其他蛋白有相同的灵敏度。 如鸟枪法可鉴定出10个跨膜域以上的膜蛋白,而2DE仅能检测出2~4个跨膜域的。 /p p Shotgun法可实现自动化、快速、高通量的蛋白组学分析。 /p p 但Shotgun法数据冗余复杂,需要专业人员进行分析。 /p p 在医学领域,Shotgun技术可用于以下方面: /p p 除血清血浆外,还可用于研究体液及组织的蛋白组 /p p 分泌蛋白组 /p p 大脑皮层神经元细胞蛋白组 /p p 新生物标记物的发现 /p p 疫苗研究,分析感染源的表面蛋白质,从而发现潜在的抗原。如,在分析人类疟疾致病源plasmodium falciparum时,发现了大量潜在的抗原, 目前这些抗原的特性巳经被评估出来。 /p p 发现新的药靶。如,研究发现甲硫氨酸氨基肤酶是肿瘤生长抑制因子bengmide的分子作用靶点。 /p p 部分参考文献: /p p 1)A proteomics approach to discovering natural products and their biosynthetic pathways, Stefanie B Bumpus, Bradley S Evans, Paul M Thomas, Ioanna Ntai1, Neil L Kelleher, Nature Biotechnology,27,951-956,2009 /p p 2)High-throughput generation of selected reaction-monitoring assays for proteins and proteomes, Paola Picotti, Oliver Rinner, Robert Stallmach, Franziska Dautel, Terry Farrah, Bruno Domon, Holger Wenschuh, Ruedi Aebersold, Nature Methods 7, 43-46 (6 December 2009) /p p 3)Large-scale analysis of the yeast proteome by means of multidimensional protein identification technology, M.P. Washburn, D. Wolters and J. R. YatesNature Biotechnology, 19, 242-247, 2001 /p p 4)Comparison of alternativeanalyticaltechniques for the characterisationof thehuman serumproteomein HUPO Plasma ProteomeProject, XiaohaiLi, Xiaohong Qian etc. Proteomics, 5, 3423–3441,2005 /p p 5)An Automated Multidimensional Protein Identification Technology for Shotgun Proteomics, Dirk A. Wolters, Michael P. Washburn, and John R. Yates, Anal. Chem., 73 (23), 5683-5690, 2001 /p p & nbsp /p