在我们的传统印象中,溶剂有优级纯,分析纯,化学纯,实验纯。但是当我们走进分析实验室,接触检测以后,才知道实验试剂还用光谱纯和色谱纯等划分。本文重点介绍色谱纯!色谱纯顾名思义,就是在色谱条件下,溶剂本身无杂质干扰。色谱纯不一定比分析纯更纯,但是一定要保证干扰小,或者无干扰,试剂如此,溶剂也如此。色谱纯溶剂的干扰尤其在杂质分析中尤为重要,特别是药物分析的杂质分析中很重要。所以即使有好的色谱柱,还是要有好的帮手去辅助分离,正所谓好马配好鞍!色谱分析从来不是孤立的体系。选择纯度高,质量好的色谱纯溶剂往往能使的检测效果更加卓越!下一次,我将和大家沟通一下,色谱纯溶液的验收!
顶空气相色谱法(HS-GC)已经被制药企业的实验室采用了很多年,但是人们尚未找到过一种挥发性有机物杂质背景值含量极低的溶剂。最近几年,随着检测器的灵敏度不断的增加,残留溶剂最小量的控制要求也越来越严格,所以寻找一种高质量并且适用于HS-GC-FID/HS-GC-MS分析的溶剂成为大势所趋。 在药物生产过程中,无论是原材料还是成品,残留溶剂的分析都是十分必要的。与样品其他组分相比,残留溶剂沸点具有沸点低、易挥发等特点,最合适的分析方法便是使用氢火焰离子化检测器(FID)或者质谱检测器(MS)的顶空气相色谱法。样品需要被溶解于一种无残留溶剂的高沸点溶剂。样品在高温下被孵化,残留溶剂就能以气态和样品的其他组分分离,从而进行HS-GC-FID/HS-GCMS。 气相色谱顶空溶剂中如甲醇、乙腈、乙醇、异丙醇、正丙醇、正丁醇、环己烷、正己烷、正庚烷、二恶烷、二氯甲烷、吡啶、四氢呋喃、叔丁基甲醚、乙酸乙酯、乙酸丁酯、乙酸异丙酯、苯系物(甲苯、乙苯、二甲苯)等数十种有机挥发性化合物杂质背景值极低,均低于1ppm。产品货号 产品名称 品牌 规格4.109001.1000 气相顶空级N,N-二甲基甲酰胺,DMF,for HS-GC CNW 1L 4.109002.1000 气相顶空级N,N-二甲基乙酰胺,DMA,for HS-GC CNW 1L 4.109003.1000 气相顶空级二甲基亚砜,DMSO,for HS-GC CNW 1L 4.109004.1000 气相顶空级1,3-二甲基-2-咪唑啉酮,DMI,for HS-GC CNW 1L 4.109005.1000 气相顶空级N-甲基吡咯烷酮,NMP,for HS-GC CNW 1L 4.109006.1000 气相顶空级环己酮,for HS-GC CNW 1L 4.109008.1000 吹扫捕集级甲醇,for purge and trap CNW 1L 4.109007.1000 气相顶空级水,for HS-GC CNW 1L
可否用分析纯的溶剂代替色谱级的溶剂来作为液相色谱的流动相?
可否用分析纯的溶剂代替色谱级的溶剂来作为液相色谱的流动相?
[color=#3e3e3e]用溶剂清洗色谱柱包括将色谱柱从GC上卸下来,并将几毫升溶剂至于色谱柱中。任何可溶于清洗剂的残留物就会从色谱柱中去除。如果未卸下色谱柱就注入大量溶剂,将不能清洗色谱柱,也不能从色谱柱中去除任何污染物。毛细管GC色谱柱必须具有键合和交联的固定相才可以使用溶剂进行清洗。使用溶剂清洗非键合的固定相会严重损坏色谱柱。[/color][color=#3e3e3e] [/color][color=#3e3e3e] 可使用色谱柱清洗装置来将溶剂注入色谱柱中,溶剂冲洗装置会连接到有压力的气源(N2或He),并把色谱柱插入到清洗装置中。把溶剂加入样品瓶中,然后使用气源对溶剂瓶回压。压力会强制溶剂流过色谱柱。残留物将溶解到溶剂中,并随溶剂反冲出色谱柱。然后将溶剂吹扫出色谱柱,并对色谱柱进行适当的老化。[/color][color=#3e3e3e] [/color][color=#3e3e3e] 清洗色谱柱前,从色谱柱的前端将其切去半米(即靠近进样器的一端)。将色谱柱连接检测器的一端插入清洗装置中。通常使用多种溶剂来清洗色谱柱。后面继续使用的溶剂必须与前面的溶剂互溶。一定不要使用高沸点溶剂,特别是不要用作最后使用的溶剂。溶解样品的溶剂通常是不错的选择。[/color][color=#3e3e3e] [/color][color=#3e3e3e] 建议使用甲醇、二氯甲烷和已烷,它们在大多数情况下都不错。可使用丙酮替代二氯甲烷、以避免使用含氯溶剂,但是二氯甲烷是最好的清洗溶剂之一。如果注射的是水性样品(例如生理体液或组织),则请在使用甲以前先使用水来冲洗。某些来自于水性样品残留物只能溶于水中而不溶于有机溶剂。应使用水和醇类(例如甲醇、乙醇和异丙醇)来清洗键合的聚乙二醇基固定相,但一般不建议采用该方法。[/color][color=#3e3e3e] [/color][color=#3e3e3e] 下表列出了针对各种直径的色谱柱,建议使用的溶剂的体积。使用大量溶剂虽无害,但效果不会好很多,并且还十分浪费。加入第一种溶剂后,对清洗装置加压,但要低于20psig。使溶剂流速低于1ml/min。除大多数0.53mm内径的色谱柱外,在流速达到1ml/min之前清洗装置的压力将先达到20psi。如果使用的是比重较大或粘度较大的溶剂,或色谱柱长度长或内径小,则需要较长的清洗时间。第一种溶剂全部进入或大部分进入色谱柱中后,加入下一种溶剂。当开始加入第二种溶剂后,上一种溶剂不要完全赶出色谱柱。[/color][color=#3e3e3e] [/color][color=#3e3e3e] 最后一种溶剂流出色谱柱后,让加压的气体流入色谱柱5-10分钟,将色谱柱装入进样口,然后通入载气。将载气通入色谱柱5-10分钟。把色谱柱连接到检测器上(或也可以不接检测器)。使用程序升温,从40℃-50℃开始将色谱柱以2-3℃/min的速度达到温度上限。将此温度保持1―4个小时,直至色谱柱完全老化为止。[/color][color=#3e3e3e][/color][color=#3e3e3e]冲洗色谱柱的溶剂体积[/color][table][tr][td][color=#3e3e3e]色谱柱内径(mm)[/color][/td][td][color=#3e3e3e]溶剂体积(ml)[/color][/td][/tr][tr][td][color=#3e3e3e]0.18-0.2[/color][/td][td][color=#3e3e3e]3-4[/color][/td][/tr][tr][td][color=#3e3e3e]0.25[/color][/td][td][color=#3e3e3e]4-5[/color][/td][/tr][tr][td][color=#3e3e3e]0.32[/color][/td][td][color=#3e3e3e]6-7[/color][/td][/tr][tr][td][color=#3e3e3e]0.45[/color][/td][td][color=#3e3e3e]7-8[/color][/td][/tr][tr][td][color=#3e3e3e]0.53[/color][/td][td][color=#3e3e3e]10-12[/color][/td][/tr][/table]
[align=center][b]谈谈溶剂对色谱柱的影响[/b][/align][b]毫无疑义,溶剂系统对液相色谱分析有重要的影响。现在有商品化的色谱纯溶剂,极大的方便了日常的检测工作。但是我们经常可以看到这样的描述,在检测开始前,色谱纯溶剂要经过微孔滤膜进行过滤。这样做有意义吗?能够真正起到保护色谱柱的作用吗?对于色谱纯溶剂,有国产和进口之分。国产色谱纯溶剂的质量良莠不齐,用微孔滤膜过滤是必须的。我以前听企业的人说,国产的色谱纯溶剂容易堵色谱柱,就是用微孔滤膜过滤以后效果还是不好。其实大家一直忽略了一个问题,就是在过滤的过程中,多次转移造成的交叉污染是不可控制的。但是对于大品牌进口溶剂来言,我认为通过微孔滤膜过滤不仅不能起到过滤的目的,反而会引进污染,往往是越过滤越脏。通常的溶剂过滤系统都是开放的敞开体系,在溶剂过滤的过程中过滤瓶的瓶壁,空气中的尘埃,溶剂转移过程中造成的交叉污染都有可能将污染物带入溶剂系统中。而我们知道,进口溶剂的蒸发残渣不会超过3ppm,这种影响对于色谱柱本身而言,相比于交叉污染的影响来说,是可以忽略不计的。另外,色谱柱本身也是耗材,自身是有使用寿命的。我们能够做到的就是好马配好鞍,这样才能最有效的提高色谱柱的使用寿命。 溶剂系统除了色谱纯的溶剂之外,还有水,做液相色谱的时候,我们通常需要引入水相作为溶剂系统。有的人会将超纯水通过微孔过滤系统进行过滤处理。这种处理有意义吗?有必要吗?超纯水在经过处理以后,已经具备了直接进液相色谱的条件了,再次处理无异于画蛇添足。反而非常容易将尘埃、微生物引入色谱系统中。笔者认为,最好的超纯水系统是用蒸馏水做水源,进行二次处理。对于溶剂系统,您有什么看法,希望您可以发表不同的意见和看法,共同学习,共同进步![/b]
我是大学生,最近学习气相色谱。我用的溶剂是乙酸,条件是厂家给的条件:柱箱温度:190度,气化室温度:300,检测室温度:280,厂家用的色谱柱是OV-17毛细管柱。我学校的色谱柱是30QC3/AC20 0.5。我是按照这些条件做的,进样量0.1/0.2uL。出来的色谱图只有溶剂峰能和厂家给的色谱图对上,其他的峰都没有出来,只有许多很小的峰,而厂家给的的谱图中原料的峰也是很大的,可我却怎么也弄不峰来。溶液的浓度我试过了,从低到高,基本都一样,只出溶剂峰,其他就是一些很小的峰。我想请问大家,我应该从哪些方面解决这个问题呢?色谱柱不行?这两个差别大吗?条件不合适?谢谢大家能够给我提供宝贵意见!
比如样品的定容的溶剂不一样,峰形也会不一样,这就需要我们选择合适的溶剂来溶解。不知道气相色谱是否存在存在溶剂效应?
用溶剂清洗毛细管色谱柱的方法,包括将要清洗的色谱柱从GC上卸下来,并将几毫升溶剂注入色谱柱中。 任何可溶于清洗溶剂的残留物就会从色谱柱中去除。如果仪器分析未卸下色谱柱,就注入大量溶剂,将不能清洗色谱柱,也不能从色谱柱中去除任何污染物。毛细管GC色谱柱必须具有键合和交联的固定相才可以使用溶剂进行清洗。若使用溶剂清洗非键合的固定相会严重损坏色谱柱。 可使用色谱柱清洗装置来将溶剂注入色谱柱中。溶剂清洗装置会连接到有压力的气源(N2或He),同时把色谱柱插入阿斗清洗装置中。把溶剂加入到样品瓶中,分析化学任何使用气源对溶剂瓶加压。压力会强制溶剂流过色谱柱。残留物将溶解在溶剂中,并随溶剂反冲出色谱柱。然后将溶剂吹扫出色谱柱,并对色谱柱进行适当的老化。 清洗色谱柱前,从色谱柱的前端敬爱能够其切去0.5米(即靠近进样器的一端)。将色谱柱连接检测器的一端插入清洗装置中。通常使用多种溶剂来清洗色谱柱。后面继续使用的溶剂要必须要与前一种溶剂互溶。分析化学一定不要使用高沸点溶剂,特别是不要作为最后使用的溶剂。溶解样品的溶剂通常是不错的选择。 建议使用甲醇、二氯甲烷和己烷,它们在大多数情况下效果不错。可使用丙酮代替二氯甲烷,以避免使用含氯溶剂,但是,二氯甲烷是最好的清洗溶剂之一。 两篇不错的气相色谱经验文章:《气相色谱仪器故障排除方法(不出峰与灵敏度降低)》 《经验:气相色谱维修维护经验谈》 如果测定的样品是水性的样品,如:生理体液和组织,则请在使用甲醇以前先使用水来冲洗。某些来自于水性样品的残留物只能溶于水中而不溶于有机溶剂。应使用水和醇类(如:甲醇、乙醇和异丙醇)来清洗键合的聚乙二醇基固定相(如:DB-WAX、DB-WAXetr、B-FFAP、HP-Innowax),但一般不建议采用该方法。 表中列出了针对各种直径的色谱柱,建议使用的溶剂的体积。使用大量溶剂虽然无害,但效果不会好很多,并且还十分浪费。加入第一种溶剂后,对清洗装置加压,但要低于20psi。使用可保持溶剂流速低于1mL/min的最高压力。除大多数0.53mmm内径的色谱柱外,在流速达到1mL/min之前清洗装置的压力将先到达20psi。如果使用的是比重较大或粘度较大的溶剂,或色谱柱直径小或长度大,则需要较长的清洗时间。待第一种溶剂全部进入或大部分已进入色谱柱中后,加入下一种溶剂。仪器分析待清洗的溶剂流出色谱柱后,让加压的气体通入色谱柱5-10分钟。将色谱柱装入进样口然后通入载气。将载气通入色谱柱5-10分钟。把色谱柱连接到检测器上(或也可以根据个人意愿不接到检测器上)。使用程序升温,从40-50℃开始将色谱柱以2-3℃/min的升温速率,直至达到温度上限。将此温度保持1-4个小时,直至色谱柱完全老化为止。
[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]质谱检测时溶剂的选择一方面要顾及质谱检测器的离子源不受损害,又要尽量使色谱柱的使用寿命延长,更要保证对样品与目标物质的溶解性以及前处理时萃取、洗脱等等步骤的可操作性,而[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]质谱不可用水、甲醇等作溶剂的说法也是众说纷云,就连一些仪器厂商的工程师也经常含糊,现请各位网友各抒己见,如果有实际经验更欢迎现身说法,欢迎大家踊跃讨论~~~
对于[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url],检测器为ECD或FPD等选择性检测器,为什么溶剂也会出峰?比如[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]-FPD带磷滤光片时,原则上它只能使含磷的化合物有检出,但是用丙酮作为溶剂时,丙酮也会出很大的峰,这是为什么?
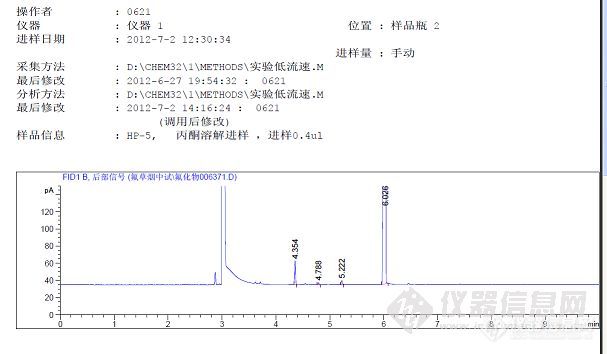
大家好,我在安捷伦的培训教材上看到说溶剂峰拖尾是由于检测器端色谱柱有活化中心,我把色谱柱切去一点后还是拖尾呢,有没有什么更好的办法解决呢?我的分析条件HP-5,30m*0.32mm*0.25um,样品用丙酮溶解呢。附件中有典型的图谱,就是溶剂拖尾严重。求助中http://ng1.17img.cn/bbsfiles/images/2012/07/201207072306_376406_2327340_3.jpg
[size=3][font=宋体] 用溶剂清洗毛细管色谱柱的方法,包括将要清洗的色谱柱从[/font][font=Times New Roman]GC[/font][font=宋体]上卸下来,并将几毫升溶剂注入色谱柱中。[/font][/size][size=3][font=宋体] 任何可溶于清洗溶剂的残留物就会从色谱柱中去除。如果未卸下色谱柱,就注入大量溶剂,将不能清洗色谱柱,也不能从色谱柱中去除任何污染物。毛细管[/font][font=Times New Roman]GC[/font][font=宋体]色谱柱必须具有键合和交联的固定相才可以使用溶剂进行清洗。若使用溶剂清洗非键合的固定相会严重损坏色谱柱。[/font][/size][font=宋体][size=3] 可使用色谱柱清洗装置来将溶剂注入色谱柱中。溶剂清洗装置会连接到有压力的气源([/size][/font][size=3][font=Times New Roman]N2[/font][font=宋体]或[/font][font=Times New Roman]He[/font][font=宋体]),同时把色谱柱插入阿斗清洗装置中。把溶剂加入到样品瓶中,任何使用气源对溶剂瓶加压。压力会强制溶剂流过色谱柱。残留物将溶解在溶剂中,并随溶剂反冲出色谱柱。然后将溶剂吹扫出色谱柱,并对色谱柱进行适当的老化。[/font][/size][font=宋体][size=3] 清洗色谱柱前,从色谱柱的前端敬爱能够其切去[/size][/font][size=3][font=Times New Roman]0.5[/font][font=宋体]米(即靠近进样器的一端)。将色谱柱连接检测器的一端插入清洗装置中。通常使用多种溶剂来清洗色谱柱。后面继续使用的溶剂要必须要与前一种溶剂互溶。一定不要使用高沸点溶剂,特别是不要作为最后使用的溶剂。溶解样品的溶剂通常是不错的选择。[/font][/size][font=宋体][size=3] 建议使用甲醇、二氯甲烷和己烷,它们在大多数情况下效果不错。可使用丙酮代替二氯甲烷,以避免使用含氯溶剂,但是,二氯甲烷是最好的清洗溶剂之一。[/size][/font][size=3][font=宋体] 如果测定的样品是水性的样品,如:生理体液和组织,则请在使用甲醇以前先使用水来冲洗。某些来自于水性样品的残留物只能溶于水中而不溶于有机溶剂。应使用水和醇类(如:甲醇、乙醇和异丙醇)来清洗键合的聚乙二醇基固定相(如:[/font][font=Times New Roman]DB-WAX[/font][font=宋体]、[/font][font=Times New Roman]DB-WAXetr[/font][font=宋体]、[/font][font=Times New Roman]B-FFAP[/font][font=宋体]、[/font][font=Times New Roman]HP-Innowax[/font][font=宋体]),但一般不建议采用该方法。 [/font][/size]
DikmaPure 高纯溶剂HPLC 和农残分析用高纯溶剂 特别纯化处理,开瓶即用 充氮保护,亚微米过滤 严格的质量控制,高品质保证 价格合理色谱级(HPLC)级溶剂特别保证高纯度平滑的紫外吸收曲线低紫外吸收低于或接近理论截止波长低蒸发残留低含水量农残级(P.R.)溶剂特别保证超过或达到ACS 标准特殊纯化处理对ECD 检测有响应的杂质含量被控制在ppt 水平对FID 检测有响应的杂质含量被控制在ppb 水平非常低的蒸发残留
HW06废有机溶剂色谱测定组分含量,有没有成熟的色谱柱可以有效分离其中各组分,色谱条件如何?
小弟色谱柱是:DB-5MS,能检测溶剂为“正己烷”的液体样品吗???急急急急!!!求各位发表己见为谢
[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]中色谱柱对溶剂有作用力吗?柱子为聚乙二醇石英毛细管色谱柱,溶剂为丙酮,请问柱子对溶剂有力的作用吗?
(气相色谱)我们公司开发的新产品的气相色谱待检残留溶剂的确定一般是根据合成中使用的溶剂、原料中引入的溶剂来作为待检溶剂,但是原料很多,所以我们建立一个新产品溶剂残留的方法是要做许多的溶剂,然后做方法学验证,,不知道大家都是怎么确定待检溶剂的?
[color=#444444]我买来的标准品甲酯是五种混标,分别是(棕榈酸,硬脂酸,油酸,亚油酸,亚麻酸)甲酯。在进[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]前,配置不同浓度时,所用的溶剂是异辛烷色谱纯,我的样品是核桃油脂肪酸,所用的溶剂是正己烷色谱纯,标品的溶剂和样品溶剂不一样可以吗?[/color]
请问手动或自动进样器的洗针溶剂,您使用分析纯还是色谱纯溶剂?
作为气相色谱的新手,对溶剂的效应十分困惑,谁能详细给我讲述一下溶剂效应呢?先说说我自己的理解,溶剂气话后进入色谱柱,冷凝 ,如果溶剂的极性和固定相相差大,将不能和固定相很好的结合,这将导致溶剂分布较宽,由于样品分布在溶剂里面样品也会展宽。其次,冷凝是部分冷凝怎么办,会不会一部分液态保留了,气态的跑了。希望高手能为我解惑。
在[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]中除了测三苯的二硫化碳一般用无苯级别的,其他的溶剂一般用什么级别的。有好点无苯级别的国产二硫化碳推荐吗?一直用进口感觉太贵了。
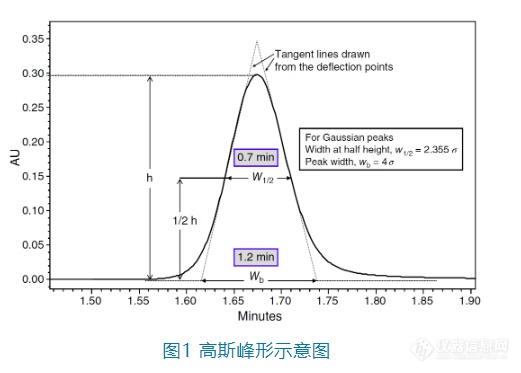
[size=14px]峰形问题是反相色谱分析中最常遇到的问题之一。造成峰形问题的原因有很多,[/size][size=14px]本次我们重点讨论在反相色谱中由于稀释剂与初始流动相的差异造成的峰形问题,也就是常说的“溶剂效应”及其内在原因和应对方法。[/size][size=16px][b][color=#007aaa]1. 为什么我们需要好的色谱峰形?[/color][/b][/size][size=14px]色谱分析是一种非常追求准确度的分析手段,理想的峰形是高斯(Gaussian)峰形,也就是呈正态分布,左右对称。但是在实际情况下,色谱峰或多或少都会有点前延(fronting)或者拖尾(tailing),甚至完全不成单峰等,这样[/size][size=14px][color=#7b0c00]不仅影响分析人员看到图谱时的心情,也会降低色谱峰的灵敏度、峰面积的积分准确度以及色谱峰之间的分离度[/color][/size][size=14px]。[/size][align=center][img=,521,373]https://ng1.17img.cn/bbsfiles/images/2022/12/202212011443520791_9645_3237657_3.png!w521x373.jpg[/img][/align][align=center][/align][size=16px][b][color=#007aaa]2. 什么是理想的样品稀释剂?[/color][/b][/size][size=14px]在分析HPLC中,往往建议稀释剂为起始流动相(但在制备HPLC中,使用比流动相更弱的稀释剂更利于更大的进样体积),以避免对分离分析产生不利影响。但是在实际的工作中,样品的预处理往往使得其稀释剂和起始流动相有了很大的差异,也有一些分析方案中会建议通过蒸发除去样品预处理中的溶剂后再用起始流动相溶解样品。但是这种额外的步骤很费时间,甚至超过了HPLC分析的时间,只有在万不得已的时候才选择。也有基于其他考虑(如溶解性、样品稳定性等)而选择和流动相不一致的溶剂作为稀释剂。但是[/size][size=14px][color=#7b0c00]不管是何种稀释剂,只要能稳定溶解足够的样品,且对峰形等不会产生不利影响,就是理想的稀释剂[/color][/size][size=14px]。[/size][size=16px][b][color=#007aaa]3. 溶剂效应的原因有哪些?如何应对?[/color][/b][/size][size=15px][b][color=#007aaa]3.1 稀释剂与流动相的洗脱强度不匹配[/color][/b][/size][size=15px][b][color=#007aaa][/color][/b][/size][size=14px]当稀释剂的洗脱强度强于起始流动相时,也就是有机相(%B)的比例高于流动相时,我们可以估算出保留的改变(Δ[i]k[/i]):[/size][align=center][img=,203,75]https://ng1.17img.cn/bbsfiles/images/2022/12/202212011445102816_8758_3237657_3.png!w203x75.jpg[/img][/align][size=14px]其中[i]S[/i]和每种溶质的特性有关,[i]S[/i] ≈ 0.25 MW[sup]0.5[/sup],MW为分子量。如果我们选择了一种典型的400 Da的小分子,当B%变化10%([/size][size=14px]即[i]Φ[/i]=0.1[/size][size=14px])时[i],S[/i] ≈ 0.25×400[sup]0.5[/sup]=5,Δ[i]k[/i] ≈ 10[sup]5×0.1[/sup] ≈ 3.2。这意味着B相的10%的增加或者降低会导致三倍的的保留因子K的降低或者增加,也就是常说的“三倍规则”。如果一个样品的稀释剂比流动相强,进样的溶液在跑过柱子的过程中,它会和流动相以相同的流速移动,但是其中的样品分子的移动速度会比溶解在流动相时更快,进样成分会被流动相逐渐稀释直到和流动相完全一致。我们把进样的液体形象地称为“样品塞”,紧跟“样品塞”的流动相会稀释它,因此尾部的溶质分子的前进速度会慢下来,以正常的洗脱速度前进。[/size][size=14px][color=#7b0c00]虽然这些过程发生的速度很快,但是如果稀释剂足够强、进样体积足够大,还是会有明显的峰展宽[/color][/size][size=14px]。[/size][size=14px]Dolan作了图来更加直观地说明这种现象,在图2中每个水平放置的长条代表充满流动相(用小圆黑点表示)的色谱柱。在上面三个例子中,进到流动相的样品用棋盘格表示,随着时间的流逝从状态A逐步变到状态B和C,样品流经色谱柱,发生了稍微的峰展宽。在下面三个例子中,样品溶解在更强的溶剂中(斜线表示),A'为刚进样后的状态,“样品塞”占据的体积和A一样,因为进样量相同;在B'中,由于“样品塞”里的溶剂比流动相更强,溶解其中的样品分子会以比正常情况更快的速度通过色谱柱,与此同时尾部被流动相稀释的部分溶质分子的通过速度降低至正常速度(棋盘格部分),这样即使“样品塞”更窄(也就是进样量更少),由于前后端的稀释,样品扩散的空间也会更大;在C'中,“样品塞”基本都被稀释了,但是峰展宽一直在发生,直到所有样品都溶解在流动相中。[/size][align=center][/align][align=center][img=,690,328]https://ng1.17img.cn/bbsfiles/images/2022/12/202212011445266041_6974_3237657_3.png!w690x328.jpg[/img][/align][align=center][/align][size=14px]在某些更极端的条件下,稀释剂的强度太大还可能导致色谱峰出现裂分甚至完全不成峰形。[/size][align=center][/align][size=14px]当由于稀释剂由于和流动相的溶剂强度不匹配而造成峰形异常时,该如何应对?[/size][size=14px][color=#7b0c00]1. 降低稀释剂的洗脱强度;[/color][/size][size=14px][color=#7b0c00]2. 降低样品的进样体积。进样体积越小,样品就越容易被流动相稀释掉。Dolan实验室尝试过在反相流动相中进样1 μL以甲苯为溶剂的样品时,可以得到满意的结果。[/color][/size][size=14px][color=#7b0c00]但是稀释剂与流动相的洗脱强度不匹配并不能解释所有情况[/color]。比如Tseing和Roger发现分析二羟基苯的异构体时,不管是将甲醇作为稀释剂,水作为流动相还是水作为稀释剂,甲醇作为流动相,最终都得到双峰,但是当稀释剂和流动相一致时,就可以得到单峰;Zapata和Garrido也发现在分析叶绿素时,当使用丙酮-水(69:31)为稀释剂,甲醇-水(95:5)为流动相时,虽然两者洗脱强度一致,但是叶素绿的峰为多峰。经过研究后发现这和稀释剂与流动相之间的[color=#7b0c00]黏度不匹配[/color]有关。[/size][size=15px][b][color=#007aaa]3.2 稀释剂与流动相的黏度不匹配[/color][/b][/size][size=14px]当稀释剂与流动相之间的黏度不一致时,会发生黏性指进(viscous fingering)这种流体力学不稳定现象。也就是低黏度的溶剂会如伸出手指一般向高粘度渗透,[/size][size=14px][color=#7b0c00]同时这种渗透是随机的,不可预测[/color][/size][size=14px]。如图3,黑色部分就是低黏度的溶剂,在更高粘度的背景溶剂中如树枝般随机“生长”。[/size][align=center][/align][align=center][img=,420,395]https://ng1.17img.cn/bbsfiles/images/2022/12/202212011445442312_5735_3237657_3.png!w420x395.jpg[/img][/align][align=center][/align][size=14px]在色谱分析中,稀释剂与流动相的黏度不匹配对谱图的影响不仅与稀释剂与流动相黏度的不匹配程度有关,也与样品溶质及样品溶剂的迁移速度有关。当黏度差异相同时,样品的溶质与溶剂在越短的时间内洗脱,且洗脱时间越接近时,对峰形的不利影响就越明显,这种现象在体积排阻色谱(SEC)中比较常见。[/size][size=14px]正如上面提到的这种“黏性指进”是随机的,因此[/size][size=14px][color=#7b0c00]往往连续进样时峰形不能重现(如图4),这也是判断到底是黏性不匹配还是上面所说的洗脱强度不匹配的重要依据[/color][/size][size=14px]。[/size][align=center][/align][align=center][img=,690,397]https://ng1.17img.cn/bbsfiles/images/2022/12/202212011446015690_3262_3237657_3.png!w690x397.jpg[/img][/align][size=14px]当由于稀释剂由于和流动相的黏度不匹配而造成峰形异常时,该如何应对?[/size][size=14px][/size][size=14px][color=#7b0c00]1. 尝试用初始流动相稀释样品,但这往往是正确的废话,因为很多情况是不能或不便用初始流动相稀释样品;[/color][/size][size=14px][color=#7b0c00]2. 降低进样量;[/color][/size][size=14px][color=#7b0c00]3. 选择更大的定量环,也就是增强在定量环中的预混,如图5。同样进样10 μL或者20 μL,当增加定量环的大小(从10 μL到20 μL或者从20 μL到50 μL)时,峰形可以明显改善。 [/color][/size][align=center][/align][align=center][img=,690,429]https://ng1.17img.cn/bbsfiles/images/2022/12/202212011446205122_5886_3237657_3.png!w690x429.jpg[/img][/align][size=14px][color=#7b0c00]4. 升高温度,可以在某些区间内拉平稀释剂和流动相之间的黏度差异,从而减少其不良影响,这在体积排阻色谱(SEC)中很常见;[/color][/size][size=14px][color=#7b0c00]5. 在半制备或者制备色谱中,常常增大进样量以提高效率,有时候由于溶解性问题也让使用起始流动相作为稀释剂不太现实,为了降低稀释剂和流动相由于黏度不匹配而造成分离的不良影响,强烈建议调节两者的黏度,一种可能的解决方案是在低黏度的一方中加入极少量的高黏度溶剂,比如DMSO或者环己醇。[/color][/size][size=15px][b][color=#007aaa]3.3 稀释剂与流动相的pH不匹配[/color][/b][/size][size=14px]我们在分析可离子化的化合物时,常常会基于分析物的[font=&]p[/font][i]K[/i][font=&]a[/font]选择不同pH的流动相,以实现最佳的分离效果。在很多情况下,样品稀释剂和流动相的pH并不一致,甚至相差好几个单位,比如样品在起始流动相条件下不稳定时,首先就应该考虑样品的稳定性。[/size][size=14px][color=#7b0c00]当稀释剂与流动相的pH不一致时,稀释剂在流经色谱柱时,会改变周围环境的pH,从而可能改变分析物的电离状态进而影响其保留行为[/color][/size][size=14px]。[/size][size=14px]为了更加直观地了解当样品稀释剂对流动相pH的影响,Stoll在HPLC系统中设计了一个pH的在线监测系统,可以实时测定色谱柱入口和色谱柱出口的pH值。实验中选择的苯甲酸为分析物,样品稀释剂为乙腈:1 mM或100 mM磷酸盐(pH 7)=13:87,流动相为乙腈:100 mM磷酸盐(pH 3.2)=23:77,色谱柱为50×4.6 mm的C18柱,流速为2 mL/min(其他详细色谱条件见参考文献[6])。图(a)为稀释剂中缓冲剂为1 mM pH 7的缓冲盐时,不同进样量时色谱柱入口处的pH随时间的变化图;图(b)为稀释剂中缓冲剂为100 mM pH 7的缓冲盐时,不同进样量时色谱柱入口处的pH随时间的变化图;图(c)为稀释剂中缓冲剂为1 mM pH 7的缓冲盐时,不同进样量时色谱柱出口处的pH随时间的变化图;图(d)为稀释剂中缓冲剂为100 mM pH 7的缓冲盐时,不同进样量时色谱柱入口处的pH随时间的变化图。其中蓝、紫、绿、红、粉曲线分别是进样量为1 μL、5 μL、15 μL、30 μL、100 μL的pH曲线图。[/size][align=center][/align][align=center][img=,690,423]https://ng1.17img.cn/bbsfiles/images/2022/12/202212011446451986_2628_3237657_3.png!w690x423.jpg[/img][/align][font=&][size=14px]在色谱柱入口端:[/size][/font][font=&][size=14px]从图(a)可以看出,即使稀释剂中的缓冲剂为1 mM的磷酸盐,当进样量为30或100 μL时也会在流动相中产生pH5的区域,而[/size][/font][font=&][size=14px][color=#7b0c00]当稀释剂中的缓冲剂为100 mM的磷酸盐时,见图(b),即使只进样5 μL,也会让流动相中产生pH值到6的区域[/color][/size][/font][font=&][size=14px]。[/size][/font][font=&][size=14px] [/size][/font][font=&][size=14px]在色谱柱出口端:[/size][/font][font=&][size=14px]我们可以看到其最大的pH值比色谱柱入口端监测的数据要低,这应该主要和样品的稀释剂的扩散和流动相对其的中和有关。当稀释剂中的缓冲剂浓度为1 mM时,如图C,样品稀释剂在色谱柱中充分扩散和被中和,监测到色谱柱后的pH基本都低于4,除非进样量达到100 μL时,才有少量的区域pH高于4;而[/size][/font][font=&][size=14px][color=#7b0c00]当样品稀释剂浓度为100 mM时,如图6D,当进样量为15 μL,30 μL和100 μL,会让色谱柱中很大的区域的pH都大于5[/color][/size][/font][font=&][size=14px]。[/size][/font][font=&][size=14px] [/size][/font][font=&][size=14px]而苯甲酸的p[i]K[/i]a为4.2,当色谱柱中的pH值由流动相的3.2升高时,让苯甲酸的电离程度也提高,从而让其保留时间降低,当pH值的变化比较剧烈时(如稀释剂的磷酸盐浓度为100 mM,进样量为15 μL或30 μL),色谱峰的保留时间显著减少,同时峰的拖尾变得更加严重,而当进样量为100 μL时,色谱峰会出现严重的变形和裂分现象,如图7。[/size][/font][font=&][size=14px][/size][/font][align=center][img=,690,289]https://ng1.17img.cn/bbsfiles/images/2022/12/202212011447093785_1060_3237657_3.png!w690x289.jpg[/img][/align][align=center][/align][font=&][size=14px]综合图6和图7可以看出,分析物的出峰行为和稀释剂对流动相pH的影响情况出现了非常强的相关性。我们可以看到当稀释剂与流动相的pH不匹配时,特别在稀释剂中缓冲液的缓冲能力比较强、进样量比较大的时,对于p[i]K[/i]a在特定范围内的分析物的出峰行为产生不可忽视的影响。相对应的,[/size][/font][font=&][size=14px][color=#7b0c00]降低稀释剂的缓冲能力、减少进样体积以及让稀释剂对流动相pH的影响范围尽量避开所关注的分析物的p[i]K[/i]a都是有效的方向[/color][/size][/font][font=&][size=14px]。[/size][/font][size=16px][b][color=#007aaa]全文总结[/color][/b][/size][size=14px]在液相色谱分析中,“溶剂效应”指由于样品的溶剂(稀释剂)与初始流动相的差异而对分析物的色谱行为造成的影响,但是其具体原因却不能一概而论。本文综合了现有的一些研究,总结了三种不同原因造成的溶剂效应,包括[/size][size=14px][color=#7b0c00]洗脱强度不匹配[/color][/size][size=14px]、[/size][size=14px][color=#7b0c00]黏度不匹配[/color][/size][size=14px]和[/size][size=14px][color=#7b0c00]pH不匹配[/color][/size][size=14px](当然,还有可能有其他的不匹配因素导致的溶剂效应,本文仅作抛砖引玉,如有错误或者遗漏,请在评论区指出)。当遇到具体的问题时,需要具体分析找出原因,并针对性地进行改善。[/size][size=14px][/size][size=14px]参考文献[/size][size=14px][1] Michael W. Dong HPLC and UHPLC for Practicing Scientists, 2nd Ed. [b]2019[/b], Wiley [/size][size=14px][2] J.W. Dolan, [i]LC-GC North Am. [/i]22 (2004) 26 [/size][size=14px][3] S. Keunchkarian et al.[i] J. Chromatogr. A[/i] 1119 ([b]2006[/b]) 20 [/size][size=14px][4] C.B. Castells et al. [i]J. Chromatogr. A [/i]805 ([b]1998[/b]) 55 [/size][size=14px][5] M. Czok et al. [i] J. Chromatogr. [/i]550 ([b]1991[/b]) 705 [/size][size=14px][6] D.R. Stoll et al.[i] LCGC Europe[/i] 33 ([b]2002[/b]) 74.[/size]
溶胶色谱所用的溶剂可以是混合溶剂吗?我合成的物质 部分溶于四氢呋喃,但溶于四氢呋喃和甲醇混合溶剂,这样能做凝胶色谱测试分子量吗?非常感谢!
请问什么是质子化溶剂?液相色谱中加入质子化溶剂的用途是什么?
有人用过SIGMA的色谱溶剂甲醇乙腈什么的嘛?质量怎么样?
[color=#444444]想了解一下物质A在几个溶剂中的溶解度的大小,采用[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]进行定量分析。已知物质A的[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]标准曲线,但是备选溶剂的沸点较高,可能气化不完全。不知道会不会对结果又影响?有影响的话是什么呢?希望各位高手帮帮忙,谢谢~~~~[/color]
气相色谱关于植物油中的溶剂残留我们气相色谱做植物油中的溶剂残留时,将植物油70度烘了一天做基体加入六号溶剂做标准溶液,为何空白也出峰呢,而未经处理的植物油上机没有什么峰。难道烘后的油含有六号溶剂??另我看别人说六号溶剂就出一个峰,我们的怎么出三个峰?FID,DB-1的柱子,用的PE的顶空,请大家指点迷津。
HPLC溶剂(LC-MS溶剂成本太贵,通常选择农残级试剂即可),HPLC溶剂常检指标(纯度、水分、紫外透光率/吸光度、酸值/碱值等)不包含农药背景值等检测在内,最后还是。欢迎大家关注安谱的农残级溶剂哦,农残级溶剂的成本要比HPLC溶剂高不少,为了推广市场以及为了用户能够用上“对”的产品(即选型正确的产品),我们从2011年就开始调低了常规农残级溶剂公开报价,对比过2010年和2009年价格的用户会有明显的感受,还希望大家多支持。编辑3:HPLC级就能满足要求,不过因为农残级也就比HPLC贵不了多少,所以用它也行的?根据我工作中遇到的一些情况来看:当把HPLC级溶剂用在GC分析时,有些时候是没有问题的,溶剂本身没有FID/ECD/NPD背景,但是同一品牌的HPLC溶剂换了其他批号之后,却可能会出现溶剂的背景干扰。当使用农残级溶剂用于GC分析时,相对而言,稳定性要好很多,因为农残级溶剂出厂前一般都会针对GC分析常用的检测器FID/ECD/NPD等进行背景测试,而HPLC级溶剂一般只会针对某些波长处的UV,IR等进行背景测试。编辑4:刚刚我们大家在讨论农残级溶剂,其实对于农残级常用试剂如氯化钠、硫酸钠,在方法上经常提到要用马弗炉烘去除有机物和挥发性化合物,而对于商品化的农残级氯化钠和农残级无水硫酸钠则不需要用马弗炉烘。编辑5:我们的GC-MS一直都用分析纯的丙酮作溶剂。 AR级的试剂建议还是不要用在GC-MS为好,毕竟AR级试剂质控指标简单,仅适合于一般研究工作和对纯度要求不高的常规实验,用在痕量分析的话,从对结果准确性的影响、对系统的负面影响(尤其过MS)等考虑,肯定是没有色谱级适合的。 通常使用之前,我都会用GC-MS做一针全扫描,确定了没什么干扰我才会采用。我们一般都是用来稀释我们的样品,然后上机测试。我们的样品里面的组分最低含量大约1%,高含量的组分超过50%,不是痕量分析,所以一直采用分析纯的丙酮。
溶剂选取原则一般讲,溶剂应具有较低的沸点,从而使其容易与样品分离。如丙酮、己烷、氯仿、苯等。尽可能避免用水、二氯甲烷和甲醇作溶剂,因为它们对延长色谱柱的使用寿命不利。