宗伟健:新一代微型双光子荧光显微镜(多图)
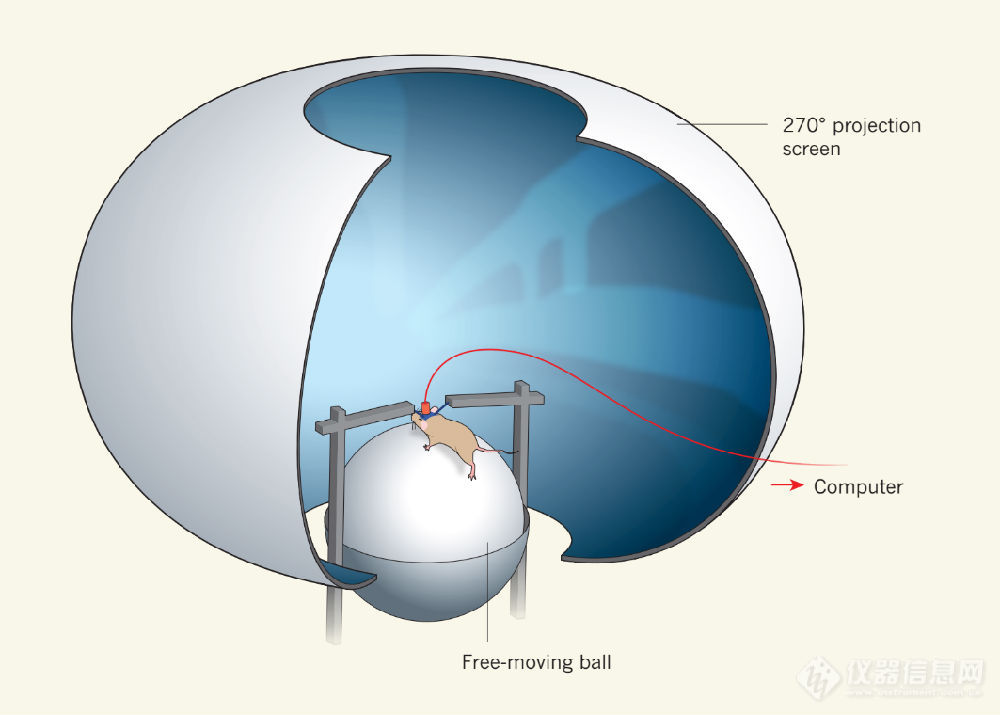
p 从石器时代原始部落的祭师对灵魂的崇拜,到中世纪后期哲人对大脑意识的产生溯源,到近代解刨学家发现井然有序的大脑功能分区,再到20世纪初Santiago Cajal得到了人类第一张清晰的大脑皮层神经元的照片,直至现在神经学家通过电生理,电子显微镜,光学显微镜等手段,在亚细胞,分子,基因水平对大脑的结构和功能进行研究,神经科学(neurosciences)这一门古老的学科,直至今日,仍然是全世界投入最大,最活跃的科学研究领域之一。 /p p 限制科学家去理解和探索大脑的最主要因素是技术。每一次神经领域的重大突破,都是以技术的一次次革命与飞跃作为基础随之而来。19世纪末高尔基染色和尼斯染色技术的发明,使得单个神经元的结构得意完整清晰的呈现,并由现代神经学之父圣地亚哥· 拉蒙· 卡哈尔(Santiago Ramon y Cajal,1852-1934)总结并开创了神经元理论,至今仍是现代神经科学的基础。计算机体层扫描(CT)、磁共振成像(MRI)、经颅多普勒(TCD)、单光子发射计算机断层(SPECT)、正电子发射断层扫描(PET)等无创性影像学技术的发展,使得人类对大脑整体水平结构和功能的认识不断提高,并且对于大脑创伤和疾病的治疗提供了有利的参考工具。在实验神经科学领域,以模式动物作为研究对象,避免了把人作为研究对象在有创,改造等伦理方面的限制,使得更多的技术手段得以大显身手。其中包括电生理学方面,脑电图(EEG),多电极记录(MER),膜片钳技术(patch clamp)等技术的发明和有效使用,得以使科学家在亚微米空间尺度(单个神经突触连接),亚毫秒时间尺度(单次神经冲动电位)对神经元的功能进行研究。而最令人激动人心的是,近几年来蓬勃发展的光学显微成像技术,给实验神经科学带来了很多前所未有的思路和成果。2008年钱永健等人由于荧光蛋白(GFP,绿色荧光蛋白)的发现和使用,获得了诺贝尔化学奖,是对荧光成像技术的一次巨大肯定和推动。光学成像本身具有高分辨率、高通量(高速)、非侵入、非毒性等特点,再与荧光蛋白以及荧光染料等标记物在细胞中的定位与表达技术相结合,使得科学家可以特异性的分辨生物体乃至细胞内部不同结构与成分,并且能够在生命体和细胞仍具有活性的状态下(活体状态)对其功能进行动态观察。这就使得荧光成像技术成为了无可替代的,生物学家现今最为重要的技术手段之一。而随着近些年来各种新型的显微技术的出现,共聚焦显微镜(confocal microscopy),相干拉曼成像(CARS),超分辨率显微技术(super-resolution microscopy),光片显微技术(lightsheet microscopy)等使得荧光显微镜的分辨率,速度,成像深度等进一步提高。 /p p 对于荧光成像技术在神经科学中应用,离不开双光子荧光显微镜(Two-photon Microscopy,简称TPM)1。目前,大多数细胞生物学,生理学研究主要还是在离体培养的细胞体系中研究。然而与细胞生物学研究有所不同的是,大脑的功能研究的整体性和原位性显得更加关键:仅研究分离的神经元无法解释神经系统的功能和规律。换句话说,必须要求神经元处在其正常生存的大脑环境中才能使其正常运转。然而,大脑是一个高度复杂的器官。即使是小鼠的大脑皮层也有将近1mm的厚度,海马,丘脑等深脑区核团更是深达3-5mm2,而且并不透明,充满了数以亿计的神经元胞体和突触,此外还有丰富的血管,粘膜(脑膜),最外层还有厚厚的颅骨和头皮包裹。使用包括共聚焦显微镜在内的传统的荧光显微镜,由于被观测的信号会受到样本组织的散射和吸收,根本无法穿透如此深的组织进行成像。而双光子显微镜的发明,则为此类研究带来了希望。双光子显微镜特有的非线性光学特性,再加上其工作波长处在红外区域等特点,令其在生物体组织内的穿透深度大大提高3,使得双光子显微镜成为神经科学家进行活体神经成像最理想的工具。神经动作电位(action potential)本身很难被光学信号捕获,但是动作电位产生的去极化会引起神经元Ca2+浓度的变化(钙内流现象)。科学家已经开发出多种Ca离子浓度的荧光探针,进而通过这种钙离子浓度的变化引起的荧光信号的变化来反映出神经活动。于是,双光子显微镜与在体的神经元Ca离子浓度指示剂标记技术相结合,碰撞出了耀眼的火花: 使得人们可以研究处于生理状态时的动物大脑内的神经元活动4。 /p p 大脑的最重要功能是对生物体的行为活动进行调控,而反过来,最能反应大脑工作状态的同样是生物体的行为活动。所以说,为了了解大脑,研究者不仅要求在体状态下对神经元进行高分辨率观测,而且也希望生物体在被观测的阶段里,能够进行正常的行为活动。所以,在成像技术不断地提高分辨率和速度等性能的同时,科学家们也在积极开改进和革这些成像技术手段,使其进行成像时尽可能小的限制被观测对象的行为活动,以求得到最接近生理状态下的数据。但是这一目标始终存在诸多的技术瓶颈: 以啮齿类动物(大鼠或小鼠)神经元的双光子钙成像为例。早些年由于动物身体运动产生的晃动剧烈,而当时双光子显微镜成像速度又很低,所以科学家只能在麻醉状态下对头部固定的动物进行成像。后来随着成像速度的提高,并且对开颅手术技术的很大改进,使得科学家可以在清醒状态下对动物的神经活动进行观察(仍然需要头部固定)。近些年来,随着基因改造技术的突飞猛进,通过病毒转染和转基因技术,在神经元内源性表达“基因编码类钙指示剂(genetically encoded calcium indicator, 简称GECI)”成为神经元钙成像的大趋势4。这种由神经元自身产生钙指示剂的方法与之前的钙染料技术相比有着巨大的优势: 信噪比提升了一个数量级 对神经元特异性好,可以区分不同的神经元类型 并且可以在大脑神经元内持续表达数月(病毒转染)甚至整个生命历程(转基因动物)。于是,大概10年前开始,科学家就开始利用双光子成像结合GECI技术对神经元的活动和结构变化进行长期的观测和追踪,从而对记忆的形成,神经元病变等问题有了更深入的认识。其中,现在性能最好,使用最为广泛的GECI为绿色荧光钙调蛋白Gcamp家族4。目前已经改进到第六代,Gcamp6f,Gcamp6f已经成为神经成像里最受欢迎的指示剂之一。目前科学家最流行的对小动物行为过程中大脑活动进行成像的方法,是将虚拟现实与双光子成像相结合,在动物头部被固定的情况下,在其眼前制造影像,让动物认为自己处在”真实“的环境之中5。通过小鼠四肢在类似跑步机或者鼠标滚球上的运动来模拟其真实活动。以求达到研究神经元在动物行为中所起到的作用(如图1)。 /p p style=" text-align: center " img src=" http://img1.17img.cn/17img/images/201706/insimg/e167bfbc-be4e-4b26-aa38-6f15b1fdca08.jpg" title=" 1.png" width=" 600" height=" 429" border=" 0" hspace=" 0" vspace=" 0" style=" width: 600px height: 429px " / /p p style=" text-align: center " 图1 双光子成像结合虚拟现实场景,对头部固定,身体活动的动物进行研究。图片来自 sup 5 /sup /p p 然而,这种虚拟现实加头部固定成像的方法,已经遭到许多科学家的质疑。人们认为,头部固定的动物在实验期间一直处在物理约束和情绪压力下,因此无法证明神经元对外界的响应在虚拟现实和自由探索下是等价的。更重要的是,许多社会行为,比如亲子护理,交配和战斗,都不能用头部固定的实验来研究。如何在动物自由活动的时候,直接对其神经元进行成像,是神经科学家还未能得到解决终极的诉求。 /p p 一个理想的解决方案是开发微型荧光显微镜直接固定在自由活动的动物身上,让动物“带着显微镜跑”6。这种尝试大概从20年前开始。起初,科学家只是将一根或几根光纤插到小鼠头上,用以激光导入和荧光信号采集。然而,这种方式而只是记录某个区域内信号的总和,不具有空间分辨率,算不上真正意义上的成像。在最近的十几年里,由于光学,电子,材料技术的发展,人们开始尝试研制真正意义上的微型显微镜。其中,微型单光子宽场显微镜(miniature wide-field microscope),由于其原理与结构相对简单,是目前人们主要尝试研制的微型显微镜技术。例如由Ghosh及其同事开发的显微镜,通过将小型LED光源,微型CCD和自聚焦透镜整合到一个小于25px3的框架之中,研制出了一个重量为1.9g的微型宽场显微镜。该技术被用于研究大脑海马区place cell等与记忆和本能相关的实验当中7。然而,宽场成像方式由于不能很好的对离焦区域的背景信号进行过滤,并且对光的散射敏感,所以其无法达到细胞分辨率。更难以对更精细的诸如树突,轴突,树突棘等结构进行观察。所以一直难以达到神经科学家满意。 /p p 于是,从大概15年前开始,世界上一些研究和开发双光子成像技术的研究组开始尝试将双光子显微镜这种在神经成像领域已经获得广泛应用的技术进行微型。然而,目前只有为数不多的几个课题组报道了他们在微型双光子显微镜研制方面的进展: 在2001年,Denk等的工作被认为是研制微型双光子显微镜的第一步8。然而,它仍然太过“巨大”(长7.5厘米,重25克),而且成像速度很慢(2 Hz 128x128的尺寸下速度为2 Hz, 512x512的尺寸下为0.5 Hz,如图2a)。之后,其他一些课题组相继报道了不同的微型双光子系统。 Helmchen课题组在2008年报道了他们的微型双光子系统,仅重0.9克9。它实现了512X512幅面下的8 fps的成像速度速度,并展示了利用该系统实现的大鼠在体钙成像信号。然而,从展示的效果来看,其空间分辨率极低,而且并没有实现真正的自由运动下的成像(如图2b)。Mark Schnitzler课题组在2009年也发表了他们的微型双光子系统10。他们的系统首次使用了微机电扫描镜(MEMS)来进行扫描,并将Z聚焦模块集成在了探头之中(如图2c)。但是扫描频率仍然很低(400x135约为4Hz) 空间分辨率也远远达不到要求(横向1.29 μm,轴向10.3 μm)。这些方面限制了其在神经元细胞核亚细胞水平成像中的应用。 Kerr课题组在2009年展示了它们的系统11,跟之前的微型双光子显微镜相比较,由于应用了微型透镜组构成的微型物镜(NA达到了0.9),这套系统的空间分辨率更高。然而,这套探头的重量也随之提高(5.5g)。此外,由于其仍然使用振动光纤的方式来进行扫描,所以其成像速度仍然比较慢。(对于64x64为10.9Hz,对于理论上的512x512为1.25Hz)(如图2d)。此外,还有一个之前所有的微型双光子系统都没有解决的问题。由于微型双光子显微镜一般需要利用光纤将飞秒激光导入到探头之中,而光纤由于存在诸如色散、截至模式、导通带宽等一系列限制,所以某一款光纤一般只允许一定带宽(一般为几十纳米)和特定中心波长的光传播。那就需要在制作微型显微镜的时候,结合使用的荧光指示剂所需要的激光波长对光纤进行选择。但是,目前商业化的,可以用来进行飞秒光传输的空心光子晶体光纤(hollow-core Photonic Crystal Fiber, HC-PCF)种类非常有限。例如,全球最大的光子晶体光纤生产商NKT公司仅提供中心波长为800nm,1030nm,1300nm和1550nm的HC-PCF。所有现有的微型双光子显微成像系统都是基于这几款光纤所限定的中心波长进行开发的。但是很遗憾的是,本文上述所提到的目前最广泛使用的GcamP指示剂需要920 nm的激光进行激发。所以先前的所有微型双光子都不能对Gcamp进行有效的成像。这限制了微型双光子显微镜的发展。 /p p style=" text-align: center " img src=" http://img1.17img.cn/17img/images/201706/insimg/4c1d7c1d-53eb-4a41-96d0-98ecb5ebda8d.jpg" title=" 2.png" / /p p style=" text-align: center " 图2 微型双光子发展史上的几个典型工作。a、b、c、d分别选自参考文献 sup 8、9、10 /sup 和 sup 11 /sup /p p 之所以这些早期的微型化双光子显微镜都无法得到真正的使用和推广,其原因在于,若要制造出具有实用价值的微型双光子显微镜,比研制单光子微型显微镜复杂和困难的多得多。微型双光子显微镜需要需要解决如下几个关键技术难题: /p p 1 如何将飞秒激光有效的导入微型显微镜 /p p 2 如何在微型显微镜内进行扫描/图像重建 /p p 3 如何在微型显微镜中进行高质量的激光汇聚,高效激发双光子信号。 /p p 4 如何有效的对荧光信号进行收集 /p p 5 如何使整个系统在动物剧烈运动时仍保持稳定 /p p 6 在满足前5项条件下,重量是否足够轻,以致尽量小地对动物的活动造成影响 /p p 本文作者所在的课题组,是由北京大学分子医学研究所、信息科学技术学院、动态成像中心、生命科学学院、工学院联合中国人民解放军军事医学科学院组成跨学科团队。我们在程和平院士的带领下,在国家自然科学基金委国家重大科研仪器研制专项《超高时空分辨微型化双光子在体显微成像系统》的支持下,历经三年多的协同奋战,成功研制了新一代高速高分辨微型双光子荧光显微镜,并将其取名为FHIRM-TPM。原始论文于5月29日在线发表于自然杂志子刊Nature Methods (IF 25.3)12。在这项成果中,我们解决了上文所提及的早先微型化双光子显微镜研制中存在的问题,获取了小鼠在自由行为过程中大脑神经元和神经突触活动清晰、稳定的图像。 /p p style=" text-align: center " img src=" http://img1.17img.cn/17img/images/201706/insimg/0418a0a6-f357-4e18-91b0-ef1c23d670bd.jpg" title=" 3.png" width=" 600" height=" 470" border=" 0" hspace=" 0" vspace=" 0" style=" width: 600px height: 470px " / /p p style=" text-align: center " 图3 FIRM-TPM示意图,来自 sup 12 /sup /p p 新一代微型双光子荧光显微镜体积小,重仅2.2克,适于佩戴在小型动物头部,通过颅窗实时记录数十个神经元、上千个神经突触的动态信号。在大型动物上,还可望实现多探头佩戴、多颅窗不同脑区的长时程观测。相比单光子激发,双光子激发具有良好的光学断层、更深的生物组织穿透等优势,所以成像质量远优于目前领域内主导的、美国脑科学计划核心团队所研发的微型化宽场显微镜。其横向分辨率达到0.65μm,与商品化大型台式双光子荧光显微镜可相媲美 采用双轴对称高速微机电系统转镜扫描技术,成像帧频已达40Hz(256*256像素),同时具备多区域随机扫描和每秒1万线的线扫描能力。最为重要的是,FHIRM-TPM克服了先前限微型双光子显微镜应用的两个障碍。首先,我们定制设计的HC-PCF为 920纳米飞秒激光脉冲提供了无畸变传输,这种改进让有效的激发例如Thy1-GFP和GCaMP-6f等常用荧光指示剂成为可能。第二,由于双光子点扫描显微镜的高空间分辨率和层切能力,安装到动物头上的微型双光子显微镜非常容易受到运动伪影的影响。为了解决这个问题,我们对整个系统进行了充分的优化:(a)使用柔软的新型光纤束SFB来使得动物运动引起的扭矩和拉拽力最小化,并不降低光子收集效率 (b)采用独立的可旋转连接器来连接光学探头上的光纤和电线,以使动物在自由探索期间线的扭曲和缠绕最小化 (c)使用高速成像以减少运动引起的帧内模糊。此外,我们在实验之前预先训练动物适应安装在其头骨上的微型显微镜,并滴加1.5%低熔点琼脂糖使其充满物镜和脑组织之间,这些措施都显著降低了探头与大脑之间的相对运动,进而改善了实验短期和长期的稳定性,于是实现了在动物进行包含大量身体和头部运动的行为学试验中中进行高分辨率成像。 /p p style=" text-align: center " img src=" http://img1.17img.cn/17img/images/201706/insimg/0d8849db-62d7-4fdd-b7e0-4e572b3a1b03.jpg" title=" 4.png" width=" 600" height=" 437" border=" 0" hspace=" 0" vspace=" 0" style=" width: 600px height: 437px " / /p p style=" text-align: center " 图4 FIRM-TPM实物图,来自 sup 12 /sup /p p 树突棘活动是神经元信息处理的基本事件,利用台式双光子显微镜在头固定的动物上的研究表明单个神经细胞的不同树突棘可以被不同朝向的视觉刺激或不同强度频率的声音刺激所激活。FHIRM-TPM实现了与传统的大型的台式双光子显微镜相同的分辨率和光学层切能力。与微型宽场显微镜相比,FIRM-TPM的高空间分辨率,固有的光学切片能力和组织穿透能力以及相当的机械稳定性都是极有优势的。所以虽然通过微型宽场显微镜可以获得数百个神经元在细胞水平上的活动,但是我们的 FHIRM-TPM无疑提供了一个更加强大的工具,即在自由活动的动物中对更加基本的神经编码单位——树突棘的时空特性进行观测。它能够在对小鼠依次进行的行为学试验(例如悬尾,跳台,以及社交行为)的过程中长时间观察位大脑中的神经元胞体、树突和树突棘的活动。这些功能的展示充分证明了FHIRM-TPM具有良好的性能和稳定性。未来,与光遗传学技术的结合,可望在结构与功能成像的同时,精准地操控神经元和大脑神经回路的活动。微型双光子荧光显微镜整机性能十分稳定,可用于在动物觅食、跳台、打斗、嬉戏、睡眠等自然行为条件下,或者在学习前、学习中和学习后,长时程观察神经突触、神经元、神经网络、远程连接的脑区等多尺度、多层次动态变化。 /p p style=" text-align: center " img src=" http://img1.17img.cn/17img/images/201706/insimg/90a13003-d9fd-404d-8df3-64926f598012.jpg" title=" 5.png" width=" 600" height=" 283" border=" 0" hspace=" 0" vspace=" 0" style=" width: 600px height: 283px " / /p p style=" text-align: center " 图5 三种模式在结构学成像中的成像质量对比,来自 sup 12 /sup /p p style=" text-align: center " img src=" http://img1.17img.cn/17img/images/201706/insimg/44bc19d8-0a51-4583-8784-2f9240ac1cdd.jpg" title=" 6.png" / /p p style=" text-align: center " 图6 FHIRM-TPM在三种不同的行为学范例对小鼠大脑皮层神经元活动进行成像,来自 sup 12 /sup /p p 从2001年Denk发表第一篇微型双光子显微镜的原型机以来,微型双光子显微镜的发展已经走过了15年的时间。15年的发展历程,微型双光子显微镜从最开始的25克笨重的身躯,只能在分离的组织中进行验证性的实验8到如今重量仅两点几克重,可以对自由活动的小鼠神经元进行树突棘级别的成像,可以说取得了一定的进步。然而,在看到这个领域取得的成就的同时,也应看到,至今为止,微型双光子显微镜还未像共聚焦显微镜或者是荧光光片显微镜一样被生物学家广泛认可和应用。而后者(光片显微镜)的发展时间更短(2008年Science的一篇文献一般被认为是现代荧光光片显微镜镜的开端13)。究其原因,除了技术本身的限制以外,整个研究领域的气氛和投入,也是重要的影响因素之一。 /p p 纵观这15年来微型双光子显微镜的发展道路,开疆拓土者有之 改革创新者有之 另辟蹊径者有之 浑水摸鱼、指鹿为马者亦有之。然而遗憾的是,愿意心无旁骛、全情投入者鲜有之 有意愿和能力建立为这个研究的领域建立范式者亦鲜有之。而中国,在不久前在这个领域基本上属于完全的空白。更不要说什么领先世界。 /p p 然而令人十分兴奋的是,中国国家基金委国家重大科研仪器设备研制专项在2014年正式将“超高时空分辨微型双光子在体显微成像系统”立项。以5年七千两百万人民币的研究经费对这一项“世界上做的还并不怎么好,中国基本没人做过”的技术进行攻关研发。这样的大力投入无疑为这一领域注入了新鲜血液和十足动力。而我也有幸在博士五年期间全程参与了这个项目的工作。从2012年来到该项目首席负责人程和平院士和陈良怡研究员的联合课题组至今,我见证了这个项目从无到有,团队从幼小稚嫩到壮大成熟的整个过程。如今,我们有了初步的成果,不仅让我们这样一支完全由中国本国科研工作者建立的团队在世界上处在了较为领先的位置,同时也把这个领域向前推动了一些,我感到无比激动和自豪。 /p p 该成果在2016年底美国神经科学年会、2017年5月冷泉港亚洲脑科学专题会议上报告后,得到包括多位诺贝尔奖获得者在内的国内外神经科学家的高度赞誉。冷泉港亚洲脑科学专题会议主席、美国著名神经科学家加州大学洛杉矶分校的Alcino J Silva教授在评述中写道,“从任何一个标准来看,这款显微镜都代表了一项重大技术发明,必将改变我们在自由活动动物中观察细胞和亚细胞结构的方式。它所开启的大门,甚至超越了神经元和树突成像。系统神经生物学正在进入一个新的时代,即通过对细胞群体中可辨识的细胞和亚细胞结构的复杂生物学事件进行成像观测,从而更加深刻地理解进化所造就的大脑环路实现复杂行为的核心工程学原理。毫无疑问,这项非凡的发明让我们向着这一目标迈进了一步。” /p p 1. Denk, W., Strickler, J. & amp Webb, W.Two-photon laser scanning fluorescence microscopy. Science248, 73-76(1990). /p p 2. Gewin, V. A goldenage of brain exploration. PLoS Biol3, e24 (2005). /p p 3. Zipfel, W.R.,Williams, R.M. & amp Webb, W.W. Nonlinear magic: multiphoton microscopy in thebiosciences.Nat Biotechnol21, 1369-1377 (2003). /p p 4. Chen, T.W. et al.Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature499, 295-300 (2013). /p p 5. Minderer, M.,Harvey, C.D., Donato, F. & amp Moser, E.I. Neuroscience: Virtual realityexplored. Nature533, 324-325 (2016). /p p 6. Hamel, E.J., Grewe,B.F., Parker, J.G. & amp Schnitzer, M.J. Cellular level brain imaging inbehaving mammals: an engineering approach. Neuron86, 140-159 (2015). /p p 7. Ghosh, K.K. et al.Miniaturized integration of a fluorescence microscope. Nat Methods8, 871-878(2011). /p p 8. Helmchen, F., Fee,M.S., Tank, D.W. & amp Denk, W. A Miniature Head-Mounted Two-Photon Microscope.Neuron31, 903-912 (2001). /p p 9. Engelbrecht, C.J.,Johnston, R.S., Seibel, E.J. & amp Helmchen, F. Ultra-compact fiber-optictwo-photon microscope for functional fluorescence imaging in vivo. Optics Express16, 5556 (2008). /p p 10. Piyawattanametha, W.et al. In vivo brain imaging using a portable 2.9 g two-photon microscope basedon a microelectromechanical systems scanning mirror. Optics Letters34, 2309(2009). /p p 11. Sawinski, J. et al.Visually evoked activity in cortical cells imaged in freely moving animals. Proceedings of the National Academy ofSciences106, 19557-19562(2009). /p p 12. Zong, W. et al. Fasthigh-resolution miniature two-photon microscopy for brain imaging in freelybehaving mice. Nat Methods (2017). /p p 13. Keller, P.J.,Schmidt, A.D., Wittbrodt, J. & amp Stelzer, E.H. Reconstruction of zebrafishearly embryonic development by scanned light sheet microscopy. Science322, 1065-1069 (2008). /p
 银牌9年
银牌9年
 400-860-5168转3750
400-860-5168转3750
 留言咨询
留言咨询
 白金10年
白金10年
 400-878-6829
400-878-6829
 留言咨询
留言咨询
 金牌19年
金牌19年
 400-633-0963
400-633-0963
 留言咨询
留言咨询

 400-803-1678
400-803-1678
 留言咨询
留言咨询

 400-860-5168转2623
400-860-5168转2623
 留言咨询
留言咨询

 400-860-5168转4543
400-860-5168转4543
 留言咨询
留言咨询