苏州大学李盛亮教授团队合作:近红外光远程调控钙通道与肿瘤治疗
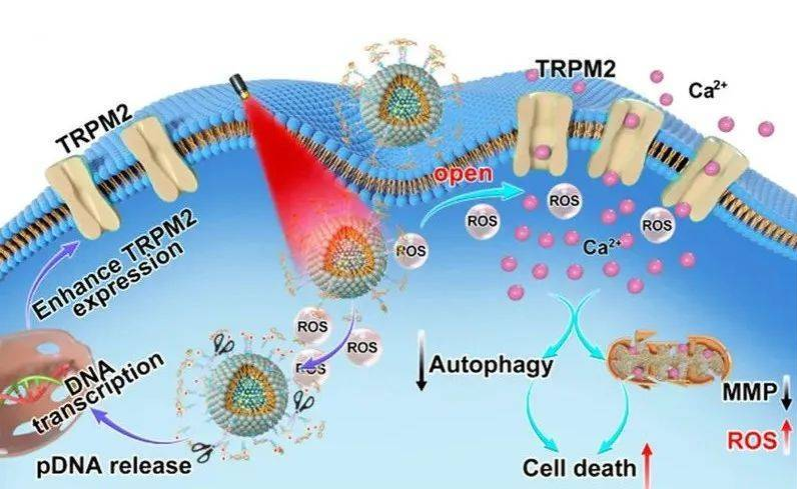
钙离子是一种重要的细胞信号,在生物发育生长以及生理响应等多个过程中扮演举足轻重的角色。钙信号一直是生物学以及医学科学家的重点研究对象,而且钙信号与多种人类重大疾病的发生与发展密切相关。在过去的几十年时间,科学家们一直试图调控钙信号从而达到对生物过程的有效控制,以及实现对疾病的精准治疗。近十年以来涌现了主要包括光遗传学在内的新兴技术应用于在体与离体钙信号调节,并取得了一系列重要的研究成果。但是,该类方法仍在创伤以及安全性等方面存在一定程度的缺陷和问题,影响了该技术的进一步使用。因此,如何远程无创、安全有限的深层组织内钙信号调控仍是当前的重大挑战。苏州大学药学院李盛亮教授与河北工业大学邢成芬教授合作在Nano Letters上发表了题为“Remote Manipulation of ROS-Sensitive Calcium Channel Using Near-Infrared-Responsive Conjugated Oligomer Nanoparticles for Enhanced Tumor Therapy In Vivo”的研究论文,发展了一种近红外响应性多功能性纳米载体系统应用于细胞钙离子通道的调控以及钙级联介导的肿瘤细胞死亡,实现了高效、安全地活体肿瘤模型的肿瘤清除治疗效果。苏州大学药学院李盛亮教授与河北工业大学邢成芬教授是论文的通讯作者。近年来,苏州大学李盛亮团队通过调控近红外光学治疗药物的分子结构与构效关系,发展了一系列具有高效光治疗活性与发光性能的药物体系与载体系统,从而实现了高性能的近红外肿瘤诊疗联合作用(Adv. Mater. 2022, 34, 2201263 Adv. Mater. 2021, 33, 2102799 Adv. Mater. 2020, 32, 2001146 Angew. Chem. Int. Ed. 2021, 133, 11864 ACS Nano 2020, 14, 13681 ACS Nano 2020, 14, 9917 ACS Nano 2019, 13, 12901 Adv. Sci. 2021, 8, 2003972 Mater. Horiz. 2021, 8, 571 Chem. Sci. 2020, 11, 888)。在上述工作基础上,该团队近期与河北工业大学邢成芬教授合作,构建了基于近红外光敏剂的多功能纳米载体,实现了钙离子通道的调控以及钙级联介导的肿瘤细胞死亡。该研究首先建立了一种负载TRPM2质粒的多功能纳米载体,该载体系统在红外光照射下一方面可以通过二硒键的响应性断裂释放TRPM2质粒从而增强TRPM2在肿瘤细胞中的表达,另一方面近红外光产生活性氧物种可激活活性氧敏感的钙通道蛋白TRPM2开启,引发钙内流以及钙信号相关的信号通路级联反应,包括线粒体损失以及抑制早期自噬等。电生理实验进一步证实了近红外光远程、反复式的钙信号调控性能。静脉注射后,近红外二区发光成像证实该载体系统可在肿瘤部位有效蓄积。与此同时,该低剂量近红外光照射启动的钙离子信号以及级联反应可实现高效的抗肿瘤治疗活性,且具备良好的生物安全性。图1. 近红外响应性多功能性纳米载体系统的设计原理及工作机制该研究的意义在于,利用近红外光敏剂的多功能纳米载体系统功能化策略,实现了同时递送基因与钙信号调控功能,发展了一种新型的近红外激活活性氧敏感的钙通道调控策略,为离子通道调控与抗肿瘤治疗提供了新的思路。