推荐厂家
暂无
暂无
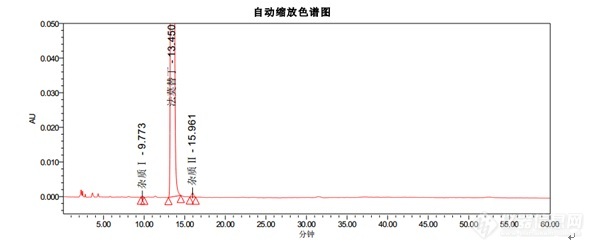
[align=center][b]法莫替丁颗粒系统适用性试验-2015中国药典 [/b][/align][align=center] [/align]色谱条件色谱柱:Kromasil 100-5-C18, 4.6*250mm货号:M05CLA25流动相:醋酸盐缓冲溶液(取醋酸钠 13.6g,溶于900ML水中,用冰醋酸调节pH至6.0±0.1,加水至1000ML):乙腈=93:7流速:1.5ml/min柱温:35℃波长:270nm进样量:20[color=#333333]μL[/color][color=#333333][img=,596,251]https://ng1.17img.cn/bbsfiles/images/2018/12/201812271539396153_2091_2428063_3.jpg!w596x251.jpg[/img][/color]结论:1. 出峰顺序为杂质Ⅰ,法莫替丁,杂质Ⅱ2. 法莫替丁保留时间约为13.4min3. 杂质Ⅰ峰和杂质Ⅱ峰相对于法莫替丁的保留时间约为0.7和1.24. 理论塔板数按照法莫替丁计算不低于5000以上指标均符合中国药典。
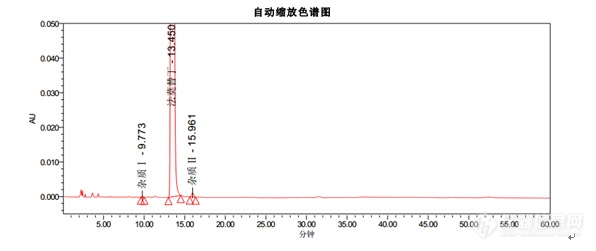
色谱条件色谱柱:Kromasil 100-5-C18, 4.6*250mm货号:M05CLA25流动相:醋酸盐缓冲溶液(取醋酸钠 13.6g,溶于900ML水中,用冰醋酸调节pH至6.0±0.1,加水至1000ML):乙腈=93:7流速:1.5ml/min柱温:35℃波长:270nm进样量:20μL[align=center][img=,596,251]https://ng1.17img.cn/bbsfiles/images/2018/12/201812101526522191_3600_3232762_3.png!w596x251.jpg[/img][/align][align=left]结论:[/align]1. 出峰顺序为杂质Ⅰ,法莫替丁,杂质Ⅱ2. 法莫替丁保留时间约为13.4min3. 杂质Ⅰ峰和杂质Ⅱ峰相对于法莫替丁的保留时间约为0.7和1.24. 理论塔板数按照法莫替丁计算不低于5000以上指标均符合中国药典。[hr/][align=center]Kromasil品牌[/align]Kromasil是Nouryon旗下高效化学品著名品牌,是全球领先的高性能硅胶基质填料和液相色谱柱生产商。Kromasil高性能多孔球形硅胶基质填料可广泛应用于胰岛素及其类似物、比伐卢定、利拉鲁肽、胸腺法新、达托霉素、EPO等蛋白、多肽及小分子药物等的分离纯化。30年来,Kromasil的经营理念始终是:为制药行业提供以硅胶为基质的、高性价比的、用于医药分离纯化的色谱填料和用于药物分析的液相色谱柱。Kromasil,一以贯之,创新向前。[align=center][img]https://mmbiz.qpic.cn/mmbiz_png/OeFA8HArUwdQyiaia3mAT7HllVGzL6MsslxRXMs2mHMtspgIicoVZic1d5iasgCuC61vnBQBiaC9v88vVZJlTMWwlDMg/640?wx_fmt=png&tp=webp&wxfrom=5&wx_lazy=1&wx_co=1[/img] [/align][align=center] 更[color=#000000]多资料请访问[/color]:[b][color=#007aaa]http://www.kromasil.com/[/color][/b][/align]
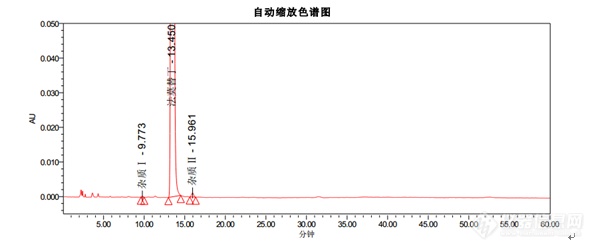
色谱条件色谱柱:Kromasil 100-5-C18, 4.6*250mm货号:M05CLA25流动相:醋酸盐缓冲溶液(取醋酸钠 13.6g,溶于900ML水中,用冰醋酸调节pH至6.0±0.1,加水至1000ML):乙腈=93:7流速:1.5ml/min柱温:35℃波长:270nm进样量:20μL[align=center][/align][align=center][img=,596,251]https://ng1.17img.cn/bbsfiles/images/2018/12/201812101529374292_9755_2785_3.png!w596x251.jpg[/img][/align]结论:1. 出峰顺序为杂质Ⅰ,法莫替丁,杂质Ⅱ2. 法莫替丁保留时间约为13.4min3. 杂质Ⅰ峰和杂质Ⅱ峰相对于法莫替丁的保留时间约为0.7和1.24. 理论塔板数按照法莫替丁计算不低于5000以上指标均符合中国药典。[hr/][align=center]Kromasil品牌[/align]Kromasil是Nouryon旗下高效化学品著名品牌,是全球领先的高性能硅胶基质填料和液相色谱柱生产商。Kromasil高性能多孔球形硅胶基质填料可广泛应用于胰岛素及其类似物、比伐卢定、利拉鲁肽、胸腺法新、达托霉素、EPO等蛋白、多肽及小分子药物等的分离纯化。30年来,Kromasil的经营理念始终是:为制药行业提供以硅胶为基质的、高性价比的、用于医药分离纯化的色谱填料和用于药物分析的液相色谱柱。Kromasil,一以贯之,创新向前。[align=center][img]https://mmbiz.qpic.cn/mmbiz_png/OeFA8HArUwdQyiaia3mAT7HllVGzL6MsslxRXMs2mHMtspgIicoVZic1d5iasgCuC61vnBQBiaC9v88vVZJlTMWwlDMg/640?wx_fmt=png&tp=webp&wxfrom=5&wx_lazy=1&wx_co=1[/img] [/align][align=center] 更[color=#000000]多资料请访问[/color]:[b][color=#007aaa]http://www.kromasil.com/[/color][/b][/align]







 400-611-9236
400-611-9236
 留言咨询
留言咨询

 400-611-9236
400-611-9236
 留言咨询
留言咨询

 400-611-9236
400-611-9236
 留言咨询
留言咨询


