推荐厂家
暂无
暂无


 400-860-5168转2232
400-860-5168转2232
 留言咨询
留言咨询

 留言咨询
留言咨询

 400-860-5168转4713
400-860-5168转4713
 留言咨询
留言咨询



我准备用紫外来测定我的样品中总异黄酮的含量,但由于我是用乙醇对原料进行提取的,得到的样品液中不仅含有异黄酮,随之色素、醇溶性蛋白也被提取出来,那么我在测量的时候怎么把这些杂质的干扰扣除?急寻帮助!
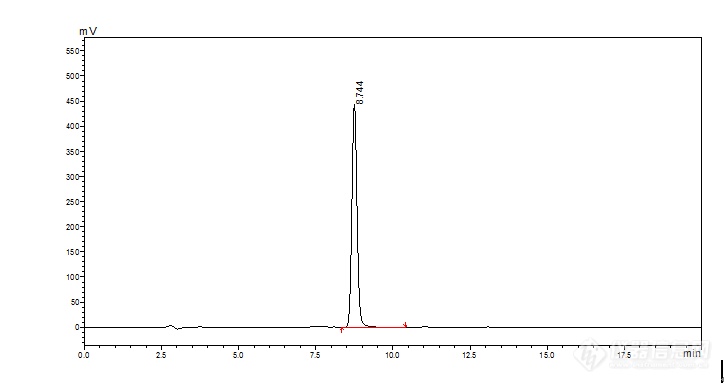
[align=center][b]HPLC法测定黄芪水提物中的毛蕊异黄酮苷含量[/b][/align][b]黄芪中的主要有效成分除皂苷外就是异黄酮类化合物。异黄酮类成分具有调节免疫、抗肿瘤、抗突变、抗氧化、抗炎、抗突变抗辐射、抗心肌缺血、抗心律失常、抗病毒、抗细胞凋亡、保肝、防止动脉粥样硬化等作用[sup][/sup],其代表成分就是毛蕊异黄酮 7-O-β-D 吡喃葡萄糖苷(即毛蕊异黄酮苷)。2010版药典才开始将毛蕊异黄酮苷收录为黄芪中有效成分含量测定项。本章实验借鉴药典中的测定方法,对不同工艺条件下获得的黄芪水提物中的毛蕊异黄酮苷含量进行考察,以期为优化芪龙胶囊和黄芪配方颗粒中黄芪的提取工艺参数提供科学基础和理论依据。[b]1 材料和仪器1.1 样品 [/b] 收集9组黄芪水提取物样品,黄芪饮片为济南济成堂中药饮片有限公司提供(批号18033101)。[b]1.2 试剂 [/b]毛蕊异黄酮苷对照品(成都瑞芬思生物科技有限公司批号M-020-170926),乙腈为色谱纯(天津市科密欧化学试剂有限公司);甲酸(天津市科密欧化学试剂有限公司);超纯水。[b]1.3 仪器 [/b]液相色谱系统,包括日本岛津公司LC-20AT型液相色谱仪,LC-20AT岛津输液泵,CTO-20A柱温箱,SIL-20A自动进样器,SPD-20A紫外-可见光检测器;超声波清洗机KS-300E(宁波科生仪器厂);电子天平MS205DU(梅特勒/瑞士)。[b]2 方法学考察2.1 色谱条件及系统适应性试验[/b]DiamonsiL(钻石)C18柱(250*4.6 mm,5 mm)。以乙腈为流动相A,0.2%甲酸溶液为流动相B,梯度洗脱,A相:0→20 min A为20→40%;20→30 min A保持40%;30→40 min A保持20%。检测波长260 nm;流速为1 mL/min;柱温35 ℃进样量为10 μL。毛蕊异黄酮苷对照品溶液以及黄芪水提物样品色谱图见图4-1与图4-2。[/b][align=center][img=,690,365]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131706005051_4964_3237657_3.png!w690x365.jpg[/img][/align][align=center]图4-1 毛蕊异黄酮苷对照品色谱图[/align][align=center][img=,690,384]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131706118782_6652_3237657_3.png!w690x384.jpg[/img][/align][align=center]图4-2 黄芪水提物样品色谱图[/align][b]2.2 供试品溶液的制备[/b]精密称定1/50重量的黄芪水提物样品(折合黄芪药材2 g)置于锥形瓶中,精密加入50 mL甲醇,超声30 min,过滤,将滤液放至水浴锅上蒸干,残渣用甲醇溶解,并定容至25 mL,用0.22 μm的微孔滤膜过滤,即得。[b]2.3 对照品储备溶液的制备[/b]精密称取黄芪甲苷标品5.10mg至10 mL容量瓶中,用甲醇溶解后定容,摇匀,即得浓度为0.51 mg/mL的对照品储备溶液。[b]3 结果3.1 线性关系考察[/b]精密吸取 2. 3 项下对照品储备溶液 4,2,1,0.5,0.25 mL至10 mL容量瓶中,用甲醇定容,得到浓度为204.00,102.00,51.00,25.50,12.75 μg/mL的对照品溶液。按“2.3”项下色谱条件分别进样10 μL,利用自动积分功能测定峰面积积分值,并以峰面积积分值与浓度进行线性回归。如图3,得回归方程为:Y =25445X + 44225(r[sup]2[/sup]= 0.9994)提示毛蕊异黄酮苷在12.75~204.00 μg/mL范围内线性关系良好。毛蕊异黄酮苷对照品标准曲线如图4-3所示。[align=center][img=,690,406]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131706302801_395_3237657_3.png!w690x406.jpg[/img][/align][align=center]图4-3 毛蕊异黄酮苷标准曲线[/align][b]3.2 精密度实验[/b]按2. 2 项下方法制备供试品溶液,精密吸取供试品溶液10 μL,重复进样 6 次,记录色谱图峰面积,测定毛蕊异黄酮苷含量,计算得相对标准偏差RSD为1.6% ,提示该方法精密度良好。[b]3.3 重复性实验[/b]取同一黄芪样品 6份,按“2. 2”项下方法制备供试品溶液,在拟定分析条件下,精密吸取供试品溶液10 μL,测定毛蕊异黄酮苷含量,计算得RSD为1.1%,提示该方法重复性良好。[b]3.4 稳定性实验 [/b]按2. 2 项下方法制备供试品溶液,分别在0 h、3 h、6 h、9 h、24 h、48 h后,准确吸取 10 μL 进样分析,测定毛蕊异黄酮苷含量,计算得 RSD 为 0.6%,提示黄芪供试品溶液在48h内稳定性良好。[b]3.5 加样回收率实验[/b]精密称取 6 份毛蕊异黄酮苷含量已知的黄芪水提物样品,每份折合黄芪药材 0. 5 g,分别准确加入样品中毛蕊异黄酮苷含量的50%,50%,100%,100%,150%,150%重量的毛蕊异黄酮苷标品,按2. 2 项下方法制备供试品溶液,准确吸取 10 μL 进样分析,测定毛蕊异黄酮苷含量,计算回收率,结果见表4-1。方法平均回收率为108.48%,表明该方法具有较好的回收率。[align=center]表4-1 毛蕊异黄酮苷加样回收率测定结果[/align] [table][tr][td] [align=center]样号[/align] [/td][td] [align=center]样品中的量/mg[/align] [/td][td] [align=center]加入量[/align] [align=center]/mg[/align] [/td][td] [align=center]测得量/mg[/align] [/td][td] [align=center]回收率[/align] [align=center]/%[/align] [/td][td] [align=center]平均值/%[/align] [/td][td] [align=center]RSD[/align] [align=center]/%[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]0.52 [/align] [/td][td] [align=center]1.64 [/align] [/td][td] [align=center]111.54 [/align] [/td][td=1,6] [align=center]108.85 [/align] [/td][td=1,6] [align=center]2.9 [/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]0.52 [/align] [/td][td] [align=center]1.64 [/align] [/td][td] [align=center]112.08 [/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]2.22 [/align] [/td][td] [align=center]109.20 [/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]2.24 [/align] [/td][td] [align=center]111.02 [/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]1.59 [/align] [/td][td] [align=center]2.72 [/align] [/td][td] [align=center]104.57 [/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]1.59 [/align] [/td][td] [align=center]2.72 [/align] [/td][td] [align=center]104.67 [/align] [/td][/tr][/table][b]3.6 毛蕊异黄酮苷的含量测定结果[/b]取9组黄芪水提物按照“2.2”项下操作,制备供试品溶液,准确吸取 10 μL 进样分析,测定毛蕊异黄酮苷的含量。结果见表2。[align=center]表4-2 9组黄芪水提物中毛蕊异黄酮苷含量测定结果[/align] [table][tr][td] [align=center]批号[/align] [/td][td] [align=center]峰面积[/align] [/td][td] [align=center]含量(mg/g)[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]1123989.50 [/align] [/td][td] [align=center]0.53 [/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]2707047.50 [/align] [/td][td] [align=center]1.31 [/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]1947171.50 [/align] [/td][td] [align=center]0.93 [/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]3573103.75 [/align] [/td][td] [align=center]1.73 [/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]1824562.00 [/align] [/td][td] [align=center]0.87 [/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]2767419.00 [/align] [/td][td] [align=center]1.34 [/align] [/td][/tr][tr][td] [align=center]7[/align] [/td][td] [align=center]2077551.50 [/align] [/td][td] [align=center]1.00 [/align] [/td][/tr][tr][td] [align=center]8[/align] [/td][td] [align=center]1677225.50 [/align] [/td][td] [align=center]0.80 [/align] [/td][/tr][tr][td] [align=center]9[/align] [/td][td] [align=center]1725416.00 [/align] [/td][td] [align=center]0.83 [/align] [/td][/tr][/table][b]3.7 毛蕊异黄酮苷转移率测定正交试验结果[/b]水提的毛蕊异黄酮苷转移率考察正交试验与水提的出膏率考察正交试验设计相同,即以水作为提取溶剂,把影响药材提取效果的用水量(A)、提取时间(B)、提取次数(C)确定为考察因素,以上三个考查因素各分3个水平考察,见表4-3。[align=center]表4-3水提实验因素水平表[/align] [table][tr][td=1,2] [align=center]水平[/align] [/td][td=3,1] [align=center]因素[/align] [/td][/tr][tr][td] [align=center]A(用水量/倍)[/align] [/td][td] [align=center]B(提取时间/h)[/align] [/td][td] [align=center]C(提取次数/次)[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]4[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]8[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]10[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][/tr][/table][b] [/b]毛蕊异黄酮苷转移率=各实验组黄芪提取物中毛蕊异黄酮苷含量/原黄芪药材中毛蕊异黄酮苷含量×100%。原药材中毛蕊异黄酮苷的含量按照药典的方法测得的结果为0.1425mg/g。跟据实验数据,得到水提实验中设定的不同工艺条件下的毛蕊异黄酮苷的转移率,其中因素D为误差项,作直观分析表和方差分析表,见表4-4,4-5。[align=center]表4-4 毛蕊异黄酮苷转移率考察L[sub]9[/sub](3[sup]4[/sup])正交试验表[/align] [table][tr][td] [align=center]批号[/align] [/td][td] [align=center]A[/align] [/td][td] [align=center]B[/align] [/td][td] [align=center]C[/align] [/td][td] [align=center]D[/align] [/td][td] [align=center]毛蕊异黄酮苷[/align] [align=center]转移率/%[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]37.21[/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]91.77[/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]65.58[/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]121.62[/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]61.36[/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]93.85[/align] [/td][/tr][tr][td] [align=center]7[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]70.08[/align] [/td][/tr][tr][td] [align=center]8[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]56.28[/align] [/td][/tr][tr][td] [align=center]9[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]57.94[/align] [/td][/tr][tr][td] [align=center]K1[/align] [/td][td] [align=center]194.56[/align] [/td][td] [align=center]228.91[/align] [/td][td] [align=center]187.34[/align] [/td][td] [align=center]156.51[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]K2[/align] [/td][td] [align=center]276.83[/align] [/td][td] [align=center]209.41[/align] [/td][td] [align=center]271.33[/align] [/td][td] [align=center]255.70[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]K3[/align] [/td][td] [align=center]184.30[/align] [/td][td] [align=center]217.37[/align] [/td][td] [align=center]197.02[/align] [/td][td] [align=center]243.48[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]优水平[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]R[/align] [/td][td] [align=center]92.53[/align] [/td][td] [align=center]19.50[/align] [/td][td] [align=center]83.99[/align] [/td][td] [align=center]99.19[/align] [/td][td] [align=center] [/align] [/td][/tr][/table][b] [/b][align=center]表4-5 毛蕊异黄酮苷转移率考察方差分析表[/align] [table][tr][td] [align=center]方差来源[/align] [/td][td] [align=center]离差平方和[/align] [/td][td] [align=center]自由度[/align] [/td][td] [align=center]F[/align] [/td][td] [align=center]显著性[/align] [/td][/tr][tr][td] [align=center]A[/align] [/td][td] [align=center]1715.05[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1.50[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]B[/align] [/td][td] [align=center]64.09[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]0.04[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]C[/align] [/td][td] [align=center]1407.78[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1.13[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]方差来源[/align] [/td][td] [align=center]离差平方和[/align] [/td][td] [align=center]自由度[/align] [/td][td] [align=center]F[/align] [/td][td] [align=center]显著性[/align] [/td][/tr][tr][td] [align=center]D [/align] [/td][td] [align=center]1950.20[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]-[/align] [/td][/tr][/table]注:F[sub]0.1[/sub](2,2)=9,F[sub]0.05[/sub](2,2)=19,*为有显著性,-为无显著性。从正交试验结果可知:水提实验中,各因素对毛蕊异黄酮苷转移率的影响大小顺序为:A(用水量)C(提取次数)B(提取时间);每个因素3水平之间的趋势为A[sub]2[/sub]A[sub]1[/sub]A[sub]3[/sub],B[sub]1[/sub]B[sub]3[/sub]B[sub]2[/sub],C[sub]2[/sub]C[sub]3[/sub]C[sub]1[/sub],直观分析得提取工艺为A[sub]2[/sub]B[sub]1[/sub]C[sub]2[/sub],即加水8倍量,提取2次,每次1h。表4-5的方差分析结果表明: A、B、C三因素的对毛蕊异黄酮的转移率影响都无统计学差异(PC(提取次数)B(提取时间);每个因素3水平之间的趋势为A[sub]2[/sub]A[sub]3[/sub]A[sub]1[/sub],B[sub]1[/sub]B[sub]3[/sub]B[sub]2[/sub],C[sub]2[/sub]C[sub]3[/sub]C[sub]1[/sub],直观分析得提取工艺为A[sub]2[/sub]B[sub]1[/sub]C2,即加水8倍量,提取2次,每次1h。表4-7的方差分析结果表明:A、B、C三因素对综合评分的影响都无统计学差异(P0.05)。[b]4 讨论[/b]本章实验借鉴药典中测定黄芪药材中毛蕊异黄酮苷含量的方法,利用紫外-可见光检测器的高效液相色谱仪测定黄芪水提物中毛蕊异黄酮苷的含量。与药典中方法测得的结果相比,本实验测得的结果除色谱峰分离度稍差外,其他方法学考察指标显示良好。从毛蕊异黄酮苷转移率测定正交试验结果来看,第4组实验毛蕊异黄酮苷转移率最高,这也是正交结果分析中最佳提取工艺,即加水8倍量,提取2次,每次1小时。本结果与上一章实验中第四组黄芪水提物中黄芪甲苷的转移率最高结果一致,但其他组别毛蕊异黄酮苷的转移率高低顺序与上一章黄芪甲苷的转移率高低顺序并不一致,这说明毛蕊异黄酮苷和黄芪甲苷对提取工艺的要求并不完全一致。同一种原药材,加工成不同功效的药物,那么发挥药效的物质也有可能不同,因此相应的提取工艺也是需要根据药效物质适时调整的。另外,用水量在设置的三个因素中对毛蕊异黄酮苷的转移率影响最大,但仍无统计学差异(P0.05),说明用水量、提取次数、提取时间三种工艺的改变对黄芪水提物中毛蕊异黄酮苷的含量无显著性影响。从综合评分计算正交试验结果来看,第4组实验综合评分最高,这也是正交结果分析中最佳提取工艺,即加水8倍量,提取2次,每次1小时。用水量在设置的三个因素中对综合评分影响最大,但仍无统计学差异(P0.05),说明用水量、提取次数、提取时间三种工艺的改变对黄芪水提工艺的综合评分无显著性影响。综合出膏率、黄芪甲苷和毛蕊异黄酮苷的含量得出综合评分来优选黄芪水提的最佳提取工艺,能够从化学成分的角度来客观全面地评价和研究黄芪水提的关键环节,这也为芪龙胶囊和黄芪配方颗粒水提环节工艺的优化提供借鉴和指导。[align=center] [/align][align=center]参考文献[/align] 陈建真,吕圭源, 叶磊, 等.黄芪黄酮的化学成分与药理作用研究进展. 医药导报, 2009, 28(10): 1314-1316. 赵四清,周日宝, 陈胜璜, 等.不同的产地加工方法对中药材金樱子质量的影响. 湖南中医学院学报, 2005, 25(3): 21-22.
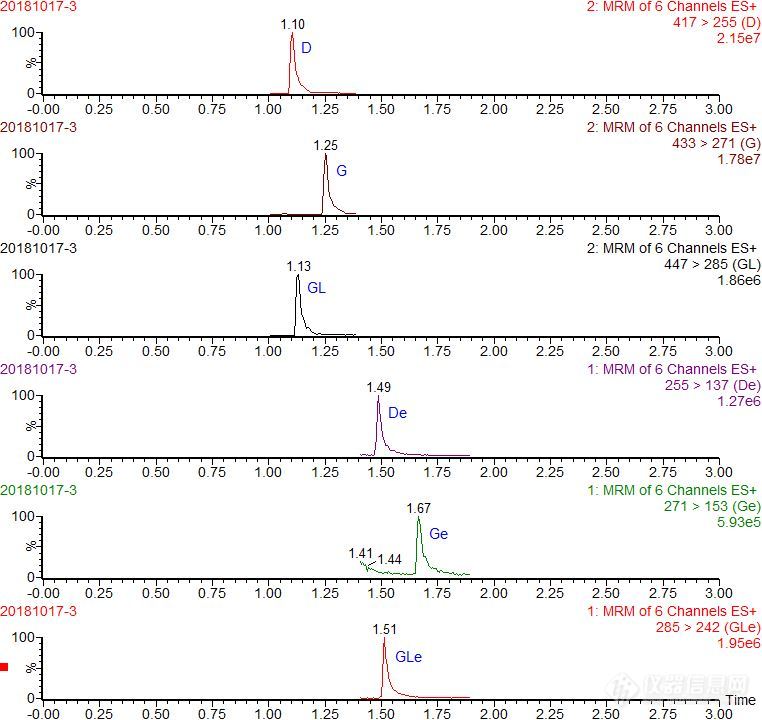
[align=center][b]超高效液相色谱-串联质谱法测定大豆中大豆异黄酮的含量[/b][/align][align=center]户江涛[/align][align=center](农业农村部豆类产品质量安全风险评估实验室(佳木斯),黑龙江省农垦科学院测试化验中心,黑龙江佳木斯 154007 )[/align]摘要:采用超高效液相色谱-串联质谱法建立了检测大豆中大豆异黄酮含量的分析方法。试样经90%甲醇水提取后,6种大豆异黄酮在C[sub]18[/sub]色谱柱上以0.1%甲酸水溶液和乙腈为流动相,进行液相色谱分离;质谱检测采用电喷雾正离子化模式和多反应监测模式(MRM)。结果表明,6种大豆异黄酮分别在0.01~0.5 mg/L(D、GL、G)和0.002~0.1 mg/L(De、GLe、Ge)范围内线性关系良好,相关系数(R)为0.9993~0.9998,定量限(LOQ)为0.0001 g/kg。在大豆空白样品添加浓度分别为0.01、0.05、0.2 g/kg(De、GLe、Ge)和0.2、1、2 g/kg(D、GL、G),6种大豆异黄酮的平均回收率为86.6%~96.2%,相对标准偏差(RSD)为1.07%~5.93%(n=6)。本方法简便、灵敏、抗干扰,适用于大豆中大豆异黄酮含量检测。关键词:超高效液相色谱-串联质谱;大豆;大豆异黄酮[align=center]Determination of soybeanisoflavone in soybean by ultra performance liquid chromatography-tandem massspectrometry[/align][align=center]HU Jiangtao[/align][align=center]([i]Laboratory of Qualityand Safety Risk Assessment for Soybean products, Ministry of Agriculture andRural Affairs, Testing and Analysis Center of Heilongjiang Academy of LandReclamation Sciences, Jiamusi 154007,China[/i])[/align][b]Abstract:[/b]A methodwasdeveloped for the determination of soybeanisoflavone in soybean by ultra performance liquid chromatography-tandem massspectrometry(UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS). The samples were extracted by 90% methanol-water, then 6 soybean isoflavones were separated on aWaters BEH C[sub]18[/sub] column with gradient elution with the mobile phase of0.1% formic acid and acetonitrile, and finally detected by positive eletrosprayionization-mass spectrometry(ESI[sup]+[/sup]-MS/MS) in multiple reactionmonitoring(MRM) mode. The results showed the linearities of 6 soybean isoflavones were good in the concentrationrange of 0.01~0.5 mg/L(D、GL、G)and 0.002~0.1 mg/L(De、GLe、Ge), the correlation coefficients were 0.9993~0.9998. The limitof quantification(LOQ) of soybean isoflavone was 0.0001 g/kg. At the spiked levels of 0.01、0.05、0.2 g/kg(De、GLe、Ge)and 0.2、1、2 g/kg(D、GL、G) in the blank soybean samples, the mean recovery of soybeanisoflavone was 86.6%~96.2%, andthe relative standard deviation(RSD) was 1.07%~5.93%(n=6).This method is simple,sensitive, anti-jamming and suitable for simultaneous determination of soybean isoflavone in soybean.[b]Key words: [/b]ultra performance liquid chromatography-tandem massspectrometry (UPLC-MS/MS) soybean soybean isoflavone大豆异黄酮(soybean isoflavone)是一族化合物的统称,是大豆植物体内的一种次生代谢产物,是大豆主要活性成分之一,其母核为3-苯并吡喃酮,主要包括大豆苷、大豆黄苷、染料木苷及其相应苷元[sup][/sup]。研究表明,大豆异黄酮除具有天然抗氧化作用外[sup][/sup],还具有降低胆固醇含量、预防多种癌症及改善妇女更年期综合征等多方面生物功效[sup][/sup]。大豆异黄酮主要存在于大豆籽实中,其总含量约为0.4~5 g/kg,其中大豆苷、大豆黄苷和染料木苷这三种含量约占总量的97%~98%,而其对应的苷元含量仅占2%~3%左右[sup][/sup]。目前,大豆异黄酮的检测方法主要有高效液相色谱法(HPLC)[sup][/sup]、[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法[sup][/sup]、紫外分光光度法[sup] [/sup]、质谱法(HP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS[sup][/sup])等。紫外分光光度法[sup] [/sup]只能测定大豆异黄酮总量,且灵敏度不高;[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法[sup][/sup]需要对异黄酮进行衍生,前处理复杂;目前,大豆异黄酮检测现有的国家标准GB/T 26625-2011[sup] [/sup]采用的是高效液相色谱法(HPLC),在实际检测过程中发现,由于紫外检测器灵敏度不高,存在个别样品中异黄酮相应苷元检测不到的情况;同时大豆提取液中含有蛋白、脂肪等杂质影响色谱柱柱效,以至于不能满足分离度要求,严重干扰低含量组分峰面积积分定量。而[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS法质谱检测器灵敏度高,通过选定大豆异黄酮的特征离子,能有效去除上述杂质干扰,定量更加准确可靠。目前,国内外采用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS法检测大豆中大豆异黄酮含量的文献很少[sup][/sup]。本文对大豆中大豆异黄酮检测的前处理方法借鉴GB/T 26625-2011[sup][/sup],提取液改用UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS测定。该方法前处理过程简便、灵敏度高、分析时间短、抗干扰能力强,适用于大批量大豆样品中大豆异黄酮含量的检测。[b]1 实验部分[/b]1.1 材料与试剂大豆苷(daidzin,记为D,以下同)、大豆黄苷(glycitin,GL)、染料木苷(genistin, G)、大豆素(daidzein,De)、大豆黄素(glycitein, GLe)、染料木素(genistein,Ge)(纯度≥99%,Dr.Ehrenstorfer公司);甲醇、乙腈、甲酸(色谱纯,Fisher公司);实验用水为Millipore纯水仪制备。1.2 仪器与设备Acquity UPLC型超高效液相色谱仪(Waters公司);XEVO TQ-S三重四级杆质谱仪(Waters公司);KQ-500DE型超声波仪(昆山市超声仪器有限公司);涡旋混合器(IKA公司);CR21GⅢ型高速离心机(HITACHI公司)。1.3 大豆异黄酮标准储备液的配置分别称取适量的D、GL、G、De、GLe、Ge标准品,用甲醇配置成质量浓度为1mg/mL标准储备液,于-18℃冰箱保存(有效期6个月),待用;使用时用10%甲醇水逐级稀释成所需浓度的混合标准工作液,现用现配。1.4 样品前处理提取:称取粉碎均与后的试样1.0g(精确到0.01g)于50mL聚乙烯离心管中,加入10.0 mL90%甲醇水,涡旋混合30 s后置于60℃超声波清洗器中提取30 min,在离心机中以15000 r/min离心5 min,将上清液转移至100 mL容量瓶中,残渣再加入10.0 mL90%甲醇水溶液按上述步骤提取后,合并两次上清液于100 mL容量瓶中,用10%甲醇水溶液定容至刻度,摇匀。a)De、GLe、Ge的测定:取1 mL过0.22um有机系微孔滤膜,供UPLC/MS/MS分析测定;b)D、GL、G的测定:由于D、GL、G含量较高,需要将a)中过完滤膜的待测液用10%甲醇水稀释50倍后,供UPLC/MS/MS分析测定。1.5 液相色谱及质谱条件液相色谱:色谱柱:Waters BEH C[sub]18[/sub](1.7 μm,50mm×2.1mm);柱温:30℃;流速:0.5 mL/min;进样量:1μL;流动相A:乙腈;流动相B:0.1%的甲酸水溶液。梯度洗脱程序:0~0.5min,10% A;0.5~3. 0 min,10%~100% A;3. 0 ~4. 0 min,100%A,4 ~4.1.1min,100% A~10% A,4.1 ~5.0min 10% A。质谱:离子源:电喷雾离子源( ESI [sup]+[/sup] ) ;扫描方式:正离子扫描;检测方式:多反应监测( MRM);毛细管电压:3.2 kv;离子源温度:150℃;去溶剂气温度:500℃;去溶剂气流量:1000 L /h;定性、定量离子对及碰撞能量见表1。[align=center]表1大豆异黄酮的质谱参数[/align][align=center]Table 1 MRM parameters of soybean isoflavone[/align] [table][tr][td] [align=center]Analyte[/align] [/td][td] [align=center]Cone/V[/align] [/td][td] [align=center]Parent ion/(m/z)[/align] [/td][td] [align=center]Daughter ion/(m/z)[/align] [/td][td] [align=center]Collision energy/V[/align] [/td][/tr][tr][td] [align=center]D[/align] [align=center] [/align] [/td][td] [align=center]30[/align] [align=center] [/align] [/td][td] [align=center]417[/align] [align=center][sup] [/sup][/align] [/td][td] [align=center]255﹡[/align] 137[/td][td] [align=center]27[/align] [align=center]18[/align] [/td][/tr][tr][td] [align=center]G[/align] [align=center] [/align] [/td][td] [align=center]30[/align] [align=center] [/align] [/td][td] [align=center]433[/align] [align=center][sup] [/sup][/align] [/td][td] [align=center]271﹡[/align] 153[/td][td] [align=center]21[/align] [align=center]50[/align] [/td][/tr][tr][td] [align=center]GL[/align] [align=center] [/align] [/td][td] [align=center]30[/align] [align=center] [/align] [/td][td] [align=center]447[/align] [align=center][sup] [/sup][/align] [/td][td] [align=center]285﹡[/align] 270[/td][td] [align=center]25[/align] [align=center]46[/align] [/td][/tr][tr][td] [align=center]De[/align] [align=center] [/align] [/td][td] [align=center]25[/align] [align=center] [/align] [/td][td] [align=center]255[/align] [align=center][sup] [/sup][/align] [/td][td] [align=center]137﹡[/align] 181[/td][td] [align=center]30[/align] [align=center]26[/align] [/td][/tr][tr][td] [align=center]Ge[/align] [align=center] [/align] [/td][td] [align=center]25[/align] [align=center] [/align] [/td][td] [align=center]271[/align] [align=center][sup] [/sup][/align] [/td][td] [align=center]153﹡[/align] 215[/td][td] [align=center]30[/align] [align=center]25[/align] [/td][/tr][tr][td] [align=center]GLe[/align] [align=center] [/align] [/td][td] [align=center]25[/align] [align=center] [/align] [/td][td] [align=center]285[/align] [align=center][sup] [/sup][/align] [/td][td] [align=center]242﹡[/align] 168[/td][td] [align=center]27[/align] [align=center]35[/align] [/td][/tr][/table]﹡quantitativeion[b]2 结果与讨论[/b]2.1 色谱及质谱条件的优化流动相的选择:对比了酸性体系(0.1%甲酸水溶液)与非酸性体系(纯水、乙酸铵溶液)分别与甲醇、乙腈的流动相体系组合,结果发现目标物在酸性体系中比非酸性体系响应更高、峰形更好;同时大豆提取液中含有蛋白、脂肪等杂质可能会残留在色谱柱上,影响色谱柱的使用寿命,而乙腈比甲醇体系洗脱能力更强,可以有效去这些杂质。综合考虑目标物信号强度、色谱分离效果以及除杂等因素,本研究采用0.1%甲酸水溶液+乙腈流动相体系。质谱的选择:根据6种大豆异黄酮的分子量,用10%甲醇水配置1.0 mg/L 大豆异黄酮标准溶液直接注射到质谱中,在正离子模式下分别对各种组分进行母离子及对应子离子全扫描,最终确定的质谱条件见表1。2.2 质谱法(UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS)与色谱法(HPLC)的比较国家标准《GB/T 26625-2011粮油检验大豆异黄酮含量测定高效液相色谱法》[sup][/sup]中规定的大豆异黄酮检测方法为HPLC法。对同一大豆样品分别采用本文UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS法(MRM色谱图见图1、2)和GB/T 26625 HPLC法检测,结果表明这两种方法测定的大豆异黄酮总含量值基本一致。由于De、GLe、Ge这三种苷元在大豆中含量很低,用HPLC法检测时,紫外检测器灵敏度不高,存在个别样品中上述三种组分检测缺失的情况;同时在实际大批量样品检测中发现,随着进样次数的增加,色谱柱柱效下降,大豆提取液中存在的蛋白、脂肪等杂质对含量低的目标物峰干扰越来越大,定量困难。研究发现,同浓度的大豆异黄酮在质谱检测器上的响应值要远远超过紫外检测器,同时质谱法可以通过选定大豆异黄酮的特征离子,有效地去除杂质的干扰,其目标物分离度不受色谱柱进样次数增加的影响,定量更加准确可靠。[align=center][img=,690,651]https://ng1.17img.cn/bbsfiles/images/2019/08/201908050912587968_4111_3299836_3.jpg!w690x651.jpg[/img][/align][align=center]图1 大豆异黄酮标准溶液(0.01mg/L)MRM色谱图[/align][align=center]Fig.1 MRM chromatograms of soybean isoflavone standard solution at 0.01 mg/L[/align][align=center][/align][align=center][img=,690,653]https://ng1.17img.cn/bbsfiles/images/2019/08/201908050913342201_5843_3299836_3.jpg!w690x653.jpg[/img][/align][align=center]图2 大豆样品中大豆异黄酮MRM色谱图[/align][align=center]Fig.2 MRM chromatograms of soybean isoflavone in soybean[/align]2.3线性范围和定量限吸取不同体积的大豆异黄酮标准储备液(1.3),用10%甲醇水分别配置0.002、0.005、0.01、0.05、0.1(De、GLe、Ge)和0.01、0.05、0.1、0.2、0.5(D、GL、G)的大豆异黄酮上机混合标准溶液,以各自定量离子的峰面积为Y对应质量浓度X(mg/L)做标准曲线,得到的线性方程和相关系数见表2。结果表明,大豆异黄酮标准溶液在各自浓度范围内线性良好,相关系数R为0.9993~0.9999。以10倍信噪比(S/N)计算,大豆异黄酮上机液最低定量浓度为0.001 mg/L,通过公式(1)计算得到大豆中大豆异黄酮含量,最终确定本方法大豆异黄酮的定量限(LOQ)为0.0001 g/kg。糠氨酸质量分数计算公式:[align=center][img=,207,87]https://ng1.17img.cn/bbsfiles/images/2019/08/201908050915166414_5621_3299836_3.jpg!w207x87.jpg[/img] ………………(1)[/align] 式中:X为试样中大豆异黄酮含量,以g/kg计;C为大豆异黄酮上机浓度(mg/L);V为定容体积(V=100)。表2 大豆异黄酮标准溶液的线性方程和相关系数[align=center]Table 2 Linear equation and correlation of soybean isoflavone in 10% methanol-water standard solutions[/align] [table][tr][td] [align=center]Analyte[/align] [/td][td] [align=center]Linear range/(mg/L)[/align] [/td][td] [align=center]Linear equation[/align] [/td][td] [align=center]R[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]D[/align] [align=center]GL[/align] [align=center]G[/align] [align=center]De[/align] [align=center]GLe[/align] [align=center]Ge[/align] [/td][td] [align=center][sup]0.01~0.5[/sup][/align] [align=center][sup]0.01~0.5[/sup][/align] [align=center][sup]0.01~0.5[/sup][/align] [align=center][sup]0.002~0.1[/sup][/align] [align=center][sup]0.002~0.1[/sup][/align] [align=center][sup]0.002~0.1[/sup][/align] [/td][td] [align=center]Y=2393.6x+479.38[/align] Y=1885x+139.66 [align=center]Y=1470.9x+187.97[/align] [align=center]Y=4287.9x+442.79[/align] [align=center]Y=3521.7x-103.62[/align] [align=center]Y=1993x+122.79[/align] [/td][td] [align=center]0.9995[/align] [align=center]0.9999[/align] [align=center]0.9993[/align] [align=center]0.9998[/align] [align=center]0.9997[/align] [align=center]0.9998[/align] [/td][td] [/td][/tr][/table]2.4回收率和精密度大豆中De、GLe、Ge含量较低,而D、GL、G含量较高,故本方法准确度实验分为高低浓度梯度组进行加标。称取大豆试样1.00 g,分别添加0.01、0.05、0.2 g/kg(De、GLe、Ge)和0.2、1、2 g/kg(D、GL、G),每个水平重复6次,同时做该大豆的空白本底实验。按照1.4前处理方法处理后上机检测,计算回收率(扣除空白),结果表明:不同添加浓度下,De、GLe、Ge的平均回收率为91.7%~96.2%,相对标准偏差(RSD,n=6)为2.78%~5.93%;D、GL、G的平均回收率为86.6%~93.8%,相对标准偏差(RSD,n=6)为1.07%~3.77%。[b]3 结语[/b]本文建立了超高效液相色谱-串联质谱法(UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS)测定大豆中大豆异黄酮含量的分析方法。该方法灵敏度高,线性范围宽,能同时覆盖大豆中多梯度浓度大豆异黄酮组分含量的测定。同时该方法具有较高的准确度和精密度,前处理步骤简单,分析速度快,可有效避免由于色谱柱柱效下降对最终检测结果的影响,特别适合大批量样品的检测。田娟娟, 宋宏哲, 张飞, 等. 水剂法纯化大豆异黄酮的研究. 大豆通报, 2005, 6:19-22. Hagen M K, Ludke A, Araujo A S, et al.Antioxidant characterization of soy derived products in vitro and the effect ofa soy diet on peripheral markers of oxidative stress in a heart disease model .Canadian Journal of Physiology and Pharmacology, 2012,90(8):1095-1103. 徐春华, 张治广, 谢明杰, 等. 大豆异黄酮的抗氧化和抗肿瘤活性研究研究 . 大豆科学, 2010, 29(5): 870-873. 李俏俏, 王清路, 薛金艳, 等. 大豆异黄酮对绝经女性血清中脂类物质的影响的研究 . 大豆科学, 2009, 28(1):172-174. 胡润芳, 张玉梅, 陈宇华, 等. 大豆异黄酮含量的初步研究. 东南园艺, 2017, 6:9-11. 刘琴, 朱媛媛, 白兴梁. 不同种类大豆中大豆异黄酮含量及抗氧化性比较. 北京工商大学学报(自然科学版), 2012, 30(6): 45-51. 袁凤杰, 姜莹, 董德坤, 等. 中国大豆核心种质异黄酮含量分析.中国粮油学报, 2011, 26(2):5-8. Tepavcevic V, Atanackovic M,Miladinovic J,et al. Isoflavone composition,total polyphenolic content,and antioxidant activity in soybeans of different origin. MedFood,2010,13(3):657-664 GB/T 26625-2011《粮油检验大豆异黄酮含量测定高效液相色谱法》. Liggins J,Bluck J C. Deidzein and genistein content of fruits and nuts. Journal ofNutritional Biochemistry,2000,11(6):326-331. 鞠兴荣, 袁建, 汪海峰. 三波长紫外分光光度法测定大豆异黄酮含量的研究. 食品科学, 2001, 22(5):46-48.


