推荐厂家
暂无
暂无



 400-860-5168转3825
400-860-5168转3825
 留言咨询
留言咨询

 400-860-5168转6216
400-860-5168转6216
 留言咨询
留言咨询

 留言咨询
留言咨询



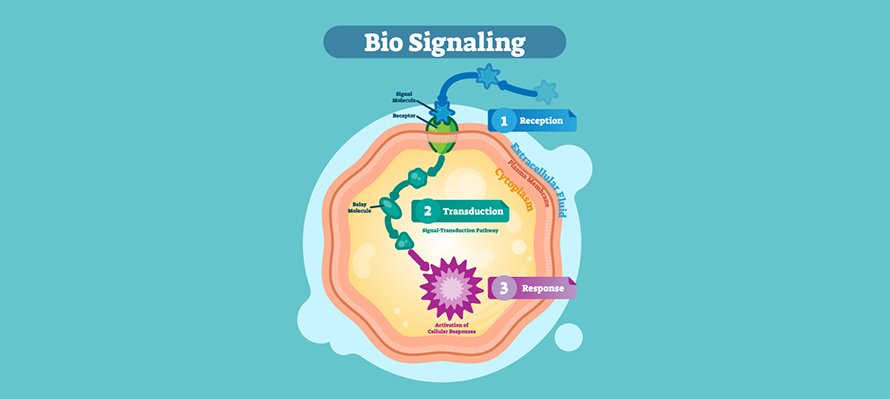
[b][size=15px][color=#595959]血管[/color][/size][size=15px][color=#595959]生成[/color][/size][/b][size=15px][color=#595959]是[b]肿瘤[/b]发展和转移的标志,使氧气和营养物质运输到过度增殖的[/color][/size][b][size=15px][color=#595959]肿瘤细胞[/color][/size][/b][size=15px][color=#595959]。目前,许多抗血管生成靶向药物被用于[/color][/size][b][size=15px][color=#595959]恶性肿瘤[/color][/size][/b][size=15px][color=#595959]的治疗,如[b]血管内皮生长因子(VEGF)[/b]单克隆抗体贝伐珠单抗、寡核苷酸适配体哌加他尼、重组融合蛋白阿柏西普等。然而大多数患者对这些药物有许多毒性反应,容易产生耐药性。此外,还存在疗效不一、价格偏高等问题。[/color][/size] [size=15px][color=#595959]许多临床研究证实,中药通过多环节、多靶点的过程,在[b]抗血管生成[/b]和[/color][/size][b][size=15px][color=#595959]抑制[/color][/size][size=15px][color=#595959]肿瘤转移[/color][/size][/b][size=15px][color=#595959]方面具有副作用少、治疗效果好的特点。因此,安全有效的中药在癌症治疗中的应用还有待进一步探索。[b]积雪草(CA)[/b]在传统中医中被用于治疗癌症已有几个世纪的历史。已有研究证实其抗血管生成的作用,但其作用机制尚不清楚。[/color][/size] [size=15px][color=#595959]该研究旨在通过[b]网络药理学[/b]和实验验证,探讨[b]CA及其三萜[/b]抗血管生成的潜在机制。[/color][/size] [size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][size=15px][color=#595959]利用Cytoscape构建化合物-疾病靶点和蛋白-蛋白相互作用(PPIs)网络,从中鉴定核心靶点。使用metscape进行GO和KEGG分析,并使用AutoDock-Vina程序实现分子对接以进一步验证。然后利用[b]VEGF165建立诱导血管生成模型[/b]。通过测量细胞增殖、迁移和管状结构形成来评估CA的抗血管生成作用。[/color][/size][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size] [align=center][size=16px][color=#3573b9]结果[/color][/size][size=15px][color=#595959][/color][/size][/align] [size=15px][color=#595959]CA中有[b]25种活性成分具有抗血管生成的潜在靶点[/b],包括[b]羟基积雪草甙、积雪草苷、羟基积雪草酸、积雪草酸和积雪草苷B[/b]。共鉴定出138个潜在靶点,其中[b]19个核心靶点包括STAT3、SRC、MAPK1和AKT1[/b]。KEGG分析显示,CA与癌症相关的途径有关,特别是[b]PD-1和AGE-RAGE[/b]。分子对接验证了CA活性组分与血管生成的前四个重要靶点具有良好的结合能。[/color][/size] [size=15px][color=#595959]在实验验证中,CA提取物和三萜通过减少人脐静脉内皮细胞(HUVECs)的增殖、迁移和管形成来改善VEGF165诱导的血管生成。[/color][/size][font=mp-quote, -apple-system-font, BlinkMacSystemFont, &][size=15px][color=#595959][/color][/size][/font][font=mp-quote, -apple-system-font, BlinkMacSystemFont, &][size=15px][color=#595959][/color][/size][/font][size=15px][color=#595959][/color][/size][color=#3573b9]结论[/color][size=15px][color=#595959][/color][/size] [b][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][/b][size=15px][color=#595959][font=&][/font][/color][/size][b][size=15px][color=#595959][/color][/size][/b][size=15px][color=#595959][/color][/size][b][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][/b][size=15px][color=#595959][/color][/size][size=15px][color=#595959]该研究结果初步证明了[b]CA的有效成分和良好的抗血管生成活性[/b]。证据表明CA的提取物和三萜具有令人满意的抗血管生成作用,这表明[b]CA作为治疗癌症的潜在药物具有很大的潜力[/b]。[/color][/size][size=15px][color=#595959][/color][/size][size=15px][color=#595959] [/color][/size]
在一项最新研究中,来自美国印第安纳大学医学院的研究人员比较了来自人胎盘和来自人脐带血的内皮集落形成细胞(endothelial colony-forming cells, ECFCs)哪个拥有更强的增殖能力和更好地形成新的血管,结果发现来自人胎盘的ECFCs更好地产生新血管。相关研究结果发表在Cell Medicine期刊上。研究通信作者Michael P. Murphy博士说,“从人脐带血分离出的循环流通ECFCs(circulating ECFCs)和从人胎盘中分离出的常驻ECFCs(resident ECFCs)在表型上是一样,而且拥有同样的增殖潜力。在移植之后,胎盘来源的常驻ECFCs要比来自脐带血中的循环流通ECFCs产生明显更加多的血管,这就表明常驻ECFCs和循环流通ECFCs之间存在内在性的功能差别,源自胎盘的ECFCs产生更加多的新血管。”研究人员说,脐带血和胎盘胚外膜都是祖细胞的理想来源。然而,从胎盘中能够获得的细胞量要比从脐带血中获得的数量大得多,这就使得胎盘成为细胞量更为充足的来源。他们作出结论,胎盘代表着一种ECFCs数量充足的来源,能够提供大量用于治疗的细胞
【序号】:4【作者】:谌程程【题名】:c-Cbl对长期扩增培养的BM-MSCs用于促进血管生成及糖尿病创面愈合的影响【期刊】:中国人民解放军陆军军医大学【年、卷、期、起止页码】:2021【全文链接】:https://kns.cnki.net/kcms2/article/abstract?v=3uoqIhG8C447WN1SO36whLpCgh0R0Z-ia63qwICAcC3-s4XdRlECrf6Jl847AheRjKMZgxs9-PxRToSpp4Xl1nCRiR41xLdy&uniplatform=NZKPT