有没有关于荧光标准曲线制作的书籍,或者别的资料。求推荐。谢谢
当你在测定物质的荧光强度时,荧光标准溶液作何用?有下列答案供选择:A.参比溶液B.荧光测定标度C.调整仪器零点D.对照标准
请各位帮忙:X荧光标准样品保存和光洁度注意的方面
请教各位高手:荧光标准工作曲线的线性范围的上下限应该怎么计算?谢谢
一直想找钢中化学成分采用X荧光仪分析的国家标准,那位大虾赐教?谢谢
5(6)-FAM,FITC,CY5,RhodamineB,PNA,EDNAS/dabcyl等荧光标记修饰的多肽:荧光标记修饰多肽技术是我们国肽生物的代表性多肽合成技术,我们的这项技术已经相当成熟。[img=,488,412]https://ng1.17img.cn/bbsfiles/images/2019/04/201904191652029467_5266_3531468_3.jpg!w488x412.jpg[/img]我们主要提供:多肽合成、定制多肽、同位素标记肽、人工胰岛素、磷酸肽、生物素标记肽、荧光标记肽(Cy3、Cy5、Fitc、AMC等)、目录肽、偶联蛋白(KLH、BSA、OVA等)、化妆品肽、多肽文库构建、抗体服务、糖肽、订书肽、药物肽、RGD环肽等。合肥国肽生物官网:http://www.bankpeptide.com欢迎咨询服务热线:17718122172;17718122684;17730030476;17718122397
[em03],各位原子荧光的前辈,我刚入行,用海光公司AF2202型双到原子荧光测汞,标准曲线法,可我的标准曲线测完后,荧光值标准空白最高32,其他的标准溶液都是负值,压根就没有出现标准曲线,怎么办,求救,在线等!!!!
[b][font=宋体]一、引言[/font][/b][font=宋体] [/font][font=宋体]荧光标记技术是生物学和医学领域中常用的可视化技术,其中荧光标记抗体凭借其独特的应用优势,在许多研究方向中发挥了重要作用。本文将详细介绍荧光标记抗体的原理、应用及最新进展。[/font][font=宋体] [/font][b][font=宋体]二、荧光标记抗体的原理[/font][/b][font=宋体] [/font][font=宋体]荧光标记技术是一种利用荧光物质对目标进行标记,通过特定波长的光激发后发出荧光,从而实现可视化检测的方法。荧光标记抗体则是将荧光物质与特异性抗体结合,形成荧光标记抗体,用于对目标抗原进行特异性结合和荧光标记。常见的荧光物质有荧光素、量子点、上转换纳米颗粒等。[/font][b][font=宋体] [/font][font=宋体]三、荧光标记抗体的应用[/font][/b][font=宋体] [/font][font=宋体][font=宋体]免疫分析:荧光标记抗体在免疫分析中具有广泛的应用,如酶联免疫吸附试验([/font][font=Calibri]ELISA[/font][font=宋体])、流式细胞术、免疫荧光染色等。通过荧光标记抗体与抗原的特异性结合,可以实现对目标抗原的高灵敏度、高特异性检测。例如,利用荧光标记抗体检测肿瘤标志物,有助于肿瘤的早期诊断和治疗监测。[/font][/font][font=宋体]细胞成像:荧光标记抗体在细胞成像中具有重要作用,可以用于观察细胞内特定抗原的表达情况,了解细胞的功能和行为。例如,利用荧光标记抗体对细胞膜抗原进行标记,可以观察细胞迁移、侵袭等行为。[/font][font=宋体]组织切片染色:荧光标记抗体也可用于组织切片染色,对病理组织中的特定抗原进行标记,有助于病理诊断和组织学研究。例如,利用荧光标记抗体对肿瘤组织进行染色,有助于肿瘤类型的鉴别和恶性程度的评估。[/font][font=宋体]药物筛选:荧光标记抗体在药物筛选中具有重要应用,可以用于药物作用靶点的检测和药物作用机制的研究。例如,利用荧光标记抗体对药物作用靶点进行标记,可以观察药物对靶点的影响,评估药物的疗效和安全性。[/font][font=宋体] [/font][b][font=宋体]四、展望[/font][/b][font=宋体] [/font][font=宋体]随着荧光标记技术的不断发展,荧光标记抗体在灵敏度、特异性和可视化效果等方面得到了显著提升。同时,新型荧光物质的开发和制备也为荧光标记抗体的应用提供了更多选择。未来,随着荧光标记技术的进一步优化和多色荧光标记技术的发展,荧光标记抗体将在更多领域发挥重要作用,为生物学、医学和其他相关领域的研究提供有力支持。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/immunofluorescence-service][b]免疫荧光检测服务[/b][/url]:[/font][font=Calibri]https://cn.sinobiological.com/services/immunofluorescence-service[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
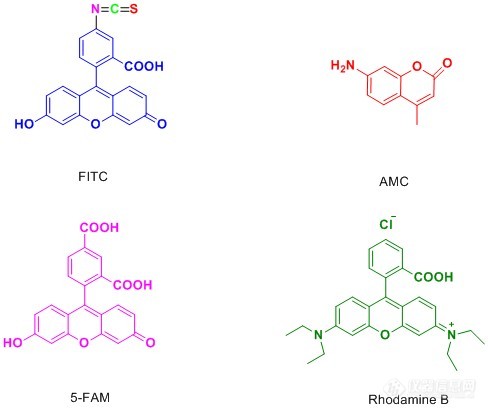
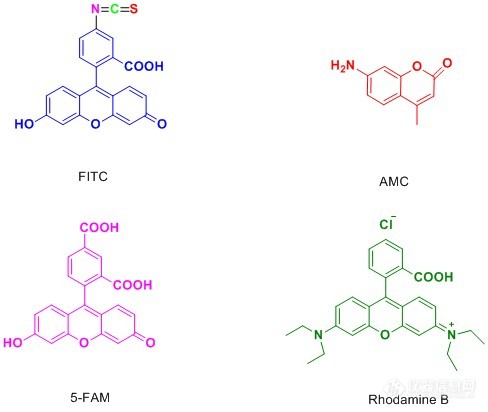
荧光标记所依赖的化合物称为荧光物质。荧光物质是指具有共轭双键体系化学结构的化合物,受到紫外光或蓝紫光照射时,可激发成为激发态,当从激发态恢复基态时,发出荧光。荧光标记技术指利用荧光物质共价结合或物理吸附在所要研究分子的某个基团上,利用它的荧光特性来提供被研究对象的信息。荧光标记的无放射物污染,操作简便等优点,使得荧光标记物在许多研究领域的应用日趋广泛。荧光标记物质在蛋白的功能研究、药物筛选等领域也有着广泛的应用。人们利用利用荧光标记的多肽来检测目标蛋白的活性,并将其发展的高通量活性筛选方法应用于疾病治疗靶点蛋白的药物筛选和药物开发(例如,各种激酶、磷酸酶、肽酶等)。因此,多肽的荧光修饰,同样是多肽合成领域的重要内容。下面是一些常用的多肽修饰荧光物质:[align=center][img=,488,412]https://ng1.17img.cn/bbsfiles/images/2018/12/201812201531359566_2467_3531468_3.jpg!w488x412.jpg[/img][/align]下面是一些荧光物质的激发光波长和发射光波长[align=center][img=,572,527]https://ng1.17img.cn/bbsfiles/images/2018/12/201812201531560487_1473_3531468_3.jpg!w572x527.jpg[/img][img=,572,296]https://ng1.17img.cn/bbsfiles/images/2018/12/201812201531563837_2721_3531468_3.jpg!w572x296.jpg[/img][/align]1.FITC修饰异硫氰酸荧光素(FITC)具有比较高的活性,通常来说,在固相合成过程中引入该种荧光基团相对于其他荧光素要更容易,并且反应过程中不需要加入活化试剂。我们公司合成的FITC修饰的多肽通常主要有两种形式:(1)在整条肽链末端接入FITC,并且在FITC之前接入一分子的Acp(6-氨基己酸),也称烷基间隔器。反应中FITC与肽链上裸露的-NH2反应,Acp的接入提供了六个碳的直链空间,大大降低了反应的空间位阻,提高了反应效率,降低了反应难度。其次,FITC还与多肽结构中的-SH,侧链-NH2反应,Acp的加入也降低了这种副反应发生的可能。此外,多肽在酸性环境条件下切割时,在N端接入FITC的多肽需要经历环化作用来形成荧光素,这种过程通常都会伴随最后一个氨基酸的切除,而烷基间隔器Acp的接入就避免了这一情况的发生。(2)在整条肽中的某个Lys侧链接入FITC,Lys侧链为末端为-NH2的四碳直链烷基,直接起到了降低空间位阻的作用。这种修饰方式能够灵活的在整条肽中任何位置进行FITC修饰,而不仅仅局限于末端。我们所采用的FITC修饰多肽的两种形式,都具有操作简便,成功率高,容易分离纯化等优点。[align=center][img=,670,486]https://ng1.17img.cn/bbsfiles/images/2018/12/201812201532383561_827_3531468_3.jpg!w670x486.jpg[/img][/align]2.AMC修饰7-氨基-4-甲基香豆素(AMC)是一种应用广泛的荧光标记试剂,例如,酶的痕量测定,酶的鉴定,激光染料的制备等多种用途,此外,C端用香豆素修饰的泛素分子也是研究蛋白质泛素化过程的重要探针。与其他荧光染料不同的是,AMC修饰多肽分子是从C端进行:(1)AMC与肽链C端第一个氨基酸反应 (2)固相合成整条肽链(从第二个氨基酸开始),并且保留整条肽链的侧链保护基和最后一个氨基保护基;(3)液相缩合AA-AMC与全保护的肽链;(4)切除保护基,完成肽链的修饰。[align=center][img=,514,326]https://ng1.17img.cn/bbsfiles/images/2018/12/201812201533275550_1867_3531468_3.jpg!w514x326.jpg[/img][/align]国肽生物提供5(6)-FAM,FITC,CY5,RhodamineB,PNA,EDNAS/dabcyl,Biotin等各种修饰的高质量多肽。国肽生物具有成熟的荧光标记多肽技术,优良的纯化生产工艺,定制荧光修饰的多肽,国肽生物是值得信任的品牌。成功案例:序列Cy5-betaA-YNDEDPEKEKRIKELELLLMSTENELKGQQAL,CY5进行修饰。HPLC分析:[align=center][img=,562,256]https://ng1.17img.cn/bbsfiles/images/2018/12/201812201534177890_6619_3531468_3.jpg!w562x256.jpg[/img][/align]MS分析:[align=center][img=,562,236]https://ng1.17img.cn/bbsfiles/images/2018/12/201812201534424203_4797_3531468_3.jpg!w562x236.jpg[/img][/align]合肥国肽生物官网[img=,220,52]https://ng1.17img.cn/bbsfiles/images/2018/12/201812201535194030_1002_3531468_3.jpg!w220x52.jpg[/img]
吉天AFS-8220原子荧光测砷时,标准空白是载液还是标准系列的0点? 在软件标准系列设置时,0点是输不进去的,但是曲线的结果会有0点,我用的标准系列的0点做标准空白,跟标准系列一样加过预还原剂的,曲线可以做出来,但是后面用标液配制的样品,按样品来测,发现结果偏高很多,是不是我标准空白弄错了呢?
最近用天瑞的原子荧光AFS200T测地表水中硒时出现的问题,当我曲线的线性范围是0~20ug/L时,线性相关系数为0.999,而截距为-59左右,这样就导致我在测实际样品时,在荧光值为0.5左右时,仪器自己反应出来的浓度有0.3ug/L,这已经超出标准的检出限了,而我用标准空白和载流空白进样测定时,得到的浓度也在0.3ug/L左右,这就说明我的曲线截距对样品浓度的计算有很大影响了,本来是未检出的样品都被测定出超出方法检测线。当我把曲线的线性范围调整到0~5ug/L时,截距为-23左右,这样的曲线用来测地表水,最后就能报未检出。想请教几个问题:1 标曲的截距到底是什么原因产生的?有的同事说是因为荧光淬灭,在低浓度时淬灭个几十荧光值,而当高浓度时淬灭的荧光值相对本身的荧光值而言影响就很小了,所以导致最终出现比较大的截距。我个人比较同意这个观点,但是我在看荧光淬灭产生 的原因时,发现就有点说不通了,只有在高浓度时才会发生荧光自淬灭,低浓度基本不会出现。2 通过实践证明,缩小曲线的线性范围确实是能降低截距,这个该如何解释?用荧光淬灭确实比较容易说的通3 在做砷的时候,由于低浓度的砷也有很大的荧光值,所以就算截距在-50左右,依然不会有太大影响(在其他帖子上看到这样的说法:截距在标曲的第一个点的荧光值的十分之一都算合理)。那么我在实验条件优化之后,在测硒、锑、汞这些荧光响应值相对较小的元素时,如何避免应为截距的问题而导致的误差?4 为什么在测汞的时候,会出现截距为正,而在测硒、砷、锑时截距都是负的。ps:对于标准曲线的配置,我个人还是比较信任自己的操作的。我做曲线都是自己手工配置5~6个点,包括标准空白。
在做原子荧光测量做标准系列的过程中,仪器基本最少是需要六个标准点,但是在操作的过程中,标准系列点中因为某一或两点做得并不好,r值并不能达到0.999以上,因此不停重复测那一至两个标准点,甚至重新配制那两点的标准溶液,然后上机不停的替换做标准系列,直至r值为0.999以上,这个是否正确呢?请教各位高手了,谢谢
求助写出两种用于免疫分析的荧光标记物和化学发光标记物,写出它们的标记反应。
哪位老师有太阳光标准光谱图和数据!麻烦给我传一份好吗?谢谢了
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=154966]荧光标记染料[/url]
不知道各位大侠有那位使用目前最新的量子点荧光标记手段来进行检测的?大家来交流一下好吗》?[em07]
哪位有GE荧光差异双向电泳的荧光标记试剂盒的渠道请站短
问题描述:荧光定量[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]几种不同荧光标记有哪些,有什么区别?解答:[align=left][font=宋体][color=black]荧光定量[/color][/font][font='Times New Roman','serif'][color=black][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/color][/font][font=宋体][color=black]的荧光标记主要有特异性和非特异性两类。非特异性荧光标记主要包括:[/color][/font][font='Times New Roman','serif'][color=black]SYBR Green I[/color][/font][font=宋体][color=black],[/color][/font][font='Times New Roman','serif'][color=black]SuperGreen[/color][/font][font=宋体][color=black];特异性荧光标记主要包括:水解探针([/color][/font][font='Times New Roman','serif'][color=black]TaqMan[/color][/font][font=宋体][color=black]探针)、杂交探针([/color][/font][font='Times New Roman','serif'][color=black]hybridization probe[/color][/font][font=宋体][color=black])、分子信标。[/color][/font][/align][align=left][font='Times New Roman','serif'][color=black]SYBR Green [/color][/font][font=宋体][color=black],对[/color][/font][font='Times New Roman','serif'][color=black]DNA[/color][/font][font=宋体][color=black]模板没有选择性,适用于任何[/color][/font][font='Times New Roman','serif'][color=black]DNA[/color][/font][font=宋体][color=black]使用方便、灵敏、便宜,不必设计复杂探针,但容易与非特异性双链[/color][/font][font='Times New Roman','serif'][color=black]DNA[/color][/font][font=宋体][color=black]结合,产生假阳性,对引物特异性要求较高。[/color][/font][/align][align=left][font='Times New Roman','serif'][color=black]TaqMan[/color][/font][font=宋体][color=black]探针法,对目标序列的高特异性设计不同标记的探针,可进行多重检测,结果的重复性较好,但只适合一个特定的目标,价格相对较高,探针的设计较为繁琐。[/color][/font][/align]以上内容来自仪器信息网《PCR实战宝典》
[font=宋体]在生物学研究中,融合标签作为一种强大的工具,广泛应用于蛋白质纯化、定位和功能分析等方面。而在众多的融合标签中,表位标签、亲和标签和荧光标签是三种常见的分类。它们各自具有独特的特性和应用,为生物学研究提供了便利。表位标签主要用于蛋白质的检测和识别,通过特定的抗体与表位结合,实现对目标蛋白质的精准定位。亲和标签则依赖于其与特定配体的亲和力,用于蛋白质的纯化和分离。荧光标签则以其独特的发光性质,为蛋白质在细胞内的定位和动态变化提供了直观的观察手段。本文将深入探讨这三种标签的区别及其在各自领域的应用。[/font][font=宋体] [/font][b][font=宋体]为什么要考虑融合标签?融合标签的优缺点:[/font][/b][font=宋体]优点:[/font][font=宋体]①无需特异性蛋白即可分离目标蛋白[/font][font=宋体]②有时可在纯化后裂解标签[/font][font=宋体]③可将多个标签连接到同一蛋白上,增加其功能[/font][font=宋体]④避免免疫沉淀中出现抗体干扰[/font][font=宋体]⑤荧光标签可用于显示活细胞中的蛋白[/font][font=宋体]⑥多种标签供选择,适合不同的应用[/font][font=宋体] [/font][font=宋体]缺点:[/font][font=宋体]①某些标签可能会影响蛋白功能[/font][font=宋体]②可能需要多次尝试才能找到最佳标签位置,导致实验成本增加[/font][font=宋体] [/font][b][font=宋体][font=宋体]标签揭秘:表位标签、亲和标签和荧光标签[/font][font=宋体][/font][/font][/b][font=宋体] [/font][font=宋体]融合标签主要分为三类,适用于不同的应用:表位标签、[url=https://cn.sinobiological.com/resource/protein-review/affinity-tag][b]亲和标签[/b][/url]和荧光标签。[/font][font=宋体] [/font][font=宋体][font=宋体]表位标签往往是短肽序列,可用于免疫学应用,如[/font] [font=Calibri]Western Blot [/font][font=宋体]和免疫共沉淀。[/font][/font][align=center][font=宋体] [/font][img=表位标签抗体+序列,534,481]https://ng1.17img.cn/bbsfiles/images/2024/03/202403051443476642_6751_5907840_3.png!w534x481.jpg[/img][/align][font=宋体]亲和标签一般较长,可用于蛋白纯化或增加蛋白溶解度。[/font][align=center][font=宋体] [/font][img=亲和标签抗体+序列,500,284]https://ng1.17img.cn/bbsfiles/images/2024/03/202403051444164170_2397_5907840_3.png!w500x284.jpg[/img][/align][font=宋体]荧光标签可用于活细胞和死细胞,并广泛用于影像学研究,如细胞定位和共表达实验。[/font][align=center][img=荧光标签抗体+序列,537,191]https://ng1.17img.cn/bbsfiles/images/2024/03/202403051444342533_295_5907840_3.png!w537x191.jpg[/img][/align][font=宋体] [/font][b][font=宋体][font=宋体]标签揭秘选择[/font] [font=Calibri]C [/font][font=宋体]端还是 [/font][font=Calibri]N [/font][font=宋体]端?[/font][/font][/b][font=宋体][font=宋体]选择将标签融合到目标蛋白的[/font] [font=Calibri]C [/font][font=宋体]端还是 [/font][font=Calibri]N [/font][font=宋体]端,很大程度上取决于蛋白本身:蛋白的折叠方式,以及您选择的末端是否有功能要求。例如,如果 [/font][font=Calibri]C [/font][font=宋体]端在蛋白内部折叠,那么您收到融合蛋白信号的可能性非常小;或者,如果蛋白在标签融合末端进行翻译后剪切,那么标签将从目标蛋白中移除。[/font][/font][font=宋体][font=宋体]如果您有资源或准备开展新型实验,最好同时克隆[/font] [font=Calibri]C [/font][font=宋体]端和 [/font][font=Calibri]N [/font][font=宋体]端标签的构造,从而确定最佳选择。一研究小组发现,与 [/font][font=Calibri]N [/font][font=宋体]端的标签融合蛋白相比, 更多的[/font][font=Calibri]C[/font][font=宋体]端融合蛋白定位于目标亚细胞腔隙。但是,需要强调的是,虽然 [/font][font=Calibri]C [/font][font=宋体]端标签蛋白的定位和表现往往符合预期,但并不是始终可以预测。[url=https://cn.sinobiological.com/resource/protein-review/fusion-protein][b]融合蛋白[/b][/url]定位是否正确,可通过免疫荧光进行检测;免疫印迹有助于确认融合蛋白的大小是否正确并以预期的水平表达,[url=https://cn.sinobiological.com/services/ip-co-ip-service][b]免疫共沉淀[/b][/url]有助于评估融合蛋白与已知底物的相互作用方式。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多[url=https://cn.sinobiological.com/resource/protein-review/protein-tag][b]蛋白标签[/b][/url]详情可以查看:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-tag[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
XRF买仪器的时候送了一个塑料片是预热的,一个银片是初始化的,一个681K的标准品。仪器主要是做ROHS的,上次审核的时候被开了个不符合,说是没有标准品,而且我们的681K证书也过期了,说是要买铜合金,铝合金,锡合金的标准品,我在网上查的时候没见过有铜合金,铝合金,锡合金合金里含有铅,汞,铬,镉的。有的一些只含有其中一两种金属元素,问了一些人别人也没见过,我想问下你们,你们有这东西吗?
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=15490]As Hg Pb Se原子荧光标准[/url]中 华 人 民 共 和 国 水 利 行 业 标 准
生物荧光倒置显微镜用于荧光标记的CD63抗体复合材料的表征[img]https://ng1.17img.cn/bbsfiles/images/2023/06/202306302150380963_8217_5389809_3.png[/img]
最近用天瑞的原子荧光AFS200T测地表水中硒时出现的问题,当我曲线的线性范围是0~20ug/L时,线性相关系数为0.999,而截距为-59左右,这样就导致我在测实际样品时,在荧光值为0.5左右时,仪器自己反应出来的浓度有0.3ug/L,这已经超出标准的检出限了,而我用标准空白和载流空白进样测定时,得到的浓度也在0.3ug/L左右,这就说明我的曲线截距对样品浓度的计算有很大影响了,本来是未检出的样品都被测定出超出方法检测线。当我把曲线的线性范围调整到0~5ug/L时,截距为-23左右,这样的曲线用来测地表水,最后就能报未检出。想请教几个问题:1 标曲的截距到底是什么原因产生的?有的同事说是因为荧光淬灭,在低浓度时淬灭个几十荧光值,而当高浓度时淬灭的荧光值相对本身的荧光值而言影响就很小了,所以导致最终出现比较大的截距。我个人比较同意这个观点,但是我在看荧光淬灭产生 的原因时,发现就有点说不通了,只有在高浓度时才会发生荧光自淬灭,低浓度基本不会出现。2 通过实践证明,缩小曲线的线性范围确实是能降低截距,这个该如何解释?用荧光淬灭确实比较容易说的通3 在做砷的时候,由于低浓度的砷也有很大的荧光值,所以就算截距在-50左右,依然不会有太大影响(在其他帖子上看到这样的说法:截距在标曲的第一个点的荧光值的十分之一都算合理)。那么我在实验条件优化之后,在测硒、锑、汞这些荧光响应值相对较小的元素时,如何避免应为截距的问题而导致的误差?4 为什么在测汞的时候,会出现截距为正,而在测硒、砷、锑时截距都是负的。ps:对于标准曲线的配置,我个人还是比较信任自己的操作的。我做曲线都是自己手工配置5~6个点,包括标准空白。
原子荧光测定样品的标准曲线,可以重复利用不?
今天做了牛奶的重金属测定,发现原子原子荧光光度计的荧光值特别低,但是找不出什么原因。
我做原子荧光测汞,标曲是按照标准溶液配(只含标曲元素.水和盐酸),还是说全程按照样品处理的的方法(除了以上三者,还要和样品添加其他试剂一样,变量只是标液的浓度),大家有没有出现过样品空白的荧光强度比试剂空白的还低的情况.你们是怎么解决的?
实验思路,带有荧光模块的酶标仪可以高通量定量测定显荧光的物质,合成的新材料接枝荧光标签后,可以特异性结合外泌体等生物囊泡,从而计算外泌体的数量,用于后续的研究。
谷氨酸的红外图是什么样的?它能用荧光表征么?
有哪些荧光标准物质可用做量子产率测定的参比?
我想测一种物质的荧光量子产率,待测物的激发波长是360nm,发射波长是490nm,不知该选择哪个荧光标准物,其量子产率是多少?谢谢各位呀!(急)