化学药物质量标准建立的规范化过程技术指导原则第二稿目录 一、概述 二、质量标准建立的基本过程 (一)质量研究内容的确定 (二)方法学研究 (三)质量标准项目及限度的确定 (四)质量标准的制定 (五)质量标准的修订 三、药物的质量研究 (一)质量研究用样品和对照品 (二)原料药质量研究的一般内容 (三)制剂质量研究的一般内容 (四)方法学研究 四、质量标准的制定 (一)质量标准制定的一般原则 (二)质量标准项目和限度的确定 (三)质量标准的格式和用语 (四)质量标准的起草说明 五、质量标准的修订 (一)质量标准修订的必要性 (二)质量标准修订的一般原则 (三)质量标准的阶段性[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=46808]化学药物质量标准建立的规范化过程技术指导原则第二稿[/url]
新药质量标准药品不同于一般产品,是用于防病、治病、诊断疾病、改善体质、增强抵抗力的物质。因此,药品质量好坏直接关系着人们的身体健康和生命安全。为保证药品质量,必须制定出每种药品的管理依据,即药品质量标准,并对药品质量进行全面控制(从研究、生产、贮存到使用各个环节),以确保用药的安全有效。自60年代以来,鉴于药品安全总是的突出,各国政府和世界卫生组织对药品质量都很重视,先后组织了大批科研、生产、临床使用和管理单位对药品的安全性和有效性进行了深入探讨,制订了相应的药品管理法规,公布了一些能对药品质量控制的全过程起指导作用的法令性文件,计有:为确保实验研究质量与实验数据准确可靠的《实验室工作质量管理规范》(GLP);为生产出全面符合质量标准的药品的《药品生产质量管理规范》(GMP);为保证药品在运输、贮存和销售过程中的质量和效力的《药品供应质量管理规范》(GCP)和保证临床资料的科学性、可靠性和重现性的《临床工作质量管理规范》(GCP)。我国卫生部和国家医药管理总局为加强新药的临床、鉴定和审批等管理工作,促进新药的发展,保证新药的质量,先后制订和修订了《新药管理办法》,把新药的质量标准列为新药审批的内容之一,要求研制单位在研究新药及其生产工艺的同时,必须制订出新药及其制剂的质量标准草案,经批准后方能进行临床试验和工厂试生产;对加强"全面控制药品质量"的科学管理的四个主要方面(GLP、GMP、GSP、GCP),有的已在研定实施,有的条例尚在拟订中。药品质量标准对药品的质量规格及检测方法所作的技术规定,是药品生产、供应、使用、检验和管理部门必须共同遵循的法定依据。这里既有认真细致的技术措施,又有原则性问题。一、 制订新药质量标准的原则一个正在研究的新药,经临床前有关工作准备进入临床试验,应根据研究中发现的问题和评价的结果,制订出临床用药的质量标准,以保证临床用药质量的均衡性,这对保证临床试验的安全和得出正确结果具有重要意义。临床用药的质量标准也为今后中试以至投产的质量水平,并修订制订正式质量标准提供了依据。可按下列原则制订质量标准。(一) 要确保药品的安全性和有效性新药质量标准是衡量新药质量而作出的具体规定,要充分体现新药的特点,树立质量第一的观点,抓住影响新药质量的几个主环节,作出明确的规定。首先要保证新药的纯度,通过对外观性状、理化常数,杂质检查和含量等有关规定来保证药品的质量。杂质检查是控制药物质量的一个重要方面,要有针对性地制订检查项目,探明其对人体危害的程度,并规定其允许限量,危害健康的要严加控制,原则上内服药要求严些,注射用药和麻醉用药更严。有效成份的含量是反映药物纯度的重要标志,应明确规定其含量限度。对制剂的内在质量要有明确的要求,如新药的固体制剂应根据不同情况规定测含量均匀度、体外溶出度、甚至生物利用度等。注射剂要严格检查澄明度、无菌、热原等,以保证用药安全有效。新药的质量标准中还应对影响该药稳定性的因素采取一些措施,如在包装、贮存条件上作出规定,以加强防患。(二) 要符合国家药典或其他法定标准根据药品使用和生产的广泛和成熟程度,《药品管理法》规定,药品分为两种标准,即国家药品标准和省、自治区、直辖市的药品标准。前者包括中国药典和卫生部颁布的药品标准(简称部颁标准),在全国范围内起法定作用;后者为各省、自治区、直辖市有关卫生行政部门制订的药品标准,只限在相应的地区起法定作用。第一、二、三类新药由国家卫生部审批,应严格按照中国药典和卫生部的要求,制订新药的质量标准,按中国药典的格式及使用的术语进行书写,力求规范化。需要在国际范围内使用交流的新药,应按有关国际标准制订。(三) 要结合实验研究和中试生产的实际新药质量标准是对新药系统评价基础上的高度概括,是根据实验研究、临床试验和中试生产三方面的结果制订的。因此,从新药评价开始,就要有目的、有计划地收集和积累有关药品质量问题的资料,及时发现问题并及时解决,为制订新药质量标准提供依据。药品的质量与生产工艺有密切的关系。中试生产所用的原材料、溶剂等的质量以及最终产品的纯化往往与实验研究不尽相同,有可能产品达不到实验研究的规格和纯度。制订新药质量标准时,则要全面考虑、宽严适度,做到合理性和可行性。应在保证药品安全性、有效性的前提下,根据实验研究资料,结合中试生产的实际情况,制订出既确保药品质量,又能符合生产实际,并难促进生产的新药质量标准。(四) 把检测手段的先进性和可行性结合起来随着现代分析技术的发展,药品检测手段也已由经典法向仪器化、自动化方向推进,从凭感观到尽量用参数。现代分析技术有快速、灵敏、专一的特点,但需要特殊的仪器设备,有些在我国国情条件下,尚难以普及推广。经典方法如容量法、分光光度法等,简便易行、准确度高,不受设备条件的限制,在当前的药检工作中,仍占有一定的地位。选择检测方法,既要积极采用现代分析技术,又要结合药检工作的实际情况,把先进性和可行性结合起来。当然,随着仪器设备的逐步普及,现代分析技术在药品检测工作中的应用将会与日俱增。美国药典22版各项分析方法的应用中,色谱法和光谱法处于最重要的地位,尤其是高效液相色谱法(HPLC),在所有的含量测定方法中应用频率最高。所收载的应用气相色谱法(GC)中,除常规的GC法外,还有衍生GC法、裂解GC法和顶空毛细管GC法。核磁共振法也已作为法定检测手段。22版还首次在附录中收载了质谱法(MS)和扫描电子显微镜法(SEM)。中国药典1995年版中高效液相色谱法、电泳法、原子吸收分光光度法和荧光分析法等也已列为法定检测手段。
一直以来,认为《中国药典》是药品行业最权威的质量标准,也总是想当然的认为药品质量标准高于食品质量标准,药典标准是最严格的。最近,发现好多药品用的质量质量标准反而很低,和国标简直没法比。 举例来说,中药硫磺。药典规定含量只要大于等于98.5%即可。国标中连工业用硫磺都要求含量在99.0%以上,食品添加剂级硫磺要求达到99.9%以上,而且国标中还增加了水分、灰分、砷含量、有机物等项目的检测。药典为啥不能学习一下呢? 大家遇到过类似的问题么?怎么看呢?
各位前辈,我是一药厂,我们用高纯氮气做为某些药品生产过程中的保护器,但是现在要求制定质量标准。我参考了下国标,发现氮[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]气质[/color][/url]量标准很难测,哪位同志有好的建议呀?谢谢。[~96935~]
药品在检验的时候,可以放大质量标准中样品的称重吗?比如质量标准说称20mg,我称了0.1g,放大了5倍,这个有没有具体要求?
农药原药的质量标准1.纯度纯度即原药中有效成份的含量,以百分率表示。纯度是原药质量的主要指标,有效成分含量百分率越高质量越好。联合国粮农组织(FAO)和世界卫生组织(WHO)公布的农药原药质量标准,纯度应在90%以上。在我国的农药质量标准中,原药的纯度一般也能达到90%以上。纯度低的农药原药中杂质的含量就高,原药中杂质过多有以下害处:(1)可能会对作物产生药害。2000年在吉林省梅河口市稻田使用苄嘧磺隆出现药害,造成稻苗死亡。苄嘧磺隆对稻苗的安全性较好,一般不会产生药害。据初步研究表明:产生药害的原因是苄嘧磺隆中的杂质JP-003和JP-004含量超标。(2)杂质较多会增高原药对人的毒性。例如甲胺磷的纯品对大鼠的LD50为30mg/kg体重,而国内有的厂家生产的50%甲胺磷乳油对大鼠的LD50为13.6mg/kg,说明毒性增高,其原因为甲胺磷原油中有5种杂质的含量较高,而且这5种杂质的毒性也较甲胺磷纯品的毒性为高。(3)原药中杂质都对以有效成分分子中含有某元素或某原子团的量计算有效成分含量的化学分析法失去原有的准确度。由于杂质中同样含有与有效成分相同的元素或原子团,使测定的结果产生偏差,不能反映原药及其制剂中有效成分的真实含量。(4)原药中的杂质还给加工粉剂带来困难,因为杂质的存在使原药的凝固点下降,不易粉碎。(5)原药的杂质能降低有效成分的稳定性,而且随着农药的使用,杂质进入环境之中,造成污染。所以要尽可能提高原药的纯度,减少杂质的含量。 2.酸碱度酸碱度既是原药的质量指标也是制剂的质量指标。酸碱度是指农药原药及其制剂中含游离酸或游离碱的数量,或其氢离子浓度。限制酸碱度的目的主要是降低贮存过程中农药原药和制剂中有效成分的分解作用,防止制剂物理性能改变及其使用时产生药害。此外还可以用作评估农药对包装材料腐蚀性的参考。FAO对原药及制剂及制剂酸碱度的质量标准均以酸度(H2SO4的含量百分数)或碱度(NaOH的含量百分数)表示,对原粉一般要求为0.1%~0.2%,原粉及制剂的酸碱度有时以PH值表示。我国对农药原药规定以酸度或碱度表示,对制剂大多规定以PH值表示。 3.水分含量水分含量既是原药又是制剂的质量指标。限制农药原粉中水份含量的目的是降低有效成分的分解作用,保持化学稳定性。对粉剂、可湿性粉剂来讲限制水分含量可使制剂保持良好的分散状态,喷洒时能很好的分散到叶面上。FAO在1971年后颁布的农药质量标准中,对农药原药及乳油、部分可溶性粉剂等剂型均有水分含量指标,而对粉剂、可湿性粉剂即无水分含量指标。我国对粉剂的水分含量要求不大于1.5%。但是因加工粉剂所用填料种类不同,其吸水性能有差异,有的填料吸水性强,即使水分含量高些,也不影响粉剂的分散性能;有的填料吸水性能弱,即使水分含量不太高,也会影响粉剂的分散性,因此用控制水分含量以保证粉剂的分散性的办法是不可靠的,用粉剂的流动性指标控制粉剂的分散性比用水分含量控制的办法更有效。我国在粉剂类农药制剂的质量标准中没有流动性指标,而用限制水分含量控制其分散性。
[size=4][B]农药质量标准概述[/B][/size]工厂生产的未经加工的农药原产物称之为原药,原产物在常温下是固体的称之为原粉,如绿麦隆原粉。是液体的,则称之为原油,如禾单丹、禾草敌原油。现在制订的标准中统称为“原药”。工厂生产的原药一般不能直接施用,要根据原药的理化性质和使用技术的要求将原药加工成制剂才能施用。原药和制剂的质量对施药的效果有密切的关系。 一、原药的质量标准 1.纯度 纯度即原药中有效成份的含量,以百分率表示。纯度是原药质量的主要指标,有效成分含量百分率越高质量越好。联合国粮农组织(FAO)和世界卫生组织(WHO)公布的农药原药质量标准,纯度应在90%以上。在我国的农药质量标准中,原药的纯度一般也能达到90%以上。纯度低的农药原药中杂质的含量就高,原药中杂质过多有以下害处: (1)可能会对作物产生药害。2000年在吉林省梅河口市稻田使用苄嘧磺隆出现药害,造成稻苗死亡。苄嘧磺隆对稻苗的安全性较好,一般不会产生药害。据初步研究表明:产生药害的原因是苄嘧磺隆中的杂质JP-003和JP-004含量超标。 (2)杂质较多会增高原药对人的毒性。例如甲胺磷的纯品对大鼠的LD50为30mg/kg体重,而国内有的厂家生产的50%甲胺磷乳油对大鼠的LD50为13.6mg/kg,说明毒性增高,其原因为甲胺磷原油中有5种杂质的含量较高,而且这5种杂质的毒性也较甲胺磷纯品的毒性为高。 (3)原药中杂质都对以有效成分分子中含有某元素或某原子团的量计算有效成分含量的化学分析法失去原有的准确度。由于杂质中同样含有与有效成分相同的元素或原子团,使测定的结果产生偏差,不能反映原药及其制剂中有效成分的真实含量。 (4)原药中的杂质还给加工粉剂带来困难,因为杂质的存在使原药的凝固点下降,不易粉碎。(5)原药的杂质能降低有效成分的稳定性,而且随着农药的使用,杂质进入环境之中,造成污染。所以要尽可能提高原药的纯度,减少杂质的含量。 2.酸碱度 酸碱度既是原药的质量指标也是制剂的质量指标。酸碱度是指农药原药及其制剂中含游离酸或游离碱的数量,或其氢离子浓度。限制酸碱度的目的主要是降低贮存过程中农药原药和制剂中有效成分的分解作用,防止制剂物理性能改变及其使用时产生药害。此外还可以用作评估农药对包装材料腐蚀性的参考。FAO对原药及制剂及制剂酸碱度的质量标准均以酸度(H2SO4的含量百分数)或碱度(NaOH的含量百分数)表示,对原粉一般要求为0.1%~0.2%,原粉及制剂的酸碱度有时以PH值表示。我国对农药原药规定以酸度或碱度表示,对制剂大多规定以PH值表示。 3.水分含量 水分含量既是原药又是制剂的质量指标。限制农药原粉中水份含量的目的是降低有效成分的分解作用,保持化学稳定性。对粉剂、可湿性粉剂来讲限制水分含量可使制剂保持良好的分散状态,喷洒时能很好的分散到叶面上。FAO在1971年后颁布的农药质量标准中,对农药原药及乳油、部分可溶性粉剂等剂型均有水分含量指标,而对粉剂、可湿性粉剂即无水分含量指标。我国对粉剂的水分含量要求不大于1.5%。但是因加工粉剂所用填料种类不同,其吸水性能有差异,有的填料吸水性强,即使水分含量高些,也不影响粉剂的分散性能;有的填料吸水性能弱,即使水分含量不太高,也会影响粉剂的分散性,因此用控制水分含量以保证粉剂的分散性的办法是不可靠的,用粉剂的流动性指标控制粉剂的分散性比用水分含量控制的办法更有效。我国在粉剂类农药制剂的质量标准中没有流动性指标,而用限制水分含量控制其分散性。 二、制剂的质量标准 1.有效成分含量 有效成分含量是农药制剂中最重要的指标,以质量百分数克/千克或克/升表示。有效成分是指农药产品中具有生物活性的特定化学结构成分。生物活性系指对昆虫、螨、病菌、鼠、杂草等有害生物的行为、生长、发育和生理生化机制的干扰、破坏、杀伤作用,还包括对动、植物生长发育的调节作用,FAO对农药制剂的有效成分含量允许在标明含量上下一定范围内变化,例如50g/kg(±10%)。我国的标准要求为应不低于标明含量,近年也有允许在标明含量上下一定范围内变化的趋势。 2.粉粒细度 粉剂类农药制剂(粉剂、可湿性粉剂、悬浮剂、干悬浮剂、粒剂)质量指标之一。以能通过一定筛目的百分率表示。如日本、美国规定粉剂的细度为98%通过45微米筛(325目筛)。我国目前对大多数粉剂只要求95%通过75微米筛(200目筛)。粉剂的药效和细度有密切的关系。在一定范围内,药效与粒径成反比,触杀性杀虫剂的粉粒愈小,则每单位重量的药剂与虫体接触面愈大,触杀效果也就越好。在胃毒性农药中,药粒愈小,愈易为害虫吞食,食后亦较易被肠道吸收而发挥毒效。但药粒过细,有效成分挥发加快,药效期缩短,喷药时飘移严重,反而会降低药效,并对环境不利。因此,在确定粉剂的细度时,应根据原药特性、加工设备条件和施药机械水平,确定合适的粒径。 3.容重 容重是粉剂的质量指标之一。容重即每单位容积内粉体的质量(克/毫升),又称表现比重。按填充紧密程度的不同,容重又分为疏松容重和紧密容重两种。前者是粉体自然装满容器时的容重。后者是粉体装入容器后,经规定的机械震动,使粉体装填比较紧密时的容重。同一种粉体的容重小,表示粉粒较细,粉体含水量低。在测定方法一致的条件下,粉剂和可湿性粉剂的容重与所用填料的容重、助剂的种类、有效成分的种类和浓度以及粉粒的细度有关,填料的容重影响最大。选择填料的容重要考虑两个因素:(1)固体原药和填料的疏松容重相近,以避免在施药过程中原药和填料的分离,造成单位面积上药剂不均匀;(2)从施用的药械和风速考虑填料的容重。当风速小于2.5米/秒时,要求粉粒的容重在0.46~0.60克/毫升范围之内,飞机喷粉则要求在0.66~0.80克/毫升之间。容重可用于监测粉剂的粉碎程度及含水情况,也可根据粉剂的容重来计算包装袋的大小以及粉剂加工厂的仓容。
在建立一个中药质量标准时,一般需要多少批才算能定下,定含量限度又需要多少批,指纹图谱呢,我看有的课题结题材料中有的是3批,有的是10批,具体这个确却的数据是多少呢?还有课题结题和一个中药新药在建立质量标准时是不是所用批数不一样?还有药材、中成药所用的批数是不是也不一样等等,那中药和西药建立质量标准时所用样品批数又有哪些不一样的地方呢?请各位同仁指点,多谢!
农药行业质量标准交流
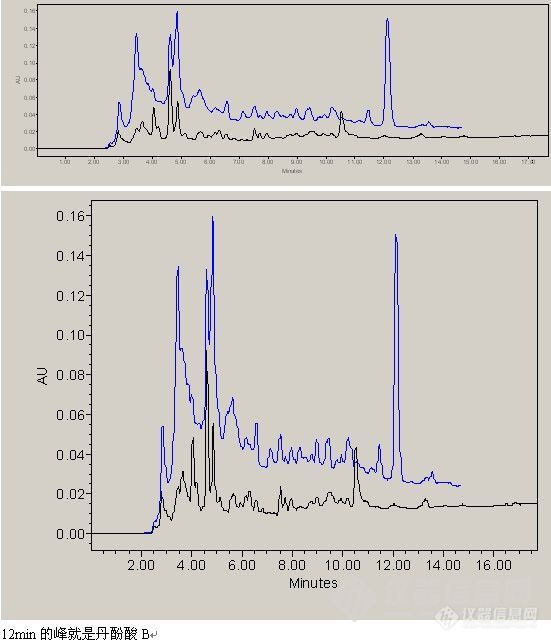
中药新药的质量标准,读研将近一年了,老板叫做中药新药的质量标准,怎么说呢,一开始就糊里糊涂的做,老板说行就行,自己心里一点底都没有,不知道这样做符合标准么,符合新药的要求么。也不知道该看些什么参考资料。觉得迷茫的很。现在又开始第二个新药了,还是一无所知。我想做的明明白白,药典上的东西都是做出来的,看的是结果,我想知道做的过程中该怎么样去做,怎么样符合标准、还有听说做新药至少走三十分钟,是么?下面是我做的阴性对照,有点干扰,光谱图不一样,说明不是同一个物质。大家觉得影响么?该怎么调整?[img]http://ng1.17img.cn/bbsfiles/images/2010/04/201004211104_213672_1638724_3.jpg[/img]
急求药用黄氧化铁质量标准!我们用的是上海一品颜料公司生产的药用黄氧化铁,如果有他们的质量标准就更好了。谢谢!
欧洲药典质量标准的起草技术指南2023,详细介绍了质量标准的起草过程,值得一看。

[size=3][font=Times New Roman]1[/font][font=宋体]、质量标准中浸膏相对密度存在的问题[/font][font=Times New Roman] [/font][font=宋体]个别品种提取药液浓缩时的相对密度与温度的描述实际操作时有困难,有以下几种情况:[/font][/size][size=3][font=Times New Roman]1.1[/font][font=宋体]浸膏测量相对密度的温度要求过高[/font][font=Times New Roman] [/font][font=宋体]如“十全大补颗粒制法规定浓缩至相对密度为[/font][font=Times New Roman]1.30~1.32(90~95[/font][font=宋体]度[/font][font=Times New Roman])[/font][font=宋体]的清膏”等,如药液浓缩设备多为真空浓缩,浓缩过程中浸膏温度基本在[/font][font=Times New Roman]80[/font][font=宋体]度左右。使浸膏达到[/font][font=Times New Roman]90~95[/font][font=宋体]度就需要降低设备真空度,这样既浪费能源又降低效率。另处在[/font][font=Times New Roman]90~95[/font][font=宋体]度相对密度为[/font][font=Times New Roman]1.30~1.32[/font][font=宋体]的浸膏在室温进基本状态为半固体,制剂生产时浸膏不易混合均匀。[/font][/size][size=3][font=Times New Roman]1.2[/font][font=宋体]没有规定测量温度,操作无法可依[/font][font=Times New Roman] [/font][font=宋体]如“参苓健脾胃颗粒制法规定滤液浓缩至相对密度为[/font][font=Times New Roman]1.30~1.34[/font][font=宋体]的稠膏”。[/font][/size][size=3][font=Times New Roman]1.3[/font][font=宋体]浸膏要求相对密度为一定固定值[/font][font=Times New Roman] [/font][font=宋体]如“益肾灵颗粒”制法规定滤液浓缩至相对密度为[/font][font=Times New Roman]1.35[/font][font=宋体]的清膏”。该类品种很多、在实际操作中控制困难。[/font][/size][size=3][font=Times New Roman]1.4[/font][font=宋体]醇沉前规定清膏相对密度过大[/font][font=Times New Roman] [/font][font=宋体]如“感冒舒颗粒制法规定滤液浓缩至相对密度为[/font][font=Times New Roman]1.20~1.25(90[/font][font=宋体]度[/font][font=Times New Roman])[/font][font=宋体],加乙醇使含醇量达到[/font][font=Times New Roman]60%[/font][font=宋体]等”,在[/font][font=Times New Roman]90[/font][font=宋体]度时相对密度[/font][font=Times New Roman]1.20~1.25[/font][font=宋体]的浸膏是很稠的,醇沉时会对有效万分产生包裹,影响产品质量。[/font][/size][size=3][font=宋体]本人建议在质量标准中浓缩操作改为“浓缩至适量或浓缩至[/font][font=Times New Roman]***[/font][font=宋体](热测)”,([/font][font=Times New Roman]***[/font][font=宋体]应为一个范围值)各企业根据自己的设备、工艺规程中明确规定相对密度及检测温度。[/font][/size]
提高中药质量标准的8个问题建国以来,国家科技部先后将中药质量标准列入国家“七五”、“八五”、“九五”、“十五”攻关项目、当前国际上认可的“中药指纹图谱检测标准研究”等都被列入了国家“创新药物与中药现代化”项目中…我国自实施中药现代化工程以来,掀起了中药质量标准研究的热潮。然而,虽然我国中药质量标准研究水平有了明显的提高,有效地促进了中药质量控制水平的提升和质量控制体系的完善。但是从总体上来看,我国中药的质量标准体系还不够完善,质量检测方法及控制技术比较落后。要尽快提高我国中药的质量标准,必须优先处理好8个方面的问题。问题1:中药有效成分不明确中药质量的有效控制应是对其有效成分的控制。尽管中药的化学成分研究已开展了近一个世纪,但由于长期以来化学成分与生物活性研究的脱节,至今大部分中药的有效成分仍未得以阐明。就《中国药典》2005年版一部收载的572种中药材(包括部分饮片和提取物)而言,只有60%有过化学成分研究报道,约20%进行过较系统的化学成分研究,至今已阐明其有效成分的品种不到5%。目前建立的鉴别或含量测定方法大部分只是针对其指标性成分进行控制,即使达到要求,也不能说明其质量稳定、一致。问题2:专属性鉴别方法缺乏目前,大部分常用中药材已建立鉴别方法,但由于缺少特征成分或对照药材的对照,很多鉴别方法缺少专属性,难以有效地鉴别中药材。如2005年版《中国药典》尽管已将金银花与山银花分别单列,但鉴别方法都是以绿原酸作对照。对于同属多来源品种,鉴别更加困难,如柴胡,全国各地所产品种多达20多种,但按照目前的鉴别方法却很难鉴别出来。对于中成药,鉴别的问题则更加严重,因为目前大部分复方中成药建立鉴别的药味仅占总药味数的1/3以下,还有2/3未建立鉴别方法。这些未建立鉴别方法的药味,即使未投料,按照国家标准检验,仍是合格的产品。对于已建立鉴别方法的药味,同样存在着与中药材一样的专属性问题,如中成药中很多药味的鉴别以芦丁作对照,芦丁原料的价格很低,有些不法企业就以芦丁代替药材,降低生产成本。问题3:有害物质检测待加强中药的毒副作用主要来源于两个方面,其一是外来的污染物,如重金属、农药残留等。随着国际上对我国中药出口检验越来越严格,业内对重金属、农残检测的重要性基本上已达成共识,只是目前在国内销售的产品中仍极少检测。当务之急应将重金属和农残检测列入中药特别是中成药的质量标准中。其二是中药本身含有的化学成分。这类成分又分为两类,一为既是有效成分,又是毒性成分,如乌头、附子中的乌头碱、马钱子中的士的宁等。对于这类物质,目前我国对卫生部规定的28种有毒中药已大部分实行限量检查或规定其含量范围,但对其它有毒中药的毒性和机理的研究仍很缺乏,如半夏、天南星的毒性成分至今未能阐明。二为纯粹有毒成分,如关木通中的马兜铃酸、马兜铃内酰胺类成分,千里光中的吡咯里西定类生物碱等。对于这些毒性成分,特别是慢性毒性成分,我国的研究基本上属于空白,目前认识的这些毒性成分也基本上都是国外发现的。问题4:多指标含量测定亟须建立中药成分复杂,作用广泛,每一适应症都有相对应的有效成分,所以单一指标成分的含量测定不能有效地控制中药的质量。如肉苁蓉补肾阳作用的有效成分为苯乙醇苷类成分,润肠通便的成分为多元醇类成分,而法定标准仅测定其毛蕊花糖苷(苯乙醇苷类成分之一)含量,未对多元醇类成分进行控制。对于中成药,该问题更加严重。因为目前大部分中成药仅建立一种成分的含量测定,其它未建立含量测定的药味,投料量根本无法控制。因此,建立多指标的有效成分含量测定,特别是建立复方中成药中每味药的含量测定,是确保中药临床疗效和开拓国际市场的有效途径。问题5:正确看待指纹图谱中药指纹图谱检测技术在确保中药质量的一致性方面有着独特的作用,目前已普遍被欧美日等发达地区采用,我国多年的指纹图谱研究实践也充分说明了这一点。但目前对指纹图谱的认识仍存在着很大的问题,部分人带着有色眼镜看待指纹图谱,全盘否定指纹图谱,而另一些人又夸大指纹图谱的作用,把指纹图谱看成是万能的技术。这些观点都严重影响了指纹图谱的研究与应用。因此,当务之急,我们必须正确认识和评价指纹图谱检测技术,在不断进行指纹图谱研究的同时,使之作为中药质量标准的组成部分,早日发挥其在中药质量控制中的作用。问题6:缺少化学对照品中药化学成分对照品的严重缺乏,已成为制约中药质量标准建立和提高的瓶颈。要解决化学对照品问题,一方面必须继续加强化学对照品的研究,但更重要的是要放开对照品的生产和销售,引入市场机制,建立化学对照品的专业生产、经营企业,这样才能有效解决该问题。问题7:应提倡中药提取物投料中成药的质量是生产出来的,而不是检验出来的。作为中成药原料的中药材大都来源于生物,不管是野生的,还是栽培的,甚至是GAP基地生产的,其质量不可能稳定、一致。但作为药品,又必须要求其质量稳定、一致。因此,我们应该改变传统观念,逐步推广中药提取物投料,使中药早日实现标准化。 问题8:中药材质量评价体系不完善目前,中药材的质量基本上处于有标准而无人执行的局面,只有中药厂进货时才对部分药材进行质量检验。要确保中药材的质量,必须控制好中药材生产、流通的每一个环节。中药材生产企业在采收、加工时把好中药材质量的第一关;中药材销售公司在市场流通时把好中药材质量的第二关;饮片、提取物、中成药生产企业在进货时把好第三关。药品检验机构应对中药材生产、流通的全过程进行抽样、监督,从而建立较完善的中药材质量评价体系。
硅酸锆Zirconium silicateCas 号: 【10101-52-7】 M D L: --MFCD00085353分子式: ZrSiO4 分子量: 183.31别 名: 锆英石,锆石,风信子石,红锆石 Zirconium(IV) silicon oxide 分子结构式: 78x25性 状: 无色四方双椎体结晶。为天然锆石的主要成分。硬似石英。化学性稳定。1540℃以上开始分解为二氧化锆和二氧化硅。不溶于水、酸、王水和碱。相对密度4.7(α型)、3.9-4.0(β型)。密度:4.6-4.7熔点:2550℃ 质量标准: 外观Appearance 类白色至浅灰色粉末纯度Purity ≥99.0%平均粒度: 1um-1.2um贮 存: 密封保存。用途 制造烷烃和链烯烃用催化剂。硅橡胶稳定剂。制造金属锆和氧化锆。工业上应用:锆原料,宝石、催化剂、胶结剂、玻璃抛光剂、电阻及电器绝缘器、耐火材料、釉药、在陶瓷釉料中起增白作用,能取代价贵的二氧化锡、二氧化锆、使釉料上能大幅度降低成本,平均粒度1um-1.2um。
前段时间对HPLC中方法学研究加样回收率的数据要求有疑问(RSD值的范围在多少以内),后面从中国药典委员会网站找了几篇资料,有些版友肯能已经有了,没有的看看吧。《中国药典》中药质量标准起草说明编写细则 http://www.chp.org.cn/cms/business/cm/000033.html《中国药典》中药质量标准起草与复核工作规范 http://www.chp.org.cn/cms/business/cm/000035.html《中国药典》中药质量标准研究制定技术要求 http://www.chp.org.cn/cms/business/cm/000036.html今日发现原链接已经用不了,现已更新。同时将三个附件上传。欢迎下载。
对《土壤质量标准》(征求意见稿)的几点建议 制定土壤环境质量标准是为了保障土壤环境、地下水安全、生态风险(含作物、微生物体系)、人体健康。严肃、科学的制定《土壤环境质量标准》,它是贯彻实施的需要,是环境管理的要求,是判断土壤是否要修复的基础,更是保障全国人民“菜篮子”、“水缸子”基石。对土壤环境质量标准提几点看法:1.关于《编制说明》 (1)没有参考文献。(2)每个项目及其限制由来不清楚—项目限值是如何采用“地球化学方法还是生态因子方法”获得的呢?(3)“一级标准删除而期望建立地方标准”不合适—对“七五”土壤调查数据,按照土壤类别设置背景值。2.关于《农用地土壤环境质量标准》2.1项目数量 项目选择是否应该遵循以下原则呢?(1)项目是否应该与相关标准如《食品安全国家标准 食品中污染物限量》(GB 2762-2012)中的项目相衔接呢?(2)项目是否应该主要体现有毒有害的元素及有机物呢?(3)项目是否应该既与国际接轨,也体现国内污染状况呢?金属是否应该包括有效态和形态呢?土壤金属项目总量超标(其主要来源于成土母质)而农产品、地下水未超标的现象是普遍存在的。(4)是否应该包含必要的理化性质指标呢? 建议:(1)删除项目。铜、锌、锰、硒等项目是否必要呢?若这些项目是为考虑该采矿、冶炼行业附近的土壤污染,是否也应该把钛、钼、稀土等列入呢?(2)增加项目。有效态:所有金属和类金属项目;②形态:铬、砷、汞;③非金属项目:硼、硫化物、氰化物;④金属项目:铍等;⑤有机物:半挥发性有机物、有机氯(多氯联苯等)和有机磷农药及除草剂(马拉硫磷等);⑥土壤理化指标:氧化还原电位、阳离子交换容量等。2.2项目限值 土壤标准项目限值过宽、过窄都不利于保护土壤,以下以镉为例说明。以下两个表格分别列出了一些国家和地区镉和其它金属的限值。据表知,对于农用地土壤,我国土壤镉的限值分别是英国、加拿大、德国及我国台湾的地区6-12倍、2-5倍、5-10倍、4-8倍。file:///C:\DOCUME~1\ADMINI~1\LOCALS~1\Temp\ksohtml\wpsCA.tmp.jpg 备注:来源文献。file:///C:\DOCUME~1\ADMINI~1\LOCALS~1\Temp\ksohtml\wpsCB.tmp.jpg 备注:来源文献。 若以镉的标准限值来评价我国“七五”时期各省份的镉的背景值(见下表),显然广西、贵州等省份存在超标现象比较严重,这些地方土壤中的其它元素如钒也明显偏离全国的平均值。因此,土壤标准中金属的限量值要结合土壤类型、理化性质等设置。file:///C:\DOCUME~1\ADMINI~1\LOCALS~1\Temp\ksohtml\wpsCC.tmp.jpg 备注:来源文献。 当前,我国严重缺乏生态毒理学、环境卫生学方面的相关资料,在制定农用地土壤质量标准时宜纳国内外经验,特别是英国、加拿大、德国以及台湾地区的经验;同时应该充分吸收我国“六五”、“七五”科技公关研究成果,该成果已经制定了黄棕壤、褐土、黑土等十几类土壤的环境临界含量。2.3其它 (1)土壤污染术语:标准及编制说明中均未提及,建议采用综合性定义,考虑含量增加和其对生态系统造成危害。 (2)制定标准的目的:旧标准(除不涉及地下水保护外)表述的全面。 土壤是一个复杂的体系,限于知识不足,阅历尚浅,能力有限,如有不合适敬请谅解。参考文献 蔡彦明,刘凤枝,王跃华,等.我国土壤环境质量标准之探讨.农业环境科学学报,2006,25(S1):403-406. 章海波,骆永明,李 远,等.中国土壤环境质量标准中重金属指标的筛选研究.土壤学报,2014,51(3):429-438. 袁建新,王 云.我国《土壤环境质量标准》现存问题与建议.中国环境监测,2004,20(3):41-43. 陈 平,陈 研,白 璐.日本土壤环境质量标准与污染现状.中国环境监测,2004,20(3):63-66,62. 孟凡乔,史雅娟,吴文良.我国无污染农产品重(类)金属元素土壤环境质量标准的制定与研究进展.农业环境保护,2000,19(6):356-359. 赵晓军,陆泗进,许人骥,等.土壤重金属镉标准值差异比较研究与建议.环境科学,2014,35(4):1491-1497. 王国庆,林玉锁.土壤环境标准值及制订研究:服务于管理需求的土壤环境标准值框架体系.生态与农村环境学报,2014,30(5):552-562. 周东美,王玉军,陈怀满.论土壤环境质量重金属标准的独立性与依存性.农业环境科学学报,2014,33(2):205-216. 周启星,滕 涌,展思辉,等.土壤环境基准/标准研究需要解决的基础性问题.农业环境科学学报,2014,33(1):1-14. 夏家淇,骆永明.我国土壤环境质量研究几个值得探讨的问题.生态与农村环境学报,2007,23(1):1-6.

[url=http://www.instrument.com.cn/download/shtml/045401.shtml]中药质量标准与05版药典.rar [/url]
中药材质量标准薄层定性中,如果标准品是2种,现在两种原药材样品处理方法得到的薄层结果一种是2个点(同标准品),一种是6个点(含标准品),报新药用哪种处理方法比较好?谢谢
关于中药注射剂质量标准草案的公示 按照国家食品药品监督管理局组织的中药注射剂质量标准提高以及中药注射剂安全再评价工作的要求,我委逐步将有关品种标准草案上网公示。标准公示日期一周,其增修订内容详见附件。请相关单位认真研核,若有异议,请附相关说明及实验数据,及时来文来函。公示期满未有意见者视为同意。 电子邮箱:zy@chp.org.cn 通讯地址:北京市崇文区法华南里11号楼 国家药典委员会 中药标准处 邮 编:100061 附件:中药注射剂质量标准草案公示名单
请问各位谁有原料药质量标准汇编,分享一下好吗?十分感谢!
各位大侠,谁有FAO农药规格质量标准汇编电子版的?能否与我共享一下。看到有人上传过,但是我打不开。谢谢了!
《兽药质量标准》(2017年版)已经发布并实施,化药卷电子版资料685M,中药卷电子版资料373M,内容相当丰富,值得拥有
中药饮片炮制工艺与质量标准及GMP实施手册包含4个压缩包,请下载后一齐解压1\中药饮片炮制工艺与质量标准及GMP实施手册.part1.rar 2\中药饮片炮制工艺与质量标准及GMP实施手册.part2.rar3\中药饮片炮制工艺与质量标准及GMP实施手册.part3.rar4\中药饮片炮制工艺与质量标准及GMP实施手册.part4.rar图书价格:¥499.00,共1756页第一篇:中药饮片炮制片炮制方法与临床组方第二篇:解表药炮制工艺与质量第三篇:清热药炮制工艺与质量标准第四篇:泻下药炮制工艺与质量标准第五篇:祛风湿药炮制工艺与质量标准第六篇:芳香化湿药炮制工艺与质量标准第七篇:利水渗湿炮制工艺与质量标准第八篇:温里药炮制工艺与质量标准第九篇:理气药炮制工艺与质量标准第十篇:消食药炮制工艺与质量标准第十一篇:驱虫药炮制工艺与质量标准第十二篇:止血药炮制工艺与质量标准第十三篇:活血化瘀止咳药炮制工艺与质量标准第十四篇:化瘀止咳喘药炮制工艺与质量标准第十五篇:安神药炮制工艺与质量标准第十六篇:平肝息风药炮制工艺与质量标准第十七篇:开窍药炮制工艺与质量标准第十八篇:补虚药炮制工艺与质量蒜准第十九篇:收涩药炮制工艺与质量标准第二十篇:涌吐药炮制工艺与质量标准第二十一篇:外用药炮制工艺与质量标准第二十二篇:中药饮片GMP实施第二十三篇:中药饮片管理相关法规文件
2010版三部药典除了之前发的三个贴外,另外的资料《生物制品质量标准》就整理了一些,大家可以下载,欢迎大家讨论:该资料包括狂犬疫苗、生物制品工艺验证、血液制品质量和安全性探讨、诊断试剂…………生物制品质量标准.part1.rarhttp://www.instrument.com.cn/download/download.asp?id=128616[color=#f10b00][size=5]所有附件都放在8楼了,还有一个部分过大没有办法传上来,想要的给我留言。[/size][/color]
请问一下在准备原料药申报资料的过程中,其中的11号资料,关于药品质量标准的建立,必须完全参照现行药典吗,如果参照欧洲药典时作细微的改动,例如:将EP中加入盐酸的量由30ml改为10ml,其他均不改变,这样允许吗,要怎样说明?必须做方法学验证吗?
各位大侠 请教一个问题 在药品质量标准分析方法验证指导原则中准确度项下有这么一句话:“如该分析方法已经测试并求出了精密度、线性和专属性,在准确度也可推算出来的情况下,这一项可不必再做”请问这句话该怎么理解 具体该怎么操作~多谢~
那个有半夏曲的质量标准!急要!
当建立原料药的质量标准时,一般都是参照法定标准来建立。而客户往往会有自己的要求,而且不同的客户会有不同的要求,不同的时间可能会有不同的要求。这种情况下应该怎么办?不断的修订企业内控的质量标准吗?我们现在就有这样的情况,不断的根据客户的要求来修订企业内控标准,不断的来换质量指标的版本。个人感觉这样不是很好。各位大虾有什么好的建议?请支招。不胜感激
中成药质量标准,方法学中的检测限和定量限,要做吗?好像看很多的分析文章,都没有做的。药典规定如何?