[font=宋体][size=10.5000pt][font=宋体]请问单分子成像稀疏激活然后算[/font]SPF[font=宋体]中心,怎么保证激活的就是单个荧光分子呢?[/font][/size][/font]
显微镜(microscope)简称光镜,是一种将肉眼无法看清楚的微生物体进行光学放大成像的常用仪器。在生命科学、材料科学、基础科学及众多的微观领域中都离不开显微镜。1590年.荷兰的Han,父子始创放大10倍显微镜。175.8年,Dollond制成消色差透镜,提高了显微镜放大倍数。1873年,德国科学家Abbe设计成近代显微镜。1953年.上海江南光学仪器厂国产显微镜诞生,并陆续生产了荧光、相衬、偏光等专用显微镜。生物及医用显微镜可分为光学放大及电子放大两大类。前者按用途可分为普通型、特种型、高级型显微镜和手术显微镜。普通型生物显微镜仅供一般用途使用,通常的农用与医用显微镜、倒税显微镜均属这一类。特种型生物显微镜可作某些专用的观察和研究。暗场生物显微镜、荧光显微镜、偏光显微镜、相衬和干涉相衬显微镜等均属于这一类。高级型生物显微镜系指大型多用途的生物显微镜.研究用生物显微镜和万能研究用生物显微镜等属于这一类。一、显微镜放大成像系统显微镜光学系统由物镜和目镜两部分组成。因为被观测的物体本身不发光,而要借助于外界照明,故显微镜需要有一个照明系统,这些部分都是由较复杂的透镜组成,尤其物镜更为复杂。下图是显微镜成像的光路原理图,图中的物镜和目镜均用薄透镜表示。http://www.yi7.com/file/upload/201201/07/14-00-33-93-1.jpg显微镜成像原理显微镜的物体AB处于物镜的2倍焦距之内一倍焦距之外,它首先通过物镜成一放大的倒立实像A'B',且使之位于目镜的物方焦平面上或焦平面以内很靠近的地方,然后目镜将这一实像再次成一个正立虚像A"B"于无限远或人眼明视距离之外,以供眼睛观察。显微镜对物体进行2次放大,因此与放大镜相比,具有更高的放大倍率,能观察到肉眼所不能直接观察的微小物体,分辨更细小的细节。在这里目镜相当于放大镜,只不过这时放大镜的物是物镜所成的像而已。由于物镜所成的像是实像.因而可在实像处(即目镜的物方焦平面处)安放各种用途分划板.供对准或测量用。二、显徽镜的放大率与分辨本领1.显微镜的分辨本领 分辨本领主要指接物镜分辨被检查物体细微结构的能力,也就是说在显微镜下判别的最小微粒的大小或两点之间最短距离及某物点最小直径的限度,便叫做显微镜的分辨本领.或称为鉴别率。通常用d表示:http://www.yi7.com/file/upload/201201/07/14-00-33-14-1.jpg式中.A表示波长;n sins (NA)表示数值孔径。 从式中可知,显微镜的分辨率主要取决于光的波长和数值孔径这两个因素。d值越小,分辨本领也就越强,越能看清物体的细微结构。鉴别率计算单位是Um. 显微镜的鉴别率的提高只有两个办法: (1)增大物镜的数值孔径(镜口率)。从图可以看出,影响数值孔径(n sina)的因素有两个:其一为物体上某点射人物镜光锥角(镜口角)的一半(sina);其二为检品与物镜间媒质的折射率n。即数值孔径为NA = n sine镜口角半数最大能到900,故si na的最大值为1.00,这时物镜的焦距最短而曲度也很大,制造上是极为困难的。即使能办到,在干燥系中的镜口率只有1 x sin90“(控气n二1)。若再增大镜口率便只有从媒质着手,所以便有水、甘油,石蜡油和香柏油等浸润均匀媒质的应用,确实改进了镜口率不少.它最高可到1.40。如果用澳萘液可达1.67左右,更接近盖片和透镜的折射率。http://www.yi7.com/file/upload/201201/07/14-00-33-51-1.jpghttp://www.yi7.com/file/upload/201201/07/14-00-33-44-1.jpg (2)缩短光源的波长:采用紫外线作光源,波长可到0.1Um,这样放大倍数比自然光放大的倍数大3-4倍,普通紫外线光波在0.2 Um左右,即使能产生出0.1 Um波长的紫外线.一般透镜也将把它吸收干净.无法利用。显微镜的最大数位孔径可达1.5 Um左右,在这种情形下: http://www.yi7.com/file/upload/201201/07/14-00-33-33-1.jpg即在这种显微镜里,仍可分辨的两点间最短距离差不多等于所用光波波长的1/30假定绿光的光波的波长http://www.yi7.com/file/upload/201201/07/14-00-33-23-1.jpg那么显微镜能分辨的最短距离为:http://www.yi7.com/file/upload/201201/07/14-00-33-89-1.jpg 则这台显微镜的最高分辨距离也超不过。.182 Um。肉眼在明视距离(250 mm)能分辨的两点之间最短距离为0.1 mm,约为上述d值的560倍.因此I台光学显徽镜的放大率有100()倍也就足够了。这是因为光的本性及光的绕射现象就限制了显徽镜的放大极限。凡是光波超过微粒直径的2倍时,光线就很方便地绕过微粒而继续前进,所以普通干燥系显微镜的最大鉴别率只能达到光源波长的1/2,直径小到0.2 5m的微粒就无法被光学显微镜发觉。虽然后来应用浸润系方法,如油镜,提高了折射率,其鉴别率也只不过能提高到光源波长的1/3而已。而且还要用最好的透镜才能达到。
由于客观条件,任何光学系统都不能生成理论上理想的像,各种相差的存在影响了成像质量。下面分别简要介绍各种相差。 1、色差 色差是透镜成像的一个严重缺陷,发生在多色光为光源的情况下,单色光不产生色差。白光由红 橙 黄 绿 青 蓝 紫 七种组成,各种光的波长不同 ,所以在通过透镜时的折射率也不同,这样物方一个点,在像方则可能形成一个色斑。 色差一般有位置色差,放大率色差。位置色差使像在任何位置观察,都带有色斑或晕环,使像模糊不清。而放大率色差使像带有彩色边缘。2、球差 球差是轴上点的单色相差,是由于透镜的球形表面造成的。球差造成的结果是,一个点成像后,不在是个亮点,而是一个中间亮、边缘逐渐模糊的亮斑。从而影响成像质量。 球差的矫正常利用透镜组合来消除,由于凸、凹透镜的球差是相反的,可选配不同材料的凸凹透镜胶合起来给予消除。旧型号显微镜,物镜的球差没有完全矫正,应与相应的补偿目镜配合,才能达到纠正效果。一般新型显微镜的球差完全由物镜消除。1、慧差慧差属轴外点的单色相差。轴外物点以大孔径光束成像时,发出的光束通过透镜后,不再相交一点,则一光点的像便会得到一逗点状,型如慧星,故称“慧差”。 2、像散像散也是影响清晰度的轴外点单色相差。当视场很大时,边缘上的物点离光轴远,光束倾斜大,经透镜后则引起像散。像散使原来的物点在成像后变成两个分离并且相互垂直的短线,在理想像平面上综合后,形成一个椭圆形的斑点。像散是通过复杂的透镜组合来消除。3、 场曲 场曲又称“像场弯曲”。当透镜存在场曲时,整个光束的交点不与理想像点重合,虽然在每个特定点都能得到清晰的像点,但整个像平面则是一个曲面。这样在镜检时不能同时看清整个相面,给观察和照相造成困难。因此研究用显微镜的物镜一般都是平场物镜,这种物镜已经矫正了场曲。 4、 畸变 前面所说各种相差除场曲外,都影响像的清晰度。畸变是另一种性质的相差,光束的同心性不受到破坏。因此,不影响像的清晰度,但使像与原物体比,在形状上造成失真。 (1) 当物体位于透镜物方二倍焦距以外时,则在像方二倍焦距以内、焦点以外形成缩小的倒立实像; (2) 当物体位于透镜物方二倍焦距上时,则在像方二倍焦距上形成同样大小的倒立实像; (3) 当物体位于透镜物方二倍焦距以内,焦点以外时,则在像方二倍焦距以外形成放大的倒立实像; (4) 当物体位于透镜物方焦点上时,则像方不能成像; (5) 当物体位于透镜物方焦点以内时,则像方也无像的形成,而在透镜物方的同侧比物体远的位置形成放大的直立虚像。 显微镜的成像原理就是利用上述(3)和(5)的规律把物体放大的。当物体处在物镜前F-2F(F为物方焦距)之间,则在物镜像方的二倍焦距以外形成放大的倒立实像。在显微镜的设计上,将此像落在目镜的一倍焦距F1之内,使物镜所放大的第一次像(中间像),又被目镜再一次放大,最终在目镜的物方(中间像的同侧)、人眼的明视距离(250mm)处形成放大的直立(相对中间像而言)虚像。因此,当我们在镜检时,通过目镜(不另加转换棱镜)看到的像与原物体的像,方向相反。 本文转自http://www.gzspecial.com/qyxw/19.html
金相显微镜是的成像原理则是根据电子光学原理,用电子束和电子透镜代替光束和光学透镜,利用凸透镜的成像原理进行成像,使用非常高的放大倍数对细微结构的物质进行成像。普通的金相显微镜是根据凸透镜的成像原理,要经过凸透镜的两次成像。这点不同于望远镜的成像,望远镜成缩小倒立的实像。而不管是普通的金相显微镜,还是电子显微镜,都有一个重要的物件—透镜。金相显微镜当中有几个英文名词,大家可以了解一下,f 表示透镜焦距u 表示物体与透镜之间距离(简称物距)引用:www.bsdgx.com
[b]巯基萘酚自组装单分子膜的二维同分异构现象研究取得进展[/b]国家纳米科学中心副研究员江鹏通过与丹尼斯菲周教授领导的法国原子能委员会、法国国家科研中心、巴黎第六大学联合研究小组合作,日前对巯基萘酚自组装单分子膜在Au(111)表面的自然组装行为进行了STM高分辨成像研究,首次揭示了巯基萘酚分子在表面存在旋转同分异构现象。由于这一现象所导致的两种共存的有序超晶格结构被清晰地观察到,这一研究发现对分子电子学的研究具有十分重要的意义。该项研究成果被发表在最新一期出版的《美国化学会志》上。《美国化学会志》的评委们对此研究给予了高度的评价。他们认为,这样一个研究解决了具有简单结构的巯基多芳环有机化合物在金表面的构像问题,为进一步的分子电学特性的研究铺平了道路。 分子电子学是当今纳米科技领域的研究热点之一。在通常情况下,具有共轭结构的巯基多芳环有机化合物是分子电子学研究的首选材料。通过强的Au-S相互作用,这些分子被发现能够在金表面上形成一层单层。但是,迄今为止,这些分子在表面的吸附构像问题仍然悬而未决,这也是分子电子学研究中必须首先加以解决的基本问题之一。 该项研究工作得到中国科学院—法国原子能委员会双边合作计划、国家纳米科学中心以及归国留学人员启动基金的支持。 【巯基萘酚自组装单分子膜的二维同分异构现象研究是下一代生物传感器以及生物芯片研究的潜在技术,请大家关注这方面的研究】[url=http://www.instrument.com.cn/download/search.asp?sel=admin_name&keywords=quanbaogang]欢迎到我的资料库下载[/url]
[url=http://www.f-lab.cn/microscopes-system/magnetic-tweezers.html][b]细胞单分子操纵磁镊系统[/b][/url],magnetic tweezers是继激光光镊技术仪器后又一种细胞操纵和细胞力学测量仪器.它采用倒置显微镜和电动平移旋转定位台和PicoTwist磁力细胞操纵捕获技术,组成强大的单分子操纵磁镊仪器。细胞单分子操纵磁镊系统是通过梯度分布的磁场对处于其中的可磁化微粒施力,通过显微镜观察并分析微粒运动过程,这套磁镊可同时对40个细胞分子视频采集和跟踪测量。[b]细胞单分子操纵磁镊系统特点[/b]操作稳定—图像漂移很低分辨率高,测力能力强—适合超薄样品可以同时对40个细胞单分子成像和跟踪测量磁铁来控制 DNA拉伸和超螺旋结构[b]细胞单分子操纵磁镊系统应用[/b]细胞单分子,生物单分子,细胞力学,生物力学等,在单分子水平上对生物分子行为(包括构象变化、相互作用、相互识别等)的实时﹑动态检测以及在此基础上的操纵﹑调控等;对单个生物大分子施以力或力矩,并测量它们的物理性质(如DNA弹性、蛋白质的力学变性等);对单个生物大分子施以力或力矩,测量它们的力学生化反应(如分子马达);研究机械力的作用如何影响细胞的生长、分裂、运动、粘附以及信号的传输,基因的表达;在生物大分子上施加力以使之发生构像上的变化,研究生物单分子形成新的结构,以及力学以及动力学之间的相互联系等。研究各种药物可能导致的DNA、蛋白质凝聚、变性过程;给出分子实时行为与性质的分布,有效避免对集群测量苛刻的同步(synchronization)要求,如DNA的解链(unzipping)、蛋白质的折叠(folding)等。[b][img=细胞单分子操纵磁镊系统]http://www.f-lab.cn/Upload/magnetic-tweezers.jpg[/img][/b]细胞单分子操纵磁镊系统:[url]http://www.f-lab.cn/microscopes-system/magnetic-tweezers.html[/url]
[align=center][b][size=14.0pt]如何用sCMOS相机优化显微成像[/size][/b][/align][align=center][size=11.0pt]会议时间:2020年3月20日10:00[/size][/align][b][size=12.0pt]内容介绍:[/size][/b]本次报告从灵敏度、成像视野、成像速度、成像特性等参数方面全面解读来自牛津仪器Andor的全新背照式、高分辨sCMOS相机。首先,介绍相机的成像结构和数据读出原理;第二,重点介绍Andor背照式SCMOS相机,分析相机参数对显微成像的影响;第三,以单分子成像为例,比较背照式sCMOS相机和EMCCD相机,给出各自成像优势;最后,展示sCMOS相机在具体科研上的应用。[b][size=12.0pt]讲师介绍:[/size][size=11.0pt]王坤:[/size][/b][size=11.0pt]2009[/size][size=11.0pt]年中科院国家纳米科学中心获得凝聚态物理博士,目前在牛津仪器Andor公司担任应用科学家,近十年来一直从事高端显微成像系统的相关科研及应用工作,参与过科技部重大仪器专项、中科院仪器专项、中科院仪器功能开发项目、上海市自然科学基金等科研项目,熟悉各类高端显微成像系统的原理,在各类生物样本成像上具有丰富的经验。[/size][font=等线][size=10.5pt]报名地址:[url]https://www.instrument.com.cn/webinar/meeting_12626.html[/url][/size][/font]

[align=center][font=楷体][size=14.0pt][url=http://instrumentmarketresearch.mikecrm.com/mMzWAQH][img=,600,219]https://ng1.17img.cn/bbsfiles/images/2020/06/202006241018499162_1869_3486149_3.jpg!w690x253.jpg[/img][/url][/size][/font][/align][align=center](点击图片参与答题)[/align][font=楷体][size=14.0pt]传统的质谱分析法是将生物体组织样品破碎、提取物质得到的混合液体,然后使用液相色谱仪等进行分离,测定目标分子。因此,无法得知某一分子在样品的什么部位高浓度存在或在样品中某个部位有什么样的分子高浓度存在。因此,研究人员渴望有一种分析装置可以对见到的物质、见到的部位中所含的分子直接实施质谱分析。[/size][/font][font=楷体][size=14.0pt]基于此,岛津推出了成像质谱显微镜(iMScope)系列产品,相较于传统的质谱成像产品,iMScope系列搭载了光学显微镜并可以在大气压下实施成像质谱分析,该装置采用了高聚焦激光光学系统与高精度样品移动系统,能够以5微米以下的领先水平的高分辨率下,取得生物体样品的质谱分析图像,观察分子的分布状态。[/size][/font][font=楷体][size=14.0pt]不仅如此,该系统实现了大气压下的质谱分析,使其能够分析更接近于活体状态的组织。此外,通过重合、解析从光学图像获得的形态信息与质谱分析图像获得的分子分布状态,可以在各个领域的尖端研究开发中发挥潜力,比如,特定癌干细胞中高浓度存在的分子,并将此分子作为标记物的癌早期诊断法的开发;阐明医药品代谢、聚集过程的药物动力学观察;解明食品中有助于增进健康的有效成分的分布;以增加有效成分量为目的的农作物品种改良;电路板、化成品材料的缺陷解析等领域。[/size][/font][font=楷体][size=14.0pt]iMScope[/size][/font][font=楷体][size=14.0pt]系列产品从2013年推出至今,几经迭代发展,目前该系列共有iMScope、iMScope[i]TRIO[/i]等产品,与此同时,岛津公司在2018年强势推出其首款四极杆飞行时间质谱联用仪,最大限度提高质量准确度和灵敏度的同时,确保质量准确度的长期稳定可靠,这也标志着岛津公司在高分辨质谱市场的成功探索。[/size][/font][font=楷体][size=14.0pt]2020[/size][/font][font=楷体][size=14.0pt]年,正值岛津公司质谱事业50周年之际,岛津公司特面向广大科研用户推出[color=red]新一代的iMScope成像质谱显微镜产品[/color],新技术将为用户带来什么样的惊喜呢?[/size][/font][font=楷体][size=14.0pt]2020[/size][/font][font=楷体][size=14.0pt]年7月9日,岛津公司“镜质合璧,还原真实”成像质谱显微镜新品发布会将在仪器信息网线上召开,为了使广大用户对即将发布的岛津iMScope系列成像质谱显微镜新产品有一个实际的感受,本次发布会前特别启动了[color=red]“质谱成像新品参数大竞猜”[/color]活动,期待各位用户的积极参与,精美奖品等您拿![/size][/font][font=楷体][size=14.0pt]本次活动时间自[color=red]2020[/color][color=red]年6月24日起,至2020年7月9日发布会开始前结束[/color],热忱欢迎各位用户参与本次有奖竞猜活动![/size][/font][font=楷体][size=14.0pt]您可以通过点击下方图片“岛津质谱新品参数大猜想”参与本次活动。[/size][/font][url=http://instrumentmarketresearch.mikecrm.com/mMzWAQH][font=楷体][size=14.0pt]http://instrumentmarketresearch.mikecrm.com/mMzWAQH[/size][/font][/url][font=楷体][size=14.0pt] [url=http://instrumentmarketresearch.mikecrm.com/mMzWAQH][img=竞猜活动,690,253]https://ng1.17img.cn/bbsfiles/images/2020/06/202006231629343263_4000_3486149_3.jpg!w690x253.jpg[/img][/url][/size][/font][font=楷体][size=14.0pt]您也可以扫码参与本次活动:[/size][/font][font=楷体][size=14.0pt][img=二维码,100,97]https://ng1.17img.cn/bbsfiles/images/2020/06/202006231630596534_2532_3486149_3.png!w307x298.jpg[/img][/size][/font][b][font=楷体][size=14.0pt]本次岛津新品发布会期间,除了内容竞猜的发布会之外,还准备了丰富的礼品回馈用户。只要您成功报名并出席本次岛津线上新品发布会,即可获得岛津精心准备的报名小礼品一份。在新品发布会期间,还将进行三次抽奖活动,幸运观众将获得岛津提供的精美礼品。[/size][/font][/b][align=center][b][font=楷体][size=14.0pt]礼品一览[/size][/font][/b][/align][align=center][img=礼品,600,379]https://ng1.17img.cn/bbsfiles/images/2020/06/202006231631322187_2703_3486149_3.png!w690x436.jpg[/img][/align]
显微镜成像系统,是能够连接显微镜和电脑,方便教学与及研究,不知道有多少人选择了便用显微镜成像系统
[em0703] 供应显微镜专业成像设备 产品介绍产品特点:显微镜专用数码相机,适用接口RCA(连接TV机)USB(连接PC机),支持单目、双目、三目成像系统,可实时数码观察目标,实时数码录象,单张拍照,主机具有记忆功能。可以适配金相、生物、体视等各种类型显微镜!操作安装步骤简单,功能齐全。与不同性能的显微镜配套适用于高等教育、医疗卫生、科学研究、农林环保等领域。其价格远远低于市场同类产品。我公司产品直接和目镜相连,所以可以实现一机多用,根据具体情况提供不同象素的机子,目前我公司产品已在福建省科研、工厂、学校等单位采用,而且新推出工厂质检系统,学校多媒体系统,大家选购!真金不怕火炼!欢迎到公司来洽谈业务!如果业务量合适我们可以派专人为您做演示指导工作,本公司现在全国招聘代理商,共创辉煌!效果图见慧聪企业博客http://blog.hc360.com/portal/personShowArticle.do?articleId=170399福州泉通电子有限公司福州市则徐大道368弄仓山工业区8号楼 (350007) 电话: 0591-83471089,传真: 86-591-83448434联系人: 梁建新所在区域: 福建.福州邮件地址: quantong@fjqt.com klop-116@163.com公司网站: http://www.fjqt.com
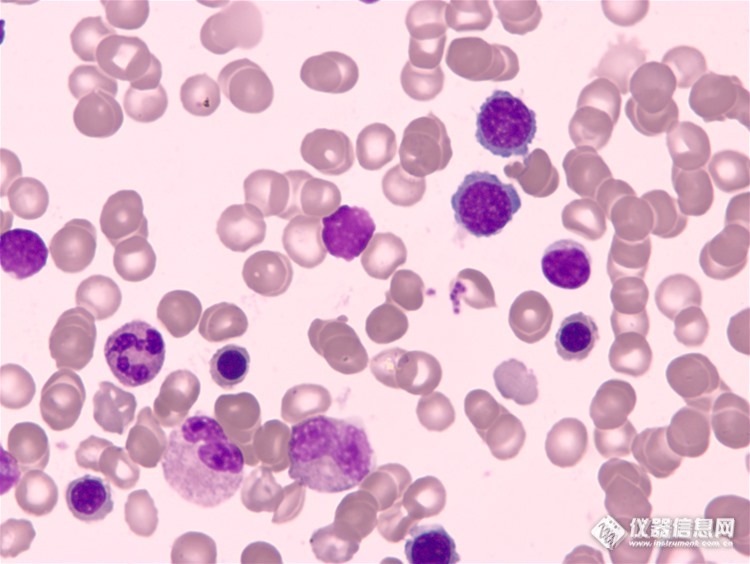
骨髓细胞是我们人体不可或缺的一部分,随着不同的生理条件,骨髓像的变化范围也很广,下面我们一起来看看在广州明美光电最新产品科研级摄像头MSX2下看到的骨髓细胞成像。MSX2是最新研发的科研级数字摄像头,采用大靶面高性能的成像芯片,设计USB3.0数据传输接口,具有高分辨率、颜色还原准确和高灵敏度的特点,其优秀的色彩表现,是液基细胞分析、免疫组化、骨髓细胞分析等对颜色要求高的病理诊断的理想工具。此外在明暗场、相衬、偏光、DIC、荧光成像等领域同样表现出色。科研级数字摄像头MSX2性能特点高分辨率、图像精细。 大靶面芯片、拍摄视野更接近目镜观察视野、图像更真实。 优化颜色算法,色彩还原准确,辨识度高。高灵敏度,适合弱光条件使用。高速USB3.0传输,高效数据处理,1200万全分辨下最高15fps。http://ng1.17img.cn/bbsfiles/images/2016/06/201606080956_596339_1783654_3.jpghttp://ng1.17img.cn/bbsfiles/images/2016/06/201606080956_596340_1783654_3.jpg以上图片是在显微镜摄像头下所观察到的现象。
(一)阿贝成像原理 为了理解相差尼康显微镜的原理,不得不回顾普通显微镜的成像原理。德国光学家阿贝(E. Abbe)从1874年以后创立了成像原理.在现代波动光学的发展基础上兴起的变换光学中的空间信息滤波和信息处理概念,就是奠基于阿贝成像原理。 据阿贝的看法,尼康显微镜的透镜或透镜组不只是反映物平面和像平面的共扼关系,而且也反映透镜前后的无数个对应平面的共扼关系。当然,显微镜的成像光路中最为重要的共扼面还是物平面和像平面(图10-18,0--0').显微镜成像光路中同样具有重要的共扼面是发光平面((KY1000显微镜)和光源的像平面(L')。 但是如果在显徽镜结构中在聚光镜的前焦面上放置孔径光栏时,那么光源和光源像两平面的共辘关系,代之以聚光镜前焦面的光栏平面和物镜后焦面的L"平面的共扼关系。 阿贝认为发光平面的共扼面即L’平面,是显微镜的初级成像平面,而物平面是次级成像平面。若通俗一点来讲,L‘烛光是L烛光的像,而O‘空间是L'烛光的像。 如果我们在尼康显微镜的初级成像光路上在聚光镜和物镜之间,擂入一张不同光密度的标本O(图10-20上是光栅)时,立即破坏了初级成像光路.这是因为标本细节的光密结构(栅)和光疏结构(间隙)的折射率不同,而产生光的衍射。其结果如图10-20所示,L烛光在它的像平面上出现了数支烛光。与此同时,在像平面上出现标本0的干涉像.这些干涉纹是由次波源。,一1,+1发射的衍射光的重叠所造的。这样由于标本的干涉次级成像过程,已由CM100的共扼面改变成CM300FL的共扼面。也就是说像平面上不是L,的像,而是标本0的像了。 总之,相干成像过程的第一步是形成衍射斑,而第二步是相干干涉.当然未染色生物标本细节的折射率有很小的差异,在像平面上的对比度非常小。为了提高物像的对比度(反差),荷兰物理学家(F. Zernike(1935)设计了相差显微镜的基本部件如环状光栏和位相板。 从阿贝成像原理已经知道尼康显微镜的聚光镜前焦面上放置孔径光栏时,这个平面就成为物镜后焦面的共扼面。F. Zernike在这个平面上放置了环状光栏,按空间滤波概念,称带通滤波器。 环状光栏给物镜后焦面提供的是照射在环形甲像平面上的相干光束。照射在环形像平面上的相图10-20显徽镜的成像光路干光束,不同于线形窄缝所提供的相干光束.前者不能造成带有方向性衍射斑.在共扼面上的光分布强度也不像窄缝衍射那种零级强度。它所造成的衍射光是均匀的无方向性的. F. Zernike在相差尼康显微镜的物镜后焦面上放置了位相板。恰巧位相板的吸收环变成环状光栏的成像平面。其结果就像F. Zernike指出的,如果人工地改变照射到不吸光物体而形成初级成像光束的光波,以此来改变衍射光和直射光的位相和振幅,使之近似乎吸光物体的初级成像光束时,那么其结果就造成完全像吸光物体的次级成像,也就是加强了物体细节的反衬度。巧妙地使用位相板,就能够使物像平面上的光强度分布与物体细节的位相信息成为线性关系.也就是人工地用物体细节的位相分布调整像平面的光强分布。甚至巧妙地选配不同类型的位相板,使之适合于物体细节的折射率时,可以强使物像平面上的反衬度出现逆转,即由明反差改变为暗反差,或者反之。
[b][url=http://www.f-lab.cn/vivo-imaging/micron-iv.html]小动物视网膜成像显微镜Micron IV[/url]特点: [/b]可用于明场、血管结构和荧光(GFP,YFP,mCherry,CFP标记)成像。定制的最先进低噪音三芯片CCD:高灵敏度捕捉微弱的荧光。 近红外成像(可达700-900nm,最高到900nm)视网膜成像精度:小鼠4 μm,大鼠8 μm位滤光片轮,双回补灯及滤光片配置,更加灵活,包含荧光及近红外滤光片,提供亮场和荧光成像模式 实验台:可三维翻转及旋转,便于调整大小鼠眼睛角度清晰成像。[img=小动物视网膜成像显微镜]http://www.f-lab.cn/Upload/Micron-retinal-imaging.jpg[/img]小动物视网膜成像显微镜Micron IV可提供分辨率达4 μm的高清晰视网膜影像,且与荧光显微镜类似,可观察明视野和荧光(Ex. CFP, GFP, mCh erry等) 影像。方便的软件设计可直接从明场成像转换至荧光成像。[url=http://www.f-lab.cn/Upload/retinal-imaging-micron.jpg][img=小动物视网膜成像显微镜]http://www.f-lab.cn/Upload/retinal-imaging-micron.jpg[/img][/url][b]小动物视网膜成像显微镜Micron IV应用范围:[/b]荧光血管造影糖尿病视网膜病变视网膜母细胞瘤视网膜黄斑衰退症早产儿视网膜病变脉络膜新生血管小动物视网膜成像显微镜:[url]http://www.f-lab.cn/vivo-imaging/micron-iv.html[/url]
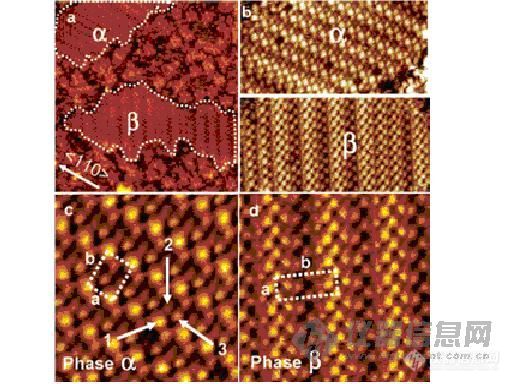
[img]http://ng1.17img.cn/bbsfiles/images/2006/09/200609240957_27637_1627011_3.jpg[/img] 分子电子学是当今纳米科技领域的研究热点之一。在通常情况下,具有共轭结构的巯基多芳环有机化合物是分子电子学研究的首选材料。通过强的Au-S相互作用,这些分子被发现能够在金表面上形成一层单层。但是,迄今为止,这些分子在表面的吸附构像问题仍然悬而未决。这也是分子电子学研究中必须首先加以解决的基本问题之一。国家纳米科学中心江鹏副研究员与Denis Fichou领导的法国原子能委员会(CEA)、法国国家科研中心、巴黎第六大学联合研究小组合作,对巯基萘酚自组装单分子膜在Au(111)表面的自然组装行为进行了STM高分辨成像研究,首次揭示了巯基萘酚分子在表面存在旋转同分异构现象。由于这一现象所导致的两种共存的有序超晶格结构被清晰地观察到。这一研究发现对分子电子学的研究具有十分重要的意义。该项研究成果被发表在最新一期出版的美国化学会志(J. AM. CHEM. SOC. 2006, 128, 12390-12391 )上。J. AM. CHEM. SOC. 评委给予本项研究高度的评价。他们认为这样一个研究解决了具有简单结构的巯基多芳环有机化合物在金表面的构像问题,为进一步的分子电学特性的研究铺平了道路。 该项研究工作得到中国科学院-法国原子能委员会双边合作计划、国家纳米科学中心以及归国留学人员启动基金的支持。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=27638]JACS 128 12390.pdf[/url]
[align=left][font=宋体][color=#374151]摘要:光学显微成像技术在神经科学研究中发挥着不可或缺的作用。文章将深入探讨两种主要的光学显微成像技术,即荧光显微镜和多光子显微镜,在神经科学领域的应用案例。我们首先介绍了这些技术的基本原理和发展历程,然后详细描述了它们在神经细胞成像、突触可塑性研究和脑功能成像中的应用。通过这些案例,我们展示了光学显微成像技术在神经科学研究中的重要性,以及它们对我们深入理解神经系统的贡献。[/color][/font][/align][font=宋体][color=#374151]关键词:神经科学、荧光显微镜、多光子显微镜、神经细胞成像[/color][/font][font=宋体][color=#374151]光学显微成像技术自17世纪以来一直在科学研究中扮演着重要的角色。随着技术的不断发展,光学显微镜已经成为许多科学领域的核心工具之一,尤其在生命科学和神经科学领域。文章将深入探讨光学显微成像技术在神经科学研究中的应用案例,重点介绍荧光显微镜和多光子显微镜这两种主要技术的原理和应用。[/color][/font][font=宋体][color=#374151]一、光学显微成像技术应用[/color][/font][font=宋体][color=#374151]1.荧光显微镜的应用[/color][/font][font=宋体][color=#374151]荧光显微镜是一种广泛应用于神经科学研究的工具,它使用荧光染料或标记物来可视化和研究神经系统的结构和功能。以下是荧光显微镜在神经科学研究中的应用案例,包括神经细胞成像、突触可塑性研究、脑疾病研究等方面。[/color][/font][font=宋体][color=#374151](1)神经细胞成像[/color][/font][font=宋体][color=#374151]荧光显微镜在观察和研究神经细胞的结构和功能方面发挥了关键作用。通过使用荧光标记的抗体或分子探针,研究人员可以可视化神经元的不同结构,包括轴突、树突、细胞核等。这有助于研究神经细胞的形态特征以及它们在不同生理条件下的变化。[/color][/font][font=宋体][color=#374151](2)突触可塑性研究[/color][/font][font=宋体][color=#374151]荧光显微镜在突触可塑性研究中也具有重要应用。突触可塑性是指突触的结构和功能如何受到刺激和学习的影响。通过标记突触相关的蛋白质或分子,研究人员可以实时观察突触的变化,如突触增强或突触抑制,以深入理解学习和记忆的神经机制。[/color][/font][font=宋体][color=#374151](3)脑功能成像[/color][/font][font=宋体][color=#374151]荧光显微镜在脑功能成像方面也具有潜力。通过将钙指示剂或光遗传学标记物引入神经元,研究人员可以实时监测神经元的活动。这种技术使我们能够理解大脑不同区域的活动模式,以及不同刺激下神经元的响应。这对于研究认知过程、行为和神经疾病有着重要意义。[/color][/font][font=宋体][color=#374151](4)神经干细胞研究[/color][/font][font=宋体][color=#374151]荧光显微镜也被广泛用于研究神经干细胞。通过标记和追踪神经干细胞的命运和分化过程,研究人员可以理解神经系统的发育和再生机制。这对于神经系统修复和治疗神经系统疾病具有潜在应用。[/color][/font][font=宋体][color=#374151](5)荧光标记的蛋白表达[/color][/font][font=宋体][color=#374151]荧光显微镜也可用于研究不同蛋白质在神经系统中的表达和定位。通过使用荧光标记的蛋白表达技术,研究人员可以观察不同蛋白质的分布和相互作用,从而深入理解神经系统中的信号传导和调控。[/color][/font][font=宋体][color=#374151](6)脑疾病研究[/color][/font][font=宋体][color=#374151]荧光显微镜在研究脑疾病方面也发挥着关键作用。研究人员可以使用荧光显微镜来研究神经系统疾病的病理机制,如帕金森病、阿尔茨海默病和精神分裂症。这有助于发现潜在的治疗方法和药物筛选。[/color][/font][font=宋体][color=#374151]荧光显微镜在神经科学研究中的应用是多方面的,涵盖了神经细胞成像、突触可塑性研究、脑功能成像、神经干细胞研究、蛋白质表达和脑疾病研究等多个领域。这一技术为神经科学家提供了非常强大的工具,帮助他们深入理解神经系统的结构和功能,以及与神经相关的疾病的机制。未来,随着技术的不断发展,荧光显微镜将继续在神经科学领域中发挥关键作用,为我们揭示神经系统的奥秘提供更多的洞察力。[/color][/font][font=宋体][color=#374151]2.多光子显微镜的应用[/color][/font][font=宋体][color=#374151]多光子显微镜(Multi-Photon Microscopy)是一种先进的成像技术,它利用非线性光学效应,如多光子吸收,为神经科学家提供了强大的工具,用于研究神经系统的结构和功能。相比传统的荧光显微镜,多光子显微镜具有许多显著的优势,包括更深的成像深度、较少的光损伤、更少的荧光标记物和更高的空间分辨率。以下是多光子显微镜在神经科学研究中的应用领域:[/color][/font][font=宋体][color=#374151](1)脑功能成像[/color][/font][font=宋体][color=#374151]脑功能成像是多光子显微镜的一个主要应用领域。这种技术允许研究人员实时观察活体动物的脑活动,包括神经元的兴奋与抑制、突触传递和脑区之间的相互作用。多光子显微镜能够提供高分辨率的三维图像,而无需使用荧光标记物。这对于研究大脑的基本功能、学习和记忆等过程至关重要。[/color][/font][font=宋体][color=#374151](2)钙离子成像[/color][/font][font=宋体][color=#374151]钙离子在神经元内起着关键的信号传导作用。多光子显微镜可以用于监测神经元内的钙离子浓度变化,这对于理解神经元的兴奋性和突触传递至关重要。通过使用荧光钙染料,研究人员可以实时观察神经元内钙离子浓度的动态变化,以及不同神经元之间的协同作用。[/color][/font][font=宋体][color=#374151](3)神经元形态学研究[/color][/font][font=宋体][color=#374151]多光子显微镜在研究神经元的形态学和结构上也具有独特的优势。它可以提供高分辨率的三维成像,允许研究人员详细观察神经元的分支结构、突触连接和细胞器的分布。这对于理解神经元的连接方式、发展和退行性疾病的机制至关重要。[/color][/font][font=宋体][color=#374151](4)活体动物模型研究[/color][/font][font=宋体][color=#374151]多光子显微镜也在活体动物模型研究中发挥着关键作用。研究人员可以使用这种技术观察小鼠、果蝇等模型动物的脑活动,从而研究不同物种的神经系统功能和行为。这对于神经药理学、疾病建模和药物筛选具有重要意义。[/color][/font][font=宋体][color=#374151](5)细胞内成像[/color][/font][font=宋体][color=#374151]多光子显微镜也可用于单个神经元或突触的细胞内成像。这允许研究人员观察细胞内的亚细胞结构、蛋白质运输和突触形成等过程。这对于研究神经元的分子机制和突触可塑性非常有帮助。[/color][/font][font=宋体][color=#374151]多光子显微镜的应用领域不仅局限于神经科学,还扩展到其他生命科学领域,如细胞生物学、免疫学和生物医学研究。其高分辨率和深层成像能力使其成为许多领域中不可或缺的工具。[/color][/font][font=宋体][color=#374151]尽管多光子显微镜在神经科学研究中具有巨大的潜力,但它也面临着一些挑战。其中之一是成像速度,尤其在观察大脑活动时,需要高速成像以捕捉快速的神经事件。另一个挑战是数据处理和分析,因为高分辨率、三维和四维成像产生了大量的数据,需要强大的计算资源和分析工具。[/color][/font][font=宋体][color=#374151]未来,我们可以期待多光子显微镜技术的不断改进和发展,以应对这些挑战。新的激光技术、荧光标记物和成像算法将继续推动这一领域的进展,为我们深入理解神经系统的复杂性提供更多的洞察力。多光子显微镜将继续在神经科学领域中发挥关键作用,有望帮助我们解决一些最具挑战性的神经科学问题。[/color][/font][font=宋体][color=#374151]二、光学显微成像技术在神经科学研究中的应用存在问题[/color][/font][font=宋体][color=#374151]光学显微成像技术在神经科学研究中的应用虽然具有众多优势,但也存在一些问题和挑战,这些问题需要科研人员不断努力来解决。以下是一些存在问题:[/color][/font][font=宋体][color=#374151]1.有限的成像深度[/color][/font][font=宋体][color=#374151]传统的光学显微成像技术受到光的折射和吸收的限制,导致成像深度受到限制。这在研究深层脑区时成为问题,因为光无法有效透过多层组织,导致深层神经元无法清晰成像。多光子显微镜已经在这一方面取得了进展,但仍然存在深度限制。[/color][/font][font=宋体][color=#374151]2.光损伤和毒性[/color][/font][font=宋体][color=#374151]荧光标记物和强光源在成像过程中可能对生物样本产生光损伤和毒性作用。这对于活体成像和长时间观察是一个挑战,因为它可能导致样本的退化和死亡。科研人员需要努力寻找更温和的成像方法和标记物,以减轻这些问题。[/color][/font][font=宋体][color=#374151]3.数据量庞大[/color][/font][font=宋体][color=#374151]高分辨率和多维成像技术产生大量的数据,需要强大的计算资源和复杂的数据分析工具。处理和管理这些数据可能是一个挑战,尤其是在长期实验和大规模成像项目中。[/color][/font][font=宋体][color=#374151]4.标记物的选择[/color][/font][font=宋体][color=#374151]合适的荧光标记物对于获得高质量的成像数据至关重要。然而,选择适当的标记物可能会受到限制,因为一些标记物可能会干扰样本的正常生理活动,或者不适合特定的实验条件。因此,需要不断开发新的标记物和成像方法。[/color][/font][font=宋体][color=#374151]5.解析度限制[/color][/font][font=宋体][color=#374151]光学显微成像的分辨率受到光的波长限制,通常受到绕射极限的限制。虽然一些超分辨率成像技术已经出现,但它们仍然无法突破光学分辨率极限。这可能会限制对神经系统微观结构的精确观察。[/color][/font][font=宋体][color=#374151]6.活体成像的挑战[/color][/font][font=宋体][color=#374151]对于活体成像,尤其是在大脑中,样本的运动和呼吸等因素可能导致成像失真。稳定和精确定位样本是一个技术挑战。[/color][/font][font=宋体][color=#374151]尽管存在这些问题,光学显微成像技术仍然是神经科学研究的不可或缺的工具,因为它们提供了独特的实时、高分辨率和非侵入性的成像能力。科研人员不断努力解决这些问题,通过技术创新和改进,光学显微成像技术有望继续为神经科学领域的研究提供更多洞察力。[/color][/font][font=宋体][color=#374151]三、下一步研究方向[/color][/font][font=宋体][color=#374151]基于上述问题,光学显微成像技术在神经科学研究中的应用仍然需要不断改进和发展。下面是可能的下一步研究方向,以解决这些问题:[/color][/font][font=宋体][color=#374151]1.改进成像深度[/color][/font][font=宋体][color=#374151]研究人员可以探索新的成像方法,如双光子显微镜和光学波前调制成像,以增加成像深度。此外,开发新的光学透明样本制备技术,如透明大脑样本技术,可以帮助克服深度限制问题。[/color][/font][font=宋体][color=#374151]2.减少光损伤和毒性[/color][/font][font=宋体][color=#374151]研究人员可以寻找更温和的成像条件,减少光损伤和荧光标记物的毒性。此外,使用先进的成像系统,如自适应光学成像,可以减小激光功率,同时保持高分辨率。[/color][/font][font=宋体][color=#374151]3.数据管理和分析工具[/color][/font][font=宋体][color=#374151]开发更强大的数据管理和分析工具,以处理庞大的成像数据。机器学习和深度学习方法可以帮助提高数据分析的效率,并自动检测和量化细胞和结构。[/color][/font][font=宋体][color=#374151]4.标记物的改进:寻找更多、更具选择性的标记物,以减少对样本的干扰。这可以包括荧光标记物的改进、发展新的基因表达标记和探测技术。[/color][/font][font=宋体][color=#374151]5.突破分辨率极限[/color][/font][font=宋体][color=#374151]进一步发展超分辨率成像技术,以突破传统光学分辨率极限,获得更高的细节分辨率。例如,结构光显微镜和单分子成像技术可以帮助提高分辨率。[/color][/font][font=宋体][color=#374151]6.活体成像技术改进:研究人员可以探索新的样本固定和稳定技术,以减小样本运动对成像的影响。另外,开发新的活体成像方法,如头部悬置成像和小型显微成像技术,可以帮助在动态活体条件下进行成像。[/color][/font][font=宋体][color=#374151]7.多模态成像[/color][/font][font=宋体][color=#374151]结合不同的成像技术,如光学显微镜与电生理记录、光学显微镜与功能磁共振成像(fMRI)等,以获得更全面的神经科学数据。[/color][/font][font=宋体][color=#374151]8.多尺度成像[/color][/font][font=宋体][color=#374151]开发多尺度成像方法,能够在微观和宏观水平上同时观察神经系统的活动,从神经元到整个脑区。[/color][/font][font=宋体][color=#374151]这些研究方向代表了改进和扩展光学显微成像技术在神经科学研究中的应用的可能途径。通过不断的技术创新和跨学科合作,神经科学家和工程师有望克服这些问题,提高光学显微成像技术的效能和应用广度,以更深入地理解神经系统的复杂性。[/color][/font][font=宋体][color=#374151]四、结论[/color][/font][font=宋体][color=#374151]光学显微成像技术在神经科学研究中的应用案例清楚地表明,这些技术在揭示神经系统的复杂性和功能中起到了关键作用。然而,这仅仅是一个开始,未来仍有许多挑战和机遇等待我们探索。例如,新的成像技术和荧光标记方法的不断发展将进一步扩展我们的研究领域。此外,将光学显微成像技术与其他分子生物学和生物化学技术相结合,可以更全面地理解神经系统的功能。[/color][/font][font=宋体][color=#374151]在未来,我们可以期待更高分辨率、更深层次的成像以及更多三维和四维成像的发展。这将有助于解决神经科学中的一些最具挑战性的问题,如神经网络的复杂性和神经退行性疾病的机制。光学显微成像技术将继续为神经科学研究提供有力的工具,推动我们对大脑和神经系统的理解不断深入。[/color][/font][font=宋体][color=#374151]参考文献:[/color][/font][font=宋体][color=#374151][1]高宇婷,潘安,姚保利等.二维高通量光学显微成像技术研究进展[J].液晶与显示,2023,38(06):691-711.[/color][/font][font=宋体][color=#374151][2]王义强,林方睿,胡睿等.大视场光学显微成像技术[J].中国光学(中英文),2022,15(06):1194-1210.[/color][/font][font=宋体][color=#374151][3]章辰,高玉峰,叶世蔚等.自适应光学在双光子显微成像技术中的应用[J].中国激光,2023,50(03):37-54.[/color][/font][font=宋体][color=#374151][4]曹怡涛,王雪,路鑫超等.无标记光学显微成像技术及其在生物医学的应用[J].激光与光电子学进展,2022,59(06):197-212.[/color][/font][font=宋体][color=#374151][5]关苑君,马显才.光学显微成像技术在液-[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]分离研究中的应用[J].中山大学学报(医学科学版),2022,43(03):504-510.DOI:10.13471/j.cnki.j.sun.yat-sen.Univ (med.sci).2022.0319.[/color][/font][font=宋体][color=#374151][6]陈廷爱,陈龙超,李慧等.结构光照明超分辨光学显微成像技术与展望[J].中国光学,2018,11(03):307-328.[/color][/font][font=宋体][color=#374151][7]安莎. 轴平面光学显微成像技术及其应用研究[D].中国科学院大学(中国科学院西安光学精密机械研究所),2021.DOI:10.27605/d.cnki.gkxgs.2021.000055.[/color][/font][font=宋体][color=#374151][8]杜艳丽,马凤英,弓巧侠等.基于空间光调制器的光学显微成像技术[J].激光与光电子学进展,2014,51(02):13-22.[/color][/font][font=宋体][color=#374151][9]莫驰,陈诗源,翟慕岳等.脑神经活动光学显微成像技术[J].科学通报,2018,63(36):3945-3960.[/color][/font][font=宋体][color=#374151][10]张财华,赵志伟,陈良怡等.自适应光学在生物荧光显微成像技术中的应用[J].中国科学:物理学 力学 天文学,2017,47(08):26-39.[/color][/font]
[font=宋体]传统的[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]技术测量的是平均光谱,反映样本的平均组成,而近红外显微成像技术增加了光谱的空间分布信息,可以使样品的异质性得到进一步[/font][font=宋体]确定。近红外显微成像系统是将[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]与光学显微镜联用的系统,主要由近红外主机、近红外显微镜系统和计算机组成。近红外主机多采用干涉分光原理,主要部件包括迈克尔逊干涉仪、显微镜光学系统、检测器等。显微镜把光束聚焦到测量样品的微区上,可移动镜头从而对样品进行点、线、面的分子水平的扫描,可以快速获得大量的[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]图,并把测量点的坐标与对应的红外光谱同时存入计算机,得到不同化合物在微区分布的平面图或立体图。[/font][font='Times New Roman']1. [/font][font=宋体]近红外显微成像技术的特点[/font][font=宋体][font=宋体]([/font][font=Times New Roman]1[/font][font=宋体])样品不需预处理。[/font][/font][font=宋体][font=宋体]([/font][font=Times New Roman]2[/font][font=宋体])穿透能力强。[/font][/font][font=宋体][font=宋体]([/font][font=Times New Roman]3[/font][font=宋体])水的干扰小,可以对鲜活组织和溶液中的细胞样品直接测定。[/font][/font][font=宋体][font=宋体]([/font][font=Times New Roman]4[/font][font=宋体])测定的区域可达到[/font][/font][font='Times New Roman']lcm[/font][sup][font='Times New Roman']2[/font][/sup][font=宋体]以上,并且可以检测粗糙表面的样品。[/font][font=宋体][font=宋体]([/font][font=Times New Roman]5[/font][font=宋体])非接触性、非破坏性、无环境污染。[/font][/font][font=宋体][font=宋体]([/font][font=Times New Roman]6[/font][font=宋体])二维光谱可以增强分辨率,展示更多的细节。[/font][/font][font=宋体][font=宋体]([/font][font=Times New Roman]7[/font][font=宋体])可分析多种物态的样品。[/font][/font][b][font='Times New Roman']2. [/font][font=宋体]成像方式[/font][/b][font=宋体][font=宋体]([/font][font=Times New Roman]1[/font][font=宋体])总吸收图像,以每一个的数据点的[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]图为基础,宏观显示图像分析区域内的近红外吸收强度。[/font][/font][font=宋体][font=宋体]([/font][font=Times New Roman]2[/font][font=宋体])单波长成像,以特定波长的近红外吸收强度为特征,显示对应化学官能团在图像分析区域内的分布信息。[/font][/font][font=宋体][font=宋体]([/font][font=Times New Roman]3[/font][font=宋体])化学成像,也叫峰面积图像,是以特定吸收峰的峰面积为特征,显示对应化学官能团在图像分析区域内的分布信息。[/font][/font][font=宋体]([/font][font='Times New Roman']4[/font][font=宋体])相关谱成像,以某一张[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]为标准,计算出整个图像上的像素点光谱与它的相关性,再以相似度为度量成像。特别适于鉴别纯物质中的零星污染物。[/font][font=宋体]([/font][font='Times New Roman']5[/font][font=宋体])峰比率成像,以[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]图不同吸收峰的峰比率为特征,显示对应化学官能团在图像分析区域内的分布信息。[/font][font=宋体]近红外显微成像技术在材料、食品、医药等行业已经发挥了较大的作用,利用其进行化学成分测定及微区分析,快速、简单、直观。与扫描电镜、透射电镜、电子探针、[/font][font='Times New Roman']X[/font][font=宋体]射线衍射等其他微区分析技术相比,近红外显微成像技术具有制样简单、操作方便、快速定量、无损分析的优点。因此,作为现代分析技术,近红外显微成像技术必将得到越来越广泛的应用。如何建立适用性、稳定性更好的数学模型,实现不同仪器之间、同一仪器不同条件下的定标模型的转移,以及与其他分析技术的联用将是近红外显微成像技术的发展趋势。[/font]
[b]摘要[/b]在神经科学和神经外科中对活体大脑组织中神经元的成像能力是一项基本要求。尤其是需求一种具有测微计尺分辨率的大脑形态学的非侵入探针的开发,因为它可以在临床诊断上提供一种非侵入式光学活体组织检查的手段。在这一领域,双光子激光扫描显微镜(2PLSM)是一个强大工具,并已成为活体生物样品最小侵入性损害的高分辨率成像的标准方法。但是,(2PLSM)基于光学方法提供足够分辨率的同时,对荧光染料的需求妨碍了图像对比度的提高。本文中,我们提供了一种活体大脑组织以细胞分辨率的高对比度成像方法,无需荧光探针,使用光学三次谐波发生进行成像。我们利用细胞水平的特殊几何学和大脑组织的液体内容物来获取THG的部分相匹配,提供了一种荧光对比度机制的替代方法。我们发现THG大脑图像允许快速、无侵入性标记的神经元、白质结构、血管同时成像。而且,我们利用THG成像来引导微吸管指向活体组织中指定的神经元。这个工作是一个无标记活体大脑成像的主要步骤,并开启了活体大脑中激光引导的微注射技术发展的可能性。[b]材料与方法[/b]THG成像对于THG成像实验,我们使用了一台商业化双光子激光扫描显微镜([color=#ff0000]TrimScope, Lavision BioTec[/color])。光源是一个光学参量震荡器(Mira-OPO,APE),810nm泵浦光来自一个Ti:Sa锁模激光器(Coherent Chameleon Ultra II)。使用一个20X,0.95N.A水浸物镜(Olympus XLUMPFL-IR)将光聚焦到样品上。使用epidetection几何学描述THG实验。使用分光镜(Chroma T800lpxrxt)将背景散射THG光子从入射激光束中分离出来,用一个THG波段的带通滤波器(Chroma HQ390-70X)过滤。检测器是GaAsP高灵敏度光电倍增管(Hamamatsu H7422-40),400nm处量子效率为25%。最高分辨率成像(1024×1024像素)的典型获取时间为1.6s,我们用于目标定向实验的512 X 512像素成像时间为0.6s。 为与前向端口比较,使用了一个定制的投射端口。这个端口使用了一个1.4N.A油浸物镜,一个长波分光镜(UQG optics)和一个400nm的相干窄带滤波器。对于THG与SR-101联合实验我们用1200nm的OPO来同时产生两种信号。使用一个594nm带通和561nm隔断的分光镜将SR-101荧光从THG信号中分离。SR-101信号使用一个PMT检测(Hamamatsu H6780-20)。Nile Red和THG成像也是由1200nm的OPO同步激发。在这个案例中THG信号由投射端口测量,Nile Red荧光通过一个593∕40 nm的带宽滤波器检测。对于THG和GFP联合成像,用来泵浦OPO的Ti:Sa激光被调谐到970nm并耦合到显微镜中。组织块的GFP和THG信号使用同一个检测器连续测量。但使用一个不同的(561∕40 nm)带通滤波器检测GFP。使用显微镜软件(Imspector Pro)获取图像并以16bit 的tiff格式存储,图像分析使用Image J(MacBioPhotonics)进行。[b]主要结果[/b] [img=,575,768]http://qd-china.com/uploads/bio-product/21.jpg[/img]Fig. 1.无标记活体大脑的三次谐波显微成像(A)脑组织THG成像的epidetection几何学图示。插图:THG原理。注意基质中没有光学激发发生。(B) 树突处的聚焦激光束。通过将激光聚焦体积设定到树突直径的几倍大小,可以获得部分相匹配,显著的THG信号将会产生。(C)细胞体内的聚焦激光束。由于不好的结构相匹配状态,没有THG信号产生。(D) 小鼠大脑组织的活神经元成像。体细胞以暗影存在。 [img=,466,500]http://qd-china.com/uploads/bio-product/22.jpg[/img]Fig. 2.活体大脑组织的THG成像(A)小鼠皮质的THG图像 (B) 与A同位置的Nile Red染色的双光子荧光图像 (C) 大鼠凹陷的脑回THG图像(水平切面) (D)小鼠脑胼胝体THG图像,轴突纤维束被清晰得分辨。Movie S1是这个结构的一个3D投影 (E)小鼠大脑纹状体的THG图像(冠状面)。白质和神经元细胞清晰可见。明亮的粒状结构是垂直穿行图像平面的轴突纤维。Movie S2是这个区域的3D投影。(F)麻醉活小鼠的脑皮质上层的血管THG图像(z栈平均投影密度是50um) [img=,510,767]http://qd-china.com/uploads/bio-product/23.jpg[/img]Fig. 3. THG与双光子成像的叠加 (A)小鼠额前叶脑皮质的THG图像 (B)SR-101标记的星细胞双光子图像 (C) A、B的叠加提供了神经网络中星细胞的分布信息 (D) 小鼠额前叶皮质的THG图像 (E) GFP标记的生长抑素神经元的双光子荧光图像 (F)D、E的叠加显示了生长抑素神经元在脑前叶皮质结构中的分布 [img=,461,768]http://qd-china.com/uploads/bio-product/24.jpg[/img]Fig. 4.THG成像深度与自动化细胞检测 (A-C) 小鼠额前叶皮质的THG图像,成像深度分别为100, 200, and 300 μm 。每幅图像都是3个以2微米深度间隔独立图像的最大密度投影(D) 110 μm深度处神经元细胞的自动检测THG图像。细胞检测的运算法则定义为以红色显示的神经元 (E)红色标记:来自A-C的图像栈的细胞可见性对比。黑色标记:作为一个深度功能的平均检测到的THG密度。 [img=,531,768]http://qd-china.com/uploads/bio-product/25.jpg[/img]Fig. 5. 无标记目标定向和细胞活性(A)小鼠新大脑皮层的THG图像 (B) 在对一个神经元进行THG引导膜片钳之后同一位置的THG图像 (C)一个200um深处钳住神经元的大视野THG图像(5幅深度间隔2um的图像平均) (D)记录以100pA电流脉冲刺激B中被钳住的神经元的动力势训练 (E) 测量在THG扫描期间静止膜电位的改变。即使以最高的能量,也只观察到4%的电压变化,保持了完全的可逆性。0.8秒的周期相应于图像扫描时间。(F)最大观察到的静止膜电位Vs扫描时的激光能量。没有非线性效应出现。
[b][url=http://www.f-lab.cn/vivo-imaging/nexus128.html]三维光声超声成像系统Nexus128[/url][/b]是全球首款成熟商用的[b]3D光声成像系统[/b]和[b]3D光声CT系统[/b]和[b]3D光声断层扫描成像系统[/b],具有更高灵敏度和各向同性分辨率,提高光声图像质量,具有更快的扫描时间和更高光声成像处理能力。三维光声超声成像系统利用内源性或外源性对比产生层析吸收的断层图像,适用于近红外吸收染料或荧光探针进行对比度增强和分子成像应用。三维光声超声成像系统应用分子探针的吸收和分布肿瘤血管-血红蛋白浓度肿瘤缺氧-二氧化硫[img=三维光声超声成像系统]http://www.f-lab.cn/Upload/photo-acoustic-CT-Nexus128.png[/img]三维光声超声成像系统Nexus128特点预定义的肿瘤生物学和探头吸收协议先进灵活的研究模式的扫描参数先进的重建算法易于使用的图形用户界面紧凑,方便的现场系统强大的查看和分析软件易于使用的图形用户界面数据可视化与分析三维光声数据从三维光声超声成像系统传输到工作站进行观察和分析。工作站上的数据具有与三维光声超声成像系统相同的结构/组织。独立的工作站允许调查员分析数据,而另一个操作员正在获取数据。前置像头具有强大的内置工具Endra 可以为特殊定量数据应用提供OsiriX 插件三维光声超声成像系统Nexus128:[url]http://www.f-lab.cn/vivo-imaging/nexus128.html[/url]
共焦显微镜因其高分辨率和能三维立体成像的优点被广泛应用在生物、医疗、半导体等方面。文章首先分析了影响共焦显微镜分辨率的因素,主要有光源、探测器孔径和杂散光等;并结合这些因素介绍了双光子共焦碌微镜、彩色共焦显微镜、荧光共焦显微镜、光纤共焦显微镜;然后从提高系统成像速度的方面介绍了波分复用共焦显微镜和频分复用共焦显微镜;最后分析了共焦显微镜的发展趋势。一、引言随着人们对于生物医学的研究,传统的光学显微镜已经无法满足研究的需要,人们需要可以实现三维成像的显微镜。1957年Marvin Minsky提出了共焦扫描显微镜的原理。1969年,耶鲁大学的Paul Davidovits和M.David Egger设计了第一台共焦显微镜,1987年第一台商业化共焦显微镜的问世,真正实现了三维立体成像。与普通光学显微镜相比,共焦显微镜具有极其明显的优点:能对物体的不同层面进行逐层扫描,从而获得大量的物体断层图像;可以利用计算机进行图像处理;具有较高的横向分辨率和纵向分辨率;对于透明和半透明物体,可以得到其内部的结构图像;还可以对活体细胞进行观察,获取活细胞内的信息,并对获得的信息进行定量分析。自共焦显微原理被提出以来,引起了研究者的广泛关注,提高显微系统的分辨率和改善系统的性能是研究者开发新型显微镜时考虑的主要因素。近几十年,国内外学者通过对共焦显微成像系统的三维点扩散函数、光学传递函数等方面的分析,得出影响显微系统分辨率的因素,主要包括系统的激励光源、探测器孔径、杂散光等。此外,共焦显微镜的成像速度也是决定系统性能的一个重要因素,专家们也一直在进行提高系统成像速度的研究。本文主要从提高显微系统分辨率和系统成像速度这两个方面来介绍共焦显微镜的发展情况。二、共焦扫描显微镜分辨率的提高光源、探测器孔径和杂散光等是影响共焦显微镜分辨率的几个主要因素,因此可以通过改善这些方面来提高显微系统的分辨率。1.光源显微镜的成像性质在很大程度上取决于所采用光源的相干性,有关研究表明,光源相干性好的系统其分辨率要比相干性差的系统要好,并且照明光源对分辨率的改变范围达到了26.4%。因此,选取适合的照明光源对提高显微系统的分辨率有很大帮助。常规的共焦扫描显微镜主要使用普通单色激光作为光源,随着技术的进步,目前已经出现了使用飞秒激光、超白激光、高斯光束作为光源的共焦显微镜,以提高系统性能,获得更高的分辨率。①飞秒激光为光源的双先子扫描共焦显微镜双光子扫描共焦显微镜通常使用近红外的飞秒激光作为激发光源,由于红外光具有较强的穿透性,它能探测到生物样品表面下更深层的荧光图像,并且生物组织对红外光吸收少,随着探测深度的增加衰减会变小,另一方面红外光的衍射低,光束的形状保持性好。2005年,Wild等人利用双光子扫描共焦显微技术实时观察和定量分析了PAHs在植物叶片表面和内部的光降解过程。后来又进一步研究了菲从空气到叶片的迁移过程、菲在叶片内部的运动及其分布情况等,该技术可观测PAHs在叶片内部的最大深度约为200μm。②白激光( supercontinuum laser)为光源的彩色共焦显微镜彩色共焦显微镜是利用光学系统的彩色像差,光源的不同光谱成分会聚焦到样品的不同深度,通过分析由样品反射的光谱能有效地获得样品的扫描深度。2004年,美国宾夕法尼亚州立大学的Zhiwen Liu课题小组使用光子晶体光纤产生的超连续谱白光作为彩色共焦显微镜的光源,这种超连续谱白光具有大的带宽,能够提高系统的扫描范围,能达到7μm扫描深度。另外超白激光有较高的空间相干性,无斑点噪声,能提高系统的信噪比和扫描速度。③使用高斯光束的荧光共焦显微镜荧光共焦显微镜是通过激光照射样品激发样品发出荧光,再通过探测器接受荧光对样品进行观察的共焦显微镜。华南农业大学的杨初平等人研究了不同光源孔径和束斑尺寸的高斯光束对荧光共焦显微镜分辨率的影响表明:与一定孔径尺寸的平行光束相比,采用高斯光束系统可以获得更好的分辨率。 2. 探测器孔径和杂散光共焦显微镜中探测器孔径能滤除部分杂散光,提高系统的分辨率和信噪比。根据相关文献对共焦扫描显微镜的三维光学传递函数与探测器孔径之间的依赖关系的研究,可以得到探测小孔直径为:d=β*1.22λ/NA,式中,β为物镜的放大率,λ为光的波长,NA为物镜的数值孔径。由该公式确定探测器小孔的直径,一方面满足了共焦扫描系统对探测器小孔直径的要求,从而保证高的横向和纵向分辨率,另一方面,又最大限度地使由试样中发射的荧光能量被探测器接收。为了更进一步提高系统分辨率,许多研究者对共焦显微镜中探测孔径进行了改进,例如使用单模光纤代替普通针孔孔径,还有双D型孔径等。① 使用单模光纤的光纤共焦显微镜在光纤共焦显微镜中用光纤分路器代替传统共焦显微镜中的光束分路器,并以单模光纤来代替光源和探测器的微米尺寸针孔孔径。使用单模光纤的优点在于:首先,在采用寻常针孔制作的共焦显微镜中,光源、针孔、探测器等有可能不在一条直线上从而会引起像差;但是在光纤作为针孔的共焦显微镜中,即使有的部件偏离直线时也不会引入像差。其次,使用单模光纤代替微型针孔,容易清除针孔的污染,而且不易受污染。第三,在使用光纤的系统中,可以自由移动显微镜部分而不必挪动探测器。2006年德克萨斯大学使用光纤共焦显微镜进行口腔病变检测,测得的系统横向和轴向分辨率分别为2. 1µm和10µm,成像速度为15帧/s,可观测范围为200µm×200µm。② 具有D型孔径的共焦显微镜近几年,具有对称D型光瞳的共焦显微成像技术引起广泛的关注,图1所示是该系统示意图。2006年美国东北大学的Peter J.Dwyer等人使用这种共焦显微镜进行了人体皮肤内部成像的实验,测得横向分辨率为1.7士0.1µm。2009年新加坡国立大学的Wei Gong等人采用傍轴近似方法理论分析了在共焦显微镜中使用双D型孔径对轴向分辨率的影响。分析表明在图1中的d值给定时,进入瞳孔的光信号强度l会随着探测器尺寸的增加而增加;但是在探测器尺寸给定时,光信号强度I会随着d的增加而单调递减。在使用有限大小的探测器时,改变d的大小,轴向分辨率可以得到改善。 http://www.biomart.cn//upload/userfiles/image/2011/11/1321512815.png 图1 双D型孔径共焦成像系统示意图在共焦成像光学系统中,到达像面的杂散光会在像面上产生附加的强度分布,从而进一步降低了像面的对比度,限制了系统分辨率的提高,因此在显微系统设计时,杂散光的影响也是不容忽视的。一般除了使用探测小孔来抑制杂散光,其他的一些设备例如可变瞳滤波器等对杂散光也有很好的过滤作用。最近以色列魏茨曼科学研究所的O.sipSchwartz and Dan Oron等人提出在系统中使用可变瞳滤波器,这个滤波器能够使多光子荧光共焦显微镜达到分辨率阿贝极限的非线性模拟,从而改善系统的分辨率。三、共焦扫描显微成像速度的提高共焦显微镜快速的成像速度为研究者观察生物细胞中快速动态反应提供了良好的条件。在共焦扫描显微成像系统中,传统的方法是通过改善扫描探测技术来提高成像速度。现有的扫描探测技术主要有Nipkow转盘法、狭缝共焦检测法、多光束的微光学器件检测法。这些方法可以改善扫描速度,但是与系统分辨率,视场之间都存在矛盾,因此又诞生了两种提高成像速度的新型显微镜:波分复用共焦显微镜和频分复用共焦显微镜。
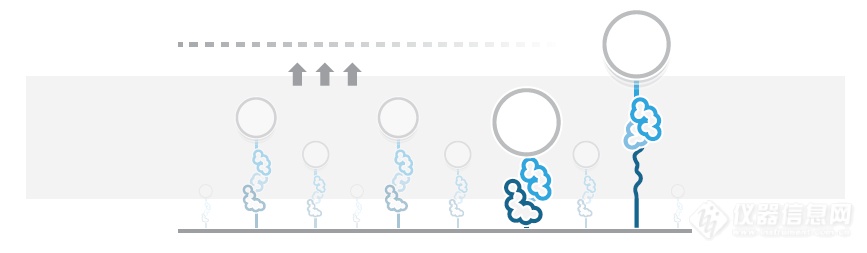
[b]使用声力研究蛋白去折叠[/b]单分子力谱(SMFS)技术是研究蛋白结构与蛋白去折叠中的生物力学性质的有力工具。SMFS能够为研究和药物开发提供有价值的信息。SMFS有助于揭示人类疾病病理的分子机制,而机制往往被认为与错误折叠的蛋白的形成和积聚有关,如阿茲海默症和帕金森氏症。然而现有的SMFS仪器缺少同时并行研究多个蛋白去折叠的功能,使得研究过程耗时很长。使用声波来对数以百计的生物分子施力并操控是非常理想的高通量研究方法。此案例中,声力谱学(AFS)是最新的用于研究蛋白去折叠的单分子操控方法。[img=,500,145]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021031435408_23_981_3.png!w690x201.jpg[/img]1 AFS检测蛋白去折叠的图解。蛋白一端栓住玻璃表面,另一端拴住聚苯乙烯微球。[img=,400,238]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021032257008_8827_981_3.png!w421x251.jpg[/img]2 对视野范围内被蛋白分子拴在玻璃表面的4.5 μm聚苯乙烯微球同时成像。物镜放大倍数为20x。AFS设备使用压电元件共振激发平面声阱穿过微流控芯片。共振波对与周围介质密度不同的微球施力,每个生物分子被单独地由微球拉伸(图1)。仪器可以实时并行操控视野范围内数以百计的微球,获得大量的数据以研究每个生物分子的随机与异质行为(图2)。在Yan Jie(NUS)的实验室的这项试点研究中,我们首次展示了AFS如何对蛋白施力并操控。实验对踝蛋白施力引发(去)折叠同时以高精确度记录蛋白的拉伸。踝蛋白属于机械敏感性大分子,在调控蛋白粘附于胞外基质中起作用。踝蛋白是细胞代谢过程和信号通路中的关键,并能够在力的作用下改变构象,在单分子生物物理学中备受关注。[img=,500,156]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021033524578_3892_981_3.png!w679x212.jpg[/img]3 使用AFS得到的单个踝蛋白分子的去折叠曲线,力变化速率为1 pN/s。轨迹在500 Hz下获得(彩色点),并平衡至50 Hz(黑色线)。3a 单个踝蛋白多次拉伸的力-距离曲线。3b 单个拉伸循环的力-距离曲线。3c 图3b中分子的时间-距离曲线。在这项研究中,连接了DNA的踝蛋白拴在聚苯乙烯微球和玻璃表面。启动声波后形成平面声阱,连接了踝蛋白的微球受到朝向声阱的力。实验中通过调节声波的振幅来改变力的大小。逐渐增加力的大小使得蛋白的结构域按顺序去折叠。实验循环进行拉伸与收缩的过程(力变化速率为1 pN/s)并同时以nm级的分辨率检测每个蛋白的拉伸长度(图3)。通过力-距离曲线(图3a)可以观察到单个踝蛋白的去折叠循环。将单个蛋白的去折叠轨迹叠加即可检测到单个结构域去折叠的发生,研究人员可以得到蛋白结构和蛋白去折叠自由能图谱信息。AFS仪器产生的超声并不会损害生物分子的结构完整性,因此蛋白可以连续去折叠和再折叠长达数小时,并能够得到单个蛋白多次去折叠和再折叠的曲线。相比于其他SMFS方法经过多次拉伸和收缩之后对蛋白造成光学损伤或力学损伤使得实验被迫终止,AFS能够获得更多的信息。图3b: 单个力-距离曲线中截取一小段,表示一个拉伸过程。将力从15 pN增加至19 pN,可以观察到4个去折叠过程,与蛋白的4个结构域相符合,拉伸长度为30 nm至100 nm。AFS的高分辨率检测功能可以很清晰地区分去折叠过程。AFS在x,y方向精度为2 nm,在z方向精度为4 nm(频率为25 Hz),可以大幅提高(去)折叠研究的精密程度。图3c: 图3b中分子的18秒范围内的时间-距离曲线。AFS可以检测短至毫秒级至长达10小时以上的事件,用于研究蛋白的热力学和动力学。通过检测踝蛋白的去折叠步骤并记录连续的高分辨率的去折叠轨迹,可以得出AFS如何用于研究蛋白去折叠。研究蛋白(去)折叠的详细机制能够在生物物理和生物医药领域产生突破性发现。今后的蛋白折叠以及蛋白相互作用的研究中,AFS的多分子并行操控功能将发挥重要作用,用户可以同时并行检测大量的蛋白分子。用户可以获得大量的实验数据,在不影响分辨率的同时对蛋白的机械性质数据作出分析。
中国科技网讯 受光子放大和光子在室内被物体和墙壁反弹现象的启发,美国麻省理工学院、哈佛大学、威斯康星大学和莱斯大学的科学家利用先进的光学系统追踪反弹的光子,从而能够“看到”隐藏在屋内拐角处无法直接看到的物体。该技术在未来有望成为减灾和无损生物医学成像的无价之宝。 麻省理工大学研究生奥特克莱斯特·古普塔表示,当光子从墙上反弹并射在室内拐角处暗藏物体上被反射回来时,利用光子环绕和反弹的时间数据,他们能够获取有关物体几何形状的信息。 先进光学系统主要由超快激光器和两维超快扫描照相机组成,它们的工作频率可达每秒万亿次。科学家用它们能在1秒钟内拍摄数10亿张图像,通过分析反弹光子的运动状况“看到”室内拐角处的物体。 超快扫描照相机与其他照相机不同,它是根据光子进入照相机的时间来成像。古普塔说,这样的成像方式为人们提供了了解光子需要多长时间被反弹回来的良好途径。如果在拐角处存在某种物体的话,光子返回得越快则进入超快扫描照相机的时间就越早。他们用超快扫描照相机捕捉和计算光子数,每张图像上有3个或更少的光子。通过快速大量的成像来生产扫描图像,帮助他们决定光子传输的距离(以厘米计算)。当数据收集完成后,他们便能了解拐角处暗藏物体的基本几何形状和3维成像。 新的成像技术具有众多潜在的应用,其中包括在救灾方面的应用。古普塔认为,如果有房屋倒塌,新技术能够帮助救灾人员知道废墟内是否有人存在。事实上,新技术几乎适用于各种各样的灾害现场,特别是需要了解内部具体情况以及角落处是否有人的火灾,火灾的危险程度以及有害环境,由此人们不会冒险派人进入燃烧的房屋内,新技术可以极大地减少救灾人员可能面对的威胁。 此外,新技术十分有望被用作无损或非侵害生物医学成像,帮助医生掌握病人皮下组织的情况。这是科学家目前要着手研究的课题。古普塔表示,根据典型的时间表,研发展示到产品推出,新技术商业化需要5年至10年的时间。(驻美国记者 毛黎) 《科技日报》(2012-08-17 二版)
食品微生物实验室想买彩色成像显微镜,大家有好的品牌型号推荐吗?
光学分子成像技术由于其具有灵敏度高,响应速度快,操作方便且能实时直观等优异性能引起广泛关注。穿透性荧光三维成像技术(FLIT)凭借其特有的底部透射荧光成像模式能够精确获取体内荧光标记靶点的深度、体积、细胞
德国夫琅禾费应用光学与精密工程研究所最近研制出一种厚度仅5.3毫米、分辨率达5微米的超薄显微镜,其未来用途可包括皮肤癌变检查和鉴别文件真伪。 这家研究所日前发表的新闻公报说,达到同样分辨率的传统显微镜要么只能一次观察一片很小的区域,要么就是对观察对象进行多次扫描,最后组合成图像,费时费力。这种新型显微镜可以对火柴盒大小的观察面积一次成像,成像速度快到即使医生手持这种超薄显微镜,其观察到的影像也不会模糊,对于观察皮肤病变非常实用。 达到这种观察效果的奥秘在于该显微镜用于成像的部分由无数紧密排列的微小透镜组成,每个透镜仅对观察对象的局部成像,每个局部的面积只有0.09平方毫米,与此同时显微镜内的软件能将这些微小局部组合成整体图像。这些微小透镜由特殊模具对高分子材料加工制成,可以批量生产,因而成本相对低廉。 目前德国研究人员已研制出这种超薄显微镜的样品,但批量生产至少还需一两年时间。(转载自科技日报)
【网络讲座】:NT-MDT系列技术讲座3:原子力显微镜用于物质组分成像【讲座时间】:2016年06月22日 14:00【主讲人】:葛林 北京办公室应用工程师。清华大学电子工程系本科,德国马普研究院纳米技术博士,10年AFM应用经历。【会议简介】1. AFM应用于物质组分成像的原理及分类2. 基于基础配置的力学组分成像3. 基于HybirD控制箱的力学组分成像4. 电学组分成像5. 结合拉曼光谱的组分成像-------------------------------------------------------------------------------1、报名条件:只要您是仪器网注册用户均可报名参加。2、报名截止时间:2016年06月22日 13:304、报名参会:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/19925、报名及参会咨询:QQ群—171692483,扫码入群“显微镜之家”http://ng1.17img.cn/bbsfiles/images/2017/01/201701191700_667767_2507958_3.gif
紧急求助静电力显微镜中电场梯度成像的工作原理, 组里最近买了一台omicron的真空AFM,除了向扫描表面之外,还想进行电场梯度成像。我的助教在导电的针尖上加了一个偏压(AC bias),想测量电场梯度。我是个新手,接触AFM 才2个月,所以想请教各位,在经过这个改变后,我们的AFM 是不是就可以测电场梯度了,另外,静电力显微镜中电场梯度成像的3个方法中,相检测 (phase detection)、频率调制 (frequency modulation)和振幅检测 (amplitude detection) 的工作原理是怎样的。哪个个方式更合适我们的AFM呢请多多指教咯^__^
MPI磁粒子成像的原理是什么?有什么品牌的设备推荐。网上只找到北京普华量宇代理的MI和布鲁克的设备。
以下转自科学网:http://paper.sciencenet.cn/htmlpaper/201333013373163128569.shtm?id=28569 单分子成像技术揭示毛细管电泳机理中国科学院生态环境研究中心环境化学与生态毒理学国家重点实验室汪海林课题组在高灵敏分析的基础研究方面取得重要进展。他们利用先进的单分子成像技术研究并揭示了独特的等速电泳聚焦和分离的机理,其有关“DNA单分子不连续运动成像揭示场强变化的等速电泳动力学”的研究发表在国际著名化学期刊《美国化学会志》(J. Am. Chem. Soc. 2013, 135, 4644 - 4647)上。带电组分在均一和非均一电场中的运动是电泳应用于化学、物理学、生命科学以及新兴的纳米科技领域的基础。目前,人们对带电组分在均一电场中的运动已经有了充分的认识,而对其在非均一电场中运动的了解却有限。事实上,通过巧妙设计非均一电场,可实现其它技术难以分离的超大DNA分子(80 kb) 的分离和多种分析物的高倍浓缩(可达百万倍)。因而,认识非均一电场中带电组分的运动机制对发展高灵敏的生物分子分析技术和方法具有特殊意义。尽管非均一电场的使用已有百年历史,但对于其形成机理的认识由于存在技术瓶颈而踯躅不前。为了解决这一学科难题,汪海林课题组通过改造全内反射荧光显微成像仪器,首先实现了毛细管电泳-单分子荧光成像分析。在此基础上,以毛细管等速电泳(cITP)作为非均一电场模型,对流经毛细管检测窗口处单个DNA分子实时成像。由于每一幅像记录了单个DNA分子在50 毫秒内的运动轨迹,因此可以计算出每一时间点DNA单分子的运动速度。而DNA运动速度的大小直接与电场强度相关,从而可获得毛细管中电场强度的动态分布信息。通过研究电场强度的实时变化,揭示了电渗流存在下等速电泳的动力学,并首次提出了三区带模型,突破了传统二区带模型的局限。利用这一研究成果,他们发展一种新颖的DNA单分子聚焦方法,实现对极低浓度下随机分布的、难以检测的单分子成像,可检测出4´10-17mol/L DNA分子。在这项研究工作中,汪海林课题组创造性地利用单分子成像技术测定电场强度的分布,提供了一种全新的非均一电场研究方法,这对发展基于电泳分离的高灵敏生物分析技术和方法具有重要意义。该工作得到了国家杰出青年基金、国家973计划、重点实验室等的支持。(来源:中国科学院生态环境研究中心)
[b]摘要[/b]组织的发生与再生依赖于细胞-细胞间相互作用和指向干细胞的信号以及它们的直接增殖。但是,引导组织适当再生的细胞行为还没有被很好的理解。运用一种新的,非侵入的双光子成像技术,我们研究了活鼠随时间推移的生理性毛囊再生。通过这种方法,我们监测了真皮层干细胞和它们的后代在生理性毛囊再生过程中的行为,并指出了间充质对它们行为的影响。承接早先的研究,干细胞在毛发再生的初始阶段处于静止状态而它们的后代处于更活跃的分生状态。除了细胞分化之外,后代细胞的协调运动也允许毛囊的快速扩张。最后,我们通过切蚀目标细胞的和长时间跟踪活毛囊展示了间充质对毛发再生的要求。因此,我们建立了一种直接原位观察毛囊内生长调控的细胞机制的方法,这使得我们可以精确调查生理性再生过程对毛囊组分的功能性要求。[b]材料与方法[/b]在原位成像中,对3周龄的小鼠通过腹膜内注射克他命和甲苯噻嗪进行麻醉,头部区域的皮肤使用机械剪毛器和脱毛膏剃光。小鼠被放在一个加热平台上,头部和耳朵通过一个自制固定台固定。一个玻璃盖被放在头耳结合部的皮肤上。皮肤的图像栈通过一台装配Chameleon Vision II (Coherent)双光子激光器的[color=#ff0000]TriM II Scope[/color][color=#ff0000](LaVision Biotech[/color][color=#ff0000])[/color]显微镜获取。一束激光(at 940 nm for GFP and 1040 nm for RFP, respectively)通过aX20水浸物镜((N.A. 1.0 Olympus)聚焦并以600Hz的频率扫描0.25到0.5mm2的视野区域。系列光学切片在5分钟内以步长2-3μm成像总深度100μm的组织。从静止阶段向生长阶段转变的几个相(静止相到生长初期相)被分析。在皮肤里使用不同的内在标记以在不同试验中定位到视野的初始区域并观察同一个毛囊。实验过程中通过鼻尖吸入气化异氟醚保持麻醉状态。三维双光子激光切蚀。使用同样的光学设备进行激光切蚀。使用900nm的激光束扫描一个10μm2的区域,以25%的激光能量持续1秒钟即可获得切蚀。根据目标深度(30-80 μm)调整切蚀参数。[b]主要结果[/b] [img=,655,507]http://qd-china.com/uploads/bio-product/11.jpg[/img]Figure 1 | 新的一次生长开始,细胞分化是在毛囊中进行空间调控的。a,静止状态毛囊。参与毛发再生的不同细胞群,包括干细胞,progeny和间充质,存在于定义的毛囊解剖隔层中。 b, 来源于双光子激光扫描显微镜系列光学切片的静止态活毛囊的三维重构。上皮细胞核(绿色)通过角蛋白14启动子(K14H2BGFP)驱动的H2B-GFP融合蛋白显影。 c, 一个progeny 分裂的例子。一个活毛囊的单独光学切片(左侧)和progeny 组分中三个处于有丝分裂期间细胞核的放大图(右侧,插图)。 d, 从几个处于早期生长阶段毛囊(n=17)中定量化细胞分裂的位置和轴 (生长初期 II)。e,垂直(左图)和水平(右图)方向干细胞分裂的两个例子。一个活毛囊的单独的光学切片(左侧插图)和处于有丝分裂中的干细胞隔层(右侧插图)的细胞核放大图。红色箭头,有丝分裂中的亲代核与子代核。图片的时间推移分别为15分钟和45分钟。标尺20 μm. [img=,629,446]http://qd-china.com/uploads/bio-product/12.jpg[/img]Figure 2 |生长过程中处于形态重组的干细胞progeny隔层. a, 毛囊生长中的向下伸展。生长状态的活毛囊三个连续时间点(3小时间隔)的光学切片,展示了progeny组分向下的伸展(左三) 。核间距增加,干细胞和progen隔层(大约生长初期 II to IIIa)中的总细胞数被定量。 (右侧, 数据表示为mean±s.e.m. (n=13-20 asterisk, P 0.0001) b,毛囊内的核重组.两个光学切片(左侧)分别跟踪和测量了同一毛囊在0时刻和4h时的(右侧)冠面和切面(xy and xz)(大约生长初期II to IIIa)(底图)。c, 生长中毛囊的向下迁移。单一光学切片表明了单个毛囊在1小时间隔连续时间点的完整的(左侧)和下部局部视图(上侧)。光学切片中的红色箭头和相应的跟踪标记了一个正在向下移动的核,5h内走过了30μm(大约生长初期IIIb)。在0h所展示的绿色核的位置以灰色表示用来比较(右下方图)。标尺20μm. [img=,575,588]http://qd-china.com/uploads/bio-product/13.jpg[/img]Figure 3 | 间充质皮肤乳头的切蚀削弱了毛发再生的启动. a, 实验设计,使用激光诱导皮肤乳头细胞切蚀来测试间充质对毛发再生的要求。b, 切蚀皮肤乳头细胞的活毛囊四个时间点的高放大率光学切片。c,包含少数切蚀皮肤乳头细胞的活毛囊的一群毛囊(黄色箭头)在三个时间点的低放大率光学切片。d,两个progeny被部分切蚀的毛囊在3个时间点的低放大率光学切片。e,切蚀皮肤乳头(上)或部分切蚀progeny隔层(下)的毛囊(作为毛囊的总长度测量)生长与对照完整毛囊的量化比较。数据表示为mean±s.e.m. (n=8-10 asterisk, P 0.0001).标尺50 μm. [img=,566,365]http://qd-china.com/uploads/bio-product/14.jpg[/img]Figure 4 | 毛囊再生的细胞机制。毛发再生的初始阶段,干细胞progeny是启动增殖的第一隔层。虽然分化数量少于干细胞progeny,但是隆突内部也检测到了细胞的分化。子代隔层是沿毛囊生长的轴向分化,而隆突内的分化方向则是随机的。毛囊经历了一个向下的延伸,其中子代内而不是干细胞隔层内的核间距增加。围绕间充质皮肤乳头的上皮细胞核重新排列并围绕间充质压缩。间充质的切蚀导致了毛囊生长的减弱。
[font=&][size=14px]质谱成像(Imaging Mass Spectrometry, IMS)这种最新原位分析技术主要是利用质谱直接扫描生物样品,分析分子在细胞或组织中的“结构、空间与时间分布”信息。其基本流程(以质谱分析生物组织标记物为例)见下: [color=#333333] [/color][/size][/font][img]https://file.jgvogel.cn/134/upload/resources/image/406626.jpeg?x-oss-process=image/resize,w_700,h_700[/img][font=&][size=14px]简单而言,质谱成像技术就是借助于质谱的方法,再配套上专门的质谱成像软件控制下,使用一台通过测定质荷比来分析生物分子的标准分子量的质谱仪来完成的。但是随着这项技术的不断发展,也陆续出现了许多针对各种问题的新技术。[/size][/font][font=&][size=14px]最早的质谱成像技术是基质辅助激光解吸电离(MALDI,matrix assisted laser desorption ionization)质谱分子成像技术,由范德堡大学(Vanderbilt University)的Richard Caprioli等在1997年提出,他们通过将MALDI质谱离子扫描技术与专业图像处理软件结合,直接分析生物组织切片,产生任意指定质荷比(m/z)化合物的二维离子密度图,对组织中化合物的组成、相对丰度及分布情况进行高通量、全面、快速的分析,可通过所获得的潜在的生物标志物的空间分布以及目标组织中候选药物的分布信息,来进行生物标志物的发现和化合物的监控。[/size][/font][font=&][size=14px]正如数字图像包括三个通道:红,绿,蓝一样(单个亮度定义了每个像素的颜色),质谱成像也包含了数以千计的通道,每一个对应于一个特殊的光谱峰值,“你可以通过质谱方法从这些像素中获得任何信号,然后调整图像中所需分子像素的相对亮度,最后,得到一张分子特异性的成像图。”[/size][/font][font=&][size=14px]这种方法可用于小分子代谢物,药物化合物,脂质和蛋白,而且,质谱成像能相对快速的利用许多分子通道,完全无需特殊抗体,下面列出五种先进的质谱成像方法。[/size][/font][font=&][size=14px]1、MALDI质谱分子成像技术[/size][/font][font=&][size=14px]在对组织或生物体进行成像,分析小分子构成的时候,有一个“拦路虎”总是阻碍实验的进程,那就是多肽,这些多肽体积十分大,要想对它们进行分子成像几乎是不可能的,比如,想要研究肿瘤边缘的分子微环境,如果直接成像是不可能获得清晰图像的。[/size][/font][font=&][size=14px]来自范德堡大学的质谱方法专家Richard Caprioli博士因此发明了基质辅助激光解吸电离(MALDI)质谱分子成像技术,这项技术不局限于特异的一种或者几种蛋白质分子,它可在组织切片中找到每一种蛋白质分子,并提供这些蛋白质分子在组织中的空间分布的精确信息,而事先无需知道所检测蛋白的信息。同时,可对这些蛋白质分子含量进行相对定量。[/size][/font][font=&][size=14px]MALDI质谱分子成像是在专门的质谱成像软件控制下,使用一台通过测定质荷比来分析生物分子的标准分子量的质谱仪来完成的。被用来研究的组织首先经过冰冻切片来获得极薄的组织片,接着用基质封闭组织切片并将切片置入质谱仪的靶上。通过计算机屏幕观察样品,利用MALDI系统的质谱成像软件,选择拟成像部分,首先定义图像的尺寸,根据尺寸大小将图像均分为若干点组成的二维点阵,来确定激光点轰击的间距。激光束通过这个光栅图案照射到靶盘上的组织切片,软件控制开始采集质谱数据,在质谱仪中,激光束对组织切片进行连续的扫描,组织样品在激光束的激发下释放出的分子被质谱仪所鉴定从而获得样品上每个点的质荷比(m/z)信息,然后将各个点的分子量信息转化为照片上的像素点。在每个点上,所有质谱数据经平均化处理获得一幅代表该区域内化合物分布情况的完整质谱图。仪器逐步采集组织切片的质谱数据,最后得到具有空间信息的整套组织切片的质谱数据。这样就可以完成对组织样品的“分子成像”。设定m/z的范围,即可确定该组织区域所含生物分子的种类,并选定峰高或者峰面积来代表生物分子的相对丰度。图像中的彩色斑点代表化合物的定位,每个斑点颜色的深浅与激光在每一个点或像素上检测到的信号大小相关。[/size][/font][font=&][size=14px]通过增加单位面积上轰击的激光点数量和像素,研究人员可以获得更多的样品信息,例如,采用4000像素比200像素能够得到更好的样品图像。质谱分子成像技术是一种半定量或相对定量技术,图像上颜色深的部分表明有更多的生物分子聚集在组织的这个部分,然而,不可能据此确定生物分子在组织的不同部位的实际绝对含量。选择组织图像上的任意一个斑点,图像都能够给出一个质谱谱图或者离子谱图,代表在组织的该部位存在这种生物分子,然后,与做指纹图谱类似,像做指纹图谱那样,将样品的离子谱图与已知标准品进行对照,分析差异,从而进行生物标志物的发现和药物作用的监控。[/size][/font][font=&][size=14px]2、电喷雾电离技术[/size][/font][font=&][size=14px]一般质谱成像方法由于体积庞大,重量重,需要冗长的样品准备阶段,因此,并不适用于即时成像(bed side applications),比如,要帮助外科医生进行实时的肿瘤边界成像监控,那么就要寻找新的方法了。[/size][/font][font=&][size=14px]一种称为电喷雾电离技术(desorption electrospray ionization,DESI)的MS成像技术解决了这个问题。DESI技术于2004年首次提出,由于这一方法具有样品无需前处理就可以在常压条件下,从各种载物表面直接分析固相或凝固相样品等优势而得到了迅速的发展。[/size][/font][font=&][size=14px]这种方法的原理是带电液滴蒸发,液滴变小,液滴表面相斥的静电荷密度增大。当液滴蒸发到某一程度,液滴表面的库仑斥力使液滴爆炸。产生的小带电液滴继续此过程。随着液滴的水分子逐渐蒸发,就可获得自由徘徊的质子化和去质子化的蛋白分子DESI与另外一种离子源:SIMS(二次离子质谱)有些相似,只是前者能在大气压下游离化,发明这项技术的普渡大学Cooks博士认为DESI方法其实就是一种抽取方法,即利用快速带电可溶微粒(比如,水或者乙腈acetonitrile)进行离子化,然后冲击样品,获得分析物的方法。[/size][/font][font=&][size=14px]DESI系列产品最大的优势就在于无需样品处理,一般质谱和高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]分析,样品必须经过特殊的分离流程才能够进行分析检测,使得一次样品检测常常需要约一个小时,而DESI系列产品可将固体样品直接送入质谱,溶液被喷射到检测表面,促使样品离子均匀分布。采用这一手段的质谱分离过程,只需3分钟左右即可完成。[/size][/font][font=&][size=14px]3、APIR MALDI/LAESI技术[/size][/font][font=&][size=14px]了解细胞的内部成分是理解健康细胞不同于病变细胞的关键,但是,直到目前为止,唯一的方法是观察单个细胞的内部,然后将其从动物或植物中移除,或者改变细胞的生存环境。但是这么做的话,会使细胞发生变化。科学家还不是很清楚一个细胞在病变时与健康细胞的差别,或者当它们从一个环境移到另一个环境中产生的变化。[/size][/font][font=&][size=14px]来自华盛顿大学Akos Vertes教授希望能从另外一个方面来进行活细胞分析,在他的一项关于活叶样品中初级和次级代谢产物分布的研究中,研究人员发现叶片中积累基质很厚,常导致光谱末端低分子量部分模糊,而且基质辅助激光解析电离(MALDI)质谱分析需要在真空中进行,但是,活体样本在真空中无法存活。[/size][/font][font=&][size=14px]实际上,MALDI质谱分析的原理是将分析物分散在基质分子中并形成晶体,当用激光照射晶体时,由于,基质分子经辐射所吸收的能量,导致能量蓄积并迅速产热,从而使基质晶体升华,致使基质和分析物膨胀并进入[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相[/color][/url]。而生物样品也可以直接吸收能量的,比如,2.94mm波长的光能激活水中氢氧键。[/size][/font][font=&][size=14px]因此,Vertes等人想到复合两种技术来解决这一问题。首先他们利用大气压红外线(an atmosphericpressure infrared,APIR)MALDI激光直接激活组织中的水分,使样品气化,就像是组织表面发生了细胞大小的核爆炸,从而获得了离子化微粒,进入质谱中进行分析。但是并不是所有的气化微粒都带电,大部分其实是不带电的,会被APIR MALDI遗漏。[/size][/font][font=&][size=14px]为了捕捉这些中性粒子,Vertes等人采用了第二种方法:[/size][/font][font=&][size=14px]LAESI(laser ablation electrospray ionization,激光烧蚀电喷雾电离),这种方法能捕捉大量带电微滴的微粒,然后重新电离化。通过对整个样品进行处理,复合这两种方法,就能覆盖更多的分子,分析质量更高。[/size][/font][font=&][size=14px]与一般质谱成像过程不同,Verte的方法还在成像中增加了高度,从而实现了3D代谢物成像。这项技术的分辨率是直径10mm,高度30mm,这与生物天然的立体像素相吻合,这样科学家们就可以获得天然构像。[/size][/font][font=&][size=14px]4、二次离子质谱技术[/size][/font][font=&][size=14px]质谱成像技术能将基质辅助激光解吸电离质谱的离子扫描与图像重建技术结合,直接分析生物组织切片,产生任意质荷比(m/z)化合物的二维或三维分布图。其中三维成像图是由获得的质谱数据,通过质谱数据分析处理软件自动标峰,并生成该切片的全部峰值列表文件,然后成像软件读取峰值列表文件,给出每个质荷比在全部质谱图中的命中次数,再根据峰值列表文件对应的点阵坐标绘出该峰的分布图。[/size][/font][font=&][size=14px]但是,一般的质谱成像技术不能对一些携带大分子碎片的化学成分进行成像,来自宾夕法尼亚州州立大学的NicholasWinograd教授改进了一种称为二次离子质谱(SIMS,secondary ion mass spectrometry)的方法,可以对样品进行完整扫描,三维成像。[/size][/font][font=&][size=14px]SIMS早在用于生物学研究之前就已经应用广泛了,比如,分析集成电路(integratedcircuits)中的化学成分,这种质谱技术是表面分析的有利工具,能检测出微小区域内的微量成分,具有能进行杂质深度剖析和各种元素在微区范围内同位素丰度比的测量能力。[/size][/font][font=&][size=14px]这种技术具有几个优点:[/size][/font][font=&][size=14px]速度快(-10,000 spectra per second),亚细胞构造分辨率(-100nm),以及不需要基质。但是另外一方面,不同于MALDI方法,SIMS方面不是一种“软”技术,这种方法只能对小分子成像,因此常常需要进行粉碎。[/size][/font][font=&][size=14px]Winograd教授改进了这一方法,他利用了一种新型SIMS光束(carbon-60磁性球),这种新光束比传统的SIMS光束对物体的化学损伤更小。C60同时撞击样品表面,类似于“一阵爆炸”,这样重复的轰击使得研究人员能深入样品,进行三维分子成像,Winograd教授称这个过程是“分子深度成像”(molecular depth profiling)。[/size][/font][font=&][size=14px]C60的能量与其它的离子束相当,却不到达样品表面以下,这样样品可以连续地被逐层剥离,研究人员就可以得到纵面图形,最终获得三维的分子影像。Winograd教授等人用含有肽的糖溶液将硅的薄片包裹起来并进行SIMS实验,随着薄膜逐渐被C60剥蚀,可以获得糖和肽的稳态信号。最终,薄膜完全剥离后就可以获得硅的信号。如果用其它的射线或原子离子代替C60,粒子束会快速穿过肽膜而无法提供有关生物分子的信息。因此,这种方法具有良好的空间分辨率,能够获得巨噬细胞和星型细胞的细胞特征和分析物的分布情况。[/size][/font][font=&][size=14px]这里还要说到一点,SIMS和上一技术(APIR MALDI/LAESI技术)都可以对三维成像,但两者也有差别,SIMS方法中,采用高能离子轰击样品,逐出分析物离子(二级离子),离子再进入质量分析器。MALDI方法则用激光辐射样品使之离子化,另外SIMS探针可以探测到100nm的深度,能提供纳米级的分辨率,而MALDI可以探测更深,但空间分辨率较低。[/size][/font][font=&][size=14px]5、纳米结构启动质谱技术[/size][/font][font=&][size=14px]质谱在检测生物分子方面有很大潜力,但现有方法仍存在一些缺陷,灵敏度不够高和需要基质分子促使分析对象发生离子化就是其中之二。比如说,需要溶解或者固定在基质上的方法检测代谢物,较易错判,因为这些代谢物与那些基质常常看上去都一样。另外基于固定物基质的系统也不允许研究人员精确的判断出样品中某一分子到底来自于哪儿。[/size][/font][font=&][size=14px]来自斯克利普斯研究院的Gary Siuzdak博士发明了一种称为纳米结构启动质谱(nanostructure-initiator mass spectrometry,NIMS)的新技术,这种技术能以极高的灵敏度分析非常小的区域,从而允许对肽阵列、血液、尿和单个细胞进行分析,而且还能用于组织成像。 [/size][/font][font=&][size=14px]NIMS利用了一种特制的表面,这种多孔硅表面上聚集了一种含氟聚合物,这些分子在受到激光或离子束照射时会猛烈爆发,这种爆发释放出离子化的分析物分子,它们被吸收到表面上,使其能够被检测到。这种方法利用激光或离子束来从纳米尺度的小囊中气化材料,从而克服了一般质谱方法缺少所需的灵敏度和需要基质分子促使分析对象发生离子化的缺陷。 [/size][/font][font=&][size=14px]通过这种方法可以分析很多类型的小分子,比如,脂质,糖类,以及类固醇,虽然每一种分析材料需要的含氟聚合物有少许差别,但是这是一种一步法的方法,比MALDI简单多了——后者需要固定组织,并添加基质。 [/size][/font][font=&][size=14px]由于,含氟聚合物不能很好的离子化,因此,会发生轻微的光谱干扰,而且由于离子化过程是“软性”的——就像MALDI,所以NIMS产生的生物分子是整块离子化,而不是片段离子化。不过这种技术对于完整蛋白的检测灵敏度没有MALDI高[/size][/font]