
酶标仪测定特定蛋白的蛋白含量-ELISA实验步骤[img]https://ng1.17img.cn/bbsfiles/images/2023/06/202306301442498094_2367_5389809_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2023/06/202306301442501323_8948_5389809_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2023/06/202306301442504164_1052_5389809_3.png[/img]
[font=宋体]重组蛋白的表达(尤其是使用细菌载体和宿主)是一项成熟的技术。难点在于如何将其以活化形式分离。[/font][font=宋体] [/font][font=宋体]重组蛋白的纯化是生物学研究中的重要技术。为了研究蛋白的特定功能和结构,研究人员必须将重组蛋白从生物体中分离并纯化。蛋白纯化方法主要利用不同重组蛋白之间的相似性和差异性。可以根据蛋白之间的相似性去除非蛋白物质,然后根据蛋白之间的差异分离纯化目标重组蛋白。[/font][font=宋体] [/font][font=宋体][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/protein-tag][b]蛋白标签[/b][/url]是一种可以提高重组蛋白的溶解度、简化蛋白纯化的简单有效的工具,并通过简单的方法跟踪蛋白表达和纯化过程。此外,蛋白标签是追踪活细胞中蛋白和进程的一种有效工具,可以通过显微镜直接跟踪或者通过[/font][font=Calibri]Western blot[/font][font=宋体]、免疫沉淀或免疫染色间接进行跟踪。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]蛋白纯化的原理:[/b][/font][font=宋体]不同的重组蛋白具有不同的氨基酸序列和空间结构,导致其物理、化学和生物学特性存在差异。我们也可以根据目标蛋白与其他蛋白和裂解液的性质差异设计合理的蛋白纯化方案。[/font][font=宋体] [/font][font=宋体][font=宋体]大多数的纯化方案需要不止一步才能达到理想的纯度水平。该过程中的每一步都会造成一定的产品损失,假设每一步的获得率为[/font][font=Calibri]80%[/font][font=宋体]。因此,建议尽可能减少纯化步骤。起始原料的选择是纯化过程设计的关键。[/font][/font][font=宋体] [/font][font=宋体]在背景信息、检测方法和样品规格都已到位的情况下,可以考虑采用三阶段纯化策略。纯化分为捕获、中度纯化和精细纯化三个阶段,每个阶段都有特定的目标。捕获阶段的目标是分离、浓缩和稳定目标产物。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b][url=https://cn.sinobiological.com/resource/protein-review/protein-purification]蛋白纯化[/url]操作步骤:[/b][/font][font=宋体]理想情况下,最终的纯化过程包括样品制备,其中包括在需要时进行萃取和澄清,然后进行上述捕获、中度纯化和精细纯化三个阶段的纯化。步骤的数量始终取决于所需的纯度和蛋白的预期用途。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供不同表达系统的蛋白纯化服务,有细菌系统蛋白纯化、哺乳动物瞬时系统蛋白纯化、杆状病毒系统蛋白纯化。详情可以参看:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification[/font][/font]
[font=宋体][font=宋体][url=https://cn.sinobiological.com/resource/protein-review][b]重组蛋白[/b][/url]([/font][font=Calibri]recombinant protein[/font][font=宋体])技术原理是现代生物技术的核心之一,它通过将目的基因插入到表达载体中,在宿主细胞中进行表达,从而获得所需的重组蛋白。这一技术的关键是选择合适的表达载体和宿主细胞,以确保目的基因的正确表达和蛋白质的正确折叠。重组蛋白技术的应用范围非常广泛,包括药物研发、疫苗生产、诊断试剂、生物治疗等领域。通过重组蛋白技术,我们可以快速、高效地获得具有特定结构和功能的蛋白质,为科学研究、医学和工业应用提供重要的工具和资源。[/font][/font][font=宋体] [/font][b][font=宋体] [/font][font=宋体]构建重组蛋白的技术路线主要包括以下几个步骤:[/font][/b][font=宋体] [/font][font=宋体]①目的基因的获取:根据所需蛋白质的氨基酸序列,设计并合成相应的基因片段,或者从基因文库中筛选出相应的基因。[/font][font=宋体]②表达载体的构建:将目的基因插入到表达载体中,常用的表达载体包括质粒、病毒等,它们可以在宿主细胞中进行复制和表达。[/font][font=宋体]③宿主细胞的选择:选择适合的宿主细胞,如细菌、酵母、昆虫、哺乳动物等,以确保目的基因的正确表达和蛋白质的正确折叠。[/font][font=宋体]④重组蛋白的表达:将构建好的表达载体转入宿主细胞,进行培养或诱导,使目的基因在细胞内表达,产生重组蛋白。[/font][font=宋体]⑤重组蛋白的纯化:通过各种分离纯化技术,如离心、过滤、沉淀、色谱等,将重组蛋白从细胞中提取出来,并进行纯化和精制。[/font][font=宋体]⑥重组蛋白的鉴定:通过各种检测技术,如质谱、免疫学检测等,对重组蛋白进行鉴定和质量控制。[/font][font=宋体]通过以上技术路线,可以构建出具有特定结构和功能的重组蛋白,为科学研究、医学和工业应用提供重要的工具和资源。[/font][font=宋体] [/font][b][font=宋体] [/font][font=宋体]重组蛋白技术应用:[/font][/b][font=宋体] [/font][font=宋体]一、药物研发与生产:[/font][font=宋体]靶点验证:在药物研发初期,可以使用重组蛋白来验证药物作用的靶点。[/font][font=宋体]抗体药物:利用重组蛋白技术可以生产人源化抗体,用于癌症治疗、自身免疫性疾病治疗等。[/font][font=宋体]直接药物:某些重组蛋白本身就是药物,如胰岛素、生长激素等。[/font][font=宋体]二、疫苗开发:[/font][font=宋体]基因工程疫苗:使用重组蛋白技术生产疫苗,例如针对乙肝、流感等疾病的疫苗。[/font][font=宋体]三、诊断试剂:[/font][font=宋体][font=宋体]免疫检测:重组蛋白可以用作抗原或抗体,用于各种免疫检测技术,如[/font][font=Calibri]ELISA[/font][font=宋体]、免疫荧光等。[/font][/font][font=宋体]四、生物治疗:[/font][font=宋体]细胞因子:重组蛋白技术可以生产各种细胞因子,用于促进细胞生长、分化、凋亡等。[/font][font=宋体]五、基础研究:[/font][font=宋体]结构生物学:利用重组蛋白研究蛋白质的结构与功能关系。[/font][font=宋体]信号转导研究:通过重组蛋白研究细胞内信号转导过程。[/font][font=宋体]六、其他应用:[/font][font=宋体]酶工程:生产具有特定性质的酶。[/font][font=宋体]七、农业应用:如生产抗虫作物或具有特定性状的动物。[/font][font=宋体]通过以上几个方面,重组蛋白技术在生物医药领域中发挥着越来越重要的作用,为疾病治疗、疫苗开发、基础研究等提供了有力的技术支持。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供重组蛋白纯化服务:[/font][font=Calibri]https://cn.sinobiological.com/services/recombinant-protein-expression-service[/font][/font][font=宋体][font=宋体]更多重组蛋白详情可以以关注义翘神州:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b][font=宋体] [/font][font=Calibri] [/font]
[font=宋体]在现代生命科学研究中,[url=https://cn.sinobiological.com/resource/protein-review/protein-production][b]重组蛋白表达技术[/b][/url]扮演着至关重要的角色。通过将外源基因导入宿主细胞,并使其表达特定蛋白,我们能够获取大量高纯度的重组蛋白,为疾病治疗、药物研发和生物工程等领域提供了强有力的支持。本文将介绍重组蛋白表达的原理、表达系统、生产步骤以及应用前景。[/font][font=宋体][b]一、重组蛋白表达的原理[/b][/font][font=宋体][font=宋体]重组蛋白表达是利用[/font][font=Calibri]DNA[/font][font=宋体]重组技术,将目标基因(外源基因)导入宿主细胞中,并通过宿主细胞的生物机制使其表达出特定蛋白。其主要步骤包括:[/font][/font][font=宋体][font=宋体]基因克隆:将目标基因经过[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]扩增后,与表达载体连接,形成重组质粒。[/font][/font][font=宋体]转染或转化:将重组质粒导入宿主细胞中,可以使用化学方法、电穿孔或者嗜热菌等方式进行转染或转化。[/font][font=宋体]表达蛋白:重组质粒进入宿主细胞后,融合到宿主细胞的染色体中,随后遵循细胞的转录和翻译机制,表达出目标蛋白。[/font][font=宋体] [/font][b][font=宋体]二、常见的重组蛋白表达系统[/font][/b][font=宋体]大肠杆菌表达系统:大肠杆菌是常用的重组蛋白表达宿主细胞之一。其优点在于生长快速、易于培养,并且能够产生大量的蛋白。此外,大肠杆菌的遗传工具和代谢途径也被广泛研究,提供了便利。[/font][font=宋体]酵母表达系统:酵母表达系统包括酿酒酵母和毕赤酵母。这些酵母细胞具有真核细胞的特点,能够进行正确的蛋白折叠和修饰。同时,酵母细胞也可以进行大规模培养和高表达,适用于一些复杂蛋白的表达。[/font][font=宋体]昆虫细胞表达系统:昆虫细胞表达系统常用于大规模蛋白表达。昆虫细胞具有真核细胞的优势,能够对蛋白进行正确的折叠和修饰,适合于表达大量需求复杂结构的重组蛋白。[/font][font=宋体]哺乳动物细胞表达系统:哺乳动物细胞的表达系统可用于高效表达复杂蛋白和进行蛋白质研究。哺乳动物细胞具有真核细胞特点,能够进行正确的蛋白质修饰和折叠,并且在一些特殊情况下需要考虑到人类蛋白的免疫原性。[/font][font=宋体] [/font][font=宋体][b]三、重组蛋白生产步骤[/b][/font][font=宋体] [/font][font=宋体]细胞中有两个蛋白生产阶段:转录和翻译,被称为分子生物学的中心法则。换言之,转录和翻译步骤属于重组蛋白表达步骤。[/font][font=宋体] [/font][font=宋体]为了生产重组蛋白,基因被分离并克隆到表达载体中。重组蛋白的生产需要蛋白表达系统、蛋白纯化系统和蛋白识别系统。[/font][font=宋体] [/font][font=宋体][b]获取重组蛋白的基本步骤:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]目标基因的扩增。[/font][/font][font=宋体][font=Calibri]2.[/font][font=宋体]插入克隆载体。[/font][/font][font=宋体][font=Calibri]3.[/font][font=宋体]亚克隆到表达载体中。[/font][/font][font=宋体][font=Calibri]4.[/font][font=宋体]转化到蛋白表达宿主中[/font][font=Calibri]([/font][font=宋体]细菌[/font][font=Calibri]([/font][font=宋体]大肠杆菌[/font][font=Calibri])[/font][font=宋体]、酵母细胞、哺乳动物细胞或杆状病毒[/font][font=Calibri]-[/font][font=宋体]昆虫细胞系统[/font][font=Calibri])[/font][font=宋体]。[/font][/font][font=宋体][font=Calibri]5.[/font][font=宋体]重组蛋白鉴定试验[/font][font=Calibri](Western blot[/font][font=宋体]或荧光[/font][font=Calibri])[/font][/font][font=宋体][font=Calibri]6.[/font][font=宋体]大规模生产。[/font][font=Calibri]([/font][font=宋体]大规模发酵[/font][font=Calibri])[/font][/font][font=宋体][font=Calibri]7.[/font][font=宋体]分离和纯化。[/font][/font][font=宋体] [/font][font=宋体]需要考虑多种因素:[/font][font=宋体][font=Calibri]1.[/font][font=宋体]选择哪个宿主系统?[/font][/font][font=宋体][font=Calibri]2.[/font][font=宋体]如何分离和纯化重组蛋白?[/font][/font][font=宋体] [/font][font=宋体]选择适当的表达宿主或使用正确的纯化方法并不容易,应考虑目标重组蛋白的性质。下面列出了一些重要因素:[/font][font=宋体] [/font][font=宋体]? 膜结合[/font][font=宋体]? 溶解度[/font][font=宋体]? 单或多结构域[/font][font=宋体][font=宋体]? 大小[/font][font=Calibri]([/font][font=宋体]分子量[/font][font=Calibri])[/font][/font][font=宋体]? 表达位置[/font][font=宋体] [/font][font=宋体][font=宋体]对于大多数没有足够经验来表达和分离重组蛋白的人来说,重组蛋白的生产是非常耗时的。许多生物公司为各种不同规模的重组蛋白表达提供良好的服务:[/font][font=Calibri]https://cn.sinobiological.com/services/recombinant-protein-expression-service[/font][font=宋体],例如义翘神州[/font][/font][font=宋体] [/font][font=宋体][b]四、重组蛋白表达技术的应用前景[/b][/font][font=宋体]药物研发:重组蛋白表达技术被广泛应用于药物研发领域,用于生产重组蛋白药物。这些药物包括多肽类、蛋白类和抗体类药物,如生长因子、抗体药物和血液制剂等。通过重组蛋白表达技术,我们可以获得高效纯度的药物,满足临床上的需求。[/font][font=宋体]生物工程:重组蛋白表达技术被广泛应用于生物工程领域,用于生产特定的蛋白产品。这些产品可以应用于食品、化妆品、工业发酵等领域,如酶制剂、生物染料和生物材料等。[/font][font=宋体]疾病治疗:通过重组蛋白表达技术,我们能够合成特定的蛋白,用于疾病的治疗和诊断。例如,利用重组抗体技术,可以开发出用于癌症治疗和免疫治疗的抗体药物。[/font][font=宋体] [/font][font=宋体][font=宋体]详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-production[/font][/font]
核酸蛋白检测仪是层析分析的主要装置,核酸蛋白检测仪配上层析柱、恒流泵、部分收集器、层析谱分析系统(根据需要选配)和电脑打印设备即构成一套完整的核酸蛋白检测仪分离层析系统。它是当今从事生命科学研究、药物测定、化工、食品科学及医学研究等行业的现代分析实验仪器。核酸蛋白检测仪分析系统广泛用于工业、农业、科研和大专院校的科学研究和教学实验。其原理是根据物质(样品)对紫外光有明显吸收的特征,实现对样品成份含量比对分析,以便进行样品蛋白、核酸物质识别检测和含量测定。在生化分析、环保科学、食品研究、毒理研究、新药开发等领域中对核酸、蛋白检测、纯化和提取提供了一种独特的分析手段。
[font=宋体][b]蛋白纯化的原理:[/b][/font][font=宋体]不同的重组蛋白具有不同的氨基酸序列和空间结构,导致其物理、化学和生物学特性存在差异。我们也可以根据目标蛋白与其他蛋白和裂解液的性质差异设计合理的蛋白纯化方案。[/font][font=宋体] [/font][font=宋体][font=宋体]大多数的纯化方案需要不止一步才能达到理想的纯度水平。该过程中的每一步都会造成一定的产品损失,假设每一步的获得率为[/font][font=Calibri]80%[/font][font=宋体]。因此,建议尽可能减少纯化步骤。起始原料的选择是纯化过程设计的关键。[/font][/font][font=宋体] [/font][font=宋体]在背景信息、检测方法和样品规格都已到位的情况下,可以考虑采用三阶段纯化策略。纯化分为捕获、中度纯化和精细纯化三个阶段,每个阶段都有特定的目标。捕获阶段的目标是分离、浓缩和稳定目标产物。[/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体]蛋白纯化实际操作:[/font][/b][font=宋体] [/font][font=宋体]理想情况下,最终的纯化过程包括样品制备,其中包括在需要时进行萃取和澄清,然后进行上述三个阶段的纯化。步骤的数量始终取决于所需的纯度和蛋白的预期用途。[/font][font=宋体] [/font][font=宋体][font=宋体]分析纯化通常利用三个特性来分离蛋白。首先,蛋白可以通过[/font][font=Calibri]pH[/font][font=宋体]梯度凝胶或离子交换柱,根据其等电点进行纯化。其次,根据蛋白大小或分子量,可以通过体积排除色谱法分离或通过[/font][font=Calibri]SDS-PAGE([/font][font=宋体]十二烷基硫酸钠[/font][font=Calibri]-[/font][font=宋体]聚丙烯酰胺凝胶电泳[/font][font=Calibri])[/font][font=宋体]分析。通常采用[/font][font=Calibri]2D-PAGE[/font][font=宋体]对蛋白进行纯化,然后进行肽质量指纹图谱分析,以确定蛋白的特性。这对于实现科学目的非常有用,目前蛋白的检测限非常低,纳克级的蛋白足以用于分析。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]如何应用纯化原则:[/b][/font][font=宋体]①纯化技术的选择和组合:[/font][font=宋体]这种组合的目的是发展出一条最快的方法来获得所需纯度的产品。对于任何色谱分离来说,不同的技术在回收率、分辨率、速度和容量方面的表现都各不相同。我们可以对一种技术进行优化,使其专注于其中一个参数;例如分辨率要在速度和容量两个参数之间达到最佳。[/font][font=宋体] [/font][font=宋体]分辨率是通过技术的选择和色谱基质产生窄峰的效率来实现的。一般来说,此时目标蛋白和杂质具有非常相似的性质,分辨率是最难实现的。[/font][font=宋体] [/font][font=宋体][font=宋体]②标签蛋白的纯化[/font][font=Calibri]:[/font][/font][font=宋体][font=宋体]在蛋白中添加标签可以使蛋白具有它本来不具有的结合亲和力。通常重组蛋白是混合物中唯一具有这种亲和力的蛋白,有助于蛋白分离。最常见的标签是对镍或钴离子有亲和力的组氨酸标签([/font][font=Calibri]His[/font][font=宋体]标签)。因此,我们通过将镍离子或钴离子固定在树脂上,可以创建与组氨酸标签蛋白特异性结合的亲和介质。[/font][/font][font=宋体] [/font][font=宋体]③评估纯化产量:[/font][font=宋体][font=宋体]通常使用[/font][font=Calibri]SDS PAGE[/font][font=宋体]监测纯化过程中的不同步骤。这一方法只能粗略地测量混合物中不同蛋白的量,并且无法区分具有相似分子量的蛋白。为了评估多步纯化的过程,必须将特定蛋白的量与总蛋白的量进行比较。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]蛋白表达纯化实验中注意事项有哪些?[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1. [/font][font=宋体]选择表达载体时,要根据所表达蛋白的最终应用考虑。如为方便纯化,可选择融合表达;如为获得天然蛋白,可选择非融合表达。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2. [/font][font=宋体]融合表达时在选择外源[/font][font=Calibri]DNA[/font][font=宋体]同载体分子连接反应时,对转录和转译过程中密码结构的阅读不能发生干扰。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3. [/font][font=宋体]菌液[/font][font=Calibri]OD[/font][font=宋体]值要小于[/font][font=Calibri]1[/font][font=宋体],否则细胞太浓太老,不易破碎,且质粒易丢失。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4. [/font][font=宋体]诱导时间最好做一个梯度,不同蛋白诱导时间需摸索。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5. [/font][font=宋体]诱导温度适当摸索。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]6. IPTG[/font][font=宋体]浓度:一般在[/font][font=Calibri]1 mM [/font][font=宋体]以内,可适当摸索。[/font][/font][font=宋体] [/font][font=宋体]7. [/font][font=宋体]超声条件可视实际情况改变,只要使菌体裂解充分即可,即菌液清亮不粘稠。[/font][font=宋体][b]义翘神州提供[/b][url=https://cn.sinobiological.com/services/e-coli-protein-expression-service][b]原核蛋白纯化服务[/b][/url][b],服务内容包括:[/b][/font][font=宋体]①基因合成及密码子优化[/font][font=宋体]②载体构建[/font][font=宋体]③表达鉴定和可溶性分析[/font][font=宋体][font=宋体]④放大表达和[/font][font=Calibri]1-2[/font][font=宋体]步纯化[/font][/font][font=宋体]⑤大量表达及纯化[/font][font=宋体] [/font][font=宋体][font=宋体]更多详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/e-coli-protein-expression-service[/font][/font]
[font=宋体]蛋白质是生物体的基本组成部分,参与各种生物过程。为了更好地理解和操控这些过程,科学家们开发了多种技术来分离和纯化蛋白质。其中,标签蛋白沉淀技术是一种非常有效的方法,它通过将特定的标签连接到目标蛋白上,利用标签的特性将其与其他蛋白分离开来。这项技术的优点在于其高特异性和高纯度,使得研究人员能够获得高质量的蛋白质样品,以进行进一步的分析和研究。在生物科学领域,[b]标签蛋白沉淀技术[/b]已成为一项关键技术,它有助于我们更好地理解生命的基本过程以及开发新的治疗方法。标签蛋白沉淀技术步骤:[/font][font=宋体] [/font][font=宋体][font=宋体]①这一技术的核心在于对目标蛋白进行巧妙的改造。我们通过在蛋白编码序列中嵌入特定的标签或标记(例如[url=https://cn.sinobiological.com/resource/protein-review/gst-tag-protein-expression][b]谷胱甘肽[/b][/url][/font][font=Calibri][url=https://cn.sinobiological.com/resource/protein-review/gst-tag-protein-expression][b]S-[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/gst-tag-protein-expression][b]转移酶[/b][/url],[/font][font=Calibri][url=https://cn.sinobiological.com/resource/protein-review/poly-his-tag-protein-expression][b]His[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/poly-his-tag-protein-expression][b]标签[/b][/url],[/font][font=Calibri][url=https://cn.sinobiological.com/resource/protein-review/flag-tag-protein-expression][b]FLAG[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/flag-tag-protein-expression][b]标签[/b][/url]等),使目标蛋白在表达时能与标签紧密结合。[/font][/font][font=宋体] [/font][font=宋体]②我们将携带标签蛋白编码序列的表达载体导入适合的宿主细胞。在适当的培养条件下,宿主细胞高效地表达出目标蛋白。随后,通过细胞破碎技术释放出蛋白质。[/font][font=宋体] [/font][font=宋体]③核心环节——沉淀。利用标签与亲和配体间的特异性结合力,我们使用具有亲和性的树脂、磁珠或柱子将目标蛋白从混合物中分离出来。不同标签有其独特的亲和性,确保了蛋白的高纯度分离。[/font][font=宋体] [/font][font=宋体]④在成功沉淀目标蛋白后,我们通过洗涤步骤去除其他杂质和未结合的蛋白。最后,只需特定的洗脱条件,目标蛋白便能从亲和树脂上完全洗脱下来。[/font][font=宋体] [/font][font=宋体][font=宋体]⑤经过这一系列步骤,我们获得的蛋白纯净度极高,可进行各种后续分析,如[/font][font=Calibri]SDS-PAGE[/font][font=宋体]、质谱等。而这些高纯度蛋白在科学实验、药物研发、生物工程等领域具有广泛的应用前景。[/font][/font][font=宋体] [/font][font=宋体]值得注意的是,选择合适的标签和亲和树脂是这项技术的关键。同时,标签的引入可能会对蛋白的结构和功能产生影响,因此在实验设计时必须慎重考虑。[/font][font=宋体] [/font][font=宋体]总的来说,[url=https://cn.sinobiological.com/resource/protein-review/protein-tag][b]标签蛋白[/b][/url]沉淀技术以其精准、高效的特性,为蛋白质研究领域带来了革命性的突破。随着科学技术的不断进步,我们有理由相信这一技术将继续为生命科学领域带来更多突破性的发现。[/font][font=宋体] [/font][font=宋体][font=宋体]详情可以关注义翘神州[url=https://cn.sinobiological.com/resource/protein-review/protein-tag][b]蛋白标签[/b][/url]详情:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-tag[/font][/font]
[font=宋体]蛋白质是包括人类在内的各种生物有机体的重要组成成分,是生命的物质基础之一。生物体的生长、发育、遗传和繁殖等一切生命活动都离不开蛋白质。[/font][font=宋体] [/font][font=宋体]随着分子生物学、结构生物学、基因组学等研究的不断深入,人们意识到仅仅依靠基因组的序列分析来试图阐明生命活动的现象和本质是远远不够的。只有从蛋白质组学的角度对所有蛋白质的总和进行研究,才能更科学地掌握生命现象和活动规律,更完善地揭示生命的本质。[/font][font=宋体] [/font][font=宋体]由此许多学者将生命科学领域的研究焦点从基因转向蛋白质,使蛋白质成为揭示生命活动现象和分子生物学机理的重要研究对象。研究蛋白质首要的步骤是将目的蛋白从复杂的大分子混合物中分离纯化出来,得到高纯度具有生物学活性的目的物。因此,高效的纯化技术和手段是蛋白质研究的重要基础和关键之一。[/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体][font=宋体]蛋白纯化的目的[/font] [/font][/b][font=宋体][font=宋体]蛋白纯化的目的是将目标蛋白质从细胞裂解液的全部组分中分离出来,同时仍保留蛋白的生物学活性及化学完整性。蛋白质的分离和提纯工作是一项艰巨而繁重的任务,需根据蛋白的特性选择合适的纯化方法来提高获得的蛋白制品的纯度。[/font] [/font][font=宋体] [/font][b][font=宋体][font=宋体]蛋白纯化的原理[/font] [/font][/b][font=宋体][font=宋体]不同蛋白质的氨基酸序列及空间结构不同,导致其在物理、化学、生物学等性质上存在差异,利用待分离蛋白质与其它蛋白质性质上的差异,即可以设计出一套合理的蛋白纯化方案。蛋白的纯化大致分为粗分离阶段和精细纯化阶段两个阶段。粗分离阶段主要将目的蛋白和其他细胞成分如[/font] [font=Calibri]RNA[/font][font=宋体]、[/font][font=Calibri]DNA [/font][font=宋体]等分开,常用的方法为硫酸铵沉淀法。精细纯化阶段的目的是把目的蛋白与其他大小及理化性质接近的蛋白区分开来,[/font][/font][b][font=宋体][font=宋体]常用的方法有:凝胶过滤层析、离子交换层析、疏水层析、亲和层析等。[/font] [/font][/b][font=宋体] [/font][b][font=宋体]①[/font][font=宋体]凝胶过滤层析[/font][/b][font=宋体]凝胶过滤层析(又叫做分子筛)是根据样品的分子大小对样品进行分离的一种简单温和的层析技术。凝胶过滤层析也称分子筛层析、排阻层析,是利用具有网状结构的凝胶的分子筛作用,根据被分离物质的分子大小不同来进行分离。不同于离子交换层析和亲和层析,凝胶过滤的层析样品不与层析柱料结合,因此,缓冲液成分不直接影响分辨率。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]原理:层析柱中的填料是球状颗粒的惰性的多孔网状结构的柱料,多是交联的聚糖[/font][font=Calibri]([/font][font=宋体]如葡聚糖或琼脂糖[/font][font=Calibri])[/font][font=宋体]类物质。在加入样品之后,样品中的小分子物质能进入球状填料内部,在柱子中停留时间较长;而大分子物质不能进入球状填料内部,停留时间较短。所以当样品经过凝胶过滤层析柱分离后,样品中的不同分子大小的物质就可以被分离开了。[/font][/font][font=宋体] [/font][font=宋体]特点:[/font][font=宋体] [/font][font=宋体]根据分子大小和形状进行分离[/font][font=宋体] [/font][font=宋体]是一种非吸附的分离方式[/font][font=宋体] [/font][font=宋体]缓冲液成分不直接影响分辨率,只需要一种缓冲液[/font][font=宋体] [/font][font=宋体]操作便捷[/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体]②[/font][font=宋体]离子交换层析[/font][/b][font=宋体]离子交换层析是目前蛋白质分离纯化中应用最广泛的方法之一。[/font][font=宋体] [/font][font=宋体]原理:不同蛋白等电点差异,分子大小差异,在同一个流动相中电荷密度分布不同,电荷量不等,与具有相反电荷的离子交换介质结合强度不同,在流动相洗脱时保留时间不同,从而得以分离。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体]特点:[/font][font=宋体] [/font][font=宋体]根据分子大小和等电点差异进行分离[/font][font=宋体] [/font][font=宋体]灵敏度高,重复性,选择性好,分析速度快[/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体]③[/font][font=宋体]疏水层析[/font][/b][font=宋体]原理:疏水层析是依据蛋白质疏水性差异分离的。即根据蛋白质和疏水介质表面的疏水基团的可逆相互作用进行分离。蛋白的疏水性在高离子强度下被增强,因此在高离子强度环境中结合,通常采用降低离子强度的方式进行洗脱。独特的吸附分离模式使得疏水层析成为硫酸铵盐析后或离子交换高盐洗脱后理想的纯化方式。[/font][font=宋体] [/font][font=宋体]特点:[/font][font=宋体] [/font][font=宋体]采用了盐的水溶液作为流动相,色谱条件温和,生物大分子的活性回收率很高。[/font][font=宋体] [/font][font=宋体][font=宋体]蛋白质在[/font][font=Calibri]HIC[/font][font=宋体]操作过程中是高盐上样,低盐洗脱(高盐浓度的样品不必作处理就可直接上样)。[/font][/font][font=宋体] [/font][font=宋体]在一次色谱中可同时实现出去盐酸胍、蛋白质复性和分离三个目的。[/font][font=宋体] [/font][font=宋体][font=宋体]温度升高,蛋白质天然折叠伸展,暴露出更多内部疏水集团,使蛋白质的[/font][font=Calibri]HIC[/font][font=宋体]保留发生变化。[/font][/font][font=宋体] [/font][font=宋体]色谱填料稳定性好,盐水体系作流动相无环境污染。[/font][font=宋体] [/font][b][font=宋体]④[/font][font=宋体]亲和层析[/font][/b][font=宋体][font=宋体]原理:[url=https://cn.sinobiological.com/resource/protein-review/protein-purification-by-ac][b]亲和层析[/b][/url]是应用生物高分子与配基可逆结合的原理,将配基通过共价键牢固结合于载体上而制得的层析系统。这种可逆结合的作用主要是靠生物高分子对它的配基的空间结构的识别。常用的生物亲和关系有酶[/font][font=Calibri]-[/font][font=宋体]底物、底物类似物、抑制剂、激活剂、辅因子,抗体[/font][font=Calibri]-[/font][font=宋体]抗原,激素[/font][font=Calibri]-[/font][font=宋体]受体蛋白、载体蛋白,外源凝集素[/font][font=Calibri]-[/font][font=宋体]多糖、糖蛋白、细胞表面受体,核酸[/font][font=Calibri]-[/font][font=宋体]互补核苷酸序列、组蛋白、核酸结合蛋白等,具有高效、简单、快速的优点,是当前最为理想的分离纯化蛋白的方法。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多详情可以参看蛋白纯化技术[/font][font=Calibri]/[/font][font=宋体]方法:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification-techniques[/font][/font][font=Calibri] [/font]
[font=宋体][font=宋体]抗体融合蛋白是一种将抗体片段与功能蛋白融合表达的重组蛋白,具有抗体的特性和功能蛋白的活性。它可广泛应用于免疫诊断、免疫治疗、抗体纯化、抗体和抗原的定量分析以及免疫导向药物的制备等领域。根据结合的[/font][font=Calibri]Ig[/font][font=宋体]片段的不同,可以将抗体融合蛋白分为[/font][font=Calibri]Fab[/font][font=宋体]融合蛋白、[/font][font=Calibri][url=https://cn.sinobiological.com/resource/protein-review/fc-fusion-proteins][b]Fc[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/fc-fusion-proteins][b]融合蛋白[/b][/url]与[url=https://cn.sinobiological.com/resource/antibody-technical/scfv-antibody-production][b]单链抗体([/b][/url][/font][font=Calibri][url=https://cn.sinobiological.com/resource/antibody-technical/scfv-antibody-production][b]scFv[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/resource/antibody-technical/scfv-antibody-production][b])[/b][/url]融合蛋白。制备抗体融合蛋白的方法主要有化学交联法和基因工程技术,其中基因工程技术是目前主要的方法。在制备过程中,需要注意两蛋白间的接头序列的长度,以确保蛋白质的折叠和稳定性。抗体融合蛋白在免疫学、生物制药和医学等领域具有广泛的应用前景,为疾病的诊断、治疗和药物研发提供了新的工具和方法。[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]双特异性抗体如何与蛋白融合[/font][font=Calibri]?[/font][/font][/b][font=宋体] [/font][font=宋体]双特异性抗体是一种特殊的抗体,具有两个不同的抗原结合位点。通过技术手段,可以将双特异性抗体与另一种蛋白质融合。[/font][font=宋体] [/font][font=宋体]①使用基因工程技术,将双特异性抗体的基因与目标蛋白质的基因进行融合,然后通过表达载体在细胞内表达融合蛋白质。[/font][font=宋体] [/font][font=宋体]②使用化学手段,将双特异性抗体与目标蛋白质进行化学偶联。这需要使用特定的化学偶联剂,将双特异性抗体的特定基团与目标蛋白质的特定基团连接起来。[/font][font=宋体] [/font][font=宋体]需要注意的是,融合蛋白质的功能和性质取决于其组成成分的特性和比例,因此在融合过程中需要谨慎选择和设计组成成分,以确保融合蛋白质具有所需的功能和性质。[/font][font=宋体] [/font][b][font=宋体]抗体融合蛋白具有广泛的应用,包括但不限于以下方面:[/font][/b][font=宋体] [/font][font=宋体]①免疫诊断:抗体融合蛋白可以用于检测抗原,如病毒、细菌、肿瘤标志物等。通过将抗体片段与荧光蛋白、酶等标记物结合,可以实现对抗原的高灵敏度检测。[/font][font=宋体]②免疫治疗:抗体融合蛋白可以用于治疗肿瘤、感染性疾病等。通过将抗体片段与细胞毒素、免疫调节因子等效应分子结合,可以实现对肿瘤细胞的靶向杀伤或调节免疫反应。[/font][font=宋体]③抗体纯化:抗体融合蛋白可以用于分离和纯化抗体。通过将抗体片段与亲和标签结合,可以利用亲和层析等技术实现对抗体的纯化和富集。[/font][font=宋体]抗体和抗原的定量分析:抗体融合蛋白可以用于定量分析抗体和抗原的浓度。通过将抗体片段与荧光染料等标记物结合,可以利用流式细胞术等技术实现对抗体和抗原的定量分析。[/font][font=宋体]④免疫导向药物的制备:抗体融合蛋白可以用于制备免疫导向药物,即将药物与抗体片段结合,利用抗体的特异性结合能力,将药物定向引导至病变部位,提高药物的疗效并降低副作用。[/font][font=宋体] [/font][font=宋体][font=宋体]更多[url=https://cn.sinobiological.com/resource/antibody-technical/bispecific-antibody][b]双特异性抗体[/b][/url]详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/antibody-technical/bispecific-antibody[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
牛奶蛋白质分析仪的原理主要基于光学测量技术,特别是光谱分析法。具体地说,它采用红外光谱法来测量牛奶中乳清蛋白和酪蛋白的含量。首先,将牛奶样品制成透明薄片,然后使用近红外光电传感器和光源对其进行扫描。牛奶中的蛋白质对特定波长的红外光有特定的吸收特性,通过测量这些吸收特性,可以分析出牛奶中蛋白质的种类和含量。此外,仪器会将牛奶光谱与事先建立的标准光谱进行比较,通过复杂的算法处理,从而得出各种蛋白质形态的含量。这种比较和计算过程确保了测量结果的准确性和可靠性。总的来说,牛奶蛋白质分析仪通过光学测量和光谱分析技术,能够快速、准确地测定牛奶中蛋白质的含量和种类,为乳制品生产、质量控制和科学研究提供了有力的支持。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/04/202404291701212298_2595_6238082_3.jpg!w690x690.jpg[/img]
[font=宋体]蛋白纯化介质主要应用于研究目的蛋白的结构、功用以及相互作用的和过程中。比如:在蛋白纯化过程中,由于[url=https://cn.sinobiological.com/resource/protein-review/protein-purification-by-ac][b]亲和层析法[/b][/url]的选择性和结合力较强,分辨率也高。所以,亲和层析法是一种常用的蛋白、抗体纯化方法,天地人和生物多种简单易用的亲和纯化介质,适用于批量或利用重力进行纯化,可以高效、便捷、可靠地从品中分离蛋白和抗体,为下游应用提供有力保证。[/font][font=宋体][b]亲和层析法的原理:[/b][/font][font=宋体][font=宋体]亲和层析是应用生物高分子与配基可逆结合的原理,将配基通过共价键牢固结合于载体上而制得的层析系统。这种可逆结合的作用主要是靠生物高分子对它的配基的空间结构的识别。常用的生物亲和关系有酶[/font][font=Calibri]-[/font][font=宋体]底物、底物类似物、抑制剂、激活剂、辅因子,抗体[/font][font=Calibri]-[/font][font=宋体]抗原,激素[/font][font=Calibri]-[/font][font=宋体]受体蛋白、载体蛋白,外源凝集素[/font][font=Calibri]-[/font][font=宋体]多糖、糖蛋白、细胞表面受体,核酸[/font][font=Calibri]-[/font][font=宋体]互补核苷酸序列、组蛋白、核酸结合蛋白等,具有高效、简单、快速的优点,是当前最为理想的分离纯化蛋白的方法。[/font][/font][b][font=宋体][font=宋体]亲和层析的操作步骤[/font][font=Calibri]:[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]在亲和层析中,蛋白在影响蛋白[/font][font=Calibri]([/font][font=宋体]或标签[/font][font=Calibri])[/font][font=宋体]与其配体之间结合的条件下被加载到柱子上。在不破坏特定相互作用但能破坏污染蛋白与固定相之间任何非特异性相互作用的条件下洗涤结合的蛋白。然后用含有竞争性分子的缓冲液或破坏所有蛋白[/font][font=Calibri]/[/font][font=宋体]蛋白相互作用的条件洗脱结合的蛋白。竞争分子与配体结合,取代目标蛋白,这种竞争分子通常通过另一种色谱流程或透析法从目标蛋白中去除。[/font][/font][font=宋体] [/font][table][tr][td][b][font=微软雅黑][color=#232323]亲和层析配体和洗脱条件[/color][/font][/b][/td][td][font=微软雅黑] [/font][/td][td][font=微软雅黑] [/font][/td][/tr][tr][td][b][font=微软雅黑][color=#232323]需纯化的蛋白[/color][/font][/b][/td][td][b][font=微软雅黑][color=#232323]配体[/color][/font][/b][/td][td][b][font=微软雅黑][color=#232323]洗脱条件[/color][/font][/b][/td][/tr][tr][td][font=微软雅黑][color=#232323]抗体(抗原特异性)[/color][/font][/td][td][font=微软雅黑][color=#232323]抗原肽[/color][/font][/td][td][font=微软雅黑][color=#232323]游离肽[/color][/font][/td][/tr][tr][td][font=微软雅黑][color=#232323]多聚组氨酸标签蛋白[/color][/font][/td][td][font=微软雅黑][color=#232323]Ni2+或Co2+[/color][/font][/td][td][font=微软雅黑][color=#232323]咪唑或游离组氨酸[/color][/font][/td][/tr][tr][td][font=微软雅黑][color=#232323]FLAG标签蛋白[/color][/font][/td][td][font=微软雅黑][color=#232323]FLAG特异性抗体[/color][/font][/td][td][font=微软雅黑][color=#232323]FLAG肽或低pH值[/color][/font][/td][/tr][tr][td][font=微软雅黑][color=#232323]GST标签蛋白[/color][/font][/td][td][font=微软雅黑][color=#232323]还原型谷胱甘肽[/color][/font][/td][td][font=微软雅黑][color=#232323]游离谷胱甘肽[/color][/font][/td][/tr][tr][td][font=微软雅黑][color=#232323]Myc标签蛋白[/color][/font][/td][td][font=微软雅黑][color=#232323]Myc特异性抗体[/color][/font][/td][td][font=微软雅黑][color=#232323][font=微软雅黑]低[/font][font=微软雅黑]pH[/font][/color][/font][/td][/tr][tr][td][font=微软雅黑][color=#232323]抗体(类特异性)[/color][/font][/td][td][font=微软雅黑][color=#232323][font=微软雅黑]蛋白[/font][font=微软雅黑]A、G和L或精蛋白[/font][/color][/font][/td][td][font=微软雅黑][color=#232323]pH极端值[/color][/font][/td][/tr][tr][td][font=微软雅黑][color=#232323]DNA结合蛋白[/color][/font][/td][td][font=微软雅黑][color=#232323]肝素[/color][/font][/td][td][font=微软雅黑][color=#232323]高离子强度[/color][/font][/td][/tr][/table][font=宋体][font=宋体]更多详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification-by-ac[/font][/font]
[font=宋体][b]什么是抗体纯化?抗体纯化原理:[/b][/font][font=宋体][font=宋体]抗体纯化是指从抗血清([/font][font=Calibri]pAb[/font][font=宋体])、腹水或杂交瘤细胞系([/font][font=Calibri]mAb[/font][font=宋体])细胞培养上清液中提取抗体的过程。纯化后的抗体适用于多种应用。该过程可以在提供抗体纯化服务的实验室中进行,如果有必需的设备和工具,也可以自行纯化。如研究人员担心原始研究的完整性受到破坏,可在实验室中进行纯化,确保研究快速进行。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]抗体的主要来源之一是在动物体内生成的抗血清。在这种情况下,反复向动物体内注射抗原,直到抗体开发完成为止,其血液用于制备抗血清,经纯化后可获得多克隆抗体。抗体的另一个来源是克隆细胞,其作为相同细胞群的一部分生成抗体;这种方法用于大规模生产单克隆抗体。查看更多有关[/font][font=宋体]“单克隆抗体纯化”的信息。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]什么是蛋白纯化?[/b][/font][font=宋体] [/font][font=宋体]重组蛋白的纯化是生物学研究中的重要技术。为了研究蛋白的特定功能和结构,研究人员必须将重组蛋白从生物体中分离并纯化。蛋白纯化方法主要利用不同重组蛋白之间的相似性和差异性。可以根据蛋白之间的相似性去除非蛋白物质,然后根据蛋白之间的差异分离纯化目标重组蛋白。[/font][font=宋体] [/font][font=宋体][font=宋体]蛋白标签是一种可以提高重组蛋白的溶解度、简化蛋白纯化的简单有效的工具,并通过简单的方法跟踪蛋白表达和纯化过程。此外,蛋白标签是追踪活细胞中蛋白和进程的一种有效工具,可以通过显微镜直接跟踪或者通过[/font][font=Calibri]Western blot[/font][font=宋体]、免疫沉淀或免疫染色间接进行跟踪。[/font][/font][font=宋体] [/font][font=宋体][b]蛋白纯化原理:[/b][/font][font=宋体] [/font][font=宋体]不同的重组蛋白具有不同的氨基酸序列和空间结构,导致其物理、化学和生物学特性存在差异。我们也可以根据目标蛋白与其他蛋白和裂解液的性质差异设计合理的蛋白纯化方案。[/font][font=宋体] [/font][font=宋体][font=宋体]大多数的纯化方案需要不止一步才能达到理想的纯度水平。该过程中的每一步都会造成一定的产品损失,假设每一步的获得率为[/font][font=Calibri]80%[/font][font=宋体]。因此,建议尽可能减少纯化步骤。起始原料的选择是纯化过程设计的关键。[/font][/font][font=宋体] [/font][font=宋体]在背景信息、检测方法和样品规格都已到位的情况下,可以考虑采用三阶段纯化策略。纯化分为捕获、中度纯化和精细纯化三个阶段,每个阶段都有特定的目标。捕获阶段的目标是分离、浓缩和稳定目标产物。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供重组蛋白表达纯化服务和[url=https://cn.sinobiological.com/services/monoclonal-antibody-production-services][b]单克隆抗体定制服务[/b][/url],更多详情可以关注[/font][font=Calibri]https://cn.sinobiological.com/services/monoclonal-antibody-production-services[/font][/font][font=宋体][font=Calibri]https://cn.sinobiological.com/services/recombinant-protein-expression-service[/font][/font]
相同的方法,将底衬材料与外泌体及荧光抗体孵育,用多功能读板机测定,制作标准曲线,得出特定蛋白的量
[font=宋体][font=宋体]膜联蛋白([/font][font=Calibri]Annexin[/font][font=宋体])是一类分布广泛的钙依赖性磷脂结合蛋白,与磷脂酰丝氨酸([/font][font=Calibri]PS[/font][font=宋体])能特异性结合,参与一系列[/font][font=Calibri]Ca2+[/font][font=宋体]依赖型的膜相关的过程,包括细胞的胞吐和内吞作用、囊泡运输、调节血液凝固以及炎症反应等多种生物学事件,在许多人类疾病的发病机制或进展中起着非常重要的作用。膜联蛋白[/font][font=Calibri]V[/font][font=宋体]([/font][font=Calibri]Annexin V[/font][font=宋体])染色是检测细胞凋亡的常用方法。[/font][/font][b][font=宋体][font=宋体]膜联蛋白[/font][font=Calibri]V[/font][font=宋体]染色原理及应用[/font][/font][/b][font=宋体] [/font][b][font=宋体][font=宋体]一、膜联蛋白[/font][font=Calibri]V[/font][font=宋体]染色原理[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]膜联蛋白[/font][font=Calibri]V[/font][font=宋体]染色,也称为[/font][font=Calibri]Annexin V[/font][font=宋体]染色,是一种用于检测细胞凋亡的方法。其核心原理基于细胞凋亡过程中的一种生物化学变化。在正常细胞中,磷脂酰丝氨酸([/font][font=Calibri]PS[/font][font=宋体])只分布在细胞膜脂质双层的内侧。然而,当细胞开始凋亡时,这一分布会发生改变,磷脂酰丝氨酸会从细胞膜内侧翻到外侧。膜联蛋白[/font][font=Calibri]V[/font][font=宋体]是一种能够与这种外翻的磷脂酰丝氨酸特异性结合的蛋白。通过结合荧光物质,这种结合可以被检测和观察,从而确定哪些细胞正在经历凋亡。[/font][/font][b][font=宋体] [/font][font=宋体][font=宋体]二、膜联蛋白[/font][font=Calibri]V[/font][font=宋体]染色的应用[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]①流式细胞术:膜联蛋白[/font][font=Calibri]V[/font][font=宋体]染色常用于流式细胞术中,以检测和分类正常细胞和凋亡细胞。通过流式细胞仪,可以快速分析大量细胞,并准确地识别出凋亡细胞。[/font][/font][font=宋体][font=宋体]②光学显微镜成像:膜联蛋白[/font][font=Calibri]V[/font][font=宋体]染色也可用于光学显微镜成像技术,这使得研究者能够在显微镜下直接观察细胞的形态变化,从而对凋亡过程有更深入的理解。[/font][/font][font=宋体][font=宋体]③与其他染色方法的结合:膜联蛋白[/font][font=Calibri]V[/font][font=宋体]染色可以与其他染色方法如碘化丙啶[/font][font=Calibri](PI)[/font][font=宋体]染色结合使用。[/font][font=Calibri]PI[/font][font=宋体]是一种能够进入凋亡晚期细胞核的染料,因此可以用于区分凋亡早期和晚期细胞。这种联合使用的方法能提供更全面的细胞凋亡信息。[/font][/font][font=宋体][font=宋体]④临床应用:膜联蛋白[/font][font=Calibri]V[/font][font=宋体]染色在许多临床领域中都有应用,例如肿瘤学、血液学和药理学等。它可以帮助研究者深入理解疾病的发展过程,评估新药物对细胞凋亡的影响,以及监测疾病的进展和治疗的效果。[/font][/font][font=宋体][font=宋体]总的来说,膜联蛋白[/font][font=Calibri]V[/font][font=宋体]染色是一种强大的工具,可以帮助科学家们更好地理解细胞凋亡的过程,从而为疾病的治疗和药物研发提供有价值的信息。[/font][/font][font=宋体] [/font][font=宋体]更多关于膜联蛋白详情可以关注[url=https://cn.sinobiological.com/][b]义翘神州[/b][/url]![/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
在原核蛋白表达体系中,如E.coli(大肠埃希菌)系统,外源基因通常需要诱导剂的诱导才能进行表达,本文详细讲述了常用诱导剂IPTG 对外源蛋白诱导表达的原理以及实验步骤。
[font=宋体][font=宋体]在生物细胞的世界里,膜蛋白是一个不可或缺的角色。它们不仅参与细胞的识别、信号转导和物质运输等重要功能,还成为了药物研发的重要靶点。动物细胞的膜脂主要有[/font][font=Calibri]9[/font][font=宋体]种,而膜蛋白的种类繁多,虽然多数膜蛋白分子数量较少,但它们赋予了细胞膜至关重要的生物学功能。[/font][/font][font=宋体]根据与脂分子的结合方式和分离难易程度,膜蛋白主要分为外在膜蛋白和内在膜蛋白两大类。[/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体])外在膜蛋白为水溶性蛋白,通过离子键或其它较弱的键与膜表面的蛋白质分子或脂分子结合。因此,通过改变溶液的离子强度或提高温度,就可以轻松地从膜上分离出来,而不会破坏膜的结构。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体])内在膜蛋白与膜结合非常紧密,一般只有用去垢剂[/font][font=Calibri](detergent)[/font][font=宋体]使其膜解后才可分离出来。[/font][/font][b][font=宋体]膜蛋白提取方法:[/font][/b][font=宋体] [/font][font=宋体][font=Calibri]1)[/font][font=宋体]膜蛋白色谱[/font][font=Calibri](Chromatography of Membrane Protein,CMP)[/font][font=宋体]:[/font][font=Calibri]CMP[/font][font=宋体]分离强疏水性蛋白、多肽混合物的层析系统,一般有去垢剂(如[/font][font=Calibri]SDS[/font][font=宋体])溶解膜蛋白后形成[/font][font=Calibri]SDS-[/font][font=宋体]融膜蛋白,并由羟基磷灰石为固定相的柱子分离纯化。羟基磷灰石柱具有阴离子磷酸基团([/font][font=Calibri]P-[/font][font=宋体]端),又具有阳离子钙([/font][font=Calibri]C-[/font][font=宋体]端),与固定相结合主要决定于膜蛋白的大小、[/font][font=Calibri]SDS[/font][font=宋体]结合量。利用原子散射法研究[/font][font=Calibri]cAMP[/font][font=宋体]的分离机制发现,样品与[/font][font=Calibri]SDS[/font][font=宋体]结合后在离子交换柱上存在[/font][font=Calibri]SDS[/font][font=宋体]分子、带电荷氨基酸与固定相中带电离子间的交换,从而达到分级分离的目的。[/font][/font][font=宋体][font=Calibri]2)[/font][font=宋体]顺序抽提法:根据细胞蛋白溶解性的差异,用具有不同溶解能力的蛋白溶解液进行抽提的方法。用[/font][font=Calibri]Tris[/font][font=宋体]碱溶液裂解细胞提取高溶解性蛋白;把未溶解的沉淀用标准液溶解提取高疏水性蛋白;最后用含复合表面活性剂的蛋白溶解液,可以再次抽提前两次抽提后不能溶解的膜蛋白。[/font][/font][font=宋体][font=Calibri]3)[/font][font=宋体]离心蛋白提取法([/font][font=Calibri]centrifugal protein extraction[/font][font=宋体])[/font][/font][font=宋体]原理:高渗的蛋白裂解液让细胞溶胀破裂后,超高速离心[/font][font=宋体][font=Calibri]4)detergent-based[/font][font=宋体]:提取时先用裂解液裂解胞膜(选用不同的去污试剂是关键),梯度离心分离细胞器[/font][font=Calibri](ER)[/font][font=宋体],然后分级抽提方法。例如,去掉细胞器之后的[/font][font=Calibri]DEBRIS[/font][font=宋体]就是核膜,再裂解得到核膜蛋白。而膜蛋白是裂胞膜时不溶的部分。[/font][/font][font=宋体]总的感受:细胞的量要很充足。之后的定性鉴定常用的方法有双向免疫扩散、免疫电泳及聚丙稀酰胺凝胶电泳等。纯化蛋白质浓度的定量测定可用双缩脲法、酚试剂法或紫外光吸收法定量鉴定膜蛋白,方便迅速。[/font][font=宋体] [/font][font=宋体]除了上述的提取方法,还有其他一些方法可以用于提取膜蛋白。例如,可以采用超声波破碎法或反复冻融法来破坏生物膜的结构,从而使膜蛋白释放出来。此外,还可以使用一些特殊的分离技术,如超离心或凝胶电泳,来分离和纯化膜蛋白。[/font][font=宋体] [/font][font=宋体]值得注意的是,不同的膜蛋白具有不同的性质和稳定性,因此需要采用不同的提取方法。在选择提取方法时,需要考虑的因素包括目标膜蛋白的分子量、溶解度、稳定性以及生物膜的组成和性质等。[/font][font=宋体] [/font][font=宋体]总之,提取和纯化膜蛋白是一项具有挑战性的任务,需要综合考虑多种因素。通过对不同方法的了解和比较,我们可以根据实际需求选择合适的方法来提取和纯化目标膜蛋白,为进一步的研究和应用奠定基础。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/platform/multi-pass-transmembrane-protein][b]多次跨膜蛋白开发技术平台[/b][/url],详情可以关注[/font][font=Calibri]https://cn.sinobiological.com/services/platform/multi-pass-transmembrane-protein[/font][/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
[font=宋体][url=https://cn.sinobiological.com/resource/protein-review/protein-purification-protocol][b]蛋白纯化[/b][/url]是生物实验室和制药工业中至关重要的技术。它涉及从复杂的混合物中分离出目标蛋白质,同时保持蛋白质的结构和功能。了解蛋白纯化的原理和步骤不仅有助于提高实验效率,还可以降低实验失败的风险。在本篇文章中,我们将详细介绍蛋白纯化的定义、原理和步骤。[/font][font=宋体] [/font][font=宋体][b]蛋白纯化定义及原理[/b][/font][font=宋体] [/font][font=宋体]蛋白纯化是生物研究常用的一种技术,是指从蛋白混合物中得到纯度较高的某种蛋白的过程。根据样本和杂质的特性选择适合的纯化方法,纯化技术的选择要简单化,并且要产生最佳的纯化效果。如果纯度的要求很高,再增加一个离子交换或疏水作用色谱的额外中间步骤。不过尽量尝试使用尽可能少的步骤,因为步骤增多会降低总蛋白产出量。亲和步骤常用重力柱,有时其他色谱步骤中会使用恒压泵,然而蛋白纯化系统将提供更多的控制,可获得更详细的目标蛋白和杂质信息,并为色谱柱提供更好的保护。[/font][font=宋体] [/font][font=宋体][b]可溶性蛋白纯化的步骤[/b][/font][font=宋体] [/font][font=宋体]用于分离可溶性重组或非重组蛋白的分离方法取决于蛋白的内在生理化学特性(被标记蛋白除外)。典型的纯化方案如下所示(使用离子交换色谱法)。[/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、细胞裂解液[/font][/font][font=宋体]澄清裂解液[/font][font=宋体][font=宋体]离心([/font][font=Calibri]60000[/font][font=宋体]×[/font][font=Calibri]g[/font][font=宋体],[/font][font=Calibri]90 [/font][font=宋体]分钟)过滤或脱盐和交换缓冲液[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、澄清裂解液[/font][/font][font=宋体]①用亲和法[/font][font=宋体][font=宋体]([/font][font=Calibri]1[/font][font=宋体])进行[/font][font=Calibri]DEAE-Sepharose[/font][font=宋体]离子交换[/font][/font][font=宋体]交换缓冲液[/font][font=宋体] [/font][font=宋体][font=宋体]([/font][font=Calibri]2[/font][font=宋体])进行离子交换[/font][/font][font=宋体][font=宋体]? 弱阳离子[/font][font=Calibri]-[/font][font=宋体]羧甲基[/font][/font][font=宋体][font=宋体]? 强阳离子[/font][font=Calibri]-[/font][font=宋体]甲基磺酸盐[/font][/font][font=宋体][font=宋体]? 强阴离子[/font][font=Calibri]-[/font][font=宋体]季铵盐[/font][/font][font=宋体][font=宋体]? 弱阴离子[/font][font=Calibri]-[/font][font=宋体]二乙氨基乙基[/font][/font][font=宋体]? 磷酸纤维素[/font][font=宋体] [/font][font=宋体][font=宋体]([/font][font=Calibri]3[/font][font=宋体])用其他色谱方法[/font][/font][font=宋体]? 染料基质[/font][font=宋体]? 疏水[/font][font=宋体]? 羟磷灰石[/font][font=宋体]? 层析聚焦[/font][font=宋体] [/font][font=宋体]②浓缩[/font][font=宋体] [/font][font=宋体]③进行凝胶过滤[/font][font=宋体]④无菌过滤[/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、经纯化的蛋白[/font][/font][font=宋体] [/font][font=宋体][b]包涵体蛋白的折叠与纯化[/b][/font][font=宋体]在大肠杆菌中表达的重组蛋白位于细胞裂解后低速颗粒部分,它们高度聚集。包涵体通常来自于细胞质(或细胞周质,如使用了分泌载体)中的蛋白聚集。如前所述,由于与细菌核酸的相互作用,蛋白也可以位于低速或高速颗粒部分中。[/font][font=宋体] [/font][font=宋体][font=宋体]采用蛋白变性剂提取蛋白,如盐酸胍[/font][font=Calibri](Gu[/font][font=宋体][/font][font=Calibri]HCl)[/font][font=宋体]、尿素或有机酸。使用还原剂二硫苏糖醇[/font][font=Calibri](DTT)[/font][font=宋体]防止人工二硫键形成(尤其是分子间键)。变性后的蛋白可以通过各种方法纯化后再折叠,也可以直接折叠。通常建议在折叠前进行一些纯化(如[/font][font=Calibri]Gu[/font][font=宋体][/font][font=Calibri]HCl[/font][font=宋体]中的凝胶过滤),因为这往往会带来更高的折叠产率。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]原文转载:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification-protocol[/font][/font]
[font=宋体][font=宋体]蛋白过镍柱纯化的原理是利用[/font][font=Calibri]Ni[/font][font=宋体]柱中的氯化镍与有[/font][font=Calibri]HIs[/font][font=宋体](组蛋白)标签的蛋白特异性结合的能力,同时也能与咪唑结合。具体步骤如下:[/font][/font][font=宋体] [/font][font=宋体]①[/font][font=宋体][font=宋体]过柱子前可以选择[/font][font=Calibri]Ni[/font][font=宋体]柱重生,往柱子里倒氯化镍,一个柱长体积就行,然后平衡柱子,用你自己的[/font][font=Calibri]buffer[/font][font=宋体],给蛋白提供最适的环境。[/font][/font][font=宋体]②[/font][font=宋体][font=宋体]平衡[/font][font=Calibri]4[/font][font=宋体]个柱长后,蛋白上样,可以让他自己挂,这样挂柱子的效果好一些。如果流速太慢,可以加个恒流泵,但是一定不能太快,太快挂柱效果差。也可以选择循环挂柱,就是恒流泵的一头接你装蛋白的烧杯,从柱子中留下来的液体还用同一个烧杯接回去。[/font][/font][font=宋体]③[/font][font=宋体][font=宋体]挂完之后,按理想来讲,蛋白在[/font][font=Calibri]Ni[/font][font=宋体]柱中与[/font][font=Calibri]Ni[/font][font=宋体]就结合了,杂蛋白多数在烧杯里留下来了。肯定有少量杂蛋白也挂上了。这时候要梯度洗脱,拿咪唑和你的[/font][font=Calibri]buffer[/font][font=宋体]配,一般从[/font][font=Calibri]0[/font][font=宋体]、[/font][font=Calibri]20mM[/font][font=宋体]、[/font][font=Calibri]40mM......100mM[/font][font=宋体]这样洗脱。咪唑加入之后,会和蛋白争夺与[/font][font=Calibri]Ni[/font][font=宋体]的结合位点,杂蛋白、你的目的蛋白,会在不同的浓度被洗脱下来。[/font][/font][font=宋体]④[/font][font=宋体][font=宋体]洗完之后,可以用[/font][font=Calibri]200mM[/font][font=宋体]咪唑洗柱子,清理一切蛋白,然后平衡几次。是否选择重生你自己定咯[/font][font=Calibri]~[/font][font=宋体]然后放上[/font][font=Calibri]20%[/font][font=宋体]乙醇保存柱子就可以咯[/font][font=Calibri]~ [/font][font=宋体]过的蛋白用不同的管子收下,然后[/font][font=Calibri]SDS-page[/font][font=宋体]检测在哪个管子里。[/font][/font][font=宋体]以上步骤仅供参考,不同的实验条件可能方法会不同。具体可以查阅专业书籍或者咨询专业人士。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供不同表达系统的[url=https://cn.sinobiological.com/resource/protein-review/protein-purification][b]蛋白纯化服务[/b][/url],有细菌系统蛋白纯化、[url=https://cn.sinobiological.com/services/transient-protein-expression-service][b]哺乳动物瞬时系统蛋白纯化[/b][/url]、杆状病毒系统蛋白纯化等,具体重组蛋白纯化原理及操作步骤可以查看[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification[/font][/font][font=宋体][font=宋体]杆状病毒[/font][font=Calibri]-[/font][font=宋体]昆虫细胞蛋白表达服务:[/font][font=Calibri]https://cn.sinobiological.com/services/baculovirus-insect-protein-expression-service[/font][/font][font=宋体][font=宋体]原核([/font][font=Calibri]E. coli[/font][font=宋体])蛋白表达服务:[/font][font=Calibri]https://cn.sinobiological.com/services/e-coli-protein-expression-service[/font][/font]
本文引用自cheney《蛋白胨和胰蛋白胨简介》蛋白胨是将肉、酪素或明胶用酸或蛋白酶水解后干燥而成的外观呈淡黄色的粉剂,具有肉香的特殊气息。蛋白质经酸、碱或蛋白酶分解后也可形成蛋白胨。蛋白胨富含有机氮化合物,也含有一些维生素和糖类。它可以作为微生物培养基的主要原料,在抗生素、医药工业、发酵工业、生化制品及微生物学科研等领域中的用量均很大。不同的生物体需要特定的氨基酸和多肽,因此存在着各种蛋白胨,一般来说,用于蛋白胨生产的蛋白包括动物蛋白(酪蛋白、肉类)和植物蛋白(豆类)等两种。能为微生物提供C源、N源、生长因子等营养物质。因此,蛋白胨从来源上可分为动物性蛋白胨和植物性蛋白胨。胰胨、肉胨、骨胨等都是动物性蛋白胨,而大豆蛋白胨等则是植物性蛋白胨。动物性来源的蛋白胨还有:蚕蛹蛋白胨、血液蛋白胨等。 不同来源的蛋白质和不同的水解条件,其水解物中组成可千差万别。所以胨往往是一个复杂的多肽混合物。可溶于水,过热不凝固,在饱和硫酸铵中不发生沉淀但可为蛋白质沉淀剂所沉淀。可用作微生物和动物细胞培养基、特种功能性食品和化妆品的配料,也有用作啤酒等产品的稳定剂。胰蛋白胨,又称胰酪蛋白胨(Casein Tryptone)、胰酶消化酪蛋白胨(Pancreatic digest of casein),是一种优质蛋白胨,是以新鲜牛肉和牛骨经胰酶消化,浓缩干燥而成的浅黄色粉末。具有色浅、易溶、透明、无沉淀等良好的物理性状。含有丰富的氮源、氨基酸等,可配制各种微生物培养基,用于细菌的培养、分离、增殖、鉴定,以及无菌试验培养基、厌氧菌培养基等细菌生化特性试验用培养基的配置。胰蛋白胨还广泛应用于高品质的抗生素、维生素、医药工业,氨基酸、有机酸、酶制剂、黄原胶等发酵工业,生化制品及微生物学科研等领域中的用量均很大,临床用于抗炎消肿,工业上用于皮革制造,生丝处理,食品加工。在国际市场上,胰蛋白胨也属于货紧价昂的短线品种之一。 胰酪蛋白胨质量标准及其检验标准: 常规各项理化指标: 1. 澄清度(磷酸盐、碱性沉淀):无沉淀、澄清 2. 2%水溶液:透明 3. 酸碱度:6-7 4. 氨基氮:≥3% 5. 色氨酸:≥0.8% 6. 胨含量:≥80% 7. 总氮:≥13% 8. 水份:≤5% 9. 灰份:≤6% 10. 氯化钠:≤0.2%胰蛋白胨特指用胰蛋白酶酶解酪蛋白生成的蛋白胨产物,与一般蛋白胨的区别在于酶解工艺处理上,属于水解度更高、胨分子量更小更均衡的蛋白胨。
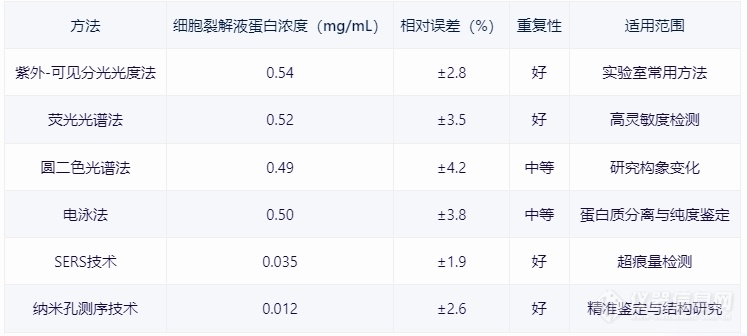
[b][font=宋体]一、引言[/font][/b][font=宋体] [/font][font=宋体]蛋白质浓度测定是生物化学实验中的一项基本操作,对于了解蛋白质的性质、评估实验效果以及开展生物学研究具有重要意义。本文将详细介绍蛋白浓度测定的方法、技术原理、最新进展及其在生物医学研究中的应用。[/font][font=宋体] [/font][b][font=宋体]二、蛋白浓度测定方法概述[/font][/b][font=宋体] [/font][font=宋体][font=宋体]①紫外[/font][font=Calibri]-[/font][font=宋体]可见分光光度法[/font][/font][font=宋体]原理:利用蛋白质中特定氨基酸(如酪氨酸、色氨酸)在紫外光区的吸收特性,通过测量吸光度值来计算蛋白质浓度。[/font][font=宋体] [/font][font=宋体]应用:适用于大多数蛋白质的测定,尤其在实验室中广泛使用。[/font][font=宋体] [/font][font=宋体]②荧光光谱法[/font][font=宋体]原理:利用荧光染料与蛋白质结合后产生的荧光光谱,通过测量荧光强度来计算蛋白质浓度。[/font][font=宋体] [/font][font=宋体]应用:适用于具有荧光特性的蛋白质,具有高灵敏度。[/font][font=宋体] [/font][font=宋体]③圆二色光谱法[/font][font=宋体]原理:利用圆二色光谱分析蛋白质的构象变化,从而推算蛋白质浓度。[/font][font=宋体] [/font][font=宋体]应用:常用于研究蛋白质的构象变化和稳定性。[/font][font=宋体] [/font][font=宋体]④电泳法[/font][font=宋体]原理:利用电泳技术将蛋白质分离,通过测量电泳带亮度或面积来计算蛋白质浓度。[/font][font=宋体] [/font][font=宋体]应用:常用于蛋白质分离和纯度鉴定。[/font][font=宋体] [/font][b][font=宋体]三、进展与技术优化[/font][/b][font=宋体] [/font][font=宋体][font=宋体]①表面增强拉曼散射([/font][font=Calibri]SERS[/font][font=宋体])技术[/font][/font][font=宋体]原理:利用金属表面增强拉曼散射效应,提高信号强度,从而提高检测灵敏度。[/font][font=宋体] [/font][font=宋体]应用:适用于痕量蛋白质的检测,具有高灵敏度和高分辨率。[/font][font=宋体] [/font][font=宋体]②纳米孔测序技术[/font][font=宋体]原理:利用纳米孔测序技术对蛋白质进行测序,通过电导变化检测蛋白质序列信息。[/font][font=宋体] [/font][font=宋体]应用:有助于蛋白质的精准鉴定和分子结构研究。[/font][font=宋体] [/font][font=宋体][b]四、[/b][/font][b][font=宋体]实际应用案例分析[/font][/b][font=宋体] [/font][align=center][img=蛋白浓度测定案例,690,310]https://ng1.17img.cn/bbsfiles/images/2024/01/202401231537106869_2656_5907840_3.png!w690x310.jpg[/img][font=宋体] [/font][/align][font=宋体][font=宋体]详情可以关注义翘神州更多[url=https://cn.sinobiological.com/resource/protein-review][b]蛋白资源[/b][/url]详情:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review[/font][/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
特定蛋白检测标准化——从CRM470到ERM-DA470k及ERM-DA472k唐文佳 吴炯 郭玮 潘柏申
[b][font=宋体][font=宋体]什么是重组蛋白疫苗[/font][font=Calibri]? [/font][/font][/b][font=宋体]即将某种病毒的目的抗原基因构建在表达载体上,将已构建的表达蛋白载体转化到细菌、酵母或哺乳动物或昆虫细胞中,在一定的诱导条件下,表达出大量的抗原蛋白,通过纯化后制备的疫苗。[/font][font=宋体] [/font][b][/b][font=宋体][font=宋体][b]重组蛋白疫苗的基本原理[/b]是将病毒表面的刺突蛋白或受体结合区([/font][font=Calibri]Receptor binding domain, RBD[/font][font=宋体])的一部分,与宿主细胞结合制成疫苗。通过结合重组蛋白和多种免疫素来增强免疫应答,促进抗体产生,从而诱导免疫系统产生高强度的识别位点,使人体具备更好的免疫抵抗力,并可迅速减轻症状,有效地预防和治疗传染病。[/font][/font][font=宋体] [/font][b][font=宋体]重组蛋白疫苗优势:[/font][/b][font=宋体]①不养活病毒,无需担心病毒外泄,对生产车间的生物安全等级要求低;[/font][font=宋体][font=宋体]②利用转基因技术生产病毒[/font][font=Calibri]S[/font][font=宋体]蛋白上的[/font][font=Calibri]RBD[/font][font=宋体]蛋白,能实现高产量、高纯度、低成本;[/font][/font][font=宋体][font=宋体]③重组蛋白疫苗只含[/font][font=Calibri]RBD[/font][font=宋体]蛋白,纯度高,安全性更好。[/font][/font][b][font=宋体] [/font][font=宋体]重组蛋白疫苗缺点:[/font][/b][font=宋体]①免疫原性较差:相比于一些其他类型的疫苗,重组蛋白疫苗的免疫原性可能较差。这意味着需要使用较高剂量的疫苗才能激发免疫反应,从而增加疫苗的成本和副作用的发生率。[/font][font=宋体]②需要辅助免疫刺激剂:重组蛋白疫苗通常需要添加辅助免疫刺激剂,如佐剂或载体,以增强免疫原性和免疫反应。这些辅助免疫刺激剂可能会增加疫苗的副作用和成本,并且有时可能会引起过敏反应。[/font][font=宋体]③需要多次接种:相对于一些其他类型的疫苗,重组蛋白疫苗需要进行多次接种,以达到充分的免疫效果。这可能会增加接种的难度和成本,并且需要较长时间才能建立起有效的免疫保护。[/font][font=宋体]④局部和全身反应:虽然重组蛋白疫苗的安全性较高,但含有佐剂的疫苗可能引起更多局部反应,如注射部位发红、肿胀,以及更多全身反应,如发热、寒战和身体疼痛。[/font][font=宋体] [/font][font=宋体][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/protein-production][b]重组蛋白生产[/b][/url]详情可参看:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-production[/font][/font][b][font=宋体] [/font][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b][font=宋体] [/font]
[font=宋体][font=宋体]重组蛋白([/font][font=Calibri]recombinant protein[/font][font=宋体])是指应用重组 [/font][font=Calibri]DNA [/font][font=宋体]或重组 [/font][font=Calibri]RNA [/font][font=宋体]技术而获得的蛋白质。重组蛋白工程先应用基因克隆或化学合成技术获得目的基因([/font][font=Calibri]gene of interest[/font][font=宋体],[/font][font=Calibri]GOI[/font][font=宋体]),连接到适合的表达载体,导入到特定的宿主细胞,利用宿主细胞的遗传系统,表达出有功能的蛋白质分子。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]重组蛋白的产生是应用了重组[/font][font=Calibri]DNA[/font][font=宋体]或重组[/font][font=Calibri]RNA[/font][font=宋体]的技术从而获得的蛋白质。体外重组蛋白的生产主要包括四大系统:原核蛋白表达,哺乳动物细胞蛋白表达,酵母蛋白表达及昆虫细胞蛋白表达。生产的蛋白在活性和应用方法方面均有所不同。根据自身的下游运用选择合适的蛋白表达系统,提高表达成功率。[/font][/font][font=宋体] [/font][font=宋体]其获得途径可以分为体外方法和体内方法。两种方法的前提都是应用基因重组技术,获得连接有可以翻译成目的蛋白的基因片段的重组载体,之后将其转入可以表达目的蛋白的宿主细胞从而表达特定的重组蛋白分子。[/font][font=宋体] [/font][font=宋体][font=宋体][b]当前重组蛋白的生产主要有四大系统[/b]:原核表达系统:最常用的大肠杆菌蛋白表达,真核表达系统如酵母,哺乳动物细胞蛋白表达(常用的细胞[/font][font=Calibri]CHO[/font][font=宋体],[/font][font=Calibri]HEK293[/font][font=宋体])及、昆虫细胞蛋白表达系统。重组蛋白的产生尚可利用转基因动物的乳腺或者植物产生,产生的重组蛋白作为生物制药的产物,在医学中作用显著。利用基因工程技术,可以使细胞或者动物本身变成“批量生产药物的工厂”。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]以利用转基因动物的乳腺表达重组蛋白为例:其方法是将药用蛋白基因与乳腺蛋白基因的启动子等调控组件重组在一起,通过显微注射等方法,导入哺乳动物(哺乳动物才会泌乳)的受精卵中,然后,将受精卵送入母体内,使其生长发育成转基因动物。转基因动物进入泌乳期后,可以通过分泌的乳汁来生产所需要的蛋白质药品,因而称为动物乳腺生物反应器或乳房生物反应器。科学家已在牛和山羊等动物的乳腺生物反应器中表达出了抗凝血酶、血清白蛋白、生长激素和[/font][font=宋体]α[/font][font=Calibri]-[/font][font=宋体]抗胰蛋白酶等重要的医药产品。[/font][/font][font=宋体]重组蛋白在制药工业上主要是指表达获得的细胞因子、凝血因子或者人工设计的蛋白分子。[/font][font=宋体] [/font][font=宋体][font=宋体]目前,重组蛋白试剂已被广泛应用于生物药、细胞免疫治疗及诊断试剂的研发和生产中。其中重组蛋白药物是生物药物的重要组成成分,常被被广泛应用于医疗领域[/font][font=Calibri],[/font][font=宋体]包括肿瘤治疗、免疫调节、神经保护、结缔组织疾病、肾病治疗等。包括细胞因子类、抗体治疗性疫苗、激素及酶等。[/font][/font][font=宋体] [/font][font=宋体]义翘神州致力于提供[url=https://cn.sinobiological.com/resource/protein-review/protein-production][b]重组蛋白生产[/b][/url]、[url=https://cn.sinobiological.com/resource/protein-review/protein-expression][b]重组蛋白表达[/b][/url]及[url=https://cn.sinobiological.com/resource/protein-review/protein-production-systems][b]重组蛋白系统[/b][/url]详情的咨询与解决方案。为实验中特定的应用选择正确的表达系统是成功的关键所在。在选择表达系统时,蛋白溶解度、功能、纯化速度和产量通常是必须考虑的重要因素。此外,每个表达系统都有其独特的优势和挑战,这一点在选择时也需着重考虑。我们的专业团队将为您提供个性化的建议,以帮助您根据实验需求选择最合适的表达系统。[/font][font=宋体][font=宋体]更多详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-production[/font][/font][font=Calibri] [/font]
蛋白多肽多肽:多肽是α-氨基酸以肽键连接在一起而形成的化合物,是蛋白质水解的中间产物。由两个氨基酸分子脱水缩合而成的化合物叫做二肽,同理类推还有三肽、四肽、五肽等。通常由10~100氨基酸分子脱水缩合而成的化合物叫多肽,它们的分子量低于10,000Da(Dalton,道尔顿),能透过半透膜,不被三氯乙酸及硫酸铵所沉淀。也有文献把由2~10个氨基酸组成的肽称为寡肽(小分子肽);10~50个氨基酸组成的肽称为多肽;由50个以上的氨基酸组成的肽就称为蛋白质。蛋白质:生物体中广泛存在的一类生物大分子,由核酸编码的α氨基酸之间通过α氨基和α羧基形成的肽键连接而成的肽链,经翻译后加工而生成的具有特定立体结构的、有活性的大分子。是α—氨基酸按一定顺序结合形成一条多肽链,再由一条或一条以上的多肽链按照其特定方式结合合而成的高分子化合物。蛋白偶联KLH/BSA/Ovalbumin etc 偶联小肽/半抗原必须耦合到载体蛋白(KLH,BSA,Ova),才可以获得高效的抗体。一般来说,多肽可以与蛋白偶联的条件如下:1 有一个自由的氨基或羧基2 半胱氨酸上的-SH也可以与载体蛋白偶联目前我公司提供高质量的偶联载体蛋白(KLH,BSA,OVA)[img=,690,300]https://ng1.17img.cn/bbsfiles/images/2019/02/201902191022256586_4193_3531468_3.jpg!w690x300.jpg[/img]我们主要提供:多肽合成、定制多肽、同位素标记肽、人工胰岛素、磷酸肽、生物素标记肽、荧光标记肽(Cy3、Cy5、Fitc、AMC等)、目录肽、偶联蛋白(KLH、BSA、OVA等)、化妆品肽、多肽文库构建、抗体服务、糖肽、订书肽、药物肽、RGD环肽等。请移步百度搜“[b]合肥国肽生物[/b]”即可
[font=宋体][font=宋体]抗体融合蛋白([/font][font=Calibri]Ig[/font][font=宋体]融合蛋白)是指在基因水平上将目的基因同免疫球蛋白部分片段基因相连,并在真核或原核表达系统中表达的重组蛋白。抗体融合蛋白具有抗体的特性及融合功能蛋白的活性,可广泛应用于免疫诊断、免疫治疗、抗体纯化及抗体和抗原的定量分析等,特别可用于免疫导向药物的制备。根据结合的[/font][font=Calibri]Ig[/font][font=宋体]片段的不同,可以将抗体融合蛋白分为[/font][font=Calibri]Fab[/font][font=宋体]融合蛋白、[/font][font=Calibri]Fc[/font][font=宋体]融合蛋白与单链抗体([/font][font=Calibri]scFv[/font][font=宋体])融合蛋白。[/font][/font][font=宋体] [/font][font=宋体][b]抗体融合蛋白结构:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]Fab[/font][font=宋体]融合蛋白、单链抗体融合蛋白研究表明,抗体可变区的[/font][font=Calibri]N[/font][font=宋体]端空间结构上与互补决定区([/font][font=Calibri]CDR[/font][font=宋体])形成的抗原结合部位十分接近,有的抗体可变区[/font][font=Calibri]N[/font][font=宋体]端残基甚至直接参与抗原结合部位的形成,如果将效应蛋白与抗体片段的[/font][font=Calibri]N[/font][font=宋体]端结合,可能对抗体可变区的空间构型造成较大影响,从而降低抗体与抗原的结合能力。因此,通常将蛋白与抗体片段的[/font][font=Calibri]C[/font][font=宋体]端进行结合,形成抗体融合蛋白。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]Fc[/font][font=宋体]融合蛋白[/font][/font][/b][font=宋体] [/font][font=宋体][font=Calibri]Fc[/font][font=宋体]融合蛋白在结构上是将抗体的[/font][font=Calibri]Fc[/font][font=宋体]区与功能蛋白进行融合,可将[/font][font=Calibri]Fc[/font][font=宋体]的[/font][font=Calibri]N[/font][font=宋体]端或[/font][font=Calibri]C[/font][font=宋体]端与目的基因进行融合。根据结合蛋白的不同,可以有多种构型。[/font][/font][font=宋体] [/font][font=宋体][b]抗体融合蛋白作用原理:[/b][/font][font=宋体] [/font][font=宋体]含有抗体可变区的抗体融合蛋白[/font][font=宋体] [/font][font=宋体][font=Calibri]Fab[/font][font=宋体]融合蛋白与[/font][font=Calibri]scFv[/font][font=宋体]融合蛋白含有抗体的可变区,可以进行抗原[/font][font=Calibri]-[/font][font=宋体]抗体反应,其作用原理为利用抗体[/font][font=Calibri]-[/font][font=宋体]抗原特异性结合的特性,通过这种特性的引导,将具有生物活性的蛋白靶向引导至细胞的特定部位,进而发挥一定的生物效应。[/font][/font][font=宋体] [/font][font=宋体]不含抗体可变区的抗体融合蛋白[/font][font=宋体] [/font][font=宋体][font=宋体]该类融合蛋白含有的抗体功能区为[/font][font=Calibri]Fc[/font][font=宋体]区,不能进行抗原[/font][font=Calibri]-[/font][font=宋体]抗体反应,[/font][font=Calibri]Fc[/font][font=宋体]段的作用为延长药物在血浆内的半衰期、增加融合蛋白的稳定性等。[/font][font=Calibri]Fc[/font][font=宋体]融合蛋白药理作用的发挥依赖于功能蛋白部分,利用受体[/font][font=Calibri]-[/font][font=宋体]配体之间的相互作用产生一系列的生物学效应。[/font][/font][font=宋体] [/font][font=宋体][b]抗体融合蛋白制备:[/b][/font][font=宋体] [/font][font=宋体]最初抗体融合蛋白制备的方法为化学交联法,但这种方法制备的抗体融合蛋白组成不均一、性能不稳定、免疫源性大,随着基因工程技术的发展,该技术已被淘汰。目前主要利用基因工程技术来进行抗体融合蛋白的制备。[/font][font=宋体] [/font][font=宋体][font=宋体]其制备原理为:将抗体基因与目的蛋白基因通过一段接头序列([/font][font=Calibri]linker[/font][font=宋体])进行链接,然后将链接产物亚克隆至载体中,并用原核或者真核表达系统进行表达。制备抗体融合蛋白过程中,一个关键的问题是两蛋白间的接头序列[/font][font=Calibri](Linker)[/font][font=宋体]的长度,[/font][font=Calibri]linker[/font][font=宋体]的长短对蛋白质的折叠和稳定性非常重要。如果接头序列太短,可能影响两蛋白高级[/font][font=Calibri]-[/font][font=宋体]结构的折叠,从而相互干扰;如果接头序列太长,又涉及免疫原性的问题。抗体融合蛋白与双特异性抗体抗体融合蛋白是将抗体的部分片段与目的蛋白进行融合表达得到的重组蛋白,若将两个具有不同抗原特异性的抗体片段连接至同一蛋白,即可得到双特异性抗体。[/font][/font][font=宋体] [/font][font=宋体][b]单克隆抗体与抗体融合蛋白区别:[/b][/font][font=宋体] [/font][font=宋体]单克隆抗体抗体[/font][font=宋体] [/font][font=宋体][font=宋体]结构:[/font][font=Calibri]Y[/font][font=宋体]型[/font][/font][font=宋体][font=宋体]制备方法:杂交瘤技术[/font][font=Calibri]/[/font][font=宋体]基因重组[/font][/font][font=宋体][font=宋体]表达系统:真核系统[/font][font=Calibri]/[/font][font=宋体]原核系统[/font][/font][font=宋体][font=宋体]真核系统[/font][font=Calibri]/[/font][font=宋体]原核系统[/font][/font][font=宋体][font=宋体]作用原理:特异性识别抗原,[/font][font=Calibri]Fc[/font][font=宋体]段引起[/font][font=Calibri]ADCC[/font][font=宋体]、[/font][font=Calibri]ADCP[/font][font=宋体]、[/font][font=Calibri]CDC[/font][font=宋体]等作用。[/font][/font][font=宋体] [/font][font=宋体]抗体融合蛋白[/font][font=宋体] [/font][font=宋体]结构:具有多种结构[/font][font=宋体]制备方法:基因重组[/font][font=宋体][font=宋体]表达系统:真核系统[/font][font=Calibri]/[/font][font=宋体]原核系统[/font][/font][font=宋体][font=宋体]作用原理:功能蛋白与靶分子间的受体[/font][font=Calibri]-[/font][font=宋体]配体的相互作用[/font][/font][font=宋体] [/font][font=宋体][font=宋体]详情可以参考:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/fusion-protein[/font][/font][font=Calibri] [/font]
[font=宋体] [font=宋体]重组蛋白纯化要利用不同蛋白间内在的相似性与差异,利用各种蛋白间的相似性来除去非蛋白物质的污染,而利用各蛋白质的差异将目的蛋白从其他蛋白中纯化出来。每种蛋白间的大小、形状、电荷、疏水性、溶解度和生物学活性都会有差异,利用这些差异可将蛋白从混合物如大肠杆菌裂解物中提取出来得到重组蛋白。[/font][/font][font=宋体] [font=宋体][b]重组蛋白纯化常用的几个方法如下:[/b][/font][/font][font=宋体] [font=Calibri]1.[/font][font=宋体]蛋白纯化色谱法:[/font][/font][font=宋体] [font=宋体]色谱法无疑是下游处理中主要和常用的操作,因为色谱法相比其他单元操作具有某些优势。例如色谱法支持高分辨率的效率,可以分离分子性质非常相似的复杂粗制混合物。此外,色谱法是生物工艺中遇到的稀释溶液中捕获分子的理想选择。[/font][/font][font=宋体] [font=宋体]柱色谱法[/font][font=Calibri]([/font][font=宋体]层析法[/font][font=Calibri])[/font][font=宋体]的原理是将一个大的蛋白池分离成许多小的蛋白池,其中一些富集了目标蛋白。虽然柱色谱法有昂贵的专业设备,但只需要基本的设备就可以了。[/font][/font][font=宋体] [font=Calibri]2.[/font][font=宋体]亲和色谱法:[/font][/font][font=宋体] [font=宋体]亲和色谱法依赖于蛋白对基质结合配体的特异性和可逆性结合。该配体可以直接与目的蛋白结合或共价连接到蛋白的标签上与其相结合。亲和层析通常是最有效的纯化方法,通常用在纯化方案的早期阶段。这种特定的亲和相互作用能够捕获目标物,同时去除溶液中的污染物或其他分子,并一步富集或纯化目标分子,使其与其他不能结合配体的分子分离。[/font][/font][font=宋体] [font=宋体]除了理论上蛋白能够通过免疫亲和色谱纯化之外,亲和法仅限于具有特异结合特性的蛋白,而免疫亲和色谱是所有亲和技术中特异性最高的。[/font][/font][font=宋体] [font=Calibri]3.[/font][font=宋体]离子交换色谱法:[/font][/font][font=宋体] [font=宋体]离子交换色谱[/font][font=Calibri](IEX)[/font][font=宋体]是一种主要基于蛋白净电荷的色谱分离方法,通常用于追踪脱酰胺和琥珀酰亚胺的形成。[/font][font=Calibri]IEX[/font][font=宋体]有两种类型:阳离子交换和阴离子交换色谱法。当缓冲液[/font][font=Calibri]pH[/font][font=宋体]值高于此[/font][font=Calibri]IP[/font][font=宋体]时,蛋白带负电(阴离子);当[/font][font=Calibri]pH[/font][font=宋体]值低于此[/font][font=Calibri]IP[/font][font=宋体]时,蛋白带正电(阳离子)。[/font][/font][font=宋体] [font=宋体]所有蛋白都表现出净电荷,这取决于蛋白氨基酸组成和任何共价连接的修饰。蛋白净电荷受溶解它的溶剂[/font][font=Calibri]pH[/font][font=宋体]所影响,因为溶剂会与蛋白进行氢离子交换。通常情况下,蛋白与[/font][font=Calibri]IEX[/font][font=宋体]的结合必须通过反复试验来确定,使用一系列[/font][font=Calibri]pH[/font][font=宋体]值的溶剂以确定蛋白保留的最佳[/font][font=Calibri]pH[/font][font=宋体]。通常溶剂的[/font][font=Calibri]pH[/font][font=宋体]值与[/font][font=Calibri]pI[/font][font=宋体]相差约一个[/font][font=Calibri]pH[/font][font=宋体]单位就足以实现蛋白结合。[/font][/font][font=宋体] [font=Calibri]4.HPLC[/font][font=宋体]法蛋白纯化:[/font][/font][font=宋体] [font=宋体]色谱法是一种常用分析技术,可以将混合物分离成单独的成分。高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法通常称为[/font][font=Calibri]HPLC[/font][font=宋体],在化学生物学研究实验室中广泛应用。[/font][/font][font=宋体] [font=宋体]在化学生物学中,单个分析物(如多肽)通常经色谱纯化后作为一种功能工具使用。高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法[/font][font=Calibri](HPLC)[/font][font=宋体]是一种用于分析和分离液体样品的方法。在化学生物学实验室中,[/font][font=Calibri]HPLC[/font][font=宋体]是纯化多肽(人工合成或用合成器自动合成)和其他中小型有机分子不可或缺的过程。它还允许使用颗粒非常小的柱填料,这就给固定相和流经它的分子之间产生相互作用提供了更大的表面积,这样可以更好地分离混合物的成分。[/font][/font][font=宋体][font=宋体]针对特定应用开发的[/font][font=Calibri]HPLC[/font][font=宋体]色谱柱有很多种类,如正相[/font][font=Calibri]HPLC(NP-HPLC)[/font][font=宋体]和反相[/font][font=Calibri]HPLC(RP-HPLC)[/font][font=宋体]。正确选择色谱柱是获得良好的[/font][font=Calibri]HPLC[/font][font=宋体]结果的关键。色谱柱的选择取决于我们希望分离的混合物的组分特性。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供从基因合成、载体构建到蛋白质表达、纯化的一站式服务,可以根据客户需求,选用不同表达[/font][font=Calibri]/[/font][font=宋体]纯化标签、表达宿主等,真正为客户实现深度私人定制。多种纯化体系,为蛋白表达、纯化提供多种选择,我们致力于为客户提供高质量、低成本的重组蛋白。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多[url=https://cn.sinobiological.com/services/recombinant-protein-expression-service][b]重组蛋白表达纯化服务[/b][/url]详情尽在:[/font][font=Calibri]https://cn.sinobiological.com/services/recombinant-protein-expression-service[/font][/font]
[font=宋体][b]亲和层析技术的原理:[/b][/font][font=宋体][font=宋体]亲和分析是利用生物聚合物与基础可逆结合的原理,通过共价键将基础与载体牢固结合而成的分析系统。这种可逆结合的作用主要取决于生物聚合物对其基础的空间结构的识别。受体蛋白、载体蛋白、外源凝集素[/font][font=Calibri]-[/font][font=宋体]多糖、糖蛋白、细胞表面受体、核酸[/font][font=Calibri]-[/font][font=宋体]互补核苷酸序列、组蛋白、核酸结合蛋白等。它具有高效、简单、快速的优点,是目前分离纯化蛋白质最理想的方法。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]在亲和色谱中,在影响蛋白质(或标签)与其配体结合的情况下,将蛋白质装载在柱子上。在不破坏特定相互作用但能破坏污染蛋白质与固定相互作用的情况下,清洗组合蛋白质。然后用含有竞争性分子的缓冲液或破坏所有蛋白[/font][font=Calibri]/[/font][font=宋体]蛋白相互作用的条件洗脱结合的蛋白。竞争分子与配体结合,取代目标蛋白,这种竞争分子通常通过另一种色谱流程或透析法从目标蛋白中去除。[/font][/font][font=宋体] [/font][font=宋体][b]亲和色谱配体和条件[/b][/font][font=宋体]需纯化的蛋白[/font][font=宋体]配体[/font][font=宋体]洗脱条件[/font][font=宋体]抗体(抗原特异性)[/font][font=宋体]抗原肽[/font][font=宋体]游离肽[/font][font=宋体]多聚组氨酸标签蛋白[/font][font=宋体][font=Calibri]Ni2+[/font][font=宋体]或[/font][font=Calibri]Co2+[/font][/font][font=宋体]咪唑或游离组氨酸[/font][font=宋体][font=Calibri]FLAG[/font][font=宋体]标签蛋白[/font][/font][font=宋体][font=Calibri]FLAG[/font][font=宋体]特异性抗体[/font][/font][font=宋体][font=Calibri]FLAG[/font][font=宋体]肽或低[/font][font=Calibri]pH[/font][font=宋体]值[/font][/font][font=宋体][font=Calibri]GST[/font][font=宋体]标签蛋白[/font][/font][font=宋体]还原型谷胱甘肽[/font][font=宋体]游离谷胱甘肽[/font][font=宋体][font=Calibri]Myc[/font][font=宋体]标签蛋白[/font][/font][font=宋体][font=Calibri]Myc[/font][font=宋体]特异性抗体[/font][/font][font=宋体][font=宋体]低[/font][font=Calibri]pH[/font][/font][font=宋体]抗体(类特异性)[/font][font=宋体][font=宋体]蛋白[/font][font=Calibri]A[/font][font=宋体]、[/font][font=Calibri]G[/font][font=宋体]和[/font][font=Calibri]L[/font][font=宋体]或精蛋白[/font][/font][font=宋体][font=Calibri]pH[/font][font=宋体]极端值[/font][/font][font=宋体][font=Calibri]DNA[/font][font=宋体]结合蛋白[/font][/font][font=宋体]肝素[/font][font=宋体]高离子强度[/font][font=宋体] [/font][font=宋体][b]亲和纯化蛋白的注意点:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]a. Ni[/font][font=宋体]柱进行蛋白纯化时注意点:[/font][/font][font=宋体] [/font][font=宋体][font=Calibri](1)[/font][font=宋体]避免缓冲液中有高浓度的电子供体基团,比如:[/font][font=Calibri]NH4[/font][font=宋体],甘氨酸,精氨酸,等等;[/font][/font][font=宋体][font=Calibri](2)[/font][font=宋体]各种缓冲液中不能有强螯合剂,如[/font][font=Calibri]EDTA[/font][font=宋体],[/font][font=Calibri]EGTA[/font][font=宋体],等等;[/font][/font][font=宋体][font=Calibri](3)[/font][font=宋体]各种缓冲液里不能有高浓度的强还原剂,,比如[/font][font=Calibri]DTT[/font][font=宋体],防止二价[/font][font=Calibri]Ni[/font][font=宋体]被还原;[/font][/font][font=宋体][font=Calibri](4) [/font][font=宋体]不能含离子型的去垢剂,比如[/font][font=Calibri]SDS[/font][font=宋体],防止[/font][font=Calibri]Ni[/font][font=宋体]流失;[/font][/font][font=宋体][font=Calibri](5)[/font][font=宋体]在破碎细胞的时候建议加入蛋白酶抑制剂,比如[/font][font=Calibri]0.1-1mM[/font][font=宋体]的[/font][font=Calibri]PMSF[/font][font=宋体],防止目的蛋白被降解;[/font][/font][font=宋体][font=Calibri](6)[/font][font=宋体]缓冲液里可以加入甘油,防止蛋白之间由于疏水相互作用而发生聚集沉淀,甘油浓度最高可达[/font][font=Calibri]50%[/font][font=宋体]([/font][font=Calibri]v/v[/font][font=宋体])[/font][/font][font=宋体][font=Calibri](7)[/font][font=宋体]应避免含碳酸氢钠,柠檬酸等物质;[/font][/font][font=宋体][font=Calibri](8)[/font][font=宋体]缓冲液里[/font][font=Calibri]NaCl[/font][font=宋体]的浓度应在[/font][font=Calibri]300mM[/font][font=宋体]到[/font][font=Calibri]2M[/font][font=宋体]之间;[/font][/font][font=宋体][font=Calibri](9)[/font][font=宋体]可加入变性剂促溶,盐酸胍(最高可[/font][font=Calibri]6M[/font][font=宋体]),尿素(最高可[/font][font=Calibri]8M[/font][font=宋体])[/font][/font][font=宋体][font=Calibri](10)[/font][font=宋体]可加入非离子型去垢剂,如[/font][font=Calibri]Triton[/font][font=宋体],[/font][font=Calibri]Tween[/font][font=宋体],[/font][font=Calibri]NP40[/font][font=宋体]等,最高[/font][font=Calibri]2%[/font][font=宋体],可以减少背景蛋白污染和去除核酸污染;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]b. gst[/font][font=宋体]柱进行蛋白纯化时注意点[/font][/font][font=宋体] [/font][font=宋体][font=Calibri](1)[/font][font=宋体]在细胞裂解时,加入终浓度[/font][font=Calibri]1[/font][font=宋体]–[/font][font=Calibri]10 mM DTT[/font][font=宋体]可以显著提高[/font][font=Calibri]GST[/font][font=宋体]融合蛋白的结合效率, 在[/font][font=Calibri]Binding Buffer[/font][font=宋体]和[/font][font=Calibri]Elution Buffer[/font][font=宋体]中加入[/font][font=Calibri]1[/font][font=宋体]–[/font][font=Calibri]10 mM DTT[/font][font=宋体],可以提高蛋白纯度,但是会导致其产率降低[/font][/font][font=宋体][font=Calibri](2)[/font][font=宋体]超声太剧烈或时间过长会引起蛋白变性,导致蛋白不能与介质结合。[/font][/font][font=宋体][font=Calibri](3)[/font][font=宋体]在[/font][font=Calibri]pH[/font][font=宋体]值低于[/font][font=Calibri]6.5[/font][font=宋体]或高于[/font][font=Calibri]8.0[/font][font=宋体]结合效率会降低,使用前需用[/font][font=Calibri]pH6.5[/font][font=宋体]~[/font][font=Calibri]8.0[/font][font=宋体]的[/font][font=Calibri]Buffer[/font][font=宋体]如[/font][font=Calibri]PBS[/font][font=宋体]进行平衡;[/font][/font][font=宋体][font=Calibri](4)[/font][font=宋体]增大[/font][font=Calibri]Elution Buffer[/font][font=宋体]的[/font][font=Calibri]pH[/font][font=宋体]值。[/font][font=Calibri]Elution Buffer[/font][font=宋体]的[/font][font=Calibri]pH[/font][font=宋体]值调至[/font][font=Calibri]pH 8[/font][font=宋体]–[/font][font=Calibri]9[/font][font=宋体]可以提高洗脱效率而不需要增加[/font][font=Calibri]glutathione[/font][font=宋体]的浓度;[/font][/font][font=宋体][font=Calibri](5)[/font][font=宋体]增加[/font][font=Calibri]Elution Buffer[/font][font=宋体]的离子强度。加入[/font][font=Calibri]0.1[/font][font=宋体]–[/font][font=Calibri]0.2 M NaCl[/font][font=宋体]能提高洗脱效率;[/font][/font][font=宋体][font=Calibri](6)Elution Buffer[/font][font=宋体]中加入非离子型变性剂。非特异性的疏水作用可能会阻碍[/font][font=Calibri]GST[/font][font=宋体]融合蛋白从介质上增溶和洗脱。加入[/font][font=Calibri]0.1% Triton X-100 or 2% N-octylglucoside[/font][font=宋体]可以显著增加洗脱效率[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]c. proteinA[/font][font=宋体]柱进行蛋白纯化时注意点[/font][/font][font=宋体] [/font][font=宋体][font=Calibri](1)[/font][font=宋体]介质的选择[/font][font=Calibri]A,G or [/font][font=宋体]其他,其结合能力的选择[/font][/font][font=宋体][font=Calibri](2)[/font][font=宋体]上样流速尽量小,让[/font][font=Calibri]Protein G[/font][font=宋体]和抗体有充分的结合时间[/font][/font][font=宋体][font=Calibri](3)[/font][font=宋体]在低[/font][font=Calibri]pH[/font][font=宋体]值洗脱后,快速中和。[/font][/font][font=宋体][font=Calibri](4)[/font][font=宋体]长时间保存加入[/font][font=Calibri]0.02-0.05[/font][font=宋体]%叠氮钠;[/font][/font][font=宋体][font=Calibri](5)[/font][font=宋体]加入[/font][font=Calibri]10%[/font][font=宋体]甘油,可有效防止疏水作用引起的聚集。[/font][/font][font=宋体][font=Calibri](6)[/font][font=宋体]抗体纯度不够,杂蛋白含量高,易引起蛋白的沉淀。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]目前义翘神州提供[url=https://cn.sinobiological.com/services/recombinant-protein-expression-service]重组蛋白表达服务[/url],包含[/font][font=Calibri]VLP[/font][font=宋体]形式的膜蛋白表达服务、原核([/font][font=Calibri]E. coli[/font][font=宋体])蛋白表达服务、哺乳动物细胞瞬时表达服务、杆状病毒[/font][font=Calibri]-[/font][font=宋体]昆虫细胞蛋白表达服务、稳定细胞系构建服务等,想咨询蛋白纯化服务的用户,可以直接[/font][font=Calibri]https://cn.sinobiological.com/services/recombinant-protein-expression-service[/font][/font]
[font=宋体][font=Calibri]GST[/font][font=宋体]标签蛋白纯化原理:[/font][/font][font=宋体][font=宋体]谷胱甘肽[/font][font=Calibri]-S-[/font][font=宋体]转移酶[/font][font=Calibri](GST)[/font][font=宋体]是一个由[/font][font=Calibri]211[/font][font=宋体]个氨基酸组成的大小为[/font][font=Calibri]26kDa[/font][font=宋体]序列,它是另一种广泛使用的可提高靶蛋白的溶解度亲和标签。[/font][font=Calibri]GST[/font][font=宋体]标签与固定化的谷胱甘肽具有亲和力,常用于原核表达。它可以与一个蛋白的[/font][font=Calibri]N[/font][font=宋体]端或[/font][font=Calibri]C[/font][font=宋体]端融合。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]谷胱甘肽亲和是一种有效的一步纯化[/font][font=Calibri]GST([/font][font=宋体]谷胱甘肽[/font][font=Calibri]S-[/font][font=宋体]转移酶[/font][font=Calibri])[/font][font=宋体]标签蛋白的方法。[/font][font=Calibri]GST[/font][font=宋体]可作为一种可溶性蛋白在大肠杆菌细胞质中大量表达,并具有完全的酶活性。此外,许多在大肠杆菌中表达时不溶的真核蛋白,在表达为[/font][font=Calibri]GST[/font][font=宋体]标签蛋白时被证明至少部分可溶。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]谷胱甘肽[/font][font=Calibri]S-[/font][font=宋体]转移酶([/font][font=Calibri]GST[/font][font=宋体])的应用:[/font][/font][font=宋体] [/font][font=宋体][font=宋体]谷胱甘肽[/font][font=Calibri]S-[/font][font=宋体]转移酶([/font][font=Calibri]GST[/font][font=宋体])是具有多基因、多功能的[/font][font=Calibri]II[/font][font=宋体]相代谢酶家族成员,广泛存在于动物、植物、昆虫、真菌、酵母和各种细菌中。能够催化还原型谷胱甘肽与各种亲电化合物进行亲核加成反应,从而使其极性提高,易于从尿液中排出。因此,[/font][font=Calibri]GST[/font][font=宋体]家族蛋白是一类在外源化合物生物转化、保护机体免受过氧化作用损害和药物代谢过程中的一类极为重要的多功能蛋白质。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]在生物研究领域,来源于日本血吸虫的谷胱甘肽巯基转移酶([/font][font=Calibri]GST[/font][font=宋体])标签,是目前应用最为广泛的融合标签之一。融合标签技术是利用[/font][font=Calibri]DNA[/font][font=宋体]重组技术将某种标签编码基因融合于目的基因的[/font][font=Calibri]3[/font][font=宋体]′端或[/font][font=Calibri]5[/font][font=宋体]′端,再通过适宜的宿主来表达融合蛋白。表达的融合蛋白可以通过其融合标签与包被在固相基质上的特异性配基结合,从而纯化出融合蛋白。[/font][font=Calibri]1988[/font][font=宋体]年,[/font][font=Calibri]Smith[/font][font=宋体]和[/font][font=Calibri]Johnson[/font][font=宋体]首次提出[/font][font=Calibri]GST[/font][font=宋体]融合蛋白的亲和纯化法,此后广泛使用。目前,国内外纯化[/font][font=Calibri]GST[/font][font=宋体]融合蛋白的主要方法是亲和纯化法。[/font][font=Calibri]GST[/font][font=宋体]标签蛋白亲和纯化,其配基通常是[/font][font=Calibri]GST[/font][font=宋体]的底物谷胱甘肽([/font][font=Calibri]GSH[/font][font=宋体]),通过酶与底物的特异性结合来实现[/font][font=Calibri]GST[/font][font=宋体]蛋白的分离纯化。其原理是:在固相基质上通过巯基结合一个谷胱甘肽,然后利用谷胱甘肽与谷胱甘肽巯基转移酶之间的特异性作用力,使得带[/font][font=Calibri]GST[/font][font=宋体]标签的融合蛋白与基质上的谷胱甘肽结合,达到分离纯化的目的。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]自[/font][font=Calibri]GST[/font][font=宋体]融合蛋白亲和纯化法问世以来,[/font][font=Calibri]GST-pull down[/font][font=宋体]技术也随即成为一种研究蛋白质与蛋白质之间相互作用的热门手段。该技术的原理是:利用重组技术将诱饵蛋白与[/font][font=Calibri]GST[/font][font=宋体]标签融合表达,融合表达的蛋白经纯化后与待测蛋白共同孵育,并用[/font][font=Calibri]GST[/font][font=宋体]琼脂糖凝胶或[/font][font=Calibri]GST[/font][font=宋体]琼脂糖磁珠将其分离下来,再通过[/font][font=Calibri]SDS-PAGE[/font][font=宋体]鉴定待测蛋白与诱饵蛋白的相互作用。这种方法简单易行,操作简单。此外,[/font][font=Calibri]GST[/font][font=宋体]标签还有助于对目标蛋白的检测。[/font][/font][font=宋体] [/font][font=宋体][b][font=Calibri][url=https://cn.sinobiological.com/resource/protein-review/gst-tag-protein-expression]GST[/url][/font][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/gst-tag-protein-expression]标签蛋白纯化[/url]常见问题解答:[/font][/b][/font][font=宋体] [/font][font=宋体][font=宋体]为什么使用[/font][font=Calibri]GST[/font][font=宋体]标签来表达和生产蛋白?[/font][/font][font=宋体][font=宋体]在蛋白[/font][font=Calibri]N[/font][font=宋体]端添加[/font][font=Calibri]GST[/font][font=宋体]标签有利于通过[/font][font=Calibri]GSH[/font][font=宋体]亲和树脂对其进行检测、分离和纯化。更重要的是,由于[/font][font=Calibri]GST[/font][font=宋体]是具有很好的溶解性的高表达的蛋白,将难以表达的蛋白与[/font][font=Calibri]GST[/font][font=宋体]标签相融合,有时可以显著提高重组蛋白的表达量和溶解性。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]纯化后如何裂解[/font][font=Calibri]GST[/font][font=宋体]标签?[/font][/font][font=宋体][font=宋体]在某些应用(如蛋白的结晶)中需要去除[/font][font=Calibri]GST[/font][font=宋体]标签。为了裂解[/font][font=Calibri]GST[/font][font=宋体]标签,需要在标签和蛋白之间设计一个蛋白酶裂解位点。在 [/font][font=Calibri]GST[/font][font=宋体]标签后面的[/font][font=Calibri]EK[/font][font=宋体]裂解位点[/font][font=Calibri](GST-EK[/font][font=宋体]位点[/font][font=Calibri]-[/font][font=宋体]蛋白结构[/font][font=Calibri])[/font][font=宋体]可以使[/font][font=Calibri]GST[/font][font=宋体]标签和裂解位点完全去除,在[/font][font=Calibri]GST[/font][font=宋体]标签的特异裂解后不留下任何额外的氨基酸。[/font][/font][font=宋体] [/font][font=宋体][b][font=Calibri]GST[/font][font=宋体]标签纯化蛋白的优劣势?[/font][/b][/font][font=宋体] [/font][font=宋体]优势:[/font][font=宋体] [/font][font=宋体][font=Calibri]1. [/font][font=宋体]适用范围广,可在不同宿主中表达;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2. [/font][font=宋体]增强外源蛋白可溶性;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3. [/font][font=宋体]可用不同的蛋白酶进行去除;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4. [/font][font=宋体]有助于保持蛋白的抗原性与生物活性,提高外源蛋白的稳定性;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5. [/font][font=宋体]特异性好,纯化方便且温和。[/font][/font][font=宋体] [/font][font=宋体]劣势:[/font][font=宋体] [/font][font=宋体][font=Calibri]1. [/font][font=宋体]分子量较大,可能会影响蛋白质的功能和下游实验;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2. [/font][font=宋体]仅能纯化可溶性蛋白,若蛋白不可溶,则很难用变性的方法纯化。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多详情可以关注:义翘神州[/font][font=Calibri]GST[/font][font=宋体]标签[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/gst-tag-protein-expression[/font][/font]
褚福亮,王福生, 中国人民解放军第302医院全军艾滋病与病毒性肝炎重点实验室 北京市 100039项目负责人 王福生, 100039 ,北京市丰台路26号, 中国人民解放军第302医院全军艾滋病与病毒性肝炎重点实验室. fswang@public.bta.net.cn电话:010-66933332 传真:010-63831870收稿日期 2002-08-15 接受日期 2002-09-03摘要新近广泛应用蛋白质芯片(ProteinChipâ Array)系统成功鉴定出了一些重要疾病(如肿瘤和危害性较大的传染病)新的、特异性的生物标记(biomarkers),后者不仅在生物医学的基础方面具有重要的科学价值,而且在临床疾病的诊断、治疗和预防发挥重要的指导作用,显示了良好的发展前景.本文就表面增强的激光解析电离-飞行时间-质谱(SELDI-TOF-MS)相关的原理、特点、在临床和基础研究中的应用新进展和未来的发展趋势做一综述.此外,我们就蛋白质谱分析技术在病毒性肝炎、肝硬化和肝癌等一系列肝病方面的应用策略和前景进行了分析.褚福亮,王福生. 蛋白质谱分析方法特点及其在蛋白组学研究领域中的应用.世界华人消化杂志 2002 10(12):1431-14350 引言人类基因组计划已经进入后基因组时代-即功能基因组时代[1],作为基因功能的直接体现者-蛋白质,及其之间的相互作用越来越引起基础和临床科学家们的关注[2-6] .因为要彻底了解生命的本质,只把基因测出来还是不够的,还必须要了解其在生物生长、发育、衰老和整个生命过程中的功能、不同蛋白质之间的相互作用以及他们与疾病发生、发展和转化的规律[7-14] .正因为如此,有关上述问题的蛋白质组学研究成了今天生命科学最重要的焦点之一[15] .为了阐明蛋白质在上述生命现象中的作用和相关机制,人们设计了许多新的方法技术,如:二维电泳、质谱分析、微距阵列、酵母双杂交和噬菌体展示等,这些方法在一些特定的情况下,虽然显示出了他们各自不同的优点,但是同样也存在着较大的局限性,难以开展大规模、超微量、高通量、全自动筛选蛋白质等方面的分析,因而设计更全面、同时研究多种蛋白质相互作用的技术,在功能基因组和蛋白组学的研究中建立一个更有效的技术平台,成为本领域中优先关注的问题[16] .近来,美国Ciphergen(赛弗吉)公司研制的ProteinChipâ Array的仪器,并建立了一种新的蛋白质飞行质谱-表面增强的激光解析离子化-飞行时间-质谱(surface-enhanced laser desorption/inionation-time of flight-mass spectra, SELDI-TOF-MS),已取得可喜的进展,筛选出了许多与疾病相关的新型生物标志,不仅为临床疾病的诊断和治疗等提供了新的选择,而且在基础科学、新药研制和疾病预防等方面具有广泛的应用前景[16-18] .本文就SELDI-TOF-MS相关的原理、特点、在临床和基础研究中的应用新进展和未来的发展趋势做一综述.1 ProteinChipâ Array系统和SELDI-TOF-MS的特点1.1 蛋白质芯片系统的组成和原理 蛋白质芯片系统由三部分组成:蛋白质芯片、芯片阅读器和芯片软件.供研究用芯片上有6-10芯池,不同的芯片表面上的化学物质不同,芯片表面分为两大类:一类为化学类表面,包括经典的色谱分析表面,如:结合普通蛋白质的正相表面,用于反相捕获的疏水表面,阴阳离子交换表面和捕获金属结合蛋白的静态金属亲合捕获表面;另一类称为生物类,特定的蛋白质共价结合于预先活化的表面阵列,可以用来研究传统的抗体一抗原反应,DNA和蛋白质作用,受体、配体作用和其他的一些分子之间的相互作用[19] . 根据检测目的不同,可以选用不同的芯片,或者自己设计芯片.将样本和对照点到芯池上以后,经过一段时间的结合反应,用缓冲液或水洗去一些不结合的非特异分子,再加上能量吸收分子(energy absorbing molelule,EAM)溶液,使样本固定在芯片表面.当溶液干燥后,一个含有分析物和大量能量吸收分子“晶体”就形成了.能量吸收分子对于电离来说非常重要.经过以上步骤,就可经把芯片放到芯片阅读器中进行质谱分析. 在阅读器的固定激光束下,芯片上、下移动,使样本上每一个特定点都被“读”到.激光束的每一次闪光释放的能量都聚集在该区一个非常小的点上(focused laser beam,聚焦激光束).这样,每个区都含有丰富的,可寻址(addressable)的位置.蛋白质芯片处理软件精确控制激光寻读过程.当样本受到激发,就开始电离和解除吸附.不同质量的带电离子在电场中飞行的时间长短不同,计算检测到的不同时间,就可以得出质量电荷比,把他输入电脑,形成图像[19].Ball et al [20]采用一种称为人工神经网络(artifical neural network,ANN)的算法处理出现的成千上万的峰,鉴定出三个分子量为13 454、13 457和14 278的生物标记分子,使疾病预测率达到97.1 %.1.2 ProteinChipâ Array芯片和SELDI-TOF-MS的特点 新型蛋白芯片与以往的蛋白芯片不同之处:SELDI-TOF-MS,他是在MALDI(matrix-assisted laser desorption/inionation)[21,22]基础上,改进后实行表面增强的飞行质谱.SELDI-TOF-MS优于MALDI-TOF表现为他不会破坏蛋白质,或使样本与可溶的基质共结晶来产生质谱信号.对SELDI-TOF来说,可以直接将血清、尿液、组织抽取物等不需处理直接点样检测[40] 由于一部分非特异结合的分析物被洗去,因而出现的质峰非常一致,有利于后期分析[23,24] . 与二维电泳相比:二维电泳分析蛋白质的分子量在30 KDa以上时电泳图谱较清楚,对在组织抽提物中占很大比例的低丰度的蛋白质不能被检出;其次,二维电泳胶上的蛋白质斑点很大一部分包含一种以上的蛋白质;而且,二维电泳耗时长,工作量大,对象染色转移等技术要求高,不能完全实现自动化.而SELDI-TOF在200 Da-500 KDa区间都可以给出很好的质谱,对一个样本的分析在几十分钟内就可以完成[19],处理的信息量远远大于二维电泳;对于低丰度物质,即使浓度仅attomole(10-18)的分子,只要与表面探针结合,就可以检测到,这也是二维电泳所不具备的[24,25] . 对于微距阵蛋白芯片来说,需要一种不破坏折叠的蛋白质构象的固定技术,再与另外的蛋白质反应,经检测莹光来观察蛋白质之间的作用[26] .而基于SELDI-TOF-MS的ProteinChip分析蛋白质不需溶解、不需染色、廉价、针对性强. 因而蛋白质芯片仪具有以下优势:(1)可直接使用粗样本,如:血清、尿液、细胞抽提物等[27] .(2)使大规模、超微量、高通量、全自动筛选蛋白质成为可能;(3)他不仅可发现一种蛋白质或生物标记分子,而且还可以发现不同的多种方式的组合蛋白质谱,可能与某种疾病有关[28] (4)推动基因组学发展,验证基因组学方面的变化,基于蛋白质特点发现新的基因.可以推测疾病状态下,基因启动何以与正常状态下不同,受到那些因素的影响,从而跟踪基因的变化[2,14,15] . 其存在的问题:对于不同的样本,根据检测的目标采取或者设计几种芯片,理论上可以把所有的相同性质蛋白质捕获,但是实际上仍有少量的分子没与表面探针结合.使用SELDI-TOF-MS,仅能给出蛋白质的分子量,不能给出C端、N端的序列,也没法知道蛋白质的构型,因此需要将蛋白质充分纯化后,用蛋白酶消化芯片上的蛋白质,分析肽段,再用生物信息学方法鉴定蛋白质序列[18,24] .另外,在国内,该芯片费用较高,分析质谱需要大量后续工作支持.
功能性蛋白及一例分析自19世纪中叶荷兰化学家Gerardus Mul-der从动物组织和植物体中提取出蛋白质以来,人们发现了越来越多的蛋白质,据估计生物界中蛋白质的种类可达1010~1012之多;在这如此众多的蛋白质中,功能性蛋白发挥着极其重要的生理功能 。功能性蛋白也有人称其为活性蛋白。它们的特点是都有识别功能,能与其他分子特异性结合.完成各种复杂的生命活动:在结构上主要是一些球状蛋白质。1 功能性蛋白的种类按其作用方式不同可分为酶蛋白、运输蛋白、运动蛋白、免疫球蛋白、毒蛋白、激素蛋白(1)酶蛋白: 细胞的生长和繁殖、代谢物的合成和分解、能量的产生和利用,这些过程所需要的物质都是通过无数的生物化学反应来提供的.而这些反应又都是在一类特殊蛋白质—酶蛋白的催化下完成的。酶的催化效率极高,且具有高度的专一性,也正是这种高度的专一性使一种特定的酶只能作用于一种或少数几种结构相似的化合物,这就要求有各种不同的酶去作用于不同的化合物。在酶的作用下,生物细胞才得以合成各种复杂的化合物,也才能使各种大分子物质被分解、吸收和利用.且这些反应都要在适合于生物体本身的温度、压力和pH值等非常温和的条件下进行,能使生物细胞按照这种方式进行化学变化是蛋白质最重要的功能之一。常见的酶蛋白如淀粉酶使淀粉分解形成葡萄糖,蛋白酶、肽酶使蛋白质分解为氨基酸;溶菌酶使细菌细胞壁中的肤聚糖被破坏;凝血系统酶的有序作用使凝血过程得以有条不紊地进行.合成酶能合成多种体内所需要的大分子物质。应用举例:由于近年来鱼粉资源价格上涨,冷向军等人通过向鱼粉含量较低(10﹪)的饲料个添加蛋白酶AG使鱼的前肠蛋白酶有显著提高。同样有实验证明在玉米-豆粕型粮食中添加蛋白酶可以改善肉鸡的生长性能,提高蛋白质的消化率。(2)运输蛋白:有些蛋白质起载体的作用可以运输特定的物质到达必须的部位,使其完成特定的功能,这种蛋白质称为运输蛋白。如哺乳动物的血红蛋白能将氧从氧气充裕的肺内运送到各个组织中去:血清蛋白能与游离脂肪酶等多种物质结合,并将这些物质在脂肪组织与身体的其他部位间运送(最典型的β1-脂蛋白可随血流运输脂肪),铁传递蛋白能传递血液中的铁。无脊椎动物体内的血蓝蛋白,大豆根瘤中的豆血红蛋白也起着输送氧气的作用。另外还有一些能携带物质通过细胞膜进出细胞的蛋白质,如细菌过膜运输中的载体蛋白等,它们都属于运输蛋白。(3)运动蛋白:参与运动功能的蛋白质种类较多如脊椎动物中骨骼肌的主要成分就是肌动蛋白和肌球蛋白,肌肉的收缩就是靠着这两种互相联系的平行丝状蛋白相对滑动来完成的;细菌的运动器官——鞭毛也是由鞭毛蛋白组成的;绿藻的运动也离不开蛋白质;有丝分裂的完成,精子的运动等都与运动蛋白有关,所以绝大多数生物的运动和收缩过程都是运动蛋白参与的结果。应用举例:邱永忠等人在研究烟草花叶病毒(TMV)在植物细胞间的运动时发现用体外定位突变引起L株上,被点突变的DNA体外转录成RNA后感染感病烟草,结果定位突变的L株表型30kD蛋白基因四种位点不同的移码突变和一种基因中间大部分缺失的突变体均使病毒不能感染植株。这证明TMV 30kD蛋白与病毒运动有关,而与病毒复制无关。同时因为胞间连丝一般只能让小于1kD的分子通过,其通透范围远小于病毒颗粒,也小于折叠的病毒核酸分子,Wolf等实验证明正时因为30kD蛋白才使得植株分子半径扩散了三倍多。(4)免疫球蛋白:指具有抗体活性的动物蛋白。主要存在于血浆中,也见于其他体液、组织和一些分泌液中。脊椎动物的免疫系统能抵抗外来的入侵物质,如病毒、细菌以及其他机体的细胞,当外来的这些入侵物质(抗原)进入机体后就会激发机体的免疫系统而产生特异性的免疫球蛋白(抗体),通常每一种抗体对于相应的某一特定抗原具有高度的专一性,抗原与抗体结合形成抗原-抗体复合物.使入侵物质——抗原失活而排出体外,从而消除外来物质对机体的干扰。由此看来蛋白质不仅参与了高等动物的免疫反应,而且起着重要的作用,由于抗原和抗体结合的高度专一性,必然有数量众多的抗体作用于不同的抗原物质,据估计抗体的类型可能有10O万种,即免疫球蛋白可能有100万种之多。(5)毒蛋白:动物、植物和微生物都可以产生某些特殊的物质来防御敌害,这些物质中绝大多数是蛋白质类物质,由于它们对高等动物具有毒性,故称为毒蛋白。蝎类能产生毒性很强的蝎毒蛋白.用来攻击敌害,保护自己;蛇类产生的神经毒素和心赃毒素其主要成分也是小分子量的蛋白质;毒蘑菇中的相当一部分蘑菇毒素也是蛋白质;细菌产生的毒素,毒性极强的肉毒梭菌毒素(人的致死量小于19m)和破伤风痉挛毒素、白喉杆菌毒素等外毒素均是蛋白质。应用举例:王峰等人研究核糖体失活蛋白(RIPS)是一类能够抑制细胞核糖体合成蛋白质,从而导致宿主死亡的毒蛋白,广泛存在于植物、细菌中。发现其在在细胞内的转运途径研究很多,目前较为清楚的是逆向转运途径,其中以蓖麻毒素、志贺菌毒素、霍乱毒素为代表,大体过程为:内吞一内吞小体一高尔基体一内质网一胞液。(6)激素蛋白:是由特殊细胞所产生的一类物质,它们通过与靶细胞或系统内其它器官的相互作用来发挥其代谢上的功能,其实许多激素本身就是蛋白质,这样的蛋白质称为激素蛋白,它们在生物合成上具有重要的功能。如胰高血糖素、胰岛素、胃泌素、生长激素、促甲状腺激素、促肾上腺皮质激素和促脂解激素等均是蛋白