NaOH标准溶液的标定一、基本操作1.碱式滴定管的使用 a.包括使用前的准备:试漏、清洗b.标准溶液的装入:润洗、标准液的装入、排气泡、调节液面、记录初读数。c.滴定管的读数:2.滴定操作:左的拇指在前、食指在后,其余三指夹住出口管。用拇指与食指的指尖捏挤玻璃珠周围右侧的乳胶管,溶液即可流出。半滴的滴法二、标定实验(采用邻苯二甲酸氢钾KHC8H4O4为基准物进行标定)一)实验原理 NaOH溶液采用间接配制法配制,采用基准物质进行标定。常用标定NaOH溶液的基准物有:邻苯二甲酸氢钾(KHP)、草酸。本实验采用邻苯二甲酸氢钾(KHP)作为基准物质标定NaOH溶液。其标定反应为:KHP + NaOH = KNaP + H2O反应产物KHP为二元弱碱,在溶液中显弱碱性,可选用酚酞作指示剂。滴定终点颜色变化:无 微红(半分钟不褪色)二)实验步骤准确称取邻苯二甲酸氢钾0.4~0.5g于锥形瓶中,加20-30mL水,温热使之溶解,冷却后加1-2滴酚酞,用0.10mol·L-1NaOH溶液滴定至溶液呈微红色,半分钟不褪色,即为终点。平行标定三份。
请教各位老师,氨氮标准液的标定方法或硫酸铵标准液的标定方法;有同事说杂质标准国标都不标定的,假如要标定如何操作;
如题,已经标定好的标准滴定溶液放置了3个月,在使用前是否需要重新标定。
各位大虾:工作标准品的标定操作规程有规定的吗?例如:一次标定需几份标准品和几份样品?需几个人标定?分析样品时(HPLC)进样的顺序是怎样的?标准品连续进样几针?一般连续进样的RSD要求?及每个样结果之间的相对偏差等都是如何规定的?哪位师傅教教俺吧?急啊!
哪位知道GB/T 1912.1 纺织品 甲醛的测定 游离水解甲醛 这个标准中关于标准溶液的标定具体是怎么操作的,标准中讲解的不够详细,能否把具体步骤详细的讲解一下,谢谢了
在检测过程中,经常要配制各种标准溶液,比如硫酸、盐酸、氢氧化钠标液,按国标规定标液一般需要双人标定。但我们人手有限,经常自己配制自己标定,做三次重复。 大家说说看标定都是怎么操作的呢,标液是否有专人配制,一般做几次重复?
EDTA标准滴定溶液用氧化锌基准试剂标定,终点要求是纯蓝色,实际操作中近终点会出现2次蓝色,相差一滴溶液,以哪个蓝色为基准呢?
用重铬酸钾(基准试剂),高锰酸钾(分析纯)标准溶液已标定,用来标定0.1mol/L的硫酸亚铁铵标准溶液。分别按照gb11914和国标601-88进行操作,结果为0.1025和0.09713,操作绝对没有问题,反复实验结果差别都比较大,请问是什么原因!!急
依据GB/T601-2002,标准滴定溶液标定时需两人分别做四平行,那么日常分析工作中,是不是也要按照此要求去做?比如做COD、BOD、总硬度,标准溶液配制好后,每次使用前都需要进行两人分别做四平行的标定?
工作标准品质量标准的建立 要首先建立工作标准品的质量标准,总的原则是在原法定标准的基础上建立,该标准要严于药典标准。 法定标准品及标定检验方法:法定标准品是指USP、EP、CP等标准品的现行批号。要选择药典的检验方法。不同的标准采用不同的药典检验方法。 工作标准品质量标准的建立 要首先建立工作标准品的质量标准,总的原则是在原法定标准的基础上建立,该标准要严于药典标准。要将主成份含量提高,有关物质的限度降低,其它项目可不变。 一、工作标准品的标定 1、要按照工作标准品的质量标准进行标定检验。标定时要全检,复标时只测定含量。标定或复标合格后,经批准后,可用作工作标准品。如果选用了近期生产的质量较好的放行原料药作为工作标准品,标定时可以只测定含量。 2、如果标定的是USP工作标准品,那么标定时要使用USP现行批号的法定标准品,其它类推。 3、工作标准品的标定过程 A 若需要,应对标准品进行预处理(如干燥);B 选用两个熟练的人员进行标定;C 各称取一份法定标准品,三份样品;D 系统适应性试验应合格; E 同一化验员含量结果的RSD应不大于0.5%,不同化验员含量结果平均值的相对偏差应不大于0.3%; F 平均后作为标定结果 。 4、当无标准品时,自制工作标准品需按以下方法的进行标化:同一批号分别称取5份样品,每份样品进样两次,含量结果的RSD应不大于1.0%,经计算后的结果作为此自制标准品的纯度值。 5、此方法的每个平行样结果都必须符合己确立的指标时方可使用。此时,总平均值可用作自制标准品的纯度值。但此结果要考虑到水、残留溶剂或残渣的含量对结果的影响,要进行适当调整。 二、工作标准品的有效期及复标日期 1、工作标准品的有效期为两年(从标定之日起算,短于原料药的有效期)。 2、工作标准品含量每半年复标一次。 3、工作标准品的批号在原料药的批号后加-RS,作为工作对照品的批号。如:110727-RS。
经常有初学者问:我需要某某品种的0.02mol/L标准滴定溶液,如何配制和标定?根据GB/T601-2016《化学试剂 标准滴定溶液的制备》规定:3.9 标准滴定溶液的浓度小于或等于0.02mol/L时(除0.02mol/L乙二胺四乙酸二钠、氯化锌标准滴定溶液外),应于临用前将浓度高的标准滴定溶液用煮沸并冷却的水稀释(不含非水溶剂的标准滴定溶液),必要时重新标定。当需用本标准规定浓度以外的标准滴定溶液时,可参考本标准中相应标准滴定溶液的制备方法进行配制和标定。据此,除乙二胺四乙酸二钠、氯化锌标准滴定溶液外,在配制其余品种浓度小于或等于0.02mol/L的标准滴定溶液时,均应于临用前将浓度高的标准滴定溶液用煮沸并冷却的水稀释(不含非水溶剂的标准滴定溶液),必要时重新标定。示例:配制0.02 mol/L盐酸标准滴定溶液盐酸标准滴定溶液常见浓度为1mol/L、0.5mol/L及0.1mol/L。为方便配制,一般取1份(如20mL)0.1mol/L盐酸标准滴定溶液,加4份煮沸并冷却的水稀释,即定容至100mL.标定0.02 mol/L盐酸标准滴定溶液按照盐酸标准滴定溶液标定时溶液浓度与工作基准试剂无水碳酸钠质量的比例关系为1:1.9~2,一般取0.04g 工作基准试剂无水碳酸钠进行标定。
[align=center][color=#333333][b][size=24px]标准滴定溶液配制与标定的要求与注意事项[/size][/b][/color][/align][align=center]西安国联质量检测技术股份有限公司[/align][align=center]化工室:魏巧娟[/align][color=#333333]标准溶液在化学分析试验中具有举足轻重的作用,化学试剂的正确性和准确度直接影响着检验的最终结果,所以正确制备标准滴定溶液就显得尤为重要。标准溶液在滴定分析中常用作滴定剂。在其他的分析方法中用标准溶液绘制工作曲线或作计算标准。配制方法有两种,一种是直接法,即准确称量基准物质,溶解后定容至一定体积;另一种是标定法,即先配制成近似需要的浓度,再用基准物质或用标准溶液来进行标定。已知准确浓度的溶液,在容量分析中用作滴定剂,以滴定被测物质。如果试剂符合基准物质的要求 (组成与化学式相符、纯度高、稳定),可以直接配制标准溶液,即准确称出适量的基准物质,溶解后配制在一定体积的容量瓶内。可由下式计算应称取的基准物质的重量W:W=ΜV基准物质的摩尔质量。式中Μ和V分别为所需配制的溶液的摩尔浓度和体积。利用上式可计算出标准溶液的浓度。如果试剂不符合基准物质的要求,则先配成近似于所需浓度的溶液,然后再用基准物质准确地测定其浓度,这个过程称为溶液的标定。[/color][color=#333333]然而在其制备与标定过程中却有很多方面容易被忽视。其中GB/T 601-2016《化学试剂 标准滴定溶液的制备》标准中明确规定了标准滴定溶液在配制与标定时的要求要注意以下方面:[/color][color=#333333]除另有规定外,实验室用水应符合6682中三级水的规格。[/color][color=#333333]制备标准溶液的浓度,除高氯酸外,均指20℃的浓度。在标准滴定溶液的标定、直接制备和使用时若有温度差异,应按附录A进行补正。标准滴定溶液的标定、直接制备和使用时所用分析天平、砝码、滴定管、容量瓶、单标吸管等均须定期校正。[/color][color=#333333]3.在标定和使用标准滴定溶液时,滴定速度一般应保持在6 mL/min~8mL/min。[/color][color=#333333]4.称量工作基准试剂的质量数值小于等于0.5g时,按精确至0.01mg称量,数值大于0.5g时按精确至0.1mg称量。[/color][color=#333333]5.制备标准滴定浓度值应在规定浓度值的士5%的范围内。[/color][color=#333333]6.标定标准滴定溶液浓度时,须应两入进行实验,分别各做四平行,每人四平行测定结果极差的相对值不得大于0.15%,两人共八平行测定结果极差的相对值不得大于0.18%。取八平行测定结果的平均值为测定结果。在运算过程式中保留五位有效数字,浓度值报出结果取四位有效数字。[/color][color=#333333]7.本标准中标准滴定溶液浓度平均值的扩展不确定度一般不应大标准滴定溶液的浓度小于等于0.02moL时,应于临用前将浓度高的标准滴定溶液用煮沸并冷至却的水稀释,必要时重新标。[/color][color=#333333]同时在配制不同性质的不同标准滴定溶液在配制过程、贮存、标签的填写等也要注意以下方面:[/color][color=#333333]溶液要用带塞的试剂瓶盛装 见光易分解的溶液要装于棕色瓶中 挥发性试剂(如,有机试剂)配制的溶液,瓶塞要严密 见空气易变质及放出腐蚀性气体的溶液也要盖紧,长期存放要用蜡封住 浓碱溶液应用塑料瓶装,如装在玻璃瓶中,要用橡皮塞塞紧,不能用玻璃磨口塞。[/color][color=#333333]2.每瓶试剂瓶必须有标明名称、规格、浓度和配制日期的标签。[/color][color=#333333]3.配制硫酸、磷酸、硝酸、盐酸等溶液时,都应把酸倒入水中。对于溶解时放热较多的试剂,不可在试剂瓶中配制,以免炸裂。配制硫酸溶液时,应将浓硫酸分为小份慢慢倒入水中,边加边搅拌,必要时以冷水冷却烧杯外壁。[/color][color=#333333]4.有机溶剂配制溶液(如,配制指示剂溶液时),有时有机物溶解较慢,应不时搅拌,可以再热水浴中温热溶液,不可以直接加热,易燃溶剂使用时要远离明火。几乎所有的有机溶剂都有毒,应在通风柜内操作。应避免有机溶剂不必要的蒸发,烧杯应加盖。[/color][color=#333333]5.要熟悉一些常用溶液的配制方法。如碘溶液应将碘溶于较浓的KI水溶液中,才可稀释。配制易水解的盐类的水溶液应先加酸溶解后,再以一定浓度的稀酸稀释,如,配制SnCl[/color][size=undefined][color=#333333]2[/color][/size][color=#333333]溶液时,如果操作不当已发生水解,加相当多的酸仍难溶解沉淀。[/color][color=#333333]6.标准溶液不能用手接触腐蚀性及有剧毒的溶液。剧毒废液应作解毒处理,不可直接倒入下水道。[/color][color=#333333]实验室应该专人进行配制与标定溶液,同时及时填写配制与标定记录,标准溶液的有效期除另有规定外,一般标准贮备液为六个月,浊度标准贮备液,在冷处避光保存条件下,可在两个月内使用,用前摇匀,超过期限的标准溶液应重新配制。所使用的标准溶液应按规定浓度,临用前用贮备液稀释而得。标准溶液应由专人管理,统一分发。[/color][color=#333333]领发双方核对品名、批号、浓度、配制日期、使用期和标签后,在标准溶液领发记录上签字。如样品不符合规定或在限度边缘时,应重新配制标准溶液再进行复查。使用过程中发现标准溶液岀现混浊、沉淀等异常情况或超过使用期限的,应立即停用。[/color]
全面详解常用标准溶液的配制与标定(分析与实验)标准溶液是援引美国加联数据库定义已知准确浓度的溶液。在滴定分析中常用作滴定剂。在其他的分析方法中用标准溶液绘制工作曲线或作计算标准。如果试剂符合基准物质的要求 (组成与化学式相符、纯度高、稳定),可以直接配制标准溶液,即准确称出适量的基准物质,溶解后配制在一定体积的容量瓶内。如果试剂不符合基准物质的要求,则先配成近似于所需浓度的溶液,然后再用基准物质准确地测定其浓度,这个过程称为溶液的标定。标准溶液的配制方法直接配制法:用基准物质(如K2Cr2O7)来直接配制标准溶液。因为这些基准物质能够符合基准物质条件,容易得到。此法溶液浓度由计算而得,浓度不必标定。间接配制法:不能得到符合基准物条件的物质(如NaOH 、HCl ),先配制近似浓度的标准溶液,再用基准物质或另一种已知浓度的标准溶液来标定它的浓度。这种配制方法比较费事,但大多数标准溶液都是这样配制的。溴酸钾标准溶液的配制与标定配制:c(1/6KBrO3)=0.1mol/l称取3g溴酸钾,溶于1000ml水中,摇匀标定方法及计算同溴标准溶液的标定及计算碘标准溶液的配制与标定配制:c(1/2I2)=0.1mol/l称取13g碘及25g碘化钾,溶于100ml水中,稀释至1000ml,摇匀,保存于棕色具塞瓶中。标定:称取0.15g预先在硫酸干燥器中干燥至恒重的基准三氧化二砷,称准至0.0001g。置于碘量瓶中,加4ml氢氧化钠溶液溶解,加50ml水,加2滴酚酞指示剂,用硫酸溶液中和,加3g碳酸氢钠及3ml5g/l淀粉指示剂,用配好的碘溶液c(1/2I2)=0.1mol/l滴定至溶液呈浅蓝色。同时作空白试验。
名 称 盐酸滴定液的配制及标定操作规程 一、 目 的:建立盐酸滴定液(1mol/L、0.5mol/L、0.2mol/L、 0.1mol/L)的配制及标定的标准操作规程,确保检验的准确性。二、 适用范围:适用于盐酸滴定液(1mol/L、0.5mol/L、0.2mol/L、0.1mol/L)的配制及标定。三、 责 任 者:QC化验员、QA。四、 引用标准:中华人民共和国药典(2000年版)二部附录。五、 规 程:1、误差要求: 法定标准标定 标定份数≥3份,相对偏差≤0.1%复标 复标份数≥3份,相对偏差≤0.1%标定、复标 二者的相对偏差≤0.15%滴定液浓度 (F)应在1.000-1.050之间2、反应原理:2HCl+Na2CO3 2 NaCl+H2O+CO23、指示剂:甲基红-溴甲酚绿混合指示液4、基准试剂:基准无水碳酸钠5、仪器与用具:三角烧瓶、滴定管6、操作步骤配制:盐酸滴定液(1 mol/L) 取盐酸90 ml,加水适量使成1000 ml,摇匀。 盐酸滴定液(0.5 mol/L、0.2 mol/L或0.1 mol/L) 照上法配制,但盐酸的取用量分别为45 ml、18 ml或9.0 ml。标定:盐酸滴定液(1 mol/L) 取在270~300 ℃干燥至恒重的基准无水碳酸钠约1.5g,精密称定,加水50ml使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色转变为紫红色时,煮沸2分种,冷却至室温,继续滴定至溶液由绿色变为暗紫色。每1ml盐酸滴定液(1mol/L)相当于53.00mg的无水碳酸钠。根据本液的消耗量与无水碳酸钠的取用量,算出本液的浓度,即得。盐酸滴定液(0.5mol/L) 照上法标定,但基准无水碳酸钠的取用量改为约0.8g。每1ml盐酸滴定液(0.5mol/L)相当于26.50mg的无水碳酸钠。盐酸滴定液(0.2mol/L) 照上法标定,但基准无水碳酸钠的取用量改为约0.3g。每1ml盐酸滴定液(0.2mol/L)相当于10.60mg的无水碳酸钠。盐酸滴定液(0.1mol/L) 照上法标定,但基准无水碳酸钠的取用量改为约0.15g。每1ml盐酸滴定液(0.1mol/L)相当于5.30mg的无水碳酸钠。如需用盐酸滴定液(0.05 mol/L、0.02 mol/L或0.01 mol/L)时,可取盐酸滴定液(1mol/L或0.1mol/L)加水稀释制成。必要时标定浓度。7、计算公式: 盐酸滴定液(1 mol/L) F=M/(V×0.053)盐酸滴定液(0.5 mol/L) F=M/(V×0.0265)盐酸滴定液(0.02mol/L) F=M/(V×0.0106)盐酸滴定液(0.1 mol/L)F=M/(V×0.0053)式中:M无水碳酸钠的质量(g) V滴定所耗盐酸滴定液的体积(ml) 8、注意事项反应致近终点时,应加热煮沸2分钟,以赶走溶解于水中的CO2,排除CO2对反应的干扰。
如果所要测定的化合物的浓度范围变化较大,是应该用同一条浓度范围可以覆盖所有样品要求的标准曲线标定呢?还是用两条各自合适高低浓度的标准曲线进行标定呢?当然有中间浓度的存在,这个要看标准曲线中与中间浓度较为相近的标样在哪条中得到的结果更接近实际结果来决定。对此有哪些专门的规定吗?还是具体问题具体分析?曾经试过 用一个很大浓度范围的标准曲线,对于高端浓度,结果较准,可是对于低端浓度偏差较大。
请教各位大神关于实验室标准滴定液标定需要几人几平行 以及标定结果需要满足什么条件的相关标准是哪个?标准号是多少?
5.1 仪器与用具5.1.1 分析天平 其分度值(感量)应为0.1mg或小于0.1mg,毫克组砝码需经校正,并列有校正表备用。5.1.2 10、25和50ml滴定管 应附有该滴定管的校正曲线或校正值。5.1.3 10、15、20和25ml移液管 其真实容量应经校准,并附有校正值。5.1.4 250ml和1000ml量瓶 应符合国家A级标准,或附有校正值。5.2 试药与试液5.2.1 均应按下列各滴定液项下的规定取用。5.2.2基准试剂应有专人负责保管与领用。5.3配制滴定液的配制方法有间接配制法与直接配制法两种,应根据规定选用,并应遵循下列有关规定。5.3.1所用溶剂“水”,系指蒸馏水或去离子水,在未注明有其他要求时,应符合纯化水的规定。5.3.2采用间接配制法时,溶质与溶剂的取用量均应根据规定量进行称取或量取,并且制成后滴定液的浓度值应为其名义值的0.95~1.05;如在标定中发现其浓度值超出其名义值的0.95~1.05范围时,应加入适量的溶质或溶剂予以调整。当配制量大于1000ml时,其溶质与溶剂的取用量均应按比例增加。5.3.3采用直接配制法时,其溶质应采用“基准试剂”,并按规定条件干燥至恒重后称取,取用量应为精密称定(精确至4~5位有效数字),并置1000ml量瓶中,加溶剂溶解并稀释至刻度,摇匀。配制过程中应有核对人,并在记录中签名以示负责。5.3.4配制浓度等于或低于0.02mol/L的滴定液时,除另有规定外,应于临用前精密量取浓度等于或大于0.1mol/L的滴定液适量,加新沸过的冷水或规定的溶剂定量稀释制成。 5.3.5配制成的滴定液必须澄清,必要时可滤过;并按各该滴定液项下的条件贮存,经下述标定其浓度后方可使用。5.4标定“标定”系指根据规定的方法,用基准物质或已标定的滴定液准确测定滴定液浓度(mol/L)的操作过程;应严格遵照本规定中各该滴定液项下的方法进行标定,并应遵循下列有关规定。 5.4.1 工作中所用分析天平及其砝码、滴定管、量瓶和移液管等,均应经过检定合格;其校正值与原标示值之比的绝对值大于0.05%时,应在计算中采用校正值予以补偿。5.4.2标定工作宜在室温(10~30℃)下进行,并应在记录中注明标定时的室内温度。5.4.3所用基准物质应采用“基准试剂”,取用时应先用玛瑙乳钵研细,并按规定条件干燥,置干燥器中放冷至室温后,精密称取(精确至4~5位数);有引湿性的基准物质宜采用“减量法”进行称重。如系以另一已标定的滴定液作为标准溶液,通过“比较”进行标定,则该另一已标定的滴定液的取用应为精密量取(精确至0.01ml),用量除另有规定外应等于或大于20ml),其浓度亦应按本规定规定准确标定。5.4.4根据滴定液的消耗量选用适宜容量的滴定管;滴定管应洁净,玻璃活塞应密合、旋转自如,盛装滴定液前,应先用少量滴定液淋洗3次,盛装滴定液后,宜用小烧杯覆盖管口。 5.4.5标定中,滴定液宜从滴定管的起始刻度开始;滴定液的消耗量,除另有特殊规定外,应大于20ml,读数应估计到0.01ml。5.4.6标定中的空白试验,系指在不加供试品或以等量溶剂替代供试液的情况下,按同法操作和滴定所得的结果。5.4.7标定工作应由初标者(一般为配制者)和复标者在相同条件下各作平行试验3份;各项原始数据经校正后,根据计算公式分别进行计算:3份平行试验结果的相对平均偏差,除另有规定外,不得大于0.1%;初标平均值和复标平均值的相对偏差也不得大于0.1%;标定结果按初、复标的平均值计算,取4位有效数字。5.4.8直接法配制的滴定液,其浓度应按配制时基准物质的取用量(准确至4~5位数)与量瓶的容量(加校正值)以及计算公式进行计算,最终取4位有效数字。5.4.9临用前按稀释法配制浓度等于或低于0.02mol/L的滴定液,除另有规定外,其浓度可按原滴定液(浓度等于或大于0.1mol/L)的标定浓度与取用量(加校正值),以及最终稀释成的容量(加校正值),计算而得。5.5贮藏与使用5.5.1滴定液在配制后应按各滴定液规定的条件贮存,一般宜采用质量较好的具玻璃塞的玻瓶。 5.5.2应在滴定液贮瓶外的醒目处贴上标签,写明滴定液名称及其标示浓度;并在标签下方加贴如下内容的表格,根据记录填写。配制或标定日期室温 浓度或校正因子(“F”值) 配制者 标定者 复核者 5.5.3滴定液经标定所得的浓度或其“F”值,除另有规定外,可在3 个月内应用;过期应重新标定。当标定与使用时的室温相差未超过10℃时,除另有规定外,其浓度值可不加温度补正值;但当室温之差超过10℃,应加温度补正值,或按本操作规程5.4.7的要求进行重新标定。5.5.4当滴定液用于测定原料药的含量时,为避免操作者个体对判断滴定终点的差异而引入的误差,必要时可由使用者按本操作规程5.4.7的要求重新进行标定;其平均值与原标定值的相对偏差不得大0.1%,并以使用者复标的结果为准。5.5.5取用滴定液时,一般应事先轻摇贮存有大量滴定液的容器,使与黏附于瓶壁的液滴混合均匀,而后分取略多于需用量的滴定液置于洁净干燥的具塞玻瓶中,用以直接转移至滴定管内,或用移液管量取,避免因多次取用而反复开启贮存滴定液的大容器;取出后的滴定液不得倒回原贮存容器中,以避免污染。5.5.6当滴定液出现浑浊或其他异常情况时,该滴定液应即弃去,不得再用。6 滴定液配制及标定法6.1 乙二胺四醋酸二钠滴定液(0.05mol/L)C10H14N2Na2O8·2H2O=372.24 18.61g→1000ml 【配制】 取乙二胺四醋酸二钠19g,加适量水使溶解成1000ml,摇匀。 【标定】 取于约800℃灼烧至恒重的基准氧化锌0.12g,精密称定,加稀盐酸3ml使溶解,加水25ml,加0.025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色,加水25ml与氨-氯化铵缓冲液(pH10.0)10ml,再加铬黑T指示剂少量,用本液滴定至溶液由紫色变为纯蓝色,并将滴定的结果用空白试验校正。每1ml乙二胺四醋酸二钠滴定液(0.05mol/L),相当于4.069mg的氧化锌。根据本液的消耗量与氧化锌的取用量,算出本液的浓度,即得。【贮藏】置玻璃塞瓶中,避免与橡皮塞、橡皮管等接触。【有关注释及注意事项】 (1)配制过程中,乙二胺四醋酸二钠不易即时完全溶解,可采用加热促使其完全溶解,或在配制放置数日后再行标定。 (2)氧化锌在空气中能缓缓吸收二氧化碳,因此对标定中的基准氧化锌,要强调经800℃灼烧至恒重。具体操作为:取基准氧化锌约1g,用玛瑙研钵研细,置具盖磁坩埚中,于800℃灼烧至恒重;移置称重量瓶中,密盖,贮于干燥器中备用。 (3)滴定时溶液的pH值要较严控制,因此在基准氧化锌加稀盐酸3ml(不宜过多)溶解并加水25ml稀释后,应以甲基红为指示剂,滴加氨试液以中和多于的稀盐酸,而后再加水25ml与氨-氯化铵缓冲液(pH10.0)10ml,才能控制溶液的pH值为10左右。 (4)铬黑T在水或醇溶液中不稳定,故规定采用固体粉末状的铬黑T指示剂,而不采用指示液。(5)滴定至终点时,滴定液要逐滴加入,并充分摇匀,以防终点滴过。 (6)由于在加入的试剂中可能混杂有金属离子而消耗滴定液,因此需将滴定的结果用空白试验校正。 (7)乙二胺四醋酸二钠滴定液(0.05mol/L)的”F”值按下式计算: m F= (V1-V2)×4.069 式中:m为基准氧化锌的称取量(mg); V1为滴定中本滴定液的用量(ml); V2为空白试验中本滴定液的用量(ml); 4.069为与每1ml的乙二胺四醋酸二钠滴定液(0.05mol/L)相当以毫克表示的氧化锌的质量。上式中如将F改以浓度C (mol/L)计,则式中的“4.069”应该为“81.38”。 (8)乙二胺四醋酸二钠滴定液应贮于具玻璃塞的玻璃瓶中保存,避免与橡皮管、橡皮塞等接触。6.2四苯硼钠滴定液(0.02mol/L)(C6H5)4BNa=342.22 6.845g → 1000mL【配制】取四苯硼钠7.0g,加水50ml振摇使溶解,加入新配制的氢氧化铝凝胶(取三氯化铝1.0g,溶于25ml水中,在不断搅拌下缓缓加氢氧化钠试液至pH8~9),加氯化钠16.6g,充分搅匀,加水250ml,振摇15分钟,静置10分钟,滤过,滤液中滴加氢氧化钠试液至pH8~9,再加水稀释至1000ml,摇匀。【标定】精密量取本液10ml,加醋酸-醋酸钠缓冲液(pH3.7)10ml与溴酚蓝指示液0.5ml,用烃铵盐滴定液(0.01mol/L)滴定至蓝色,并将滴定的结果用空白试验校正。根据烃铵盐滴定液(0.01mol/L)的消耗量,算出本液的浓度,即得。本液临用前应标定浓度。如需用四苯硼钠滴定液(0.01mol/L)时,可取四苯硼钠滴定液(0.02mol/L)在临用前加水稀释制成。必要时标定浓度。【贮藏】置棕色玻瓶中,密闭保存。【有关注释及注意事项】 (1)配制过程中“加入新配制的氢氧化铝凝胶”的目的为滤液澄清;其后的“振摇15min”要强力振摇,否则制成后滴定液的浓度将偏低;“滤过”时要先倾去上清液滤过,尽可能不要把氢氧化铝凝胶倒入滤器,以免堵塞滤纸或滤器,影响滤过速度。 (2)滴定至近终点时,滴定速度要慢,并不断振摇;蓝色滴定终点的出现,系由微过量的烃铵盐
按照规定,标准品的标定需要两种不同的标定方法,比如质量平衡法和定量核磁。同一种标定方法一般要求RSD小于2%,两种方法之间的差值多少是可以接受的?比如质量平衡法的平均值是99%,定量核磁测得平均值是98%,是不是可以接受?
检测食品样品中氯的含量,用到了硝酸银标准溶液,规定要使用 GBT 601-2002 中的配制和标定方法。GBT 601 中使用的是电化学方法确认滴定终点,但是为什么要加入 淀粉溶液 呢?淀粉在滴定过程中起什么作用?另外,作为实验室认可申请的一部分,该标准溶液标定受仪器限制(复合电极+较小滴定体系+无须人工进行二级微商法,仪器自动判别滴定终点),需要对一些用量进行修改。如果相应写了标准操作规程,这个标定过程能否算是满足认可要求呢?
各位老师,关于71-3中0.07mol/L 的盐酸标定,有国标标准时说关于盐酸标定的么?
关于标准溶液配制及其基准物及其标定有标准码?今天突然发现一个问题,目前实验室所用的标准溶液都是自己配制的没看到标定记录像氢氧化钠这种对实验结果影响会很大的既然涉及到标定,我查了下资料,基准物有好几种想问下,每种试剂的标定有标准不??我百度了下 没看到求助 谢谢
关于0.1mol/L亚硝酸钠标准溶液的标定时的近终点时是这样说的:“用玻璃棒沾取一滴反应液在淀粉碘化钾试纸上,应出现浅色斑点,经过5分钟后,用同样方法试验仍出现浅兰色斑点,即为终点”。这句话理解不透,终点很难判断,请各位给予指导!谢谢!
AHMT法测定空气中甲醛含量 GB 16129-1995甲醛标准贮备溶液:取2.8mL甲醛溶液(含甲醛36%~38%)于1L容量瓶中,加0.5mL硫酸并用水稀释至刻度,摇匀。其准确浓度用下述碘量法标定。甲醛标准贮备溶液的标定:精确量取20.00mL甲醛标准贮备溶液,置于250mL碘量瓶中。 加入20.00mL0.0500mol/L碘溶液和 15mL1mol/L氢氧化钠溶液,放置 15min。加入20mL0.5mol/L硫酸溶液,再放置 15min硫代硫酸钠滴定,至溶液呈现淡黄色时,加入 1ml 0.5%淀粉溶液,继续滴定至刚使蓝色消失为终点,记录所用硫代硫酸钠溶液体积。同时用水作试剂空白滴定。甲醛溶液的浓度用公式(1)计算。C=(V1-V2)×M×15/20..........................(1)式中: c──甲醛标准贮备溶液中甲醛溶液,mg/mL;V1──滴定空白时所用硫代硫酸钠标准溶液体积,mL;V2──滴定甲醛溶液时所用硫代硫酸钠标准溶液体积,mL;M──硫代硫酸钠标准溶液的摩尔浓度;15──甲醛的换算值。取上述标准溶液稀释 10 倍作为贮备液,此溶液置于室温下可使用 1 个月。有前辈告诉 说是按照这个方法配不出来,不加硫酸的话,才可以配出标准溶液。但按照那种方法,做出的曲线是不正确的,斜率为负值。请问,硫酸应该是必须要加的吧? 操作上有什么要注意的地方吗?现在一直没做出甲醛的标准曲线来[em0808]
实验室整改中,评审组提出要单设标准溶液标定室,为什么标准溶液标定室需要单设,标准规范出处在哪。哪位高人帮着解释一下
最近,单位评审被指出标准溶液配制与标定格式不对,想请各位大侠提供一下标准溶液配制与标定的格式,以供参考,谢谢了!
求标准溶液的标定记录空白及标准溶液的标定周期,谢谢!我的邮箱:y2th@sina.com
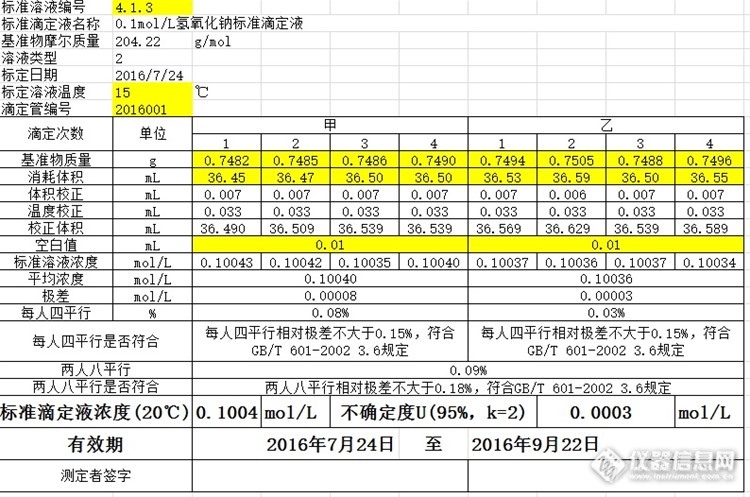
1 引子滴定分析是分析化学的基础实验,其中包括称量、溶解、定容、转移、稀释、过滤等操作。可以这样说,如果没有好的滴定操作基础,就不可能操作好仪器分析。滴定分析应参考《化学试剂 标准滴定溶液的制备》GB/T 601-2002。传统的计算过程使用白纸、科学计算器,每一种标准滴定溶液分别有不同的计算表格,记录和数据处理费时费力,而且如果操作者不熟练非常容易出现错误。如果还要考虑标定过程的不确定度,计算A类不确定度、B类不确定度和合成不确定度,估计大部分的老师傅也会犯晕。因此,我冒出了这样的一个想法:“这都是信息化时代了,电脑、手机等软件非常普及,可不可以开发一个Excel计算模板,涵盖所有的标准滴定溶液标定记录计算呢?“于是便有了这个”万能Excel模板——标准滴定溶液标定记录计算“。简化计算,让工作高效起来!2 模板建立过程2.1 建立“标准滴定溶液数据库”标准滴定溶液数据库包括《化学试剂 标准滴定溶液的制备》GB/T 601-2002中所有使用基准物质标定的标准滴定溶液。同时,定义各种标准溶液的溶液类型,该编号与“溶液温度补正值数据库”关联。该数据库还包括各自标准滴定溶液使用基准物质的摩尔质量、摩尔质量不确定度、基准物质纯度不确定度。摩尔质量不确定度来源于IUPAC 2013相对原子量计算所得。基准物纯度不确定度分别根据各基准物质的国家标准标示含量范围值。完成后如下: 编号标准溶液名称基准物摩尔质量 g/mol溶液类型摩尔质量不确定度U(95%,k=2)基准物纯度不确定度U(95%,k=2)4.1.11mol/L氢氧化钠标准滴定液204.2260.0040%0.03%4.1.20.5mol/L氢氧化钠标准滴定液204.2250.0040%0.03%4.1.30.1mol/L氢氧化钠标准滴定液204.2220.0040%0.03%4.2.11mol/L盐酸标准滴定液52.99440.0014%0.05%4.2.20.5mol/L盐酸标准滴定液52.99430.0014%0.05%4.2.30.1mol/L盐酸标准滴定液52.99420.0014%0.05%4.3.11mol/L硫酸标准滴定液52.99460.0014%0.05%4.3.20.5mol/L硫酸标准滴定液52.99450.0014%0.05%4.3.30.1mol/L硫酸标准滴定液52.99420.0014%0.05%4.6.10.1mol/L硫代硫酸钠标准滴定溶液49.03120.0010%0.02%4.7.10.1mol/L碘标准滴定溶液49.46020.0006%0.05%4.12.10.1mol/L高锰酸钾标准滴定溶液66.99920.0019%0.05%4.14.10.1mol/L硫酸铈标准滴定溶液66.99920.0019%0.05%4.15.10.1mol/LEDTA标准滴定液81.37920.0246%0.05%4.15.20.05mol/LEDTA标准滴定液81.37910.0246%0.05%4.15.30.01mol/LEDTA标准滴定液81.37910.0246%0.05%4.21.10.1mol/L硝酸银标准滴定液58.44120.0094%0.05%4.22.10.5mol/L亚硝酸钠标准滴定液173.1930.0061%0.10%4.22.20.1mol/L亚硝酸钠标准滴定液173.1920.0061%0.10%4.23.10.1mol/L高氯酸标准滴定液204.2290.0040%0.03%4.24.10.1mol/L氢氧化钾乙醇标准滴定液204.2280.0040%0.03%备注:1)本表格包含GB/T 601-2002使用基准物质标定的标准滴定溶液。2)摩尔质量不确定度来源于IUPAC 2013相对原子量计算所得。3)基准物纯度不确定度分别根据各基准物质的国家标准标示含量范围值。2.2 建立“溶液温度补正值数据库”本数据库来源于GB/T 601-2002,顺序一样,只不过对溶液进行编号,该编号与“标准滴定溶液数据库”关联。如下: 溶液类型123456789温度: ℃水及0.05mol/L以下的各种水溶液0.1mol/L及0.2mol/L各种水溶液盐酸溶液0.5mol/L盐酸溶液1mol/L硫酸0.5mol/L 氢氧化钠溶液0.5mol/L硫酸1mol/L 氢氧化钠溶液1mol/L碳酸钠溶液1mol/L氢氧化钾乙醇液0.1mol/L0.1mol/L高氯酸标准滴定液51.381.701.902.302.403.603.3016.7861.381.701.902.202.303.403.2015.6471.361.601.802.202.203.203.0014.518[td
在《QB/T 2739-2005 洗涤用品常用试验方法 滴定分析(容量分析)用试验溶液的制备》这份标准中提到“3.5 标定标准滴定溶液的浓度时,应两人进行操作,规定为标三复二”,有点不明白“标三复二”这个概念,不知有人能够帮忙解释下吗?谢谢了!
标定标准溶液时结果在什么误差范围内可以接受?
大家的配制标准的时候,是选择标定还是标准溶液配制?标准方法上一般都会有标准溶液的标定方法,但是一般比较繁琐,而且配制的浓度不一定能够满足使用需要;我们现在一般都是直接用标准样品按照需要配制对应的标准使用液浓度,方便快捷,就是代价较高。现在各位版友在实验过程中一般是自己标定标注溶液,还是直接购买标准溶液来配制呢???