自动定氮仪测水溶蛋白怎么进行???
请各位高手发表一下看法:我用凯式微量定氮仪测蛋白,同一瓶消化液,容量瓶内的消化液已经应该均匀了,我都摇晃6次的,但在同一个时间段里测两个数据,结果不平行,请问是为什么啊?这种现象已经出现了100多次了,以前没这种情况的。最近一直为这个问题烦恼啊
[font=宋体]蛋白纯化介质主要应用于研究目的蛋白的结构、功用以及相互作用的和过程中。比如:在蛋白纯化过程中,由于[url=https://cn.sinobiological.com/resource/protein-review/protein-purification-by-ac][b]亲和层析法[/b][/url]的选择性和结合力较强,分辨率也高。所以,亲和层析法是一种常用的蛋白、抗体纯化方法,天地人和生物多种简单易用的亲和纯化介质,适用于批量或利用重力进行纯化,可以高效、便捷、可靠地从品中分离蛋白和抗体,为下游应用提供有力保证。[/font][font=宋体][b]亲和层析法的原理:[/b][/font][font=宋体][font=宋体]亲和层析是应用生物高分子与配基可逆结合的原理,将配基通过共价键牢固结合于载体上而制得的层析系统。这种可逆结合的作用主要是靠生物高分子对它的配基的空间结构的识别。常用的生物亲和关系有酶[/font][font=Calibri]-[/font][font=宋体]底物、底物类似物、抑制剂、激活剂、辅因子,抗体[/font][font=Calibri]-[/font][font=宋体]抗原,激素[/font][font=Calibri]-[/font][font=宋体]受体蛋白、载体蛋白,外源凝集素[/font][font=Calibri]-[/font][font=宋体]多糖、糖蛋白、细胞表面受体,核酸[/font][font=Calibri]-[/font][font=宋体]互补核苷酸序列、组蛋白、核酸结合蛋白等,具有高效、简单、快速的优点,是当前最为理想的分离纯化蛋白的方法。[/font][/font][b][font=宋体][font=宋体]亲和层析的操作步骤[/font][font=Calibri]:[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]在亲和层析中,蛋白在影响蛋白[/font][font=Calibri]([/font][font=宋体]或标签[/font][font=Calibri])[/font][font=宋体]与其配体之间结合的条件下被加载到柱子上。在不破坏特定相互作用但能破坏污染蛋白与固定相之间任何非特异性相互作用的条件下洗涤结合的蛋白。然后用含有竞争性分子的缓冲液或破坏所有蛋白[/font][font=Calibri]/[/font][font=宋体]蛋白相互作用的条件洗脱结合的蛋白。竞争分子与配体结合,取代目标蛋白,这种竞争分子通常通过另一种色谱流程或透析法从目标蛋白中去除。[/font][/font][font=宋体] [/font][table][tr][td][b][font=微软雅黑][color=#232323]亲和层析配体和洗脱条件[/color][/font][/b][/td][td][font=微软雅黑] [/font][/td][td][font=微软雅黑] [/font][/td][/tr][tr][td][b][font=微软雅黑][color=#232323]需纯化的蛋白[/color][/font][/b][/td][td][b][font=微软雅黑][color=#232323]配体[/color][/font][/b][/td][td][b][font=微软雅黑][color=#232323]洗脱条件[/color][/font][/b][/td][/tr][tr][td][font=微软雅黑][color=#232323]抗体(抗原特异性)[/color][/font][/td][td][font=微软雅黑][color=#232323]抗原肽[/color][/font][/td][td][font=微软雅黑][color=#232323]游离肽[/color][/font][/td][/tr][tr][td][font=微软雅黑][color=#232323]多聚组氨酸标签蛋白[/color][/font][/td][td][font=微软雅黑][color=#232323]Ni2+或Co2+[/color][/font][/td][td][font=微软雅黑][color=#232323]咪唑或游离组氨酸[/color][/font][/td][/tr][tr][td][font=微软雅黑][color=#232323]FLAG标签蛋白[/color][/font][/td][td][font=微软雅黑][color=#232323]FLAG特异性抗体[/color][/font][/td][td][font=微软雅黑][color=#232323]FLAG肽或低pH值[/color][/font][/td][/tr][tr][td][font=微软雅黑][color=#232323]GST标签蛋白[/color][/font][/td][td][font=微软雅黑][color=#232323]还原型谷胱甘肽[/color][/font][/td][td][font=微软雅黑][color=#232323]游离谷胱甘肽[/color][/font][/td][/tr][tr][td][font=微软雅黑][color=#232323]Myc标签蛋白[/color][/font][/td][td][font=微软雅黑][color=#232323]Myc特异性抗体[/color][/font][/td][td][font=微软雅黑][color=#232323][font=微软雅黑]低[/font][font=微软雅黑]pH[/font][/color][/font][/td][/tr][tr][td][font=微软雅黑][color=#232323]抗体(类特异性)[/color][/font][/td][td][font=微软雅黑][color=#232323][font=微软雅黑]蛋白[/font][font=微软雅黑]A、G和L或精蛋白[/font][/color][/font][/td][td][font=微软雅黑][color=#232323]pH极端值[/color][/font][/td][/tr][tr][td][font=微软雅黑][color=#232323]DNA结合蛋白[/color][/font][/td][td][font=微软雅黑][color=#232323]肝素[/color][/font][/td][td][font=微软雅黑][color=#232323]高离子强度[/color][/font][/td][/tr][/table][font=宋体][font=宋体]更多详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification-by-ac[/font][/font]
欲购买凝胶成像系统、核酸蛋白仪全自动定氮仪,请各位使用者及代理商广泛给予建议,谢谢!
正在做麸皮的蛋白测定,称样约0.2g,消化时硫酸用量是20ml,用的是半自动凯氏定氮仪,加的蒸馏水为50ml, 但不知道要加多少碱,和蒸馏时间设定多少呢?做了一个加碱70ml的,但蒸馏没有生成大量沉淀,溶液的颜色依然是蓝色的。还有就是硼酸的用量10ml可以吗?正在做麸皮的蛋白测定,称样约0.2g,消化时硫酸用量是20ml,用的是半自动凯氏定氮仪,加的蒸馏水为50ml, 但不知道要加多少碱,和蒸馏时间设定多少呢?做了一个加碱70ml的,但蒸馏没有生成大量沉淀,溶液的颜色依然是蓝色的。还有就是硼酸的用量10ml可以吗?
[font=宋体][font=宋体]亲和层析是应用生物高分子与配基可逆结合的原理,将配基通过共价键牢固结合于载体上而制得的层析系统。这种可逆结合的作用主要是靠生物高分子对它的配基的空间结构的识别。常用的生物亲和关系有酶[/font][font=Calibri]-[/font][font=宋体]底物、底物类似物、抑制剂、激活剂、辅因子,抗体[/font][font=Calibri]-[/font][font=宋体]抗原,激素[/font][font=Calibri]-[/font][font=宋体]受体蛋白、载体蛋白,外源凝集素[/font][font=Calibri]-[/font][font=宋体]多糖、糖蛋白、细胞表面受体,核酸[/font][font=Calibri]-[/font][font=宋体]互补核苷酸序列、组蛋白、核酸结合蛋白等,具有高效、简单、快速的优点,是当前最为理想的分离纯化蛋白的方法。[/font][/font][font=宋体] [/font][font=宋体][b]亲和层析纯化步骤:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、捕获阶段[/font][/font][font=宋体]在样品捕获阶段,通过将速度和容量进行优化组合,使样品中的目标产物被有效的分离、浓缩和稳定化处理。[/font][font=宋体] [/font][font=宋体][font=宋体]捕获阶段一般选择亲和层析,离子交换层析或者疏水层析,通过吸附作用使样品和杂质实现分离。如果样品带有标签,第一步可以选择标签蛋白亲和层析;如果样品不带有标签,可以考虑使用离子交换[/font][font=Calibri]/[/font][font=宋体]疏水层析。由于捕获阶段一般样品量较大,杂质较多,所以捕获阶段分辨率不是特别主要考虑的因素,可以主要考虑增加上样量和速度。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、中度纯化阶段[/font][/font][font=宋体]在中度纯化阶段,应将注意力集中于将目标样品和大多数大体积的杂质分开。在中度纯化阶段,速度不是最重要的因素,因为经过捕获阶段样品体积会缩减。中度纯化阶段一般建议使用离子交换层析或者疏水层析进一步提高样品的纯度。[/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、精细纯化阶段[/font][/font][font=宋体]在精细纯化阶段,关注的重点就是如何达到高分辨率,从而完成最终的纯化。在此前的步骤中已经去除了大部分的污染物和杂质。如果需要达到较高的分辨率,可能会在此步骤造成一些回收率的损失。精细纯化阶段一般建议使用高分辨率的分子筛或者高分辨率的离子交换层析柱。[/font][font=宋体] [/font][font=宋体][b]亲和层析纯化优缺点:[/b][/font][font=宋体][font=Calibri]1. [/font][font=宋体]亲和层析法是分离蛋白质的一种极为有效的方法,它经常只需经过一步处理即可使某种待提纯的蛋白质从很复杂的蛋白质混合物中分离出来,而且纯度很高。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2. [/font][font=宋体]是最有效的生物活性物质纯化方法,它对生物分子选择性的吸附和分离,可以取得很高的纯化倍数。此外蛋白在纯化过程中得到浓缩,结合到亲和配基后,性质更加 稳定,其结果提高了活性回收率。此外它可以减少纯化步骤,缩短纯化时间,对不稳定蛋白的纯化十分有利。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3. [/font][font=宋体]除特异性的吸附外,仍然会因分子的错误认别和分子间非选择性的作用力而吸附一些杂蛋白质,另洗脱过程中的配体不可避免的脱落进入分离体系。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4. [/font][font=宋体]载体较昂贵,机械强度低,配基制备困难,有的配基本身要经过分离纯化,配基与载体耦联条件激烈等。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多详情可以参看义翘神州[url=https://cn.sinobiological.com/resource/protein-review/protein-purification-by-ac][b]亲和层析纯化蛋白[/b][/url]:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification-by-ac[/font][/font]
凯氏定氮仪与蛋白测定仪有什么区别?

[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]快速检测人血白蛋白原液蛋白质含量的建模研究摘要:本研究建立[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]定量分析模型,对浓缩液蛋白含量进行快速及有效的测定。在实验室条件下配置不同浓度的蛋白样品,建立用于蛋白含量测定的定量分析模型,以实现浓缩液蛋白含量的快速及有效的判断。关键词:[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]分析技术;人血白蛋白;定量分析模型1材料1.1 试剂供试品:人血白蛋白原液;生理盐水。1.2 仪器和软件AntarisⅡ傅里叶变换[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url](美国Thermo Fisher scientific公司);内径4×50 mm的玻璃小管(Kimble Chase,德国); MATLAB 2015a(美国Mathworks公司);PLS_Toolbox工具箱(美国Eigenvector Research公司)。2方法2.1 蛋白含量的测定及样品溶液的配制2.1.1 蛋白质含量的测定取生产过程中超滤浓缩后的人血白蛋白原液为实验供试品,用半微量凯氏定氮法测定蛋白质浓度,浓度应不低于26.5%。2.1.2样品溶液的配制根据试验需要,将供试品溶液用生理盐水进行稀释得到多个不同蛋白质浓度的实验样品。2.2 样品光谱的采集本实验使用AntarisⅡ傅里叶变换[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url],采用透射分析模块,采用仪器自带的RESULT-Intergration软件编写采集光谱的工作流程。光谱分辨率为8 cm-1,扫描范围为10000-4000 cm-1,扫描次数为32次,用偏最小二乘回归(Partial Least Squares Regression, PLSR)方法建立定量模型。2.3 校正集和验证集的划分校正集中的样品应包含使用该模型预测的未知样品的所有化学成分。且校正集中的样品的化学成分浓度范围应覆盖使用该模型预测的未知样品中可能存在的浓度范围。而且验证集中的样品应涵盖使用模型分析的待测样品中的化学组成,测定浓度范围也应尽可能覆盖该模型分析的待测样品可能存在的浓度范围,且分布均匀。所以,需要选择合理的样品集划分方法,以提高模型的应用性及准确性。2.4 预处理方法的选择为了消除噪声和产生的基线漂移,提高模型的预测能力,得到稳健的模型,需要在模型建立前对样品的原始光谱进行预处理,常用的谱图处理方法有均值中心化(Mean Center)、标准化(Auto scale)、平滑和导数等。导数是常用的基线校正和光谱分辨预处理方法,但也会放大噪声的信号,降低光谱的信噪比;为消除光谱变换带来的噪声,常对原始光谱进行平滑后求导,能有效提高信噪比;均值中心化可增大不同样品之间的差异,从而使模型的稳健性和预测能力得到提高;标准化可以使光谱中所有波长变量的权重相同,增加光谱之间差异化,适合于低浓度成分的建模。本研究中对Auto scale、Mean Center、一阶导数(First Derivative,FD)SG13点平滑、二阶导数(Second Derivative,SD)SG13点平滑等预处理方法进行了考察,以模型的RMSEP为指标,选择最合适的预处理方法。2.5 光谱区间的选择[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]信息十分复杂,在建立校正模型的过程中选择有效的建模变量是十分必要的。本研究选用间隔偏最小二乘法(Interval Partial Least Squares Regression, iPLS)),以RMSECV值为评价标准,选择变量区间以建立最佳的定量模型。3 实验结果3.1 蛋白质含量的测定结果采用半微量凯氏定氮法进行蛋白含量的测定,测定得到17个样品的蛋白含量。用生理盐水稀释样品,共得到49个不同蛋白质含量的样品。3.2 样品的原始光谱图1为49个蛋白样品的原始光谱,原始光谱图中可见各样品的光谱差异不明显,因此需要使用化学计量学方法对样品光谱进行处理。[align=center][img=,494,237]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151606_01_1626619_3.png[/img][/align][align=center]图1 样品原始光谱图[/align]3.3 校正集和验证集的划分结果本研究采用Kennard-Stone(K-S)分类的算法,按照2:1的比例进行样品集的划分,划分为33个校正集样品和16个验证集样品。图2为校正集样品和验证集样品的主成分得分图,图中灰色点为校正集样品,红色点为验证集样品,从主成分得分图中可以看出,校正集样品和验证集样品分布比较均匀,且验证集样品比较均匀的分布在校正集样品之间,符合理想校正集和验证集的要求。[align=center] [img=,467,301]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151608_01_1626619_3.png[/img][/align][align=center]图2 样品主成分得分图[/align]3.4 光谱预处理的结果建模过程中,分别采用各种方法对光谱数据进行预处理,包括标准化(Auto scale)、均值中心化(Mean Center)、一阶导数(First Derivative,FD)、SG13点平滑、二阶导数(Second Derivative,SD)等处理方法,以RMSEP作为评价模型的参数,通过对比预处理后的建模结果,选出最合适的预处理方法。表1列出了预处理后各模型的评价参数,通过比对,可以较直观的选出一阶导数SG13点平滑和Mean Center的组合为最佳预处理方法。图3所示为用经过一阶导数SG13点平滑和Mean Center 预处理后的光谱所建立的模型的结果,从图3中可以看出,建模效果较好,预测能力较高,Rc2=0.994,Rp2=0.986,RMSEC=0.1993%,RMSEP=0.2585%,RMSECV=0.2518%。[align=center]表1 不同预处理后各模型参数[/align][align=center][img=,629,241]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151613_01_1626619_3.png[/img][/align][align=left]FD+SG:一阶导数+SG13点平滑[/align][align=left]SD+SG:二阶导数+SG13点平滑[/align][align=center][img=,572,305]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151616_01_1626619_3.png[/img][/align][align=center]图3 一阶导数+SG平滑+ Mean Center[/align]3.5 光谱区间的选择结果通过筛选光谱区间,可以选择与样品白蛋白含量相关性大的光谱变量进行建模,去掉大量无关信息,减少模型的计算量,使得模型的效果更好。本实验采用iPLS进行变量的选择。将光谱进行SG13点平滑+一阶导数+ Mean Center预处理后,分别采用Forward iPLS和Reverse iPLS方法选择最佳的光谱区间,改变窗口宽度,分别选择最佳变量,以RMSECV为标准选择谱区。3.5.1Forward iPLS选择波段采用FiPLS的方法以RMSECV为标准选取最佳的光谱区间,分别选择50、100、200个变量进行自动选择,如表2所示窗口宽度为100个变量时建模结果较佳,结果图4所示。[align=center]表2 Forward iPLS结果[/align] [align=center][img=,645,163]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151618_01_1626619_3.png[/img][/align][align=center][img=,517,246]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151619_01_1626619_3.png[/img][/align][align=center]图4 Forward iPLS波段结果图[/align]由图4中可以看出,绿色部分为建模的波段,图5为建模预测结果图。[align=center][img=,551,291]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151620_01_1626619_3.png[/img] [/align][align=center]图5 Forward iPLS建模结果图[/align]3.5.2 Reverse iPLS选择波段采用Reverse iPLS的方法选取最佳的光谱区间,同样,分别选择50、100、200个变量进行自动选择,如表3所示窗口宽度为50个变量时建模结果较佳,波段选择结果如图6所示。[align=center]表3 Reverse iPLS结果[/align][align=center][img=,652,456]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151622_01_1626619_3.png[/img][/align] [align=center]图6 Reserve iPLS 选波段结果图[/align]如图6中所示,其中绿色部分为建模波段,图7为预测结果。[align=center][img=,520,228]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151624_01_1626619_3.png[/img][/align][align=center]图7 Reserve iPLS 建模结果图[/align]通过采用Forward iPLS和Reservei PLS波段选择方法建立PLSR模型,经过两种方法中选择的最优变量的对比(见表4),选择窗口宽度为100变量的Forward iPLS变量选择方法建立的模型最佳。最终建立的PLSR模型结果:模型的参数为Rc2=0.997,Rp2=0.987,均方根误差RMSEC=0.1394%,RMSEP=0.2560%,RMSECV= 0.1831%,建模结果较好。[align=center]表4不同变量选择方法的建模结果[/align][align=center][img=,641,142]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151629_01_1626619_3.png[/img][/align]3.6 一级数据与预测值比较对16个验证集样品的传统方法获得的蛋白含量和NIRS蛋白含量预测值进行偏差分析,结果见表5所示。蛋白含量一级数据和预测值的平均偏差和相对平均偏差的计算公式见式1和式2,蛋白含量NIRS的预测值和一级数据间的平均偏差为0.17,相对平均偏差为0.81,两者都较低,说明了NIRS和传统的凯氏定氮法结果相差较小,表明NIRS用于蛋白含量测定的准确性和可靠性。[align=center][img=,372,89]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151631_01_1626619_3.png[/img][/align]式中yi, actual为传统凯氏定氮方法得到的一级数据值,yi, predicted为NIRS得到的预测值,n为验证集样品数量。[align=center]表5 验证集样品方法结果比较表[/align][align=center][img=,585,86]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151632_01_1626619_3.png[/img][/align]3.7 预测值的精密度通过重复测量光谱计算,建立的蛋白含量校正模型的预测精密度。随机选取验证集样品中的1号、15号、35号、42号和47号样品,每个样品重复测量10次,然后采用建立的蛋白含量模型采集以上样品的光谱,得到样品的预测值。然后计算每个样品预测值的平均值、标准偏差和相对标准偏差,用这些指标来表示预测的精密度,结果见表6。如表中所示, RSD值均在1.0%以下,远远低于5.0%,证明了模型的精密度良好。[align=center]表6 模型精密度考察结果[/align][align=center][img=,584,394]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151636_01_1626619_3.png[/img][/align]4结论和讨论本研究建立了人血白蛋白生产过程中蛋白含量测定的近红外定量模型,用于人血白蛋白原液蛋白质含量的测定,为下一步原液的生产配制提高依据。首先,取生产过程中的样品17个,用凯氏定氮法测得各个样品的蛋白含量,然后在实验室条件下,用生理盐水配制成49个不同浓度的蛋白样品。对49个样品进行[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]的采集,然后对样品进行校正集和验证集的划分,对光谱进行预处理方法和不同的变量选择方法进行了考察;采用Kennard-Stone(K-S)分类的算法,按照2:1的比例进行样品集的划分,优先选出Mean Center +一阶导数SG13点平滑的预处理方法,并采用窗口宽度为100变量的Forward iPLS变量选择方法选出变量区间,最终建立最佳的近红外定量模型。最终建立的PLSR模型结果:Rc2=0.997,Rp2=0.987,均方根误差RMSEC=0.1394%,RMSEP=0.2560%,RMSECV= 0.1831%。除此之外,对模型进行了重复性考察,从结果可知模型具有较好的重复性。在模型的建立中,选用Kennard-Stone(K-S)分类的算法进行样品集的划分,通过PCA分析得到具有代表性的校正集和验证集样品。在预处理方法的选择中,分别选用Autoscale、Mean Center、SG平滑一阶导数以及各预处理方法的组合进行预处理方法的考察,其中SG平滑中,不同的窗口宽度会对平滑产生不同的效果,窗口宽度越宽平滑效果越好,但也会丢掉有用的信息,经过考察选择13点平滑时结果较佳。参考文献吴清, 周法根. 脑梗死治疗中白蛋白应用价值的探讨 . 心脑血管病防治, 2005, 5(2): 49-50.王华平, 米宇俊. 人血白蛋白治疗肾综合征出血热低血压休克患者疗效观察 . 医师进修杂志, 2001, 24(8):20-21.郑红光, 杨志藩, 关欣. 静脉输注人血白蛋白对肾病综合征的正负临窗效应观察 . 中国实用内科杂志, 2003, 23(1):25-27.刘丽萍. 人血白蛋白在肝硬化资料中的应用 . 中国医院用药评价与分析, 2013, 13(5):388-390.常花蕾, 史涛. 人血白蛋白临床不合理应用及改进措施 . 中国药物应用与监测, 2014, 11(1): 52-54.孙世光, 余明莲, 王建民, 张国辉. 人血白蛋白的临床应用误区及其对策 .解放军药学学报, 2009, 25(4):366-368.
核酸蛋白检测仪是层析分析的主要装置,核酸蛋白检测仪配上层析柱、恒流泵、部分收集器、层析谱分析系统(根据需要选配)和电脑打印设备即构成一套完整的核酸蛋白检测仪分离层析系统。它是当今从事生命科学研究、药物测定、化工、食品科学及医学研究等行业的现代分析实验仪器。核酸蛋白检测仪分析系统广泛用于工业、农业、科研和大专院校的科学研究和教学实验。其原理是根据物质(样品)对紫外光有明显吸收的特征,实现对样品成份含量比对分析,以便进行样品蛋白、核酸物质识别检测和含量测定。在生化分析、环保科学、食品研究、毒理研究、新药开发等领域中对核酸、蛋白检测、纯化和提取提供了一种独特的分析手段。
你好,能不能请教个问题。我是做进口胶原蛋白的商家,当时我们在选择这个原料的时候,一个朋友去过检测,具体内容是这样的,他有个朋友赵医生在澳大利亚行医,赵医生的妹妹得了癌症,回国照顾妹妹,带回来了一台仪器,日本产的,在上海有卖的,我们收集了很多种胶原蛋白原料,请赵医生帮忙检测,我的朋友检测后跟我说,赵医生拔了自己的一根头发,然后检测了不同的胶原蛋白原料,得出结果是,有的吸收度(可能表达不准确)是8,有的 22,有的 56,而我们的是 366,非常好,还说,我们说人体一天需要4克不对,检测下来她需要8克。后来赵医生回澳大利亚,联系不上。我想请教的是,您知道这个仪器是什么仪器吗?据说可以做地质检测。还有如果我们还想检测原料。您可以做到赵医生哪样的检测吗?请加我 QQ4567466,或者打我电话13319788283,必有重谢!
哪位大侠知道如何用紫外测定DNA和蛋白原理是什么?又是怎么计算的?先谢谢啦中国心中国心中国心
原理:在确定量的血浆样本经过一定时间的加温后,加入试剂。加入试剂后,采用波长为660nm的光照射样本。凝血过程(纤维蛋白原转化为纤维蛋白)中血的浑浊度可以通过测量散射光光强度的改变来测定。从散射光光强度的测定,可以做出凝血曲线,通过PercentageDetection Method方法求得凝血时间。一、仪器:(一)型号:Sysmex CA—1500自动血液凝血分析仪(二)分析和计算参数:1.处理量:约120个测试/小时2.所需样本量:10μl 3.检验时间:在最长检验时间之内测出结果,典型最长检验时间:100秒4.重复性:CV≤4%5. 计算参数:纤维蛋白原浓度(Fbg)二、试剂及配套品:(一)试剂:1. 凝血酶试剂(Thrombin Reagent)(1)商标:德灵(DADE BEHRING)(2)包装规格:Pack for 10×1ml(3)代码:B4233 G25 E0533 (961) W(4)成分:牛凝血酶冻干粉(lyophilized preparation of bovine thrombin)(近似100 NIH units/ml)
中文摘要: 目的 利用近红外光谱分析技术,建立原液中总蛋白及纤原含量的检测模型,实现原液的快速检定。 方法 选取层析过程流穿液为研究对象,收集流穿液制备了一系列不同浓度的样品,共60个,用透射模块采集其近红外光谱。建模过程中,首先用K-S方法将样品划分为40个校正集和20个验证集,简历模型,用R2、RMSEC、RMSECV、RMSEP对模型进行评价。 结果 建立模型的各项参数为:R2=0.995,RMSEC=0.1911,RMSECV=0.2245,RMSEP=0.1662。 结论 所建立的方法,可以快速准确的对层析流穿液的蛋白含量进行在线检测,如果应用于生产,还可以对层析过程进行饱和度分析,确定最优的层析方案。关键词:近红外光谱分析;人纤维蛋白原;层析流穿液; 蛋白质含量人纤维蛋白原(HumanFibrinogen,Fg)是血浆的主要成分,含量高达2~4 g/L。在人凝血反应的最后阶段在凝血酶与人凝血因子ⅩⅢ、Ca2+作用下形成纤维蛋白凝胶,将血液有形成分包绕其中,达到止血的目的。在纤维蛋白原的生产过程中,通过层析收集流穿液进行下一步的制备。当离子交换树脂吸附饱和时停止收集,目前填料饱和度的判断通过检测流穿液中纤原的纯度来进行,采用凯氏定氮法分别检测原液中总蛋白的含量,进而计算得出。在制药领域,NIRS作为一种重要的PAT工具,已成功用于药物的原辅料质量评价、关键过程的监测和控制、成品的快速放行和质量检测等各个环节,为保证产品质量、降低生产成本、革新生产过程发挥了重要的作用。利用近红外光谱分析技术,建立原液中总蛋白及纤原含量的检测模型,可以实现原液的快速检定以及在线监测,提高生产效率。1实验材料与仪器1.1试剂纤维蛋白原层析流穿液(山东泰邦生物制品有限公司,批号201409S05,蛋白含量9.70mg/mL);注射用水。1.2仪器Antaris Ⅱ傅里叶变换近红外光谱仪(美国Thermo Fisher scientific公司),附件配置:透射检测器,1mm光程玻璃比色皿;Result光谱采集软件;Matlab 2009化学计量学软件(美国Mathworks公司)。2方法2.1样品制备在纤原的生产过程中,对层析时的流穿液留样。按照不同的比例用注射用水将流穿液稀释,得到含有不同蛋白含量的样品共60个。2.2近红外光谱采集每个样品取适量装于光程4mm的比色皿中,采集其透射光谱,扫描范围为10000-4000cm-1,分辨率为8 cm-1,扫描次数32次,每小时扫描一次背景。2.3校正集和验证集的划分采用K-S分类的方法将样品划分为校正集和验证集,二者的比例为2:1,得到40个校正集样品和20个验证集样品。2.4预处理方法的选择本研究考察了Autoscale、均值中心化、一阶导数,以及两种方法联用等预处理方法对光谱数据进行处理后,对建模结果的影响,并以此选择最佳的预处理方法。2.5光谱区间的选择本研究中分别采用iPLS和GA筛选光谱变量,使用选择的谱区建立PLS模型,并依据模型结果的优劣确定最终使用的变量选择方法,从而更好地提高模型的性能。2.6重复性考察随机挑选3个验证集样品,每个样品重复测定10次光谱,用所建立的定量模型预测其蛋白含量,计算每个样品预测值的平均值和标准偏差。用χ2检验考察这些重复性标准偏差是否属于同一总体,若属于,则近红外方法的重复性按z×data:image/png;base64,iVBORw0KGgoAAAANSUhEUgAAACQAAAAjCAYAAAD8BaggAAAAAXNSR0ICQMB9xQAAAAlwSFlzAAAWJQAAFiUBSVIk8AAAABl0RVh0U29mdHdhcmUATWljcm9zb2Z0IE9mZmljZX/tNXEAAAEpSURBVFjDY2hsbGQYTHhQOWbUQSPXQUDwnxxMcwcNuhAaVA4adGlo0DiImtE1fB2ETTzKmGEhSjY3jlo4IA7q6Ejj8ZBh2IO97DG+G1tfL0lXB+W4yRajWwwRIy6kqJp+QKHjLmc8C1soIKIQfyhRNXTq62Ml3dzywrCprc/zMJRlYHhDVwfhwyDHGjMw3B08DoKFEK3SEKnlT0O0sQ9IvXF0g8+AOwheFBBRFhFs31AjuiChQ7gMwuogohtSRDoIlpgJRRVRUUapg2BRJeuWU0y1ugybo4hNP6DCkBTHkOQgZAcQ4xhwdUFkhUpyLiPVQfgcAy6PZD1WpnV08FDsIJhD8DkIpSLFgfElcLK7OuQ6hmpVBzFlE91bjIPOQdTuYYwONgwLBwEA8PQuvy1MfhwAAAAASUVORK5CYII=×σ算出。3.结果3.1样品蛋白含量的分布共制备60个样品,其蛋白含量范围在0.2425 mg·mL-1~9.7000 mg·mL-1,且分布较为均匀。3.2样品的近红外光谱采集的60个样品的原始透射光谱如图1所示。data:image/png;base64,iVBORw0KGgoAAAANSUhEUgAAAz4AAAF3CAMAAABT3W5nAAAAAXNSR0ICQMB9xQAAAPxQTFRFAAAAAAA6AABmAAD/ADo6ADpmADqQAH8AAGaQAGa2AL+/OgAAOgA6OgBmOjoAPz8/OjpmOjqQOmZmOma2OpC2OpDbZgAAZgA6ZgBmZjqQZmY6ZmZmZma2ZpC2Zra2Zrb/kDoAkDo6kDpmkGZmkGaQkJA6kJBmkJC2kJDbkLbbkLb/kNvbkNv/vwC/tmYAtmY6tmZmtpA6tpBmtpCQtpDbv78AtrZmtraQtra2trbbtrb/ttv/tv+2tv/btv//25A625Bm25CQ27Zm27a229u229vb29v/2/+22//b2////wAA/7Zm/7aQ/7a2/9uQ/9u2/9vb//+2///b////7ggbWwAAAAlwSFlzAAAWJQAAFiUBSVIk8AAAABl0RVh0U29mdHdhcmUATWljcm9zb2Z0IE9mZmljZX/tNXEAABV0SURBVHja7d2NY9s2esdxOryFE3wdt2uVttdscrOs7eVEJ92G7XLbpOZub4butEr8//+XASApybbiSBAJAuT3l8RxXixaND9+HgAklZSEEMck7AJC4EMIfAiBDyHwIYTAhxD4EAIfQuBDCHwIIfAhBD6EwIcQ+BBC4EMIfAiBDyHwIQQ+hBD4EAIfQuBDCHwIIfAhJEI+q+Rqzr4m8HHKf5WrGfuawMctq2cL9jWBj2PWn+ttEdJzouTzdr55afgM79sCm4ppU5HyWV+bqQP4sCn4hPPJj+SrX+jABz589c+nI4oiTc1PQ4gdCB+++ufw0XJSmdoUhVLsQPjw1T9Zj7GTZ3meSykrQtqQivxZDWdTXvmU5Fw+SmVZJvWvPM/M21QYQdpQaRQp9hB8yEeTqkwpIZRRVJegvOnkDKICRPAhH4umo5OLSlBVgWQmc1kjqpo5g0gpBSP4kMOI1PApRaEFKYNHwykz/Q9WkfZkCVWlqIAQfMg9PoUZ6wj9W1HaQmQHQHmupCyLsrCe7vVzAIIPqaPhpPpXae0UZV6YcVBWEzIjoUyWUv8//buOViT8zm7DBz5B8zGCRPUHW310KbJTCVm2V2QcFdKOikw3VyAIPkTrkXrYI+79lZlGyAsrSTuyo53akWnjtKDCLA8V8IEPfJTmc+TvtaA8F6moGBlCaZaZqe3MdnRljh/4kEykT/1zqp2Ybm6XqhQZR2YIxP6DD3xOix3yNIpyYVyx/+Az6ogsPftjDCKV6Y+k/MBn7HxcPspWIaX9sAPhM2o+qeMHFqn2I/EDH/g4+6F9g8+o+bh/qPYjMsoPfODj7IfyAx/4uCXPBO0bfODjm
中文摘要: 目的 利用近红外光谱分析技术可以有效的对纤原冻干产品的水分含量进行实时测定,优化冻干过程。 方法 选取冻干完成后制品为研究对象,制备了水分含量有一定梯度的样品共60个,用积分球漫反射模块采集其近红外光谱,然后用卡尔费休容量滴定法测定每个样品的水分含量作为一级数建立近红外模型,以R2、RMSEC、RMSECV、RMSEP对模型进行评价。结果 模型各项参数为:R2=0.881,RMSEC=0.4426,RMSECV=0.8370,RMSEP=0.6311。 结论 所建立模型可作为在线监控纤原冻干过程水分含量的基础,将冻干设备进行相关的改造后,借助光纤可实现产品水分含量的实时监测。关键词:近红外光谱分析;人纤维蛋白原;水分人纤维蛋白原(HumanFibrinogen,Fg)是血浆的主要成分,含量高达2~4 g/L。在人凝血反应的最后阶段在凝血酶与人凝血因子ⅩⅢ、Ca2+作用下形成纤维蛋白凝胶,将血液有形成分包绕其中,达到止血的目的。纤维蛋白原的原液经配制、分装后,进行冷冻干燥,使产品的水分含量控制在5%以下。人纤维蛋白原工艺过程纤原产品水分的检测是使用卡尔费休水分测定方法,该传统方法费时费力,对产品具有破坏性,极易引入误差而使测定不准确。在制药领域,NIRS作为一种重要的PAT工具,已成功用于药物的原辅料质量评价、关键过程的监测和控制、成品的快速放行和质量检测等各个环节,为保证产品质量、降低生产成本、革新生产过程发挥了重要的作用。利用近红外光谱分析技术可以有效的对纤原冻干产品的水分含量进行实时测定,从而极大地优化冻干过程。1材料1.1试剂人纤维蛋白原(冻干剂,山东泰邦生物制品有限公司,批号201409S02);甲醇(分析纯,国药集团化学试剂有限公司);卡尔·费休试剂(KFR-06型,天津市科密欧化学试剂有限公司)。1.2仪器Antaris Ⅱ傅里叶变换近红外光谱仪(美国ThermoFisher scientific公司),附件配置:积分球漫反射检测器;KF-4型自动水分测定仪(南京科环分析仪器有限公司);EL204电子天平(METTLER TOLEDO公司)。2方法2.1样品制备取若干瓶纤原样品,开盖后置于37℃水浴锅中,通过放置不同的时间,制备出水分含量有一定梯度的样品,样品取出后加盖密封,平衡一段时间。共得到60个样品。2.2采集近红外光谱用Antaris Ⅱ傅里叶变换近红外光谱仪的积分球采样模块对60个纤原样品进行光谱采集,扫描范围为10000-4000 cm-1,分辨率为8 cm-1,扫描次数64次,每小时扫描一次背景。2.3测定样品水分含量依据2010版中国药典规定,采用卡尔费休容量滴定法,测定样品的水分含量。测定用KF-4型自动水分测定仪完成,先进行标定,记录10mg蒸馏水所消耗的卡尔费休试剂的体积,然后进行测定,向反应杯中加入一定量的样品粉末,记录滴定至终点时所消耗的卡尔费休试剂的体积,最后通过计算得到样品的水分含量。2.4划分校正集和验证集采用K-S分类的方法将样品划分为校正集和验证集,二者的比例为2:1,得到40个校正集样品和20个验证集样品。2.5预处理方法的选择通过对原始光谱数据进行平滑、微分等预处理,可消除仪器背景或基线漂移等对光谱的影响。本次建模过程考察了MSC、SNV、一阶导数SG11点平滑、二阶导数SG11点平滑,以及MSC、SNV分别和二阶导数联用的多种方法,依据处理后的建模结果确定最终使用的方法。2.6选择光谱区间通过光谱变量的筛选,可去除大量的无关变量,大大减少建模的计算量,节省时间。本次建模过程考察了相关系数法和iPLS两种变量选择的方法,并依据模型的结果确定最终的光谱区间。3结果3.1样品的水分含量测定结果依据药典三部附录VIID 水分测定法第一法,测得60个样品的水分含量范围为1.7244-7.2012,将其作为建模用的一级数据。3.2纤原样品的近红外光谱图1为积分球漫反射模块采集的60个样品的光谱。从图中可以看出,样品的近红外光谱谱带较宽且重叠严重,而且基线漂移比较严重,不能从光谱直接得到样品水分含量的信息,需要采用化学计量学的方法对光谱进行处理和信息提取,最终建立水分含量的定量分析模型。data:image/png;base64,iVBORw0KGgoAAAANSUhEUgAAAz4AAAF3CAMAAABT3W5nAAAAAXNSR0ICQMB9xQAAAQJQTFRFAAAAAAA6AABmAAD/ADo6ADqQAH8AAGZmAGaQAGa2AL+/OgAAOgA6OgBmOjoAPz8/Ojo6OjpmOjqQOmZmOma2OpC2OpDbZgAAZgA6ZgBmZjqQZmY6ZmZmZma2ZpDbZra2Zrb/kDoAkDo6kDpmkGZmkGaQkJA6kJBmkJCQkJC2kJDbkLbbkLb/kNvbkNv/vwC/tmYAtmY6tmZmtpA6tpBmtpCQtpDbv78AtrZmtraQtra2trbbtrb/ttv/tv+2tv/btv//25A625Bm25CQ27Zm27a229u229vb29v/2/+22//b2////wAA/7Zm/7aQ/7a2/9uQ/9u2/9vb//+2///b////dsL9UAAAAAlwSFlzAAAWJQAAFiUBSVIk8AAAABl0RVh0U29mdHdhcmUATWljcm9zb2Z0IE9mZmljZX/tNXEAADEDSURBVHja7Z0NY2O5dZ45Cy/awcRF29ga27EbjTdb185G0G7q3jZOUskbN20GihVL+P9/pXjPAe7F5ZdIiqTuld53dzQSSREU5z46Hzg4Z5EoijpQC74FFEV8KIr4UBTxoSjiQ1EU8aEo4kNRxIeiiA9FER+KoogPRREfiiI+FEV8KIoiPhRFfCiK+FAU8aEo4kNRFPGhKOJDUcSHoogPRVHEh6Lmhc/DL/Dx8asbvtcU8dlT9x/e46+7L4gPRXz2llifx6//ivhQxOcwfO4uvwM+C4p6Wc0Sn9vF4n06a56CS3GpNSvNEZ+7y5TU+vBfn0sRH/6TcCniQ3y4FPEhPlyKSxEfLsWlZrbUa8WHoogPRREf4kMRH+JDER/iQxEf4kNRxIeiiA/xoYgP8aGID/GhKOJDUcSH+FDEh/hQxIf4UMSH+FAU8aEo4kN8KOJDfCjiQ3woivhQFPEhPhTxIT4U8SE+FPEhPhRFfCiK+BAfivgQH4r4EB+KmjE+Opxx8e6K+FDEZ0/pZO1/lglzxIciPvtJrE8ZTH+a8awU9fR1PufRwNkK/SjR+lAvTtEs8fn2Sv4iPhTx2Refu8v7D0wdUMRnRotRFPGhKOJDfCjiQ3wo4kN8KOJDfCiK+FAU8SE+FPEhPhTxIT4URXwoivgQH4r4EB+K+BAfivgQH4oiPhRFfIgPRXyID0V8iA9FER+KIj7896OID/GhiA/xoYgP8aEo4kNRxIf4UMSH+FDEh/hQFPGhKOJDUcSH+FDEh/hQxGfCV7SMleN4LIr4HCCdrP3t1d174kO9tLq5jgbWwfScrE29kOTKmys++nFxniUpau113s009nn46Q3BoV5a88Tn7vJ6sWDsQ704PUxcUxTxoajz00N8KOpgejzxoagD6SE+FHUwPn5++z7Eh5oIPckz9qGoA/HxM9z3IT7UVPBJgfhQ1EH4ZOPD1AFFHYRPpicQH4o6jJ78xxAfijoEn5SND2MfijoQH2+ID0UdgI9EPoGJa4o6BJ9MjwmR+FDU3vQkHzJAifhQ1EH4pGx8WPNGUQfQ02XXLUWmDijqAHyCD9n42Knjc1eaUV0SH2pC+GTnLXZh2vg8fJSOIFmPnxZf3BAfakr4BDtp5620o1r7FfGhXpCezgcYH9a8UdQB+Ag9YTaZt+9viA81EXzE+ITOTv2w9u1CQ57HT18QH2pK+GR6Qucmjc/du6t0/eVnpN8uTs8qRVVAnsAnZXxs8NPG5/HTe2TfLm8XM
摘要:采用凯氏法测酱油中的蛋白质含量是国标推荐方法。关键词:全自动定氮仪、消化炉、酱油蛋白质含量引言:酱油等调味品的质量是牵涉到千家万户的日常消费品,酱油中蛋白质含量是酱油指标中重要指标.高等级的酱油含有较高的蛋白质含量。见表二和表三。 在酱油等日常消耗品也存在用色素调制,来糊弄消费者,损害消费者的健康。为此我们使用上海沛欧全自动定氮仪SKD-2000(采用国际通用的颜色法判断、国内领先、具有多项专利技术)红外石英辐射消化炉SKD-08S2.(获得绿色仪器奖和节能仪器奖)对二款酱油进行蛋白质含量检测。 前言:按GB18186-2000 酿造酱油 范围:本标准适用于第3章所指的酿造酱油。 参考文献: 凯氏法原理:酱油样品在浓硫酸和催化剂硫酸铜、硫酸钾高温下,把有机的细胞结构破坏,把氮元素和硫酸反应产生硫酸铵,(为了使得样品消化时不产生挂壁,必须采用样品孔间温差小和带程序升温功能的消化炉,否则会产生挂壁现象,导致消化失败)消化完成后,需要将样品冷却到40℃左右,再把消化管放入定氮仪上。仪器对消化管内自动添加稀释液、碱,反应杯内自动添加硼酸和显色剂。对消化管内样品加热蒸馏,逸出氨气和水蒸气混合气体,冷却成氨水流到反应杯内生成硼酸氨,同时用标准硫酸进行滴定,直到蒸馏结束和滴定到终点。仪器自动计算酱油中蛋白质含量(蛋白质系数取5.71)。仪器设备和试剂[font='Times New
求购一台粗蛋白快速测定仪,用于饲料厂检测原料,要求快速,结果准确(跟凯斯定氮仪结果比对)。
杜马斯定氮仪 测量固体样品直接出结果 如果测水溶性蛋白应该怎么计算? 如:样品质量 1g 、最终定容体积 100ml、进样量100ul
[font=宋体]重组蛋白的表达(尤其是使用细菌载体和宿主)是一项成熟的技术。难点在于如何将其以活化形式分离。[/font][font=宋体] [/font][font=宋体]重组蛋白的纯化是生物学研究中的重要技术。为了研究蛋白的特定功能和结构,研究人员必须将重组蛋白从生物体中分离并纯化。蛋白纯化方法主要利用不同重组蛋白之间的相似性和差异性。可以根据蛋白之间的相似性去除非蛋白物质,然后根据蛋白之间的差异分离纯化目标重组蛋白。[/font][font=宋体] [/font][font=宋体][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/protein-tag][b]蛋白标签[/b][/url]是一种可以提高重组蛋白的溶解度、简化蛋白纯化的简单有效的工具,并通过简单的方法跟踪蛋白表达和纯化过程。此外,蛋白标签是追踪活细胞中蛋白和进程的一种有效工具,可以通过显微镜直接跟踪或者通过[/font][font=Calibri]Western blot[/font][font=宋体]、免疫沉淀或免疫染色间接进行跟踪。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]蛋白纯化的原理:[/b][/font][font=宋体]不同的重组蛋白具有不同的氨基酸序列和空间结构,导致其物理、化学和生物学特性存在差异。我们也可以根据目标蛋白与其他蛋白和裂解液的性质差异设计合理的蛋白纯化方案。[/font][font=宋体] [/font][font=宋体][font=宋体]大多数的纯化方案需要不止一步才能达到理想的纯度水平。该过程中的每一步都会造成一定的产品损失,假设每一步的获得率为[/font][font=Calibri]80%[/font][font=宋体]。因此,建议尽可能减少纯化步骤。起始原料的选择是纯化过程设计的关键。[/font][/font][font=宋体] [/font][font=宋体]在背景信息、检测方法和样品规格都已到位的情况下,可以考虑采用三阶段纯化策略。纯化分为捕获、中度纯化和精细纯化三个阶段,每个阶段都有特定的目标。捕获阶段的目标是分离、浓缩和稳定目标产物。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b][url=https://cn.sinobiological.com/resource/protein-review/protein-purification]蛋白纯化[/url]操作步骤:[/b][/font][font=宋体]理想情况下,最终的纯化过程包括样品制备,其中包括在需要时进行萃取和澄清,然后进行上述捕获、中度纯化和精细纯化三个阶段的纯化。步骤的数量始终取决于所需的纯度和蛋白的预期用途。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供不同表达系统的蛋白纯化服务,有细菌系统蛋白纯化、哺乳动物瞬时系统蛋白纯化、杆状病毒系统蛋白纯化。详情可以参看:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification[/font][/font]
[font=宋体][font=宋体]膜联蛋白([/font][font=Calibri]Annexin[/font][font=宋体])是一类分布广泛的钙依赖性磷脂结合蛋白,与磷脂酰丝氨酸([/font][font=Calibri]PS[/font][font=宋体])能特异性结合,参与一系列[/font][font=Calibri]Ca2+[/font][font=宋体]依赖型的膜相关的过程,包括细胞的胞吐和内吞作用、囊泡运输、调节血液凝固以及炎症反应等多种生物学事件,在许多人类疾病的发病机制或进展中起着非常重要的作用。膜联蛋白[/font][font=Calibri]V[/font][font=宋体]([/font][font=Calibri]Annexin V[/font][font=宋体])染色是检测细胞凋亡的常用方法。[/font][/font][b][font=宋体][font=宋体]膜联蛋白[/font][font=Calibri]V[/font][font=宋体]染色原理及应用[/font][/font][/b][font=宋体] [/font][b][font=宋体][font=宋体]一、膜联蛋白[/font][font=Calibri]V[/font][font=宋体]染色原理[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]膜联蛋白[/font][font=Calibri]V[/font][font=宋体]染色,也称为[/font][font=Calibri]Annexin V[/font][font=宋体]染色,是一种用于检测细胞凋亡的方法。其核心原理基于细胞凋亡过程中的一种生物化学变化。在正常细胞中,磷脂酰丝氨酸([/font][font=Calibri]PS[/font][font=宋体])只分布在细胞膜脂质双层的内侧。然而,当细胞开始凋亡时,这一分布会发生改变,磷脂酰丝氨酸会从细胞膜内侧翻到外侧。膜联蛋白[/font][font=Calibri]V[/font][font=宋体]是一种能够与这种外翻的磷脂酰丝氨酸特异性结合的蛋白。通过结合荧光物质,这种结合可以被检测和观察,从而确定哪些细胞正在经历凋亡。[/font][/font][b][font=宋体] [/font][font=宋体][font=宋体]二、膜联蛋白[/font][font=Calibri]V[/font][font=宋体]染色的应用[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]①流式细胞术:膜联蛋白[/font][font=Calibri]V[/font][font=宋体]染色常用于流式细胞术中,以检测和分类正常细胞和凋亡细胞。通过流式细胞仪,可以快速分析大量细胞,并准确地识别出凋亡细胞。[/font][/font][font=宋体][font=宋体]②光学显微镜成像:膜联蛋白[/font][font=Calibri]V[/font][font=宋体]染色也可用于光学显微镜成像技术,这使得研究者能够在显微镜下直接观察细胞的形态变化,从而对凋亡过程有更深入的理解。[/font][/font][font=宋体][font=宋体]③与其他染色方法的结合:膜联蛋白[/font][font=Calibri]V[/font][font=宋体]染色可以与其他染色方法如碘化丙啶[/font][font=Calibri](PI)[/font][font=宋体]染色结合使用。[/font][font=Calibri]PI[/font][font=宋体]是一种能够进入凋亡晚期细胞核的染料,因此可以用于区分凋亡早期和晚期细胞。这种联合使用的方法能提供更全面的细胞凋亡信息。[/font][/font][font=宋体][font=宋体]④临床应用:膜联蛋白[/font][font=Calibri]V[/font][font=宋体]染色在许多临床领域中都有应用,例如肿瘤学、血液学和药理学等。它可以帮助研究者深入理解疾病的发展过程,评估新药物对细胞凋亡的影响,以及监测疾病的进展和治疗的效果。[/font][/font][font=宋体][font=宋体]总的来说,膜联蛋白[/font][font=Calibri]V[/font][font=宋体]染色是一种强大的工具,可以帮助科学家们更好地理解细胞凋亡的过程,从而为疾病的治疗和药物研发提供有价值的信息。[/font][/font][font=宋体] [/font][font=宋体]更多关于膜联蛋白详情可以关注[url=https://cn.sinobiological.com/][b]义翘神州[/b][/url]![/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
[font=宋体]蛋白质是包括人类在内的各种生物有机体的重要组成成分,是生命的物质基础之一。生物体的生长、发育、遗传和繁殖等一切生命活动都离不开蛋白质。[/font][font=宋体] [/font][font=宋体]随着分子生物学、结构生物学、基因组学等研究的不断深入,人们意识到仅仅依靠基因组的序列分析来试图阐明生命活动的现象和本质是远远不够的。只有从蛋白质组学的角度对所有蛋白质的总和进行研究,才能更科学地掌握生命现象和活动规律,更完善地揭示生命的本质。[/font][font=宋体] [/font][font=宋体]由此许多学者将生命科学领域的研究焦点从基因转向蛋白质,使蛋白质成为揭示生命活动现象和分子生物学机理的重要研究对象。研究蛋白质首要的步骤是将目的蛋白从复杂的大分子混合物中分离纯化出来,得到高纯度具有生物学活性的目的物。因此,高效的纯化技术和手段是蛋白质研究的重要基础和关键之一。[/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体][font=宋体]蛋白纯化的目的[/font] [/font][/b][font=宋体][font=宋体]蛋白纯化的目的是将目标蛋白质从细胞裂解液的全部组分中分离出来,同时仍保留蛋白的生物学活性及化学完整性。蛋白质的分离和提纯工作是一项艰巨而繁重的任务,需根据蛋白的特性选择合适的纯化方法来提高获得的蛋白制品的纯度。[/font] [/font][font=宋体] [/font][b][font=宋体][font=宋体]蛋白纯化的原理[/font] [/font][/b][font=宋体][font=宋体]不同蛋白质的氨基酸序列及空间结构不同,导致其在物理、化学、生物学等性质上存在差异,利用待分离蛋白质与其它蛋白质性质上的差异,即可以设计出一套合理的蛋白纯化方案。蛋白的纯化大致分为粗分离阶段和精细纯化阶段两个阶段。粗分离阶段主要将目的蛋白和其他细胞成分如[/font] [font=Calibri]RNA[/font][font=宋体]、[/font][font=Calibri]DNA [/font][font=宋体]等分开,常用的方法为硫酸铵沉淀法。精细纯化阶段的目的是把目的蛋白与其他大小及理化性质接近的蛋白区分开来,[/font][/font][b][font=宋体][font=宋体]常用的方法有:凝胶过滤层析、离子交换层析、疏水层析、亲和层析等。[/font] [/font][/b][font=宋体] [/font][b][font=宋体]①[/font][font=宋体]凝胶过滤层析[/font][/b][font=宋体]凝胶过滤层析(又叫做分子筛)是根据样品的分子大小对样品进行分离的一种简单温和的层析技术。凝胶过滤层析也称分子筛层析、排阻层析,是利用具有网状结构的凝胶的分子筛作用,根据被分离物质的分子大小不同来进行分离。不同于离子交换层析和亲和层析,凝胶过滤的层析样品不与层析柱料结合,因此,缓冲液成分不直接影响分辨率。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]原理:层析柱中的填料是球状颗粒的惰性的多孔网状结构的柱料,多是交联的聚糖[/font][font=Calibri]([/font][font=宋体]如葡聚糖或琼脂糖[/font][font=Calibri])[/font][font=宋体]类物质。在加入样品之后,样品中的小分子物质能进入球状填料内部,在柱子中停留时间较长;而大分子物质不能进入球状填料内部,停留时间较短。所以当样品经过凝胶过滤层析柱分离后,样品中的不同分子大小的物质就可以被分离开了。[/font][/font][font=宋体] [/font][font=宋体]特点:[/font][font=宋体] [/font][font=宋体]根据分子大小和形状进行分离[/font][font=宋体] [/font][font=宋体]是一种非吸附的分离方式[/font][font=宋体] [/font][font=宋体]缓冲液成分不直接影响分辨率,只需要一种缓冲液[/font][font=宋体] [/font][font=宋体]操作便捷[/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体]②[/font][font=宋体]离子交换层析[/font][/b][font=宋体]离子交换层析是目前蛋白质分离纯化中应用最广泛的方法之一。[/font][font=宋体] [/font][font=宋体]原理:不同蛋白等电点差异,分子大小差异,在同一个流动相中电荷密度分布不同,电荷量不等,与具有相反电荷的离子交换介质结合强度不同,在流动相洗脱时保留时间不同,从而得以分离。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体]特点:[/font][font=宋体] [/font][font=宋体]根据分子大小和等电点差异进行分离[/font][font=宋体] [/font][font=宋体]灵敏度高,重复性,选择性好,分析速度快[/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体]③[/font][font=宋体]疏水层析[/font][/b][font=宋体]原理:疏水层析是依据蛋白质疏水性差异分离的。即根据蛋白质和疏水介质表面的疏水基团的可逆相互作用进行分离。蛋白的疏水性在高离子强度下被增强,因此在高离子强度环境中结合,通常采用降低离子强度的方式进行洗脱。独特的吸附分离模式使得疏水层析成为硫酸铵盐析后或离子交换高盐洗脱后理想的纯化方式。[/font][font=宋体] [/font][font=宋体]特点:[/font][font=宋体] [/font][font=宋体]采用了盐的水溶液作为流动相,色谱条件温和,生物大分子的活性回收率很高。[/font][font=宋体] [/font][font=宋体][font=宋体]蛋白质在[/font][font=Calibri]HIC[/font][font=宋体]操作过程中是高盐上样,低盐洗脱(高盐浓度的样品不必作处理就可直接上样)。[/font][/font][font=宋体] [/font][font=宋体]在一次色谱中可同时实现出去盐酸胍、蛋白质复性和分离三个目的。[/font][font=宋体] [/font][font=宋体][font=宋体]温度升高,蛋白质天然折叠伸展,暴露出更多内部疏水集团,使蛋白质的[/font][font=Calibri]HIC[/font][font=宋体]保留发生变化。[/font][/font][font=宋体] [/font][font=宋体]色谱填料稳定性好,盐水体系作流动相无环境污染。[/font][font=宋体] [/font][b][font=宋体]④[/font][font=宋体]亲和层析[/font][/b][font=宋体][font=宋体]原理:[url=https://cn.sinobiological.com/resource/protein-review/protein-purification-by-ac][b]亲和层析[/b][/url]是应用生物高分子与配基可逆结合的原理,将配基通过共价键牢固结合于载体上而制得的层析系统。这种可逆结合的作用主要是靠生物高分子对它的配基的空间结构的识别。常用的生物亲和关系有酶[/font][font=Calibri]-[/font][font=宋体]底物、底物类似物、抑制剂、激活剂、辅因子,抗体[/font][font=Calibri]-[/font][font=宋体]抗原,激素[/font][font=Calibri]-[/font][font=宋体]受体蛋白、载体蛋白,外源凝集素[/font][font=Calibri]-[/font][font=宋体]多糖、糖蛋白、细胞表面受体,核酸[/font][font=Calibri]-[/font][font=宋体]互补核苷酸序列、组蛋白、核酸结合蛋白等,具有高效、简单、快速的优点,是当前最为理想的分离纯化蛋白的方法。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多详情可以参看蛋白纯化技术[/font][font=Calibri]/[/font][font=宋体]方法:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification-techniques[/font][/font][font=Calibri] [/font]
[size=6][b]生产豆奶检测蛋白质含量用那类定氮仪最合适啊[/b][/size]
蛋白质为复杂的含氮有机化合物,是各种氨基酸以肽键连接而成,各类食品的蛋白质含量很不均匀,蛋白质含量是评价食物营养价值的重要指标之一。在食品中蛋白质含量测定方法中最常用最基本的方法是凯氏定氮法,在GB/T5009.5-2003中也将其定为法定检测方法,凯氏定氮法有常量凯氏氮法和微量凯氏定氮法。采用经典的凯氏定氮法比较费时费力,采用模块式消化、全自动凯氏定氮仪测定食品中的蛋白质,该方法比经典法快速,且数据准确可靠。1 材料与方法1.1 仪器与试剂1.1.1主要仪器:KjeltecTM2300型全自动凯氏定氮仪,DS-20消化炉及排废装置(均为瑞典FOSSTECATOR公司生产),样品磨,电子天平(准确至0.0001克)。1.1.2主要试剂:浓硫酸;硫酸钾;硫酸铜;盐酸标准溶液0.1027mol/L;氢氧化钠溶液400g/L;1%溴甲酚绿和0.7%甲基红混合指示剂;1%硼酸吸收溶液;硫酸铵;蔗糖。所用试剂均为优质品。1.2 测定方法称取适量样品放入消化管中,加入0.2g硫酸铜,6g硫酸钾及约12mL浓硫酸慢慢摇动将样品浸湿。把消化管放入已预热至42℃的加热模块中,将抽气泵打开到最大。5min后,关小抽气泵至酸雾刚好充满排废罩,在试管中形成冷凝环。约60min样品消化至透明蓝绿色液体,取出冷却至室温。将消化管放入2300型自动凯氏定氮仪,关上安全门,待仪器自动蒸馏、滴定、计算并打印结果。2 结果与讨论2.1 精密度取3种蛋白质含量不同的样品,每种样品平行测定6次,从测定结果可见,该仪器的精密度良好(见表1)。表1 仪器精密度测定样品名称 蛋 白 质 含 量(g/100g) 平均值(g/100g) 相对标准差(RSD%)纯牛奶 3.18 3.17 3.20 3.19 3.18 3.18 3.18 0.34大豆 31.25 31.46 31.38 31.53 31.62 31.39 31.44 0.41螺旋藻粉 67.54 67.78 67.58 67.64 67.69 67.82 67.68 0.16
[font=宋体][font=宋体]蛋白过镍柱纯化的原理是利用[/font][font=Calibri]Ni[/font][font=宋体]柱中的氯化镍与有[/font][font=Calibri]HIs[/font][font=宋体](组蛋白)标签的蛋白特异性结合的能力,同时也能与咪唑结合。具体步骤如下:[/font][/font][font=宋体] [/font][font=宋体]①[/font][font=宋体][font=宋体]过柱子前可以选择[/font][font=Calibri]Ni[/font][font=宋体]柱重生,往柱子里倒氯化镍,一个柱长体积就行,然后平衡柱子,用你自己的[/font][font=Calibri]buffer[/font][font=宋体],给蛋白提供最适的环境。[/font][/font][font=宋体]②[/font][font=宋体][font=宋体]平衡[/font][font=Calibri]4[/font][font=宋体]个柱长后,蛋白上样,可以让他自己挂,这样挂柱子的效果好一些。如果流速太慢,可以加个恒流泵,但是一定不能太快,太快挂柱效果差。也可以选择循环挂柱,就是恒流泵的一头接你装蛋白的烧杯,从柱子中留下来的液体还用同一个烧杯接回去。[/font][/font][font=宋体]③[/font][font=宋体][font=宋体]挂完之后,按理想来讲,蛋白在[/font][font=Calibri]Ni[/font][font=宋体]柱中与[/font][font=Calibri]Ni[/font][font=宋体]就结合了,杂蛋白多数在烧杯里留下来了。肯定有少量杂蛋白也挂上了。这时候要梯度洗脱,拿咪唑和你的[/font][font=Calibri]buffer[/font][font=宋体]配,一般从[/font][font=Calibri]0[/font][font=宋体]、[/font][font=Calibri]20mM[/font][font=宋体]、[/font][font=Calibri]40mM......100mM[/font][font=宋体]这样洗脱。咪唑加入之后,会和蛋白争夺与[/font][font=Calibri]Ni[/font][font=宋体]的结合位点,杂蛋白、你的目的蛋白,会在不同的浓度被洗脱下来。[/font][/font][font=宋体]④[/font][font=宋体][font=宋体]洗完之后,可以用[/font][font=Calibri]200mM[/font][font=宋体]咪唑洗柱子,清理一切蛋白,然后平衡几次。是否选择重生你自己定咯[/font][font=Calibri]~[/font][font=宋体]然后放上[/font][font=Calibri]20%[/font][font=宋体]乙醇保存柱子就可以咯[/font][font=Calibri]~ [/font][font=宋体]过的蛋白用不同的管子收下,然后[/font][font=Calibri]SDS-page[/font][font=宋体]检测在哪个管子里。[/font][/font][font=宋体]以上步骤仅供参考,不同的实验条件可能方法会不同。具体可以查阅专业书籍或者咨询专业人士。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供不同表达系统的[url=https://cn.sinobiological.com/resource/protein-review/protein-purification][b]蛋白纯化服务[/b][/url],有细菌系统蛋白纯化、[url=https://cn.sinobiological.com/services/transient-protein-expression-service][b]哺乳动物瞬时系统蛋白纯化[/b][/url]、杆状病毒系统蛋白纯化等,具体重组蛋白纯化原理及操作步骤可以查看[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification[/font][/font][font=宋体][font=宋体]杆状病毒[/font][font=Calibri]-[/font][font=宋体]昆虫细胞蛋白表达服务:[/font][font=Calibri]https://cn.sinobiological.com/services/baculovirus-insect-protein-expression-service[/font][/font][font=宋体][font=宋体]原核([/font][font=Calibri]E. coli[/font][font=宋体])蛋白表达服务:[/font][font=Calibri]https://cn.sinobiological.com/services/e-coli-protein-expression-service[/font][/font]
[font=宋体][b]蛋白纯化的原理:[/b][/font][font=宋体]不同的重组蛋白具有不同的氨基酸序列和空间结构,导致其物理、化学和生物学特性存在差异。我们也可以根据目标蛋白与其他蛋白和裂解液的性质差异设计合理的蛋白纯化方案。[/font][font=宋体] [/font][font=宋体][font=宋体]大多数的纯化方案需要不止一步才能达到理想的纯度水平。该过程中的每一步都会造成一定的产品损失,假设每一步的获得率为[/font][font=Calibri]80%[/font][font=宋体]。因此,建议尽可能减少纯化步骤。起始原料的选择是纯化过程设计的关键。[/font][/font][font=宋体] [/font][font=宋体]在背景信息、检测方法和样品规格都已到位的情况下,可以考虑采用三阶段纯化策略。纯化分为捕获、中度纯化和精细纯化三个阶段,每个阶段都有特定的目标。捕获阶段的目标是分离、浓缩和稳定目标产物。[/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体]蛋白纯化实际操作:[/font][/b][font=宋体] [/font][font=宋体]理想情况下,最终的纯化过程包括样品制备,其中包括在需要时进行萃取和澄清,然后进行上述三个阶段的纯化。步骤的数量始终取决于所需的纯度和蛋白的预期用途。[/font][font=宋体] [/font][font=宋体][font=宋体]分析纯化通常利用三个特性来分离蛋白。首先,蛋白可以通过[/font][font=Calibri]pH[/font][font=宋体]梯度凝胶或离子交换柱,根据其等电点进行纯化。其次,根据蛋白大小或分子量,可以通过体积排除色谱法分离或通过[/font][font=Calibri]SDS-PAGE([/font][font=宋体]十二烷基硫酸钠[/font][font=Calibri]-[/font][font=宋体]聚丙烯酰胺凝胶电泳[/font][font=Calibri])[/font][font=宋体]分析。通常采用[/font][font=Calibri]2D-PAGE[/font][font=宋体]对蛋白进行纯化,然后进行肽质量指纹图谱分析,以确定蛋白的特性。这对于实现科学目的非常有用,目前蛋白的检测限非常低,纳克级的蛋白足以用于分析。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]如何应用纯化原则:[/b][/font][font=宋体]①纯化技术的选择和组合:[/font][font=宋体]这种组合的目的是发展出一条最快的方法来获得所需纯度的产品。对于任何色谱分离来说,不同的技术在回收率、分辨率、速度和容量方面的表现都各不相同。我们可以对一种技术进行优化,使其专注于其中一个参数;例如分辨率要在速度和容量两个参数之间达到最佳。[/font][font=宋体] [/font][font=宋体]分辨率是通过技术的选择和色谱基质产生窄峰的效率来实现的。一般来说,此时目标蛋白和杂质具有非常相似的性质,分辨率是最难实现的。[/font][font=宋体] [/font][font=宋体][font=宋体]②标签蛋白的纯化[/font][font=Calibri]:[/font][/font][font=宋体][font=宋体]在蛋白中添加标签可以使蛋白具有它本来不具有的结合亲和力。通常重组蛋白是混合物中唯一具有这种亲和力的蛋白,有助于蛋白分离。最常见的标签是对镍或钴离子有亲和力的组氨酸标签([/font][font=Calibri]His[/font][font=宋体]标签)。因此,我们通过将镍离子或钴离子固定在树脂上,可以创建与组氨酸标签蛋白特异性结合的亲和介质。[/font][/font][font=宋体] [/font][font=宋体]③评估纯化产量:[/font][font=宋体][font=宋体]通常使用[/font][font=Calibri]SDS PAGE[/font][font=宋体]监测纯化过程中的不同步骤。这一方法只能粗略地测量混合物中不同蛋白的量,并且无法区分具有相似分子量的蛋白。为了评估多步纯化的过程,必须将特定蛋白的量与总蛋白的量进行比较。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]蛋白表达纯化实验中注意事项有哪些?[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1. [/font][font=宋体]选择表达载体时,要根据所表达蛋白的最终应用考虑。如为方便纯化,可选择融合表达;如为获得天然蛋白,可选择非融合表达。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2. [/font][font=宋体]融合表达时在选择外源[/font][font=Calibri]DNA[/font][font=宋体]同载体分子连接反应时,对转录和转译过程中密码结构的阅读不能发生干扰。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3. [/font][font=宋体]菌液[/font][font=Calibri]OD[/font][font=宋体]值要小于[/font][font=Calibri]1[/font][font=宋体],否则细胞太浓太老,不易破碎,且质粒易丢失。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4. [/font][font=宋体]诱导时间最好做一个梯度,不同蛋白诱导时间需摸索。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5. [/font][font=宋体]诱导温度适当摸索。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]6. IPTG[/font][font=宋体]浓度:一般在[/font][font=Calibri]1 mM [/font][font=宋体]以内,可适当摸索。[/font][/font][font=宋体] [/font][font=宋体]7. [/font][font=宋体]超声条件可视实际情况改变,只要使菌体裂解充分即可,即菌液清亮不粘稠。[/font][font=宋体][b]义翘神州提供[/b][url=https://cn.sinobiological.com/services/e-coli-protein-expression-service][b]原核蛋白纯化服务[/b][/url][b],服务内容包括:[/b][/font][font=宋体]①基因合成及密码子优化[/font][font=宋体]②载体构建[/font][font=宋体]③表达鉴定和可溶性分析[/font][font=宋体][font=宋体]④放大表达和[/font][font=Calibri]1-2[/font][font=宋体]步纯化[/font][/font][font=宋体]⑤大量表达及纯化[/font][font=宋体] [/font][font=宋体][font=宋体]更多详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/e-coli-protein-expression-service[/font][/font]
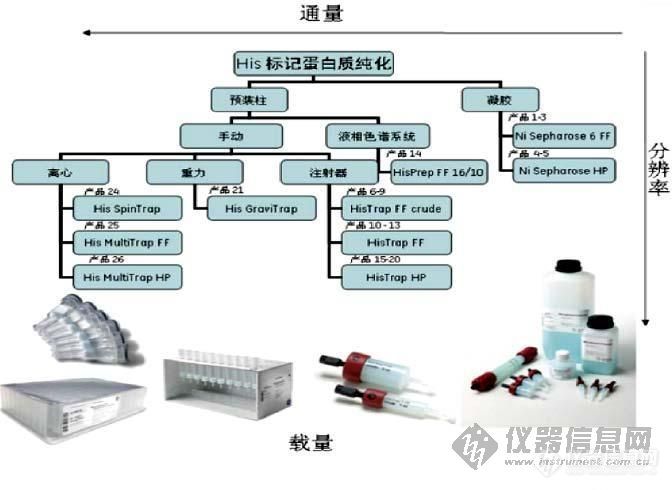
His-tag是专门设计用于重组蛋白质的纯化,与其他标签相比有很多明显优势,是目前用于纯化的融合标签中使用最为广泛的一种。Tag虽然简单,但是做过的人都知道,融合蛋白的纯化并非简单。1、纯化介质有10多种,应该如何选择?2、洗脱的标签蛋白杂带较多是什么原因?如何优化?3、甚至洗脱产物中没有目标蛋白原因为何?策略如何?欢迎大家互相交流讨论啊!His-tag 选择[img]http://ng1.17img.cn/bbsfiles/images/2008/10/200810061637_111174_1613111_3.jpg[/img]
[font=宋体]中国食品药品检定研究院(以下简称“中检院”)对纤维蛋白原和硫酸氨基葡萄糖氯化钠标准物质原料项目进行公告,现诚邀符合项目要求的供应商报名参加。[/font][b][font=宋体]一、项目基本情况[/font][/b][font=宋体]项目名称:中检院纤维蛋白原和硫酸氨基葡萄糖氯化钠标准物质原料项目[/font][font=宋体]项目编号:ZFCG202300023[/font][font=宋体]采购需求:[/font][table][tr][td=1,1,30][b][font=宋体]序号[/font][/b][/td][td=1,1,79][b][font=宋体]品种名称[/font][/b][/td][td=1,1,64][b][font=宋体]采购数量[/font][/b][/td][td=1,1,95][b][font=宋体]预算金额(万元)[/font][/b][/td][td=1,1,221][b][font=宋体]技术要求[/font][/b][/td][td=1,1,108][b][font=宋体]供应商特殊资质要求[/font][/b][/td][/tr][tr][td=1,1,30][font=宋体]1[/font][/td][td=1,1,79][font=宋体]纤维蛋白原[/font][/td][td=1,1,64][font=宋体]8000[/font][font=宋体]支[/font][/td][td=1,1,95][font=宋体]52.8[/font][/td][td=1,1,221][align=left][font=宋体]标准试剂,应为牛血来源,应为白色安瓿冻干分装,凝固物含量应不低于50%。[/font][/align][/td][td=1,1,108][font=宋体]/[/font][/td][/tr][tr][td=1,1,30][font=宋体]2[/font][/td][td=1,1,79][font=宋体]硫酸氨基葡萄糖氯化钠[/font][/td][td=1,1,64][font=宋体]1000g[/font][/td][td=1,1,95][font=宋体]2.2[/font][/td][td=1,1,221][align=left][font=宋体]应符合硫酸氨基葡萄糖氯化钠质量标准规定,氯化钠为19.0%-22.0%,乙醇应不得超过0.5%,硫酸根应为16.3%-17.3%,干燥失重应小于0.5%,炽灼残渣应为23.5%-26.0%,纯度应大于99.0%,含量应不低于99.0%。[/font][/align][/td][td=1,1,108][font=宋体] [/font][font=宋体]应具有硫酸氨基葡萄糖氯化钠原料药生产许可或口服制剂批准文号[/font][/td][/tr][/table][font=宋体]提供技术资料要求:[/font][font=宋体]1[/font][font=宋体]、根据采购需求中“技术要求”提供品种检验报告,报告应包括要求所列明内容;[/font][font=宋体]2[/font][font=宋体]、具有特殊资质要求的品种,按要求提供相关资质证明文件;[/font][font=宋体]3[/font][font=宋体]、货期要求[b]:[/b]纤维蛋白原3个月[b];[/b]硫酸氨基葡萄糖氯化钠:现货。[/font][font=宋体]4[/font][font=宋体]、质保期要求标化合格后1年。[/font][b][font=宋体]二、供应商资格要求[/font][/b][font=宋体]1.[/font][font=宋体]具有独立承担民事责任的能力;[/font][font=宋体]2.[/font][font=宋体]具有良好的商业信誉和健全的财务会计制度;[/font][font=宋体]3.[/font][font=宋体]具有履行合同所必需的专业技术能力;[/font][font=宋体]4.[/font][font=宋体]有依法缴纳税收和社会保障资金的良好记录;[/font][font=宋体]5.[/font][font=宋体]参加政府采购活动前三年内,在经营活动中没有重大违法记录;[/font][font=宋体]6.[/font][font=宋体]资格审查时,通过“信用中国”网站、中国政府采购网、国家企业信用信息公示系统、天眼查、企查查网站等渠道查询供应商信用记录,经查询列入失信被执行人、重大税收违法案件当事人名单、政府采购严重违法失信行为记录名单、经营异常名录信息、严重违法失信企业名单(黑名单)信息的,经查询在经营活动中有重大违法记录的,截至本项目采购活动开始前三年内因违法经营受到刑事处罚或者责令停产停业、吊销许可证或者执照、较大数额罚款等行政处罚的,不得参加本项目;[/font][font=宋体]7.[/font][font=宋体]单位负责人为同一人或者存在控股、管理关系的不同单位,不得参加同一项目响应;[/font][font=宋体]8.[/font][font=宋体]本项目不接受联合体参加,禁止转包或分包;[/font][font=宋体]9.[/font][font=宋体]法律、行政法规规定的其他条件。[/font][b][font=宋体]三、报名及提交响应文件方式[/font][/b][font=宋体]1.[/font][font=宋体]本项目采取网上报名的方式,不设现场报名及其他形式的报名。[/font][font=宋体]符合项目要求的潜在供应商需填写完整报名表(附件1)发送至邮箱hqzc@nifdc.org.cn。(邮件命名:项目名称+报名单位名称)[/font][font=宋体]2.[/font][font=宋体]潜在供应商需提交真实有效的响应文件(具体内容见附件2)并盖章密封邮寄至中检院联系人处。[/font][font=宋体]3.[/font][font=宋体]报名和邮寄时间截止至2023年3月10日(北京时间)。[/font][b][font=宋体]四、供应商确定原则[/font][/b][font=宋体]本项目以单品种有效报价最低原则确定供应商。[/font][b][font=宋体]五、联系方式[/font][/b][font=宋体]采购单位:中国食品药品检定研究院[/font][font=宋体]地址:北京市大兴区生物医药产业基地华佗路31号院后勤政采部[/font][font=宋体]联系人: 王晓雅[/font][font=宋体]联系电话:010-53852853[/font][font=宋体]电子邮箱:hqzc@nifdc.org.cn [/font][font=宋体]附件:[/font][font=宋体]1.[/font][font=宋体]标准物质原料项目报名表[/font][font=宋体]2.[/font][font=宋体]供应商报名响应文件[/font][font=宋体][/font]
[font=宋体][url=https://cn.sinobiological.com/resource/protein-review/protein-purification-protocol][b]蛋白纯化[/b][/url]是生物实验室和制药工业中至关重要的技术。它涉及从复杂的混合物中分离出目标蛋白质,同时保持蛋白质的结构和功能。了解蛋白纯化的原理和步骤不仅有助于提高实验效率,还可以降低实验失败的风险。在本篇文章中,我们将详细介绍蛋白纯化的定义、原理和步骤。[/font][font=宋体] [/font][font=宋体][b]蛋白纯化定义及原理[/b][/font][font=宋体] [/font][font=宋体]蛋白纯化是生物研究常用的一种技术,是指从蛋白混合物中得到纯度较高的某种蛋白的过程。根据样本和杂质的特性选择适合的纯化方法,纯化技术的选择要简单化,并且要产生最佳的纯化效果。如果纯度的要求很高,再增加一个离子交换或疏水作用色谱的额外中间步骤。不过尽量尝试使用尽可能少的步骤,因为步骤增多会降低总蛋白产出量。亲和步骤常用重力柱,有时其他色谱步骤中会使用恒压泵,然而蛋白纯化系统将提供更多的控制,可获得更详细的目标蛋白和杂质信息,并为色谱柱提供更好的保护。[/font][font=宋体] [/font][font=宋体][b]可溶性蛋白纯化的步骤[/b][/font][font=宋体] [/font][font=宋体]用于分离可溶性重组或非重组蛋白的分离方法取决于蛋白的内在生理化学特性(被标记蛋白除外)。典型的纯化方案如下所示(使用离子交换色谱法)。[/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、细胞裂解液[/font][/font][font=宋体]澄清裂解液[/font][font=宋体][font=宋体]离心([/font][font=Calibri]60000[/font][font=宋体]×[/font][font=Calibri]g[/font][font=宋体],[/font][font=Calibri]90 [/font][font=宋体]分钟)过滤或脱盐和交换缓冲液[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、澄清裂解液[/font][/font][font=宋体]①用亲和法[/font][font=宋体][font=宋体]([/font][font=Calibri]1[/font][font=宋体])进行[/font][font=Calibri]DEAE-Sepharose[/font][font=宋体]离子交换[/font][/font][font=宋体]交换缓冲液[/font][font=宋体] [/font][font=宋体][font=宋体]([/font][font=Calibri]2[/font][font=宋体])进行离子交换[/font][/font][font=宋体][font=宋体]? 弱阳离子[/font][font=Calibri]-[/font][font=宋体]羧甲基[/font][/font][font=宋体][font=宋体]? 强阳离子[/font][font=Calibri]-[/font][font=宋体]甲基磺酸盐[/font][/font][font=宋体][font=宋体]? 强阴离子[/font][font=Calibri]-[/font][font=宋体]季铵盐[/font][/font][font=宋体][font=宋体]? 弱阴离子[/font][font=Calibri]-[/font][font=宋体]二乙氨基乙基[/font][/font][font=宋体]? 磷酸纤维素[/font][font=宋体] [/font][font=宋体][font=宋体]([/font][font=Calibri]3[/font][font=宋体])用其他色谱方法[/font][/font][font=宋体]? 染料基质[/font][font=宋体]? 疏水[/font][font=宋体]? 羟磷灰石[/font][font=宋体]? 层析聚焦[/font][font=宋体] [/font][font=宋体]②浓缩[/font][font=宋体] [/font][font=宋体]③进行凝胶过滤[/font][font=宋体]④无菌过滤[/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、经纯化的蛋白[/font][/font][font=宋体] [/font][font=宋体][b]包涵体蛋白的折叠与纯化[/b][/font][font=宋体]在大肠杆菌中表达的重组蛋白位于细胞裂解后低速颗粒部分,它们高度聚集。包涵体通常来自于细胞质(或细胞周质,如使用了分泌载体)中的蛋白聚集。如前所述,由于与细菌核酸的相互作用,蛋白也可以位于低速或高速颗粒部分中。[/font][font=宋体] [/font][font=宋体][font=宋体]采用蛋白变性剂提取蛋白,如盐酸胍[/font][font=Calibri](Gu[/font][font=宋体][/font][font=Calibri]HCl)[/font][font=宋体]、尿素或有机酸。使用还原剂二硫苏糖醇[/font][font=Calibri](DTT)[/font][font=宋体]防止人工二硫键形成(尤其是分子间键)。变性后的蛋白可以通过各种方法纯化后再折叠,也可以直接折叠。通常建议在折叠前进行一些纯化(如[/font][font=Calibri]Gu[/font][font=宋体][/font][font=Calibri]HCl[/font][font=宋体]中的凝胶过滤),因为这往往会带来更高的折叠产率。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]原文转载:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification-protocol[/font][/font]
[font=宋体][font=宋体]在生物细胞的世界里,膜蛋白是一个不可或缺的角色。它们不仅参与细胞的识别、信号转导和物质运输等重要功能,还成为了药物研发的重要靶点。动物细胞的膜脂主要有[/font][font=Calibri]9[/font][font=宋体]种,而膜蛋白的种类繁多,虽然多数膜蛋白分子数量较少,但它们赋予了细胞膜至关重要的生物学功能。[/font][/font][font=宋体]根据与脂分子的结合方式和分离难易程度,膜蛋白主要分为外在膜蛋白和内在膜蛋白两大类。[/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体])外在膜蛋白为水溶性蛋白,通过离子键或其它较弱的键与膜表面的蛋白质分子或脂分子结合。因此,通过改变溶液的离子强度或提高温度,就可以轻松地从膜上分离出来,而不会破坏膜的结构。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体])内在膜蛋白与膜结合非常紧密,一般只有用去垢剂[/font][font=Calibri](detergent)[/font][font=宋体]使其膜解后才可分离出来。[/font][/font][b][font=宋体]膜蛋白提取方法:[/font][/b][font=宋体] [/font][font=宋体][font=Calibri]1)[/font][font=宋体]膜蛋白色谱[/font][font=Calibri](Chromatography of Membrane Protein,CMP)[/font][font=宋体]:[/font][font=Calibri]CMP[/font][font=宋体]分离强疏水性蛋白、多肽混合物的层析系统,一般有去垢剂(如[/font][font=Calibri]SDS[/font][font=宋体])溶解膜蛋白后形成[/font][font=Calibri]SDS-[/font][font=宋体]融膜蛋白,并由羟基磷灰石为固定相的柱子分离纯化。羟基磷灰石柱具有阴离子磷酸基团([/font][font=Calibri]P-[/font][font=宋体]端),又具有阳离子钙([/font][font=Calibri]C-[/font][font=宋体]端),与固定相结合主要决定于膜蛋白的大小、[/font][font=Calibri]SDS[/font][font=宋体]结合量。利用原子散射法研究[/font][font=Calibri]cAMP[/font][font=宋体]的分离机制发现,样品与[/font][font=Calibri]SDS[/font][font=宋体]结合后在离子交换柱上存在[/font][font=Calibri]SDS[/font][font=宋体]分子、带电荷氨基酸与固定相中带电离子间的交换,从而达到分级分离的目的。[/font][/font][font=宋体][font=Calibri]2)[/font][font=宋体]顺序抽提法:根据细胞蛋白溶解性的差异,用具有不同溶解能力的蛋白溶解液进行抽提的方法。用[/font][font=Calibri]Tris[/font][font=宋体]碱溶液裂解细胞提取高溶解性蛋白;把未溶解的沉淀用标准液溶解提取高疏水性蛋白;最后用含复合表面活性剂的蛋白溶解液,可以再次抽提前两次抽提后不能溶解的膜蛋白。[/font][/font][font=宋体][font=Calibri]3)[/font][font=宋体]离心蛋白提取法([/font][font=Calibri]centrifugal protein extraction[/font][font=宋体])[/font][/font][font=宋体]原理:高渗的蛋白裂解液让细胞溶胀破裂后,超高速离心[/font][font=宋体][font=Calibri]4)detergent-based[/font][font=宋体]:提取时先用裂解液裂解胞膜(选用不同的去污试剂是关键),梯度离心分离细胞器[/font][font=Calibri](ER)[/font][font=宋体],然后分级抽提方法。例如,去掉细胞器之后的[/font][font=Calibri]DEBRIS[/font][font=宋体]就是核膜,再裂解得到核膜蛋白。而膜蛋白是裂胞膜时不溶的部分。[/font][/font][font=宋体]总的感受:细胞的量要很充足。之后的定性鉴定常用的方法有双向免疫扩散、免疫电泳及聚丙稀酰胺凝胶电泳等。纯化蛋白质浓度的定量测定可用双缩脲法、酚试剂法或紫外光吸收法定量鉴定膜蛋白,方便迅速。[/font][font=宋体] [/font][font=宋体]除了上述的提取方法,还有其他一些方法可以用于提取膜蛋白。例如,可以采用超声波破碎法或反复冻融法来破坏生物膜的结构,从而使膜蛋白释放出来。此外,还可以使用一些特殊的分离技术,如超离心或凝胶电泳,来分离和纯化膜蛋白。[/font][font=宋体] [/font][font=宋体]值得注意的是,不同的膜蛋白具有不同的性质和稳定性,因此需要采用不同的提取方法。在选择提取方法时,需要考虑的因素包括目标膜蛋白的分子量、溶解度、稳定性以及生物膜的组成和性质等。[/font][font=宋体] [/font][font=宋体]总之,提取和纯化膜蛋白是一项具有挑战性的任务,需要综合考虑多种因素。通过对不同方法的了解和比较,我们可以根据实际需求选择合适的方法来提取和纯化目标膜蛋白,为进一步的研究和应用奠定基础。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/platform/multi-pass-transmembrane-protein][b]多次跨膜蛋白开发技术平台[/b][/url],详情可以关注[/font][font=Calibri]https://cn.sinobiological.com/services/platform/multi-pass-transmembrane-protein[/font][/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
[font=宋体][font=宋体][url=https://cn.sinobiological.com/resource/protein-review][b]重组蛋白[/b][/url]([/font][font=Calibri]recombinant protein[/font][font=宋体])技术原理是现代生物技术的核心之一,它通过将目的基因插入到表达载体中,在宿主细胞中进行表达,从而获得所需的重组蛋白。这一技术的关键是选择合适的表达载体和宿主细胞,以确保目的基因的正确表达和蛋白质的正确折叠。重组蛋白技术的应用范围非常广泛,包括药物研发、疫苗生产、诊断试剂、生物治疗等领域。通过重组蛋白技术,我们可以快速、高效地获得具有特定结构和功能的蛋白质,为科学研究、医学和工业应用提供重要的工具和资源。[/font][/font][font=宋体] [/font][b][font=宋体] [/font][font=宋体]构建重组蛋白的技术路线主要包括以下几个步骤:[/font][/b][font=宋体] [/font][font=宋体]①目的基因的获取:根据所需蛋白质的氨基酸序列,设计并合成相应的基因片段,或者从基因文库中筛选出相应的基因。[/font][font=宋体]②表达载体的构建:将目的基因插入到表达载体中,常用的表达载体包括质粒、病毒等,它们可以在宿主细胞中进行复制和表达。[/font][font=宋体]③宿主细胞的选择:选择适合的宿主细胞,如细菌、酵母、昆虫、哺乳动物等,以确保目的基因的正确表达和蛋白质的正确折叠。[/font][font=宋体]④重组蛋白的表达:将构建好的表达载体转入宿主细胞,进行培养或诱导,使目的基因在细胞内表达,产生重组蛋白。[/font][font=宋体]⑤重组蛋白的纯化:通过各种分离纯化技术,如离心、过滤、沉淀、色谱等,将重组蛋白从细胞中提取出来,并进行纯化和精制。[/font][font=宋体]⑥重组蛋白的鉴定:通过各种检测技术,如质谱、免疫学检测等,对重组蛋白进行鉴定和质量控制。[/font][font=宋体]通过以上技术路线,可以构建出具有特定结构和功能的重组蛋白,为科学研究、医学和工业应用提供重要的工具和资源。[/font][font=宋体] [/font][b][font=宋体] [/font][font=宋体]重组蛋白技术应用:[/font][/b][font=宋体] [/font][font=宋体]一、药物研发与生产:[/font][font=宋体]靶点验证:在药物研发初期,可以使用重组蛋白来验证药物作用的靶点。[/font][font=宋体]抗体药物:利用重组蛋白技术可以生产人源化抗体,用于癌症治疗、自身免疫性疾病治疗等。[/font][font=宋体]直接药物:某些重组蛋白本身就是药物,如胰岛素、生长激素等。[/font][font=宋体]二、疫苗开发:[/font][font=宋体]基因工程疫苗:使用重组蛋白技术生产疫苗,例如针对乙肝、流感等疾病的疫苗。[/font][font=宋体]三、诊断试剂:[/font][font=宋体][font=宋体]免疫检测:重组蛋白可以用作抗原或抗体,用于各种免疫检测技术,如[/font][font=Calibri]ELISA[/font][font=宋体]、免疫荧光等。[/font][/font][font=宋体]四、生物治疗:[/font][font=宋体]细胞因子:重组蛋白技术可以生产各种细胞因子,用于促进细胞生长、分化、凋亡等。[/font][font=宋体]五、基础研究:[/font][font=宋体]结构生物学:利用重组蛋白研究蛋白质的结构与功能关系。[/font][font=宋体]信号转导研究:通过重组蛋白研究细胞内信号转导过程。[/font][font=宋体]六、其他应用:[/font][font=宋体]酶工程:生产具有特定性质的酶。[/font][font=宋体]七、农业应用:如生产抗虫作物或具有特定性状的动物。[/font][font=宋体]通过以上几个方面,重组蛋白技术在生物医药领域中发挥着越来越重要的作用,为疾病治疗、疫苗开发、基础研究等提供了有力的技术支持。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供重组蛋白纯化服务:[/font][font=Calibri]https://cn.sinobiological.com/services/recombinant-protein-expression-service[/font][/font][font=宋体][font=宋体]更多重组蛋白详情可以以关注义翘神州:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b][font=宋体] [/font][font=Calibri] [/font]
[font=宋体]在现代生命科学研究中,[url=https://cn.sinobiological.com/resource/protein-review/protein-production][b]重组蛋白表达技术[/b][/url]扮演着至关重要的角色。通过将外源基因导入宿主细胞,并使其表达特定蛋白,我们能够获取大量高纯度的重组蛋白,为疾病治疗、药物研发和生物工程等领域提供了强有力的支持。本文将介绍重组蛋白表达的原理、表达系统、生产步骤以及应用前景。[/font][font=宋体][b]一、重组蛋白表达的原理[/b][/font][font=宋体][font=宋体]重组蛋白表达是利用[/font][font=Calibri]DNA[/font][font=宋体]重组技术,将目标基因(外源基因)导入宿主细胞中,并通过宿主细胞的生物机制使其表达出特定蛋白。其主要步骤包括:[/font][/font][font=宋体][font=宋体]基因克隆:将目标基因经过[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]扩增后,与表达载体连接,形成重组质粒。[/font][/font][font=宋体]转染或转化:将重组质粒导入宿主细胞中,可以使用化学方法、电穿孔或者嗜热菌等方式进行转染或转化。[/font][font=宋体]表达蛋白:重组质粒进入宿主细胞后,融合到宿主细胞的染色体中,随后遵循细胞的转录和翻译机制,表达出目标蛋白。[/font][font=宋体] [/font][b][font=宋体]二、常见的重组蛋白表达系统[/font][/b][font=宋体]大肠杆菌表达系统:大肠杆菌是常用的重组蛋白表达宿主细胞之一。其优点在于生长快速、易于培养,并且能够产生大量的蛋白。此外,大肠杆菌的遗传工具和代谢途径也被广泛研究,提供了便利。[/font][font=宋体]酵母表达系统:酵母表达系统包括酿酒酵母和毕赤酵母。这些酵母细胞具有真核细胞的特点,能够进行正确的蛋白折叠和修饰。同时,酵母细胞也可以进行大规模培养和高表达,适用于一些复杂蛋白的表达。[/font][font=宋体]昆虫细胞表达系统:昆虫细胞表达系统常用于大规模蛋白表达。昆虫细胞具有真核细胞的优势,能够对蛋白进行正确的折叠和修饰,适合于表达大量需求复杂结构的重组蛋白。[/font][font=宋体]哺乳动物细胞表达系统:哺乳动物细胞的表达系统可用于高效表达复杂蛋白和进行蛋白质研究。哺乳动物细胞具有真核细胞特点,能够进行正确的蛋白质修饰和折叠,并且在一些特殊情况下需要考虑到人类蛋白的免疫原性。[/font][font=宋体] [/font][font=宋体][b]三、重组蛋白生产步骤[/b][/font][font=宋体] [/font][font=宋体]细胞中有两个蛋白生产阶段:转录和翻译,被称为分子生物学的中心法则。换言之,转录和翻译步骤属于重组蛋白表达步骤。[/font][font=宋体] [/font][font=宋体]为了生产重组蛋白,基因被分离并克隆到表达载体中。重组蛋白的生产需要蛋白表达系统、蛋白纯化系统和蛋白识别系统。[/font][font=宋体] [/font][font=宋体][b]获取重组蛋白的基本步骤:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]目标基因的扩增。[/font][/font][font=宋体][font=Calibri]2.[/font][font=宋体]插入克隆载体。[/font][/font][font=宋体][font=Calibri]3.[/font][font=宋体]亚克隆到表达载体中。[/font][/font][font=宋体][font=Calibri]4.[/font][font=宋体]转化到蛋白表达宿主中[/font][font=Calibri]([/font][font=宋体]细菌[/font][font=Calibri]([/font][font=宋体]大肠杆菌[/font][font=Calibri])[/font][font=宋体]、酵母细胞、哺乳动物细胞或杆状病毒[/font][font=Calibri]-[/font][font=宋体]昆虫细胞系统[/font][font=Calibri])[/font][font=宋体]。[/font][/font][font=宋体][font=Calibri]5.[/font][font=宋体]重组蛋白鉴定试验[/font][font=Calibri](Western blot[/font][font=宋体]或荧光[/font][font=Calibri])[/font][/font][font=宋体][font=Calibri]6.[/font][font=宋体]大规模生产。[/font][font=Calibri]([/font][font=宋体]大规模发酵[/font][font=Calibri])[/font][/font][font=宋体][font=Calibri]7.[/font][font=宋体]分离和纯化。[/font][/font][font=宋体] [/font][font=宋体]需要考虑多种因素:[/font][font=宋体][font=Calibri]1.[/font][font=宋体]选择哪个宿主系统?[/font][/font][font=宋体][font=Calibri]2.[/font][font=宋体]如何分离和纯化重组蛋白?[/font][/font][font=宋体] [/font][font=宋体]选择适当的表达宿主或使用正确的纯化方法并不容易,应考虑目标重组蛋白的性质。下面列出了一些重要因素:[/font][font=宋体] [/font][font=宋体]? 膜结合[/font][font=宋体]? 溶解度[/font][font=宋体]? 单或多结构域[/font][font=宋体][font=宋体]? 大小[/font][font=Calibri]([/font][font=宋体]分子量[/font][font=Calibri])[/font][/font][font=宋体]? 表达位置[/font][font=宋体] [/font][font=宋体][font=宋体]对于大多数没有足够经验来表达和分离重组蛋白的人来说,重组蛋白的生产是非常耗时的。许多生物公司为各种不同规模的重组蛋白表达提供良好的服务:[/font][font=Calibri]https://cn.sinobiological.com/services/recombinant-protein-expression-service[/font][font=宋体],例如义翘神州[/font][/font][font=宋体] [/font][font=宋体][b]四、重组蛋白表达技术的应用前景[/b][/font][font=宋体]药物研发:重组蛋白表达技术被广泛应用于药物研发领域,用于生产重组蛋白药物。这些药物包括多肽类、蛋白类和抗体类药物,如生长因子、抗体药物和血液制剂等。通过重组蛋白表达技术,我们可以获得高效纯度的药物,满足临床上的需求。[/font][font=宋体]生物工程:重组蛋白表达技术被广泛应用于生物工程领域,用于生产特定的蛋白产品。这些产品可以应用于食品、化妆品、工业发酵等领域,如酶制剂、生物染料和生物材料等。[/font][font=宋体]疾病治疗:通过重组蛋白表达技术,我们能够合成特定的蛋白,用于疾病的治疗和诊断。例如,利用重组抗体技术,可以开发出用于癌症治疗和免疫治疗的抗体药物。[/font][font=宋体] [/font][font=宋体][font=宋体]详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-production[/font][/font]