近几年频频出现药物制剂中检出基因毒性杂质残留而被召回的事件。何为基因毒性杂质呢?“基因毒性杂质”(又称遗传毒性杂质Genotoxic Impurity ,GTI),是指本身直接或间接损伤细胞DNA,产生基因突变或体内诱变,具有致癌可能或者倾向的化合物。其主要来源为原料药合成过程中的起始物料、中间体、试剂和反应副产物,此外,药物在合成、储存或者制剂过程中也可能因为降解而产生基因毒性杂质,因其特点为毒性极强,在很低浓度时即可造成人体遗传物质的损伤,进而导致基因突变并可能促使肿瘤的发生,对用药的安全性产生了强烈的威胁。化学药品中的典型基因毒性杂质包括亚硝胺类杂质和磺酸酯类杂质,它们经过代谢激活后基因毒性非常强,是药物研发过程当中最易产生且需严格把控的基因毒性杂质。因此,各国的法规机构如ICH、FDA、EMA等都对基因毒性杂质提出了明确的要求,越来越多的药企在创新药和仿制药研发过程中也更加关注基因毒性杂质的控制和检测。2020 版《中国药典》四部通则中新增了《遗传毒性杂质控制指导原则》,本指导原则对基因毒性杂质的监管策略与ICH M7指导原则几乎保持一致。2020年5月国家药监局药审中心网站发布了《化学药物中亚硝胺类杂质研究技术指导原则》,该原则为注册申请上市以及已上市化学药品中亚硝胺类杂质的研究和控制提供了指导。在理论上,大部分药物都存在残留基因毒性杂质或被基因毒性杂质污染的风险,因此建立便捷、高效的分析方法是非常有必要的。
安谱实验致力于药品质量安全,针对近期热点基因毒性杂质NDMA的检测,开发了GC-MS对12种亚硝胺检测的应用解决方案,方法简单,定量结果可靠。[align=center][b]事件背景[/b][/align]近期,某药企在对一种主要用于治疗轻、中度原发性高血压的缬沙坦原料药生产工艺优化评估时,在未知杂质中发现并检定其中一种杂质为基因毒性杂质——N-亚硝基二甲胺(NDMA)。该事件持续发酵,国内外陆续有相关缬沙坦药品被召回或暂停交易,此事件被认为是该药企发展的”“黑天鹅”。一时间,药品中基因毒性杂质的排查和有效控制问题被推上行业甚至是广大社会舆论的风口浪尖。[align=center][b]那么NDMA是什么物质,它竟能引起如此恐慌?[/b][/align]世界卫生组织(WHO)将NDMA归类为2A类致癌物质,即对人很可能致癌,此类致癌物对人致癌性证据有限,对实验动物致癌性证据充分。该基因毒性杂质广泛存在于日常食品、饮品、烟草、橡胶制品等物质当中,甚至空气、水、土壤均是其重要来源,它是世界公认的三大致癌物质之一(另外两种是黄曲霉毒素和苯并芘)。在上述涉事药企所生产的缬沙坦原料药中检测出NDMA的平均含量远超欧盟暂定标准0.3ppm的200多倍,而这是被病人长期服用的药物,因此对病人来说是药已经不是“三分毒”而是“十分毒”。安谱实验作为全国领先的实验室用品供应链管理服务商,不仅能够提供整体打包的耗材供应服务,同时也为各行业提供完备的应用解决方案。本次,安谱实验为助力制药行业基因毒性杂质的监测,开发了GC-MS对12种亚硝胺检测的应用解决方案。[b]1.检测方法[/b]色谱检测(GC-MS法):色谱柱:CD-WAX (GAEQ-103221)30m*0.25mm*0.25μm色谱柱温度程序:起始温度60℃,保持1 min;以8℃/min 升温至132℃,保持5min,以50℃/min升温至240℃,保持10 min。载气:氦气,进样量:1.0 μL进样方式:不分流离子源温度:230℃传输线温度:250℃进样口温度:240℃检测器:MS检测器(单四级杆)[b]2.实验结果[/b]配置不同浓度的12种亚硝胺混标溶液,使得其中NDMA的浓度分别为10ppb,20ppb,50ppb,100ppb,200ppb。在10ppb下,该方法仍能满足NDMA检测信噪比大于10。建立浓度和峰面积的线性曲线,得到相关系数R2=0.9997,证明该方法具有良好线性。且平行进样6针,峰面积RSD<2.0%,方法稳定,定量结果可靠。[align=center][img]http://img1.17img.cn/17img/images/201808/insimg/e0e1977c-985f-40c3-a0a9-76abcd31704d.jpg[/img][/align][align=center]12种亚硝胺混标中NDMA标准曲线图[/align][align=center][img]http://img1.17img.cn/17img/images/201808/insimg/170276fe-703a-479a-ac46-6f6ba0985864.jpg[/img][/align]方法重现性表[align=center][img]http://img1.17img.cn/17img/images/201808/insimg/dfd1dbdc-abc4-49d1-ac38-72d5cc967579.jpg[/img][/align]根据物质特征离子,该方法可以对12种亚硝胺物质分别进行精确定量检测。[align=center][img]http://img1.17img.cn/17img/images/201808/insimg/af52a548-afa5-42b2-99a1-0684afd662e6.jpg[/img][/align][align=center]12种亚硝胺200ppb标液TIC[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]气质[/color][/url]谱图[/align]化合物参数表[align=center][img]http://img1.17img.cn/17img/images/201808/insimg/dbda93be-ab7a-4c65-8403-0ab9dcf0e999.jpg[/img][/align][b]3.实验室耗材[/b][align=center][img]http://img1.17img.cn/17img/images/201808/insimg/197a9dc4-da74-4613-a2bc-b57178160aa9.jpg[/img][/align]想要获得更多详细的产品信息欢迎来电咨询:021-54890099或访问安谱实验电商平台:www.anpel.com.cn
[B][center]药物中杂质的来源及杂质限量检查[/center] [/B]药物只有合格品与不合格品;一般化学试剂分为4个等级(基准试剂、优级纯、分析纯、化学纯) [B]药物中一般杂质检查 [/B][B]氯化物为一指示性杂质。[/B] 通过对氯化物的控制,可同时控制与氯化物结合的一些阳离子以及某些同时生成的副产物。可从氯化物检查结果显示药物的纯度,间接考核生产、贮藏过程是否正常。 1. 原理 药物中微量的氯化物在硝酸酸性条件下与硝酸银反应,生成氯化银的胶体微粒而显白色浑浊,与一定量的标准氯化钠溶液在相同条件下产生的氯化银浑浊程度比较,判定供试品中氯化物是否符合限量规定。 Ag+ + Cl- → AgCl ↓ [B]硫酸盐检查法 [/B] 1. 原理 药物中微量的硫酸盐在稀盐酸酸性条件下与氯化钡反应,生成硫酸钡的微粒而显白色浑浊,与一定量的标准硫酸钾溶液在相同条件下产生的硫酸钡浑浊程度比较,判定供试品中硫酸盐是否符合限量规定。 [B]铁盐检查法 [/B]硫氰酸盐法 巯基醋酸法 砷盐检查法 1. 古蔡氏法 1. 原理 金属锌与酸作用产生新生态的氢,与药物中微量砷盐反应生成具挥发性的砷化氢,遇溴化汞试纸产生黄色至棕色的砷斑,与同条件下一定量标准砷溶液所生成的砷比较斑,判断砷盐的含量。 [B]硒、氟及硫化物检查法 [/B]1. 氧瓶燃烧法 适用于以共价键结合的卤素、硫、硒的有机药物。 本法系将有机药物防入充满氧气的密闭燃烧瓶中进行燃烧,将燃烧所产生的欲测组分吸收于适当的吸收液中,然后根据欲测组分的性质,选用合适的分析方法进行鉴别、检查或含量测定。 [B]注意事项及讨论 [/B]1. 根据被燃烧分解的样品量选用适宜大小的燃烧瓶。 2. 测定氟化物时应改用石英燃烧瓶。 1. 硒检查法 (1). 操作方法 样品与对照品液,调节Ph2.0±0.2,加盐酸羟胺,二氨基萘,比色。 [B]硫化物检查法 [/B] 方法同砷盐检查第一法,不装醋酸铅棉花,以醋酸铅试纸代替溴化汞试纸。 标准液取1ml 5/ml [B]澄清度检查法 [/B]将一定浓度的供试品溶液与浊度标准液分别置于配对的比浊用玻璃管,同置黑色背景上,在漫射光下观察。浊度标准液 硫酸肼与乌洛托品溶液混合分五个等级,未超过0.5等级即为澄清。BP98规定未超过1等级即为澄清。 [B]溶液颜色检查法 [/B]CHP2000 [B]1. 比色法[/B] 色调标准贮备液 黄色液 重铬酸钾液(BP98用氯化铁) 红色液 氯化钴液 蓝色液 硫酸铜液 配成各种色调色号标准比色液共50种。 [B]2. 分光光度法 [/B] [B]易碳化物检查法 [/B]检查药物中含有的遇硫酸易碳化或易氧化而呈色的有机杂质。 对照品液 样品液 加硫酸5后,加供试品。 [B]炽灼残渣检查法[/B] 取供试品1.0~2.0g或个药品项下规定的重量,置已炽灼至恒重的坩埚中,精密称定,缓缓炽灼至完全碳化,放冷至室温;除另有规定外,加硫酸使湿润,低温加热至硫酸蒸气除尽后,在700~800炽灼使完全灰化,移至干燥器内,放冷至室温,精密称定,再在700~800炽灼至恒重,即得。残渣限量一般为0.1~0.2% 一般应使炽灼残渣量为1~2mg 若需将炽灼残渣留作重金属检查时,炽灼温度必须控制在500~600。 [B]干燥失重测定 [/B]1. 常压恒温干燥法 2. 干燥剂干燥法 3. 减压干燥法 [B]水分测定法 [/B][B]费休氏法 [/B] 本法是根据碘和二氧化硫在吡啶和甲醇溶液中能与水起定量反应的原理以测定水分。 [B]甲苯法[/B] 在加热状态下,甲苯夹带着水分蒸出,收集蒸出的水分测定。 [B]药物中特殊杂质检查 [/B] [B]一、物理法 [/B] [B]二、化学反应法 [/B](一)容量分析法 (二)重量分析法 (三)比色法和比浊法 [B]三、色谱法 [/B]1.纸色谱法 薄层色谱法 TLC是药典中最常用的特殊杂质限量检查方法。 1.在一定供试品及检查条件下,不允许有杂质斑点存在 2.以待测杂质对照品检测 3.将供试品稀释到适当浓度作为杂质对照品溶液 4.选用质量符合规定的与供试品相同的药物作为杂质对照品 [B]高效液相色谱法 [/B] [B][url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法 [/B] 1.面积归一化法 2.主成分自身对照法 3.内标法测定 4.内标法加校正因子法 5.外标法 有机溶剂残留量测定法 [B]分光光度法 紫外分光光度法 比色法 [url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]分光光度法[/B]
浅谈对已有国家标准化学药物杂质检查方法学研究资料的审评体会审评五部 李志万 《已有国家标准化学药品研究技术指导原则》(征求意见稿)中“质量研究方法的选择及方法学验证”部分提出“对于原料药的有关物质检查,重点通过采用合成中间体、粗品等考察方法的专属性;对于制剂的有关物质检查,重点通过破坏试验等考察方法的专属性”。 已有国家标准的(注册分类6的仿制)药物注册占我国目前的药物注册绝大部分。可能因为对新制订的《化学药物杂质研究技术指导原则》的理解不同,仿制药物申报资料中杂质研究部分多数存在这样或那样的问题,需要以书面或非书面的形式进行说明或完善,严重影响了对药品评价和注册的进度。笔者拟根据自己对此问题的理解,简略谈一下自己对仿制药物杂质检查方法研究的几点认识。 本文所阐述的杂质主要为药物中的有机杂质,但不包括残留有机溶剂。 一 正确认识仿制药物杂质研究的意义 可能有部分研究人员认为鉴于仿制药物的安全性已经验证,其杂质研究可否不再进行,可否不经验证直接沿用已有标准中(有关物质检查)方法。对上述观点,笔者认为因不同研发单位所用的原辅料不同,所引入的杂质不同;不同研发单位所采用的制备路线、制备工艺不同,所产生的杂质可能会不同。因此,有必要对仿制药物中的杂质重新进行研究,已有标准中方法是否适用于自制品也需实验验证。 二、已有标准药物杂质检查方法研究的几点考虑 与其它定量检查方法相比,杂质检查更着重于方法的专属性和灵敏度;仿制药物杂质研究亦是如此,但因有同品种标准可供参考,也有其特殊性。下面拟以已有标准中有无杂质检查项,以及在相应情况下原料药和制剂的杂质如何研究分别阐述。 1 已有标准中有有关物质检查项的仿制药物杂质检查 此时的原料药杂质研究如采用已有标准中方法,方法专属性和灵敏度验证的主要对象应药物粗品中杂质和药物制备过程中的中间体,尤其是后期制备中间体,而非原料降解物。之所以不对原料降解物作更多关注,是基于药物结构一致,其降解物亦应一致的推断;而已有标准中检查方法对(相同)降解物检测的可行性是已经验证过的。以此相反,仿制的制剂杂质研究主要关注点则是已有方法对制剂中主药(在适宜条件下)降解物的检测专属性和灵敏度是否符合要求。这是因为:(1)原料药中杂质及其制备中间体已经得到检控。(2)因不同制剂的处方、制备工艺不同,导致主药存在的环境不同;在酸、碱、氧化、热、光照等条件的“催化下攠,主药产生的降解物可能会不同。(3)不同的辅料对主药降解物检测的干扰性不同。因此,验证已有方法是否仍适用于新制剂中的杂质检测很有必要。 对于已有明确认识的有毒降解物,如对乙酰氨基酚之对氨基酚、葡萄糖之5-甲基糠醛等,无论原料药还是制剂,均建议采用杂质对照品验证所用方法的可行性。 如可能因条件限制,或认识的不同,仿制药物研发单位采用有别于已有标准中的其他方法,笔者则建议进行全面的(自拟)杂质检查方法学研究为宜,具体要求见《化学药物杂质研究技术指导原则》。值得强调的是,自拟方法与已有方法对相同供试品中杂质进行对比研究,对评价自拟方法的可行性很有意义。 2 已有标准中无有关物质检查项的仿制药物杂质检查 如已有标准中未收载有关物质检查项,在无相关研究结论支持的条件下,不能简单地推断所仿制的药物稳定而不需进行有关物质研究。笔者认为无论从质量标准的提高方面,还是从自制品质量研究、稳定性的考察方面(本文前面已说明自制品杂质可能与被仿制品杂质不同,稳定性亦可能有所差异),均有必要对仿制的原料药和/或制剂进行相应的杂质研究,并根据研究结果选用可行的杂质检查方法检控自制品的质量。具体要求亦请参见《化学药物杂质研究技术指导原则》。 考虑到原料药有时不会即时制成制剂,在贮存期间可能会有一定的降解,同时便于制剂厂家检测市购原料药的质量,建议制订适宜限度将有关物质检查项列入(原料药)质量标准;制剂质量标准中是否制订有关物质检查项,可根据杂质的毒性(安全性)、制剂的稳定性综合考虑。 欢迎对上述观点进行讨论、指正。

药物杂质是指无治疗作用或影响药物的稳定性以及疗效的物质。由于杂质检测和含量控制对药品质量控制以及安全用药密切相关,国家药品监督管理局(National Medical Products Administration, NMPA)对药物临床前研究中的杂质分析越来越重视。 化药中的杂质可分为有机杂质、无机杂质、残留溶剂。对于新药制剂来说:有活性组分的降解产物、活性组分与赋形剂和(或)内包装/密封系统的反应产物、遗传毒性杂质以及药包材杂质。关于杂质的分析方法,对于有机杂质的分析(起始物、副产物、中间体、降解产物等),使用色谱法分析居多;对于无机杂质(重金属,无机盐等),通常采用ICP/AA/[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICPMS[/color][/url]等仪器分析;对于残留溶剂杂质,则以GC分析为主。 贯穿于药品研发的整个过程的理念就是保证安全。选择合适的分析方法,准确地测定杂质的含量,综合毒理及临床研究的结果可以更好地研究药物杂质。基于此,[b][color=#ff0000]仪器信息网[/color][/b]与[b][color=#ff0000]天津市分析测试协会[/color][/b]拟于[b][color=#ff0000]2021年7月27日[/color][/b]联合举办“[color=#ff0000]化学药物杂质研究及检测技术[/color]”主题网络研讨会,旨在关注药物安全和药物杂质分析检测,为广大药学工作者和检测人员提供交流的空间。[url=https://insevent.instrument.com.cn/t/Kk][img=,690,483]https://ng1.17img.cn/bbsfiles/images/2021/07/202107231627454035_7123_2507958_3.png!w690x483.jpg[/img][/url][b][size=18px][color=#ff0000][url=https://insevent.instrument.com.cn/t/Kk]点击参会:https://insevent.instrument.com.cn/t/Kk[/url][/color][/size][/b]
采购一些原料时,基因毒杂质检验结果是否可以参考厂家,而不采用入厂检验的方式?

药物杂质即影响药物纯度的物质。药品在临床使用中产生的不良反应除了与药品本身的药理活性有关外,有时与药品中存在的杂质也有很大关系[b][color=#ff0000]。杂质直接关系到药品的质量可控性与安全性[/color][/b],在药物的研究、生产、供应和临床使用等方面,规范地进行杂质的研究,并将其控制在一个安全、合理的限度范围之内,才能保证药物的有效性和安全性。[color=#ff0000][b]因此杂质的研究及检测技术是药品研发的一项重要内容[/b][/color]。 [color=#3366ff][b]2018年8月30日[/b][/color],仪器信息网网络讲堂栏目将为您呈现“化学药物杂质研究及检测技术”主题网络研讨会。届时将邀请业内专家及技术人员为大家介绍化学药物杂质研究的最新进展及检测技术。 [b]如果你是一个对知识渴望的化学药物研究者或从业人员,想了解药物杂质的最新研究进展;又或者是不安于现状的检验检测机构工作者,想要提高检测技术水平,那就千万不要错过这个难得的沟通交流机会,保证会让你有意想不到的收获哦~欢迎大家踊跃报名[/b]([b][url=https://www.instrument.com.cn/webinar/meetings/icd/]点击即可传送至免费报名处[/url],[color=#ff0000]报名截止日期8月29日[/color][/b])![url=https://www.instrument.com.cn/webinar/meetings/icd/][img=,690,636]https://ng1.17img.cn/bbsfiles/images/2018/08/201808281042237666_6386_3429861_3.jpg!w690x636.jpg[/img][/url][url=https://www.instrument.com.cn/webinar/meetings/icd/][img=,690,724]https://ng1.17img.cn/bbsfiles/images/2018/08/201808281042363056_2579_3429861_3.png!w690x724.jpg[/img][/url]

药物杂质是指无治疗作用或影响药物的稳定性以及疗效的物质。由于杂质检测和含量控制对药品质量控制以及安全用药密切相关,国家药品监督管理局(National Medical Products Administration, NMPA)对药物临床前研究中的杂质分析越来越重视。 化药中的杂质可分为有机杂质、无机杂质、残留溶剂。对于新药制剂来说:有活性组分的降解产物、活性组分与赋形剂和(或)内包装/密封系统的反应产物、遗传毒性杂质以及药包材杂质。关于杂质的分析方法,对于有机杂质的分析(起始物、副产物、中间体、降解产物等),使用色谱法分析居多;对于无机杂质(重金属,无机盐等),通常采用ICP/AA/[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICPMS[/color][/url]等仪器分析;对于残留溶剂杂质,则以GC分析为主。 贯穿于药品研发的整个过程的理念就是保证安全。选择合适的分析方法,准确地测定杂质的含量,综合毒理及临床研究的结果可以更好地研究药物杂质。基于此,[b]仪器信息网[/b]与[b]天津市分析测试协会[/b]拟于[b][color=#ff0000]2021年7月27日[/color][/b]联合举办[color=#ff0000][b][url=https://insevent.instrument.com.cn/t/Kk]“化学药物杂质研究及检测技术”主题网络研讨会[/url][/b][/color],旨在关注药物安全和药物杂质分析检测,为广大药学工作者和检测人员提供交流的空间。[url=https://insevent.instrument.com.cn/t/Kk][img=,690,483]https://ng1.17img.cn/bbsfiles/images/2021/07/202107231500576930_1336_2507958_3.png!w690x483.jpg[/img][/url][url=https://insevent.instrument.com.cn/t/Kk][size=18px][color=#ff0000][b]点击报名:https://insevent.instrument.com.cn/t/Kk[/b][/color][/size][/url]
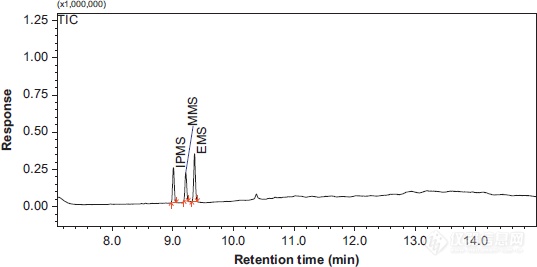
[align=left][font='simsun'][size=14px]药物中基因毒性杂质甲磺酸烷基酯类物质的检测[/size][/font][/align][align=center][size=21px]—[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url][/size][font='calibri'][size=21px]-[/size][/font][size=21px]质谱串联法[/size][/align][align=left][/align][align=left][font='simsun'][size=14px]简介[/size][/font][/align][align=left][font='simsun'][size=14px]近年来药物中基因毒性杂质的检测成为人们关注的焦点,基因毒性杂质是指直接或者间接损[/size][/font][font='simsun'][size=14px]伤细胞 [/size][/font][font='simsun'][size=14px]DNA[/size][/font][font='simsun'][size=14px],产生致突变和致癌作用的物质,常见的基因毒性杂质有甲磺酸烷基酯等。[/size][/font][/align][align=left][/align][align=left][font='simsun'][size=14px]拉米夫定[/size][/font][font='simsun'][size=14px][color=#333333]可以抑制 [/color][/size][/font][font='simsun'][size=14px][color=#333333]HIV[/color][/size][/font][font='simsun'][size=14px][color=#333333] [/color][/size][/font][font='simsun'][size=14px][color=#333333]和乙型肝炎病毒。在拉米夫定合成过程中磺酸类化合物作为反应试[/color][/size][/font][font='simsun'][size=14px][color=#333333]剂[/color][/size][/font][font='simsun'][size=14px][color=#333333]([/color][/size][/font][font='simsun'][size=14px][color=#333333]如甲磺酸[/color][/size][/font][font='simsun'][size=14px][color=#333333])[/color][/size][/font][font='simsun'][size=14px][color=#333333],醇类化合物作为溶剂(如甲醇,乙醇和异丙醇[/color][/size][/font][font='simsun'][size=14px][color=#333333])[/color][/size][/font][font='simsun'][size=14px][color=#333333],因此药物中存在杂质甲磺[/color][/size][/font][font='simsun'][size=14px][color=#333333]酸甲酯[/color][/size][/font][font='simsun'][size=14px][color=#333333]([/color][/size][/font][font='simsun'][size=14px][color=#333333]M[/color][/size][/font][font='simsun'][size=14px][color=#333333]M[/color][/size][/font][font='simsun'][size=14px][color=#333333]S[/color][/size][/font][font='simsun'][size=14px][color=#333333])[/color][/size][/font][font='simsun'][size=14px][color=#333333],甲磺酸乙酯[/color][/size][/font][font='simsun'][size=14px][color=#333333]([/color][/size][/font][font='simsun'][size=14px][color=#333333]E[/color][/size][/font][font='simsun'][size=14px][color=#333333]M[/color][/size][/font][font='simsun'][size=14px][color=#333333]S[/color][/size][/font][font='simsun'][size=14px][color=#333333])[/color][/size][/font][font='simsun'][size=14px][color=#333333],甲磺酸异丙酯[/color][/size][/font][font='simsun'][size=14px][color=#333333]([/color][/size][/font][font='simsun'][size=14px][color=#333333]I[/color][/size][/font][font='simsun'][size=14px][color=#333333]P[/color][/size][/font][font='simsun'][size=14px][color=#333333]M[/color][/size][/font][font='simsun'][size=14px][color=#333333]S)[/color][/size][/font][font='simsun'][size=14px][color=#333333] [/color][/size][/font][font='simsun'][size=14px]。[/size][/font][font='simsun'][size=14px] [/size][/font][font='simsun'][size=14px]基于药物的每日最大剂量 [/size][/font][font='simsun'][size=14px]300mg[/size][/font][font='simsun'][size=14px],杂质含量要求低于 [/size][/font][font='simsun'][size=14px]5ug/ml[/size][/font][font='simsun'][size=14px]。[/size][/font][/align][align=left][/align][align=left][font='simsun'][size=14px]本文用[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]柱[/size][/font][font='simsun'][size=14px]GSBP-INOWAX 30m-0.25mm-0.25um [/size][/font][font='simsun'][size=14px]建立了液体直接进样法分析药物中甲磺酸烷基酯的 [/size][/font][font='simsun'][size=14px][url=https://insevent.instrument.com.cn/t/Mp]gc[/url]/MS [/size][/font][font='simsun'][size=14px]方法,该方法快速,稳定并且灵敏度满足了对微量分析的要求。[/size][/font][/align][align=left][font='simsun'][size=14px]样品制备[/size][/font][/align][size=14px]分别取[/size][font='calibri'][size=13px]1[/size][/font][font='calibri'][size=13px]0[/size][/font][font='calibri'][size=13px]m[/size][/font][font='calibri'][size=13px]g[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]MM[/size][/font][font='calibri'][size=13px]S[/size][/font][size=13px],[/size][size=13px] [/size][font='calibri'][size=13px]E[/size][/font][font='calibri'][size=13px]M[/size][/font][font='calibri'][size=13px]S[/size][/font][size=14px]和[/size][font='calibri'][size=13px]I[/size][/font][font='calibri'][size=13px]P[/size][/font][font='calibri'][size=13px]M[/size][/font][font='calibri'][size=13px]S[/size][/font][size=14px]溶于[/size][font='calibri'][size=13px]1[/size][/font][font='calibri'][size=13px]0[/size][/font][font='calibri'][size=13px]m[/size][/font][font='calibri'][size=13px]l[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]N[/size][/font][size=13px],[/size][font='calibri'][size=13px]N[/size][/font][size=14px]-二甲基甲酰胺溶剂中为标准品储备液。[/size][size=14px]用溶剂稀释储备液制成 [/size][font='calibri'][size=13px]1000ug/mL [/size][/font][size=13px]的[/size][size=14px]混标加入 [/size][font='calibri'][size=13px]200mg/ml [/size][/font][size=14px]的拉米夫定中制成样品加标的溶液待用。[/size][align=left][font='simsun'][size=14px][url=https://insevent.instrument.com.cn/t/Mp]gc[/url] [/size][/font][font='simsun'][size=14px]条件[/size][/font][/align][align=left][size=14px]色谱仪: [/size][font='calibri'][size=13px][url=https://insevent.instrument.com.cn/t/Mp]gc[/url]MS-QP2010[/size][/font][/align][align=left][font='simsun'][size=14px]色谱柱:[/size][/font][font='simsun'][size=14px] [/size][/font][font='simsun'][size=14px]GSBP-INOWAX[/size][/font][font='simsun'][size=14px]30m-0.25mm-0.25um[/size][/font][font='simsun'][size=14px]([/size][/font][font='simsun'][size=14px]PN[/size][/font][font='simsun'][size=14px]:[/size][/font][font='simsun'][size=14px]2025-3002[/size][/font][font='simsun'][size=14px])[/size][/font][/align][align=left][size=14px]进样体积:[/size][font='calibri'][size=13px]1.5uL[/size][/font][/align][align=left][font='simsun'][size=14px]进样模式:分流进[/size][/font][font='simsun'][size=14px]样[/size][/font][font='simsun'][size=14px]分流比:[/size][/font][font='simsun'][size=14px]5[/size][/font][font='simsun'][size=14px]:[/size][/font][font='simsun'][size=14px]1[/size][/font][/align][align=left][size=14px]衬管: 分流衬管进样口温度:[/size][font='calibri'][size=13px]200 °C [/size][/font][size=14px]柱温:[/size][/align][align=left][size=14px]在[/size][font='calibri'][size=13px]100 °C [/size][/font][size=14px]下保持[/size][font='calibri'][size=13px]3[/size][/font][size=14px]分钟[/size][/align][align=left][size=14px]以[/size][font='calibri'][size=13px]15°C/min [/size][/font][size=14px]升至[/size][font='calibri'][size=13px]220 °C[/size][/font][size=14px],保持[/size][font='calibri'][size=13px]16[/size][/font][size=14px]分钟柱流速: [/size][font='calibri'][size=13px]1.46 mL/min [/size][/font][size=14px]恒流[/size][/align][align=left][font='simsun'][size=14px]载气:氦气[/size][/font][/align][align=left][/align][font='calibri'][size=18px]MS [/size][/font][size=18px]条件[/size][size=14px]传输线温度:[/size][font='calibri'][size=13px]240°C [/size][/font][size=14px]离子源温度:[/size][font='calibri'][size=13px]240°C [/size][/font][size=14px]电离能:[/size][font='calibri'][size=13px]70 eV[/size][/font][align=left][size=14px]增益:[/size][font='calibri'][size=13px]1.5 kV[/size][/font][/align][align=left][/align][align=left][font='simsun'][size=14px]结果[/size][/font][font='simsun'][size=14px]:[/size][/font][/align][align=left][font='simsun'][size=14px][color=#333333]由于甲磺酸酯类化合物极性强[/color][/size][/font][font='simsun'][size=14px],[/size][/font][font='simsun'][size=14px][color=#333333]在非极性或者弱极性的色谱柱上不能基线分离[/color][/size][/font][font='simsun'][size=14px][color=#333333]MMS[/color][/size][/font][font='simsun'][size=14px][color=#333333]和[/color][/size][/font][font='simsun'][size=14px][color=#333333]IPMS[/color][/size][/font][font='simsun'][size=14px]。该方法实现了[/size][/font][font='simsun'][size=14px]3[/size][/font][font='simsun'][size=14px]种化合物的基线分离,[/size][/font][font='simsun'][size=14px][color=#333333]见图[/color][/size][/font][font='simsun'][size=14px][color=#333333]1[/color][/size][/font][font='simsun'][size=14px]。[/size][/font][/align][align=left][font='simsun'][size=14px][color=#333333]根据国际药品注册协调会议([/color][/size][/font][font='simsun'][size=14px][color=#333333]ICH[/color][/size][/font][font='simsun'][size=14px][color=#333333])的规定进行方法验证[/color][/size][/font][font='simsun'][size=14px],[/size][/font][font='simsun'][size=14px][color=#333333]具体数据见表格 [/color][/size][/font][font='simsun'][size=14px][color=#333333]1[/color][/size][/font][font='simsun'][size=14px]。[/size][/font][/align][align=left][font='simsun'][size=14px][color=#333333]检出限和定量限分别是 [/color][/size][/font][font='simsun'][size=14px][color=#333333]3 [/color][/size][/font][font='simsun'][size=14px][color=#333333]倍信噪比[/color][/size][/font][font='simsun'][size=14px][color=#333333](S/N)[/color][/size][/font][font='simsun'][size=14px][color=#333333]和 [/color][/size][/font][font='simsun'][size=14px][color=#333333]10 [/color][/size][/font][font='simsun'][size=14px][color=#333333]倍信噪比[/color][/size][/font][font='simsun'][size=14px][color=#333333](S/N)[/color][/size][/font][font='simsun'][size=14px][color=#333333]的数值[/color][/size][/font][font='simsun'][size=14px]。[/size][/font][font='simsun'][size=14px][color=#333333]方法的精密度是同一[/color][/size][/font][font='simsun'][size=14px][color=#333333]浓度[/color][/size][/font][font='simsun'][size=14px][color=#333333]1.5ug/ml [/color][/size][/font][font='simsun'][size=14px][color=#333333]样品连续六次进样[/color][/size][/font][font='simsun'][size=14px][color=#333333](n=6)[/color][/size][/font][font='simsun'][size=14px][color=#333333]得到[/color][/size][/font][font='simsun'][size=14px]。[/size][/font][font='simsun'][size=14px][color=#333333]方法中间精密度是在同一实验室在不同的六天[/color][/size][/font][font='simsun'][size=14px], [/size][/font][font='simsun'][size=14px][color=#333333]测得同一浓度 [/color][/size][/font][font='simsun'][size=14px][color=#333333]1.5ug/ml [/color][/size][/font][font='simsun'][size=14px][color=#333333]样品得到[/color][/size][/font][font='simsun'][size=14px]。[/size][/font][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2020/11/202011101046041590_3824_3276347_3.png[/img][font='simsun'][size=14px][color=#333333]结果表明该方法具有很好的重现性和稳定性[/color][/size][/font][font='simsun'][size=14px],[/size][/font][font='simsun'][size=14px][color=#333333]成功的应用于拉米夫定中甲磺酸烷基酯类化合物的检测[/color][/size][/font][font='simsun'][size=14px]。[/size][/font][/align][align=left][/align][align=left][/align][align=left][/align][align=left][font='simsun'][size=14px]表格 [/size][/font][font='simsun'][size=14px]1 [url=https://insevent.instrument.com.cn/t/Mp]gc[/url]/MS [/size][/font][font='simsun'][size=14px]法分析 [/size][/font][font='simsun'][size=14px]MMS, EMS [/size][/font][font='simsun'][size=14px]和 [/size][/font][font='simsun'][size=14px]IPMS [/size][/font][font='simsun'][size=14px]数据验证[/size][/font][/align][table][tr][td][align=left][font='simsun'][size=14px]参数[/size][/font][font='simsun'][size=14px]MMS(m/z 110)[/size][/font][font='simsun'][size=14px]EMS (m/z 124)[/size][/font][font='simsun'][size=14px]IPMS(m/z[/size][/font][font='simsun'][size=14px] [/size][/font][font='simsun'][size=14px]137)[/size][/font][/align][/td][/tr][tr][td][align=left][font='simsun'][size=14px]检测[/size][/font][font='simsun'][size=14px]限[/size][/font][font='simsun'][size=14px](ug/mL)[/size][/font][font='simsun'][size=14px]0.5[/size][/font][font='simsun'][size=14px]0.5[/size][/font][font='simsun'][size=14px]0.5[/size][/font][/align][align=left][font='simsun'][size=14px]定量限[/size][/font][font='simsun'][size=14px] [/size][/font][font='simsun'][size=14px](ug/mL)[/size][/font][font='simsun'][size=14px]1.5[/size][/font][font='simsun'][size=14px]1.5[/size][/font][font='simsun'][size=14px]1.5[/size][/font][/align][align=left][font='simsun'][size=14px]方法[/size][/font][font='simsun'][size=14px]精[/size][/font][font='simsun'][size=14px]密度[/size][/font][font='simsun'][size=14px] [/size][/font][font='simsun'][size=14px](RSD,[/size][/font][font='simsun'][size=14px] %)[/size][/font][font='simsun'][size=14px]1.99[/size][/font][font='simsun'][size=14px]1.36[/size][/font][font='simsun'][size=14px]1.55[/size][/font][/align][align=left][font='simsun'][size=14px]方法[/size][/font][font='simsun'][size=14px]中[/size][/font][font='simsun'][size=14px]间[/size][/font][font='simsun'][size=14px]精[/size][/font][font='simsun'][size=14px]密[/size][/font][font='simsun'][size=14px]度[/size][/font][font='simsun'][size=14px](RSD,[/size][/font][font='simsun'][size=14px] [/size][/font][font='simsun'][size=14px]%)[/size][/font][font='simsun'][size=14px]2.08[/size][/font][font='simsun'][size=14px]1.58[/size][/font][font='simsun'][size=14px]1.86[/size][/font][/align][align=left][font='simsun'][size=14px]线性[/size][/font][font='simsun'][size=14px]范[/size][/font][font='simsun'][size=14px]围[/size][/font][font='simsun'][size=14px](ug/mL)[/size][/font][font='simsun'][size=14px]1.5–6.0[/size][/font][font='simsun'][size=14px]1.5–6.0[/size][/font][font='simsun'][size=14px]1.5–6.0[/size][/font][/align][align=left][font='simsun'][size=14px]线性[/size][/font][font='simsun'][size=14px]相[/size][/font][font='simsun'][size=14px]关[/size][/font][font='simsun'][size=14px]系[/size][/font][font='simsun'][size=14px]数[/size][/font][font='simsun'][size=14px]0.999[/size][/font][font='simsun'][size=14px]0.999[/size][/font][font='simsun'][size=14px]0.999[/size][/font][/align][align=left][font='simsun'][size=14px]斜率[/size][/font][font='simsun'][size=14px]60332[/size][/font][font='simsun'][size=14px]97982[/size][/font][font='simsun'][size=14px]73058[/size][/font][/align][align=left][font='simsun'][size=14px]截距[/size][/font][font='simsun'][size=14px]1524[/size][/font][font='simsun'][size=14px]28001[/size][/font][font='simsun'][size=14px]13134[/size][/font][/align][align=left][font='simsun'][size=14px]1.5ug/ml [/size][/font][font='simsun'][size=14px]样品回收率[/size][/font][font='simsun'][size=14px](%)[/size][/font][/align][align=left][font='simsun'][size=14px]1[/size][/font][font='simsun'][size=14px]102.0[/size][/font][font='simsun'][size=14px]102.4[/size][/font][font='simsun'][size=14px]95.0[/size][/font][/align][align=left][font='simsun'][size=14px]2[/size][/font][font='simsun'][size=14px]104.0[/size][/font][font='simsun'][size=14px]104.8[/size][/font][font='simsun'][size=14px]95.0[/size][/font][/align][align=left][font='simsun'][size=14px]3[/size][/font][font='simsun'][size=14px]105.3[/size][/font][font='simsun'][size=14px]106.4[/size][/font][font='simsun'][size=14px]107.1[/size][/font][/align][/td][/tr][/table]
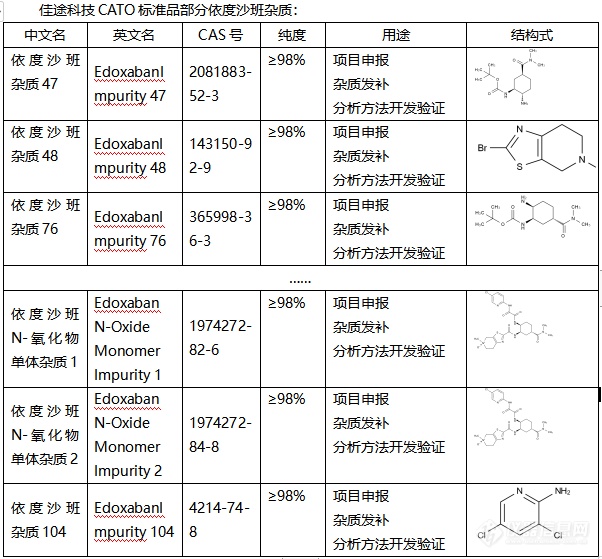
依度沙班,作为一种抗凝药物,被广泛应用于预防和治疗血栓形成。然而,与其他药物一样,依度沙班在生产过程中也可能产生杂质。这些杂质的存在可能会影响药物的安全性和有效性。为了确保依度沙班的质量,科学家们引入了CATO标准进行杂质分析。CATO标准是一种先进的分析方法,可以帮助研究人员准确地检测和衡量依度沙班中的杂质。通过对比和分析,我们可以清楚地了解杂质的种类、数量以及可能对药物产生的影响。这一标准的应用,不仅提高了依度沙班的生产质量,也为我们提供了一种有效的质量控制手段。在实际应用中,CATO标准品发挥着重要的作用。首先,它能够准确鉴定和量化依度沙班中的杂质,为药物的质量控制提供科学依据。其次,通过与标准品的比对分析,研究人员可以深入了解杂质的来源和性质,从而优化生产工艺,降低杂质的产生。此外,CATO标准品还可以用于评估杂质的毒性和风险,为药物的安全性评价提供有力支持。随着研究的深入,CATO标准在依度沙班杂质分析中的应用将不断优化和完善。通过科学的分析和严格的控制,我们能够确保依度沙班的安全性和有效性,为患者的健康提供更好的保障。同时,这也将推动药物生产的科技进步,造福更多患者。[img=,602,559]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021907159831_6894_6381568_3.png!w602x559.jpg[/img]广州佳途科技股份有限公司是一家专业的CATO标准品生产厂家,目前公司库存有全套乐伐替尼杂质,能够提供相应的系列图谱和产品COA证书,并且支持买家溯源。
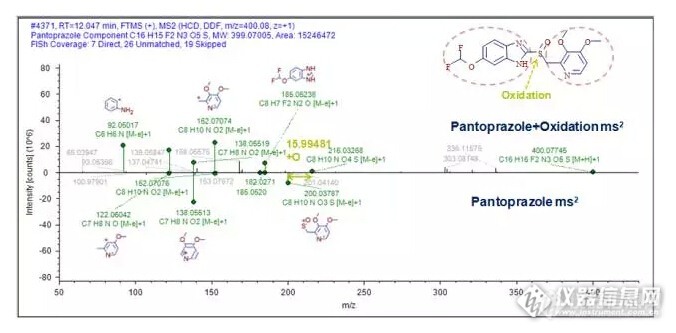
药物杂质是药物活性成分(原料药)或药物制剂中不希望存在的化学成分,会对用药的安全性和有效性带来隐患,因此杂质的检测是保证药物质量至关重要的部分,FDA、EMEA、PMDA、CFDA等各国药品监管部门制定了相应的指导原则对其进行严格管控。http://ng1.17img.cn/bbsfiles/images/2015/12/201512141737_577892_3005330_3.jpg 独有的四极杆静电场轨道阱Q Exactive™ Focus高分辨液质联用技术,凭其高灵敏度、高专属性和高准确性的分析能力,可对样品中药物杂质进行全面的信息采集。结合新一代的智能小分子化合物鉴定软件Compound Discoverer™,以高度灵活的自定义方式制定分析工作流程,对数据中的目标和非目标杂质进行提取、比对及鉴定,工作流程如下:http://ng1.17img.cn/bbsfiles/images/2015/12/201512141737_577893_3005330_3.jpg 通过软件对样品数据的分析和提取,在Compound Discoverer中可以直观、便捷的查看和筛选预期和未知的杂质分析结果,从结果界面中可获得不同条件下样品杂质的变化情况,获得所有杂质保留时间、一级质谱、同位素和二级质谱等丰富信息:http://ng1.17img.cn/bbsfiles/images/2015/12/201512141738_577894_3005330_3.jpg 在获得母药和杂质的一级和二级质谱信息后,软件将调用碎裂数据库(Fragmentation Library)快速的对泮托拉唑的碎片结构进行归属,该数据库几乎涵盖了所有已发表的文献,保证了碎片解析的准确性。在此研究结果之上,通过软件对杂质与母药二级质谱信息之间的比对,可进一步对杂质变化位点进行推测。在本例中,通过152、185等共有碎片和200、216等特征差异碎片的比对,推测出该杂质为泮托拉唑砜:http://ng1.17img.cn/bbsfiles/images/2015/12/201512141738_577895_3005330_3.jpg 基于新一代四极杆-静电场轨道阱质谱Q Exactive Focus和新一代小分子化合物分析软件Compound Discoverer,建立了药物杂质鉴定的新流程。无论是优质数据的有效获取,还是获取后对已知和未知杂质的分析鉴定,该工作流程都可以完美的实现。在本例中,共鉴定到泮托拉唑杂质15个,其中可能的降解杂质9个,可能的工艺杂质6个,为药物杂质的质量控制、安全性评估提供了富有价值的信息。(分享)
请教一下各位:药物中杂质的来源主要有哪些?什么是一般杂质?什么是特殊杂质?
[font=Calibri][font=宋体]仪器信息网于[/font]5[/font][font=Calibri][size=10.5pt][font=宋体]月[/font]22[font=宋体]日组织召开[/font][b] [size=18px][b]新药研发申报与质控专家论坛[/b][/size][/b][/size][/font][font=Calibri][size=10.5pt][font=宋体],特邀嘉宾[url=https://www.instrument.com.cn/webinar/meetings/News/expert?id=6560]龙志敏(SCIEX中国药物市场应用支持经理)[/url][/font][font=宋体],带来报告[b]《[url=https://www.instrument.com.cn/webinar/meetings/News/expert?id=6560]SCIEX [url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]技术在杂质及基因毒性杂质分析中的解决方案[/url]》[/b];[/font][/size][/font][font=宋体]欢迎感兴趣的你,报名参会![/font][b][font='Times New Roman'][color=#0563c1][url]https://www.instrument.com.cn/webinar/meetings/SCIEX522/[/url][/color][/font][/b]
杂质检查分析方法建立过程中破坏性试验的意义和存在的问题分析 正文 杂质与药品临床使用的安全性密切相关,如果药品中存在的杂质未能通过有效的方法加以检出、控制,将给临床安全造成直接或潜在的危害,因此,制订合理、有效的药品杂质检测方法控制药品中的杂质是一项非常重要的工作。杂质检测方法的建立基于方法学研究,主要包括专属性试验、检测限试验、溶液稳定性试验等内容,如果定量检测杂质还需进行线性、回收率等试验,从不同的角度、层面验证分析方法的可行,从而保证药品中的杂质能够有效地检测。破坏性试验是杂质检测方法建立时验证专属性、检测灵敏度重要试验内容之一。由于破坏性试验的实验过程复杂,分析检测技术要求高,在技术审评过程中经常发现存在研究过程中不完善、不全面,因此,在此结合化学药物创新药的审评工作体会,分析如何合理开展破坏性试验研究。 破坏性试验,也称为强制降解试验(stressing test),它是在人为设定的特殊条件下,如酸、碱、氧化、高温、光照等,引起药物的降解,通过对降解产物的测定,验证检测方法的可行性,分析药物可能的降解途径和降解机制。每项破坏性试验通常包括以下内容:酸降解一般采用0.1mol/L-1mol/L盐酸或硫酸;碱降解采用0.1mol/L-1mol/L的氢氧化钠溶液;氧化降解采用合适的过氧化氢溶液。以上三种试验,为了加快反应或者提高降解强度,必要时可以加热或提高浓度;高温试验通常温度高于加速试验温度的10℃,如50℃、60℃等,对于原料药有时需考虑水溶液或混悬液的降解,或者考虑在不同的pH值条件下的降解;光照试验条件可采用4500LX。破坏性试验的具体条件,与具体药物密切相关,需结合具体药物的特点,选择合适的条件,使药物有一定量的降解,并对可能的降解途径和降解机制进行分析,保证实验的意义。 药物经强力破坏产生的降解产物通常采用色谱法测定,需结合药物和可能降解产物的理化性质,选择不同的色谱方法(HPLC、GC、TLC)或检测器,有时可采用不同分离机理的色谱系统。下面以HPLC法分析降解产物为例,说明在进行破坏性试验时的关注点和存在的问题: 1、在选定的破坏条件下,药物应有一定量的降解。 虽然不是每一种破坏性条件都使药物产生降解产物,但一般情况下,很少有一种化合物对每一种破坏性试验条件都稳定,因此,可以通过试验,选择合适的条件,如提高酸、碱、氧化的浓度或者通过加热等,使药物降解。 对于采用HPLC法测定降解产物时,以主成分计算,一般降解10%左右。应采用有效的方法对降解产物进行检测,关注测定的回收量,通常应达到90%左右,证明检测方法的有效性。 对于破坏性试验时降解量较大的降解产物,建议结合稳定性研究中加速试验和长期试验的具体杂质数据,参考ICH对新原料药中杂质的规定(每日服用最大剂量不超过2克时,鉴定阈值为0.10%;每日服用最大剂量超过2克时,鉴定阈值为0.05%。),必要时进行定性分析,并作为已知杂质,根据安全性数据,采用已知杂质对照,确定合理的限度,订入质量标准。不能采用已知杂质进行对照时,可通过测定降解产物、主成分在测定波长处的吸收系数,分析两者的差异。若两者吸收系数相差较大时,建议采用响应因子校正后进行有效控制;如果两者吸收系数相差较小,建议采用自身对照法或峰面积归一化法进行有效控制。 药物进行破坏性试验时通常降解为小分子物质,但也有发生聚合,形成聚合物,如β-内酰胺类抗菌药物,在高温或高湿时有可能产生聚合物,故应采取有效方法进行检测。 在这方面存在的主要问题是:(1)主药完全降解,无法对降解产物进行有效检测;(2)由于选择的降解条件强度不够,使药物未能降解,而误认为药物稳定;(3)不能选择合适测定方法,测定降解产物,使主成分降解后测定的回收量偏低;(4)未考虑破坏性试验时产生的聚合物;(5)选择的色谱流动相不合适,在图谱中有干扰峰。 2、分离度与峰纯度分析 破坏性试验产生的降解产物的个数比较多,采用HPLC法测定时,需考虑主成分与降解产物之间、降解产物相互之间的分离度,保证降解产物峰与主峰、降解产物峰之间有良好的分离度。另外,对于原料药,分离度符合要求也应考虑到主药与起始原料、各合成中间体是否有良好的分离度;对于制剂,应注意辅料、辅料降解产物的干扰。色谱条件的确定通常以最难分离的两个降解产物或降解产物与主成分之间的分离度符合要求作为依据之一。鉴于降解产物检测时对分离度要求高,故推荐色谱分析时采用梯度洗脱,以有效分离降解产物。 与分离度密切相关的是峰纯度分析。检测峰纯度通常采用二级管阵列检测器或者[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]连用技术分析测定各色谱峰的纯度,说明在主峰中、各降解产物峰中有没有包含其它峰。简单地通过观察峰形判断峰的纯度没有说服力。对于创新药物的破坏性试验来说,峰纯度分析非常重要,一是可以了解降解产物的特性;二是可以有效地检出和控制杂质。存在的主要问题是:(1)主峰上出现明显的降解产物峰,测定方法不可行;(2)未对峰纯度进行有效分析,这是一种常见现象,在此情况下无法判断主峰中是否包含着降解产物峰;(3)对于制剂,未考虑辅料降解对测定结果的干扰。 3、检测灵敏度的考虑 对破坏性试验产生的降解产物,通常考虑采取改变测定波长,来分析和检测降解产物峰个数和含量,确定合理的检测条件和方法。这也是测定波长确定的重要依据之一。必要时可采用不同机理的色谱系统检测降解产物。原则上讲,所选择的杂质检测方法应能测定破坏性试验中药物的每个降解产物(而且也考虑到起始原料、每个合成中间体的检出),从而达到对降解产物的控制,同时只有这样,才能保证有合适的回收量。目前在审评中发现存在的主要问题是仅提供主成分的检测限,以主成分的检测限作为测定波长确定的依据,而忽视对部分降解产物(包括起始原料和中间体)的检出,最终体现在降解的回收量达不到一定的要求,仅有药物降解,没有降解产物检出。 充分认识破坏性试验在杂质检测方法建立中的重要意义,建立科学合理的杂质检测方法,对于保证临床用药安全起着重要作用。以上为个人观点,仅供参考。本文由提供,更多精彩请访问 http://daxs.5d6d.com谢谢您的支持!
杂质与药品临床使用的安全性密切相关,如果药品中存在的杂质未能通过有效的方法加以检出、控制,将给临床安全造成直接或潜在的危害,因此,制订合理、有效的药品杂质检测方法控制药品中的杂质是一项非常重要的工作。杂质检测方法的建立基于方法学研究,主要包括专属性试验、检测限试验、溶液稳定性试验等内容,如果定量检测杂质还需进行线性、回收率等试验,从不同的角度、层面验证分析方法的可行,从而保证药品中的杂质能够有效地检测。破坏性试验是杂质检测方法建立时验证专属性、检测灵敏度重要试验内容之一。由于破坏性试验的实验过程复杂,分析检测技术要求高,在技术审评过程中经常发现存在研究过程中不完善、不全面,因此,在此结合化学药物创新药的审评工作体会,分析如何合理开展破坏性试验研究。 破坏性试验,也称为强制降解试验(stressing test),它是在人为设定的特殊条件下,如酸、碱、氧化、高温、光照等,引起药物的降解,通过对降解产物的测定,验证检测方法的可行性,分析药物可能的降解途径和降解机制。每项破坏性试验通常包括以下内容:酸降解一般采用0.1mol/L-1mol/L盐酸或硫酸;碱降解采用0.1mol/L-1mol/L的氢氧化钠溶液;氧化降解采用合适的过氧化氢溶液。以上三种试验,为了加快反应或者提高降解强度,必要时可以加热或提高浓度;高温试验通常温度高于加速试验温度的10℃,如50℃、60℃等,对于原料药有时需考虑水溶液或混悬液的降解,或者考虑在不同的pH值条件下的降解;光照试验条件可采用4500LX。破坏性试验的具体条件,与具体药物密切相关,需结合具体药物的特点,选择合适的条件,使药物有一定量的降解,并对可能的降解途径和降解机制进行分析,保证实验的意义。 药物经强力破坏产生的降解产物通常采用色谱法测定,需结合药物和可能降解产物的理化性质,选择不同的色谱方法(HPLC、GC、TLC)或检测器,有时可采用不同分离机理的色谱系统。下面以HPLC法分析降解产物为例,说明在进行破坏性试验时的关注点和存在的问题: 1、在选定的破坏条件下,药物应有一定量的降解。 虽然不是每一种破坏性条件都使药物产生降解产物,但一般情况下,很少有一种化合物对每一种破坏性试验条件都稳定,因此,可以通过试验,选择合适的条件,如提高酸、碱、氧化的浓度或者通过加热等,使药物降解。 对于采用HPLC法测定降解产物时,以主成分计算,一般降解10%左右。应采用有效的方法对降解产物进行检测,关注测定的回收量,通常应达到90%左右,证明检测方法的有效性。 对于破坏性试验时降解量较大的降解产物,建议结合稳定性研究中加速试验和长期试验的具体杂质数据,参考ICH对新原料药中杂质的规定(每日服用最大剂量不超过2克时,鉴定阈值为0.10%;每日服用最大剂量超过2克时,鉴定阈值为0.05%。),必要时进行定性分析,并作为已知杂质,根据安全性数据,采用已知杂质对照,确定合理的限度,订入质量标准。不能采用已知杂质进行对照时,可通过测定降解产物、主成分在测定波长处的吸收系数,分析两者的差异。若两者吸收系数相差较大时,建议采用响应因子校正后进行有效控制;如果两者吸收系数相差较小,建议采用自身对照法或峰面积归一化法进行有效控制。 药物进行破坏性试验时通常降解为小分子物质,但也有发生聚合,形成聚合物,如β-内酰胺类抗菌药物,在高温或高湿时有可能产生聚合物,故应采取有效方法进行检测。 在这方面存在的主要问题是:(1)主药完全降解,无法对降解产物进行有效检测;(2)由于选择的降解条件强度不够,使药物未能降解,而误认为药物稳定;(3)不能选择合适测定方法,测定降解产物,使主成分降解后测定的回收量偏低;(4)未考虑破坏性试验时产生的聚合物;(5)选择的色谱流动相不合适,在图谱中有干扰峰。 2、分离度与峰纯度分析 破坏性试验产生的降解产物的个数比较多,采用HPLC法测定时,需考虑主成分与降解产物之间、降解产物相互之间的分离度,保证降解产物峰与主峰、降解产物峰之间有良好的分离度。另外,对于原料药,分离度符合要求也应考虑到主药与起始原料、各合成中间体是否有良好的分离度;对于制剂,应注意辅料、辅料降解产物的干扰。色谱条件的确定通常以最难分离的两个降解产物或降解产物与主成分之间的分离度符合要求作为依据之一。鉴于降解产物检测时对分离度要求高,故推荐色谱分析时采用梯度洗脱,以有效分离降解产物。 与分离度密切相关的是峰纯度分析。检测峰纯度通常采用二级管阵列检测器或者液质连用技术分析测定各色谱峰的纯度,说明在主峰中、各降解产物峰中有没有包含其它峰。简单地通过观察峰形判断峰的纯度没有说服力。对于创新药物.的破坏性试验来说,峰纯度分析非常重要,一是可以了解降解产物的特性;二是可以有效地检出和控制杂质。存在的主要问题是:(1)主峰上出现明显的降解产物峰,测定方法不可行;(2)未对峰纯度进行有效分析,这是一种常见现象,在此情况下无法判断主峰中是否包含着降解产物峰;(3)对于制剂,未考虑辅料降解对测定结果的干扰。 3、检测灵敏度的考虑 对破坏性试验产生的降解产物,通常考虑采取改变测定波长,来分析和检测降解产物峰个数和含量,确定合理的检测条件和方法。这也是测定波长确定的重要依据之一。必要时可采用不同机理的色谱系统检测降解产物。原则上讲,所选择的杂质检测方法应能测定破坏性试验中药物的每个降解产物(而且也考虑到起始原料、每个合成中间体的检出),从而达到对降解产物的控制,同时只有这样,才能保证有合适的回收量。目前在审评中发现存在的主要问题是仅提供主成分的检测限,以主成分的检测限作为测定波长确定的依据,而忽视对部分降解产物(包括起始原料和中间体)的检出,最终体现在降解的回收量达不到一定的要求,仅有药物降解,没有降解产物检出。 充分认识破坏性试验在杂质检测方法建立中的重要意义,建立科学合理的杂质检测方法,对于保证临床用药安全起着重要作用。以上为个人观点,仅供参考。
药物基因组学检测是什么
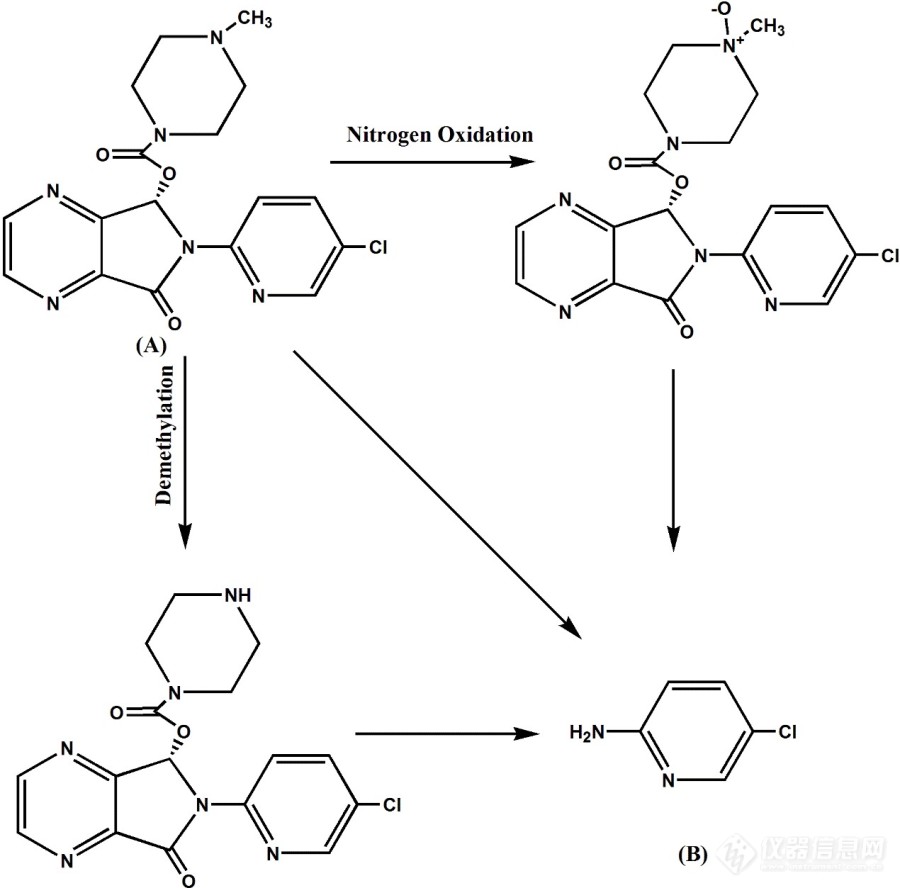
[align=center][b][font=宋体][size=14px]具有基因毒性的药物所共有的结构[/size][/font][/b][/align][align=left][font=宋体]在制药工业中,原料药生产过程中会产生各种不良副产品或化合物。研究表明,在这些有害杂质中(由于降解或合成而产生),其中一些可能在体内和体外的遗传毒性试验中具有潜在的遗传毒性作用,并且它们具有与[/font][font='Times New Roman',serif]DNA[/font][font=宋体]相互作用并导致[/font][font='Times New Roman',serif]DNA[/font][font=宋体]损伤的能力。这些化合物也被称为潜在遗传毒性杂质,能够诱导染色体断裂、基因突变和染色体重排,从而对人类有潜在的致癌作用。因此,任何微量的接触这些类型的有害化合物(杂质)存在于原料药中都可能是相当大的毒理学问题。近年来,对原料药中这些遗传毒性杂质的敏感性分析引起了药学、化学、生物学等不同学科的研究者的极大兴趣,并报道了各种各样的指南。[/font][/align][align=left][/align][font='Times New Roman',serif][/font][align=left][font='Times New Roman',serif]Viracept[/font][font=宋体]事故可以作为一个很好的例子来说明遗传毒性杂质在药物化合物中的重要性。瑞士罗氏制药公司是该地区最大的制药公司之一,[/font][font='Times New Roman',serif]2007[/font][font=宋体]年生产了一种名为[/font][font='Times New Roman',serif]Viracept[/font][font=宋体]的治疗艾滋病的新产品。但研究人员意识到,由于作为起始原料的甲基磺酸与生产罐中残留溶剂乙醇之间的不良反应,在产品中形成了过量的甲磺酸乙酯。在最终产品中检测出[/font][font='Times New Roman',serif]GTI[/font][font=宋体]甲磺酸乙酯后,所有产品均在全球召回。因此,对于过程研究人员来说,探索在[/font][font='Times New Roman',serif]api[/font][font=宋体]合成过程中避免这些遗传毒性杂质的生成和暴露的替代方法非常重要。如果这些遗传毒性杂质仍然存在于最终的[/font][font='Times New Roman',serif]api[/font][font=宋体]中,则需要将其减少到可接受的数量。这种降低可以通过在原料药合成后应用一个或多个纯化阶段来实现。今天,没有任何完整的遗传毒性杂质化合物。而不是使用[/font][font='Times New Roman',serif]“[/font][font=宋体]结构警报功能[/font][font='Times New Roman',serif]”[/font][font=宋体]列表。文献中发表了大量结构上非常关键的警示功能群(表[/font][font='Times New Roman',serif]1[/font][font=宋体])。[/font][/align][align=left][/align][align=center][font=宋体][size=14px][color=black]表[/color][/size][/font][font='Times New Roman',serif][size=14px][color=black]1[/color][/size][/font][font=宋体][size=14px][color=black]不同结构警报功能组。[/color][/size][/font][/align][img=,551,190]https://ng1.17img.cn/bbsfiles/images/2020/07/202007262105147531_1112_3255306_3.png!w551x190.jpg[/img][img=,556,513]https://ng1.17img.cn/bbsfiles/images/2020/07/202007262105141105_62_3255306_3.png!w556x513.jpg[/img][font=宋体][size=14px][color=black]图例:[/color][/size][/font][font='Times New Roman',serif][size=14px][color=black]A=[/color][/size][/font][font=宋体][size=14px][color=black]烷基、芳基或[/color][/size][/font][font='Times New Roman',serif][size=14px][color=black]H/[/color][/size][/font][font=宋体][size=14px][color=black]卤素[/color][/size][/font][font='Times New Roman',serif][size=14px][color=black]=F[/color][/size][/font][font=宋体][size=14px][color=black],[/color][/size][/font][font='Times New Roman',serif][size=14px][color=black]Cl[/color][/size][/font][font=宋体][size=14px][color=black],[/color][/size][/font][font='Times New Roman',serif][size=14px][color=black]Br[/color][/size][/font][font=宋体][size=14px][color=black],[/color][/size][/font][font='Times New Roman',serif][size=14px][color=black]I/EWG=[/color][/size][/font][font=宋体][size=14px][color=black]吸电子基团[/color][/size][/font][font=宋体][size=14px][color=black]([/color][/size][/font][font='Times New Roman',serif][size=14px][color=black]CN[/color][/size][/font][font=宋体][size=14px][color=black],[/color][/size][/font][font='Times New Roman',serif][size=14px][color=black]C=O[/color][/size][/font][font=宋体][size=14px][color=black],酯等)[/color][/size][/font][font='Times New Roman',serif] [/font][align=left][font=宋体]另一方面,氨基吡啶被广泛用作原料药生产的起始化合物,并被认为是可能存在于最终产品中的遗传毒性杂质。例如,[/font][font='Times New Roman',serif]2-[/font][font=宋体]氨基吡啶是合成吡罗昔康的起始化合物,可在产品中发现作为遗传毒性杂质。文献中报道了利用[/font][font='Times New Roman',serif]HPLC-UV[/font][font=宋体]、[/font][font='Times New Roman',serif][url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url][/font][font=宋体]和[/font][font='Times New Roman',serif]GC-MS[/font][font=宋体]分析遗传毒性杂质的各种研究。[/font][/align][align=left][/align][font=宋体][/font][align=left]氨基吡啶是原料药合成中常用的起始化合物,是一种潜在的遗传毒性杂质,目前在药物中的含量是微量的。我们对右佐匹克隆进行了研究,因为它的降解产物就是氨基吡啶。下图是其降解及转化过程。[/align][align=left][img=,690,680]https://ng1.17img.cn/bbsfiles/images/2020/07/202007262105462372_9189_3255306_3.jpg!w690x680.jpg[/img][/align][font='Times New Roman',serif][/font][align=left] [/align][align=left][/align][font=宋体][/font][align=left][font=宋体]针对此基因毒性杂质的研究,我们发表了英文[/font][font='Times New Roman',serif]SCI[/font][font=宋体]文章在[/font][font='Times New Roman',serif]Journal of pharmacutical and biomedical analysis[/font][font=宋体]杂志,感兴趣的老师可以根据[/font][font='Times New Roman',serif]doi[/font][font=宋体]下载。[/font][font='Times New Roman',serif]https://doi.org/10.1016/j.jpba.2020.113363[/font][/align][font='Times New Roman',serif] [/font]
药物基因组学是上世纪九十年代末发展起来,基于药理学和基因组学,将传统的药物科学与基因、蛋白、单核苷酸多态性等知识结合起来的一门科学。正因为药物基因组学是研究基因序列变异及其对药物不同反应的科学,所以它是研究高效、特效药物的重要途径,通过它为患者或者特定人群寻找合适的药物,药物基因组学强调个体化;因人制宜,有重要的理论意义和广阔的应用前景。一、促进新药研发 由于药物基因组学规模大、手段强、系统性强,开辟了医药工业研究的新领域,可以直接加速新药的发现。首先药品制造商不仅把注意力放在可能引起疾病的基因上,而且对药物效应基因产生了兴趣,这些药物效应基因为新药研究提供依据。由于新一代遗传标记物的大规模发现,以及将其迅速应用于群体,流行病遗传学也可以大大推进多基因遗传病和常见病机理的基础研究。还可以帮助制药厂商在一些与基因和疾病相关的蛋白质、酶和RNA分子等基础上开发新药,这样不仅促进了药物的发现,还有利于开发出针对某一特定疾病的药物,从而增强疗效,并减少对健康细胞的损伤。对于每一个药物来说大约都有10-40%的人没有疗效,又百分之几的或更多的人有副作用。如果制药公司利用药物基因组学理论可以实现预见结果或筛选人群的话,可以大大增加新药的通过率,也可以对未通过药检的新药重新估价,这些药物中一个经常引用的例子是第一个非典型性抗精神活性药氯氮平(clozapine),在氯氮平的使用过程中,由于1%的病人服药后出现严重的粒细胞缺乏症,因而只有当其它药物使用后无效才使用。但是在粒细胞缺乏症的药物效应基因被确定后,极大地改善了氯氮平的使用,除极少数敏感的病人不能服用此药外,对于99%的病人来说,这一药物是一线治疗药物。在新药的临床试验研究中,如果事先知道人群可能对药物反应的话,如代谢酶的基因型,可以减少参试人群,试验的时间表也可以大大缩短。对药物有效或毒性变异的预测试验中,可用于筛选病人。经过药物效应基因突变筛选的受试者,可以加强临床试验的统计学意义,可以用更少的病例数达到所需的统计学意义,这样可以大大节约时间和费用。 二、用药个体化合理用药的核心是个体化用药。药物基因组学通过对患者的基因检测,如对一些疾病相关基因的单核苷酸多态性(SNP)检测,进而对特定药物具敏感性或抵抗性的患病人群的SNP差异检测,指导临床开出适合每个个体的“基因处方”,使患者既能获得最佳治疗效果,又能避免药物不良反应,真正达到“用药个体化”的目的。 医生在疾病的首次治疗过程中,往往需要临床实验来确定适合病人的药物,而药物基因组学则可以通过分析病人的遗传组成来确定最合理的治疗药物。这样就免去了先期用于药物选择的临床过程及由此带来的可能的副作用,并缩短了病热的康复期。更准确的用药剂量 通过基因组分析可以判断药物在体内的作用效果及代谢时间,并以此来确定不同个体的用药剂量,对比依据体重和年龄的方法,其具有更好的治疗效果,降低了过量服药的可能性。一些临床上经常出现的现象,例如两患者诊断相同、一般症状相同、血药浓度相同,但疗效却大相径庭,这些用传统的药代动力学原理是无法解释的。这时应考虑到与药物作用相关的位点(如受体等)是否发生了变异?是什么水平的变异?药物作用的位点的变异可能发生在基因水平,也可能发生在转录、翻译等水平,基因水平的变异相对比较容易鉴定,研究也表明基因的变异与药物效应的差异是更具相关性。研究基因突变与药效关系的药物基因组学正是适应了这一要求,因此药物基因组学在临床合理用药中的应用前景是非常之好的。将基因功能学用于合理用药,利用药物基因组学的技术和方法增加药物的有效性和安全性,减少不良反应,实现个体化、可预测及可预防的医疗,这就称之为临床药物基因组学。药物基因组学应用到合理用药中,弥补了只根据血药浓度进行个体化给药的不足,惟以前无法解释的药效学现象找到了答案,为临床个体化给药开辟了一个新的途径。这样药物基因组学原理为特定人群设计最为有效的药物,不仅提高了药效,缩短了病程,而且减少了毒副反应和成本,真正达到了“物美价廉”的要求。目前,已经有人将药物基因组学知识应用于高血压、哮喘、高血脂、内分泌、肿瘤等的药物治疗中。如原发性高血压是多因素诱发的疾病,对于许多患者,高血压药物的不同药效和耐受性与遗传变异有关。Ferrari发现,一种细胞骨骼蛋白(cytoskeletalprotein)、内收蛋白(adducin)的基因多态性与高血压的发病、对钠敏感性以及对利尿剂的效果相关。因此在抗高血压治疗需要用利尿剂时,可以对患者预先进行基因检测,以确定是否选择使用此药。通过对β2肾上腺素受体的基因多态性及其对β2肾上腺素受体激动剂的敏感性关系的研究,发现β2肾上腺素受体的基因多态性影响β2肾上腺素受体激动剂福莫特罗(formoterol)的脱敏效果,β2肾上腺素受体激动剂改善肺通气的作用对Gly纯合子个体明显比Arg纯合子个体要强,杂合子个体介于两者之间。 载脂蛋白E(APOE)的基因多态性,影响绝经后妇女用雌激素替代疗法(ERT)时的血脂和脂蛋白的浓度。人群中的APOE有3个等位基因:E2、E3、E4,ERT能使具有E2型基因的妇女血中总胆固醇含量大大高于E3、E4型。提示医生在绝经期妇女中使用ERT时,可事先检测患者的APOE基因,对具有E2型基因的妇女在治疗过程中密切监测甘油三酯浓度。如此,通过对不同个体的药物代谢相关酶、转运因子、药物作用靶点的基因多态性的研究,对突变的等位基因进行分离和克隆,在分子诊断水平上建立以聚合酶链反应(PCR)为基础的基因型分析方法,在治疗患者各种疾病前检测其基因型,更精确地选择适当的治疗药物和合适的剂量以减少不良反应的发生,对患者的治疗具有很大的意义。 随着基因分析技术的飞速发展,越来越多的药物效应的个体差异与基因多态性的关系被阐明,药物基因组学将更广泛地指导和优化临床用药。
基因芯片技术对于疾病耐药性检测可从两个方面加以实现:1.在肿瘤中,通过检测肿瘤耐药基因的表达变化来分析对药物的抗性;2.在感染性疾病中,病原体的耐药性检测可通两种方式:表达谱芯片检测药物诱导的表达改变来分析其耐药性;寡核苷酸芯片检测基因组序列的亚型或突变位点从而分析其耐药性。一、多药耐药基因的表达检测肿瘤治疗中对细胞毒素药物的抗性是引起治疗失败的重要原因,是限制化疗的重要因素。机制是复杂的,由肿瘤的综合特征决定,如存活细胞的比例、血液的供给是否充分、特殊的细胞机制及多药耐药表型,多药耐药是指当肿瘤细胞暴露在某一化学治疗药物后会产生对此药及其他结构上没有联系的药物的交叉抗性,可由不同的机制引起,如MDR1、MRP、LRP等基因的过度表达,拓扑异构酶II和谷胱甘肽代谢的改变等,另外,其他促进DNA修复和抑制细胞凋亡的基因表达改变也可能导致多药耐药。检测多药耐药基因表达的变化不但可以研究恶性肿瘤的不同耐药机制,还可以用于临床诊断,以指导制定治疗方案。目前已建立了几种多药耐药检测方法,在RNA水平上有:Northern blot、Slot blot、RT-PCR、Rnase protection assay和原位杂交,从蛋白水平上的检测方法有免疫组化、Western blot及流式细胞仪等。这些方法一次只能对一个基因进行研究,效率低,难以定量检测耐药基因表达增加的幅度。基因表达谱芯片可同时对成千上万的基因表达进行检测,可以大大加速这方面的研究,在设计芯片时,可以将已知肿瘤相关基因及标记基因都点到芯片上,同时,芯片上还包含目前所有报导过的耐药基因。这样可以同时得到肿瘤的各个方面的信息。另外基因芯片还可以帮助发现新的耐药基因。二、病原体耐药性检测细菌对三种以上不同类抗菌药物耐药者即可称为多重耐药菌(multi-drug resistant bacteria, MDR)。MDR感染在全球的状况十分严重,对婴幼儿、免疫缺陷者和老年人的威胁巨大,1992年美国疾病控制中心(CDC)的资料表明,有13300例住院患者,是因为对所使用的抗菌药物耐药,细菌感染得不到控制而死亡。MDR感染已成为治疗上的难点和研究上的热点。MDR大多为条件致病菌,革兰阴性杆菌(GNR)占较大比例,如肠杆菌科中的肺炎杆菌、大肠杆菌、阴沟杆菌、粘质沙雷菌、枸橼酸菌属、志贺菌属、沙门菌属等,以及绿脓杆菌、不动杆菌属、流感杆菌等。革兰阳性菌中有甲氧西林耐药葡萄球菌(MRS),尤以MRSA和MRSE为多;万古霉素耐药肠球菌(VRE),近年来在重症监护室(ICU)中的发病率有明显增高;青霉素耐药肺炎链球菌(PRSP),常引起肺炎、脑膜炎、菌血症和中耳炎,人结核分支菌等。此外尚有淋球菌、脑膜炎球菌、霍乱弧菌等。耐药性又称抗药性,一般是指病原体的药物反应性降低的一种状态。这是由于长期应用抗菌药,病原体通过产生使药物失活的酶、改变原有代谢过程,而产生的一种使药物效果降低的反应,因而作用的剂量要不断增加。细菌对抗菌药物的耐药机制可有多种,最重要者为灭活酶的产生,如β-内酰胺酶、氨基糖苷钝化酶等;其次为靶位改变如青霉素结合蛋白(PBPs)的改变等;其他尚有胞膜通透性改变,影响药物的进入;细菌泵出系统增多、增强,以排出已进入细菌内的药物;以及胞膜主动转运减少、建立新代谢途径、增加拮抗药物等,两种以上的机制常可同时启动。耐药菌及MDR的发生和发展是抗菌药物广泛应用,特别是无指征滥用的后果。找到耐药菌的耐药基因,从而根据这些耐药基因设计新型抗生素,或将耐药菌分成不同的亚型,针对不同的亚型在临床上使用相应的抗生素,达到改善治疗效果的目的。国外采用基因芯片技术,检测耐药菌基因的改变,即检测耐药基因。如Michael Wilson就曾使用此方法检测到肺结核杆菌中脂肪酸合成酶II、fbpC、efpA、fadE23、fadE24和ahpC基因发生改变与耐药性有关。提供了新药物作用的靶目标,并指导抑制这些靶目标试剂和药物的合成。在感染性疾病中,病原体的耐药性检测可通过两种方式:1.表达谱芯片检测药物诱导的基因表达改变来分析其耐药性;2.寡核苷酸芯片检测基因组序列的亚型或突变位点从而分析其耐药性。用基因芯片不仅可以同时检测耐药菌的多个耐药基因,还可以同时对多个耐药菌的多个耐药基因进行检测。对临床上用药和新药物的合成均具有指导作用。
水中药物浓度的检测是水质监测和水处理过程中的重要环节,它对于确保水质安全、评估药物污染程度以及制定相应的应对措施具有重要意义 光谱法原理:基于溶液中分子发生吸收或发射光谱来确定浓度。常用的有紫外-可见吸收光谱法和荧光光谱法等。优点:测量结果精度高,适用于多种药物的检测。缺点:需要一定的仪器设备和专业操作人员,不适合现场快速检测。色谱法原理:利用不同物质在色谱柱中的分配系数差异进行分离,并通过检测器进行定量分析。常用的有气相色谱-质谱联用(GC-MS)和液相色谱(HPLC)等。优点:定性准确、灵敏度高、多组分同时检测能力强。缺点:设备昂贵,操作复杂,需要专业人员操作。滴定法原理:通过在一定条件下,用标准溶液逐滴加入样品中进行化学反应,直到反应达到终点(即指示剂颜色发生变化),从而确定样品的浓度。优点:精度高,对样品要求不高。缺点:操作较为繁琐,需要严格控制实验条件并选择合适的化学试剂。比色法原理:利用药物与特定试剂反应生成有色化合物的颜色深浅与药物浓度成正比的关系进行测定。优点:操作相对简单,适用于现场检测。缺点:可能会受到其他物质的干扰,需要消除干扰物质的影响。试纸法原理:通过试纸与待测液反应后颜色变化与标准色卡对比来确定药物浓度。优点:操作简便快捷,适用于现场快速检测。缺点:精度相对较低,试纸的保存和使用条件对结果有一定影响。案例:离子色谱仪测定自来水中草甘膦浓度 为了评估自来水中草甘膦(一种广泛使用的除草剂)的污染情况,研究机构采用离子色谱仪对自来水样品进行了检测。 检测方法: 仪器与条件 仪器与条件:仪器:IC6600系列离子色谱仪,配备电导检测器、阴离子抑制器等。色谱柱:诺谱HS-5A-P3(4mm×250mm);保护柱:诺谱HS-5AG(50mm×4mm)。柱温:30℃;流速:1.0ml/min;进样量:100μL。样品处理:采集自来水样品,加入抗坏血酸除去余氯的影响,过0.45μm水系滤膜进样。标准溶液配制:精确移取草甘膦标准溶液,用超纯水定容至不同浓度,配制成系列标准工作溶液。检测与分析:将样品和标准溶液分别注入离子色谱仪进行分析,记录色谱图和峰面积。根据标准曲线计算样品中草甘膦的浓度。检测结果: 通过检测发现,自来水中草甘膦的浓度低于国家饮用水标准限值,表明该区域自来水水质良好,未受到草甘膦的显著污染。

[font=&] 药物杂质是指无治疗作用或影响药物的稳定性以及疗效的物质。由于杂质检测和含量控制对药品质量控制以及安全用药密切相关,国家药品监督管理局(National Medical Products Administration, NMPA)对药物临床前研究中的杂质分析越来越重视。[/font][font=&] 化药中的杂质可分为有机杂质、无机杂质、残留溶剂。对于新药制剂来说:有活性组分的降解产物、活性组分与赋形剂和(或)内包装/密封系统的反应产物、遗传毒性杂质以及药包材杂质。关于杂质的分析方法,对于有机杂质的分析(起始物、副产物、中间体、降解产物等),使用色谱法分析居多;对于无机杂质(重金属,无机盐等),通常采用ICP/AA/[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICPMS[/color][/url]等仪器分析;对于残留溶剂杂质,则以GC分析为主。[/font][font=&] 贯穿于药品研发的整个过程的理念就是保证安全。选择合适的分析方法,准确地测定杂质的含量,综合毒理及临床研究的结果可以更好地研究药物杂质。基于此,[/font][b][color=#ff0000]仪器信息网[/color][/b][font=&]与[/font][b][color=#ff0000]天津市分析测试协会[/color][/b][font=&]拟于[/font][b][color=#ff0000]2021年7月27日[/color][/b][font=&]联合举办“[/font][font=&][color=#ff0000]化学药物杂质研究及检测技术[/color][/font][font=&]”主题网络研讨会,旨在关注药物安全和药物杂质分析检测,为广大药学工作者和检测人员提供交流的空间。[/font][url=https://insevent.instrument.com.cn/t/Kk][img=,690,483]https://ng1.17img.cn/bbsfiles/images/2021/07/202107231635032683_3933_2507958_3.png!w690x483.jpg[/img][/url][b][size=18px][color=#ff0000][url=https://insevent.instrument.com.cn/t/Kk]点击参会:https://insevent.instrument.com.cn/t/Kk[/url][/color][/size][/b]
急!急!急!新手请教各位大侠,LC/MS/MS能进行药物杂质限度检查吗?如何确定一药物中某杂质是否超出限度?
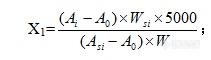
[align=center]奥美拉唑成品中杂质的质量检测[/align][align=center][b]摘要:目的:[/b]在对奥美拉唑原料药中引入的基因毒性杂质,即4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺设定质量检测方法,并进行方法验证。同时,对合成工艺中引入的残留溶剂进行质量检测,确保奥美拉唑成品的质量安全。[b]方法:[/b]在对4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺进行质量检测中,采用液相色谱的方法,并对其进行限度验证;而对残留溶剂采用[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url],利用内标法进行质量检测。[b]结果:[/b]本研究对两种基因毒性杂质及残留溶剂的检测是可行有效的,有利于对奥美拉唑原料药的质量监控,同时为后续对奥美拉唑质量标准的制定提供理论依据。[b]关键词:[/b]奥美拉唑;质量标准;毒性杂质;残留溶剂[/align][b]Abstract Objective[/b]: Themass detection is set in the introduction of genotoxic impurities into theomeprazole APIproducts, namely 4-methoxy-2-nitroaniline and4-methoxy-o-phenylenediamine, and the method was verified.At the same time, the quality of theresidual solvent introduced in the synthesis process is checked to ensure thequality and safety of the omeprazole.[b]Methods:[/b]In the mass detection of4-methoxy-2-nitroaniline and 4-methoxy-o-phenylenediamine, the method of liquidchromatography is used, and the limit is verified the residual solvent aretested by the gas chromatogram and internal standard method for quality.[b]Results:[/b]This study is feasible and effective for the detection of twogenotoxic impurities and residual solvents, which is the benefit of qualitymonitoring of omeprazole APIproducts, and provides a theoretical basis forthe subsequent development of omeprazole quality standards.[b]Keywords:[/b] Omeprazole Quality standard Genotoxicimpurities Residual solvents随着人们平时工作、学习等压力的不断增加,导致消化类疾病患病率不断上升,而在中国,发病率已达到20%左右[sup][/sup]。用于治疗消化类疾病的药物也逐步成为生活中的常用药,其发展市场也在不断扩大。在消化系统溃疡类疾病的临床治疗中,质子泵抑制剂类药物因其具有良好的治疗效果,市场销售份额高达58%[sup][/sup]。而奥美拉唑是质子泵抑制剂类的代表药物,通过抑制胃酸分泌,用于治疗胃溃疡、十二指肠溃疡等疾病。但长期服用奥美拉唑存在着潜在风险,可能会引起心脏类疾病等。且其生产过程引入的有机杂质、基因毒性杂质、无机杂质或残留的有机溶剂等均对人体健康有一定危害。因此,建立奥美拉唑引入杂质或残留有机溶剂的质量检测方法是十分有必要的,严格控制质量标准,把控药品市场质量安全。[b]1 仪器与材料1.1 实验仪器[/b]高效液相色谱仪(THERMO SCIENYIFIC, Mltimate3000);电子天平(METTLER-TOLEDO、BP-210S) [url=https://insevent.instrument.com.cn/t/Mp]气相色谱仪[/url](Agilent 6890N)顶空进样器(Agilent 7694E)[b] 1.2 实验试剂[/b][align=center][b]表1-1 实验所需试剂[/b][/align] [table][tr][td=2,1] [align=center][b]实验试剂[/b][/align] [/td][td] [align=center][b]厂家[/b][/align] [/td][/tr][tr][td=2,1] [align=center]磷酸二氢钾[/align] [/td][td] [align=center]莱阳经济技术开发区精细化工厂[/align] [/td][/tr][tr][td=2,1] [align=center]氢氧化钾[/align] [/td][td] [align=center]国药集团[/align] [/td][/tr][tr][td=2,1] [align=center]乙腈[/align] [/td][td] [align=center]Fisher Scientific[/align] [/td][/tr][tr][td=2,1] [align=center]4-甲氧基-2-硝基苯胺[/align] [/td][td] [align=center]北京百灵威科技有限公司[/align] [/td][/tr][tr][td=2,1] [align=center]4-甲氧基-邻苯二胺[/align] [/td][td] [align=center]Alfa Aesar[/align] [/td][/tr][tr][td=2,1] [align=center]奥美拉唑[/align] [/td][td] [align=center]寿光富康制药有限公司[/align] [/td][/tr][tr][td=1,6] [align=center]分析纯[/align] [/td][td] [align=center]丙酮[/align] [/td][td] [align=center]西陇化工股份有限公司[/align] [/td][/tr][tr][td] [align=center]甲醇[/align] [/td][td] [align=center]Fisher Scientific[/align] [/td][/tr][tr][td] [align=center]苯[/align] [/td][td] [align=center]天津富宇化工有限公司[/align] [/td][/tr][tr][td] [align=center]甲苯[/align] [/td][td] [align=center]莱阳经济技术开发区精细化工厂[/align] [/td][/tr][tr][td] [align=center]二氯甲烷[/align] [/td][td] [align=center]天津科密欧化学试剂有限公司[/align] [/td][/tr][tr][td] [align=center]DMA[/align] [/td][td] [align=center]Sigma-Aldrich[/align] [/td][/tr][/table][b]2 基因毒性杂质的检验方法的设定及方法学验证[/b]来源于起始物料苯并咪唑的合成路线的基因毒性杂质[sup][/sup]不适用于药典各论方法检测此类物质,在药典规定的波长无吸收。因此,采用液相色谱方法,对奥美拉唑成品中的4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺进行限度检测和控制。[b]2.1色谱条件[/b]色谱柱:ODS-3,5μm,4.6×250mm;检测波长分别设定为4-甲氧基-2-硝基苯胺(230nm)及4-甲氧基-邻苯二胺(210nm);流速为1.0ml/min;进样量为80μl;柱温为30℃。[b]2.2 溶液配制[/b]1) 流动相:溶解6.8g的磷酸二氢钾用纯化水溶解并稀释至1000ml,用氢氧化钾调节pH至6.5,和乙腈按(73:27)混合。2) 对照溶液:取4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺各16mg,精密称定置于200ml容量瓶中,用流动相溶解并稀释至刻度,准确量取1ml此溶液用流动相稀释至100ml,再量取1ml用流动相稀释至50ml。3) 奥美拉唑供试液:称取奥美拉唑样品100mg,精密称定置于50ml容量瓶中,用流动相溶解并稀释至刻度。注:计算奥美拉唑中的4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺含量都不得超过8ppm。[b]2.3质量检测方法验证[/b]通过限度验证,即该方法的专属性、系统适应性、检测限以及样品测定,是否符合验证可接受的标准,来判断该方法是否符合标准,可用于杂质测定。[b]2.3.1 专属性[/b]1) 溶液配制定性溶液:取4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺各16mg,精密称定置于200ml容量瓶中,用配制完毕的流动相溶解并稀释至刻度,准确量取1ml此溶液用流动相稀释至100ml,再稀释1ml用流动相稀释至50ml。2) 测定取流动相作为空白、定性溶液进样,记录色谱图,数据和结果。3) 数据与结果[align=center][b]表2-1专属性测试数据和结果[/b][/align] [table][tr][td] [align=center][b]项目[/b][/align] [/td][td] [align=center][b]4-甲氧基-2-硝基苯胺峰面积(230nm)[/b][/align] [/td][td] [align=center][b]4-甲氧基-邻苯二胺峰面积(210nm)[/b][/align] [/td][/tr][tr][td] [align=center]空白[/align] [align=center]溶液[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][tr][td] [align=center]定性[/align] [align=center]溶液[/align] [/td][td] [align=center]8550[/align] [/td][td] [align=center]12258[/align] [/td][/tr][/table][align=center][b]表2-2信噪比测试数据和结果[/b][/align] [table=100%][tr][td] [align=center][b]杂质[/b][/align] [/td][td] [align=center][b]信噪比[/b][/align] [/td][/tr][tr][td] [align=center]4-甲氧基-2-硝基苯胺峰面积(230nm)[/align] [/td][td] [align=center]0[/align] [/td][/tr][tr][td] [align=center]4-甲氧基-邻苯二胺峰面积(210nm)[/align] [/td][td] [align=center]0[/align] [/td][/tr][/table][b]2.3.2系统适用性试验[/b]1) 溶液制备贮备液:取4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺各16mg,精密称定置于200ml容量瓶中,用流动相溶解并稀释至刻度,准确量取1ml此溶液用流动相稀释至100ml。杂质溶液:用流动相稀释1ml贮备液到50ml或用专属性定性溶液及图谱。分离度:称取埃索美拉唑镁或奥美拉唑镁样品100mg,精密称定置于50ml容量瓶中,用流动相溶解后准确加入1ml贮备液并用流动相稀释至刻度。2) 测定以方法规定的色谱条件,取杂质溶液、分离度溶液分别进样,记录色谱图,数据和结果。3) 数据与结果[align=center][b]表2-3 系统适用性性测试结果[/b][/align] [table=562][tr][td] [align=center][b]溶液[/b][/align] [align=center][b]名称[/b][/align] [/td][td] [align=center][b]峰面积1[/b][/align] [/td][td] [align=center][b]峰面积2[/b][/align] [/td][td] [align=center][b]峰面积3[/b][/align] [/td][td] [align=center][b]峰面积4[/b][/align] [/td][td] [align=center][b]峰面积5[/b][/align] [/td][td] [align=center][b]峰面积6[/b][/align] [/td][td] [align=center][b]峰面积平均值[/b][/align] [/td][td] [align=center][b]RSD[/b][/align] [/td][/tr][tr][td] [align=center]4-甲氧基-2-硝基苯胺峰面积(230nm)[/align] [/td][td] [align=center]8427[/align] [/td][td] [align=center]8425[/align] [/td][td] [align=center]8481[/align] [/td][td] [align=center]8533[/align] [/td][td] [align=center]8483[/align] [/td][td] [align=center]8460[/align] [/td][td] [align=center]8468.17[/align] [/td][td] [align=center]0.48%[/align] [/td][/tr][tr][td] [align=center]4-甲氧基-邻苯二胺峰面积(210nm)[/align] [/td][td] [align=center]11701[/align] [/td][td] [align=center]11539[/align] [/td][td] [align=center]11086[/align] [/td][td] [align=center]11043[/align] [/td][td] [align=center]10548[/align] [/td][td] [align=center]10679[/align] [/td][td] [align=center]11099.33[/align] [/td][td] [align=center]4.11%[/align] [/td][/tr][/table][align=center][b]表2-4 奥美拉唑和4-甲氧基-邻苯二胺分离度测试结果[/b][/align] [table=100%][tr][td] [align=center][b]名称[/b][/align] [/td][td] [align=center][b]保留时间[/b][/align] [/td][td] [align=center][b]分离度[/b][/align] [/td][/tr][tr][td] [align=center]相邻杂质峰[/align] [/td][td] [align=center]3.813[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]4-甲氧基-邻苯二胺峰面积(210nm)[/align] [/td][td] [align=center]4.736[/align] [/td][td] [align=center]2.16[/align] [/td][/tr][tr][td] [align=center]相邻杂质峰[/align] [/td][td] [align=center]5.248[/align] [/td][td] [align=center]1.69[/align] [/td][/tr][/table][align=center][b]表 2-5奥美拉唑和4-甲氧基-2-硝基苯胺分离度测试结果[/b][/align] [table=100%][tr][td] [align=center][b]名称[/b][/align] [/td][td] [align=center][b]保留时间[/b][/align] [/td][td] [align=center][b]分离度[/b][/align] [/td][/tr][tr][td] [align=center]相邻杂质峰[/align] [/td][td] [align=center]23.168[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]4-甲氧基-2-硝基苯胺峰面积(230nm)[/align] [/td][td] [align=center]26.908[/align] [/td][td] [align=center]3.32[/align] [/td][/tr][tr][td] [align=center]相邻杂质峰[/align] [/td][td] [align=center]29.467[/align] [/td][td] [align=center]2.85[/align] [/td][/tr][/table][b]2.3.3检测限[/b]1) 溶液制备按照选择项下贮备溶液的配制方法配制溶液,并将标准溶液逐步稀释,得到适当浓度的溶液。2) 测定在色谱条件下,取溶液进样,记录色谱图。当待测组分的信噪比大于2时,对应的浓度为该组分的最小检测浓度。3) 数据与结果4-甲氧基-2-硝基苯胺检测限0.00256 μg/ml,LOD=1.28ppm,S/N=2.22 4-甲氧基-邻苯二胺检测限0.00256μg/ml,LOD=0.000128,S/N=2.[b]2.3.4样品检测[/b]1) 溶液配制根据已设定检测方法已将溶液配制完毕。2) 测定分别取三批样品按照溶液的配制方法,配制供试液进样,记录色谱图。3) 数据与结果[align=center][b]表2-6 奥美拉唑样品检测结果[/b][/align] [table=102%][tr][td] [align=center][b]批号[/b][/align] [/td][td] [align=center][b]4-甲氧基-2-硝基苯胺(230nm)[/b][/align] [/td][td] [align=center][b]4-甲氧基-邻苯二胺(210nm)[/b][/align] [/td][/tr][tr][td] [align=center]20150401[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][tr][td] [align=center]20150402[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][tr][td] [align=center]20150403[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][/table][b]3残留溶剂的检测方法的设定[/b]在《中国药典》[sup][/sup]规定的奥美拉唑中各论残留溶剂的检测方法的基础上,进行修正,更改部分参数,选用内标法对残留溶剂进行检测,有利于快速检验及产品及时入库。[b]3.1 色谱条件[/b]1) [url=https://insevent.instrument.com.cn/t/Mp]气相[/url]部分色谱柱:Agilent DB-624, 0.32mm×30m,膜厚1.8μm;柱温先以50 ℃保持5分钟,后以20℃/min升温到200℃保持4分钟;进样口温度为200℃; 分流比为1:1;检测器为FID,其温度为300℃;载气设定为氮气;柱流量则为3.0ml/min。2) 顶空部分顶空瓶平衡温度98℃,平衡时间20min;定量环温度115℃,体积1ml;传输管线温度为130℃。[b]3.2 溶液配制[/b]1) 苯贮备液:精密称取苯0.02g于已加入少量DMA的100ml容量瓶中,用DMA稀释至刻度,摇匀。2) 标准贮备液:精密称取丙酮0.15g,甲醇0.1g,二氯甲烷0.01g,甲苯0.03g,于已加入少量DMA的100ml容量瓶中,在此容量瓶中加入1ml准确量取的苯贮备液,用DMA稀释至刻度,摇匀。3) 标准溶液:精密量取标准溶液贮备液5.0ml于50 ml容量瓶中,用DMA稀释至刻度,混合均匀。4) 供试溶液:精密称定样品0.5g于20ml顶空瓶中,用5ml DMA溶解。[b]3.3 检测方法[/b]1) 按照[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]部分和顶空部分的操作条件设定操作方法。取标准溶液顶空进样,记录色谱图(主要组分出峰顺序依次为甲醇、丙酮、二氯甲烷、苯、甲苯)。注:计算相邻组分之间的分离度R,均应不小于1.5;取6份标准溶液,连续进样,计算各溶剂峰面积的RSD,应不大于10%。2) 先将空白溶液、6份标准溶液和样品溶液各5ml置于顶空瓶中,密封。取空白溶液进样,记录图谱,再取6份标准溶液,记录色谱图,进行系统适用性试验和标准校正,最后取供试溶液进样,记录图谱。计算公式如下式(2-1):[align=center][img=,211,60]https://ng1.17img.cn/bbsfiles/images/2019/07/201907241130224283_2738_3389662_3.png!w211x60.jpg[/img];[/align][align=center][img=,187,81]https://ng1.17img.cn/bbsfiles/images/2019/07/201907241130597462_639_3389662_3.png!w187x81.jpg[/img][/align]注:X[sub]1[/sub]:残留甲醇、甲苯、二氯甲烷、丙酮的量,ppm X[sub]2[/sub]:残留苯的量,ppm Ai:供试溶液的图谱中溶剂(i)的峰面积;A[sub]0[/sub]:空白溶液的图谱中溶剂(i)的峰面积;A[sub]si[/sub]:标准溶液的图谱中溶剂(i)的峰面积;W:样品的称量,g;W[sub]si[/sub]:溶剂(i)的称重,g。[b]3.4 检测结果[/b][align=center][b]表3-1 奥美拉唑残留溶剂检验结果[/b][/align] [table][tr][td=1,2] [align=center][b]项目[/b][/align] [/td][td=1,2] [align=center][b]标准[/b][/align] [/td][td=1,2] [align=center][b]方法[/b][/align] [/td][td=3,1] [align=center][b]奥美拉唑检验批号[/b][/align] [/td][/tr][tr][td] [align=center][b]A-51511507002[/b][/align] [/td][td] [align=center][b]A-51511507003[/b][/align] [/td][td] [align=center][b]A-51511507004[/b][/align] [/td][/tr][tr][td=1,5] [align=center]残留溶剂检验[/align] [/td][td] [align=center]丙酮不得超过1500ppm[/align] [/td][td=1,5] [align=center]内控[/align] [/td][td] [align=center]309ppm[/align] [/td][td] [align=center]396ppm[/align] [/td][td] [align=center]423ppm[/align] [/td][/tr][tr][td] [align=center]二氯甲烷不得超过100ppm[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][tr][td] [align=center]甲醇不得超过500ppm[/align] [/td][td] [align=center]115ppm[/align] [/td][td] [align=center]129ppm[/align] [/td][td] [align=center]122ppm[/align] [/td][/tr][tr][td] [align=center]甲苯不得超过300ppm[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][tr][td] [align=center]苯不得超过1ppm(LOQ)[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][/table][b]4小结[/b]本研究对治疗胃溃疡的一线药物奥美拉唑进行质量检验方法的研究。通过分析其合成过程中引入的杂质,创新性的提出原料药中可能存在的基因毒性杂质4-甲氧基-2-硝基苯胺、4-甲氧基-邻苯二胺,同时对生产过程引入的残留有机溶剂进行质量监控。根据ICH的指南Q2A和Q2B的要求,采用液相色谱,对奥美拉唑成品中的4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺进行限度检测,并对检测方法进行了专属性、系统适应性、检测限,样品测定等方面的限度验证。限度验证结果均应符合标准,说明该检测方法符合测定的准确性、可靠性和灵敏度的要求,能够进行该杂质的测定。且使用该方法进行三种批号的奥美拉唑基因毒性杂质检验时,均未发现存在4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺。说明现有的工艺可有效除去原料药中引入的这两种基因毒性杂质,可不放入日常质量监控之中。同时,在对奥美拉唑合成工艺中残留的有机溶剂的质量检测研究中,进行检测时,发现,其药品中检测出少量的丙酮和甲醇,但均在质量标准规定以内,未检测出二氯甲烷、甲苯、苯,说明选用的三批奥美拉唑成品药均符合药品质量标准。而在检测中,本研究创新性使用不同于中华人民共和国药典中的N ,N-二甲基甲酰胺(DMF),而选择易于冲洗的N ,N-二甲基乙酰胺(DMA)做溶媒,易冲洗干净,且不影响公司内其它产品的检测,与中华人民共和国药典方法相比,大大缩短检验样品的时间,中华人民共和国药典方法单个样品的检测时间为65min,内控的方法仅为36.5min,对工业化规模生产来说,快速检测样品既经济又能保证产品及时入库。[b]参考文献[/b] AnaLuisa Correia, Mina J Bissell. The tumor microenvironment is a dominantforceinmulti drμg resistance.Drμg Resist Update. 2012, 15(6):39-49. Shaojun Shi, ΜlrichKlotz,Protonpump inhibitors: an update of their clinical us and pharmacokinetics .EurJ Clin Pharmacol, 2008, 64(30): 935-951. ICHVALIDATION OF ANALYTICAL PROCEDURES: TEXT AND METHODOLOGY Q2 (R1) Current Step4 version (Complementary Guideline on Methodology dated 6 November 1996incorporated in November 2005). 国家药典委员会.中华人民共和国药典.二部.北京:中国医药科技出版社, 2015: 1412.
有关物质方法专属性问题本人在做一化学药方法学验证,在做药物降解实验时,发现主药降解后的杂质检测不到,或者只能检测到一部分,但是通过峰面积比较可以看出降解的大概比例(未破坏和降解实验时的称样量比较接近)。我在做酸碱强降解实验时,能检测到部分杂质,在做氧化强降解实验时,不能检测到杂质。请各位老师前辈指教:1.我通过峰面积计算降解比例可不可取?2.在降解杂质不能检测到或者不能全部检测到的情况下,是否说明我的方法不够专属呢?
请问关于基因毒性杂质大家都怎么检测呢?要求限度这么低,一般的方法也检测不出来啊?
原料药中元素杂质含量检测方法验证,查看药典,没有具体接受标准,,这个哪里可以查?
药物杂质中有三甲胺、溴代十六烷和溴代十八烷(沸点超过300度)。其中三甲胺标准品的溶剂为甲醇,浓度为100mg/L。做药物杂质的含量分析时,如用DB-5ms柱,进样口温度为310度,则柱温25度甲醇峰掩盖三甲胺的峰;溴代十六烷和溴代十八烷在220度保持20分钟会出峰。如用DB-wax柱,进样口温度为240度,溶剂为乙醚。如何证明溴代十六烷和溴代十八烷在进样口中完全气化。
随着公众对药物安全性的日益关注,控制药物中杂质已成为控制药品质量的关键因素之一,也是困扰着广大药物分析工作者的难题之一。由于药物杂质的来源广泛,已知的杂质可以通过现有的分析手段进行定性定量,未知的杂质则成为分析的难题,因此对于药品的杂质控制首要解决的问题就是将所有杂质进行完全分离。为了让广大药物分析工作者能实现有效地药品杂质控制,全国医药技术市场协会于2012年4月10日-13日在上海市举办“2012药物研究分析中新技术、新方法应用及杂质控制研讨会”。 制药企业和新药研究机构的研发人员,各级药品检验所(院)和口岸药品检验所人员,药品生产企业研发技术与质量管理负责人,新药研发CRO实验室人员及高管,各高等院校、科研院所等相关专业人员100多人参加了此次会议。 在此次会议上,多位行业知名专家钟大放(中科院药物研究所),王洪允(协和医院临床药理中心),胡昌勤(中国食品药品检定研究院),周立春(北京市药检所),王玉(江苏省检品检验所),张尊建(中国药科大学分析测试中心)分别讲解了当前药物分析领域中各种新技术、新方法,探讨分析新技术在药品研发及药品质量控制中的应用,特别是用于生物标志物、活性成份、药物代谢等高通量、定性、定量的各种分析技术,以及新版药典对药物分析方法新要求与国外药典比较等内容。 作为全球色谱消耗品领先的制造商,迪马科技一直致力于为食品、药品检测行业提供完善的技术服务,除与参会专家进行技术交流外,迪马科技技术应用工程师还与广大与会者共同分享了《Dikma 高效液相色谱柱技术应用于药品杂质控制分析》技术报告。 对于药品中杂质控制分析,首先要借助色谱柱进行良好的分离,迪马科技在此次技术报告中重点讲解了在杂质控制中色谱柱的分离性能所起关键作用及迪马科技多款液相色谱柱:Ø Diamonsil(钻石)—通用型反相色谱柱,超高的分离性能特别适合分析复杂的样品及杂质;Ø Spursil(思博尔)—通用型极性改性反相色谱柱,耐受100%水相-100%有机相,特别适用于强碱性化合物和极性化合物的分析;Ø Endeavorsil(奋进)—1.8 μm UHPLC专用色谱柱,超高的柱效满足您UHPLC分离杂质的需求;Ø Leapsil(飞跃)—2.7μm兼容UHPLC/HPLC色谱柱,低柱压设计,高选择性可在HPLC上拥有UHPLC色谱柱的分离能力;[font=Wing
[font=&]原料药中元素杂质含量检测方法验证,查看药典,没有具体接受标准,,这个哪里可以查?[/font]

中药材提取过程中回收乙醇挥发性杂质检测前言: 某中药注射剂的原料药材在前处理提取过程中,依据生产工艺要使用大量的乙醇做溶媒提取其中的有效成分。本次试验主要是检测已经使用过的乙醇,经过处理之后,是否以仍然符合标准要求后,二次投入使用,达到降低成本的目的。关键词:中药材、乙醇、挥发性杂质等。标准依据:《中国药典》2010年版 主要仪器:http://ng1.17img.cn/bbsfiles/images/2013/11/201311221945_478901_2204446_3.jpgAgilent 7890A 气相色谱仪 http://ng1.17img.cn/bbsfiles/images/2013/11/201311221945_478902_2204446_3.jpgAgilent DB-624 毛细管柱(30m*0.25mm*1.4μm)大龙 微量移液器 (20-200μl) 主要试剂:无水甲醇 色谱纯 乙醛 色谱纯乙缩醛 色谱纯 苯 分析纯4-甲基-2-戊醇 色谱纯测试条件: FID 检测器H2:45ml/min Air:400 ml/min 进样口温度:200℃ 检测器温度:280℃ 柱温:初始 40℃保持12min,然后以 10 ℃/min升至240℃保持10min 载气:N2 流速:2.0ml/min 分流比:50∶1对照溶液配制:精密量取无水甲醇100μl置50ml量瓶内用供试品稀释至刻度,摇匀,精密量取5ml置50ml量瓶中用供试品稀释至刻度,摇匀,作为对照(a)。精密量取无水甲醇50μl,乙醛50μl 置50ml量瓶中用供试品稀释至刻度,摇匀,精密量取100μl置10ml量瓶中用供试品稀释至刻度,摇匀,作为对照(b)。精密量取乙缩醛150μl置50ml量瓶中用供试品稀释至刻度,摇匀,精密量取100μl置10ml量瓶中用供试品稀释至刻度,摇匀,作为对照(c)。精密量取苯100μl置100ml量瓶中用供试品稀释至刻度,摇匀,精密量取100μl置50ml量瓶中用供试品稀释至刻度,摇匀,作为对照(d)。供试品溶液配制:取供试品作为供试品(a)。精密量取4-甲基-2-戊醇150μl 置500ml量瓶中用供试品稀释至刻度,摇匀,作为供试品(b)。分别量取对照溶液(a)(b)(c)(d)和供试品溶液(a)(b)各1μl注入气相色谱仪测得:图1 对照(a)无水甲醇图2 对照(b)乙醛和无水甲醇 图3 对照(c)乙缩醛图4对照(d)苯图5没有使用过的供试品 (a )图6没有使用过的供试品 (b) 4-甲基-2-戊醇图7 使用过两次以上供试品 (a )图8 使用过两次以上供试品 (b)总结与数据分析:通过上述实验,我们发现回收的乙醇,使用过两次以后杂质会增加很多,建议回收乙醇使用不能超过2次。分析杂质来源控制杂质含量,是我们车间降低成本的有效途径。方法采用标准加入法测定,方法准确度较高。