蛋白质测定仪是根据蛋白质中氮的含量恒定的原理,通过测定样品中氮的含量从而计算蛋白质含量的仪器但是实际中怎么操作呢?
食品中蛋白质测定仪的优点主要取决于其技术类型、精度、使用便捷性等因素。以下是针对食品中蛋白质测定仪的一般性优点分析: 优点: 快速性:蛋白质测定仪能在短时间内完成大量样品的检测,大大提高了检测效率,适用于食品生产线上快速、连续的蛋白质含量测定。 准确性:采用先进的检测技术,如光谱技术、化学分析方法等,能够确保测量结果的准确性和可靠性。 操作简单:仪器操作简单易用,用户只需按照说明书进行操作即可完成检测,降低了操作难度和人工成本。 应用广泛:适用于各类食品中蛋白质含量的检测,如乳制品、肉制品、豆制品等,具有广泛的应用前景。 自动化程度高:部分蛋白质测定仪具有自动化功能,能够自动完成样品的处理、检测和数据分析,提高了工作效率和准确性。
食品中蛋白质测定仪是一种用于快速准确地测量食品中蛋白质含量的设备。以下是关于食品中蛋白质测定仪的一些详细信息: 一、工作原理 食品中蛋白质测定仪的工作原理通常基于蛋白质与某些化学试剂反应产生颜色变化,通过测定颜色的强度来计算蛋白质的含量。常用的化学试剂有比色法、尿素法、低丙酮酸法等。其中,比色法是一种常用的蛋白质测定方法,其原理是利用蛋白质与双糖试剂反应生成紫色化合物,通过比色法测定紫色化合物的吸光度来计算蛋白质的含量。 二、应用领域 1. 食品生产、加工、流通等环节:蛋白质测定仪可以用于检测食品的质量,确保食品符合国家食品安全标准。 2. 食品安全监管:蛋白质测定仪可以用于检测食品中的农药残留、重金属含量等食品安全指标,为食品安全监管提供准确的数据支持。 3. 科学研究:蛋白质是生命活动的基本物质,对生命科学的研究具有重要意义。蛋白质测定仪可以用于研究食品中的蛋白质结构、功能以及与其他物质的相互作用等,为生命科学研究提供重要的数据支持。 4. 教学实验:在高校和科研机构中,蛋白质测定仪可以用于教学实验和研究工作。 三、使用方法 使用蛋白质测定仪进行蛋白质含量的测定通常包括以下步骤: 1. 样品准备:取一定量的食品样品,按照仪器说明书的要求进行前处理,如稀释、过滤等。 2. 试剂添加:向样品中加入适量的化学试剂,使其与蛋白质发生反应。 3. 反应与测定:等待一定时间,使反应充分进行,然后使用蛋白质测定仪测定反应液的颜色强度。 4. 结果计算:根据仪器测定的颜色强度,结合标准曲线或公式,计算出样品中的蛋白质含量。 需要注意的是,不同的蛋白质测定仪可能具有不同的操作方法和要求,因此在使用前需要仔细阅读仪器说明书,并按照说明书的要求进行操作。 四、注意事项 1. 仪器应放置在干燥、通风、无尘的环境中,避免阳光直射和强烈震动。 2. 在使用前应对仪器进行预热和校准,确保仪器的准确性和稳定性。 3. 在操作过程中应注意安全,避免试剂溅出或吸入有害气体。 4. 定期对仪器进行维护和保养,如清洗、更换试剂等,以保证仪器的正常运行和延长使用寿命。
食品中蛋白质含量测定仪的优点主要体现在以下几个方面: 检测速度快:能够在短时间内完成大量样品的检测,大大提高了检测效率,使食品生产厂家能够快速获取检测结果,及时调整生产策略。 操作简单:仪器操作简单易用,用户只需按照说明书进行操作即可完成检测,无需复杂的操作步骤和专业技能,降低了操作难度。 准确度高:采用先进的检测技术,如光谱技术、化学分析方法等,能够确保测量结果的准确性和可靠性,为食品生产厂家提供准确的数据支持。 应用广泛:适用于各类食品中蛋白质含量的检测,如乳制品、肉制品、豆制品等,满足了不同食品生产厂家的检测需求。 安全性高:使用食品中蛋白质含量测定仪可以避免直接接触样品,降低了交叉感染的风险,保障了检测人员的安全。 智能化程度高:一些先进的食品中蛋白质含量测定仪还采用了安卓智能操作系统,具有网线连接、Wi-Fi联网上传、GPRS无线远传等功能,可以快速上传数据,实现远程监控和管理。 稳定性强:仪器具有稳定的工作性能和较长的使用寿命,保证了长期使用的可靠性。 综上所述,食品中蛋白质含量测定仪具有检测速度快、操作简单、准确度高、应用广泛、安全性高、智能化程度高和稳定性强等优点,为食品生产和质量控制提供了有力的支持。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/05/202405151149314403_9648_4214615_3.jpg!w690x690.jpg[/img]
食品中蛋白质含量测定仪是用于快速、准确地测量食品中蛋白质含量的专业仪器。这种仪器基于各种化学或物理方法,如凯氏定氮法、双缩脲法、考马斯亮蓝法(Bradford法)或紫外分光光度法等,来测定食品中蛋白质的含量。 以下是关于食品中蛋白质含量测定仪的一些详细信息: 工作原理 凯氏定氮法:这是一种经典的蛋白质测定方法。样品中的蛋白质在催化剂的作用下与硫酸共热消化,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即可计算出样品的蛋白质含量。 双缩脲法:在碱性溶液中,双缩脲(尿素加热至180℃左右生成的二聚体)与铜离子形成紫色络合物,该络合物的颜色深浅与蛋白质含量成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。 考马斯亮蓝法(Bradford法):考马斯亮蓝G-250染料在酸性溶液中与蛋白质结合后,在595nm处有最大光吸收,其光吸收值与蛋白质含量成正比。因此,可用于蛋白质的定量测定。 紫外分光光度法:蛋白质中常含有酪氨酸、色氨酸等苯环结构,在280nm的紫外波段有较强的吸收峰,其吸光度与蛋白质含量成正比。这种方法操作简单、快速,但灵敏度较低,只适合测定蛋白质含量较高的样品。 应用领域 食品质量检测:蛋白质是食品中的重要营养成分,其含量是评价食品质量的重要指标之一。食品中蛋白质含量测定仪可用于检测各类食品(如肉类、奶类、蛋类、豆类、谷物等)中的蛋白质含量,为食品质量检测提供数据支持。 食品科学研究:在食品科学研究中,蛋白质含量测定仪可用于分析不同食品原料、加工工艺对蛋白质含量的影响,以及蛋白质在食品加工过程中的变化等。 注意事项 在使用蛋白质含量测定仪进行测试之前,需要仔细阅读产品说明书,了解仪器的使用方法、操作步骤及注意事项。 确保样品准备过程符合标准要求,避免样品污染或损坏导致检测结果不准确。 定期对仪器进行维护和校准,确保检测结果的准确性和可靠性。 在使用过程中注意安全防护措施,避免对人体造成伤害或对环境造成污染。 总之,食品中蛋白质含量测定仪是食品检测领域的重要工具之一,能够快速、准确地测定食品中的蛋白质含量,为食品质量控制和科学研究提供有力支持。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/05/202405151126410832_3840_4214615_3.jpg!w690x690.jpg[/img]
请教各位大家谁有FOSS2300蛋白测定仪 自校准方法?检定校准机器测定蛋白质含量的准确性怎么样,用什么方法做?
我想问一下,KDN-04蛋白质测定仪蒸馏时,打开电源后蒸炉自动进水是从自来水管道进的还是从蒸馏水管道进的?主要是我原理没弄清,资料上说是,自动进水后打开自来水管,意思是蒸炉内的水是从蒸馏水管道进的吗?有哪位前辈知道吗?急!谢谢了!

[size=16px] 食品蛋白质检测仪通常使用一系列的化学、生物化学或物理方法来检测乳制品中的蛋白质含量。以下是一种可能的检测过程: 样品制备: 从乳制品中取得样品,通常需要将样品进行处理,以确保蛋白质在检测过程中能够充分释放和反应。 蛋白质提取: 样品中的蛋白质需要从其他成分中分离出来。这可能涉及到样品的离心、过滤和/或溶解等步骤,以获得含有蛋白质的提取物。 显色/反应: 蛋白质的浓度可以通过与特定试剂发生化学反应或形成复合物来测量。例如,比目鱼法(Bradford法)或比二巴脱酰基试剂(BCA法)都是常用于蛋白质浓度测定的方法。这些试剂与蛋白质反应后会产生颜色变化,颜色的强度可以与蛋白质的浓度成正比。 分光光度测量: 使用分光光度计来测量显色产物的吸光度,从而确定蛋白质的浓度。通常,会建立一个标准曲线,其中包含已知浓度的蛋白质标准样品,用于校准测量结果。 计算浓度: 通过比较待测样品的吸光度与标准曲线上的数据,可以计算出待测样品中蛋白质的浓度。 需要注意的是,不同类型的食品蛋白质检测仪可能会采用不同的方法和试剂,具体的步骤和操作可能会有所不同。此外,为了获得准确的结果,操作者需要在操作过程中遵循标准操作规程,并确保仪器的准确校准和维护。最终结果的准确性也可能会受到样品的处理、试剂的质量以及操作技术等因素的影响。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2023/08/202308291345517046_7349_6098850_3.png!w690x690.jpg[/img][/size]

[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2023/11/202311090941436921_4317_5604214_3.png!w690x690.jpg[/img] 特点 1. 快速准确:食品蛋白质检测仪采用先进的测试方法,可以快速准确地检测出各类食品中的蛋白质含量。 2. 操作简便:食品蛋白质检测仪具有友好的操作界面和简单的操作步骤,使得操作更加简便易行。 3. 智能化:食品蛋白质检测仪具有智能化的特点,可以自动识别样品类型并给出相应的测试结果,无需人工干预。 4. 高精度:食品蛋白质检测仪采用高精度的传感器和测试方法,可以获得更加准确的结果。 5. 多功能:食品蛋白质检测仪不仅可以用于检测各类食品中的蛋白质含量,还可以用于检测其他营养成分的含量,如脂肪、糖等。 6. 便携式:食品蛋白质检测仪采用便携式设计,方便携带和移动,可以随时随地使用。 7. 安全可靠:食品蛋白质检测仪采用安全可靠的技术和材料,符合相关标准和法规要求,可以保证测试结果的安全性和可靠性。 总之,食品蛋白质检测仪具有广泛的应用范围和特点,可以快速准确地检测出各类食品中的蛋白质含量,为消费者和生产者提供可靠的参考依据。
公司有部分产品是冻干品,主要成分是蛋白质。想用库伦滴定法测冻干品的水分,用的仪器是卡尔费休水分测定仪。之前是用甲醇溶解的,发现有点溶解不完全,不知道哪位高手有没有类似经历,用的是什么试剂复溶冻干品比较好呢?尽可能不要破坏蛋白质
尊敬的专家先生: “近红外成份测定仪”这类仪器能否测定牧草(例如紫花苜蓿)中的蛋白质、脂肪等成份的含量?谢谢!
公司自己编写仪器操作规程的册子,但是缺少快速水分测定仪的,型号是OHAUS MB45万分感谢
目的]掌握双缩脲法测定蛋白质浓度的原理和标准曲线的绘制。[align=center]原理][/align][align=center]双缩脲(NH2CONHCONH2)在碱性溶液中与硫酸铜反应生成紫红色化合物,称为双缩脲[/align][align=center]反应,蛋白质分子中含有许多肽键(-CONH-)在碱性溶液中也能与Cu2+反应产生紫红色化合物。在一定范围内,其颜色的深浅与蛋白质浓度成正比。因此,可以利用比色法测定蛋白质浓度。[/align][align=center]双缩脲法是测定蛋白质浓度的常用方法之一。操作简便、迅速、受蛋白质种类性质的影响较小,但灵敏度较差,而且特异性不高。除-CONH-有此反应外,-CONH2、-CH2NH2、-CS-NH2等基团也有此反应。[/align][align=center]操作][/align][align=center](一) 绘制标准曲线[/align][align=center](二) 未知样品蛋白质浓度的测定 [/align][align=center] 1.取12支试管[/align][align=center]6支分别加入0,0.4,0.8,1.2,1.6,2.0毫升的标准[/align][align=center] 6支分别加入1毫升不同稀释浓度的待测液(两两相同)。[/align][align=center] 2.分别加水补足到2毫升。[/align][align=center] 3.分别加入4毫升双缩脲试剂在室温/37℃下放置30分钟。[/align][align=center][
关于固体蛋白质的测定,本人是参考GB 5009.5-2010食品安全国家标准:食品中蛋白质的测定,该标准介绍了三种方法用于检测食品中的蛋白质,分别是凯氏定氮、分光光度和燃烧法。 简单分析了三种方法,主要是依据现有设备和操作繁简程度,决定采用分光光度法(为防止他人误会,简单说一下该方法的原理:食品中的蛋白质在催化加热条件下被分解,分解产生的氨与硫酸结合生成硫酸铵,在pH 4.8 的乙酸钠-乙酸缓冲溶液中与乙酰丙酮和甲醛反应生成黄色的3,5-二乙酰-2,6-二甲基-1,4-二氢化吡啶化合物。在波长400 nm 下测定吸光度值,与标准系列比较定量,结果乘以换算系数,即为蛋白质含量。) 我困惑于国标方法其后提供的公式:详细见附件 求助如下:1)公式中的C和C0测定的氮是氨氮还是总氮?2)V1,V2,V3和V4描述的很啰嗦,可否指点一下对应标准中的何处? 再此谢谢各位!
纳克公司的IRO-1型氧测定仪操作规程[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=24635]IRO-1氧测定仪操作规程[/url]
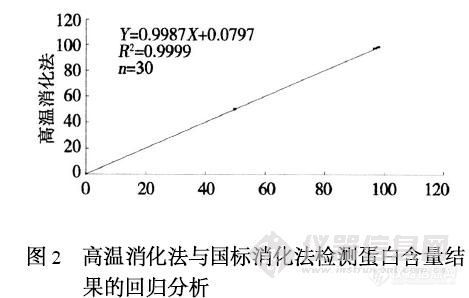
1 方法1.1 实验分组分为2 组:对照组和实验组。两组在测定样本蛋白质含量的过程中,采用不同的消化方法,之后的蒸馏、滴定、计算方法,则完全相同。推荐使用仪器:蛋白质测定仪,半自动定氮仪。1.1.1 对照组:操作严格按照国标规定〔1〕进行。其采用的消化方法为小火碳化消化法:取样品稀释液110 mL 与消化剂及硫酸一起加入定氮瓶内,于瓶口放一漏斗,将瓶以45°角斜支于有小孔的石棉网上加热消化,消化过程要求小火(400 ℃) 碳化3 h 左右。1.1.2 实验组:采用的消化方法是高温消化法:将样品稀释液110 mL 与消化剂一起加入定氮瓶内保持1 000 ℃的高温持续加热,其过程要求保持定氮瓶内液体沸腾,但所产生的蛋白质气泡不溢出瓶口,同时产生的蒸馏水气体在瓶壁遇冷回流,可以将瓶内壁上的蛋白质带回瓶底进行消化,整个消化过程大约1 h。1.2 蛋白质含量检测1.2.1 两组方法的稳定性、准确性比较: 分别对50 g/ L蛋白校准液(上海申索) 及15 份人血白蛋白样品(蛋白含量未知) 进行两种方法的蛋白质含量检测,前者重复15 次。1.2.2 实验组蛋白回收率检测(见表1) :任取2 种含蛋白的样品A、B(蛋白含量未知) ,每种样品分别取3 份各916 mL ,加入50 g/ L 的蛋白标准液0μL 、100μL 、400μL 和分别对应400μL 、300μL 、0μL 的生理盐水,执行4 次重复试验,进行2 种方法的蛋白质含量检测。最后计算回收率。http://ng1.17img.cn/bbsfiles/images/2010/12/201012032149_264269_1641058_3.jpg1.3 统计学分析数据以
1 原理: pro及其降解产物的芳香环基 ,在紫外区内对某一波长具有一定的光选择吸收,在280nm下,光吸收与pro浓度(3~8mg/ml)成直线关系,因此,通过测定pro溶液的吸光度,并参照事先用K氏定氮法分析的标准样品,从标准曲线查出蛋白质的含量。 2 试剂: (1) 0.1mol/l柠檬酸水溶液。 (2)8mol/l脲的2NNaOH溶液。 脲的2N氢氧化钠液 (3) 95%乙醇 (4) 无水乙醚 3 仪器 (1) 751型的紫外分光光度计 (2) 离心机 4 操作方法 (1)标准曲线的绘制:准确称取样品.2.00g,置于50ml烧瓶中,加入0.1mol/l柠檬酸水溶液30ml,搅拌30分钟使其充分溶解,用四层纱布过滤于玻璃离心管中,以每秒钟3000~5000转的速度离心10分钟,分别吸出上清夜0.5,1.0,1.5,2.0,2.5,3.0ml于6个10ml容量瓶钟,每个容量瓶,8mol/l脲的氢氧化钠溶液充分摇2分钟(如果离心再次离心),取透明液于比色皿中,在280nm下测定其吸光度。(做参比值) 以事先用K氏定氮法测定的样品中蛋白质的含量微横坐标上面的吸光度为纵坐标,绘制标准曲线。 (2)样品测定 准确称取试样1.00g→于50ml烧杯中→加0.1mol/l柠檬酸溶液30ml→搅拌10分钟→四层纱布过滤到离心管中→用8mol/L脲的NaOH溶液定容,摇匀后于280nm下测吸光度,从标准曲线上查出pro的含量。 计算: 蛋白质= C/W× 100 C----从标准曲线上查得的pro含量(mg) W----测定样品溶液相当于样品量(mg) 说明: a.此法运用于糕点,牛乳和可溶性pro样品,测定糕点时,应把表皮颜色去掉。 b.温度对pro水解有影响,操作温度应控制在20~30℃。
[size=4][center]Bradford法[/center][/size][B]具体操作步骤:(一)实验原理 [/B]双缩脲法(Biuret法)和Folin—酚试剂法(Lowry法)的明显缺点和许多限制,促使科学家们去寻找更好的蛋白质溶液测定的方法。 1976年由Bradford建立的考马斯亮兰法(Bradford法),是根据蛋白质与染料相结合的原理设计的。这种蛋白质测定法具有超过其他几种方法的突出优点,因而正在得到广泛的应用。这一方法是目前灵敏度最高的蛋白质测定法。 考马斯亮兰G-250染料,在酸性溶液中与蛋白质结合,使染料的最大吸收峰的位置(lmax),由465nm变为595nm,溶液的颜色也由棕黑色变为兰色。经研究认为,染料主要是与蛋白质中的碱性氨基酸(特别是精氨酸)和芳香族氨基酸残基相结合。 在595nm下测定的吸光度值A595,与蛋白质浓度成正比。
[font=宋体][font=宋体]蛋白质浓度测定的各种方法及原理是生物化学和分子生物学实验中的重要环节。蛋白质浓度的准确测定对于研究生物分子相互作用、蛋白质功能和动力学、以及生物样品的分析和鉴定等方面都具有重要的意义。本文将介绍几种常用的蛋白质浓度测定方法及其原理,包括紫外吸收法、微量凯氏定氮法、双缩尿法、[/font][font=Calibri]Lowry [/font][font=宋体]法和考马斯亮蓝法等。通过对这些方法的比较和分析,可以更好地了解它们的优缺点,以便根据实际实验需求选择合适的方法来测定蛋白质浓度。[/font][/font][font=宋体] [/font][font=宋体][b]①紫外吸收法[/b][/font][font=宋体] [/font][font=宋体]检测原理:[/font][font=宋体] [/font][font=宋体][font=宋体]蛋白质分子中,酪氨酸、苯丙氨酸和色氨酸残基的苯环含有共扼双键,使蛋白质具有吸收紫外光的性质。吸收高峰在[/font][font=Calibri]280nm[/font][font=宋体]处,其吸光度(即光密度值)与蛋白质含量成正比。此外,蛋白质溶液在[/font][font=Calibri]238nm[/font][font=宋体]的光吸收值与肽键含量成正比。利用一定波长下,蛋白质溶液的光吸收值与蛋白质浓度的正比关系,进行蛋白质含量的测定。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体]方法特点:[/font][font=宋体] [/font][font=宋体]优点:简便、灵敏、快速,不消耗样品,测定后仍能回收使用。[/font][font=宋体] [/font][font=宋体]缺点:测定蛋白质含量的准确度较差,干扰物质多。[/font][font=宋体] [/font][font=宋体]干扰物:含有嘌呤、嘧啶、核酸等吸收紫外光的物质。[/font][font=宋体] [/font][font=宋体][font=宋体]检出限:[/font][font=Calibri]50~100ug[/font][font=宋体]蛋白含量。[/font][/font][font=宋体] [/font][font=宋体]适用范围:适于用测定与标准蛋白质氨基酸组成相似的蛋白质。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]②微量凯氏定氮法[/b][/font][font=宋体] [/font][font=宋体]凯氏定氮法被国内外视为蛋白质含量的标准检验方法,可作为衡量其他蛋白质含量检测方法准确性的标准。[/font][font=宋体] [/font][font=宋体]实验原理:[/font][font=宋体] [/font][font=宋体]样品与浓硫酸共热,含氮有机物即分解产生氨(消化),氨又与硫酸作用,变成硫酸氨。经强碱碱化使之分解放出氨,借蒸汽将氨蒸至酸液中,根据此酸液被中和的程度可计算得样品之氮含量。[/font][font=宋体] [/font][font=宋体]方法特点:[/font][font=宋体] [/font][font=宋体]优点:通用性强,测定费用低,易实现,仪器简单且测定结果的重复性和重现性好。[/font][font=宋体] [/font][font=宋体]缺点:实验耗时长、灵敏度低。[/font][font=宋体] [/font][font=宋体][font=宋体]检出限:[/font][font=Calibri]0.2~1mg[/font][font=宋体]蛋白含量。[/font][/font][font=宋体] [/font][font=宋体]适用范围:凯氏定氮法测的是总蛋白的量,一些非蛋白氮无法检测出。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]③双缩尿法[/b][/font][font=宋体] [/font][font=宋体]实验原理:[/font][font=宋体] [/font][font=宋体][font=宋体]双缩尿([/font][font=Calibri]NH3CONHCONH3[/font][font=宋体])是两个分子经[/font][font=Calibri]180[/font][font=宋体]℃左右加热,放出一个分子氨后得到的产物。在强碱溶液中,双缩尿与[/font][font=Calibri]CuSO4[/font][font=宋体]形成紫色络合物,称为双缩尿反应。凡具有两个酰胺基或两个直接连接的肽链,或能过一个中间碳原子相连的肽键,这类化合物都有双缩尿反应。紫色络合物颜色的深浅与蛋白质浓度成正比,与蛋白质分子量及氨基酸成分无关。[/font][/font][font=宋体] [/font][font=宋体]方法特点:[/font][font=宋体] [/font][font=宋体]优点:适合检测总蛋白质的含量,操作简单、测量速度快。[/font][font=宋体] [/font][font=宋体]缺点:标准物质必须使用代表性很强的样品,需使用其他参考方法测出标准物质中的蛋白质总含量,故测定工作费力费时。不宜测定样品种类多、彼此差异大的样品。[/font][font=宋体] [/font][font=宋体][font=宋体]检出限:测定蛋白质含量测定范围为[/font][font=Calibri]1-20mg[/font][font=宋体]蛋白质。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]干扰物:硫酸铵、[/font][font=Calibri]Tris[/font][font=宋体]缓冲液和某些氨基酸等。[/font][/font][font=宋体] [/font][font=宋体]适用范围:常用于需要快速,但并不需要十分精确的蛋白质测定。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b][font=宋体]④[/font][font=Calibri]Lowry [/font][font=宋体]法[/font][/b][/font][font=宋体] [/font][font=宋体][font=Calibri]Lowry [/font][font=宋体]法是双缩脲法的发展,结合了双缩脲试剂和酚试剂与蛋白质的反应,是最灵敏的蛋白质测定方法之一,在生物化学领域得到广泛的应用,目前分为基本法和改良简易法,改良简易法可获得与基本法相近的结果。[/font][/font][font=宋体] [/font][font=宋体]基本法实验原理:[/font][font=宋体] [/font][font=宋体][font=宋体]显色原理与双缩尿法相同,但加入了[/font][font=Calibri]Folin-[/font][font=宋体]酚酞试剂,以增加显色量,从而提高检测蛋白质的灵敏度。这两种显色反应产生深兰色的原因是:①在碱性条件下,蛋白质中的肽键与铜结合生成复合物。②[/font][font=Calibri]Folin[/font][font=宋体]一酚试剂中的磷钼酸盐一磷钨酸盐被蛋白质中的酪氨酸和苯丙氨酸残基还原,产生深兰色(钼兰和钨兰的混合物)。在一定的条件下,兰色深度与蛋白的量成正比。[/font][/font][font=宋体] [/font][font=宋体]特点:[/font][font=宋体] [/font][font=宋体]优点:灵敏度高。[/font][font=宋体] [/font][font=宋体]缺点:耗费时间长,操作时间需精准控制,标准曲线绘制麻烦,专一性较差,干扰物质比较多。[/font][font=宋体] [/font][font=宋体][font=宋体]检出限:可检测的最低蛋白质量达[/font][font=Calibri]5ug[/font][font=宋体]。通常测定范围是[/font][font=Calibri]20~250ug[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]干扰物:酚类、柠檬酸、硫酸铵、[/font][font=Calibri]Tris[/font][font=宋体]缓冲液、甘氨酸、糖类、甘油等。[/font][/font][font=宋体] [/font][font=宋体]适用范围:除蛋白含量测定,也可用于酪氨酸和色氨酸的定量测定。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]⑤考马斯亮蓝法[/b][/font][font=宋体] [/font][font=宋体]实验原理:[/font][font=宋体] [/font][font=宋体][font=宋体]考马斯亮蓝[/font][font=Calibri]G-250[/font][font=宋体]染料,在酸性溶液中与蛋白质结合,使染料的最大吸收峰的位置([/font][font=Calibri]max[/font][font=宋体]),由[/font][font=Calibri]465mm[/font][font=宋体]变为[/font][font=Calibri]595nm[/font][font=宋体],溶液的颜色也由棕黑色变为蓝色。经研究认为,染料主要是与蛋白质中的碱性氨基酸(特别是精氨酸)和芳香族氨基酸残基相结合。在[/font][font=Calibri]595mm[/font][font=宋体]下测定的吸光度值[/font][font=Calibri]A595[/font][font=宋体],与蛋白质浓度成正比。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体]方法特点:[/font][font=宋体] [/font][font=宋体][font=宋体]优点:灵敏度比[/font][font=Calibri]Lowry[/font][font=宋体]高约[/font][font=Calibri]4[/font][font=宋体]倍,高效率、检测过程简便、只需要一种试剂,抗干扰能力强。[/font][/font][font=宋体] [/font][font=宋体]缺点:测定误差大,不适用于不同蛋白的检测。[/font][font=宋体] [/font][font=宋体][font=宋体]检出限:其最低蛋白质检测量可达[/font][font=Calibri]1ug[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]干扰物:干扰物质少,但去污剂、[/font][font=Calibri]TritonX-100[/font][font=宋体]、十二烷基硫酸钠、[/font][font=Calibri]0.1N[/font][font=宋体]的[/font][font=Calibri]NaOH[/font][font=宋体]会干扰实验测定。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]蛋白质含量测定方法选择[/b][/font][font=宋体] [/font][font=宋体]蛋白质含量测定时,考虑以下因素后选定适用的检测方法。[/font][font=宋体] [/font][font=宋体]①实验对测定所要求的灵敏度和精确度;[/font][font=宋体] [/font][font=宋体]②蛋白质的性质;[/font][font=宋体] [/font][font=宋体]③溶液中存在的干扰物质;[/font][font=宋体] [/font][font=宋体]④测定所要花费的时间。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供多种类型的[url=https://cn.sinobiological.com/resource/protein-review][b]蛋白资源[/b][/url],不仅有重组蛋白服务还有各种大咖讲座,详情可以关注[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review[/font][/font][font=Calibri] [/font]
[color=#444444]现在有两个方法:[/color][color=#444444]GB/T 5413.1-1997,[/color][color=#444444]主要用于婴儿配方食品和乳制品中蛋白质的测定;[/color][color=#444444] GB5009.5-2003,[/color][color=#444444]主要用于食品中蛋白质的测定。都用凯氏定氮法,但是最后计算公式有差异。[/color][color=#444444]5413:蛋白质含量=[u] (V-V0)* C(H+)*2* 0.014 *F [/u] * 100[/color][color=#444444] m* 25/1005009:蛋白质含量=[u] (V1-V2)* C* 0.014 *F [/u] * 100[/color][color=#444444] m* 10/100[/color][color=#444444]折算下来,5413 乘的系数是 8,而5009乘的系数为10。搞不懂了?为啥会这样?[/color][color=#444444][/color][color=#444444]究竟用两种方法测出的奶粉的蛋白质,会不会有很大差异呢?[/color]
请教 现在有关蛋白质的相关测定有那些知识和技术????就我所知的,目前蛋白质的测定主要是蛋白质总量的测定(凯氏定氮),那没有有测定分析食品中蛋白质种类的方法或技术呢???邀请大家来讨论!!!
[align=center][font=宋体]蛋白质浓度测定方法大全[/font][/align][align=left][font=宋体]蛋白质的定量分析是生物化学和其它生命学科最常涉及的分析内容,是临床上诊断疾病及检查康复情况的重要指标,也是许多生物制品,药物、食品质量检测的重要指标。在生化实验中,对样品中的蛋白质进行准确可靠的定量分析,则是经常进行的一项非常重要的工作。[/font][/align][align=left][font=宋体]蛋白质是一种十分重要的生物大分子:它的种类很多,结构不均一,分子量又相差很大,功能各异,这样就给建立一个理想而又通用的蛋白质定量分析的方法带来了许多具体的困难。目前测定蛋白质含量的方法有很多种,下面列出根据蛋白质不同性质建立的一些蛋白质测定方法:[/font][/align][align=left][font=宋体]物理性质:紫外分光光度法。[/font][font=宋体]化学性质:凯氏定氮法、双缩脲法、[/font]Lowry[font=宋体]法,[/font]BCA[font=宋体]法,胶体金法。[/font][font=宋体]染色性质:考马氏亮蓝染色法、银染法。[/font][font=宋体]其他性质:荧光法。[/font][/align][align=left][font=宋体]蛋白质测定的方法很多,但每种方法都有其特点和局限性,因而需要在了解各种方法的基础上根据不同情况选用恰当的方法,以满足不同的要求。例如凯氏定氮法结果最精确,但操作复杂,用于大批量样品的测试则不太合格;双缩脲法操作简单,线性关系好,但灵敏度差,样品需要量大,测量范围窄,因此在科研上的应用受到限制;而酚试剂法弥补了它的缺点,因而在科研中被广泛采用,但是它的干扰因素多;考马氏亮兰染色法因其灵敏而又简便开始重新受到关注;[/font]BCA[font=宋体]法又以其试剂稳定,抗干扰能力较强,结果稳定,灵敏度高而受到欢迎;胶体金法具有较高的灵敏度,可达到毫微克水平,用于微量蛋白的测定。[/font][/align][align=left][font=宋体]一、常用的测定蛋白质含量方法的比较[/font][/align][img]http://file3.foodmate.net/attachment/forum/202306/07/192040qevvp3337wwevprw.png.thumb.jpg[/img][align=left][font=宋体]下面介绍[/font]Folin[font=宋体]—酚试剂法,考马氏亮蓝[/font]G[font=宋体]—[/font]250[font=宋体]染色法,紫外分光光度法、胶体金法等几种最常用使用的方法。[/font][/align][align=left][font=宋体]二、、[/font] Folin[font=宋体]-酚试剂法(又名[/font]Lowry[font=宋体])法[/font]1[font=宋体]、、实验原理[/font][/align][align=left][font=宋体]这种蛋白质测定法是最灵敏的方法之一。过去此法是应用最广泛的一种方法,由于其试剂乙的配制较为困难(现在已可以订购),近年来逐渐被考马斯亮兰法所取代。此法的显色原理与双缩脲方法是相同的,只是加入了第二种试剂,即[/font]Folin[font=宋体]—酚试剂,以增加显色量,从而提高了检测蛋白质的灵敏度。这两种显色反应产生深兰色的原因是:在碱性条件下,蛋白质中的肽键与铜结合生成复合物。[/font]Folin[font=宋体]—酚试剂中的磷钼酸盐—磷钨酸盐被蛋白质中的酪氨酸和苯丙氨酸残基还原,产生深兰色(钼兰和钨兰的混合物)。在一定的条件下,兰色深度与蛋白的量成正比。在生物化学领域得到广泛的应用。[/font][/align][align=left][font=宋体]此法可检测的最低蛋白质量达[/font]5mg[font=宋体]。通常测定范围是[/font]20~250mg[font=宋体]。[/font][/align][align=left]2.[font=宋体]、优缺点[/font][/align][align=left][font=宋体]优点是灵敏度高,比双缩脲法灵敏得多;[/font][/align][align=left][font=宋体]缺点是费时间较长,要精确控制操作时间,标准曲线也不是严格的直线形式,且专一性较差,干扰物质较多。[/font][/align][align=left]3[font=宋体]、试剂与器材[/font][/align][align=left]3[font=宋体]、[/font]1.[font=宋体]试剂[/font][/align][align=left][font=宋体]([/font]1[font=宋体])试剂甲:([/font]A[font=宋体])[/font]10[font=宋体]克[/font]Na2CO3[font=宋体],[/font]2[font=宋体]克[/font]NaOH[font=宋体]和[/font]0.25[font=宋体]克酒石酸钾钠([/font]KNaC4H4O6[font=宋体][/font]4H2O[font=宋体]),溶解于[/font]500[font=宋体]毫升蒸馏水中。([/font]B[font=宋体])[/font]0.5[font=宋体]克硫酸铜([/font]CuSO4[font=宋体][/font]5H2O[font=宋体])溶解于[/font]100[font=宋体]毫升蒸馏水中,每次使用前,将[/font]50[font=宋体]份([/font]A[font=宋体])与[/font]1[font=宋体]份([/font]B[font=宋体])混合,即为试剂甲。[/font][/align][align=left][font=宋体]([/font]2[font=宋体])试剂乙:在[/font]2[font=宋体]升磨口回流瓶中,加入[/font]100[font=宋体]克钨酸钠,[/font]25[font=宋体]克钼酸钠及[/font]700[font=宋体]毫升蒸馏水,再加[/font]50[font=宋体]毫升[/font]85%[font=宋体]磷酸,[/font]100[font=宋体]毫升浓盐酸,充分混合,接上回流管,以小火回流[/font]10[font=宋体]小时,回流结束时,加入[/font]150[font=宋体]克硫酸锂,[/font]50[font=宋体]毫升蒸馏水及数滴液体溴,开口继续沸腾[/font]15[font=宋体]分钟,以便驱除过量的溴。冷却后溶液呈黄色(如仍呈绿色,须再重复滴加液体溴的步骤)。稀释至[/font]1[font=宋体]升,过滤,滤液置于棕色试剂瓶中保存。使用时用标准[/font]NaOH[font=宋体]滴定,酚酞作指示剂,然后适当稀释,约加水[/font]1[font=宋体]倍,使最终的酸浓度为[/font]1N[font=宋体]左右。[/font][/align][align=left][font=宋体]([/font]3[font=宋体])标准蛋白质溶液[/font]:[font=宋体]精确称取结晶牛血清清蛋白或球蛋白,溶于蒸馏水,浓度为[/font]250 mg/ml[font=宋体]左右。牛血清清蛋白溶于水若混浊,可改用[/font]0.9 % NaCl[font=宋体]溶液。[/font][/align][align=left]3[font=宋体]、[/font]2.[font=宋体]器材[/font][/align][align=left][font=宋体]([/font]1[font=宋体])可见光分光光度计;[/font][/align][align=left][font=宋体]([/font]2[font=宋体])旋涡混合器;[/font][/align][align=left][font=宋体]([/font]3[font=宋体])秒表;[/font][/align][align=left][font=宋体]([/font]4[font=宋体])试管[/font]16[font=宋体]支。[/font][/align][align=left]4[font=宋体]、操作方法[/font][/align][align=left]4[font=宋体]、[/font]1.[font=宋体]标准曲线的测定:取[/font]16[font=宋体]支大试管,[/font]1[font=宋体]支作空白,[/font]3[font=宋体]支留作未知样品,其余试管分成两组,分别加入[/font]0[font=宋体],[/font]0.1[font=宋体],[/font]0.2[font=宋体],[/font]0.4[font=宋体],[/font]0.6[font=宋体],[/font]0.8[font=宋体],[/font]1.0[font=宋体]毫升标准蛋白质溶液(浓度为[/font]250mg/ml[font=宋体])。用水补足到[/font]1.0[font=宋体]毫升,然后每支试管加入[/font]5[font=宋体]毫升试剂甲,在旋涡混合器上迅速混合,于室温([/font]20[font=宋体]~[/font]25[font=宋体]℃)放置[/font]10[font=宋体]分钟。[/font][/align][align=left][font=宋体]再逐管加入[/font]0.5[font=宋体]毫升试剂乙([/font]Folin[font=宋体]—酚试剂),同样立即混匀。这一步混合速度要快,否则会使显色程度减弱。然后在室温下放置[/font]30[font=宋体]分钟,以未加蛋白质溶液的第一支试管作为空白对照,于[/font]700nm[font=宋体]处测定各管中溶液的吸光度值。以蛋白质的量为横座标,吸光度值为纵座标,绘制出标准曲线。注意:因[/font]Lowry[font=宋体]反应的显色随时间不断加深,因此各项操作必须精确控制时间,即第[/font]1[font=宋体]支试管加入[/font]5[font=宋体]毫升试剂甲后,开始计时,[/font]1[font=宋体]分钟后,第[/font]2[font=宋体]支试管加入[/font]5[font=宋体]毫升试剂甲,[/font]2[font=宋体]分钟后加第[/font]3[font=宋体]支试管,余此类推。全部试管加完试剂甲后若已超过[/font]10[font=宋体]分钟,则第[/font]1[font=宋体]支试管可立即加入[/font]0.5[font=宋体]毫升试剂乙,[/font]1[font=宋体]分钟后第[/font]2[font=宋体]支试管加入[/font]0.5[font=宋体]毫升试剂乙,[/font]2[font=宋体]分钟后加第[/font]3[font=宋体]支试管,余此类推。[/font][/align][align=left][font=宋体]待最后一支试管加完试剂后,再放置[/font]30[font=宋体]分钟,然后开始测定光吸收。每分钟测一个样品。进行多试管操作时,为了防止出错,必须在实验记录本上预先画好下面的表格。表中是每个试管要加入的量(毫升),并按由左至右,由上至下的顺序,逐管加入。最下面两排是计算出的每管中蛋白质的量(微克)和测得的吸光度值。[/font][/align][align=left]4[font=宋体]、[/font]2.[font=宋体]样品的测定:取[/font]1[font=宋体]毫升样品溶液(其中约含蛋白质[/font]20~250[font=宋体]微克),按上述方法进行操作,取[/font]1[font=宋体]毫升蒸馏水代替样品作为空白对照。通常样品的测定也可与标准曲线的测定放在一起,同时进行。即在标准曲线测定的各试管后面,再增加[/font]3[font=宋体]个试管。如上表中的[/font]8[font=宋体]、[/font]9[font=宋体]、[/font]10[font=宋体]试管。根据所测样品的吸光度值,在标准曲线上查出相应的蛋白质量,从而计算出样品溶液的蛋白质浓度。注意,由于各种蛋白质含有不同量的酪氨酸和苯丙氨酸,显色的深浅往往随不同的蛋白质而变化。因而本测定法通常只适用于测定蛋白质的相对浓度(相对于标准蛋白质)。[/font][/align][align=left][/align][align=left]5[font=宋体]、注意事项[/font][/align][align=left][font=宋体]([/font]1[font=宋体])对双缩脲反应发生干扰的离子,同样容易干扰[/font]Lowry[font=宋体]反应。而且对后者的影响还要大得多。酚类、柠檬酸、硫酸铵、[/font]Tris[font=宋体]缓冲液、甘氨酸、糖类、甘油等均有干扰作用。浓度较低的尿素([/font]0.5%[font=宋体]),硫酸钠([/font]1%[font=宋体]),硝酸钠([/font]1%[font=宋体]),三氯乙酸([/font]0.5%[font=宋体]),乙醇([/font]5%[font=宋体]),乙醚([/font]5%[font=宋体]),丙酮([/font]0.5%[font=宋体])等溶液对显色无影响,但这些物质浓度高时,必须作校正曲线。[/font][/align][align=left][font=宋体]([/font]2[font=宋体]含硫酸铵的溶液,只须加浓碳酸钠—氢氧化钠溶液,即可显色测定。若样品酸度较高,显色后会色浅,则必须提高碳酸钠—氢氧化钠溶液的浓度[/font]1~2[font=宋体]倍。进行测定时,加[/font]Folin[font=宋体]—酚试剂时要特别小心,因为该试剂仅在酸性[/font]pH[font=宋体]条件下稳定,但上述还原反应只在[/font]pH=10[font=宋体]的情况下发生,故当[/font]Folin[font=宋体]一酚试剂加到碱性的铜—蛋白质溶液中时,必须立即混匀,以便在磷钼酸—磷钨酸试剂被破坏之前,还原反应即能发生。此法也适用于酪氨酸和色氨酸的定量测定。[/font][/align][align=left][font=宋体]三、考马斯亮蓝法[/font]1[font=宋体]、实验原理[/font][/align][align=left][font=宋体]考马斯亮蓝[/font] (Coomassie Brilliant Blue) [font=宋体]法测定蛋白质浓度,是利用蛋白质―染料结合的原理,定量测定微量蛋白浓度快速、灵敏的方法。这种蛋白质测定法具有超过其他几种方法的突出优点,因而正在得到广泛的应用。目前,这一方法是也灵敏度最高的蛋白质测定法之一。[/font][/align][align=left][font=宋体]考马斯亮蓝[/font] G-250 [font=宋体]染料,在酸性溶液中与蛋白质结合,使染料的最大吸收峰[/font] (lmax) [font=宋体]的位置,由[/font] 465 nm [font=宋体]变为[/font] 595 nm[font=宋体],溶液的颜色也由棕黑色变为蓝色。通过测定[/font] 595 nm [font=宋体]处光吸收的增加量可知与其结合蛋白质的量。研究发现,染料主要是与蛋白质中的碱性氨基酸[/font] ([font=宋体]特别是精氨酸[/font]) [font=宋体]和芳香族氨基酸残基相结合。[/font][/align][font=宋体][/font]
目前蛋白质分子量测定有多种方法。最常用的应该是SDS--PAGE,分子筛了或者称为凝胶过滤,更为精确的是蛋白质质谱分析。欢迎大家对这些方法的有缺点进行讨论。

[size=16px][font=-apple-system, BlinkMacSystemFont, &][color=#05073b]蛋白质检测仪是什么仪器[/color][/font]蛋白质检测仪是一种用于检测食品、生物样品和其他物质中蛋白质含量的仪器。它通过不同的方法,如凯氏定氮法、分光光度法、[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]法等,对样品中的蛋白质进行定量和定性分析。蛋白质检测仪可以广泛应用于实验室、质量控制部门和科研机构等领域。它具有操作简便、快速准确、灵敏度高、重复性好等优点,能够满足不同领域的需求。蛋白质检测仪的原理主要是根据蛋白质与特定试剂的反应,如与双缩脲试剂的显色反应,或与某些染料的结合反应,来测定样品的蛋白质含量。不同的蛋白质检测仪采用不同的原理和方法,但它们都具有相同的目的是准确测定样品中的蛋白质含量。在使用蛋白质检测仪时,需要注意样品的处理和试剂的选择。不同的样品需要不同的处理方法,如血液样品需要进行离心分离,组织样品需要进行匀浆等。同时,试剂的选择也需要注意,如双缩脲试剂需要使用硫酸铜和氢氧化钠等试剂进行配制。总之,蛋白质检测仪是一种重要的实验室仪器,可以用于测定样品中的蛋白质含量。它具有操作简便、快速准确等优点,能够满足不同领域的需求。同时,需要注意样品的处理和试剂的选择,以确保测定的准确性和可靠性。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2023/11/202311131032246528_1186_6098850_3.jpg!w690x690.jpg[/img][/size]
一,蛋白质(包括酶)的提取 大部分蛋白质都可溶于水、稀盐、稀酸或碱溶液,少数与脂类结合的蛋白质则溶于乙醇、丙酮、丁醇等有机溶剂中,因些,可采用不同溶剂提取分离和纯化蛋白质及酶。(一)水溶液提取法 稀盐和缓冲系统的水溶液对蛋白质稳定性好、溶解度大、是提取蛋白质最常用的溶剂,通常用量是原材料体积的1-5倍,提取时需要均匀的搅拌,以利于蛋白质的溶解。提取的温度要视有效成份性质而定。一方面,多数蛋白质的溶解度随着温度的升高而增大,因此,温度高利于溶解,缩短提取时间。但另一方面,温度升高会使蛋白质变性失活,因此,基于这一点考虑提取蛋白质和酶时一般采用低温(5度以下)操作。为了避免蛋白质提以过程中的降解,可加入蛋白水解酶抑制剂(如二异丙基氟磷酸,碘乙酸等)。下面着重讨论提取液的pH值和盐浓度的选择。1、pH值 蛋白质,酶是具有等电点的两性电解质,提取液的pH值应选择在偏离等电点两侧的pH范围内。用稀酸或稀碱提取时,应防止过酸或过碱而引起蛋白质可解离基团发生变化,从而导致蛋白质构象的不可逆变化,一般来说,碱性蛋白质用偏酸性的提取液提取,而酸性蛋白质用偏碱性的提取液。2、盐浓度 稀浓度可促进蛋白质的溶,称为盐溶作用。同时稀盐溶液因盐离子与蛋白质部分结合,具有保护蛋白质不易变性的优点,因此在提取液中加入少量NaCl等中性盐,一般以0.15摩尔。升浓度为宜。缓冲液常采用0.02-0.05M磷酸盐和碳酸盐等渗盐溶液。(二)有机溶剂提取法 一些和脂质结合比较牢固或分子中非极性侧链较多的蛋白质和酶,不溶于水、稀盐溶液、稀酸或稀碱中,可用乙醇、丙酮和丁醇等有机溶剂,它们具的一定的亲水性,还有较强的亲脂性、是理想的提脂蛋白的提取液。但必须在低温下操作。丁醇提取法对提取一些与脂质结合紧密的蛋白质和酶特别优越,一是因为丁醇亲脂性强,特别是溶解磷脂的能力强;二是丁醇兼具亲水性,在溶解度范围内(度为10%,40度为6.6%)不会引起酶的变性失活。另外,丁醇提取法的pH及温度选择范围较广,也适用于动植物及微生物材料。
求库伦说分测定仪C20的操作规程!!!请各位前辈帮帮忙!非常感谢!
云唐蛋白质检测仪为集成化食品安全快速检测分析设备,广泛应用于液态奶、奶粉等乳品中的蛋白质含量的测定。 测定奶粉中蛋白质含量的过程通常涉及一系列化学反应和分析步骤。以下是一般情况下使用蛋白质检测仪来测定奶粉蛋白质含量的一般操作步骤: 样品准备: 从奶粉中取样,确保样品的代表性。样品量的选择可能因仪器型号和分析方法的要求而有所不同。 样品预处理: 根据仪器要求,可能需要对样品进行预处理。例如,可以使用适当的溶液进行提取、稀释或其他处理,以确保样品的蛋白质能够被准确测定。 仪器准备: 打开蛋白质检测仪,根据仪器的操作手册进行系统的准备和预热,以确保仪器处于合适的工作状态。 校准: 根据仪器的要求,进行校准操作。校准是确保测量结果准确的关键步骤,通常会使用标准溶液进行校准。 装载样品: 将预处理好的样品加入仪器的样品槽中,根据仪器的要求确定每次装样的量。 测定: 根据仪器的指示,启动测定过程。仪器会自动进行反应和测量,然后计算出样品中的蛋白质含量。 结果显示和记录: 测定完成后,仪器会显示蛋白质含量的测定结果。记录结果,可以根据需要打印报告或保存数据。 清洁和维护: 在完成测定后,根据仪器的要求进行清洁和维护,以确保仪器的正常运行和延长使用寿命。 数据分析: 分析测定结果,确保奶粉中的蛋白质含量符合法规要求或产品标准。
一、实验目的了解等电聚焦的原理。通过蛋白质等电点的测定,掌握聚丙烯酰胺凝胶垂直管式等电聚焦电泳技术。二、实验原理等电聚焦(Isoelectric focusing,简称IEF)是六十年代中期出现的新技术。近年来等电聚焦技术有了新的进展,已迅速发展成为一门成熟的近代生化实验技术。目前等电聚焦技术已可以分辨等电点(pI)只差0.001pH单位的生物分子。由于其分辨力高,重复性好,样品容量大,操作简便迅速,在生物化学、分子生物学及临床医学研究中得到广泛的应用。蛋白质分子是典型的两性电解质分子。它在大于其等电点的pH环境中解离成带负电荷的阴离子,向电场的正极泳动,在小于其等电点的pH环境中解离成带正由荷的阳离子,向电场的负极泳动。这种泳动只有在等于其等电点的pH环境中,即蛋白质所带的净电荷为零时才能停止。如果在一个有pH梯度的环境中,对各种不同等电点的蛋白质混合样品进行电泳,则在电场作用下,不管这些蛋白质分子的原始分布如何,各种蛋白质分子将按照它们各自的等电点大小在pH梯度中相对应的位置处进行聚焦,经过一定时间的电泳以后,不同等电点的蛋白质分子便分别聚焦于不同的位置 。这种按等电点的大小,生物分子在pH梯度的某一相应位置上进行聚焦的行为就称为“等电聚焦”。等电聚焦的特点就在于它利用了一种称为两性电解质载体的物质在电场中构成连续的pH梯度,使蛋白质或其他具有两性电解质性质的样品进行聚焦,从而达到分离、测定和鉴定的目的。两性电解质载体,实际上是许多异构和同系物的混合物,它们是一系列多羧基多氨基脂肪族化合物,分子量在300~1000之间。常用的进口两性电解质为瑞典Pharmacia-LKB公司生产的Ampholine 和Pharmalyte,价格昂贵。国产的有中国军事医学科学院放射医学研究所和上海生化所生产的两性电解质,价格便宜,质量尚佳。两性电解质在直流电场的作用下,能形成一个从正极到负极的pH值逐渐升高的平滑连续的pH梯度。若不同的pH值的两性电解质的含量与pI值的分布越均匀,则pH梯度的线性就越好。对Ampholine两性电解质的要求是缓冲能力强,有良好的导电性,分子量要小,不干扰被分析的样品等。在聚焦过程中和聚焦结束取消了外加电场后,如保持pH梯度的稳定是极为重要的。为了防止扩散,稳定pH梯度,就必须加入一种抗对流和扩散的支持介质,最常用的这种支持介质就是聚丙烯酰胺凝胶。当进行聚丙烯酰胺凝胶等电聚焦电泳时,凝胶柱内即产生pH梯度,当蛋白质样品电泳到凝胶柱内某一部位,而此部位的pH值正好等于该蛋白质的等电点时,该蛋白质即聚焦形成一条区带,只要测出此区带所处部位的pH值,即为其等电点。电泳时间越长,蛋白质聚焦的区带就越集中,越狭窄,因而提高了分辨率。这是等电聚焦的一大优点,不像一般的其他电泳,电泳时间过长则区带扩散。所以等电聚焦电泳法不仅可以测定等电点,而且能将不同等电点的混合的生物大分子进行分离和鉴定。早期的等电聚焦电泳是垂直管式的,其特点是体系是封闭的,不与空气接触,可防止样品氧化。近年来,又发展了超薄层水平板式等电聚焦电泳。此法的优点是加样数量多,节省两性电解质,电泳后固定、染色、干燥都十分迅速简便,其最大优点是防止了电极液的电渗作用而引起正负两极pH梯度的漂变。测定pH梯度的方法有四种:1.将胶条切成小块,用水浸泡后,用精密pH试纸或进口的细长pH复合电极测定pH值,然后作图。2.用表面pH微电极直接测定胶条各部分的pH值,然后作图。3.用一套已知不同的pI值的蛋白质作为标准,测定pH梯度的标准曲线。4.将胶条于-70℃冰冻后切成1mm的薄片,加入0.5ml 0.01M KCl,用微电极测其pH。三、仪器和用具1.电泳仪2.垂直管式园盘电泳槽一套3.注射器与针头4.移液管:10ml、5ml、2ml、1ml、0.1ml5.小烧杯若干6.培养皿一套7.直尺8.小刀9.精密pH试纸和带细长复合pH电极的pH计10.塑料薄膜和橡皮筋
用MALDI-TOF测定蛋白质的分子量时,假设一种蛋白质的准确分子量为50KDa,那么用MALDI-TOF测得的结果在50KDa上下浮动多少范围算是比较准确的?谢谢各位专家的回答!
各位老师好: 有没有测定红糖中蛋白质测定的?我们测定了一个样含量2.3,比正常的红糖高,请有经验的老师给指点一下谢谢! 急!