
 400-803-2799
400-803-2799
 留言咨询
留言咨询
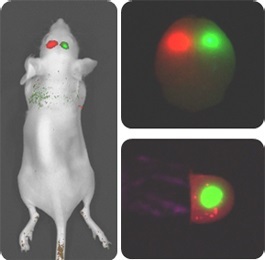
 留言咨询
留言咨询

 400-860-5168转2255
400-860-5168转2255
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 留言咨询
留言咨询

 留言咨询
留言咨询
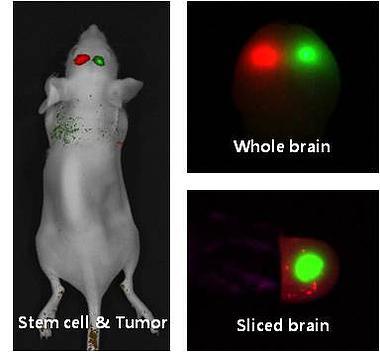
 400-860-5168转4032
400-860-5168转4032
 留言咨询
留言咨询

 400-860-5168转4783
400-860-5168转4783
 留言咨询
留言咨询
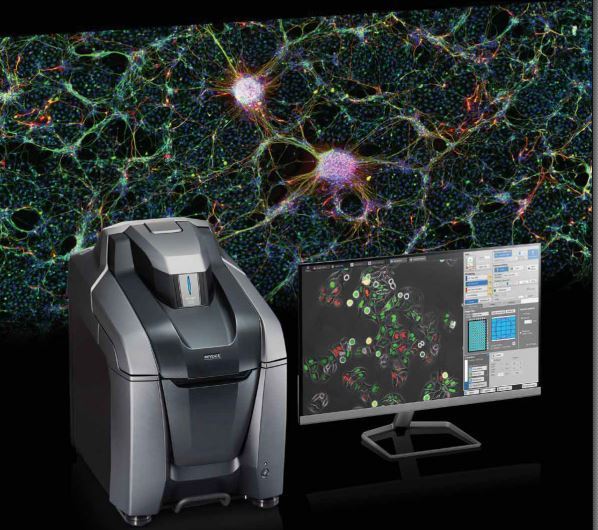
 400-801-8191
400-801-8191
 留言咨询
留言咨询

 留言咨询
留言咨询

 400-860-5168转2042
400-860-5168转2042
 留言咨询
留言咨询

 400-877-0075
400-877-0075
 留言咨询
留言咨询

 400-860-5168转2623
400-860-5168转2623
 留言咨询
留言咨询

 留言咨询
留言咨询

 400-860-5168转2387
400-860-5168转2387
 留言咨询
留言咨询

 400-860-5168转0927
400-860-5168转0927
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转4470
400-860-5168转4470
 留言咨询
留言咨询

 400-860-5168转0700
400-860-5168转0700
 留言咨询
留言咨询

 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转4783
400-860-5168转4783
 留言咨询
留言咨询

 400-860-5168转4662
400-860-5168转4662
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转4470
400-860-5168转4470
 留言咨询
留言咨询

 400-860-5168转4032
400-860-5168转4032
 留言咨询
留言咨询

 400-860-5168转2831
400-860-5168转2831
 留言咨询
留言咨询