电位滴定法关于指示电极的选择问题:沉淀滴定中以硝酸银滴定卤素离子可用银电极,也可用离子选择电极。那么以氯化钙滴定银离子为什么要用铂电极,而不能用银电极,为什么?谢谢大家。
电位滴定法与永停滴定法电位滴定法与永停滴定法是容量分析中用以确定终点或选择核对指示剂变色域的方法。选用适当的电极系统可以作氧化还原法、中和法(水溶液或非水溶液)、沉淀法、重氮化法或水分测定法等的终点指示。 电位滴定法选用2支不同的电极。1支为指示电极,其电极电势随溶液中被分析成分的离子浓度的变化而变化;另1支为参比电极,其电极电势固定不变。在到达滴定终点时,因被分析成分的离子浓度急剧变化而引起指示电极的电势突减或突增,此转折点称为突跃点。 永停滴定法采用2支相同的铂电极,当在电极间加一低电压(例如50mV)时,若电极在溶液中极化,则在未到滴定终点前,仅有很小或无电流通过;但当到达终点时,滴定液略有过剩,使电极去极化,溶液中即有电流通过,电流计指针突然偏转,不再回复。反之,若电极由去极化变为极化,则电流计指针从有偏转回到零点,也不再变动。仪器装置 电位滴定可用电位滴定仪、酸度计或电位差计,永停滴定可用永停滴定仪或按图示装置。 电流计的灵敏度除另有规定外,测定水分时用10A/格,重氮化法用10A/格。所用电极可按下表选择。 ────────┬──────────┬────────────── 方 法 │ 电 极 系 统 │ 说 明 ────────┼──────────┼────────────── 水溶液氧化还原法│ 铂-饱和甘汞 │铂电极用加有少量三氯化铁的硝 │ │酸或用铬酸清洁液浸洗 ────────┼──────────┼────────────── 水溶液中和法 │玻璃-饱和甘汞 │ ────────┼──────────┼────────────── 非水溶液中和法 │玻璃-饱和甘汞 │饱和甘汞电极套管内装氯化钾的 │ │饱和无水甲醇溶液。玻璃电极用 │ │过后应即清洗并浸在水中保存 ────────┼──────────┼────────────── 水溶液银量法 │ 银-玻璃 │银电极可用稀硝酸迅速浸洗 ├──────────┼────────────── │银-硝酸钾盐桥-饱和甘│ │汞 │ ────────┼──────────┼────────────── -C≡CH中氢置换法│玻璃-硝酸钾盐桥-饱和│ │甘汞 │ ────────┼──────────┼────────────── 硝酸汞电位滴定法│铂-汞-硫酸亚汞 │铂电极可用10%(g/ml)硫代硫酸 │ │钠溶液浸泡后用水清洗。汞-硫 │ │酸亚汞电极可用稀硝酸浸泡后用 │ │水清洗。────────┼──────────┼──────────────永停法 │铂-铂 │铂电极用加有少量三氯化铁的硝 │ │酸或用铬酸清洁液浸洗 ────────┴──────────┴──────────────滴定法 (1)电位滴定法 将盛有供试品溶液的烧杯置电磁搅拌器上,浸入电极,搅拌,并自滴定管中分次滴加滴定液;开始时可每次加入较多的量,搅拌,记录电位;至将近终点前,则应每次加入少量,搅拌,记录电位;至突跃点已过,仍应继续滴加几次滴定液,并记录电位。 滴定终点的确定 用坐标纸以电位(E)为纵坐标,以滴定液体积(V)为横坐标,绘制E-V曲线,以此曲线的陡然上升或下降部分的中心为滴定终点。或以△E/△V(即相邻两次的电位差和加入滴定液的体积差之比)为纵坐标,以滴定液体积(V)为横坐标,绘制(△E/△V)-V曲线,与△E/△V的极大值对应的体积即为滴定终点。也可采用二阶导数确定终点。根据求得的△E/△V值,计算相邻数值间的差值,即为△E/△V,绘制(△E/△V)-V曲线,曲线过零时的体积即为滴定终点。 如系供指示剂变色域的选择核对,滴定前加入指示剂,观察终点前至终点后的颜色变化,以选定该品种终点时的指示剂颜色。 (2)永停滴定法 用作重氮化法的终点指示时,调节R使加于电极上的电压约为50mV。取供试品适量,精密称定,置烧杯中,除另有规定外,可加水40ml与盐酸溶液(1→2)15ml,而后置电磁搅拌器上,搅拌使溶解,再加溴化钾2g,插入铂-铂电极后,将滴定管的尖端插入液面下约2/3处,用亚硝酸钠滴定液(0.1mol/L或0.05mol/L)迅速滴定,随滴随搅拌,至近终点时,将滴定管的尖端提出液面,用少量水淋洗尖端,洗液并入溶液中,继续缓缓滴定,至电流计指针突然偏转,并不再回复,即为滴定终点。用作水分测定的终点指示时,可调节R使电流计的初始电流为5~10μA,待滴定到电流突增至50~150μA,并持续数分钟不退回,即为滴定终点。
请问永停滴定法产生的电极电位怎样计算啊?是不是测量的电流就是产生的电动势所引起的?
咨询一下水质铝的电位滴定法,大家用的是哪一款电位滴定仪,用到的电极式“四苯硼酸根离子电极”和“217型双液接参比电极”
求助下载《氟离子电极作指示电极自动电位滴定法测定氟》 谢谢http://www.cnki.com.cn/Article/CJFDTotal-FXHX197805006.htm

【生活中的仪器分析】活动原创作品:食品安全——月饼卫生大检测 月饼中酸值、过氧化值的自动电位滴定法按GB/T5009.56-2003的标准方法并按照http://bbs.instrument.com.cn/shtml/20130907/4952019/所讲述提取月饼中的油脂后,分别用自动电位滴定仪来自动滴定其油脂的酸值、过氧化值。酸值是油脂中游离脂肪酸含量的标志,月饼在长期保存过程中,由于微生物、酶和热的作用发生水解,产生游离脂肪酸。其滴定原理较简单,就是普通的酸碱滴定。过氧化值是评价油脂中氢过氧化物的多少,油脂在空气氧化过程是一个动态平衡过程,在油脂氧化生成氢过氧化物的同时,还存在着氢过氧化物分解和聚合,氢过氧化物的含量增加到一定值,分解和聚合速度都会增加。油脂的过氧化值测定主要评价的是油脂中氢过氧化物的含量,无法了解其中分解与聚合产物的多少。但是,在油脂氧化的初期,采用过氧化值可以合理评价各种油脂的氧化情况。滴定法测定过氧化值的原理:碘化钾与冰乙酸反应生成氢碘酸,氢碘酸被油脂中的氢过氧化物氧化成碘分子(I2),利用硫代硫酸钠标准溶液与碘分子的氧化-还原反应,从而达到定量评价油脂中的氢过氧化物多少的目的。相关化学式:http://ng1.17img.cn/bbsfiles/images/2013/09/201309100520_463357_2166779_3.png目前国标法酸价、过氧化值的检测用的是手工滴定法,手工滴定法在滴定过程中的滴定速度、摇动的程度、终点的判断及滴定管的读数等都可能给结果带来一定的误差。电位滴定法是基于定量化学反应,依据待测离子的活度与其电极电位之间的关系,利用微电脑程序自动控制滴定过程,并通过测量滴定过程中电池电动势的变化,确定终点的自动滴定分析方法。由于它操作方便,具有加液准确(1/20 000的体积分辨率)、指示灵敏(无需指示剂)、搅拌均匀的特点,能够自动滴定控制,自动数据处理,测试误差小,可大大提高分析效率。1 材料与方法1.1 实验原理 电位滴定法是借助于电极电位的变化来确定终点的滴定方法,通过更换不同的电极可应用于各种类型的滴定反应。根据导数计算的原理,对得到的图谱求解一阶导数,以纵坐标的极值处即加入单位体积的滴定剂时,电位变化率最大的点所对应的横坐标体积为滴定终点体积,用于计算。1.2 主要仪器与材料 905Titrando电位滴定仪(瑞士Metrohm公司, 配备tiamo工作站);电极:复合氧化还原电极、复合非水酸碱滴定电极;FA1604电子天平,自动加液器(10mL);超纯水0.01mol/L硫代硫酸钠标液;0.05mol/L异丙醇氢氧化钾(钠)标液;市售月饼数份;月饼提取油脂;1.3 样品的测定 酸价: 称取约3~5g月饼提取的油脂,加入25mL煮沸去除二氧化碳的中性乙醇液,用C(KOH)=0.1的异丙醇溶液滴定至等当点,使用非水复合酸碱电极指示终点。过氧化值:称取约3~5g月饼提取的油脂, 加入50mL乙酸+异辛烷(3+2),0.5mL饱和碘化钾,于暗处放置1min后, 加入30mL水,用0.01mol/L硫代硫酸钠标液滴定至终点,使用氧化还原电极指示终点。2 结果与讨论2.1 建议先取一份油脂进行预滴定,根据滴定结果设定合适的预加液体积, 以加快滴定速度, 防止样品氧化。2.2 根据搅拌器的实际状况, 选择合适的搅拌速度, 使得油类样品既能均匀分散于溶剂中, 又不会产生气泡影响电极的响应。2.3 在放置与测定过程中, 应注意将烧杯口封闭, 防止操作过程中样品的氧化,使得酸价和过氧化值的检测结果偏高。2.4 月饼样品的检测结果2.4.1 酸值的检测结果 分别取两个不同月饼样品按1.3的方法进行月饼提取油脂酸值的测定,用自动电位滴定法与手工滴定法分别进行测定, 其结果见表1。从表1可看出: 自动电位滴定法的结果平行性较好, 手工滴定的结果略高于自动滴定的结果, 这是由于在滴定终点的判断上,对指示剂的变色范围的视觉误差产生的。表1 自动滴定与手工滴定酸值的检测结果http://ng1.17img.cn/bbsfiles/images/2013/09/201309100521_463362_2166779_3.pnghttp://ng1.17img.cn/bbsfiles/images/2013/09/201309100521_463363_2166779_3.pnghttp://ng1.17img.cn/bbsfiles/images/2013/09/201309100521_463364_2166779_3.pnghttp://ng1.17img.cn/bbsfiles/images/2013/09/201309100521_463365_2166779_3.png
咨询一下水质铝的电位滴定法,大家用的是哪一款电位滴定仪,用到的电极式“四苯硼酸根离子电极”和“217型双液接参比电极”
①酸碱滴定 用pH电极或锑电极指示溶液pH的变化 ②氧化还原滴定 用Pt电极或石墨电极作指示电极,可用KMnO4滴定I-、NO2‑ 、Fe2+、V4+、Sn2+、C2O42-等,可用K2Cr2O7滴定Fe2+、Sn2+、I-和Sb3+ ③沉淀滴定 银量法用银电极作指示电极,可用AgNO3滴定I-、SCN-、S2-、CN-和一些有机酸阴离子。汞量法用汞电极为指示电极,可用Hg(NO3)2滴定Cl-、I-、SCN-和C2O42-等。用铂电极作指示电极可用K4[Fe(CN)6]滴定Pb2+、Cd2+、Zn2+、Ba2+,还可间接测定SO42-等 ④配位滴定法 以EDTA滴定Fe3+时可用Pt/Fe3+, Fe2+作指示电极。以EDTA滴定Ca2+时,用Ca2+膜电极作指示电极。在试液中加入Cu-EDTA,用铜离子选择性膜电极作指示电极,可用EDTA滴定多种离子如Bi3+、Cd2+和Ca2+等
电位滴定法的优点:电位滴定法一般具有较高的准确度和精密度,但分析时间较长。由于电位滴定法测量的是随滴定剂加入而引起的电池电动势的变化,而不是电动势的绝对值,即使电极的斜率少有变化,也不影响测量结果。而其液接电位和活度系数的变化很小,等当点附近电位突跃较大,容易准确测定终点。电位滴定法的缺点:电位滴定的运用也有一定的局限性:其灵敏度受低浓度时电极电位测量准确度的限制,浓度低于10[sup]-5[/sup] mol/L时,残余电流成为零电流电位法中的干扰因素。因此,若溶液浓度低于10[sup]-3[/sup] mol/l时,就需要采用其他滴定方法,才能保证一定准确度。[em0910]
电位滴定法和永停滴定法有何联系和区别?两者的使用范围有何不同呢?哪种方法更为实用呢?
教学目的:1、掌握酸碱滴定突跃范围和影响突越范围的因素。2、掌握一元酸碱和多元酸碱能被滴定的条件和判断能否被滴定的原则。3、熟悉选择指示剂(或混合指示剂)的原则。4、理解一元强酸滴定一元强碱,一元强碱(酸)滴定一元弱酸(碱)滴定过程中pH的变化情况(酸碱滴定曲线)。5、了解多元酸和多元碱的滴定。教学重点与难点:一元酸碱能被滴定的条件。教学内容: 一、方法简介什么是酸碱滴定法?酸碱滴定法(acid-base titration):利用酸碱间的反应来测定物质含量的方法。例如:NaOH + HCl NaCl + H2O根据等物质的量的规则:Cb·Vb = C a·VaCHCl·VHCl = CNaOH·VNaOH1、作为滴定分析化学反应必须满足以下几点:①反应要有确切的定量关系,即按一定的反应方程式进行,并且反应进行的完全;②反应要迅速完成,对速度慢的反应,有加快的措施;③主反应不受共存物干扰,或有消除的措施;④有确定理论终点的方法;2、进行滴定分析必须具备以下条件:①准确称量—天平,定容体积的器皿;②标准溶液;③确定理论终点的指示剂。
做砼外加剂中氯离子含量电位滴定法用什么电极?
目前一般实验室滴定分析采用的是人工滴定法,它是根据指示剂的颜色变化指示滴定终点,然后目测标准溶液消耗体积,计算分析结果。自动电位滴定法是通过电位的变化,由仪器自动判断终点。为了比较仪器和人工滴定方法的测定结果,我们选用了酸价和过氧化值两个指标,分别用自动电位滴定法和人工滴定法进行样品分析。 1 实验部分 1.1 自动电位滴定法的实验仪器 瑞士万通(METROHM)751GPD自动电位滴定仪 727磁力搅拌滴定台 10ml交换单元 6.0431.100Pt电极 6.0133.100pH玻璃电极 6.0729.100Ag/AgCl参比电极 6.0331.0Pt辅助电极 1.2 人工滴定法 按照GB/T5009.37—1996的方法测定样品中的酸价和过氧化值。 2 实验结果与讨论 2.1 两种滴定方法的测定结果对照 自动电位滴定法和人工滴定法测定植物油的酸价和过氧化值结果无显著性差异,表明自动电位滴定仪测定植物油酸价和过氧化值,与现行的国家卫生标准滴定方法结果相近。 2.2 两种滴定方法的精密度比较 选用酸价值较高的样品,分别用自动电位滴定法和人工滴定法平行测定5次,自动电位滴定法测定的相对标准偏差1.1%,人工滴定法为1.6% 平行测定酸价值较低的样品5次,自动电位滴定法测定的相对偏差为2.1%,而人工滴定法的相对标准偏差高达11.4%,表明自动电位滴定法的精密度优于人工滴定法。综上所述,自动电位滴定法测定结果与国标法无异,精密度达到检验要求。由于自动电位滴定法是根据滴定曲线的一阶导数确定终点,等当点与终点的误差非常小,准确度高,避免了人工滴定法由于要加指示剂可能因加入量、指示终点与等当量间、操作者对颜色判断等的误差 电动定位滴定法无须使用指示剂,故对有色溶液、浑浊度以及没有适合指示剂的溶液均可测定 Metrohm自动电位滴定仪可判断多达9个等当点,可以连续滴定溶液中的多个成分,如连续滴定水样中Ca2+、Mg2+,滴定混合酸。自动电位滴定仪还能对滴定分析的各种测定参数,例如测定日期、仪器型号、滴定用标准溶液的消耗量、滴定曲线作自动记录,并自动计算打印出测定结果作为原始记录保存,减少了分析者原始记录数据处理的工作量和运算差错,提高了实验室间分析结果的可比性,有利于实验室管理,因此适于理化分析实验室用作代替人工操作的分析仪器。
电位滴定法测定氯离子和碘离子 1.实验目的 (1)用电位滴定法测定氯离子和碘离子的含量。 (2)掌握电位滴定法终点的确定方法和实验技术。2.实验原理电位滴定法利用电极电位的“突跃”指示滴定终点。电位滴定终点的确定,不必知道终点电位的确定值。只要测得电位值的变化,就可通过作图法或二阶微商法确定滴定终点。氯化银、碘化银的溶度积分别为AgCl: Ksp = 1×10-10 mol2.L-2 AgI: Ksp = 1×10-16 mol2.L-2用硝酸银进行滴定含氯离子和碘离子的试液时,先生成碘化银沉淀,当碘化银沉淀完全后,开始生成氯化银沉淀。本实验以硝酸银为滴定剂,基于银离子与碘离子和银离子分步沉淀原理进行测定。以银-氯化银电极为指示电极,玻璃电极为参比电极,通过测量滴定过程中电位的变化,测定待测溶液中碘离子和银离子的浓度。滴定过程中,溶液pH不发生变化,pH玻璃电极可作为参比电极。滴定过程中,有两个电位“突跃”。每次滴定下1.0 mL;在终点附近的量,电位值变化较大时,每次可滴下0.10 mL,以便于微商法的计算和获得准确的测定结果。3.仪器与试剂高输入阻抗电位计(或pH记,或离子计,或ZD-2型自动电位滴定仪),银-氯化银电极;pH玻璃电极。200 mL烧杯;10 mL移液管。0.10 mol.L-1AgNO3标准溶液:准确称取110℃干燥的AgNO3(GR)8.6 g于500 mL烧杯中,用约200 mL不含Cl-的蒸馏水溶解,转入500 mL容量瓶中,再用不含Cl-的蒸馏水定容。计算其浓度。配制的溶液装入棕色瓶中暗处保存。电位滴定时,稀释成0.050 mol.L-1 AgNO3标准溶液。含氯离子和碘离子的试液(各含约0.01 mol.L-1)。4.实验步骤移取10.00 mL含氯离子和碘离子的试液于200 mL烧杯中,放入搅拌子,加入80 mL蒸馏水,将电极浸入试液中,以银-氯化银电极为指示电极,pH玻璃电极为参比电极①,用0.050 mol.L-1 AgNO3标准溶液进行滴定,大概估计滴定终点。记录消耗AgNO3标准溶液的体积和电位测定值。平行测定三次。5.数据处理(1)以消耗AgNO3标准溶液的体积(V)为横坐标,以测得的电位(E)为纵坐标,绘制E-V曲线,再绘制一次微分 曲线和 曲线,确定终点体积。(2)计算试液中氯离子和碘离子的浓度和测定结果的相对平均偏差。注释①参比电极也可使用双盐桥电极(外套管内装1 mol.L-1 KNO3溶液)或用内含1 mol.L-1 KNO3溶液的盐桥连接的饱和甘汞电极。思考题1.银电极、银离子选择电极或氯离子选择电极可否用作指示电极?为什么?2.pH玻璃电极为什么可用作参比电极?3.用本实验的方法可否连续测定氯离子、溴离子和碘离子? 陕西师范大学分析化学研究所
电位滴定法快速测定糠醛* 刘俊峰 易平贵 金一粟 摘 要 试验用改良硫酸法由稻草(或麦杆)制取糠醛,用电位滴定法测定糠醛蒸馏液中糠醛的含量及产品的纯度,给出了滴定终点的选择依据.方法简便易行,准确度达到工业分析的要求.图2,表3,参5.关键词 糠醛 电位滴定 条件分类号 TQ201THE QUICK METHOD TO DETERMINE FURFURAL BY ELECTROMETRIC TITRATION Liu Junfeng Yi Pinggui Jin Yisu(Dept. of Chemical Eng. of Xiangtan Mining Institute,Xiangtan ,Hunan,China,411201)ABSTRACT The electrometric titration to determine furfural has been discussed. It also studied the determination method ,the principle, the procedure, the cause for selecting the titration end to determine the pure level of the product and the content of furfural in the distillation liquid produced from straw of rice(or straw of wheat) by the modified sulfuric acid catalytic method. The results show that the method is simple and convenient and its accuracy reaches to the industrial analysis standard.2figs.,3tabs.,5refs.Key words electrometric titration, furfural,conditionSynopsis of the author Liu Junfeng, male, born in 1957, M.E., associate professor, original chemical technology and industrial catalyst. 羰基化合物的测定常见的方法主要有羟胺法、亚硫酸氢钠加成法和2,4-二硝基苯腙重量法[1].上述测定方法有的操作繁杂,有的终点褪色迅速,准确度较差.电位滴定法在羟基苯甲醛产品的分析测定中具有简单、快速、干扰较小等优点[2,3].本文讨论了改良硫酸法制取糠醛产品的测试方法,结果表明,用电位滴定法测定馏出液中糠醛的含量和产品的纯度,结果准确、方法简便易行.1 试验1.1 测定原理[4] 先用NaOH部分中和盐酸羟胺,生成的游离羟胺部分与羰基化合物形成肟,剩余的游离羟胺用盐酸标准溶液回滴,由空白和试样溶液滴定之差值计算试样中糠醛的百分含量.反应如下: 1.2 主要仪器、试剂和溶液 1) 主要仪器 自动电位滴定仪(精度pH=0.01),饱和甘汞电极,玻璃指示电极. 2) 氢氧化钠乙醇溶液( CNaOH=0.75 mol/L) 加入42.0g氢氧化钠(质量分数50%)溶液于688mL乙醇(质量分数95%)中. 3) 羟胺溶液 溶解40.0g盐酸羟胺(NH2OH.HCl)于160mL水中,用95%乙醇溶液稀释至1 L,再加入400 mL浓度为0.75 mol/L氢氧化钠溶液,混匀. 4) 盐酸标准溶液(CHCl=0.250 mol/L) 配制与标定按GB6014.2条进行.1.3 测定步骤与结果计算 称取2.0g(准确至0.0002g)试样于干燥的150mL烧杯中,加入10.0mL含量为95%乙醇,溶解后再加入13mL水,准确吸取25.00mL羟胺溶液至试样中,搅拌反应20min.放入玻璃电极和甘汞电极,在已校正好的酸度计上用0.2500mol/L的盐酸标准溶液滴定至溶液pH值为3.55时终止滴定,消耗体积为V1;除不加试样外,以同样的方法测定25.00mL羟胺溶液空白,消耗体积为V0,计算结果如下: 式中:w糠醛,糠醛的质量分数,%;V0,空白试液消耗盐酸标准溶液体积,mL;V1,被测试样滴定消耗盐酸标准溶液体积,mL;C,盐酸标准溶液浓度,mol/L;m,试样质量,g;系数0.096 09为糠醛的毫摩尔质量,g.2 结果与讨论2.1 测定方法的选择 试验结果发现,对于改良硫酸法制取糠醛产物中醛含量的分析,用亚硫酸氢钠法终点褪色迅速;如用羟胺法直接滴定则无明显滴定突跃,使得终点判断相当困难.唯有羟胺法的间接滴定法终点突跃较为明显,但样品本身的颜色对此法干扰较大,对于颜色较深的样品不适用. 如采用仪器检测法测定样品中的糠醛,由于试样中存在的无机离子和水分在[url=https://insevent.instrument.com.cn/t/Mp]气相色谱仪[/url]FID检测器上无响应,故归一化结果均偏高.因试样(特别是久置后)本身具有颜色,用可见或紫外吸收光谱仪测定均存在不同程度的干扰而造成结果准确度较差.所以最终选择了电位滴定法.2.2 滴定终点的确定 试验了不同量羟胺溶液滴定后终点pH值的变化,结果如图1. 由图1可知终点pH值分别为3.70、3.58、3.50.根据取样量计算,当试样反应完全后,羟胺剩余量大于15 mL,因此选择pH为3.55时作为滴定终点.计算得此条件下的终点误差约为0.02 mL. 盐酸标准溶液体积/mLa.5mL羟胺溶液滴定曲线(终点pHo 3.70)b.15mL羟胺溶液滴定曲线(终点pHo 3.58)c .25mL羟胺溶液滴定曲线(终点pHo 3.50)图1 羟胺溶液滴定曲线Fig.1 Curve of determining hydroxy amine2.3 滴定反应时间的选择 羰基化合成肟反应一般需30min方能完全,少数情况要在70 ℃以上水浴中进行.本法采用搅拌方式以加快反应速度.测定了室温条件下不同反应时间分析结果的稳定性,如图2.由图2可见,在室温搅拌反应20 min即能满足要求. 图2 不同反应时间糖醛测定含量Fig.2 Content of furfural according different reaction time2.4 测定方法的准确度 采用含量为99.00%的糠醛样品进行准确度试验.在所给试验条件下,测得其含量为99.02%,回收率为100.2%.然后用99.00%含量的糠醛配置标准样品,标样含量为55.26%,实测结果为55.13%,回收率99.76%(见表1),相对误差均符合工业分析公差[5]. 表1 分析方法准确度测定结果 Tab.1 Results of accuracy of the analysis method样品含量/%测定值/%平均值/%回收率/%平均误差/%相对误差/%样品含量/%测定值/%平均值/%回收率/%平均误差/%相对误差/%99.0099.1599.2599.1899.2299.20100.20.0350.2055.2655.1655.1255.1155.1399.760.0200.242.5 试样测定 1) 馏出液糠醛含量的测定 按本试验得出的测定条件,对8批蒸出液先用NaOH中和至pH值与空白试液相同,然后进行糠醛含量的测定,结果见表2. 表2 试样平行测定结果 Tab.2 Results of determination of parallel samples样品号测定值/%平均值/%相对偏差/%样品号测定值/%平均值/%相对偏差/%12.18 2.222.200.0251.561.491.530.0321.961.991.980.0261.641.541.590.0531.881.841.860.0271.411.321.370.0441.721.651.690.0381.361.271.320.04 由表2可见,采用本法两次平行测定结果差值不大于0.2%,相对偏差在0.1%以下. 2) 糠醛产品测定 用上述同样的方法,对连续10批产品进行测定,结果如表3. 表3 产品中糠醛含量测定结果 Tab.3 Determining results of furfural content in products 样品号测定值/%平均值/%相对偏差/%样品号测定值/%平均值/%相对偏差/%196.84 96.8096.820.02696.7296.9096.960.06297.3297.4197.370.05799.3699.2099.280.08395.1695.1095.130.03897.0296.9096.960.06498.2198.1298.170.05997.8297.7697.790.03599.1099.0199.060.041097.7697.5897.670.09 由表3可见,采用本法平行测定结果差值、相对偏差均符合工业分析标准. 3 结论 本法操作简便、仪器简单、准确度、精密度均能满足工业分析要求,可用于糠醛产品质量检测和改良硫酸法生产中糠醛蒸馏液醛含量的分析. *湖南省“八五”科技攻关项目(编号:01-942-57)第一作者简介 刘俊峰 男 42岁 硕士 副教授 有机化工与工业催化剂作者单位:湘潭矿业学院化学工程系,湖南湘潭,411201参考文献 1 西北师院等校编.有机分析教程.北京:人民教育出版社,1978.306~309 2 刘俊峰,易平贵,李晓湘.电位滴定法测定间羟基苯甲醛.分析化学,1996,24(9):1111 3 魏玉鹏.电位滴定法测定对羟基苯甲醛.江苏化工,1992,20(2):45~46 4 兰州大学化学系等编.有机微量定量分析.北京:科学出版社,1978.306~309 5 田景君.分析化学.北京:化学工业出版社,1979.113收稿日期:1998-10-25
电位滴定法快速测定糠醛* 刘俊峰 易平贵 金一粟 摘 要 试验用改良硫酸法由稻草(或麦杆)制取糠醛,用电位滴定法测定糠醛蒸馏液中糠醛的含量及产品的纯度,给出了滴定终点的选择依据.方法简便易行,准确度达到工业分析的要求.图2,表3,参5.关键词 糠醛 电位滴定 条件分类号 TQ201THE QUICK METHOD TO DETERMINE FURFURAL BY ELECTROMETRIC TITRATION Liu Junfeng Yi Pinggui Jin Yisu(Dept. of Chemical Eng. of Xiangtan Mining Institute,Xiangtan ,Hunan,China,411201)ABSTRACT The electrometric titration to determine furfural has been discussed. It also studied the determination method ,the principle, the procedure, the cause for selecting the titration end to determine the pure level of the product and the content of furfural in the distillation liquid produced from straw of rice(or straw of wheat) by the modified sulfuric acid catalytic method. The results show that the method is simple and convenient and its accuracy reaches to the industrial analysis standard.2figs.,3tabs.,5refs.Key words electrometric titration, furfural,conditionSynopsis of the author Liu Junfeng, male, born in 1957, M.E., associate professor, original chemical technology and industrial catalyst. 羰基化合物的测定常见的方法主要有羟胺法、亚硫酸氢钠加成法和2,4-二硝基苯腙重量法[1].上述测定方法有的操作繁杂,有的终点褪色迅速,准确度较差.电位滴定法在羟基苯甲醛产品的分析测定中具有简单、快速、干扰较小等优点[2,3].本文讨论了改良硫酸法制取糠醛产品的测试方法,结果表明,用电位滴定法测定馏出液中糠醛的含量和产品的纯度,结果准确、方法简便易行.1 试验1.1 测定原理[4] 先用NaOH部分中和盐酸羟胺,生成的游离羟胺部分与羰基化合物形成肟,剩余的游离羟胺用盐酸标准溶液回滴,由空白和试样溶液滴定之差值计算试样中糠醛的百分含量.反应如下: 1.2 主要仪器、试剂和溶液 1) 主要仪器 自动电位滴定仪(精度pH=0.01),饱和甘汞电极,玻璃指示电极. 2) 氢氧化钠乙醇溶液( CNaOH=0.75 mol/L) 加入42.0g氢氧化钠(质量分数50%)溶液于688mL乙醇(质量分数95%)中. 3) 羟胺溶液 溶解40.0g盐酸羟胺(NH2OH.HCl)于160mL水中,用95%乙醇溶液稀释至1 L,再加入400 mL浓度为0.75 mol/L氢氧化钠溶液,混匀. 4) 盐酸标准溶液(CHCl=0.250 mol/L) 配制与标定按GB6014.2条进行.1.3 测定步骤与结果计算 称取2.0g(准确至0.0002g)试样于干燥的150mL烧杯中,加入10.0mL含量为95%乙醇,溶解后再加入13mL水,准确吸取25.00mL羟胺溶液至试样中,搅拌反应20min.放入玻璃电极和甘汞电极,在已校正好的酸度计上用0.2500mol/L的盐酸标准溶液滴定至溶液pH值为3.55时终止滴定,消耗体积为V1;除不加试样外,以同样的方法测定25.00mL羟胺溶液空白,消耗体积为V0,计算结果如下: 式中:w糠醛,糠醛的质量分数,%;V0,空白试液消耗盐酸标准溶液体积,mL;V1,被测试样滴定消耗盐酸标准溶液体积,mL;C,盐酸标准溶液浓度,mol/L;m,试样质量,g;系数0.096 09为糠醛的毫摩尔质量,g.2 结果与讨论2.1 测定方法的选择 试验结果发现,对于改良硫酸法制取糠醛产物中醛含量的分析,用亚硫酸氢钠法终点褪色迅速;如用羟胺法直接滴定则无明显滴定突跃,使得终点判断相当困难.唯有羟胺法的间接滴定法终点突跃较为明显,但样品本身的颜色对此法干扰较大,对于颜色较深的样品不适用. 如采用仪器检测法测定样品中的糠醛,由于试样中存在的无机离子和水分在[url=https://insevent.instrument.com.cn/t/Mp]气相色谱仪[/url]FID检测器上无响应,故归一化结果均偏高.因试样(特别是久置后)本身具有颜色,用可见或紫外吸收光谱仪测定均存在不同程度的干扰而造成结果准确度较差.所以最终选择了电位滴定法.2.2 滴定终点的确定 试验了不同量羟胺溶液滴定后终点pH值的变化,结果如图1. 由图1可知终点pH值分别为3.70、3.58、3.50.根据取样量计算,当试样反应完全后,羟胺剩余量大于15 mL,因此选择pH为3.55时作为滴定终点.计算得此条件下的终点误差约为0.02 mL. 盐酸标准溶液体积/mLa.5mL羟胺溶液滴定曲线(终点pHo 3.70)b.15mL羟胺溶液滴定曲线(终点pHo 3.58)c .25mL羟胺溶液滴定曲线(终点pHo 3.50)图1 羟胺溶液滴定曲线Fig.1 Curve of determining hydroxy amine2.3 滴定反应时间的选择 羰基化合成肟反应一般需30min方能完全,少数情况要在70 ℃以上水浴中进行.本法采用搅拌方式以加快反应速度.测定了室温条件下不同反应时间分析结果的稳定性,如图2.由图2可见,在室温搅拌反应20 min即能满足要求. 图2 不同反应时间糖醛测定含量Fig.2 Content of furfural according different reaction time2.4 测定方法的准确度 采用含量为99.00%的糠醛样品进行准确度试验.在所给试验条件下,测得其含量为99.02%,回收率为100.2%.然后用99.00%含量的糠醛配置标准样品,标样含量为55.26%,实测结果为55.13%,回收率99.76%(见表1),相对误差均符合工业分析公差[5]. 表1 分析方法准确度测定结果 Tab.1 Results of accuracy of the analysis method样品含量/%测定值/%平均值/%回收率/%平均误差/%相对误差/%样品含量/%测定值/%平均值/%回收率/%平均误差/%相对误差/%99.0099.1599.2599.1899.2299.20100.20.0350.2055.2655.1655.1255.1155.1399.760.0200.242.5 试样测定 1) 馏出液糠醛含量的测定 按本试验得出的测定条件,对8批蒸出液先用NaOH中和至pH值与空白试液相同,然后进行糠醛含量的测定,结果见表2. 表2 试样平行测定结果 Tab.2 Results of determination of parallel samples样品号测定值/%平均值/%相对偏差/%样品号测定值/%平均值/%相对偏差/%12.18 2.222.200.0251.561.491.530.0321.961.991.980.0261.641.541.590.0531.881.841.860.0271.411.321.370.0441.721.651.690.0381.361.271.320.04 由表2可见,采用本法两次平行测定结果差值不大于0.2%,相对偏差在0.1%以下. 2) 糠醛产品测定 用上述同样的方法,对连续10批产品进行测定,结果如表3. 表3 产品中糠醛含量测定结果 Tab.3 Determining results of furfural content in products 样品号测定值/%平均值/%相对偏差/%样品号测定值/%平均值/%相对偏差/%196.84 96.8096.820.02696.7296.9096.960.06297.3297.4197.370.05799.3699.2099.280.08395.1695.1095.130.03897.0296.9096.960.06498.2198.1298.170.05997.8297.7697.790.03599.1099.0199.060.041097.7697.5897.670.09 由表3可见,采用本法平行测定结果差值、相对偏差均符合工业分析标准. 3 结论 本法操作简便、仪器简单、准确度、精密度均能满足工业分析要求,可用于糠醛产品质量检测和改良硫酸法生产中糠醛蒸馏液醛含量的分析. *湖南省“八五”科技攻关项目(编号:01-942-57)第一作者简介 刘俊峰 男 42岁 硕士 副教授 有机化工与工业催化剂作者单位:湘潭矿业学院化学工程系,湖南湘潭,411201参考文献 1 西北师院等校编.有机分析教程.北京:人民教育出版社,1978.306~309 2 刘俊峰,易平贵,李晓湘.电位滴定法测定间羟基苯甲醛.分析化学,1996,24(9):1111 3 魏玉鹏.电位滴定法测定对羟基苯甲醛.江苏化工,1992,20(2):45~46 4 兰州大学化学系等编.有机微量定量分析.北京:科学出版社,1978.306~309 5 田景君.分析化学.北京:化学工业出版社,1979.113收稿日期:1998-10-25
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=94642]电位滴定法与手工滴定法比较[/url]
用酸碱滴定法检测糕点总酸的实验报告如何做
如何用电位滴定法测染发剂中的氧化物?
[size=4]请各位帮忙找找原因: 用GB/T12457-2008中的电位滴定法测盐分,试剂都是按照GB配置的,没有问题,但是标定的时候,用0.01mol/L氯化钠基准溶液10ml+0.2ml(1:3)的硝酸溶液+25ml丙酮,结果滴定到终点时消耗硝酸银标准滴定溶液体积的数值分别为0.81ml、0.71ml(分别测了2次)按照公式6来算:10*0.01/0.81=0.12 10*0.01/0.71=0.14和配置的0.2mol/L相差很远,不明白怎么回事,确定溶液没有问题,滴定到终点时消耗硝酸银标准滴定溶液体积的数值是梅特勒电位滴定仪EQ模式下,自动计算出来的。电极是复合电极(甘汞+银)[/size]
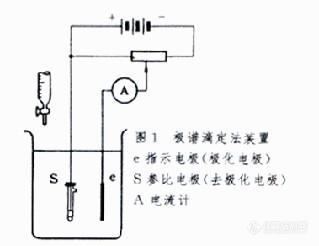
利用电解池中电流的变化指示滴定终点的电滴定分析方法。分为一个极化电极的安培滴定法和两个极化电极的安培滴定法。用滴汞电极为极化电极的一个极化电极的安培滴定法称为极谱滴定法。两个极化电极的安培滴定法称为死停终点法或双安培滴定法。 极谱滴定法是基于极谱法的原理在一定外加电压下滴加标准溶液,藉观察滴定过程中扩散电流的改变以确定滴定终点的容量滴定法。极谱滴定法装置就是一台简易极谱仪加一支滴定管( 图1 )。溶液中被测离子于一定的外加电压下在滴汞电极上还原(或氧化),此时由于浓差极化产生扩散电流。随着被测离子与滴定剂反应浓度越来越低,在滴汞电极上还原(或氧化)而产生的扩散电流越来越小,达到滴定终点时,扩散电流降至零。若将滴定剂体积与每加一次滴定剂后相应的电流读数作图,可得一直线。过滴定终点之后再将滴定剂体积与加滴定剂后的相应电流作图,又得一直线。将所得两条直线延长相交,交点所对应的滴定剂体积即为滴定终点。此法的优点是:①适用范围广,可用于沉淀反应、络合反应和氧化还原反应 ;② 适用浓度范围宽 , 测量范围为0.1~10-4摩尔/升(mol/L)。缺点是 :① 选择性差,易受其他物质干扰;②操作麻烦。 双安培滴定法的装置和图1相似, 两个电极都是铂电极,串联一个电流计指示电流。外加电压一般为几十毫伏。当滴定至电流发生突变时,表示滴定终点到达。滴定曲线的形状取决于滴定体系的可逆性程度( 图2 )。双安培滴定法可用于沉淀反应、络合反应和氧化还原反应。在双安培滴定法中,应用较广的是碘滴定法 ,此外 ,在铈量法测定As3+和Sb3+离子 ,银量法测定卤素离子和CN- 离子也常用此法指示终点 , 此外,也常用来指示库仑滴定法的终点。双安培滴定法的特点是装置简单,准确快速。[img]http://ng1.17img.cn/bbsfiles/images/2010/04/201004221500_213989_1604460_3.jpg[/img]
在GB210中,电位滴定法滴定氯化物时,空白如何滴定,请举例说明。
最近想用电位滴定法测定食品中的氯化钠,初步想法是加一个银电级和一个参比电极,但不知曲线做出后怎样计算,请哪位老师教教,我们用的是普通的pH电极带mv的
用电位滴定法测氯时,溶剂能直接使用冰乙酸吗?电位法分析对溶剂有什么要求?
请哪位老师帮忙告诉我电位滴定法(非水滴定)测定苏氨酸的终点电位值
电位滴定法和人工滴定法二者有什么优缺点?那位老师知道?
请问络合滴定中用电位滴定法分步滴定两种离子,其lg(Kc)值之差为多少才能使得滴定曲线有两个突跃呀??
滴定法是最常用的化学分析方法。在滴定中,只要被测组分、滴定剂或反应生成物中的任何一个在紫外光区有特征吸收,并遵守朗伯-比尔定律,就可通过滴定体系的吸光度的变化来指示滴定过程和滴定终点,这就是紫外分光光度滴定法。分光光度滴定法不仅适用紫外光区,也适用可见光区和红外光区。在滴定后,以滴定剂的用量为横坐标,以滴定体系的吸光度为纵坐标,绘制分光光度滴定曲线。滴定曲线中两条直线的交点就是滴定终点。由滴点终点所示的滴定剂体积和浓度,就可计算样品溶液中待测组分的含量或浓度。 分光光度滴定法准确、灵敏和精密度高(相对误差可0.1%),且有适用范围广和可实现自动滴定等特点。有人用这个做过吗
用酸碱滴定法测定工业醋酸中的乙酸含量,应选择( )作指示剂。 (A)酚酞(B)甲基橙 (C)甲基红 (D)甲基红—次甲基蓝
药典酸碱滴定法公式,有没有通用的,或者这些公式是不是一样,要去怎么解释,例如,磁石