请问用凝胶成像能不能代替激光扫描仪进行同工酶活性百分数的测定?能打出谱图吗?
用于原辅料进场检验的拉曼或近红外手持式扫描仪,光纤型,隔着塑料薄膜包装袋检测,有什么型号,报价多少?
棱镜式激光扫描切割与载物台移动式激光扫描切割的区别
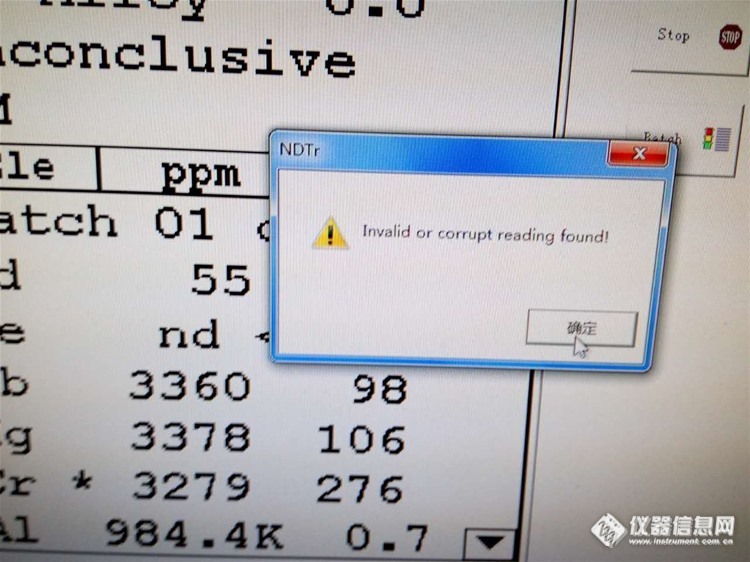
各位版友老师,今天一台扫描仪出现了故障,烦请各位老师解答一下这是什么原因。谢谢!设备为一台手持式,型号:Niton XLt797WZ错误代码为:NDT Unknown type received=0。Invalid r corrupt reading found。http://ng1.17img.cn/bbsfiles/images/2016/03/201603261907_588309_2190021_3.jpghttp://ng1.17img.cn/bbsfiles/images/2016/03/201603261907_588310_2190021_3.jpg
条码扫描模组在外国已经使用很久了,现在已经发展到中国内部。这种技术的发明带来了更多的工作改革潮流。促进了自动化的步伐,大大简化人类工作流程,减少更多的脑力负担。扫描模组属于二次开发产品,兼备识别条码并加以扫描和解码的功能,然后还可以植入更多的应用行业的功能程序。外形构造小巧,高度集成材料,可以置入手机、平板电脑,打印机和一些医疗设备等各行各业的机械设备中。一般情况,条码扫描模组分为二大类,第一个就是激光扫描模组,第二个就是红光扫描模组。 现在对激光扫描模组进行分析下,激光扫描模组是通过辐射出一个激光光源点,然后按照激光发射的原理打成激光光线照遭条码上,在经过解码转化成为数字信号,加而给电脑读取信息。但是相对于红光扫描模组来说就比价精确点了。在强烈的阳光下,一般情况都是用激光扫描模组,因为红光不是红外线,就是单单的红色的光。阳光中可以算什么光线都有,会对红光扫描模组发射出来的LED灯光造成很大的影响,导致扫描的结果不准确。 如果在结构上来说呢,红光扫描模组要比激光扫描模组好一点而且价格实惠。激光扫描模组里面的结构是靠点胶固定的机械装置,因此就有很大的结构固定,易碎行,抗硬性就不是很好了。红光扫描模组里面就没有一些所谓的机械装置固定,所以耐用性比价好,但是总体来说,激光扫描模组的用途是比较多的,红光的就有很多局限性。看个人的用处所在. 本文出自 www.yuanjingda.com 转载请注明出处!
求教鞋类同行,鞋类重金属扫描需要手持式扫描仪,目前各鞋类同行用的扫描牌子的XRF?我们的鞋子出口美国,需要符合加州65好法案,需要扫描铅,镉,汞等重金属,最好还能分析PVC.鞋材种类很多,需要测试纺织品,金属,非金属类,如橡胶,塑料类,需要测真皮及合成皮.求教鞋类同行高手,我们是鞋类贸易公司.
[url=http://www.f-lab.cn/microscopes-system/dplsm.html][b]差分偏光激光扫描显微镜[/b][/url]differential polarization laser-scanning microscope (DPLSM)具有[b]扫描光学显微镜[/b]和[b]分光偏振计[/b]的双重优点,可提供逐像素地实施的生物样本的各向异性数据,在记录生物组织图像强度的同时,能够实时地提供高精度的生物样品的各向异性组织的逐个像素的数据。差分偏光激光扫描显微镜采用模块化设计,可以直接安装到用户现有的激光扫描显微镜上,不用担心改变原来的光路和电子。我公司提供方便安装的差分偏光激光扫描显微镜DPLSM模块,可直接安装到激光扫描显微镜上,不需要改变电路和光路就可使用差分偏光激光扫描显微镜DPLSM功能。差分偏光激光扫描显微镜:[url]http://www.f-lab.cn/microscopes-system/dplsm.html[/url]
[b][font='Microsoft YaHei', 宋体, sans-serif]【序号】:1[/font]【作者】:[/b][font=&][size=12px][color=#1c1d1e][b]周一览[/b][/color][/size][/font][font='Microsoft YaHei', 宋体, sans-serif][b][b][/b][/b][/font][font=&]【题名】:[/font][b][b][color=#333333][b][font=&][color=#032d2c][b]共聚焦激光扫描显微镜的研制[/b][/color][/font][/b][/color][/b][/b][font=&]【期刊】:[/font][font=Arial][font=&][size=12px]CNKI[/size][/font][/font][font='Microsoft YaHei', 宋体, sans-serif][color=#545454][b]【链接】:[url=https://link.springer.com/book/10.1007/978-0-387-45524-2]共聚焦激光扫描显微镜的研制 - 中国知网 (cnki.net)[/url][/b][/color][/font]
摘要激光扫描共聚焦显微镜作为80年代发展起来的一种高精度分子细胞生物学分析仪器,具有组织细胞断层扫描、活细胞动态荧光监测、三维图像重建、共聚焦图像定量分析等先进功能,在近年的细胞凋亡这一研究热点中得到了大量创造性的应用。本文拟就对激光扫描共聚焦显微镜在凋亡的形态学、分子水平变化及重要生理过程三方面研究中的应用及其成果做一综述。细胞凋亡(apoptosis)是不同于细胞坏死的一种细胞主动死亡方式,并由特定的基因控制。凋亡细胞在形态上出现变圆皱缩、染色质浓缩边集、核碎裂、凋亡小体形成等变化,并最终由非炎症过程清除。由于细胞凋亡独特地影响着机体的细胞发育和代谢,在监测和清除肿瘤细胞与突变细胞等方面也可能发挥重要的作用,近年来受到了细胞生物学、分子生物学、免疫学等多学科的广泛关注。激光扫描共聚焦显微镜(laser scaing confocal microscopy, LSCM)是80年代发展起来的一种高精度分子细胞生物学分析仪器,辅以各类免疫荧光探针或荧光染料与被测物质特异性结合,不仅可观察固定的细胞组织切片,还可对活细胞的结构、分子和离子进行实时动态地观察和检测。在细胞凋亡的研究中,激光扫描共聚焦显微镜已被广泛地应用于形态学、分子水平监测及重要生理改变等各方面,其中不乏新颖之处,并获得了大量成果,以下将就此做一简单的介绍。激光扫描共聚焦显微镜与凋亡的形态学激光扫描共聚焦显微镜用点光源扫描标本的光学横断面,以代替普通光学显微镜所使用的场光源,并用探测针孔滤去离焦光线,所以消除了来自焦平面以外的衍射或散射光的干扰,可实现高清晰、高分辨率的组织细胞断层扫描。并且由于激光扫描共聚焦显微镜采用数字化成像,因而辅以一定的软件就能对图像进行定量分析及三维重建等操作。过去对细胞凋亡的形态学研究方法局限于活性细胞和组织切片染色、荧光镜观察,或者石蜡切片原位末端标记法。由于普通光镜的分辨率和清晰度有限,而电镜又显然不适合对凋亡这一复杂动态过程的监测,激光扫描共聚焦显微镜的应用使人们对细胞凋亡的形态学观察分析提高到了一个前所未有的新水平。细胞核核膜的破坏对于染色质聚集并形成凋亡小体起重要作用。lamin是构成核片层的蛋白质,位于核膜的内表面,由caase-6介导的lamin裂解可影响核膜的完整性。在McCall等的研究中,对果蝇卵子发生晚期的细胞凋亡现象进行了动态观察。以单抗mAb101标记其哺育细胞核内膜的laminDm0(哺乳类laminB的同源体),用激光扫描共聚焦显微镜加以观察。正常哺育细胞到11期时,染色的lamin呈弥散的雾状分布并围绕核周,而dcp-1GLC哺育细胞即使到了较晚的14期时,仍然显示界线明确的染色。可见dcp-1突变体在核lamin蛋白的酶切或解聚方面存在缺陷。细胞器Li 等在对C(6)-酰基鞘氨醇诱导胞内囊泡产生的研究中,在不产生中毒效应的情况下,加入10microM C(6)-酰基鞘氨醇以诱导鼠纤维母细胞(3T3-L1和3T3-F442A)凋亡。观察到囊泡的形成与C(6)-酰基鞘氨醇的诱导呈时间依从和剂量依从关系。大量小泡在其加入后8小时内出现,并且随时间而增大;大泡最终分布在核周,而小泡分布在细胞边缘。用抗-溶酶体膜蛋白抗体和共聚焦免疫荧光显微分析,证明增大的囊泡为晚期内吞体/溶酶体。另外,胞内的细胞器都有其适用的荧光探针,如高尔基复合体常用的探针有Dceramide、BODIPY ceramide等,内质网常用的有Dil、DiOC6等,经标记均可进行精细的观察。当然,激光扫描共聚焦显微镜在形态学中的优势更在于其对图像的三维重建功能,从而揭示过去只能在平面上显现的凋亡细胞在三维空间中的结构;而对细胞凋亡的动态过程,它可以用三维加时间的四维方式进行观察,来获取最逼真的形态学资料。凋亡过程中一些特征性的三维形态变化正期待着进一步具体的工作去发现。激光扫描共聚焦显微镜对凋亡细胞的分子水平监测随着分子生物学突飞猛进的发展,关于细胞凋亡分子机制的研究已有了很大的突破。细胞凋亡的信号传递途径及其调控涉及到大量的酶级联反应、生物大分子的空间转移等。而激光扫描共聚焦显微镜以其定性、定量、定时的优点,结合众多荧光探针的应用,成为了研究细胞凋亡分子水平变化的有力手段。DNA大分子DNA断裂以及染色质的异常凝聚,是细胞凋亡的关键,同时也是细胞核在细胞凋亡中具有标志性的变化。Columbara等报道将激光扫描共聚焦显微镜与原位TdT和Poll免疫荧光技术相结合,进而确定双链和单链DNA的断裂点。而在对细胞凋亡和细胞坏死区别的研究中,Kreel等在培养的K562细胞中加入放线菌素D以诱导凋亡,并对细胞的DNA片段进行了3’-末端标记。经激光扫描共聚焦显微镜观察发现K562细胞凋亡早期有大量DNA片段出现,且DNA片段弥散分布于除核仁外的细胞核区。伴随着凋亡的进展,细胞核内出现大量高标记密度的圆形小体。而采用NaN3或快速冻融法使细胞坏死,经激光扫描共聚焦显微镜观察证实,在坏死开始阶段并无DNA片段的出现,至少在坏死发生24小时后才有DNA片段产生。Caase家族Caases是一组高度保守的半胱氨酸蛋白酶,目前发现有11个成员。多数细胞凋亡是以Caase家族蛋白的激活并作用于其关键底物而实现的,而caases激活的关键又在于该家族蛋白间的级联反应,因此caases被认为是细胞凋亡的中心环节和执行者,成为研究的热点。Mandal等用激光扫描共聚焦显微镜对细胞凋亡中激活的caase-3的重分布进行了研究。用丁酸处理细胞后,观察到DNA-PKcs的裂解与caase-3的激活成正相关,而Bcl-2的过度表达则可抑制上述两个过程。同时还证明(1)激活后的caase-3重分布到核区,(2)裂解局部的DNA-PKcs和PARP(polyADP-ribosepolymerase,聚腺苷二磷酸核糖多聚酶),(3)裂解产物又被释放到核外的细胞液。caase-3的抑制物四肽DEVD-CHO又可抑制上述的三个连续的步骤。该研究提示:激活的caase-3在核内的重分布构成了丁酸所诱导的细胞凋亡中的一个重要凋亡信号。另外,在用激光扫描共聚焦显微镜对Q79诱导大鼠神经元凋亡的研究中,Sanchez等发现了Q79对caase-8的聚集和激活,而对caase-8的抑制则阻止了被诱导的细胞凋亡;加以Westernblot分析,还建立了caase-8的激活和某些神经退行性疾病(如舞蹈病)的联系。Grazyme丝氨酸蛋白酶grazyme为另一种重要的凋亡信号分子,对某些caase家族蛋白也有激活作用。Trapani等就证明了杀伤淋巴细胞利用穿孔素和grazymeB的协同作用来诱导靶细胞的凋亡,在其研究中通过激光扫描共聚焦显微镜观察到(1)50%细胞的胞核内快速聚集了以FITC荧光标记的grazymeB(最长7分钟,t1/2为2分钟),然后发生凋亡;(2)其它的细胞只有细胞液内有FITC-grazyme B的摄取,避免了凋亡。此间至少在13分钟后才有DNA碎片的出现,说明核内的grazyme B聚集出现在凋亡的执行阶段之前。并且通过对核内液的处理(加入70KDa FITC-dextran),间接观察到grazyme B的转移并非是因为核膜受caases的作用而破损,而是由于穿孔素的协同。其它以上的介绍显示,激光扫描共聚焦显微镜在检测活细胞酶活性动态变化方面有着突出的优势。实际上,对于细胞凋亡的分子机制这样一个极其复杂的课题,激光扫描共聚焦显微镜的应用远不只限于上述的几种离子和大分子,而是渗透到了大量的分枝课题中去。如在对重要的凋亡负调控蛋白Bcl-2的研究中,Beham等利用基因毒性损害(genotoxic damage)诱导细胞凋亡,并以Bcl-2蛋白抑制其凋亡过程。用激光扫描共聚焦显微镜和Immunoblotting观察显示,Bcl-2的作用在于阻止了诱导产生的p53蛋白向核内的转运。而Ohsawa等对独立于caase家族的另一种重要蛋白酶—组织蛋白酶进行了研究,用血清剥夺法诱导PC12细胞凋亡,并用激光扫描共聚焦显微镜监测了其精细超微结构改变过程和细胞内组织蛋白酶B和D的免疫活度的对比变化。又如,在人胰岛淀粉样多肽(hIA)的研究中,Hiddinga等用表达hIA的质粒转染COS-1细胞诱导凋亡,辅以免疫组化染色,用激光扫描共聚焦显微镜证明了hIA在细胞的内质网和高尔基复合体内呈簇状沉积,并与细胞
一、在细胞及分子生物学中的应用1. 细胞、组织的三维观察和定量测量 共聚焦显微镜的分辨率超过普通光学显微镜,染色过程简便,可以在活细胞上进行无创伤性的染色,最大程度地维持细胞的正常形态。多种自发性的荧光染料,已被广泛地用于诸如RNA、DNA细胞核、线粒体、内质网、肌动蛋白、细胞膜等结构的标记。运用免疫荧光技术,将不同波长的两三种荧光物质标记在内部不同结构的相应抗体上,以这几种荧光物质特定的光谱特性选择激发光和滤光片,则可以观察到细胞内部各结构间的毗邻关系。特别是在荧光着丝点易被遮盖(如荧光原位杂交实验)的情况下,这种三维图像的多角度观察提供了极大的优越性。细胞有丝分裂中细胞核内染色体数目(双倍体、多倍体)、形态和位置的变化,一直是细胞生物学肿瘤研究中的热点。着丝点是细胞核内的重要结构,被认为在有丝分裂中起重要的作用,应用共聚焦显微镜的定量测量技术,可以较精确地测定着丝点在不同分裂期的位置。共聚焦显微镜生成厚度小于0.2微米的依次相连的光学切片,即使较厚的组织的三维数据也可被计算机获取,运用适当的图像分析软件,可以测量并确定所观察结构的表面特征,体积等参数,为相互结合定量测量提供了新手段。2. 活细胞生理信号的动态监测:活细胞的功能监测在细胞生物学、神经生理学、药理学等领域都有重要意义。许多荧光染料可以聚集在细胞的特定结构,而对细胞的活性基本上不产生影响。可以利用这一特性来反映细胞受到刺激后形态或功能的改变。如亲脂性染料DiOC6(3)主要聚集在内质网,且对细胞的毒副作用极小。肌细胞中的肌浆网与ER有相同的属性,是胞内钙库,应用共聚焦显微镜,就可以动态观察肌细胞兴奋时SR的变化。许多参与神经元兴奋传导的离子如K+、Na+、Ca2+及H+、Cl-、Mg2+ 等,都有其自发性的荧光染料。Ca2+ 在细胞的兴奋、分化、死亡等过程中都起重要作用,是许多生理反应的胞内第二信使,是目前研究得最为充分的离子; 通过激光扫描共聚焦显微镜对胞内、核内钙转移的研究、对心肌细胞的钙变化研究、免疫细胞钙信号的研究、对Ca2+信号在凋亡细胞中作用的研究都取得了可喜的结果,而更多的研究则是将激光扫描共聚焦显微镜应用于神经生物学中对神经元Ca2+动态测量的研究。目前激光扫描共聚焦显微镜以其独特的优势成为钙研究中的重要手段之一。3. 粘附细胞的分选(adherent cell sorting) 对特异细胞的分选和克隆,是研究单个细胞或细胞系生物特性的先决条件。 将细胞贴壁培养在特制培养皿上,培养皿底部有一层特殊的膜,用高能量激光在欲选细胞四周切割成八角形几何形状,掀去培养皿底部的膜,非选择细胞则被去除。目前对粘附细胞分选方法多用于对杂交瘤和突变细胞的分选,也有用于对经转化的平滑肌细胞,卵巢癌细胞及人畸胎瘤干细胞等的分选和克隆,还可用于基因调控、基因治疗等研究。4. 细胞激光显微外科和光陷阱功能: 激光扫描共聚焦显微镜可将激光当作一把“光刀子”使用,完成诸如细胞膜瞬间穿孔,染色体切割,神经元突起切除等一系列细胞外科手术。光镊是利用激光的力学效应,将一个微米级大小的细胞或其它结构钳制于激光束的焦平面上,也称为光陷阱。光镊可以用来进行细胞融合(如卵细胞受精)、机械刺激或细胞骨架弹性测量等,特别是在测量植物细胞的细胞骨架时很有意义。5. 光漂白后的荧光恢复(FRAP): 细胞在相互接触后彼此间即有低阻抗的通道形成,以进行细胞间通讯;被经合成肽测试法证明只允许低于1.5KD分子通过的通道被称作缝隙连接。缝隙连接是存在于相邻细胞间的一类蛋白通道,普遍认为缝隙连接通过介导细胞间的信息传递,在诸如增殖、分化、代谢等过程中发挥极其重要作用。FRAP技术借助脉冲式激光照射细胞的某一区域,从而该区域荧光分子的光淬灭,该区域周围的未淬灭的荧光分子将以一定速率向受照区域扩散,而此扩散速率可通过低强度激光扫描探测。在研究细胞骨架构成、跨膜大分子迁移率、细胞膜流动性、胞间通讯等领域中有较大的意义。6. 在细胞凋亡研究中的应用细胞凋亡是由体内外因素触发细胞内预存的死亡程序而导致的细胞死亡过程,细胞凋亡作为生理性、主动性过程,能够确保正常发育、生长、维持内环境稳定,发挥积极的防御功能。用激光扫描共聚焦显微镜观察凋亡细胞,可见凋亡细胞体积变小,细胞质浓缩,细胞核变小,出现染色质沿核膜内侧排列的核边聚集现象。细胞凋亡的晚期,细胞核裂解为碎块,产生凋亡小体。细胞凋亡(Apoposis)是生物体内广泛存在的,由细胞特定基因控制,以细胞DNA 降解为特征的细胞自发过程,与机体中多种生理及病理过程密切相关。因而,对Apoposis 的研究现已成为研究细胞生物学研究的热点之一。而激光扫描共聚集显微镜结合众多荧光探针的应用,成为细胞Apoposis超微结构及分子水平变化的有力手段。二、在神经科学中的应用1. 定量荧光测定:对活细胞进行定量测定,具有很好的重复性,分析神经细胞和胶质细胞的某些物理及生物化学特性;监测抗原表达,细胞结合和杀伤等特征。在多发性硬化病人大脑活检标本上观察病变组织的微血管内皮细胞特异性地表达。2. 细胞内离子的测定:使用多种荧光探针,对神经细胞的Ca2+、PH及其它各种细胞内离子进行定量和动态分析。3. 神经细胞的形态学观察:激光扫描共聚焦显微镜使用模拟荧光处理,可将系列光学切片的数据合成三维图像,并可从任意角度观察。如Joshi等观察了细胞突触的骨架的三维图像。三维重建图像可使神经细胞及细胞器的形态学结构更加生动逼真。三、在耳鼻喉科学中的应用1. 在内耳毛细胞亚细胞结构研究上的应用:1993年Ikeda等应用激光扫描共聚焦显微镜研究内耳毛细胞的亚细胞结构,用Rhodamine 123染色,见线粒体分布于表皮板下和核下,加入1mmol/L三硝基酚使线粒体膜电位减小,荧光强度明显减弱。用DIOC6(3)染色,观察到内质网分布于表皮板下直至细胞核区域,呈网状、核下及侧膜下也有分布,胞质中则极少,探讨了蛋白激酶(PKC)在三磷酸肌醇/钙信号系统中的作用。2. 激光扫描共聚焦显微镜的荧光测钙技术在内耳毛细胞研究中的应用钙离子在细胞的生命活动中起着重要作用,它参与调节细胞功能,如肌肉收缩,细胞运动,递质合成与释放,信息传递,细胞换能等。激光扫描共聚焦显微镜的荧光测钙技术可探测到细胞内钙浓度的细微变化,当内耳毛细胞受到各种生理及病理因子刺激时,可用荧光测钙技术观察细胞内钙离子浓度的变化。为研究毛细胞的机能提供了新的手段。3. 激光扫描共聚焦显微镜在内耳毛细胞离子通道研究上的应用Issa等用膜片钳的全细胞记录法将Fluo-3已导入毛细胞,用激光扫描共聚焦显微镜观察,当毛细胞去极化时其底部侧膜上平均有18个亮点(钙内流所至),然后对同一毛细胞进行连续超薄切片电镜观察,证明这些亮点即为突触前活性区。4. 激光扫描共聚焦显微镜在嗅觉研究中的应用:Schild等用激光扫描共聚焦显微镜和钙荧光探针研究嗅觉感受器神经元的钙通道分布,以Fluo-3和Fura-red 染色后行双发射比例测量,测出其胞内游离钙呈不均匀分布,观察显示嗅觉感受器神经元的钙通道位于胞体部,与同一部位的钾通道一起构成适应性调节机制,而对树突尖端纤毛的钙依赖性换能过程无干扰。四、在肿瘤研究中的应用激光扫描共聚焦显微镜的出现,在一定程度上推动了肿瘤的研究进展。它为肿瘤细胞生物学、分子生物学、细胞通讯、细胞形态学研究、细胞的抗药物代谢、细胞膜及其受体等领域的研究,提供了有效手段。1. 定量免疫荧光测定:激光扫描共聚焦显微镜采用免疫荧光对肿瘤细胞的抗原表达、细胞结构特征、抗肿瘤药物的作用及机理等方面进行定量的观察和监测,为较理想的形态学观察方法。先采用荧光标记特异性抗原或抗体,使其与特异性抗体或抗原结合,再采用激光扫描共聚焦显微镜对其进行定性、定量和形态学分析。近年来报道较多的是P53肿瘤相关抗原等的定位、定性和定量分析。采用荧光标记某些蛋白分子,然后测定其平均荧光强度和积分荧光强度,从而对某些细胞结构蛋白分子进行定量分析。2. 细胞内离子分析激光扫描共聚焦显微镜可以准确地测定细胞内Ca2+ 、 K+ 、 Na+ 、 Mg2+ 、 pH等
[b][font='Microsoft YaHei', 宋体, sans-serif]【序号】:1[/font]【作者】:[/b][font=&][size=12px][color=#1c1d1e][b][b]魏通达[/b][/b][/color][/size][/font][font='Microsoft YaHei', 宋体, sans-serif][b][b][/b][/b][/font][font=&]【题名】:[/font][b][b][color=#333333][b][font=&][color=#032d2c][b]共聚焦激光扫描光学显微成像关键技术研究[/b][/color][/font][/b][/color][/b][/b][font=&]【期刊】:[/font][font=Arial][font=&][size=12px]CNKI[/size][/font][/font][font='Microsoft YaHei', 宋体, sans-serif][color=#545454][b]【链接】:[url=https://link.springer.com/book/10.1007/978-0-387-45524-2]共聚焦激光扫描光学显微成像关键技术研究 - 中国知网 (cnki.net)[/url][/b][/color][/font]
[b][font='Microsoft YaHei', 宋体, sans-serif]【序号】:1[/font]【作者】:[/b][font=&][size=12px][color=#1c1d1e][b][b]张双翼 徐熙平[/b][/b][/color][/size][/font][font='Microsoft YaHei', 宋体, sans-serif][b][b][/b][/b][/font][font=&]【题名】:[/font][b][b][color=#333333][b][font=&][color=#032d2c][b]激光扫描系统中f-θ透镜的光学设计[/b][/color][/font][/b][/color][/b][/b][font=&]【期刊】:[/font][font=Arial][font=&][size=12px]CNKI[/size][/font][/font][font='Microsoft YaHei', 宋体, sans-serif][color=#545454][b]【链接】:[url=https://kns.cnki.net/kcms/detail/detail.aspx?filename=GXYQ201205010&dbcode=CJFD&dbname=CJFD2012&v=MtjycLTRGnKxILp8twqktbNToUw7nOHEuuWOwWDenuEbA2lD5Pu15j0vTJePCmMS]激光扫描系统中f-θ透镜的光学设计 - 中国知网 (cnki.net)[/url][/b][/color][/font]
知识分享哦~~ 扫描仪的普及率越来越高了,但是这类外设的故障也比较多,而且故障的原因也比较复杂。以往的手持式扫描仪、滚筒式扫描仪现在都不是市场的主流了,而平板扫描仪才是最受欢迎的。就使用寿命来说,平板扫描仪是最长的,其次是滚筒式扫描仪,手持式扫描仪的使用寿命相对较低。这主要是因为这三种扫描仪的内部结构不同,使用方式不同所致。
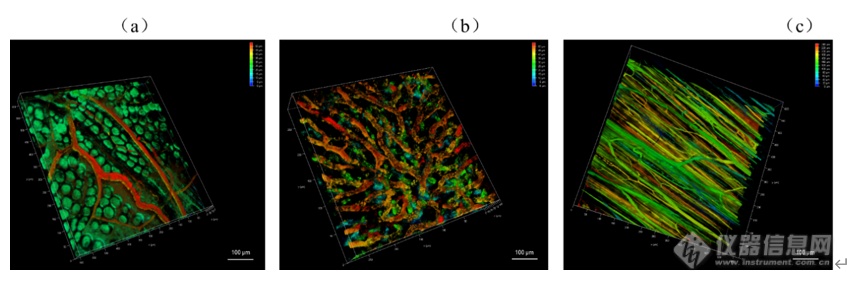
[align=center][b]双光子激光扫描显微镜的检测模式及其在生物医学领域的应用[/b][/align][align=center][font=宋体]刘皎[/font][sup]1[/sup],吴晶[sup]1[/sup][/align][align=center]1. [font=宋体]北京大学医药卫生分析中心,北京,[/font]100191[/align][b][font=黑体][[/font]摘要] [/b]双光子激光扫描显微镜(two-photon laser scan microscope, TPLSM[font=宋体])具有低光毒性、高时空分辨率、高信噪比等优点,结合了激光扫描共聚焦显微镜和双光子激发技术,广泛应用于脑科学、免疫学、肿瘤、胚胎发育等生物医学相关研究领域。本文结合作者所在的北京大学医药卫生分析中心共聚焦平台的工作经验,概述了[/font]TPLSM适用的样本、检测模式以及在生物医学领域的应用,以期为相关科研技术人员提供参考。[b][font=&][Abstract][/font] [/b]Two-photon laser scan microscopy (TPLSM) has the advantages of low phototoxicity, high spatial and temporal resolution, and high signal-to-noise ratio.TPLSM combines laser scanning confocal microscopy with two-photon excitationtechnology and it is widely used in brain science, immunology, tumor, embryodevelopment and other biomedical related research fields. Based on the author'swork experience in the confocal center of Peking University Medical and HealthAnalysis Center, this paper summarizes the applicable samples, detection modesand applications of TPLSM in the biomedical field, in order to provide referencefor related scientific researchers and technicians.[b][font=黑体][[/font]关键词] [/b]显微镜双光子,检测模式,应用[b]1 引言[/b]双光子激发技术的基本原理是在高光子密度情况下,荧光分子可同时吸收2个长波长光子,产生一个一半波长光子去激发荧光分子的相同效果。双光子激光扫描显微镜(two-photon laser scan microscope, TPLSM[font=宋体])在激光扫描共聚焦显微镜的基础上,以红外飞秒激光作为光源,长波长的近红外激光受散射影响小,易穿透标本,可深入组织内部非线性激发荧光,对细胞毒性小且具有高空间分辨率,适合生物样品的深层成像及活体样品的长时间观察成像[/font][1]。使用高能量锁模脉冲激光器,物镜焦点处的光子密度最高,在焦点平面上才有光漂白及光毒性,焦点外不损伤细胞。双光子效应只发生在焦点处,所以双光子显微镜无需共聚焦针孔,也能做到点激发点探测,提高了荧光检测效率[2]。[b][/b]双光子激光扫描显微镜显微镜可以通过XYZ,XYT,XYλ,XYZT,XYλT等多种模式实现多维成像,亦可进行更复杂实验的拍摄,比如二次谐波成像(Second Harmonic Generation Imaging,SHG[font=宋体])、双光子荧光寿命成像([/font]Two-photon Fluorescence Lifetime Imaging Microscopy, TP-FLIM[font=宋体])、荧光寿命[/font]-[font=宋体]荧光共振能量转移成像([/font]FluorescenceLifetime - Fluorescence Resonance Energy Transfer Imaging, FLIM-FRET[font=宋体])等实验以满足对样品的定性、定量、定位、共定位等多维度多功能的研究。[/font]TPLSM已成为生命科学各领域重要的研究工具,可在细胞及亚细胞水平对活体动物的神经细胞形态结构、离子浓度、细胞运动、分子相互作用等生理现象进行直接的长时间成像监测,还能进行光激活染及光损伤等光学操纵,广泛应用于脑科学、免疫学、肿瘤、胚胎发育等生物医学相关研究[3-5]。本文拟通过按TPLSM常见的检测模式分别阐述其在生物医学领域的应用,以其为相关科研技术人员提供参考。[b]2. TPLSM适用的样本[/b]TPLSM适用的样本非常广泛,从液体、固体等形式的材料或制剂、细菌、细胞、细胞团、类器官、组织切片、到各种模式动物(如线虫、果蝇、斑马鱼、小鼠、大鼠、兔、猴等)及其[font=宋体]脑、脊髓、肝脏、肺、皮肤等器官[/font],都可以通过搭载不同载物台进行测试。相对于传统激光扫描共聚焦显微镜200μm的成像深度极限,双光子显微镜成像深度可达800μm,如果是透明化样品可更厚。TPLSM尤其适合活体动物成像,且比小动物荧光成像有更高的分辨率和信噪比,一般TPLSM的XY轴分辨率为200 nm左右,Z轴分辨率为300 nm左右。[b]3. TPLSM的检测模式[/b]3.1 二维成像模式TPLSM可以实现点扫描、点探测,得到生物样品高反差、高分辨率、高灵敏度的二维图像,从而获得细胞/组织等光学切片的物理、生物化学特性及变化。也可以对所感兴趣的区域进行准确的定性、定量及定位分析。激光扫描显微镜的zoom功能,可以用来调节扫描区域的放大倍数。但受物镜分辨率的限制,一味的增大zoom值,不能得到相应的高清图像,需根据实际情况参考piexl size进行设定。TPLSM可以实现XY、XZ或XT的二维成像模式,XT线扫会在后文与XYT时间序列成像一起进行举例说明(图2b)。3.2 三维成像模式3.2.1 Z轴序列三维成像(XYZ)[align=left]TPLSM可沿Z轴方向通过电动载物台的连续扫描对样品进行无损伤的光学切片(XYZ),获得三维立体图像。同理,通过沿Y轴方向连续扫描,可获得连续的XZY图像。如图1所示TPLSM[font=宋体]可以顺利观察到可以观察到血管清晰形态结构:单个胚胎的胎盘微血管(图[/font]1a)、肝脏血窦微血管(图1b)和后肢微血管(图1c)[6]。[/align][align=center][img=,690,230]https://ng1.17img.cn/bbsfiles/images/2022/12/202212151626576232_4807_3237657_3.png!w690x230.jpg[/img][/align][align=center]图1(a)胚胎胎盘微(b)肝脏血窦和(c)后肢的微血管三维成像[/align]3.2.2 时间序列扫描模式(XYT)[align=left]按照一定的时间间隔重复采集,则可实现对该样品的实时监测(XYT)。此类实验可观察组织区域内特异荧光探针标记的单个细胞或细胞内不同部位接受刺激后的整个变化过程。[font=宋体]如图[/font]2[font=宋体]([/font]a[font=宋体]),可以根据微血管[/font]XYT[font=宋体]序列扫描的成像结果中某一血细胞在前后两张图的位置移动和这两帧图的扫描时间间隔计算血流速度。若血流速度很快,[/font]XYT扫描不足以捕捉实际流速,可以使用XT线扫计算。如图2(b),微血管XT扫描图像中绿色荧光背景里的黑色线条代表单个血细胞的流动轨迹,每条线条的横坐标代表血细胞移动的距离(distance / μm[font=宋体]),纵坐标代表此段时间([/font]time/ ms[font=宋体]),根据这两个数据可以计算出单位时间内血细胞的流动速度([/font]μm / ms)[6]。[/align][align=center][img=,690,262]https://ng1.17img.cn/bbsfiles/images/2022/12/202212151627102569_8367_3237657_3.png!w690x262.jpg[/img] [/align][align=center]图2 微血管(a)XYT扫描结果和(b)XT一维扫描结果图像计算血流说明示意图[/align]3.2.3 光谱扫描模式(XYλ/XYΛ)通常配置有可调节接受范围的检测器的TPLSM,可以实现从400nm-800nm的发射波谱扫描。通过配置具有连续可调波长的双光子激光器,还可以实现750nm-1300nm激发波谱扫描。这对于开发研制特殊染料探针的课题来说是很方便、全面的检测功能。3.3四维成像模式(XYZT/XYλT/XYΛT)基于上述三维成像模式,结合时间序列扫描,可以实现TPLSM的四维成像。3.4二次谐波成像(SHG)SHG是一个二阶非线性过程,且一般为非共振过程,适合富含胶原纤维的样本成像,如角膜、鼠尾肌腱、皮肤等。生物组织产生的二次谐波最主要的转换源自胶原,不同生物组织中的二次谐波信号强弱与组织中的胶原含量密切相关,含胶原丰富的组织包括结缔组织和肌肉组织等二次谐波信号也比较强,另外还有一些能产生强二次谐波的生物结构是微管,如细胞分裂中纺锤体。对于具有中心对称性的生物结构,如果局部中心对称性的破坏也会产生二次谐波:在两中心对称介质的界面,不同物态分子的相互作用使局部微观场特性在交界面(如细胞膜)发生突变,从而产生界面二次谐波[7]。除了动物组织外,一些含有特殊分子结构的植物组织也能产生二次谐波。二次谐波显微成像具有高空间分辨率、深成像深度、低损伤、以及对结构对称性的高度敏感性的特点,如果能与其他成像技术结合,将成为生物样品研究的有力工具[8]。3.5双光子荧光寿命成像(TP-FLIM)[9]FLIM技术是研究细胞内生命活动状态的一种非常可靠的方法。荧光寿命是荧光团在返回基态之前处于激发态的平均时间,是荧光团的固有性质,因此其不受探针浓度、激发光强度和光漂白效应等因素影响,且能区分荧光光谱非常接近的不同荧光团,故具有非常好的特异性和很高的灵敏度。此外,由于荧光分子的荧光寿命能十分灵敏地反映激发态分子与周围微环境的相互作用及能量转移,因此FLIM技术常被用来实现对微环境中许多生化参数的定量测量,如细胞中折射率、黏度、温度、pH值的分布和动力学变化等,这在生物医学研究中具有非常重要的意义。目前FLIM技术在细胞生物学中一些重要科学问题的研究、临床医学上一些重大疾病的诊断与治疗研究以及纳米材料的生物医学应用研究等方面均有广泛应用,并取得了许多利用传统的研究手段无法获取的数据。FLIM检测需要脉冲激光,TPLSM带有的高能量锁模脉冲激光器可以满足激发要求。3.6荧光寿命-荧光共振能量转移成像(FLIM-FRET)[10]传统的FRET过程分析通常是基于荧光强度成像来实现,分析的结果容易受光谱串扰的影响。而将FLIM技术应用于FRET过程分析,利用FLIM技术可定量测量这一优势,可非常灵敏地反映供体荧光分子与受体荧光分子之间的能量转移过程。当受体分子与供体之间的距离10nm时,供体的能量转移到受体,受体从基态发生能量跃迁,从而影响供体的荧光寿命。与没有受体分子的时候相比,发生FRET的供体分子的荧光寿命降低。因此,FRET-FLIM联合能够实时监测生物细胞中蛋白质的动态变化,如蛋白质折叠、分子间(蛋白-蛋白,蛋白-核酸)相互作用和细胞间信号分子传递、分子运输以及病理学研究等。[b]4 结论和展望[/b]综上,TPLSM应用灵活,具备多种检测模式,适用于多种样本,亦可实现多种实验目的,如荧光的定量、定性、定位、共定位,动态荧光的测定等。一些特殊的实验模式,将TPLSM在生物医学领域的应用进一步扩大。通过结合其他技术(多手段联合拓展,如膜片钳、原子力显微镜、光电联用等),TPLSM必将成为助力生物医学领域研究的有力工具。双光子荧光成像由于具有天生的三维层析能力以及深穿透能力,在活体生物组织成像上广受欢迎。双光子显微镜镜下空间增大后,可广泛应用于猴、大小鼠、兔等较大的模式动物的活体成像。且可结合电生理技术、光遗传技术,广泛应用于麻醉、清醒或运行行为等生理状态下的动物脑科学神经相关研究,在单细胞、单树突精度上对神经元群体活动进行监控。如结合膜片钳技术,对活体脑组组急性切片神经元进行双光子深层成像[11];结合光遗传技术,实现视觉皮层同一神经元和神经元群体的稳定操控和长期多次重复记录[12];对在健身球上移动的头部固定小鼠小脑进行成像,探讨觉醒状态和运动行为对胶质网络中钙离子的激发的影响[13];结合多种疾病模型,探讨大脑皮层神经元及胶质细胞活性的改变及作用等[14]。随着多种双光子显微镜系统的出现,双光子显微镜成像技术将以其实时、无损地探测、诊断及检测能力,在生物医药及临床医学应用中发挥更大作用。[b]参考文献[/b][1] [font=宋体]李娟[/font],[font=宋体]张岚岚[/font],[font=宋体]吴珏珩[/font].[font=宋体]双光子显微镜的应用优势与维护要素[/font][J].[font=宋体]中国医学装备[/font],2021,18(12):158-163.[2] HendelT,Mank M, Schnell B,et al.Fluorescence changes of genetic calcium indicatorsand OGB1correlated with neural ac tivity and calcium in vivo and in vitro[J].JNeurosci, 2008,28(29):7399-7411.[3] DolginE.What leva lamps and vinaigrette can teach us about cellbiology[J].Nature,2018,555(7696):300-302.[4] Noguchi J,Nagaoka A, Watanabe S,et al.in vivo two-photon uncaging of glutamate revealingthe structure-function relatio nships of dendritic spines in the neocortex ofadult mice[J]. J Physiol,2011,589(Pt 10):2447-2457.[5] BishopD,Nikiél, Brinkoetter M,et al.Nearinfrared branding efficiently correlateslight and electron microscopy[J]. Nat Methods,2011,8(7):568-570.[6] [font=宋体]刘皎[/font],[font=宋体]丛馨[/font],[font=宋体]何其华[/font].[font=宋体]活体小鼠微血管血流倒置双光子激光扫描显微镜检测方法的建立[/font][J].解剖学报,2022,53(02):261-265.[7] [font=宋体]屈军乐[/font],[font=宋体]陈丹妮[/font],[font=宋体]杨建军[/font],[font=宋体]许改霞[/font],[font=宋体]林子扬[/font],[font=宋体]刘立新[/font],[font=宋体]牛憨笨[/font].[font=宋体]二次谐波成像及其在生物医学中的应用[/font][J].[font=宋体]深圳大学学报[/font],2006,(01):1-9.[8] [font=宋体]孙娅楠[/font],[font=宋体]赵静[/font],[font=宋体]李超华[/font],[font=宋体]等[/font].[font=宋体]二次谐波结合双光子荧光成像方法观察人源胶原蛋白透皮吸收情况[/font][J].激光生物学报,2017,26(1):24-29.[9] [font=宋体]刘雄波,林丹樱,吴茜茜,严伟,罗腾,杨志刚,屈军乐,荧光寿命显微成像技术及应用的最新研究进展。物理学报,[/font]2018,67(17):178701-1-178701-14[10] [font=宋体]罗淋淋,牛敬敬,莫蓓莘,林丹樱,刘琳,荧光共振能量转移[/font]-荧光寿命显微成像(FRET-FLIM[font=宋体])技术在生命科学研究中的应用进展。光谱学与光谱分析,[/font]2021,41(4):1023-1031[11] Isom-BatzG,Zimmem PE.Collagen injection for female urinary incontinence after urethralor periurethral surgery[J].J Unol,2009,181(2):701-704.[12] JuN,Jiang R,Mrcknik SL,et al.Long-term all-optical interrogation of corticalneurons in awake-behaving nonhuman prim ates[J].LOSBiology,2018,16(8):e2005839.[13]Nimmerjahn A,Mukamel EA, Schnitzer MJ.Motor behavior activates Bergmann glialnetworks[J].Neuron,2009,62(3):400-412.[23] Huang L, Lafaille JJ, YangG.LearningDependent dendritic spine plasticity is impaired in spontaneousautoimmune encep halomyelitis[J].Dev Neurobiol,2021,81(5):736-745.[14] Huang L,Lafaille JJ,Yang G.LearningDependent dendritic spine plasticity is impaired inspontaneous autoimmune encep halomyelitis[J].Dev Neurobiol, 2021,81(5):736-745.
求助JJG 966-2010 手持式激光测距仪检定规程资料中心的那份太模糊了。
激光扫描共聚焦显微镜还能这么用! 众所周知,激光共聚焦显微镜主要的应用方向在观察活细胞结构及特定分子、离子的生物学变化,而在石笋这样的样品观察上使用激光扫描共聚焦显微镜,可以说脑洞大开了!让我们来看看原文,从Nikon A1激光扫描共聚焦显微镜使用者的角度看看,怎么把这个工具用活了! 激光扫描共聚焦显微镜在古气候纹层学的应用 第一作者:赵景耀 通讯作者:程 海 1984年第一台商业化的激光扫描共聚焦显微镜(Laser Scanning Confocal Microscope,简称 LSCM)出现,随之共聚焦显微镜技术成为了一个热点,并广泛应用在国内外生物和工业检测领域。现今,我们将LSCM首次应用于国内古气候纹层学研究。纹层学一直是古气候研究重要内容,特别是荧光微层在很多古气候载体中是重要的年代标尺和气候指标。2000年,Ribes等首次将LSCM应用于石笋荧光微层研究,发现LSCM分辨率可达1μm,因此,可适用于各种不同厚度的石笋年纹层;2008年,Orland等将LSCM与离子探针采样结合,首次发现了石笋δ18O的季节性信号,并表示以色列Soreq Cave单层δ18O季节波动可达2.15‰;2010年,Dasgupta等通过LSCM识别石笋纹层中的碎屑和粘土层,据此重建了美国明尼苏达州过去3000年极端暴雨事件,发现20世纪全球升温以来,其暴雨频率明显增加;2015年,Wendt利用LSCM,在巴西TBV Cave石笋纹层中发现了罕见的“双纹层”,且均出现在高生长速率的Heinrich事件期间,认为这与Heinrich期间,Intertropical Convergence Zone(ITCZ)南支南移所导致一年内存在2个雨季有关;2015年,Orland等再次将LSCM与离子探针技术应用于中国苦栗树洞石笋研究,发现全新世和B?lling-Aller?d暖期的夏季降水比例明显多于Younger Dryas时期。而目前,国内主要依赖于普通透射光和荧光显微镜,这一定程度上限制了国内古气候学研究。笔者在西安交通大学机械制造系统工程生物制造中心,利用购置的LSCM组件(图1a),观察石笋“年纹层”和砗磲“天纹层”,取得初步认识,以下分别就LSCM及其在古气候荧光微层方面的应用及注意事项作一简介。 图1 激光扫描共聚焦显微镜(LSCM)组件(a)及其原理(b) 1.倒置荧光显微镜(Inverted fluorescence microscope);2.荧光探测器(Flurescence detector);3.激光发生器(Laser generator);4.LSCM总控制器(Main controller);5.扫描头(Head of laser scanner);6.明场及电动载物台开关(Switch of bright-field microscopy and electric stage);7..荧光光源开关(Switch of fluorescent source);8.电动载物台(Electric stage);9.LSCM连接电脑(Computer and Monitor) LSCM以激光为点光源,由照明针孔与探测针孔对被探测点的共轭关系(图1b),实现对被探测点所在焦面的逐点激发,逐点扫描,该技术称为共聚焦。与普通荧光显微镜一次性照明整个视野不同,LSCM通过逐点扫描探测,呈现标本荧光层的2维或3维图像(图2),因此其对不同焦点和焦面的辨析能力,是普通荧光显微镜所不能达到的。其中,图2a中3D切片z轴步进间距(即焦面间距)为3μm,当前仪器上限25nm(仪器型号:Nikon A1)。在LSCM标本纹层成像过程中,放置于探测器前的探测针孔(Pinhole)(图1b)起着关键作用,有效地阻挡了不同焦点带来的杂散光,只有被探测点所发射的荧光透过Pinhole,到达探测器形成图像,这对图像对比度和分辨率有重要影响(图2)。而且LSCM采用光电倍增技术,可将微弱荧光信号进一步放大。综上,利用LSCM可以真正地实现10μm级荧光纹层的清晰辨别,其分辨率和辨识度是普通荧光显微镜所不能实现的,在此基础我们可以观察并辨别10μm左右石笋“年纹层”(图2d)和3~5μm级别砗磲“天纹层”(图2e)。 图2 石笋荧光层3D切片拟合(a)、石笋荧光“年纹层”(b、c和d)和砗磲荧光“天纹层”(e) 所有图像在1024扫描分辨率下,利用波长为488-nm的蓝色激光作为激发光源激发,然后用荧光滤光片滤选发射波长为505~539nm绿色发射光,最终被检测器探测并扫描成像;图片(a)由LSCM连续拍摄31层平行荧光焦面拟合而成,3μm/层;石笋样品(a)和(c)取自湖北省犀牛洞,(b)取自南京葫芦洞,(d)取自吉林省琉璃洞;(e)砗磲取自中国南沙群岛永暑礁 不同于普通光学显微镜,通过制作极薄的显微镜[url=http://www.gengxu.cn]滤光片[/url](≤1mm)实现对于杂散光或荧光焦面的控制。LSCM装配倒置荧光显微镜直接对古气候标本切面观察,源于LSCM对不同焦面荧光信号的精准解析和辨别能力,对于石笋和砗磲等古气候标本,无需制作显微镜薄片,只需将样品切面抛光磨平,即可实现对抛光表面荧光微层和透光微层定焦高分辨率扫描。LSCM极大地简化标本处理,不仅能够更好地节约和保护标本,且能和其他分析(如稳定同位素分析)在同一样品上进行,有利于精细对照,对于古气候研究有重要意义。例如,最近Li等在其他方法精确定年困难的情况下,利用LSCM方法精确确定了近百年石花洞的石笋样品年代序列;对著名的南京葫芦洞样品的初步工作显示,将能够重建上个冰期精细到年的时间序列及气候变化的变率(图2b),而又不破坏极其珍贵的样品。 但是由于LSCM以激光作为光源,在镜下观察过程中发现,根据物镜倍数(10×、20×、40×、60×和100×)不同,导致激光聚光强度不同,会出现不同程度的荧光猝灭,对于常用倍数10×和20×,荧光猝灭微弱,肉眼无法识别,可忽略。但是在60×油镜及以上倍数,荧光猝灭快速,因此在使用过程中,要注意调焦与拍摄时间的平衡。另外,计算机对焦过程是纳米级对焦,在标本前期处理过程中,保证样品观察面平整,是快捷对焦、自动扫描和拼接大图的工作基础。对于目前使用的型号Nikon A1,由于LSCM电动载物台承重和规格限制,以及明场聚光器位置限制(图1a),要求古气候标本观察面≤6cm×6cm,厚度≤5cm,但可根据需要选择不同型号的载物台。最后,由于各种LSCM在许多研究机构和医学院都具备,且使用费用不高,因此进行该研究不必购置新设备。
激光扫描共聚焦显微镜是近十年发展起来的医学图像分析仪器,与传统的光学显微镜相比,大大地提高了分辨率,能得到真正具有三维清晰度的原色图像。并可探测某些低对比度或弱荧光样品,通过目镜直接观察各种生物样品的弱自发荧光。能动态测量Ca2+ 、pH值,Na+、Mg2+等影响细胞代谢的各种生理指标,对细胞动力学研究有着重要的意义。同时激光扫描共聚显微镜可以处理活的标本,不会对标本造成物理化学特性的破坏,更接近细胞生活状态参数测定。可见激光扫描共聚焦显微镜是普遍显微镜上的质的飞跃,是电子显微镜的一个补充,现已广泛用于荧光定量测量,共焦图像分析,三维图像重建、活细胞动力学参数分析和胞间通讯研究等方面,在整个细胞生物学研究领域有着广阔的应用前景。1. 定量荧光测量ACAS可进行重复性极佳的低光探测及活细胞荧光定量分析。利用这一功能既可对单个细胞或细胞群的溶酶体,线粒体、DNA、RNA和受体分子含量、成份及分布进行定性及定量测定,还可测定诸如膜电位和配体结合等生化反应程度。此外,还适用于高灵敏度快速的免疫荧光测定,这种定量可以准确监测抗原表达,细胞结合和杀伤及定量的形态学特性,以揭示诸如肿瘤相关抗原表达的准确定位及定量信息。2. 定量共聚焦图像分析借助于ACAS激光共焦系统,可以获得生物样品高反差、高分辨率、高灵敏度的二维图像。可得到完整活的或固定的细胞及组织的系列及光切片,从而得到各层面的信息,三维重建后可以揭示亚细胞结构的空间关系。能测定细胞光学切片的物理、生物化学特性的变化,如DNA含量、RNA含量、分子扩散、胞内离子等,亦可以对这些动态变化进行准确的定性、定量、定时及定位分析。3. 三维重组分析生物结构ACAS使用SFP进行三维图像重组,SFP将各光学切片的数据组合成一个真实的三维图像,并可从任意角度观察,也可以借助改变照明角度来突出其特征,产生更生动逼真的三维效果。4. 动态荧光测定Ca2+、pH 及其它细胞内离子测定,利用ACAS能迅速对样品的点,线或二维图像扫描,测量单次、多次单色、双发射和三发射光比率,使用诸如Indo-1、BCECF 、Fluo-3等多种荧光探针对各种离子作定量分析。可以直接得到大分子的扩散速率,能定量测定细胞溶液中Ca2+对肿瘤启动因子、生长因子及各种激素等刺激的反应,以及使用双荧光探针Fluo-3和CNARF进行Ca2+和pH的同时测定。5. 荧光光漂白恢复(FRAP)——活细胞的动力学参数荧光光漂白恢复技术借助高强度脉冲式激光照射细胞某一区域,从而造成该区域荧光分子的光淬灭,该区域周围的非淬灭荧光分子将以一定速率向受照区域扩散,可通过低强度激光扫描探测此扩散速率。通过ACAS可直接测量分子扩散率、恢复速度,并由此而揭示细胞结构及相关的机制。6. 胞间通讯研究动物细胞中由缝隙连接介导的胞间通讯被认为在细胞增殖和分化中起非常重要的作用。ACAS可用于测定相邻植物和动物细胞之间细胞间通讯,测量由细胞缝隙连接介导的分子转移,研究肿瘤启动因子和生长因子对缝隙连接介导的胞间通讯的抑制作用,以及胞内Ca2+、PH和cAMP水平对缝隙连接的调节作用。7. 细胞膜流动性测定ACAS设计了专用的软件用于对细胞膜流动性进行定量和定性分析。荧光膜探针受到极化光线激发后,其发射光极性依赖于荧光分子的旋转,而这种有序的运动自由度依赖于荧光分子周围的膜流动性,因此极性测量间接反映细胞膜流动性。这种膜流动性测定在膜的磷脂酸组成分析、药物效应和作用位点,温度反应测定和物种比较等方面有重要作用。8. 笼锁-解笼锁测定许多重要的生活物质都有其笼锁化合物,在处于笼锁状态时,其功能被封闭,而一旦被特异波长的瞬间光照射后,光活化解笼锁,使其恢复原有活性和功能,在细胞的增值、分化等生物代谢过程中发挥功能。利用ACAS可以人为控制这种瞬间光的照射波长和时间,从而达到人为控制多种生物活性产物和其它化合物在生物代谢中发挥功能的时间和空间作用。9. 粘附细胞分选ACAS是目前唯一能对粘附细胞进行分离筛选的分析细胞学仪器,它对培养皿底的粘附细胞有两种分选方法: ① Coolie-CutterTM法,它是Meidian公司专利技术,首先将细胞贴壁培养在特制培养皿上,然后用高能量激光的欲选细胞四周切割成八角形几何形状,而非选择细胞则因在八角形之外而被去除,该分选方式特别适用于选择数量较少诸如突变细胞、转移细胞和杂交瘤细胞,即使百万分之一机率的也非常理想。 ② 激光消除法,该方法亦基于细胞形态及荧光特性,用高能量激光自动杀灭不需要的细胞,留下完整活细胞亚群继续培养,此方法特别适于对数量较多细胞的选择。10. 细胞激光显微外科及光陷阱技术借助ACAS可将激光当作“光子刀”使用,借此来完成诸如细胞膜瞬间穿孔、切除线粒体、溶酶体等细胞器、染色体切割、神经元突起切除等一系列细胞外科手术。通过ACAS光陷阱操作来移动细胞的微小颗粒和结构,该新技术广泛用于染色体、细胞器及细胞骨架的移动。
紧急求购手持式XRF,用于鞋材重金属扫描测试,如扫描铅,镉,汞等八大重金属
在网站上看到的资料,不知道有没有人需要。可以浏览一下[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=27908]激光扫描共聚焦显微镜系统及其在细胞生物学中的应用[/url]
PC-3A 手持式直读式激光粉尘检测仪使用范围: 本仪器为疾病控制中心,卫生监督,环境监测等部门实时快速测量空气中可吸入颗粒物(PM10,PM2.5)浓度的新一代智能化测量仪器。 1.适用于工矿企业劳动部门生产现场粉尘浓度的测; 2.卫生防疫站公共场所可吸入颗粒物的监测; 3.环境环保监测部门大气飘尘检测,污染源调查; 4.市政监烟; 5.科学研究,滤料性能试验等方面现场测试; 6.现场粉尘浓度测定,排气口粉尘浓度监测; 7.药品制造测试; 8.职业健康和安全检测; 9.工厂需要清洁空气的地方,精密仪器,测试仪器,电子部件,食品,药品等制造工艺的管理; 10.各种研究机构,气象学,公众卫生学,工业劳动卫生工程学,大气污染研究等; 11. .建筑或爆破的地方的粉尘检测;工地场所暴露监测; 12.室内空气质量检测。 PC-3A 手持式直读式激光粉尘检测仪原理: 本仪器为光散射法便携式直读(PM10,PM2.5)测量仪器,是根据我国卫生行业标准:“公共场所空气中可吸入颗粒物(PM10)测定方法--光散射法”(WS/T 206-2001)设计。具有测试速度快,灵敏度高,稳定性好,重量轻,噪声低,操作简单,交直流两用等优点。特别适宜于无外电源的场合测量。 PC-3A 手持式直读式激光粉尘检测仪主要技术指标: 1、可吸入颗粒物浓度测量范围:0.001~10mg/ m3 2、可吸入颗粒物径分辨率:0.3μm~10μm 3、可吸入颗粒物检测灵敏度:0.001mg/ 4、时间周期设定:2分钟、5分钟、连续 5、颗粒物计数浓度范围:350~999999粒/升 6、湿度修正范围:90~85%,85~75%,75~60%,60%以下 7、场合选择:居室、室外、公共场合 8、开机噪声:≤15dB 9、辅助功能:数据存储及打印 10、修正系数:0.1~9.9 11、工作电源:5V内置可供连续4小时运行的可充电电池。接电源适配器,可直接使用220V,50Hz交流电源。 PC-3A 手持式直读式激光粉尘检测仪技术特点: 1、具有自校功能; 2、极低功耗的LED显示及8种功能显示; 3、轻触按键操作; 4、具有温湿度等修正功能; 5、可同时测试大于1万级空间的粒子浓度数; 6、数据最大容量300组,分十区域存贮;分区域查询,打印;配置标准并行口及与RS23C兼容的串行接口;与多种打印机接配。
用激光扫描共聚焦显微镜扫描出的图,就是只有绿黑两种颜色的图,如何用软件把它处理成表示亮度的曲线图啊,很多文献上看到了,不过不知道怎么弄,听说用matlab可以,还有人能帮帮忙,告诉我怎么样的步骤啊,matlab不会用啊谢谢,心里那个急啊,还望大家顶顶贴啊
我们科室有好几台[b][size=2]手持式激光尘埃粒子计数器,最近都碰到充电充不进去的问题电源插上LED绿灯亮,但是电源指示的格子却是越来越少由于任务很重,经常要用不知哪位大虾有没有什么经验,解决之!说明书上说LED灯绿色是充满了的状态,充电状态是红色灯怎么不见红色只见绿色呢,而且电源根本就不足以支持一次测量是不是镍氢电池充爆了?[/size][/b]
最近在了解高温观察用激光共焦扫描显微镜,看了很多有关采用CLSM观察的高温熔化、凝固和固态相变的观察,感觉很不错。但是我在论坛里看见采用激光扫描共焦显微镜拍摄的很多三维组织图像照片,这种激光共焦扫描显微镜和宝钢、首钢的那种高温观察用的激光扫描共焦显微镜是不是不一样啊??激光共焦扫描显微镜是不是也分好几种啊,请专家解惑,我刚刚接触,不是很了解。另外高温观察用激光共焦扫描显微镜大概多少钱啊,在哪里买呢,谢谢大家

- 结果具有更高的重现性:4300 系统重 5 磅 (2.2 Kg),便于手持和使用。- 性能卓越:经验证的干涉仪设计、超短内部光路、光学匹配的采样接口以及低噪音电子元件能够提供更优异的光谱数据。- 快速扫描:配备 MCT 检测器的 Agilent 4300 手持式 FTIR 是快速、简便地分析材料表面的理想选择。将 MCT 检测器的快速测量能力与软件的快速响应和 4300 的优化人机工程学设计相结合,能够快速而轻松地在完成多点分析。- 实时测量:Agilent MicroLab Mobile 测量软件可增强便携式和手持式光谱仪的功能。它的实时光谱显示完美补充了 4300 MCT 系统的快速扫描功能。- 连续运行时间更长:4300 系统由锂离子电池供电,在运行过程中能轻松对其进行更换。- 灵活适用各种方法:可更换的直接固定式接口无需调整,并经过定制设计,可完美匹配光学系统和电子元件。- 轻松控制:集成式触摸屏可操作所有的系统和数据采集功能,并且有一定倾斜,在环境光线下一目了然。借助简单的触发点击可快速执行方法和命令。 http://ng1.17img.cn/bbsfiles/images/2014/04/201404300952_497827_1776450_3.jpg
荧光芯片扫描仪 由于杂交时产生序列重叠,会有成百上千的杂交点出现在图谱上,形成极为复杂的杂交图谱。序列重叠虽然可为每个碱基的正确读出提供足够的信息,可提高序列分析的可靠性,但同时信息处理量也大大增加了。一般说来,这些图谱的多态性处理与存储都由专门设计的软件来完成,而不是通过对比进行人工读谱。用计算机处理即可给出目的基因的结构或表达信息。扫描一张10cm2的芯片大概需要2-6分种的时间。目前专用于荧光扫描的扫描仪根据原理不同大致分为两类:一是激光共聚焦显微镜的原理, 是基于PMT(photomultiplier tube,光电倍增管)的检测系统(另文介绍);另一种是CCD(charge-coupled devices,电荷偶合装置)摄像原理检测光子。CCD一次可成像很大面积的区域,而以PMT为基础的荧光扫描仪则是以单束固定波长的激光来扫描,因此或者需要激光头,或者需要目的芯片的机械运动来使激光扫到整个面积,这样就需要耗费较多的时间来扫描;但是CCD有其缺点:目前性能最优越的CCD数字相机的成像面积只有16×12mm(像素为10μm),因此要达到整个芯片的面积20×60mm的话,需要数个数码相机同时工作,或者也可以以降低分辨率为代价来获得扫描精度不是很高的图像。由于灵敏度和分辩率较低,比较适合临床诊断用。 生产商业化扫描仪的公司包括:Genomic Solutions公司、Packard公司、GSI公司、Molecular Dynamics、Genetic Microsystems公司、Axon ?Instruments公司等。其中GSI Lumonics 公司ScanArray 系列一直是生物芯片扫描检测系统中的领头产品。2000GSI并入著名的Parkard公司后ScanArray的软、硬件都得到进一步加强。 ScanArray利用其专利的激光共聚焦光学系统,通过计算机控制,对生物芯片的荧光杂交信号进行全自动的扫描采集,并通过分析软件对数据结果进行定量分析。 最高灵敏度高:0.1荧光分子/μm 扫描精度可从5μm-50μm分级调整 全范围扫描时间仅需5分钟,快速方便 多达十种检测滤光片,涵盖所有生物芯片荧光染料的检测,适用于多种荧光标记探针 不同波长依次扫描避免交叉光污染 扫描后的图像还需要进一步的处理,这要求一定的软件支持。现有的分析软件包括:Biodiscovery的ImaGene系列,Axon Instruments的GenePix系列,GSI的QuantArray等 3. 基因芯片上各克隆荧光信号的分析原理 用激光激发芯片上的样品发射荧光,严格配对的杂交分子,其热力学稳定性较高,荧光强;不完全杂交的双键分子热力学稳定性低,荧光信号弱(不到前者的1/35~1/5),不杂交的无荧光。不同位点信号被激光共焦显微镜,或落射荧光显微镜等检测到,由计算机软件处理分析,得用激光激发芯片上的样品发射荧光,严格配对的杂交分子,其热力学稳定性较高,荧光强;不完全杂交的双键分子热力学稳定性低,荧光信号弱(不到前者的1/35~1/5)(2),不杂交的无荧光。不同位点信号被激光共焦显微镜,或落射荧光显微镜等检测到,由计算机软件处理分析,得到到有关基因图谱。美国GSI ?Lumonics 公司开发出专专业基因芯片检测系统(ScanArray 系列),采用激光共聚焦扫描原理进行荧光信号采集,由计算机处理荧光信号,并对每个点的荧光强度数字化后进行分析。利用QuantArray软件包对扫描的荧光信号进行分析,比 较每个克隆在不同组织间表达水平的差别。软件具体分析步骤如下: 首先,同时导入同一区域两个channel扫描的图像文件;将两个channel扫描的图像用不同的颜色显示并重叠;选择拟分析的区域,输入矩阵的行数及列数以及矩阵的个数等参数;在计算机给出的该区域信号图片上标定网格,使得网格中所包含的横线和竖线的交点个数同每个区域点样的克隆数相同,调整网格,使每个交点均位于点样克隆信号的中心;信号的中心确定后,计算机将自动以交点为中心,按照设定的半径圈定各克隆,并将其内部区域作为待分析的信号,同时在圈定的各克隆周围再按照预设的值圈定一定范围的区域,将该区域内的信号作为背景噪音;计算机分析每个克隆扣除背景噪音后的信号强度,并按照不同的要求对数据进行分析;利用GenePie方式对两个channel信号的进行定量比较分析,此时计算机根据各克隆两个channel扫描的信号,以饼图的形式给出两个channel信号强度的相对比例,同时可以逐个克隆读取计算机分析出的两个channel信号的值及所占的比例,进而确定各克隆在两种组织间的表达差异。 4. Microarray数据分析 Microarray数据分析简单来说就是对Microarray高密度杂交点阵图象处理并从中提取杂交点的荧光强度信号进行定量分析,通过有效数据的筛选和相关基因表达谱的聚类,最终整合杂交点的生物学信息,发现基因的表达谱与功能可能存在的联系。 Microarray数据分析主要包括图象分析(Biodiscovery Imagene 4.0\Quantarray分析软件)、标准化处理(normalization)、Ratio值分析、基因聚类分析(Gene Clustering)。 1. 图象分析:激光扫描仪Scaner得到的Cy3/Cy5图象文件通过划格(Griding),确定杂交点范围,过滤背景噪音,提取得到基因表达的荧光信号强度值,最后以列表形式输出。 2. 标准化处理(Normalization):由于样本差异、荧光标记效率和检出率的不平衡,需对cy3和cy5的原始提取信号进行均衡和修正才能进一步分析实验数据,Normalization正是基于此种目的。Normalization的方法有多种:一组内参照基因(如一组看家基因)校正Microarray所有的基因、阳性基因、阴性基因、单个基因。 3. Ratio分析(Ratio Analysis):cy3/cy5的比值,又称R/G值。一般0.5-2.0范围内的基因不存在显著表达差异,该范围之外则认为基因的表达出现显著改变。由于实验条件的不同,此域值范围会根据可信区间有所调整。处理后得到的信息再根据不同要求以各种形式输出,如柱形图、饼形图、点图、原始图象拼图等。将每个Spot的所有相关信息如位标、基因名称、克隆号、PCR结果、信号强度、Ratio值等自动关联并根据需要筛选数据。每个Spot的原始图象另存文件,可根据需要任意排序,得到原始图象的拼图,对于结果分析十分有利。 4. 聚类分析(Clustering Analysis):实际是一种数据统计分析。通过建立各种不同的数学模型,可以得到各种统计分析结果,确定不同基因在表达上的相关性,从而找到未知基因的功能信息或已知基因的未知功能。Gene Clustering就是根据统计分析原理,对具有相同统计行为的多个基因进行归类的分析方法,归为一个簇的基因在功能上可能相似或关联。目前以直观图形显示GeneCluster结果的程序已有人开发出来,可将抽象的数据结果转化成直观的树形图,便于研究人员理解和分析。 尽管基因芯片技术受到了广泛关注,但在基因表达谱分析中起着关键作用的生物信息学却没能引起大家的足够重视,认为简单人工处理一下原始数据就可以得到有价值的生物学信息,大量有价值的信息就这样被浪费和湮没了。可以肯定地说,没有生物信息学的有效参与,基因芯片技术就不能发挥最大效能。加大基因芯片技术中生物信息学的研究开发力度已成为当务之急。国内外已经进行了有益的尝试,初步开发出供芯片平台管理实验数据的软件包,就目前实际情况来看,生物信息学在基因芯片研究开发中介入的程度已经越来越深,主要涉及基因表达信息分析管理系统及其分析工具和分析方法,简单概括为以下几个方面:

[align=center][font=mp-quote, -apple-system-font, BlinkMacSystemFont, &][size=15px][color=#373737]上世纪80年代,一台叫做[/color][/size][/font][font=mp-quote, -apple-system-font, BlinkMacSystemFont, &][size=15px][color=#78acfe][b]激光扫描共聚焦显微镜[/b][/color][/size][/font][font=mp-quote, -apple-system-font, BlinkMacSystemFont, &][size=15px][color=#373737]的仪器“横空出世”[/color][/size][/font][/align][align=center][font=mp-quote, -apple-system-font, BlinkMacSystemFont, &][size=15px][color=#373737]在随后短短三十余年的时间里[/color][/size][/font][/align][align=center][font=mp-quote, -apple-system-font, BlinkMacSystemFont, &][size=15px][color=#373737]这台仪器在生物、医学及工业检测领域得到广泛应用![/color][/size][/font][size=15px][color=#373737]有人用它观察活细胞形态结构[/color][/size][/align][align=center][size=15px][color=#373737]有人用它看到神经组织的细微病变[/color][/size][/align][align=center][size=15px][color=#373737]有人用它进行敏感精密光学部件的表面测量[/color][/size][/align][align=center][size=15px][color=#373737]最近发现[/color][/size][/align][align=center][size=15px][color=#373737]居然还有人用它进行[b]古气候纹层学研究[/b][/color][/size][size=15px][color=#373737](不明觉厉[img]https://simg.instrument.com.cn/bbs/images/brow/em17.gif[/img][/color][/size][size=15px][color=#373737]~)[/color][/size][/align][align=center][color=#78acfe][b][size=15px]慨叹用它的人脑洞之大,慨叹它如此年轻又如此多能[/size][/b][/color][/align][align=center][size=15px][color=#373737]随着新软件的不断开发及各个学科的不断发展和相互渗透,相信它还将会有更广阔的发展前景。[/color][/size][/align][align=center][size=15px][color=#373737]为了深入了解激光扫描共聚焦显微镜相关技术及市场情况,仪器信息网特组织[/color][/size][size=15px][color=#ff2941][b]“激光扫描共聚焦显微镜2019用户有奖调研”[/b][/color][/size][size=15px][color=#373737]活动。[/color][/size][/align][align=center][size=15px][color=#373737]活动截止日期:[/color][/size][color=#78acfe][b][size=15px]2019年12月15日[/size][/b][/color][/align][align=center][size=15px][color=#373737]活动对象:激光扫描共聚焦显微镜用户(或厂商专家)[/color][/size][/align][align=center][size=15px][color=#373737]参与方式:[/color][/size][size=15px]直接点击本链接或[/size][size=15px]扫[/size][size=15px]描下方二维码[/size][/align][align=center][size=15px][color=#78acfe][url=http://u0p0nhvtsktpnpd5.mikecrm.com/SkxnmHa][b]http://u0p0nhvtsktpnpd5.mikecrm.com/SkxnmHa[/b][/url][/color][/size][/align][align=center][color=#373737][img=,120,120]https://ng1.17img.cn/bbsfiles/images/2019/12/201912051626109208_2185_3471547_3.png!w690x690.jpg[/img][/color][/align][align=center][img]https://mmbiz.qpic.cn/mmbiz_gif/CTeU7IINFNTXkk1dh9NAIHZq4Zia840UJibtA1KpcSGThPiciacd0dmb2pKvBBT6j85ibMvTcrpqDKSlByD854LWYxw/640?wx_fmt=gif&tp=webp&wxfrom=5&wx_lazy=1[/img][size=15px][color=#373737]扫我扫我[/color][/size][img]https://mmbiz.qpic.cn/mmbiz_gif/CTeU7IINFNTXkk1dh9NAIHZq4Zia840UJibtA1KpcSGThPiciacd0dmb2pKvBBT6j85ibMvTcrpqDKSlByD854LWYxw/640?wx_fmt=gif&tp=webp&wxfrom=5&wx_lazy=1[/img][/align][align=center][color=#ff2941][b][size=15px]奖励方式:[/size][/b][/color][b][size=15px]第一重奖励[/size][/b][size=15px]:[/size][size=15px]活动期间,认真、如实填写完成调研问卷,即可[/size][size=15px][color=#ff2941][b]获20元[/b][/color][/size][size=15px]话费奖励。[/size][size=15px]共200份,先到先得[/size][/align][align=center][b][size=15px]第二重奖励[/size][/b][size=15px]:初步问卷有效[/size][size=15px],小编将致电进行友好愉快的电话调研,在电话调研后确定为有效问卷的情况下,将额外获得[/size][size=15px][color=#ff2941][b]50元话费[/b][/color][/size][size=15px]奖励[/size][/align][align=center][size=15px]注:[/size][size=15px]活动期间参与完成问卷,未被确认为有效问卷,但获得电话调研资格的用户,将在电话调研后确定为有效问卷的情况下,获得20元话费奖励。[/size][/align][align=center][size=15px](活动结束后统一发放)[/size][/align][align=center][size=15px]本次活动最终解释权归仪器信息网所有[/size][/align]
[align=center][font='times new roman'][size=16px]激光扫描共聚焦显微镜的[/size][/font][font='times new roman'][size=16px]检测[/size][/font][font='times new roman'][size=16px]模式及其在生物医学领域的应用[/size][/font][/align][align=center][font='times new roman'][size=14px]吴晶[/size][/font][font='times new roman'][sup][size=14px]1[/size][/sup][/font][font='times new roman'][size=14px],刘皎[/size][/font][font='times new roman'][sup][size=14px]1[/size][/sup][/font][font='times new roman'][sup][size=14px], *[/size][/sup][/font][/align][align=center]1. [font='times new roman']北京大学医药卫生分析中心,北京,100191[/font][/align][font='times new roman'][/font][align=center][font='times new roman'][size=13px]* [/size][/font][font='times new roman']通讯作者[/font][/align][font='times new roman']摘要[/font][font='times new roman']由于激光扫描共聚焦显微镜(Confocal Laser Scanning Microscopy, CLSM)特有的分辨率和技术优势,使得其成为了生物学、医学及药学等领域重要的科研工具。本文结合[/font][font='times new roman']作[/font][font='times new roman']者所在的北京大学医药卫生分析中心共聚焦平台的工作经验,概述了CLSM适用的样本、[/font][font='times new roman']检测[/font][font='times new roman']模式以及在生物医学领域的应用,以期为相关科研技术人员提供参考。[/font][font='times new roman']A[/font][font='times new roman']bstract[/font][font='times new roman']Confocal Laser Scanning Microscopy (CLSM) has become an important scientific research tool in the fields of biology, medicine and pharmacy due to its unique resolution and technical advantages. Based on the author's work experience in the confocal [/font][font='times new roman']center[/font][font='times new roman'] of Peking University Medical and Health Analysis Center, this paper summarizes the applicable samples, detection modes and applications of CLSM in the biomedical field, in order to provide reference for related scientific researchers and technicians.[/font][font='times new roman']关键词[/font][font='times new roman']激光扫描共聚焦显微镜,[/font][font='times new roman']检测[/font][font='times new roman']模式,应用[/font][font='times new roman']1 引言[/font][font='times new roman']从17世纪世界上第一台原始的光学显微镜问世以来,光学显微镜在20世纪经历了快速发展时期[1]。但由于普通的光学显微镜受光波衍射效应的限制,分辨率已接近理论极限值。因此,为改善成像质量,提高图像清晰度,从而提高显微镜的成像分辨率,人们采用增加物象与背景的反差来实现此目的[2]。激光扫描共聚焦显微镜(Confocal Laser Scanning Microscopy, CLSM)的诞生,在一定程度上实现了这一目的。1984年,Bio-Rad公司首次推出世界第一台商品化的CLSM,从此CLSM迅速发展成为现代生物医学等领域科研的有力工具,广泛应用于细胞生物学、生理学、病理学、解剖学、胚胎学、免疫学和神经生物学等领域。[/font][font='times new roman']伴随着光学、计算机等技术的迅速发展,CLSM的分辨率甚至可以突破光学极限(0.2μm),达到0.05μm甚至0.02μm。与分辨率可以达到0.2nm的电子显微镜相比,CLSM的优势是既可以用于固定样品的拍摄,还可以用于活细胞实验,比如观察在特定刺激下细胞某个结构或者荧光强度的变化等。同时还可以通过XYZ[/font][font='times new roman'],[/font][font='times new roman']XYT[/font][font='times new roman'],[/font][font='times new roman']XYλ[/font][font='times new roman'],[/font][font='times new roman']XYZT[/font][font='times new roman'],[/font][font='times new roman']XYλT等多种模式实现多维成像,亦可进行更复杂实验的拍摄,比如荧光共振能量转移([/font][font='times new roman']Fluorescence Resonance Energy Transfer, [/font][font='times new roman']FRET),荧光漂白恢复([/font][font='times new roman']Fluorecence Recovery After Photobleaching, [/font][font='times new roman']FRAP),荧光寿命成像([/font][font='times new roman']Fluorescence Lifetime Imaging Microscopy, [/font][font='times new roman']FLIM)[/font][font='times new roman'],荧光相关光谱/荧光互相关光谱(Fluorescence Correlation/Co-Correlation Spectroscopy, [/font][font='times new roman']FCS[/font][font='times new roman']/FCCS)[/font][font='times new roman']等实验以满足对样品的定性、定量、定位、共定位等多维度多功能的研究。[/font][font='times new roman']本文拟通过按CLSM常见的[/font][font='times new roman']检测[/font][font='times new roman']模式分别阐述其在生物医学领域的应用,以其为相关科研技术人员提供参考。[/font]2. [font='times new roman']CLSM适用的样本[/font][font='times new roman']CLSM适用的样本非常广泛,从液体、固体等形式的材料或制剂、细菌、培养的粘附细胞、悬浮细胞、细胞团、类器官、各种染色、非染色荧光标记的组织或组织切片、到各种动物(如模式动物线虫、果蝇、斑马鱼、小鼠、大鼠等),都可以通过搭载不同载物台进行测试。所有的样品都可以通过匹配不同的器皿(包括共聚焦专用小皿、玻片、transwell小室、孔板等等)和固定器(比如不同热台、孔板支架等)放置到载物台上进行测试。[/font]3. [font='times new roman']CLSM的[/font][font='times new roman']检测[/font][font='times new roman']模式[/font]3.1 [font='times new roman']单一光切片模式(XY或XZ)[/font][font='times new roman']CLSM的最基本优势在于利用激光代替传统场光源,借助于激光扫描共聚焦显微镜的软件系统,CLSM可以实现点扫描、点探测,得到生物样品高反差、高分辨率、高灵敏度的二维图像,从而获得细胞/组织等光学切片的物理、生物化学特性及变化。也可以对所感兴趣的区域进行准确的定性、定量及定位分析。[/font][font='times new roman']CLSM特有的zoom功能,可以用来调节扫描区域的放大倍数。增加选定区域的zoom值,其图像会被放大。但zoom值会受吴晶分辨率的限制,一味的增大zoom值,不能得到相应的高清图像。因此,需根据实际情况参考piexl size进行设定。[/font]3.2 [font='times new roman']三维成像模式[/font]3.2.1 [font='times new roman']Z轴系列及三维成像模式,三维定位/图像重构[/font][font='times new roman']CLSM可对活的或固定的细胞及组织进行无损伤的系列光学切片,获得标本真正意义上的三维数据,这一功能被称为“细胞CT”:通过扫描振镜在X、Y方向的连续扫描,控制软件将扫描的像素点组成共聚焦图像,通过电动载物台沿Z轴方向的连续扫描,可获得样品不同层面连续的光切图像(xyz)。同理,通过沿Y轴方向连续扫描,可获得连续的xzy图像。再经计算机图像处理及三维重建软件,可产生生动逼真的动态效果。[/font]3.2.2 [font='times new roman']时间序列扫描模式(XYT)[/font][font='times new roman']共聚焦显微镜若按照一定的时间间隔、重复地采集样品内固定区域的荧光图像,并对其进行定位、定性及定量分析,则可实现对该样品的实时监测(XYT),此类实验可观察特异荧光探针标记的单个细胞不同部位或不同组织区域接受刺激后的整个变化过程,常用于对单个细胞内各种离子、膜电位、活性氧的比例及动态变化做实时定量分析,例如动态测定活细胞或组织内游离Ca[/font][font='times new roman'][sup][size=13px]2+[/size][/sup][/font][font='times new roman']、Mg[/font][font='times new roman'][sup][size=13px]2+[/size][/sup][/font][font='times new roman']、K[/font][font='times new roman'][sup][size=13px]+[/size][/sup][/font][font='times new roman']、Na[/font][font='times new roman'][sup][size=13px]+[/size][/sup][/font][font='times new roman']等离子的分布和浓度的变化、活细胞内H[/font][font='times new roman'][sup][size=13px]+[/size][/sup][/font][font='times new roman']浓度的变化、细胞/线粒体膜电位,自由基等。当Y方向上的扫描行数设为1时,便可进入特殊的XT模式,在这种扫描模式下得到的图像,可以用来计算血流速度等。[/font]3.2.3 [font='times new roman']光谱扫描模式(XYλ/XYΛ/XZλ)[/font][font='times new roman']通常配置有可调节接受范围的检测器[/font][font='times new roman']的CLSM[/font][font='times new roman'],可以实现从400nm-800nm的发射波谱扫描。通过配置具有连续可调波长的白激光,CLSM还可以实现激发波谱扫描。[/font][font='times new roman']3.3四维成像模式(XYZT/XYλT/XYΛT)[/font][font='times new roman']基于[/font][font='times new roman']上述[/font][font='times new roman']三维成像[/font][font='times new roman']模式[/font][font='times new roman'],结合时间序列扫描,可以实现CLSM的四维成像。[/font][font='times new roman']3.4反射光/透射光/微分干涉(DIC)成像模式[3-4][/font][font='times new roman']反射光成像主要是指光源发出的光到达样品后发生反射,检测器将此反射光信号转化为电信号进而生成样品表面的图像。利用反射光成像,能够更好的获得样品的表面纹理等信息,是对荧光图像信息的进一步补充。[/font][font='times new roman']透射光成像技术是通过光源发出的光到达样品后,透过样品的光进入检测器生成光信号,再由检测器转变为电信号所形成的图像信息。透射光成像通常能够更好的呈现目标的外轮廓信息,亦是对荧光图像信息的进一步补充。[/font][font='times new roman']很多CLSM配置有DIC模式。与其他成像技术相比,DIC成像技术通过对光路中梯度变化的呈现,实现“伪立体”效果,如在梯度比较小的区域中,相对比较扁平的上皮细胞亦可以较好的实现“立体”结构,同时,由于DIC成像技术不存在相差成像等技术中出现的光晕,还可以利用这个特点检测到细胞表面分布着的细菌,这是很多成像技术所观察不到的。因此DIC成像技术的主要优势在于不需要对相差环和聚光镜遮挡等因素进行考虑,可以直接实现高数值孔径的物镜观察,即可以提高轴向分辨率,这在对分辨率要求十分高的实验中具有重要的应用价值。[/font][font='times new roman']3.6 特殊[/font][font='times new roman']检测[/font][font='times new roman']模式[/font][font='times new roman']3.6.1 荧光漂白恢复(FRAP)[/font][font='times new roman'][5][/font][font='times new roman']FRAP技术由Axelrod等于20世纪70年代研发,指对细胞内的某一区域荧光漂白后,通过测定荧光分子的恢复速率,来研究活细胞中生物分子的动力学特征。[/font][font='times new roman']通过FRAP实验可以研究生物膜脂质分子的侧向扩散、细胞间的通讯、胞浆及细胞器内小分子物质转移性的观测、以及细胞骨架、核膜结构或大分子组装等。[/font][font='times new roman']3.6.2荧光能量共振转移(FRET)[/font][font='times new roman'][6][/font][font='times new roman']FRET是指两个荧光基团间能量通过偶极-偶极耦合作用以非辐射方式从供体传递给受体的现象。目前FRET技术可广泛用于单个固定细胞、亚细胞或活细胞原位生理环境下检测生物大分子的构象变化和分子间的直接相互作用,如检测配体-受体、蛋白分子共定位、转录机制、蛋白折叠以及蛋白质二聚化等,亦可用于检测酶活性变化、细胞凋亡以及膜蛋白的研究等。[/font][font='times new roman']在FRET体系中,常用的荧光能量供体、受体对主要有:CFP/YFP、BFP/RFP、CY3/CY5等。[/font][font='times new roman']进行FRET实验时,需要满足以下几个条件:① 所检测样品包含两个荧光分子,能量的提供者叫做供体,能量的接受者叫做受体;② 供体与受体的距离在[/font][font='times new roman']10[/font][font='times new roman']nm之间;③ 供体的发射波长与受体的激发波长一致。当供体的激发波长照射样品时,若没有FRET效应产生,只会检测到供体的发射光;反之,如果有FRET效应发生,则CLSM可检出供体发射的荧光减弱,而受体的发射光增强。[/font][font='times new roman']3.6.4 荧光寿命成像([/font][font='times new roman']FLIM[/font][font='times new roman'])[7][/font][font='times new roman']FLIM技术是研究细胞内生命活动状态的一种非常可靠的方法。荧光寿命是荧光团在返回基态之前处于激发态的平均时间,是荧光团的固有性质,因此其不受探针浓度、激发光强度和光漂白效应等因素影响,且能区分荧光光谱非常接近的不同荧光团,故具有非常好的特异性和很高的灵敏度。此外,由于荧光分子的荧光寿命能十分灵敏地反映激发态分子与周围微环境的相互作用及能量转移,因此FLIM技术常被用来实现对微环境中许多生化参数的定量测量,如细胞中折射率、黏度、温度、pH值的分布和动力学变化等,这在生物医学研究中具有非常重要的意义。目前FLIM技术在细胞生物学中一些重要科学问题的研究、临床医学上一些重大疾病的诊断与治疗研究以及纳米材料的生物医学应用研究等方面均有广泛应用,并取得了许多利用传统的研究手段无法获取的数据。[/font][font='times new roman']3.6.5 荧光共振能量转移-荧光寿命成像(FRET- [/font][font='times new roman']FLIM[/font][font='times new roman'])[8][/font][font='times new roman']FRET本身不是一种成像技术,而是一个物理过程。传统的FRET过程分析通常是基于荧光强度成像来实现,分析的结果容易受光谱串扰的影响。而将FLIM技术应用于FRET过程分析,利用FLIM技术可定量测量这一优势,可非常灵敏地反映供体荧光分子与受体荧光分子之间的能量转移过程。当受体分子与供体之间的距离10nm时,供体的能量转移到受体,受体从基态发生能量跃迁,从而影响供体的荧光寿命。与没有受体分子的时候相比,发生FRET的供体分子的荧光寿命降低。因此,FRET-FLIM联合能够实时监测生物细胞中蛋白质的动态变化,如蛋白质折叠、分子间(蛋白-蛋白,蛋白-核酸)相互作用和细胞间信号分子传递、分子运输以及病理学研究等。[/font][font='times new roman']3.6.3 荧光相关光谱/荧光互相关光谱([/font][font='times new roman']FCS[/font][font='times new roman']/FCCS)[9-12][/font][font='times new roman']FCS[/font][font='times new roman']和FCCS都是在涨落光谱技术的基础上衍生而来的,通过检测某一微小区域内荧光信号的瞬时涨落变化,分析分子的密度、扩散以及分子之间的相互作用,是一种新兴的单分子检测技术。由于FCS/FCCS的高灵敏性可以用来检测生物系统中发生的小概率时间,因此此技术主要用于分子之间相互作用、活细胞分析、核酸分析、蛋白质的寡聚化、蛋白质的动力学研究以及纳米制剂粒径测量等研究,在检测物质浓度、扩散速度、分子结合速率等方面体现出巨大的优越性,亦可用于肿瘤的早期诊断以及高通量药物筛选等。[/font][font='times new roman']FCS技术,即在CLSM焦点的微小测量区域内,通过对荧光强度随时间变化的自发性波动分析和其时间函数自相关的分析,并通过计算机统计与拟合运算,在活细胞内单分子水平给出分子的扩散系数、分子数目、分子浓度及分子之间结合与分离状态等动力学参数的检测方法。其实质是监测带有荧光基团的物质在激光作用体积内的扩散情况,可揭示异质群体中的每个个体,并对各自的亚群进行鉴定、分类、定量比较,亦可对复杂的生化反应提供详细、确定的动力学参数。[/font][font='times new roman']发明FCS的最初目的是在生物系统中研究非常稀的样本浓度的化学动力学特征。随着探测手段、自相关电子学等方面的技术进步,FCS在生物化学中的研究和应用越来越广泛,如经典的细胞膜中脂质扩散研究就是通过CLSM整合了FCS技术后所取得的巨大进展。[/font][font='times new roman']FCCS技术,确切来说是FCS技术的一种延伸应用。其既保持了FCS技术的灵敏性,又可以解决FCS对两种粒子的扩散速度要有明显不同的要求(至少相差2倍,即二者质量差相差8倍)。该技术在实验中通常将两种粒子用不同的荧光进行标记,荧光分子被激发后,产生两种互不干扰的荧光信号,分别被两个独立的检测器探测,然后将探测到的信息进行交叉函数分析。如果分子间存在相互作用,那么两种不同的荧光信号将同时经过检测通道,这时两个检测器就会产生同步的信号波动,从而产生互相关信号;而当单色荧光分子独立在微区域内运动时,则不会产生互相关信号。这样,相互作用的荧光分子和独立运动的荧光分子就被区分开来。由于FCCS技术直接反映分子间的相互作用,而不像FRET技术那样受分子扩散或聚集的影响,因此在生物分子互作、蛋白寡聚化、酶活性研究领域中有重要的应用前景。[/font][font='times new roman']4 结论和展望[/font][font='times new roman']综上,CLSM应用灵活,具备多种检测[/font][font='times new roman']模式,适用于多种样本,[/font][font='times new roman']亦可[/font][font='times new roman']实现多种实验目的,如荧光的定量、定性、定位、共定位,动态荧光的测定等[/font][font='times new roman']。一些特殊的实验模式,将CLSM在生物医学领域的应用进一步扩大。通过[/font][font='times new roman']结合其他[/font][font='times new roman']技术[/font][font='times new roman'](多手段联合拓展[/font][font='times new roman'],如膜片钳、原子力显微镜、光电联用等[/font][font='times new roman'])[/font][font='times new roman'],CLSM必将成为[/font][font='times new roman']助力生物医学领域研究[/font][font='times new roman']的有力工具[/font][font='times new roman']。[/font][font='times new roman']参考文献[/font]1. [font='times new roman']黄德娟,浅谈显微镜的发展史及其在生物学中的用途。赤峰教育学院学报,2000,2:51-52[/font]2. [font='times new roman']肖艳梅,付道林,李安生,激光扫描共聚焦显微镜(LSCM)及其生物学应用。激光生物学报,1999,8(4):305-311[/font]3. [font='times new roman']弓宇, 郭英玲, 张枫, 刘红旗, 基于反射光和透射光成像的图像识别方法比较。机电产品开发与创新,2013,26(3):7-9[/font]4. [font='times new roman']虞兆芳, DIC成像技术的优势。求知导刊,2016,2:53[/font]5. [font='times new roman']隋鑫,满奕,张越,林金星,荆艳萍,荧光漂白恢复技术及其在生物膜系统研究中的应用。电子显微学报,2017,36(6):601-609[/font]6. [font='times new roman']肖忠新,张进禄,荧光共振能量转移技术在激光共聚焦显微镜中的应用。中国医学装备,2014,8(11):73-75[/font]7. [font='times new roman']刘雄波,林丹樱,吴茜茜,严伟,罗腾,杨志刚,屈军乐,荧光寿命显微成像技术及应用的最新研究进展。物理学报,2018,67(17):178701-1-178701-14[/font]8. [font='times new roman']罗淋淋,牛敬敬,莫蓓莘,林丹樱,刘琳,荧光共振能量转移-荧光寿命显微成像(FRET-FLIM)技术在生命科学研究中的应用进展。光谱学与光谱分析,2021,41(4):1023-1031[/font]9. [font='times new roman']曲绍峰,林金星,李晓娟,FCS/FCCS技术及其在植物细胞生物学中的应用。电子显微学报,2014,33(5):461-468[/font]10. [font='times new roman']张普敦,任吉存,荧光相关光谱及其在单分子检测中的应用进展。分析化学,2005,33(6):875-880[/font]11. [font='times new roman']黄茹,周小明,荧光相关光谱在生物化学领域中的应用。激光生物学报,2013,22(4):289-293[/font]12. [font='times new roman']游俊,荧光相关光谱(FCS)在生物活细胞中的应用。湖北大学学报(自然科学版),2005,27(1):53-56[/font]
坛子里有专家提到Ahura公司的手持式激光拉曼光谱仪能用在安防领域,我下面要说的是这款产品在药厂车间的应用大有所为。该款产品具有快速(1 min出“通过”或“失败”结果)、准确、上手快(中文界面2分钟学会操作)、轻便(1.7 Kg),透过检测,内置软件不用外联电脑,可以在药厂车间任何一个环节使用,这款仪器已经在国际制药公司得到广泛使用,全球排名前十名药厂基本都配备了该款产品。这款产品最大的特点是软件,可以在1分钟内将待测物质图谱与之前建立标准物质图谱全部匹配一遍,如果图谱匹配上,结果显示“Pass”,同时显示被测物质的名称,如果匹配不上结果显示“Fail”,中文界面结果简单明了,准确率达99.99%。使用范围:药厂和原料药厂进料和出料及中间产品及环节随时检测,可以在原料药下车后、仓库上架前进行原料药快速全检;另外也可用于药品销售流程打假。使用仪器不用取样,可以透过薄膜包装袋和玻璃瓶检测,1min报出“通过”或“失败”结果。实际应用1:原料药进料上架前的快速全检鉴别,同时配合之后的QC抽检,为药厂严把质量关,其实目前大多数药厂质量问题是原料问题,包括2006年的齐二药事件,如果QC部门人员抽检前,再进行一次快速全检,原料质量就等于加上了一道有力保险。同时为企业省去停放进料需要的空间,无需任何耗材。实际应用2:另外生产过程中,制剂工艺质量;也是影响药品的一个重要环节,该款产品也能用于制剂过程中任意一个环节鉴别检测,如果检测不通过,可以交由QC部门进行更为严格的检测。实际应用3:本厂药品的打假,药监部门有的时候并不是很到位,该产品由于体积非常小(一块砖头大),一次充电可以联系使用5个小时,可以在任何药店等地,配合药监部门进行打假,及时发现证据线索,马上向药监部门举报。手持式产品介绍:[img]http://bbs.instrument.com.cn/images/affix.gif[/img][url=http://bbs.instrument.com.cn/download.asp?ID=199140]Ahura手持拉曼中文样本.pdf[/url][img]http://bbs.instrument.com.cn/images/affix.gif[/img][url=http://bbs.instrument.com.cn/download.asp?ID=199141]手持式激光拉曼光谱仪PPT.pdf[/url][img]http://bbs.instrument.com.cn/images/affix.gif[/img][url=http://bbs.instrument.com.cn/download.asp?ID=199142]便携式拉曼光谱仪用于磺胺类药物成分识别的研究.pdf[/url]部分全球知名药企用户名单:[img]http://bbs.instrument.com.cn/images/affix.gif[/img][url=http://bbs.instrument.com.cn/download.asp?ID=199145]手持式激光拉曼光谱全球制药用户名单.pdf[/url][color=#DC143C]广告内容删除.[/color]
激光共聚焦扫描显微镜是近代最先进的细胞生物医学分析手段之一。与传统荧光显微镜相比,共聚焦显微镜能得到更清晰的样品图像。它不仅可观察固定的细胞、组织切片,还可对活细胞的结构、分子、离子进行实时动态地观察
请问有谁知道手持式拉曼光谱仪光谱稳定性、准确度的测试方法吗?国外手持式拉曼光谱仪的稳定性和准确度大约是多少呢?谢谢!