高效液相色谱方法开发篇|关于ICHQ14的开发要求小知识 https://bbs.instrument.com.cn/topic/8433932 高效液相色谱方法开发篇|关于方法建立的不同策略汇总小知识 https://bbs.instrument.com.cn/topic/8433922 高效液相色谱方法开发篇|关于亲和色谱(HILIC)的方法开发小知识 https://bbs.instrument.com.cn/topic/8433312 高效液相色谱方法开发篇|关于正相色谱(NPC)的方法开发小知识 https://bbs.instrument.com.cn/topic/8433298 高效液相色谱方法开发篇|关于IEC的方法开发小知识 https://bbs.instrument.com.cn/topic/8432718 高效液相色谱方法开发篇|关于SEC的方法开发小知识 https://bbs.instrument.com.cn/topic/8432711 高效液相色谱方法开发篇|关于RPC的方法开发小知识 https://bbs.instrument.com.cn/topic/8432702
液相色谱方法开发的一般原则都有哪些?
本人新手,求大婶们赐教液相色谱分析方法开发的一般程序。有实例最好了。
液相色谱梯度方法开发的一些细节改进,仅供参考!!!
液相色谱方法开发时经常会遇到两种情况: 1.在谱图的最末端会起一个高高的峰,但实际里面并不含物质。 2. 物质没有被检测出,溶剂峰后并没有出,改变方法后会出峰。 3. 梯度洗脱时基线出现漂移甚至跳跃? 这种情况为何出现,如何避免?
[color=#666666][font=宋体][back=white][url=https://insevent.instrument.com.cn/t/5p]液相色谱[/url]([/back][/font][font='Times New Roman',serif][back=white]LC[/back][/font][font=宋体][back=white])方法开发是一个涉及多个步骤的过程,旨在确保分析结果的准确性和可靠性。以下是[url=https://insevent.instrument.com.cn/t/5p]液相色谱[/url]方法开发的一般流程:[/back][/font][font='Times New Roman',serif][back=white]1.[/back][/font][font=宋体][back=white]了解分析物的理化性质:在为分析物制定分析方法时,了解其理化性质至关重要。考虑的因素包括分析物的[/back][/font][font='Times New Roman',serif][back=white]pH[/back][/font][font=宋体][back=white]值、极性、溶解度和[/back][/font][font='Times New Roman',serif][back=white]pKa[/back][/font][font=宋体][back=white]。这些参数在[/back][/font][font='Times New Roman',serif][back=white]HPLC[/back][/font][font=宋体][back=white]方法开发中至关重要,影响着溶剂的选择和整个方法的成功与否。[/back][/font][font='Times New Roman',serif][back=white]2.[/back][/font][font=宋体][back=white]色谱条件优化:包括检测器、[/back][/font][font=宋体][back=white]色谱柱和[/back][/font][font=宋体][back=white]流动相的选择,并生成样品的“初始”色谱图。决定是开发[/back][/font][font='MS Gothic'][back=white]?[/back][/font][font=宋体][back=white]梯度方法还是等度方法,这两种方法都具有不同的优势,具体取决于分离要求和分析物的性质。[/back][/font][font='Times New Roman',serif][back=white]3.[/back][/font][font=宋体][back=white]色谱柱的选择:色谱柱是色谱仪的核心,在实现可靠、准确的分析中起着举足轻重的作用。选择好的色谱柱可确保良好的色谱分离效果,从而获得值得信赖的结果。反之,色谱柱选择不当会导致分离不充分和混乱,使结果无效或难以解释。[/back][/font][font='Times New Roman',serif][back=white]4.[/back][/font][font=宋体][back=white]流动相的选择:流动相的选择对于[url=https://insevent.instrument.com.cn/t/5p]液相色谱[/url]方法的开发至关重要。一般来说,反相[/back][/font][font='Times New Roman',serif][back=white]LC[/back][/font][font=宋体][back=white]的流动相包括水和作为改性剂的乙腈或甲醇。改性剂还有四氢呋喃[/back][/font][font='Times New Roman',serif][back=white](THF)[/back][/font][font=宋体][back=white]和异丙醇。反相色谱中流动相中水相的[/back][/font][font='Times New Roman',serif][back=white]pH[/back][/font][font=宋体][back=white]和离子强度在开发对条件微小变化不敏感的耐用方法中非常重要。[/back][/font][font='Times New Roman',serif][back=white]5.[/back][/font][font=宋体][back=white]方法验证:对最终的方法进行验证,检查它是否满足预期的分离效果与分析目的。这包括启动阶段的信息搜集、方法使用的目的明确、以及通过实例展示系统策略来进行方法筛选。[/back][/font][font='Times New Roman',serif][back=white]6.[/back][/font][font=宋体][back=white]优化和改进:根据初始实验结果,可能需要调整色谱条件以优化分离效果。这可能包括改变流动相的比例、调整[/back][/font][font='Times New Roman',serif][back=white]pH[/back][/font][font=宋体][back=white]值、改变温度等,以获得最佳的分离度和分辨率。[/back][/font][font='Times New Roman',serif][back=white]7.[/back][/font][font=宋体][back=white]样品制备:确保样品以适当的方式准备,以便在色谱分析中获得最佳结果。这可能包括样品的溶解、稀释、过滤等步骤。[/back][/font][/color]
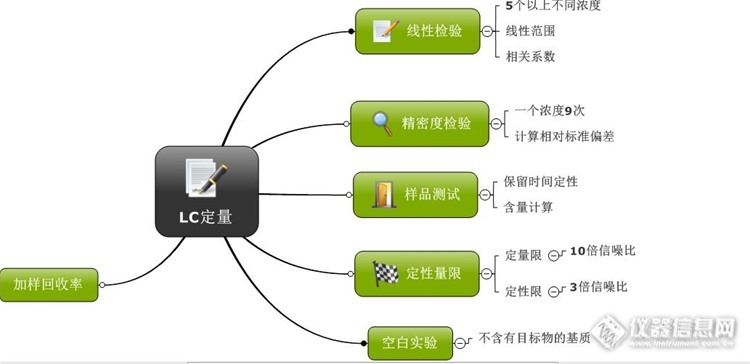
今天读到傅若农教授的文字,感到很温暖。想想我这个分析化学战线的逃兵,将彻底地和分析化学说再见了。但是,我还是讲我的一些思路做一个总结,希望能给我们90后的分析工作者有点启发。接着去年我那个帖子。《谈谈液相色谱方法开发》,有网友希望我写点定量方面的内容。那么,今天,我权当抛砖引玉。当然,我写的很不成熟,希望大家批评指正。http://bbs.instrument.com.cn/topic/5957822在做好了分离方法之后,我们需要对我们的目标物进行定量分析。定量分析的思路一般是http://ng1.17img.cn/bbsfiles/images/2016/06/201606241414_597987_1626663_3.png一般来说,通过这套思路来进行定量方法学的验证。这个是一个通用的方法。当然,这也是十五多年前我做课题时候。 我导师教我的,现在也许也有发展了吧。
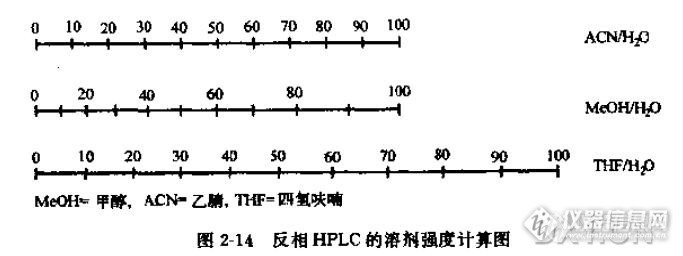
在沉寂了2年之后,qingqingcao再次探讨高效液相色谱。这次和大家探讨一些关于HPLC方法学开发的问题。当然,这是很久以前的思路,在今天看来是比较幼稚的,但是,如果能够给大家一点哪怕一点点启示也是好的。当然文章有很多缺陷,也希望大家批评。高效液相色谱在极性的角度可以分成正相色谱分析和反相色谱分析。反相色谱分析一般使用水-甲醇-乙腈体系,一般选用C8,C10,C18 柱子,主要使用C18键合相柱子。非极性物质一般用氯仿-正己烷体系。因为qingqingcao没有做过正相HPLC分离,所以,我们主要关注反相HPLC分析。色谱柱的选择当然,选用的色谱柱一般就是C18柱。长度呢?如果分析的物质复杂,那么可以选取长一些的,比如250mm╳4.6mm╳5μm。保证其分离度。 如果物质不是很复杂,那么选取150mm╳4.6mm╳5μm的色谱柱,可以有效地缩短分析时间。检测器的选择紫外检测器是最通用的检测器之一,所以,本文均以紫外检测器做说明。对于需要分析的物质,做全波长扫描,由于物质的不同官能团,他们会在不同的地方有吸收。通过综合选取大家都有吸收的波长。选择波长需要有权衡。同时也可以用一些特殊的波长,避免杂质的吸收,也可以提升测试准确度。或者使用双波长的方法。流动相的选择对于选取流动相,首先实验一下样品的溶解度。样品在水中,甲醇,乙腈中溶解程度。如果,很容易溶解在水中,这就告诉我们,流动相选取,可能有机相要少些,比方说测试维生素C,其极性很强,流动相中有机相比例不能多。(为了保护色谱柱,有机相比例一般不少于8% )如果,样品不太容易溶解在水中,那么有机相的比例应高些,比方像维生素E,就可以用90% -95% 的甲醇体系。其次是样品的酸碱度。我们知道,C18色谱柱流动相pH在2-8 之间。太酸,太碱都可能损坏色谱柱。流动相pH值对于分离有一定作用,所以,酸性物质,一般流动相酸一些,碱性物质可能碱一些。对于几种物质的分离。如果不是太多的物质,用等度方法会比较好。流动相一般开始选用20mM磷酸缓冲盐-乙腈体系。(pH一定,流速一定)。因为乙腈洗脱好,而且粘度低。通过水相-有机相的比例的改变,观察各色谱峰的分离情况。这样可以运用无限夹逼法找到最合适的值。比方说,35:65(ACN:磷酸盐)达到分离,但是还是有部分叠加,那么就微调即可。当然还要考虑到分析时间问题。不要为了完全分离而牺牲了分析时间。所以,在色谱分析,有一个k值(容量因子)。κ∈(2,20)如果真的无法改变,那么可以试着微调pH值,来分离。当然,由于乙腈毒性强,所以通过一定计算,用甲醇同等地接替乙腈。http://ng1.17img.cn/bbsfiles/images/2015/09/201509251447_567900_1626663_3.jpg如果有些物质很靠近死体积,那么需要考虑添加0.02mM离子对试剂,加强物质的保留能力。流速一般液相流速在0.8-1.4ml/min。首选1.0ml/min柱温柱温不影响色谱的分离,但是,相对稳定的温度,可以使得保留时间稳定。进样量手动进样,只有进样环。一般也就是20μL。自动进样的选择很多。但是,最好不要超过80μL。因为进样多,容易造成展宽。分离物质的浓度:分离物质,不能够太浓也不能太稀。太浓,容易过载;太稀检测不出。具体还是根据检测器的响应来调整。总结一下HPLC分析,首先要找到合适的流动相。流动相既要保证分离,又要关心分析时间。流动相尽量使用毒性小一点的甲醇。根据样品和标准品的PH值进行调节流动相溶液酸碱度。检测波长很重要,要懂得合适的波长。也就是说,这个单一波长可以分析出所有需要分析的物质。可以通过波长的调整,规避杂质峰的干扰。温度和流速都对分离,影响不大。分离条件摸索好后,就可以开展1)线性浓度测试2)精密度测试3)样品测试4)回收率测试5)空白测试。6)最小检测限,最小检测量定量的工作比较简单,就是按照以上的思路去操作。那么一个项目就这么完成了。当然,这些需要我们的工程师们的努力和智慧。也许,qingqingcao也不再写色谱方面的文章了;因为我没有机会去碰HPLC仪器了。那么,就拿这篇文章作为一个纪念吧。想想从2002年春天,还是一个大学生,去做HPLC,笨手笨脚的,导师也经常批评我。后来又接触了不少的HPLC仪器,也做过维修维护,开发过方法,做过常规工作……这么多年了,一个生手,变成一个熟练工,也能做一点点方法开发,青春就贡献在HPLC上了。看着论坛上有许多HPLC高手,他们的文章,让我觉得,我们时代的发展。后浪推着前浪。后浪必定会超过前浪的。我也希望,我在论坛上写的这些东西,能够给初学者一点点启示,当然,如果有错误的话,希望不会误导大家。如果能够记住qingqingcao做了一点事情,曾经在HPLC上做过点事情,我也欣慰了。也谢谢仪器信息网官人们的努力工作,为我们搭起这样一个平台。
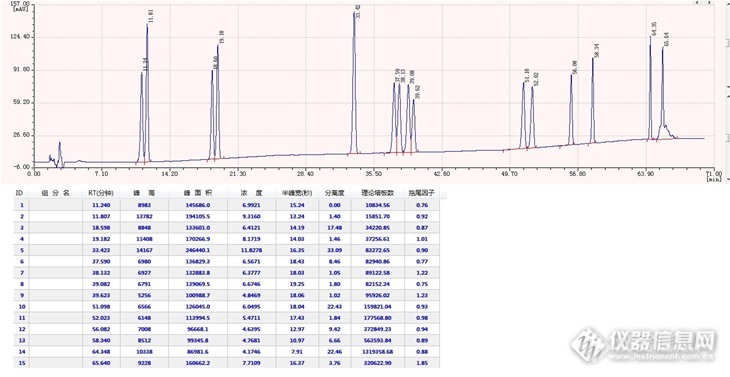
16种塑化剂的液相色谱方法开发终于算是完成了,整整一个月的时间,换过不同的柱子,尝试过各种不同的流动相种类和配比,250多次方法摸索和进样,一针一个多小时啊,项目逼得紧,周末无休,简直都快疯掉了。这16种塑化剂同时分离太难了,好不容易把这两个挨得很近的化合物分开,那两个又并一块儿去了,特别是第三组的四个峰DIBP、BBP、DBP和DBEP,真的是按下葫芦浮起瓢,如果流动相中乙腈多一点前两个峰分得开,可后两个峰却粘得更紧了,而甲醇多一点则前两个峰又粘一块儿去了,而且水的多少也是一个不可忽视的变量。由于是同时分析,所以每个峰必须都要能看得到,头大啊,一个月中大概有3/4的时间都是在解决这四个峰的分离度问题,最后把流动相调成A相是水:乙腈=60:40、B相是甲醇:乙腈=60:40的情况下才实现了这四个峰各自1.0以上的分离度。邻苯二甲酸二辛基酯和二壬基酯在C18上根本分不开,选择性不行,在C8上却很好的实现了基线分离,看来C8和辛基(也是8个碳原子)确实体现了比较好的选择性的一面。以下是谱图和数据,与大家一起分享。液相色谱仪:WUFENG LC100 二元高压梯度系统色谱柱:PntulipsTM BP-C18, 5um, 4.6×250mm流动相:梯度时间(min)A相:水/乙腈=60/40B相:甲醇/乙腈=60/4001000310002150[align=cent
液相方法开发和色谱柱选择,检测糖的仪器方法和色谱柱选择如你们喜欢,可以加入我们的小团队。 名为:shooter 团队里面有大学的教授(帅气的老外教授(我们的最终决策人)),各个地方的检验人员,和对液相感兴趣的年轻朋友。我们团队现在的进程是讨论液相色谱的条件,通过我们来把一些在液相上分析时间长的旧方法改为快速高效的方法(必须要成为实例)。 希望你们的加入,具体方法在论坛留言给我,我会尽快回复你们。 我们需要的你是能和我们融合为一个Team!
今天主要讲讲亲和色谱(HILIC)方法开发过程中的一般考量,HILIC与RP的方法开发相似度比较高,只是略有区别;HILIC利用极性固定相和以水为强洗脱溶剂的流动相,特别适合分析极性化合物,而RP则使用非极性固定相和以乙腈为强洗脱溶剂的流动相,更适合分析非极性到中等极性的化合物。 01.HILIC方法开发的一般步骤 1)色谱柱的选择:根据待分析样品的性质和分析要求,选择一个具有极性固定相的色谱柱,如未键合硅胶、酰胺基、氨基、二醇、两性离子、环糊精类、聚琥珀酰亚胺键合物质等。(HILIC色谱详细的原理请参见 高效液相色谱|亲水作用色谱法的小知识 https://bbs.instrument.com.cn/topic/8433314 ) 2)对样品进行预处理:由于HILIC中流动相通常含有较高比例的有机溶剂,因此需要确保样品能够在这种条件下溶解。对于难以溶解的大极性化合物,可能需要使用水、甲醇等大极性溶剂作为稀释剂。 3)选择色谱模式:HILIC模式;HILIC的流动相为极性更强的溶剂,如水、甲醇等。流动相中水的含量对保留行为有显著影响,一般至少需要3%的水以形成固定相表面的水层。流动相的pH值也会影响样品的电离状态和填料表面电荷,从而影响保留行为。通常,酸性化合物在高pH值下保留更强,而碱性化合物在低pH值下保留更好。另:在流动相中添加缓冲盐和添加剂可以改善峰型和保留。常用的缓冲盐包括甲酸铵和乙酸铵,它们在有机溶剂中具有良好的溶解性以及MS兼容性. 4)选择检测器:根据样品的性质选择合适的检测器,如紫外-可见光检测器(UV)、蒸发光散射检测器(ELSD)或质谱检测器(MS)。 5)选择分离条件:HILIC方法开发中,梯度洗脱是常用的手段,通过逐渐改变流动相的组成来实现样品的分离。梯度不能变化过快,需要留一定时间让色谱柱达到平衡。 6)预料、识别和解决潜在问题:预料可能出现的问题,如柱堵塞、样品降解、峰形不佳等;识别问题的原因,如样品溶剂不兼容、流动相污染等;解决问题,如更换色谱柱、优化流动相组成、调整样品处理方法等。 7)进行方法的部分验证和系统稳定性测试:进行系统适用性测试,包括理论板数、拖尾因子和分离度;进行部分方法验证,包括准确度、精密度、线性范围、检测限和定量限、耐用性;测试系统稳定性,包括连续运行条件下的系统变异性。 8)优化和调整:根据初步实验结果,优化分离条件,如调整洗脱梯度、流速或柱温;以提高方法的灵敏度和选择性。 9)最终验证:进行全面的方法验证,包括交叉验证和独立实验室验证;确定方法的可靠性和重现性。 https://ng1.17img.cn/bbsfiles/images/2024/10/202410160934564676_5869_3203140_3.png!w690x793.jpg 02.HILIC方法开发的调整考量 1)流速的优化 a. 色谱柱的平衡与流速的关系:流速会影响色谱柱达到平衡的速度。较高的流速可能会缩短分析时间,但可能导致色谱柱平衡不充分,从而影响重现性和峰形。通常,需要使用足够的水来更新固定相表面的水层,以实现快速再平衡。所以在每一针完成后的方法中需要给予一段时间进行初始平衡。 b. 样品的溶解度与流速的关系:在HILIC中,样品通常需要在有机溶剂中溶解,如水和乙腈的混合物。流速的选择会影响样品在色谱柱上的保留和分离。如果样品在流动相中的溶解度有限,可能需要调整流速以确保样品能够有效地被输送到色谱柱上。 c. 峰形和分离度与流速的关系:流速对峰形和分离度有显著影响。较高的流速可能会改善峰形,但也可能降低分离度。因此,需要找到一个平衡点,以实现良好的峰形和足够的分离度。在某些情况下,可能需要使用较低的流速来优化分离度。 d. 检测器的兼容性与流速的关系:不同的检测器对流速的敏感性不同。例如,质谱检测器可能对流速有特定的要求,以确保最佳的离子化效率。因此,在选择流速时,需要考虑检测器的特性和要求。 2)柱温的优化 a.保留时间与柱温的关系:柱温的变化会影响分析物与固定相之间的相互作用,进而影响保留行为。根据van’t Hoff方程,温度的升高通常会导致保留因子(k)的降低,因为色谱过程中的相互作用通常是放热的(ΔH°为负值)。这意味着随着柱温的升高,保留时间可能会减少,从而影响分离效果。b. 色谱分离效率柱温的关系:[color=#595959]提高柱温通常可以降低流动相的粘度,增加分析物的扩散性,从而提高色谱效率。较低的粘度和较高的扩散性有助于减少峰宽,提高分离度和分辨率。 c. 溶剂和缓冲液的选择与柱温的关系:柱温的优化还需要考虑溶剂和缓冲液的物理化学性质,包括它们在不同温度下的溶解度和稳定性。例如,某些缓冲盐在低温下可能无法完全溶解,而在高温下可能会分解。 d. 系统压力和色谱柱的稳定性与柱温的关系:柱温的变化会影响流动相的粘度,进而影响系统压力。因此,在选择柱温时,需要考虑系统的工作压力限制和色谱柱的热稳定性,以避免超过系统的最大压力承受能力或损坏色谱柱。 3)流动相的优化 1)溶剂的组成与流动相的关系:HILIC的流动相通常由水和有机溶剂(如乙腈或甲醇)混合而成。水的比例通常在3%到40%之间,以确保在极性固定相表面形成水膜,这是HILIC保留机制的基础。水的比例不低于3%是因为水在HILIC色谱中被吸附形成水膜,分析物在水膜和流动相之间进行液液分配作用。 2)缓冲液的兼容性与流动相的关系:在HILIC中,缓冲液必须在有机溶剂中具有较高的溶解度。常用的缓冲液包括甲酸盐或乙酸盐,因为它们具有挥发性,这对于与质谱联用时的离子化非常重要。应避免使用在有机溶剂中溶解度差的缓冲液,如磷酸盐缓冲液,因为它们可能会在色谱柱中析出。 3)pH值的调节与流动相的关系:流动相的pH值会影响样品的电离状态,从而影响保留行为。通常,酸性化合物在高pH值下保留更强,而碱性化合物在低pH值下保留更好。因此,流动相的pH值需要根据分析物的pKa值进行优化,以确保样品在色谱柱上适当的保留和分离。 03.HILIC方法开发的注意事项: 1)色谱柱的选择:根据分析物的属性选择适当的色谱柱。色谱柱的选择应基于分析物的极性(如对数正辛醇/水分配系数,log D)和pKa值。 2)流动相的选择:流动相通常由高比例的有机溶剂(如乙腈)和少量的水或水溶性缓冲液组成。至少需要3%的水来保持固定相的水合作用。流动相的组成、pH值和是否使用缓冲液都是需要优化的因素。 3)系统兼容性:HILIC系统与RPLC系统在仪器上相似,但在方法开发时需要考虑HILIC特定的条件,如流动相的组成和缓冲液的使用。 [/font]4)有机溶剂含量的调整:流动相中有机溶剂的含量是控制分析物保留的主要因素。增加有机溶剂的比例通常会增加分析物的保留。 5)避免使用高比例水的流动相:在HILIC中,应避免使用高比例水的流动相,因为这可能导致分析物保留不足。 6)梯度洗脱的注意事项:在HILIC中,梯度洗脱应从高比例的有机溶剂开始,而不是从100%的水开始。建议的梯度范围是从97%到60%的有机溶剂。 https://ng1.17img.cn/bbsfiles/images/2024/10/202410160935324888_3411_3203140_3.png!w490x14.jpg 总结一下: 开发亲和色谱(HILIC)方法时,有几个关键点需要特别注意: 首先,得挑个适合极性化合物的色谱柱,比如未键合硅胶或者酰胺基柱。接着,样品预处理得跟上,确保样品能在含有机溶剂的流动相中溶解。流动相的调整也比较讲究,通常得用水和有机溶剂混合,保持至少3%的水含量来形成固定相表面的水层,还得注意pH值,因为这会影响样品的电离状态。检测器的选择得看样品特性,UV、ELSD或MS都行,但得确保和流动相合得来。分离条件,比如梯度洗脱,需要逐渐调整流动相的组成,还得给色谱柱足够的时间平衡。 过程中可能会遇到各种问题,比如峰形不好或者柱子堵了,这时候就得及时找出问题并解决。最后,别忘了方法验证和色谱柱的维护,确保方法的稳定性和重现性。 总的来说,HILIC方法开发需要耐心和细致的调整,但一旦调好了,就能得到非常可靠的分析结果。
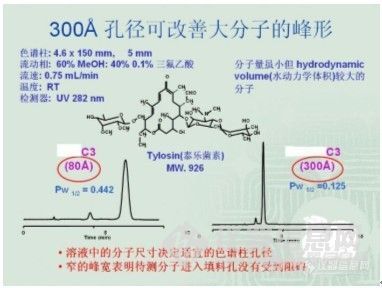
液相色谱方法开发的一般规则 高效液相色谱方法的开发是一个繁复的过程,但不管再繁复,也有其规律可寻。方法开发过程中,一个总的原则是:先找到目标化合物的峰,然后调整峰形,再是进一步完善。1. 找到目标化合物的峰:要找到目标化合物的峰,我们该如何开展工作,先举一个例子,下面是分析氟康唑氯化钠注射液的一个谱图:http://ng1.17img.cn/bbsfiles/images/2010/07/201007081805_229421_1896702_3.jpg谱图上的内容主要包括:色谱柱、波长、流动相、温度、流速和进样量这几项。这意味着如果这几个色谱条件都确定下来了就可以基本认为这个方法已经开发成功,所以开发方法时我们可以通过逐一的考查这几个色谱条件来进行。 考查色谱条件是需要通过在色谱仪上进样来进行的,这就需要我们首先确立一个初始条件,即回答从何开始的问题。在回答好“从何开始”这个问题之前,我们先要了解我们的被分析物,就像一场战争,首先要知道自己的敌人是谁一样,我们要了解它的物理、化学性质,特别是化学结构式非常关键。所以,色谱方法开发工作可以通过如下的步骤来展开:1)收集资料:对它的分子量、结构式,以及在水、甲醇、乙腈、四氢呋喃、正己烷和异丙醇中的溶解度有一个初步的了解。对分子量的了解在选择色谱柱的过程中是非常重要的,因为色谱柱填料的孔径对化合物的分离具有重要的影响,例子如图:http://ng1.17img.cn/bbsfiles/images/2010/07/201007081807_229422_1896702_3.jpg 由此可以看出填料孔径对分离度和峰形是有一定影响的,120A的色谱柱通常适用的范围为分子量10000的,如果分子量太大,在填料为120A孔径的柱子上分离度会比较差,因为样品分子在色谱柱上有较好的保留是由于可以进入到填料的微孔里面,与键合在表面上的C18长链相互作用,通常孔径直径需要大于分子直径的3倍以上才不会对分析造成影响。因此一般分子量10000一下的化合物建议用120A的柱子来分析,分子量大于1W小于20W的用300A的来分析,分子量大于20W的就要用凝胶柱了。 结构式对于分子极性大小的预测以及后续调整峰形时具有非常重要的作用,如-COOH、-NH2、-NHR、-NR2、-OH等都是极性基团,而苯环、己环、-CH=、-CH2-CH3等都是非极性基团,根据经验大致对其极性做一下判断,估计一下可能在C18上(用得最多,我们最熟悉)的保留性能如何,再结合目标化合物在上述所说的几种溶剂中的溶解度状况,对方法开发时可能用正相柱还是反相柱来作一个粗略的判断,以及方法开发完成后的认证有作用。2)选择色谱柱 I)填料孔径的选择:根据所查资料获得的化合物分子量信息来确认色谱柱填料的孔径; II)填料键合相(键合相是指C18、C8、苯基柱等)的选择:在没能查到做过该样品的相关资料之前,或者并不了解其极性之前,通常最好选择C18柱作为初始的色谱条件。因为C18柱是我们用得最多的,也是对其色谱保留性能最了解和熟悉的,在C18柱上获得的信息我们可以预测其极性,以及为解决遇到的问题问题下一步可能将采取的措施。 III)填料粒径、色谱柱型号的选择:在没有特别指明之前,最好使用我们常用的5um、4.6×150mm或250mm,和前面首选C18作初始条件一样,是为了方便预测其保留性能。3)检测器和波长的选择 目前使用最为普遍的是UV检测器,因此,在不了解其是否有紫外吸收的情况下,我们先要了解其这一性能,用标准品配成合适的溶液进行紫外扫描,收集目标化合物最大吸收波长的数据,确定波长;或者是在有DAD检测器的条件下进几针标准品溶液,通过DAD的三维谱图可以获得化合物最大吸收波长的相关信息。如无紫外吸收,则需选用合适的检测器。因为检测器是我们监测化合物是否出峰的工具,是我们的能看到化合物的“眼睛”,也是我们开发方法的基础,因此非常重要,需认真选择。[font=Times New
今天对之前讲了几个不同模式的分析方法开发做一个小小的汇总,高效液相色谱方法的开发是一个繁复的过程,但不管再繁复,也有其规律可寻。方法开发过程中,一个总的原则是:先找到目标化合物的峰,然后调整峰形,再是进一步完善。 01.样品特性的了解 在方法建立之初,应该对样品的化学组成有一定的掌握。如果样品中有酸性或碱性的化合物,可能需要在流动相中加入缓冲液来控制pH。样品化合物的pKa值,如果已知,对方法建立非常有帮助。样品的分子量也可能影响起始实验分离条件的选择。如果在文献中发现类似的方法,可以借鉴并改良。如果产品与自家的其他产品类似,可先采用自家的平台方法进行摸索 。 如果样品比较杂,需评估是否需要对样品做一些预处理,以去除那些可能会损害柱子或干扰目标的化合物成分。这包括样品溶解、样品净化、样品浓缩、样品提取、样品衍生化、样品过滤和样品pH调节 。 02.分析方法开发模式的选择 反相色谱法一般是HPLC方法建立的一个默认选择,但其他色谱模式如正相色谱法(NPC)、亲水色谱(HILIC)、离子交换色谱(IEC)和体积排阻色谱(SEC)可能更适合某些样品。选择色谱模式时,需要考虑样品的化学和物理特性 。 1)反相色谱(RPC): a. 机理:基于分析物在疏水固定相和极性流动相之间的分配差异。固定相通常是C18或C8等烷基键合硅胶,流动相为甲醇、乙腈或含水相的缓冲液。b. 适用性:适用于分离非极性、极性或离子型化合物,是目前应用最广泛的色谱模式,特别适合分析小分子化合物。 c. 特点:分辨率高、平衡速度快,可改变流动相的组成和pH值来优化分离。 d. 注意事项:对于可离子化化合物,可添加离子对试剂的方式进行分析。 2)正相色谱(NPC): a. 机理:基于分析物在极性固定相上的吸附/解吸附过程。固定相通常是硅胶或氧化铝,流动相为非极性和弱极性溶剂,如正己烷、二氯甲烷等。 b. 适用性:适用于非极性与弱极性化合物的分离,如脂溶性维生素、甾体激素等。c. 特点:在极性填料表面可能产生死吸附,导致重现性较差。 3)亲水色谱(HILIC): a. 机理:基于分析物在流动相与固定相表面富水层之间的分配差异。固定相为极性基团键合填料,流动相为含水的有机溶剂。 b. 适用性:特别适合极性化合物的分离,如糖、极性代谢物等。 c. 特点:有时被称为含水正相色谱,是高极性化合物分析的重要手段。 4)离子交换色谱(IEC): a. 机理:基于分析物所带电荷与离子交换剂上带相反电荷的基团之间的相互作用。 b. 适用性:适用于离子化化合物的分离,如氨基酸、蛋白质等。 c. 特点:离子交换剂可以是阴离子或阳离子交换剂,通过改变pH或离子强度实现分离。 5)体积排阻色谱(SEC): a. 机理:基于不同分子量组分在填料内的流经路径差异,实现分离。 b. 适用性:适用于大分子化合物的分子量测定和分布分析,如聚合物、蛋白质等。 c. 特点:通常不适用于小分子之间的分离,因为分辨率较低。 03.流动相的选择流动相的选择因素包括极性、pH、粘度和添加剂。根据样品的极性选择合适的溶剂或溶剂组合,调节流动相的pH值以适应样品组分的性质,选择低粘度流动相以利于分离,并在流动相中加入缓冲液或其他添加剂以增强分离效果 。 1)反相色谱:最常用的液相色谱模式,固定相通常是非极性的,而流动相多为水和有机溶剂的混合物。常用流动相溶剂包括水、甲醇(MeOH)和乙腈(ACN)。常用添加剂包括磷酸盐缓冲液、醋酸盐缓冲液、甲酸或乙酸和三氟乙酸(TFA)。 2)正相色谱:多用于分离极性样品,固定相极性较高,流动相则使用非极性或弱极性溶剂。常用流动相溶剂包括己烷/异辛烷、二氯甲烷、乙酸乙酯和氯仿。添加剂包括异丙醇和酸碱调节剂。 3)离子交换色谱:通过离子交换基团的作用分离离子型样品。常用流动相溶剂与缓冲液包括磷酸盐、醋酸盐、硼酸盐等。有机溶剂如甲醇和乙腈可与缓冲液混合以增强洗脱能力。添加剂包括酸碱调节剂和离子对试剂。 4)尺寸排阻色谱:主要用于分离大分子物质,如蛋白质、多糖等。常用流动相溶剂包括水相缓冲液和有机溶剂。添加剂包括防腐剂和pH调节剂 。 03.色谱柱的选择 1)孔径选择:对于分子量小于5000的小分子化合物,通常选择小孔径(60-100?)填料柱,以便样品分子能够进入填料孔中,实现良好的分离;对于大分子如蛋白质和多肽,应选择孔径较大的填料柱(如300?),以避免分子尺寸过大而无法进入孔径较小的填料孔中,导致分离效果不佳。 2)粒径选择:标准HPLC柱的粒径为5μm,适用于大多数常规分析。 对于需要快速分析或更高分离度的应用,可以选择更小粒径的填料,如3.5μm或1.8μm,以提高柱效和分离度。 3)长度选择:色谱柱的长度和内径也会影响分离效果。常见的配置有4.6mm内径的柱,长度从50mm到250mm不等,适用于不同的分析需求;较短的色谱柱(如50mm或75mm)适用于快速分析,而较长的色谱柱(如150mm或250mm)则适用于需要更高分离度的应用。 注:如果可以的话,大家也可以上USP的官网查查色谱柱的相关信息,美国药典(USP)对色谱柱有特定的分类和要求,如L1、L3、L7等,这些分类基于填料的化学和物理特性。 04.检测器的选择 检测器的选择取决于样品的特性、分析目标以及所需的灵敏度和选择性。常用的HPLC检测器包括紫外-可见光(UV)检测器、荧光检测器(FD)、示差折光检测器(RID)和蒸发光散射检测器(ELSD) ,这里就不额外细说了。 05.分离条件的选择 在知道样品的特性、色谱模式、流动相的选择、色谱柱的选择以及检测器的确定后,可以对方法进行初步分离筛选。这包括梯度的优化、流速、柱温和样品上样量 。 1)梯度的优化:确定合适的起始和终止有机溶剂浓度、梯度时间以及流速,通过初步的梯度侦测实验评估分离效果,然后根据需要调整梯度范围和条件以优化分离。这个过程需要考虑色谱柱的特性、样品的复杂性以及仪器的延迟体积,以确保有效的分离和缩短分析时间。 2)流速的优化:流速通常根据色谱柱的耐受压力和分析需求确定。如果目标物与杂质分离较远,可以在压力允许的条件下,增加流速,缩短分析时间。 3)柱温的优化:柱温的选择会影响分离速度和柱压,一般设定在室温至35℃之间。另:我们还考虑样品的溶解性和稳定性以及确定合适的上样量是比较重要的,因为这直接影响色谱分离的效果和分析结果的准确性。样品需要在流动相中充分溶解以避免柱堵塞,其稳定性在不同储存条件下会影响结果的可靠性,而上样量则决定了检测的灵敏度和重复性。 https://ng1.17img.cn/bbsfiles/images/2024/10/202410170911224386_836_3203140_3.png!w490x14.jpg 总计一下: 高效液相色谱(HPLC)方法的开发是一个复杂的过程,但只要掌握了基本步骤,就能顺利进行,期间的反复折腾是在所难免的。 首先,了解样品的特性是关键,比如它的化学组成、分子量和pKa值,这些信息能帮助你选择合适的色谱模式,比如反相、正相、亲水、离子交换或体积排阻等。接着,选择合适的流动相和色谱柱,调整流动相的组成和pH值,以及色谱柱的孔径、粒径和长度,来优化分离条件。检测器的选择也很关键,它取决于样品的特性和分析需求。最后,别忘了考虑样品的溶解性和稳定性,以及上样量,这些因素都会影响分离效果和分析结果的准确性。 总之,HPLC方法开发就是一个从了解样品开始,逐步调整和优化,直到找到最佳分离条件的过程。
因7月10-12日赴青岛参加仪器仪表学会[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]专业委员会理事会议,活动改到7月18日,本活动由液相色谱爱好者自发组织,自愿演讲,没有报酬,不代表任何厂家。活动时间:2009年7月18日,9:30-16:30,星期六一天。 活动地点:上海市梅陇路130号 华东理工大学 实验十五楼7楼726会议室。参加人数:根据场地的大小,建议不超过35人。活动费用:这次不收费,但午餐费用自理,暂定10元/人。报 告 人: 恐龙、 amian、小k,spb_tang等。报告内容:(暂定,等补充) 恐龙:奶粉中三聚氰胺色谱分析方法的比对(采用离子对色谱、亲水色谱以及离子交换色谱三种不同的液相交换机理,比较各自方法的优缺点) 恐龙:实用HPLC方法的建立 amian:An Efficient Approach to Column Selection in HPLC Method Development spb_tang:液相色谱手性分离(手性化合物液相色谱分离的方法建立) 小K:液相色谱仪的维护和保养请准备参加的人员,在发帖处回复,同时发站内短信给我,姓名,电话,单位以及e-mail。同时提出对这次沙龙的要求。在确定日程后发通知给大家如有谁愿意进行上台交流的,请积极报名。
液相色谱方法开发中,如何选择合适的缓冲盐溶液,或离子对试剂呢?麻烦各位前辈讲解下
想做盐水中溶剂定量测试,帮帮看怎么用液相色谱做。是否可做。
[color=#3e3e3e] 问题:我们开发了一种方法来检测食物样品中的苯二甲酸,此法是先对样品进行皂化处理,然后用反相离子对色谱法来分析。经皂化后,基体的酸性非常强。在所有分析方法中,是液相色谱(LC)法最好,还是离子交换色谱法更加适合呢?[/color][color=#3e3e3e][/color][color=#3e3e3e] 解答:对于如苯二甲酸的酸性样品,离子对色谱法是可取的,离子交换色谱法也是可行的,但我选择了从一种较为传统的技术开始。通常我喜欢使方法简洁一些。方法越是简单,引出的问题也就越少。因此,我从反相色谱法开始研究,它使用低pH值的流动相。(如果你决定用离子对或离子交换色谱法,在本节的末尾部分我就这两种方法如何进行添加了一些论述。)[/color][color=#3e3e3e] 从15或25cm×4.6mm,5um的C-8或C-18色谱柱开始。我比较喜欢用新型的碱灭活硅烷作为柱填料,而不喜欢旧型的色谱柱,因为碱灭活硅烷对拖尾较不敏感,并且在较宽的pH范围内稳定。为了在离子抑制的环境下操作,流动相的pH值应低于酸的pKa1-1.5个pH单位。苯二甲酸的第一个pKa为2.9,则需要在pH=1.4-1.9的环境下操作。一般情况下,除非你知道色谱柱在什么环境下是稳定的,否则我们应该尽量避免在pH〈2的环境下操作。我从pH=2.0开始,用25mM的磷酸盐缓冲液作为流动相的水溶液部分,同时用乙腈或甲醇作为有机溶剂。在这些条件下,苯二甲酸未能充分离子化而得不到好的峰形,并且表现得像中性化合物。因为芳香烃的特性,所以用UV检测在255nm应该有可能。[/color][color=#3e3e3e] 我较喜欢用搜索梯度来准确本身的流动相强度,正如以前的“液相色谱的确问题解决”和参考文献2所述。用有选择地逐步处理作为方法开发,开始时用90%有机溶剂作为起点,然后有机溶剂含量逐渐下降10%,直到得到合理的保留时间为止。在样品注射前可调节其pH值,使之与流动相的pH值接近。[/color][color=#3e3e3e] 低pH值流动相中的离子抑制比在高pH值流动相中的有更多优点。低pH值时,苯二甲酸的离子化受到抑制,所以会表现得像中性分子而其保留时间可预测且得到可接受的峰形。低pH值也抑制固定相中硅醇基团的离子化,这有助于减少峰拖尾。所有的反相色谱柱在3〈pH〈7的范围内是稳定的,而较新型的色谱柱可在2〈pH〈8甚至更宽的范围内操作。[/color][color=#3e3e3e] 如果你想在高pH值下操作,你应该知道pH值大于8时柱填料中的碱性硅会溶解。有些色谱柱比其它色谱柱稳定一些,较高的pH值下,封尾的色谱柱比没有封尾的色谱柱更加稳定。在碱性条件下,当用有机缓冲液(如柠檬酸)替代无机缓冲液(如磷酸盐)时色谱柱的稳定性得到改善。一种选择是使用聚合物反相色谱柱。这些聚合物色谱柱对pH值不敏感,但它们趋向于产生比硅胶色谱柱较低的理论塔板数和较宽的峰。[/color][color=#3e3e3e] 你提议的离子交换色谱法是在高pH值分离的另一个可能。离子交换相附着在聚合物小球上,具有你寻找的pH值稳定性,但与相应的反相色谱柱比较,其理论塔板数较低。[/color][color=#3e3e3e] [b]峰变形[/b][/color][color=#3e3e3e][/color][color=#3e3e3e] [/color][color=#3e3e3e]问题:上一部分就苯二甲酸开发分析方法时,我们发现了如果制备苯二甲酸标准溶液时用水代替甲醇则其峰形得到改善。是什么原因导致这样的结果呢?我们使用的流动相是20:80(V/V)的甲醇-5mM磷酸盐缓冲液,并加入10mM四戊铵溴化物作为离子对。[/color][color=#3e3e3e] 解答:这样的结果是由注射入太大量的过强的溶剂引致的。图1解析了这个问题。图1a所示是变形峰,是将30ul样品注射入流动相的结果,样品用乙腈溶解,而流动相是含乙腈18%的水溶液。图1b所示的是正常峰,是用流动相作为注射溶剂溶解相同的样品。如果样品用不同于流动相的溶剂溶解,当被注射入时,样品溶液与流动相混合,并被稀释。如果注射的溶液比流动相强度大,则样品像在较强溶剂中一样会立即移动,并且较快地通过色谱柱,正如图1a所示,其保留时间比较短。当注射入的溶液与流动相混合时,有些分子与流动相的混合比其它分子更快,则它们穿过色谱柱的速率将发生改变,则谱带发生变形。如图1a所示,峰变形现象对较早洗脱的峰影响较大。解决将注射溶液量减至最少的问题的关键是使稀释在瞬间发生或者用强度不大于流动相的溶剂来溶解样品。较弱的溶剂在色谱柱中将样品浓缩,因此得到的峰往往是比注射入较强溶剂时更窄。[/color][color=#3e3e3e] 因此作为一般规律,如果样品溶于比流动相强的溶剂,则注射体积应少于25ul。注射容积取决于注射溶剂与流动相之间到底存在多大的差异,此差异很容易凭经验判断――只是等体积地增加注射的量直到峰开始变形,然后返回两个单位就可以了。在读者的问题中,样品溶于甲醇,但甲醇比流动相强得多,所以他得到变形的较宽的峰。当他用水代替甲醇时,则样品溶液弱于流动相,峰形就得到了改善。在离子对色谱法中,总是用流动相作为样品溶剂以减少基线后移现象。[/color][color=#3e3e3e][/color][color=#3e3e3e] [b]干扰峰[/b][/color][color=#3e3e3e] 问题:在反相LC分离法中,怎样避免溶剂前置峰对分析峰产生的干扰呢?[/color][color=#3e3e3e][/color][color=#3e3e3e] 解答:有些化合物不具保留性,在开始分离时就被洗脱下来,避免这些物质的干扰的最好的方法是增加待分析化合物的保留时间。通常如果保留因子(k)大于1,则其色谱法和分离效果都会比较好。利用溶剂前沿作为规则可估计出k的值。色谱图的第一个峰通常是溶剂前沿峰或杂质峰,此峰的洗脱时间为色谱柱的死时间(t0),此时间表示一个在色谱柱中不保留的化合物通过色谱柱的时间。紧跟着死时间出来的是与色谱柱作用很小,并且很难从溶剂前沿和其它化合物的杂质峰中分离开来的物质。为了获得k值大于1,被检测的化合物的保留时间必须是死时间的两倍以上。例如,图1b中9.03min处的峰,其k值大约为1。[/color][color=#3e3e3e] 你可以通过使用较弱的溶剂来增加保留时间。对于反相LC,弱溶剂一般是水或缓冲溶液。每改变溶液中的有机溶剂含量的10%,则保留时间大约变化3倍。为了获得期望的保留时间,你可以利用这个“3倍规则”来估计需要改变多少有机溶剂。[/color][color=#3e3e3e] 如何开始?[/color][color=#3e3e3e][/color][color=#3e3e3e] 问题:就反相LC分离而言,我看了很多关于选择初始条件的文献,但总体来说觉得很混乱,C-8好还是C-18好呢?我需要一根长为15cm的色谱柱还是25cm的色谱柱呢?我应该用乙腈还是甲醇那一种作为有机溶剂呢?就初始条件的选择你能给我一些指引吗?[/color][color=#3e3e3e] 解答:让我们单独地分析每一个参数吧。首先,C-8好还是C-18好,又或者是其它固定相更好呢?就大多数的应用而言,你选择任何一种固定相都只有很少的差异。对于某些物质,C-18比C-8更具保留性,所以极性较小的样品选用C-8柱比较适合,同时,极性越强的物质在C-18柱中的保留性就越强。对大部分物质而言,这样选择色谱柱是正确的。填料物质的特性是一个更重要的选择。新型的、洁净的、碱性去活硅(B型)有利于新方法的开发。在我的经验中,这些固定相比旧型的固定相总是产生更好的峰形和更少的拖尾。我坚信,你为色谱柱付出多少就有多少收获--$200一根的色谱柱不可能给你$400一根的色谱柱的运行水平。当然例外是存在的,但对大部分情况而言,当你在方法的开发上花费了数千美元并在分析上花费了数万美元时,色谱柱的分离能力有可能很差吗?[/color][color=#3e3e3e] 色谱柱长度是另一个反复选择的内容。大部分微粒的分离需要8000-10000的塔板数,填充5um微粒的15cm长的色谱柱或含有3um微粒的7.5-10cm长的色谱柱对实际样品会产生这个塔板数。所以仅从塔板数来看,长为15或25cm的色谱柱都是合适的。我比较喜欢用15cm×4.6um,3.5-um的色谱柱,因为它们能在流速为2ml/min,同时柱压为2500psi的条件下操作。较长的25-cm的色谱柱对于相同的柱压要求较低的流速。较长的色谱柱产生大约3倍的通过时间,这是因为柱长和流速大约影响整个分析结果的30%。使用一根新型的7.5cm×4.6um,3.5-um的色谱柱是另一个选择。这些色谱柱在大约一半的时间内产生与15cm的色谱柱相近的塔板数。你必须使用较短的、小微粒色谱柱避免产生柱外带加宽现象。你也可以使用窄孔柱(1-2mmi.d.),但他们也对由柱外因子引起的带加宽非常敏感。[/color][color=#3e3e3e] 最后,有机溶剂也是经常选择的内容。溶剂应该与水完全混溶,与分析物及色谱柱均不起反应,粘度低,适用于所使用的检测器。最常用的三种溶剂是乙腈、甲醇和四氢呋喃。四氢呋喃是平时最坏的选择―操作时令人感觉不适,化学不稳定(放置一段时间后会形成过氧化物),平衡速度慢。甲醇是基本无毒的,并且对于检测波长高于220nm的物质是一个好的选择。然而,我的第一选择是乙腈,因为我的实验开发的许多方法都是需要在低波长检测的。[/color][color=#3e3e3e] 总而言之,我喜欢的初始条件是15cm×4.6mm,5um的C-8或C-18色谱柱,流速为2ml/min,乙腈-水或乙腈-缓冲溶液作为流动相。我也成功使用过7.5cm×4.6mm,3.5-um的色谱柱。这些色谱柱中的任何一根都会提供一个好的出发点,因为它们对于大部分的分离而言都提供了足够多的塔板数,能在较低波长下检测,并且移动速率快。说到这,我认为使用长为15或25cm的C-8或C-18色谱柱,选择乙腈或甲醇作为流动相,这里的任何一个组合都是非常可行的―这就是你的选择。[/color][color=#3e3e3e][/color][color=#3e3e3e] [b]结论[/b][/color][color=#3e3e3e] 为一个新方法选择初始条件,包括选择色谱柱、流动相和注射溶剂。虽然这些因素的许多组合都是可行的,但使用低pH值的流动相、反相色谱柱以及与流动相相似的注射溶剂,会给你开始的成功带来最大的可能。[/color]
[flash=720,540]http://ng1.17img.cn/bbsfiles/images/2017/10/200891321537_01_0_3.swf[/flash]点击下部俩小三角方向钮可观看下一页或返回,点击刷新按钮可返回首页。提示:1、要查找该资料的下载版可点击:[url=http://www.instrument.com.cn/download/search.asp?sel=admin_name&keywords=wsy18&page=1][查看该用户在资料中心上传的资料][/url];2、如资料不能打开,请下载安装以下FLASH控件:[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=32805]askwhy_flash[/url]。链接:[url=http://www.instrument.com.cn/bbs/shtml/20080913/1481325/]【分享】液相网上培训课件……液相色谱应用及方法开发(下)[/url]
01.NPC方法开发的一般步骤 1)色谱柱的选择:根据待分析样品的性质和分析要求,选择一个具有极性固定相的色谱柱,如硅胶或氰基柱。柱子的粒径、孔径和长度都会影响分离效果。(正相色谱详细的原理请参见 正相色谱小知识-原理及试剂的选择 https://bbs.instrument.com.cn/topic/8433300) 2)对样品进行预处理:根据样品的极性,可能需要将其溶解在适当的溶剂中,以确保样品能够被流动相有效携带通过色谱柱。 4)选择色谱模式:NPC模式;流动相的组成通常使用非极性或弱极性的溶剂,如正己烷、异丙醇或它们的混合物。流动相的组成决定了化合物的保留和分离。 5)选择检测器:根据样品的性质选择合适的检测器,如紫外-可见光检测器(UV)、蒸发光散射检测器(ELSD)或质谱检测器(MS)。 6)选择分离条件:根据初步分析的结果,调整流动相的组成、流速或柱温,以优化分离效果。可能需要进行多次试验来找到最佳的条件。 7)预料、识别和解决潜在问题:预料可能出现的问题,如柱堵塞、样品降解、峰形不佳等;识别问题的原因,如样品溶剂不兼容、流动相污染等;解决问题,如更换色谱柱、优化流动相组成、调整样品处理方法等。 8)进行方法的部分验证和系统稳定性测试:进行系统适用性测试,包括理论板数、拖尾因子和分离度;进行部分方法验证,包括准确度、精密度、线性范围、检测限和定量限、耐用性;测试系统稳定性,包括连续运行条件下的系统变异性。 9)优化和调整:根据初步实验结果,优化分离条件,如调整洗脱梯度、流速或柱温;以提高方法的灵敏度和选择性。 10)最终验证:进行全面的方法验证,包括交叉验证和独立实验室验证;确定方法的可靠性和重现性。 https://ng1.17img.cn/bbsfiles/images/2024/10/202410160920234182_5088_3203140_3.png!w690x834.jpg 02.NPC方法开发的调整考量 1)流速的优化 a.色谱柱的效率与流速的关系:在正相色谱中,流速会影响柱效,即理论塔板数(N)。存在一个最优流速范围,在此范围内色谱柱能够提供最高的分离效率。流速过低会增加扩散,导致柱效下降;流速过高则可能由于湍流效应而损失效率。 b. 流速与分离度的关系:流速的选择直接影响分离效果和分析时间。流速过快可能导致峰宽增加,从而降低分辨率;流速过慢则会造成分析时间过长。通过改变流速,可以改变色谱柱的效率,进而影响理论塔板数,并将这些数据与流速作图,以确定最佳流速 。 c. 系统压力与流速的关系:流速的增加可能会导致系统压力增加,需要确保色谱系统和色谱柱能够承受相应的压力。在正相色谱中,通常使用高粘度的流动相,如己烷或异丙醇,这可能导致系统压力较高。因此,在选择流速时,需要考虑系统的工作压力限制 。 d. 样品性质与流速的关系:不同的样品可能需要不同的流速以实现最佳分离。例如,对于分子量较大或极性较强的样品,可能需要较低的流速以确保足够的保留和分离。而对于分子量较小或极性较弱的样品,则可能需要较高的流速以减少分析时间 。 2)柱温的优化 a.保留时间和分离效率与柱温的关系:柱温的变化会直接影响分析物在色谱柱中的保留时间。通常,提高柱温会减少分析物与固定相之间的相互作用,导致保留时间缩短。温度的升高也有助于降低流动相的粘度,进一步提高了溶质的扩散速度,从而影响分离效率和分辨率。 b. 样品的热稳定性与柱温的关系:样品的挥发性、热稳定性和化学性质等都会影响柱温的选择。对于热敏感的样品,需要避免在过高的温度下进行分析以防止样品降解。此外,一些样品可能在高温下出现结构修饰,从而影响分析结果。 c. 流动相的粘度和溶剂强度与柱温的关系:柱温的升高会降低流动相的粘度,影响其溶剂强度,从而改变流动相与固定相之间的相互作用。这会改变分析物的保留特性和选择性,进而影响色谱峰的形状和分离度。 d. 系统压力和色谱柱的稳定性与柱温的关系:柱温的变化会影响流动相的粘度,进而影响系统压力。因此,在选择柱温时,需要考虑系统的工作压力限制和色谱柱的热稳定性,以避免超过系统的最大压力承受能力或损坏色谱柱。 3)流动相的优化 a.溶剂的极性与流动相的关系:选择合适的流动相极性是至关重要的,因为它直接影响分析物在色谱柱上的保留行为。在正相色谱中,通常使用非极性或弱极性的溶剂,如己烷、异辛烷或氯仿等,作为流动相的主要成分。流动相的极性应与分析物的极性相匹配,以实现有效的分离。 b. 溶剂的组成比例与流动相的关系:在正相色谱中,流动相的组成比例(例如,己烷与乙酸乙酯的比例)对分离选择性有显著影响。通过调整流动相中不同溶剂的比例,可以改变分析物的保留时间和分离度,从而优化色谱分离。 c. pH值与流动相的关系:对于具有酸碱性质的分析物,流动相的pH值会影响其电荷状态,进而影响保留时间。通过调节流动相的pH值,可以控制分析物的解离程度,优化分离。 d. 溶剂强度与流动相的关系:流动相中极性溶剂的比例可以调节洗脱能力,影响分析物的保留时间。在正相色谱中,增加极性溶剂的比例可以增强洗脱能力,减少分析物在柱上的保留。这种调整对于优化分离条件,特别是对于具有不同极性的分析物混合物,尤为重要。 e. 溶剂的兼容性与流动相的关系:流动相应与检测器兼容,确保检测灵敏度与信号稳定性。例如,如果使用紫外检测器,流动相在检测波长下应无吸收或吸收很小 。 [/color]05.NPC方法开发的注意事项 1)流动相的优化:流动相通常由非极性溶剂组成,如正己烷、氯仿等。流动相的极性应与分析物的极性相匹配,以实现有效的分离。 2)系统兼容性:在正相色谱中,需要注意整个液相系统应不含水和盐,因为含水过多会将硅胶成分洗脱出来。因此,在使用正相色谱时,需要将系统中的盐充分冲洗出系统,并且液相的洗针溶剂、洗泵阀的溶剂也需要更换成异丙醇等过渡溶剂。 3)色谱柱的选择:正相色谱通常使用硅胶柱,但也可以选用其他极性固定相,如CN基、Diol和氨基柱。硅胶柱由于其高比表面积和多孔性,是正相色谱中最常用的填料。 4)色谱柱的维护:正相色谱柱需要适当的活化和保存,以保持其性能。例如,硅胶柱可以直接用纯的正己烷保存,也可用异丙醇:正己烷(10:90)保存。一般不考虑用纯的异丙醇保存,因为异丙醇黏度较大,替换时间较久。 https://ng1.17img.cn/bbsfiles/images/2024/10/202410160921528181_6876_3203140_3.png!w490x14.jpg 总结一下: 开发正相色谱(NPC)方法时,有几个关键点需要特别注意。首先,选择合适的色谱柱是基础,通常我们会根据分析物的极性来挑选硅胶或者氰基柱。样品预处理也很关键,确保它们能够与流动相兼容,这样才能在色谱柱中得到良好的分离。流动相的选择和优化是NPC方法开发的核心,我们通常会用一些非极性或弱极性的溶剂,比如正己烷或异丙醇。调整流动相的组成和比例,可以精细控制分析物的保留时间和分离度。同时,流速和柱温的调整也会影响分离效率,需要找到平衡点,以确保既不会太慢也不会因为太快而损失分辨率。检测器的选择依据样品的特性,UV、ELSD或MS都可以,关键是要确保与流动相兼容,以获得稳定的信号。在整个方法开发过程中,可能会遇到各种挑战,比如柱堵塞或样品降解,这时候就需要及时诊断问题并找到解决方案。最后,别忘了色谱柱的维护,正确的活化和保存可以保持色谱柱的性能。总的来说,NPC方法开发需要耐心和细致的调整,但一旦优化得当,就能获得非常可靠的分析结果。
[flash=720,540]http://ng1.17img.cn/bbsfiles/images/2017/10/200891322013_01_0_3.swf[/flash]点击下部俩小三角方向钮可观看下一页或返回,点击刷新按钮可返回首页。提示:1、要查找该资料的下载版可点击:[url=http://www.instrument.com.cn/download/search.asp?sel=admin_name&keywords=wsy18&page=1][查看该用户在资料中心上传的资料][/url];2、如资料不能打开,请下载安装以下FLASH控件:[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=32805]askwhy_flash[/url]。链接:[url=http://www.instrument.com.cn/bbs/shtml/20080913/1481315/]【分享】液相网上培训课件……液相色谱应用及方法开发(上)[/url]
今天主要讲讲IEC方法开发过程中的一般考量,IEC的方法开发相比于RP会略微的难一些,并不会很复杂。 01.IEC方法开发的一般步骤 1)选择离子交换柱:根据待分析样品的性质和分析要求,选择适合的离子交换柱。常见的离子交换柱有阳离子交换柱、阴离子交换柱和混合离子交换柱等 。(离子交换详细的原理请参见https://bbs.instrument.com.cn/topic/8432724液相色谱|离子交换色谱法的小知识) 2)对样品进行预处理:针对待分析样品的特性,开发适合的前处理方法,如样品的提取、富集、转化等 。 3)选择色谱模式:IEC模式;流动相的组成通常是结合着无机盐缓冲溶液(如磷酸盐缓冲溶液、Tris-HCl盐缓冲溶液、柠檬酸盐缓冲液等)。 4)选择检测器:根据样品的化学性质和检测需求选择合适的检测器,如紫外-可见光检测器(UV)、荧光折光检测器(FLD)或安培检测器(AD),确定检测器的参数设置;偶尔也会联用。 5)选择分离条件: a. pH梯度分离:通过改变流动相的pH值来实现分离。随着pH的变化,分析物的电荷状态会改变,从而影响其在色谱柱上的保留时间。这种方法适用于分离带电异构体,如单克隆抗体的带电变体。 b. 盐浓度梯度分离:过逐渐增加流动相中的盐浓度来实现洗脱。随着盐浓度的增加,盐离子与分析物竞争与色谱柱上的离子交换位点结合,从而逐渐将分析物洗脱下来。这种方法适用于各种离子的分离,[/color]如阳离子和阴离子分析。 6)预料、识别和解决潜在问题:预料可能出现的问题,如柱堵塞、样品降解、峰形不佳等;识别问题的原因,如样品溶剂不兼容、流动相污染等;解决问题,如更换色谱柱、优化流动相组成、调整样品处理方法等。 7)进行方法的部分验证和系统稳定性测试:进行系统适用性测试,包括理论板数、拖尾因子和分离度;进行部分方法验证,包括准确度、精密度、线性范围、检测限和定量限、耐用性;测试系统稳定性,包括连续运行条件下的系统变异性。 8)优化和调整:根据初步实验结果,优化分离条件,如调整pH范围、缓冲盐比例、流速或柱温;以提高方法的灵敏度和选择性。 9)最终验证:进行全面的方法验证,包括交叉验证和独立实验室验证;确定方法的可靠性和重现性。 https://ng1.17img.cn/bbsfiles/images/2024/10/202410151254286091_8187_3203140_3.png!w690x668.jpg 02.IEC方法开发的调整考量 1)流速的优化 a. 分辨率与流速的关系:流速直接影响分离效率和分析时间。较低的流速通常能提高分离效率,但会增加分析时间;而较高的流速可以缩短分析时间,但可能会降低分离效率。因此需要在分辨率和分析效率之间找到平衡。 b. 系统压力与流速的关系:流速的增加可能会导致系统压力增加,这需要确保色谱系统和色谱柱能够承受相应的压力。过高的流速可能会超出系统的工作压力限制。 c.灵敏度与流速的关系:流速的变化会影响检测器的响应,尤其是在使用电导检测器时。较低的流速可能会增加检测灵敏度,因为分析物在检测器中的时间更长,从而增加了信号的积累。但过低的流速可能导致分析时间过长,影响整体分析效率。 d. 样品性质与流速的关系:流速对样品在色谱柱中的扩散和峰形有显著影响。较高的流速可能会减少样品分子与固定相之间的相互作用时间,导致峰形变宽和分辨率下降。优化流速可以帮助获得良好的峰形,提高分析的准确性和重复性。 2)柱温的优化 a. 保留时间与柱温的关系:柱温会影响分析物在色谱柱中的保留时间。通常,提高柱温会减少分析物与固定相之间的相互作用,导致保留时间缩短。这是因为较高的温度增加了分子的运动速率,减少了它们在固定相上的吸附时间。 b. 流动相粘度与柱温的关系:温度的升高通常会降低流动相的粘度,从而增加分子在柱内的扩散性。这可能会影响分离效率和分辨率。 c. 分析时间与柱温的关系:柱温的升高会增加分析物在色谱柱中的迁移速度。这是因为较高的温度通常会导致分子运动加快,从而减少分析物在色谱柱上的保留时间。如果温度过高,反而会导致分析物迁移过快,从而降低分离效率,增加分析时间。 d. 系统压力与柱温的关系:柱温的变化会影响流动相的粘度,进而影响系统压力。尽管在IEC中这种影响可能不如在RP中那么显著,但仍然需要考虑。温度升高通常会降低流动相的粘度,从而在一定程度上降低系统压力,但比较有限。 e.检测灵敏度与柱温的关系::柱温对检测灵敏度也有一定的影响。例如,在电导检测中,温度的变化可能会影响离子的电导率,从而影响检测信号的强度。 3)流动相的优化 ①.pH梯度洗脱下 a. 缓冲液的选择和pH范围:选择合适的缓冲液体系对于pH梯度洗脱至关重要。缓冲液需要能够在较宽的pH范围内保持稳定,以实现连续变化的pH梯度。例如,磷酸盐缓冲体系是一种常用的缓冲系统,它具有较宽的pH范围(一般为pH 5.7到8.0),适用于多种分析需求。 b 缓冲液的浓度:缓冲液的浓度会影响洗脱的效率和分辨率。过高的浓度可能会影响柱寿命和系统压力,而过低的浓度可能降低分离效果。需要通过实验找到最佳的缓冲液浓度,以获得最佳的分析结果。 c. 梯度程序的设置:梯度程序的设置包括梯度的起始和结束点,以及梯度的变化速率。这些参数需要根据分析物的特性和分离目标来优化。例如,可以通过改变pH梯度的起始和结束点,以及梯度的斜率,来优化分离效果。 d 检测器的兼容性:在pH梯度洗脱中,需要确保所使用的检测器能够与流动相的pH变化兼容。例如,某些检测器可能对pH变化敏感,需要选择能够在所需pH范围内稳定工作的检测器。 ②.盐梯度洗脱下 a. 流动相的组成:选择合适的流动相组成是盐浓度梯度洗脱中的关键。流动相通常由水和有机溶剂(如甲醇、乙腈等)组成,并通过调节溶剂的组成来实现梯度洗脱。对于极性物质的分离,可以选择水-有机溶剂的混合物作为流动相;而对于非极性物质的分离,则可以选择含有缓冲剂的溶液作为流动相。 b. 梯度程序的设置:梯度程序的设置包括梯度的起始和结束点,以及梯度的变化速率。这些参数需要根据分析物的特性和分离目标来优化。梯度程序的优化可以提高分离效率,缩短分析时间,并提高分辨率。(跟pH相似) c. 流速的选择:流速的选择会影响分离效果和分析时间。较高的流速可以缩短分析时间,但可能会降低分离效率。流速的优化需要考虑到分离效果、分析时间和系统压力之间的关系。 d. 检测器的兼容性:在盐浓度梯度洗脱中,需要确保所使用的检测器能够与流动相的盐浓度变化兼容。例如,某些检测器可能对盐浓度变化敏感,需要选择能够在所需盐浓度范围内稳定工作的检测器。 4)缓冲液体系的考量 a. [font=mp-quote, -apple-system-font, BlinkMacSystemFont, &]pH梯度洗脱的缓冲液体系pH梯度洗脱通常需要一个能够在较宽pH范围内保持稳定和缓冲能力的缓冲液体系。这种体系通常由两种或多种具有不同pKa值的缓冲剂组成,以实现从低pH到高pH的连续变化。常用的缓冲液包括:磷酸盐缓冲体系:由磷酸二氢钠(NaH2PO4)和磷酸氢二钠(Na2HPO4)组成,具有较宽的pH范围(一般为pH 5.7到8.0),适用于许多生物分子的分离。(当然也包括一些钾盐体系)醋酸盐缓冲体系:由醋酸和醋酸钠组成,适用于pH范围较为酸性的环境。柠檬酸盐缓冲体系:由柠檬酸和柠檬酸钠组成,适用于pH范围3.0-6.6,常用于阴离子分析。Tris-HCl缓冲体系:由三羟甲基氨基甲烷(Tris)和盐酸组成,适用于pH范围7.10-9.00,常用于生物大分子的分离纯化。b. 盐浓度梯度洗脱的缓冲液体系盐浓度梯度洗脱则侧重于通过改变流动相中的盐浓度来实现洗脱。常用的缓冲液体系包括:碳酸盐/碳酸氢盐缓冲体系:由碳酸钠和碳酸氢钠组成,适用于pH范围9.2-10.8,常用于环境样品分析。磷酸盐缓冲体系:也可以用于盐浓度梯度洗脱,通过调整磷酸二氢钠和磷酸氢二钠的浓度,可以改变流动相的离子强度。硼酸/硼砂缓冲体系:由硼酸和硼砂组成,适用于pH范围7.4-8.0,常用于生物样品的分析。Tris-HCl缓冲体系:虽然常用于pH梯度,但在某些情况下也可以用于盐浓度梯度洗脱,尤其是当需要在较宽的pH范围内进行分离时。05.IEC方法开发的注意事项 1)缓冲液的选择:[/color]选择适合的缓冲液体系,确保其在所需pH范围内稳定,以实现有效的分离。 2)梯度洗脱的优化:精心设计梯度程序,包括梯度的起始和结束点以及变化速率,以提高分离效率和分辨率。 3)流速的选择:平衡流速与分离效率和分析时间的关系,选择最佳的流速以获得最佳分离效果。 4)检测器的兼容性:确保所用检测器与流动相的pH变化和盐浓度变化兼容,以保证检测的准确性和稳定性。 5)色谱柱的选择:选择合适的色谱柱,包括填料类型(如阳离子或阴离子交换树脂)和柱尺寸,以实现最佳的分离效果。 https://ng1.17img.cn/bbsfiles/images/2024/10/202410151255489429_6744_3203140_3.png!w490x14.jpg 总结一下:今天说的有点多了,主要是离子色谱里面它又有2种洗脱的方式,大家在使用的过程中,可以足情参考。开发离子交换色谱(IEC)方法时,我们主要关注几个核心步骤:首先是选择一个适合样品性质的离子交换柱,然后对样品进行必要的预处理,比如提取或富集。接下来,我们要确定色谱模式,设置合适的pH梯度或盐浓度梯度,以及挑选一个与我们分析目标相匹配的检测器。在这些步骤中,我们还得不断调整流速、柱温、梯度洗脱程序,以优化分离效果和分析时间。同时,我们得确保流动相的组成能够满足我们的分离需求。整个过程中,我们需要留意潜在的问题,比如样品降解或峰形不佳,并及时解决。最后,我们还需要对方法进行部分验证和系统稳定性测试,确保方法的可靠性。总的来说,虽然IEC方法开发可能比RP色谱稍微复杂一些,但只要我们每一步都细致的考量和优化,就能获得高质量的分析结果。
利用紫外和荧光光谱扫描技术开发高效液相色谱-荧光检测方法全过程荧光是光致发光中的一种,荧光过程是物质吸收入射光进入激发态,从激发态回到基态并发出波长更长得光的过程,在此过程中,物质吸收的光为激发光,发出的光为发射光(这个定义并不准确,有兴趣的版友可以参照相关教科书)。荧光检测在高效液相色谱中是比紫外检测更灵敏的检测方法,但是能够发出荧光的物质并不多,如何判断分析物有没有荧光特性并优化荧光检测器参数是荧光检测方法开发过程的重要内容。荧光检测方法优化的最重要两个参数是确定激发波长和发射波长。二极管阵列检测器(DAD)可以提供分析物在流动相的紫外吸收光谱,基于提取的紫外吸收光谱在日常高效液相色谱分分析中主要有两大作用:1.发现并确定紫外检测器的最佳检测波长;2进行进一步的运算做峰纯度检查,判断有没有共流出物。在这里通过实例向大家介绍二极管阵列检测器的另一用处:二极管阵列检测器辅助荧光检测器开发分析物的高效液相色谱-荧光检测方法。1实验设备和基本实验条件:Waters 2695分离单元Waters 2996 二极管阵列检测器Waters 2475 荧光检测器二极管阵列检测器和荧光检测器串列,荧光检测器在后(检测池耐压较差)二者之间死体积为1ml/min×0.1min。分析物为两种原料药色谱柱:C18,4.6×150mm,5μm柱温:30℃流动相:乙腈:醋酸盐缓冲溶液=65:352实验A:二极管阵列检测器获取紫外吸收光谱,荧光检测器扫描发射光谱实验仪器设置 :2996 3D采集模式,获取210-400nm紫外吸收谱图2475 3D采集模式,固定激发波长220nm(一般有紫外吸收的物质在210-230nm都有吸收),获取250-650nm发射光谱。利用二极管阵列检测器来判断化合物的出峰时间,图1是在254nm下提取的分析物1和分析物2的色谱图,信号很弱。依照二极管整列检测器提取的色谱图,根据连接二极管阵列检测器和荧光检测器的管路体积,推算二者之间死时间约为0.1min。在荧光检测器中调出发射波长3D图,在250-650nm每间隔50nm提取一次色谱图(即250nm,300nm,350nm…),根据紫外色谱图的分析物保留时间,确定荧光色谱图中分析物的出峰时间。http://ng1.17img.cn/bbsfiles/images/2011/12/201112130845_337609_2265735_3.jpg图1 二极管阵列检测器色谱图和提取的分析物紫外吸收色谱图在提取的荧光色谱图中,分析物1有荧光(300nm,图2),而分析物2没有。在荧光检测中,会有很多杂质峰出现(图3,在发射400nm提取的色谱图),而紫外检测器中不一定会发现,利用二极管阵列检测器获得的谱图有利于准确定位分析物在荧光色谱图出现的位置,排除杂质干扰(图3)。http://ng1.17img.cn/bbsfiles/images/2011/12/201112130846_337610_2265735_3.jpg图2 从激发波谱300nm发射光提取的色谱图http://ng1.17img.cn/bbsfiles/images/2011/12/201112130848_337612
[b]职位名称:[/b]研发应用工程师(液相色谱方法开发)[b]职位描述/要求:[/b]液相色谱产品:色谱柱、固相萃取柱(SPE)、QuEChERS等产品岗位职责:负责新型液相色谱产品的评估工作,并及时撰写相关报告;负责液相色谱分析方法和解决方案等开发工作,并撰写相关报告;负责液相色谱产品生产SOP的建立并培训质检人员;负责实验的记录工作并定期向直属领导汇报工作;可以承担公司内部新产品技术培训工作;公司安排的其他任务。岗位要求:本科及以上学历,化学、化工、材料或生物等相关专业;有分析实验室/第三方检测行业工作经验,熟悉液相色谱仪的操作,或有应用方法开发工作经验者优先考虑;工作认真细致,责任心强,耐压能力强;具有良好的沟通能力和学习能力;熟练掌握办公软件的使用(如EXCEL、WORD、PPT等)。福利待遇:周末双休,五险一金,餐饮补贴,年终奖,法定节假日,节日礼金,年度体检,高温补贴,生日福利,年度旅游,加班费,定期培训等关于纳谱纳谱分析技术(苏州)有限公司是一家从事液相色谱产品研发、生产、销售为一体的初创型科技公司。公司背景雄厚,发展迅速目前仍处于快速发展的前期阶段。公司重视研发型人才的培养,提供共同学习成长进步的机会。 团队年轻,工作氛围良好,期待您的加入![b]公司介绍:[/b] 纳谱分析技术(苏州)有限公司是一家研发,生产和销售液相色谱耗材产品并提供相关技术服务的中外合资企业,由苏州纳微科技股份有限公司投资成立,服务对象主要涉及化工、制药、生物技术、食品安全和环保等行业领域。纳谱公司的产品是在纳微科技研发生产的国际领先的UniSil单分散硅胶微球和UniCore单分散聚合物微球的基础上结合先进的微球表面处理和键合封端修饰技术而推出的新一代色谱分离材料产品,性能优异,稳...[url=https://www.instrument.com.cn/job/user/job/position/74676]查看全部[/url]
今天对之前讲了几个不同模式的分析方法开发做一个小小的汇总,高效液相色谱方法的开发是一个繁复的过程,但不管再繁复,也有其规律可寻。方法开发过程中,一个总的原则是:先找到目标化合物的峰,然后调整峰形,再是进一步完善。 01.样品特性的了解 在方法建立之初,应该对样品的化学组成有一定的掌握。如果样品中有酸性或碱性的化合物,可能需要在流动相中加入缓冲液来控制pH。样品化合物的pKa值,如果已知,对方法建立非常有帮助。样品的分子量也可能影响起始实验分离条件的选择。如果在文献中发现类似的方法,可以借鉴并改良。如果产品与自家的其他产品类似,可先采用自家的平台方法进行摸索 。 如果样品比较杂,需评估是否需要对样品做一些预处理,以去除那些可能会损害柱子或干扰目标的化合物成分。这包括样品溶解、样品净化、样品浓缩、样品提取、样品衍生化、样品过滤和样品pH调节 。 02.分析方法开发模式的选择 反相色谱法一般是HPLC方法建立的一个默认选择,但其他色谱模式如正相色谱法(NPC)、亲水色谱(HILIC)、离子交换色谱(IEC)和体积排阻色谱(SEC)可能更适合某些样品。选择色谱模式时,需要考虑样品的化学和物理特性 。 1)反相色谱(RPC): a. 机理:基于分析物在疏水固定相和极性流动相之间的分配差异。固定相通常是C18或C8等烷基键合硅胶,流动相为甲醇、乙腈或含水相的缓冲液。b. 适用性:适用于分离非极性、极性或离子型化合物,是目前应用最广泛的色谱模式,特别适合分析小分子化合物。 c. 特点:分辨率高、平衡速度快,可改变流动相的组成和pH值来优化分离。 d. 注意事项:对于可离子化化合物,可添加离子对试剂的方式进行分析。 2)正相色谱(NPC): a. 机理:基于分析物在极性固定相上的吸附/解吸附过程。固定相通常是硅胶或氧化铝,流动相为非极性和弱极性溶剂,如正己烷、二氯甲烷等。 b. 适用性:适用于非极性与弱极性化合物的分离,如脂溶性维生素、甾体激素等。c. 特点:在极性填料表面可能产生死吸附,导致重现性较差。 3)亲水色谱(HILIC): a. 机理:基于分析物在流动相与固定相表面富水层之间的分配差异。固定相为极性基团键合填料,流动相为含水的有机溶剂。 b. 适用性:特别适合极性化合物的分离,如糖、极性代谢物等。 c. 特点:有时被称为含水正相色谱,是高极性化合物分析的重要手段。 4)离子交换色谱(IEC): a. 机理:基于分析物所带电荷与离子交换剂上带相反电荷的基团之间的相互作用。 b. 适用性:适用于离子化化合物的分离,如氨基酸、蛋白质等。 c. 特点:离子交换剂可以是阴离子或阳离子交换剂,通过改变pH或离子强度实现分离。 5)体积排阻色谱(SEC): a. 机理:基于不同分子量组分在填料内的流经路径差异,实现分离。 b. 适用性:适用于大分子化合物的分子量测定和分布分析,如聚合物、蛋白质等。 c. 特点:通常不适用于小分子之间的分离,因为分辨率较低。 03.流动相的选择流动相的选择因素包括极性、pH、粘度和添加剂。根据样品的极性选择合适的溶剂或溶剂组合,调节流动相的pH值以适应样品组分的性质,选择低粘度流动相以利于分离,并在流动相中加入缓冲液或其他添加剂以增强分离效果 。 1)反相色谱:最常用的液相色谱模式,固定相通常是非极性的,而流动相多为水和有机溶剂的混合物。常用流动相溶剂包括水、甲醇(MeOH)和乙腈(ACN)。常用添加剂包括磷酸盐缓冲液、醋酸盐缓冲液、甲酸或乙酸和三氟乙酸(TFA)。 2)正相色谱:多用于分离极性样品,固定相极性较高,流动相则使用非极性或弱极性溶剂。常用流动相溶剂包括己烷/异辛烷、二氯甲烷、乙酸乙酯和氯仿。添加剂包括异丙醇和酸碱调节剂。 3)离子交换色谱:通过离子交换基团的作用分离离子型样品。常用流动相溶剂与缓冲液包括磷酸盐、醋酸盐、硼酸盐等。有机溶剂如甲醇和乙腈可与缓冲液混合以增强洗脱能力。添加剂包括酸碱调节剂和离子对试剂。 4)尺寸排阻色谱:主要用于分离大分子物质,如蛋白质、多糖等。常用流动相溶剂包括水相缓冲液和有机溶剂。添加剂包括防腐剂和pH调节剂 。 03.色谱柱的选择 1)孔径选择:对于分子量小于5000的小分子化合物,通常选择小孔径(60-100?)填料柱,以便样品分子能够进入填料孔中,实现良好的分离;对于大分子如蛋白质和多肽,应选择孔径较大的填料柱(如300?),以避免分子尺寸过大而无法进入孔径较小的填料孔中,导致分离效果不佳。 2)粒径选择:标准HPLC柱的粒径为5μm,适用于大多数常规分析。 对于需要快速分析或更高分离度的应用,可以选择更小粒径的填料,如3.5μm或1.8μm,以提高柱效和分离度。 3)长度选择:色谱柱的长度和内径也会影响分离效果。常见的配置有4.6mm内径的柱,长度从50mm到250mm不等,适用于不同的分析需求;较短的色谱柱(如50mm或75mm)适用于快速分析,而较长的色谱柱(如150mm或250mm)则适用于需要更高分离度的应用。 注:如果可以的话,大家也可以上USP的官网查查色谱柱的相关信息,美国药典(USP)对色谱柱有特定的分类和要求,如L1、L3、L7等,这些分类基于填料的化学和物理特性。 04.检测器的选择 检测器的选择取决于样品的特性、分析目标以及所需的灵敏度和选择性。常用的HPLC检测器包括紫外-可见光(UV)检测器、荧光检测器(FD)、示差折光检测器(RID)和蒸发光散射检测器(ELSD) ,这里就不额外细说了。 05.分离条件的选择 在知道样品的特性、色谱模式、流动相的选择、色谱柱的选择以及检测器的确定后,可以对方法进行初步分离筛选。这包括梯度的优化、流速、柱温和样品上样量 。 1)梯度的优化:确定合适的起始和终止有机溶剂浓度、梯度时间以及流速,通过初步的梯度侦测实验评估分离效果,然后根据需要调整梯度范围和条件以优化分离。这个过程需要考虑色谱柱的特性、样品的复杂性以及仪器的延迟体积,以确保有效的分离和缩短分析时间。 2)流速的优化:流速通常根据色谱柱的耐受压力和分析需求确定。如果目标物与杂质分离较远,可以在压力允许的条件下,增加流速,缩短分析时间。 3)柱温的优化:柱温的选择会影响分离速度和柱压,一般设定在室温至35℃之间。另:我们还考虑样品的溶解性和稳定性以及确定合适的上样量是比较重要的,因为这直接影响色谱分离的效果和分析结果的准确性。样品需要在流动相中充分溶解以避免柱堵塞,其稳定性在不同储存条件下会影响结果的可靠性,而上样量则决定了检测的灵敏度和重复性。
今天主要讲讲SEC方法开发过程中的一般考量,SEC的方法开发相比于RP会略微的简单一些,并不会很复杂。 01.SEC方法开发的一般步骤 1)确定溶剂、温度和相化学组合:在购买色谱柱之前,参考聚合物-溶剂参考表(Polymer-To-Solvent Reference Table)来确定适用于您应用的相和溶剂。(参考链接:https://www.agilent.com.cn/cs/library/ technicaloverviews/public/5991-6802CHCN.pdf) 2)确定样品的分子量范围:根据先验知识或产品相关知识,估算样品的分子量范围;也可以用技术手段鉴定样品的分子量。 3)对样品进行预处理:根据样品性质选择合适的溶剂进行溶解;去除样品中的杂质或干扰物,如蛋白质沉淀、离心或过滤;如果需要,进行样品浓缩或稀释,以适应色谱系统的要求。 4)选择色谱模式:SEC模式;流动相的组成通常是无机盐缓冲溶液(如磷酸盐缓冲溶液、Tris-HCl盐缓冲溶液等)。 5)选择检测器:根据样品的化学性质和检测需求选择合适的检测器,如紫外-可见光(UV-Vis)、示差折光检测器(RI)或蒸发光散射检测器(ELSD),确定检测器的参数设置;偶尔也会联用。 6)选择分离条件:设定流速,通常在0.2-1.0 mL/min之间;设定柱温,以优化分离效果。 7)预料、识别和解决潜在问题:[color=#595959]预料可能出现的问题,如柱堵塞、样品降解、峰形不佳等;识别问题的原因,如样品溶剂不兼容、流动相污染等;解决问题,如更换色谱柱、优化流动相组成、调整样品处理方法等。 8)进行方法的部分验证和系统稳定性测试:进行系统适用性测试,包括理论板数、拖尾因子和分离度;进行部分方法验证,包括准确度、精密度、线性范围、检测限和定量限、耐用性;测试系统稳定性,包括连续运行条件下的系统变异性。 9)优化和调整:根据初步实验结果,优化分离条件,如调整缓冲盐比例、流速或柱温;调整检测器参数,以提高灵敏度和选择性。 10)最终验证:进行全面的方法验证,包括交叉验证和独立实验室验证;确定方法的可靠性和重现性。 https://ng1.17img.cn/bbsfiles/images/2024/10/202410151246072688_54_3203140_3.png!w690x707.jpg 图1.SEC方法开发的一般步骤 02.SEC方法开发的调整考量 1)流速的优化 a. 分辨率与流速的关系:在尺寸排阻色谱中,降低流速可以提高分辨率,因为这有助于减少扩散和提高分子在柱内的停留时间,从而实现更好的分离。然而,较低的流速也会增加分析时间,因此需要在分辨率和分析效率之间找到平衡。 b. 系统压力与流速的关系:较高的流速可能会增加系统压力,特别是当使用较长的柱子或较小的粒径的填料时。系统压力的增加可能导致泵性能下降或柱子损坏,因此需要监控并优化流速以保持在系统的压力限制内;SEC色谱柱耐压一般都较小。 c. 样品性质与流速的关系:不同的样品可能需要不同的流速来实现最佳分离。例如,对于较大的蛋白质或聚合物,可能需要较高的流速来减少扩散和保持合理的分析时间。 2)柱温的优化 a. 保留时间与柱温的关系:理论上,在SEC中温度对保留时间没有影响,因为SEC分离是基于熵驱动的分配过程,而非吸附过程。然而,在实际操作中,温度可能会通过改变蛋白质的构象间接影响保留时间[size=16px]。 b. 流动相粘度与柱温的关系:温度的升高通常会降低流动相的粘度,从而增加分子在柱内的扩散性。这可能会影响分离效率和分辨率。 c. 分析时间与柱温的关系:在某些情况下,提高柱温可以减少分析时间,但这可能会以牺牲分辨率为代价。 d. 系统压力与柱温的关系:提高柱温通常会降低流动相的粘度,从而降低系统压力,但在实际操作中,如果柱温升高导致样品的溶解度降低或色谱柱的性能下降,可能会间接增加系统的压力。SEC分离通常在10~30℃下进行。 e. 样品稳定性与柱温的关系:在方法开发过程中,需要确保所选的柱温不会影响样品的稳定性,特别是在分析温度敏感的生物分子时。 3)流动相的优化 a. 缓冲盐组成与流动相的关系:流动相通常由水相缓冲液组成,如磷酸盐缓冲液或Tris缓冲液,常与氯化钠等盐类配合使用。有时,对于特定的生物分子,可能还会添加有机溶剂,如乙腈或甲醇。优化缓冲液和盐浓度是最大程度提高色谱柱分离效果的关键部分,其目的在于避免造成峰拖尾、峰变形、分离度不佳的次级相互作用以及由流动相引起的蛋白质聚集 。 b. 离子强度与流动相的关系:调整流动相的离子强度可以减少填料与蛋白质之间的次级相互作用。例如,增加氯化钠的浓度可以减少单体的峰拖尾现象并使峰形更窄 。 c. pH与流动相的关系:流动相的pH值对蛋白质的电荷状态和因此与其与填料的相互作用有显著影响。选择合适的pH值可以优化蛋白质的分离 。 d. 缓冲液浓度与流动相的关系:缓冲液的浓度也会影响蛋白质的分离。过高的缓冲液浓度可能导致蛋白质聚集,从而影响分析结果。通常,较低的缓冲液浓度有利于获得更好的分离效果 。 https://ng1.17img.cn/bbsfiles/images/2024/10/202410151247128010_3529_3203140_3.png!w690x706.jpg 图2.不同 NaCl 浓度下的 IgG 色谱图 03.SEC方法开发的注意事项 1)流动相的组成:[color=#595959]选择合适的流动相组成,如水/盐溶液的比例,以确保样品的溶解性和稳定性。流动相的粘度和pH值对分离效果有显著影响。 2)检测器的选择:根据样品的特性选择合适的检测器,如紫外-可见光、荧光或示差折光检测器,并确保检测波长适合样品且流动相无吸收。 3)流速的选择:流速会影响分离度和分析时间。通常,降低流速可以提高分离度,但会增加分析时间。在满足分离度的前提下,适当提高流速可以缩短分析时间。 4)柱温的选择:柱温对样品的溶解度和稳定性有影响。升高柱温可以减少流动相的粘度,提高柱效,但也可能影响样品的构象。选择适宜的柱温以保持蛋白质的天然构象和避免变性 5)色谱柱的选择:根据样品的分子量范围选择合适的色谱柱孔径和粒径,以确保有效的分离。 https://ng1.17img.cn/bbsfiles/images/2024/10/202410151248453443_4365_3203140_3.png!w490x14.jpg 总结一下:在开发SEC方法时,我们通常需要考虑以下几个关键点:首先,得根据样品的分子量和溶解性来挑选合适的溶剂和色谱柱。接着,对样品进行适当的预处理,以确保它们在分析过程中保持稳定。选择合适的流速和柱温也很重要,这两者都会影响分析时间和分辨率。此外,流动相的组成,包括缓冲液的类型和浓度,需要适当调整,以减少样品与柱填料之间的次级相互作用。最后,选择一个适合样品特性的检测器,确保它能够在所需的波长下有效检测。在整个过程中,我们还得留意系统的压力限制,避免过高的压力损坏色谱柱。简而言之,SEC方法开发虽然相对简单,但每一步都需要细致的考量和优化,以确保获得高质量的分析结果。
跟大家分享一下液相色谱讲义,里面包括(1)液相色谱基础知识(2)液相色谱的方法开发-分离机理及色谱柱(3)分离方法,离子抑制及离子对方法介绍(4)梯度方法的开发及梯度分离时的注意事项(5)液相色谱的实用技术,色谱柱的保养、样品前处理(6)液相色谱的定性、定量分析(7)色谱泵和进样器的原理及操作(8)检测器的原理及操作

http://ng1.17img.cn/bbsfiles/images/2010/08/201008180948_237157_2099632_3.jpgL-3000新品发布会视频地址:http://www.instrument.com.cn/custom/SH101945/=====================================================================================================RIGOL L-3000高效液相色谱仪是一套完整的高效液相色谱系统,精心设计的各个组件充分保证了其优良的性能,高度的兼容性保证整机的重复性及稳定性,即使长期运行在超常规HPLC的压力条件下也能保持稳定良好的工作状态和结果输出。L-3000高效液相色谱仪因其优良的性能在分析化学的各个领域都有着广泛的应用,尤其是社会普遍关注的药品质量控制、食品安全,以及环境监测等热点问题方面。同时RIGOL的应用技术支持中心也以其下属的标准化应用实验室和应用技术人员为平台不断研究开发HPLC应用方法,并致力于为客户提供科学有效的分析应用方案。=====================================================================================================版主在这里将带大家了解RIGOL L-3000,感受L-3000在应用与方法上优异的体现!并解答大家对L-3000应用与方法方面的有关问题!(此贴长期保留)--------------------------------------------------------------------------------------------------------关于产品性能请转至:http://bbs.instrument.com.cn/shtml/20100818/2724500/关于RIGOL请转至:http://bbs.instrument.com.cn/shtml/20100818/2724513/=====================================================================================================问题:1、 如需应用RIGOL L-3000完成某中草药有效成分含量的分析实验,那么至少需配备哪些必要的组件?2、 在应用高效液相色谱进行分析实验时,为保证数据的可靠性,要求检测器必须提供更真实的色谱峰形,而峰形的真实程度则由检测器的灵敏度和采样频率来决定,RIGOL L-3500紫外-可见检测器提供可选的采用频率,其可选的最大采样频率是多少?3、 RIGOL L -3000系列高压输液泵采取主副双凸轮设计,精心计算凸轮曲线,从而全面减小了压力脉动,同时采用特殊结构设计的混合器,该混合器结合了阻尼器抑制压力脉动的作用,同时避免增加系统的延迟体积。那么在色谱分离过程中,延迟体积对分析结果会产生什么样的影响?=====================================================================================================答案公布:1、必要组件是L-3200高压输液泵,L-3400柱温箱,色谱柱,L-3500紫外-可见检测器,进样器(L-3300自动进样器或手动进样阀任选其一)2、100Hz3、延迟体积大则影响梯度的精度,进而影响分析的灵敏度。同时还会使运行时间周期延长,在低流速下尤其如此。====================================================================================================幸运儿产生了!恭喜恭喜~http://simg.instrument.com.cn/bbs/images/brow/em09505.gifhttp://simg.instrument.com.cn/bbs/images/brow/em09505.gif第一个回答正确者:注册ID:sunmei抽取中奖者:注册ID:lhg088注册ID:liuyuan198815注册ID:laohutushen
质谱端的变化 a.流动相的组分:液相色谱方法中常使用的缓冲盐体系,但转换为液相色谱-质谱联用方法时,因盐对质谱的损伤较大,同时目前液相色谱-质谱联用仪的液相色谱部分较多采用的是超高效液相色谱,使用的色谱柱内径较细,柱压较高。因此在转换过程中要重点关注流动相中涉及的盐成分。如果必须使用盐作为流动相组分,则一定要避免使用不可挥发性盐,且采用可挥发性盐进行替代时也要在用量上控制在最低水平。 b.离子化效率的影响:液相色谱-质谱联用法的流动相组成还要考虑对质谱端离子化效率的影响。如离子对色谱法和离子抑制色谱法的流动相不能直接转换到液相色谱-质谱联用法上,避免流动相中的离子太多,对仪器造成污染,对样品中的离子响应影响较大。使用电喷雾离子源电离时,当采用正离子扫描方式时,流动相的pH最好小于6.0,以有助于提高离子化效率,同时不能在流动相中添加三乙醇胺等表面活性剂;当采用负离子扫描方式时,pH最好大于8.0,同时,流动相中不能加入容易形成酸根负离子等物质,如三氟乙酸等。 c.流速:质谱部分一般对电喷雾离子化源来说流速不超过0.5mL/min为宜;对于大气压化学电离源来说流速不超过1.0mL/min为宜。切当高效液相色谱法转换为超高效液相色谱-质谱联用法时,因仪器的管路内径、色谱柱内径、色谱柱填料的粒径等参数的不同,而导致的两者流速的不通用。 d.梯度设置的影响:当采用梯度方法时,需考虑转换到液相色谱-质谱联用方法时在低流速条件下,样品溶液从泵腔到色谱柱前端这部分体积对色谱分离分析的影响,以及流动相从梯度程序中返回初始状态时所需要平衡时间的问题。 (2)不同液相色谱的变化 目前实验室使用的液相色谱仪主要为高效液相色谱仪[/url]和超高效液相色谱仪。所以在方法转换过程中要根据仪器的不同进行相应参数的调整,主要涉及流速、进样量、系统压力限制范围、采集时间、梯度平衡等方面。若采用同一仪器公司的高效液相色谱仪和超高效液相色谱仪检测,可以通过仪器自带的转换软件进行方法的转换,以软件转换的液相方法作为参考,再根据实际情况以及检测结果进行调整。
以下资料是转自其它网站:1960年代,由于气相色谱对高沸点有机物分析的局限性,为了分离蛋白质、核酸等不易气化的大分子物质,气相色谱的理论和方法被重新引入经典液相色谱。1960年代末科克兰(Kirkland)、哈伯、荷瓦斯(Horvath)、莆黑斯、里普斯克等人开发了世界上第一台高效液相色谱仪,开启了高效液相色谱的时代。高效液相色谱使用粒径更细的固定相填充色谱柱,提高色谱柱的塔板数,以高压驱动流动相,使得经典液相色谱需要数日乃至数月完成的分离工作得以在几个小时甚至几十分钟内完成。 1971年科克兰等人出版了《液相色谱的现代实践》一书,标志着高效液相色谱法(HPLC)正式建立。在此后的时间里,高效液相色谱成为最为常用的分离和检测手段,在医`学教育网搜集整理有机化学、生物化学、医学、药物开发与检测、化工、食品科学、环境监测、商检和法检等方面都有广泛的应用。高效液相色谱同时还极大的刺激了固定相材料、检测技术、数据处理技术以及色谱理论的发展。 1960年代前,使用的填充粒大于100μm,提高柱效面临着困境,后来的研究人员便采用微粒固定相来突破着一瓶颈。科克兰、荷瓦斯制备成功薄壳型固定相,这种在固定相在玻璃微球表面具有多孔薄壳,实现了高速传质,为高效液相色谱技术的发展奠定了稳固的基础。随着填料粒径的降低,更高的柱效也得以实现。 1960年代研制出气动放大泵、注射泵及低流量往复式柱塞泵,但后者的脉冲信号很大,难以满足高效液相色谱的要求。1970年代,往复式双柱塞恒流泵,解决了这一问题。1970年代后科克兰制备出全多孔球形硅胶医`学教育网搜集整理,平均粒径只有7μm,具有极好的柱效,并逐渐取代了无定形微粒硅胶。之后又制造出的键合固定相使柱的稳定性大为提高,多次使用成为可能。1970年后,适合分离生物大分子的填料又成为研究的热点。1980年后,改善分离的选择性成为色谱工作者的主要问题,人们越来越认识到改变流动相的组成事提高选择性的关键。
接触了一段时间[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url],想了解一下[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]方法的开发方法,怎么选择色谱柱,怎么选择流动相啥的。想要这方面的资料,谢谢