T/BPCT 001-2023牛乳及制品中A2 β-酪蛋白含量的测定 [url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]质谱法
T/CCAA 70-2023 牛乳基婴儿配方奶粉中乳铁蛋白含量的测定 [url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱法
最近要做大豆豆血红蛋白含量的测定,方法我已经知道,最后要比色,可是我查不到有关测定豆血红蛋白含量标线的方法!!!!太早的文献真的很难找到,希望各位大侠能多多指教,给与帮助!我将万分感谢 !
如何测定乳制品中非蛋白氮的含量

酶标仪测定特定蛋白的蛋白含量-ELISA实验步骤[img]https://ng1.17img.cn/bbsfiles/images/2023/06/202306301442498094_2367_5389809_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2023/06/202306301442501323_8948_5389809_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2023/06/202306301442504164_1052_5389809_3.png[/img]
请问有人知道蛋白(具体说就是酶)样品中Cu2+含量可以用[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收光谱[/color][/url]法测吗?如果可以,请提供一个测定单位?还有对样品有什么要求?谢谢帮忙
如何用双缩脲法测定总蛋白含量?
稀土离子铈(Ⅳ)[color=red]分子荧光[/color]光谱法测定血清白蛋白的含量
请问哪位前辈有下表中的乳与乳制品中动物水解蛋白鉴定-L(-)-羟脯氨酸含量测定(检测方法由中国检验检疫科学院食品安全所提供。这个文本啊!附件1食品中可能违法添加的乳与乳制品中动物水解蛋白鉴定-L(-)-羟脯氨酸含量测定(检测方法由中国检验检疫科学院食品安全所提供。非食用物质名单(第二批) 序号名称主要成分可能添加的主要食品类别可能的主要作用检测方法1皮革水解物皮革水解蛋白乳与乳制品含乳饮料增加蛋白质含量乳与乳制品中动物水解蛋白鉴定-L(-)-羟脯氨酸含量测定(检测方法由中国检验检疫科学院食品安全所提供。联系方式: Wkzhong@21cn.com)2溴酸钾溴酸钾小麦粉增筋GB/T 20188-2006 小麦粉中溴酸盐的测定 离子色谱法3β-内酰胺酶(金玉兰酶制剂)β-内酰胺酶乳与乳制品掩蔽抗生素液相色谱法(检测方法由中国检验检疫科学院食品安全所提供。联系方式: Wkzhong@21cn.com)4富马酸二甲酯富马酸二甲酯糕点防腐防虫气相色谱法(检测方法由中国疾病预防控制中心营养与食品安全所提供)
GB/T 15673—2009《食用菌中粗蛋白含量的测定》[img]http://bbs.instrument.com.cn/images/affix.gif[/img][url=http://bbs.instrument.com.cn/download.asp?ID=197394]GBT 15673-2009食用菌中粗蛋白含量的测定.pdf[/url]
1.测定的蛋白含量为囊泡表面的污染蛋白,常用于计算囊泡的纯度2.污染小的实例中需要用增强型试剂盒
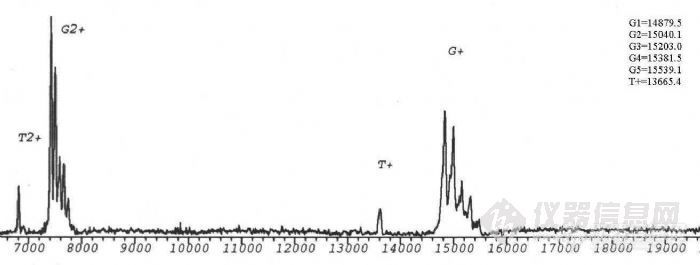
生物质谱在糖蛋白结构分析中的应用项目完成人:桑志红 蔡 耘项目完成单位:国家生物医学分析中心 随着人们对糖蛋白参与生命活动机理的日益深入了解,对天然糖蛋白及重组糖蛋白类药物的分析越来越受到重视。重组糖蛋白类药物的质量控制更是直接关系到药物的疗效及至人类的健康。九十年代以来,随着带有反射功能的基质辅助激光解吸附电离飞行时间质谱(MALDI-TOF-MS)和纳升电喷雾串联质谱(nano-ESI-Q-TOF)等具有软电离方式的现代质谱 技术的发展,质谱以其高灵敏度和强有力的分析混合物的能力,提供了生物大分子的分子量、序列、一级结构信息以及结构转换、修饰等方面的信息,使糖基化分析有了重要的进展。 通常研究糖蛋白的方法是把蛋白链上的寡糖切下来,分别研究蛋白部分和寡糖部分的结构,因此无法研究与两部分共同相关的结构问题,也不能区分不同糖基化位点上切下来的寡糖。自90年代初,国外有人开始用质谱法研究糖蛋白的结构,同时描述了各个位点的不均一性。我们用建立的现代生物质谱技术研究糖蛋白一级结构的方法,将其应用与基因重组糖蛋白的结构分析。为糖蛋白结构分析及基因重组糖蛋白类药物的质量控制提供新的手段。一、 生物质谱研究糖蛋白结构方法的建立实验所用仪器为:1.德国BRUKER 公司的REFLEXIII型基质辅助激光解吸附电离飞行时间质谱仪,N2激光器,波长337nm,线性飞行距离150cm,加速电压2kv。2.英国Micromass 公司Q-TOF型电喷雾串联质谱仪。源温80°C,气体流速40L/h,枪头电压650V,检测频率2.4S,氩气碰撞池压力6*10-5mbar。1. 基质的选择,在MALDI-TOF-MS分析中,基质起着相当重要的作用。不同的基质对不同类的物质响应不同,a-氰基-4-羟基肉桂酸用于测定糖蛋白核糖核酸酶B效果相对较好。2. 糖蛋白分子量的测定,糖蛋白核糖核酸酶B由124个氨基酸组成,在34位Asn处连有一个高甘露糖型N-糖链。由于糖链的微不均一性,与普通蛋白质及核酸不同,其分子离子峰在MALDI-TOF-MS 质谱图上表现为一簇峰,各峰之间约相差一个糖基。正是由于这种微不均一性,使得其分子离子峰变宽,灵敏度降低。糖链分子量越大,峰越宽,灵敏度越低,所以一般只有糖链较短,蛋白的质量不太大的糖蛋白才能测定其平均分子量。用MALDI-TOF可直接测定糖蛋白核糖核酸酶B的平均分子量为 15208.6Da。http://ng1.17img.cn/bbsfiles/images/2011/03/201103211511_284179_1604317_3.jpg3. 糖含量的测定,采用O聚糖酶及内糖苷键酶F分别作用于核糖核酸酶 B,只有内糖苷键酶F能够是其分子量发生变化,表明核糖核酸酶B分子中不存在O-连接糖链存在着N-连接糖链。内糖苷键酶F切断N-糖链五糖核心最内侧的GlcNAc-GlcNAc糖苷键,得到含一个GlcNAc的肽链,减去GlcNAc,可以计算出准确的肽链分子量T=13695.6,与糖蛋白平均分子量之差为糖链的平均分子量G=1513.4,平均糖含量为:(糖链大小/糖蛋白分子量)×100%=9.95%。4. 糖基化位点的确定,研究糖基化类型及糖基化位点的策略:采用蛋白酶酶解与糖苷内切酶酶解相结合的方法,通过酶切前后含糖肽片的位移,结合网上数据库检索,可以确定糖基化类型和糖基化位点。以不同类型的糖苷内切酶作用于糖蛋白(N-糖苷键酶或O-糖苷键酶),在MALDITOF-MS 上观察其质量的变化,可以直接确定糖蛋白中是否含有响应类型的糖链,这是我们确定糖蛋白中糖苷键类型的基础。我们采用先将核糖核酸酶B还原烷基化,加Glu-C酶切,产物再用内糖苷肩酶F酶切,可观察到含糖肽段出现位移,将核糖核酸酶B的肽质量指纹图进行数据库检索,证实发生位移的肽段中含有N-糖链特异连接位点,由此确定34位Asn为糖基化位点。另外我们采用内糖苷键酶F及肽-N-聚糖酶F两种酶进行差位酶切法对含糖肽段进行验证,两种酶酶切后分子离子峰的差值除以GlcNAc的质量,结果就是N-糖基化位点的个数5. 质谱测定氨基酸序列, 我们对核糖核酸酶B肽质量指纹谱中的含糖肽段进行了串联质谱测定,首先在一级质谱图中选择离子4972.23,在串联质谱的碰撞活化室以氩气与其碰撞产生碎片,从碎片的质荷比推算出此肽片中的一段氨基酸序列,检索结果为核糖核酸酶B,从而判断其理论序列是否一致。6. 糖链结构的研究,凝集素对糖肽的亲和提取,进一步分析糖肽序列及糖链结构的关键是含糖肽段的提取。核糖核酸酶B中糖链为高甘露糖型,我们选用对其有特异性吸附的伴刀豆球蛋白对其进行提取利用这种简捷的亲和质谱的方法,对糖肽段进行了分析。建立了亲和质谱分析糖肽类物质的方法,为今后糖肽序列分析及糖链结构分析奠定了基础。二、基因重组糖蛋白人促红细胞生成素(rhEPO)的结构分析。 利用以上建立的方法,我们对样品重组人促红细胞生成素进行了分析,断定此样品为非完全糖基化,样品中只存在N-连接的糖链,无O-糖链。应用酶切法用肽-N-聚糖酶处理后,得到两个含糖肽段,进行数据库检索,测得38位及83位为N-糖基化位点,与文献报道相符,结果可靠。因此,该项课
GB/T 21704-2008 乳与乳制品中非蛋白氮含量的测定2008-04-09发布,2008-07-01实施。一个非常重要的国标,三鹿事件更将强化这项标准。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=108911]GB/T 21704-2008 乳与乳制品中非蛋白氮含量的测定[/url]
请教下各位在检测大豆分离蛋白的可溶性蛋白含量,测定其溶解性和测定其氮溶指数的目的有什么区别?
方法:简单讲就是将生物材料孵育前后的抗体溶液进行蛋白浓度测定,差值为生物材料接枝的抗体含量

[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]快速检测人血白蛋白原液蛋白质含量的建模研究摘要:本研究建立[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]定量分析模型,对浓缩液蛋白含量进行快速及有效的测定。在实验室条件下配置不同浓度的蛋白样品,建立用于蛋白含量测定的定量分析模型,以实现浓缩液蛋白含量的快速及有效的判断。关键词:[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]分析技术;人血白蛋白;定量分析模型1材料1.1 试剂供试品:人血白蛋白原液;生理盐水。1.2 仪器和软件AntarisⅡ傅里叶变换[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url](美国Thermo Fisher scientific公司);内径4×50 mm的玻璃小管(Kimble Chase,德国); MATLAB 2015a(美国Mathworks公司);PLS_Toolbox工具箱(美国Eigenvector Research公司)。2方法2.1 蛋白含量的测定及样品溶液的配制2.1.1 蛋白质含量的测定取生产过程中超滤浓缩后的人血白蛋白原液为实验供试品,用半微量凯氏定氮法测定蛋白质浓度,浓度应不低于26.5%。2.1.2样品溶液的配制根据试验需要,将供试品溶液用生理盐水进行稀释得到多个不同蛋白质浓度的实验样品。2.2 样品光谱的采集本实验使用AntarisⅡ傅里叶变换[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url],采用透射分析模块,采用仪器自带的RESULT-Intergration软件编写采集光谱的工作流程。光谱分辨率为8 cm-1,扫描范围为10000-4000 cm-1,扫描次数为32次,用偏最小二乘回归(Partial Least Squares Regression, PLSR)方法建立定量模型。2.3 校正集和验证集的划分校正集中的样品应包含使用该模型预测的未知样品的所有化学成分。且校正集中的样品的化学成分浓度范围应覆盖使用该模型预测的未知样品中可能存在的浓度范围。而且验证集中的样品应涵盖使用模型分析的待测样品中的化学组成,测定浓度范围也应尽可能覆盖该模型分析的待测样品可能存在的浓度范围,且分布均匀。所以,需要选择合理的样品集划分方法,以提高模型的应用性及准确性。2.4 预处理方法的选择为了消除噪声和产生的基线漂移,提高模型的预测能力,得到稳健的模型,需要在模型建立前对样品的原始光谱进行预处理,常用的谱图处理方法有均值中心化(Mean Center)、标准化(Auto scale)、平滑和导数等。导数是常用的基线校正和光谱分辨预处理方法,但也会放大噪声的信号,降低光谱的信噪比;为消除光谱变换带来的噪声,常对原始光谱进行平滑后求导,能有效提高信噪比;均值中心化可增大不同样品之间的差异,从而使模型的稳健性和预测能力得到提高;标准化可以使光谱中所有波长变量的权重相同,增加光谱之间差异化,适合于低浓度成分的建模。本研究中对Auto scale、Mean Center、一阶导数(First Derivative,FD)SG13点平滑、二阶导数(Second Derivative,SD)SG13点平滑等预处理方法进行了考察,以模型的RMSEP为指标,选择最合适的预处理方法。2.5 光谱区间的选择[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]信息十分复杂,在建立校正模型的过程中选择有效的建模变量是十分必要的。本研究选用间隔偏最小二乘法(Interval Partial Least Squares Regression, iPLS)),以RMSECV值为评价标准,选择变量区间以建立最佳的定量模型。3 实验结果3.1 蛋白质含量的测定结果采用半微量凯氏定氮法进行蛋白含量的测定,测定得到17个样品的蛋白含量。用生理盐水稀释样品,共得到49个不同蛋白质含量的样品。3.2 样品的原始光谱图1为49个蛋白样品的原始光谱,原始光谱图中可见各样品的光谱差异不明显,因此需要使用化学计量学方法对样品光谱进行处理。[align=center][img=,494,237]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151606_01_1626619_3.png[/img][/align][align=center]图1 样品原始光谱图[/align]3.3 校正集和验证集的划分结果本研究采用Kennard-Stone(K-S)分类的算法,按照2:1的比例进行样品集的划分,划分为33个校正集样品和16个验证集样品。图2为校正集样品和验证集样品的主成分得分图,图中灰色点为校正集样品,红色点为验证集样品,从主成分得分图中可以看出,校正集样品和验证集样品分布比较均匀,且验证集样品比较均匀的分布在校正集样品之间,符合理想校正集和验证集的要求。[align=center] [img=,467,301]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151608_01_1626619_3.png[/img][/align][align=center]图2 样品主成分得分图[/align]3.4 光谱预处理的结果建模过程中,分别采用各种方法对光谱数据进行预处理,包括标准化(Auto scale)、均值中心化(Mean Center)、一阶导数(First Derivative,FD)、SG13点平滑、二阶导数(Second Derivative,SD)等处理方法,以RMSEP作为评价模型的参数,通过对比预处理后的建模结果,选出最合适的预处理方法。表1列出了预处理后各模型的评价参数,通过比对,可以较直观的选出一阶导数SG13点平滑和Mean Center的组合为最佳预处理方法。图3所示为用经过一阶导数SG13点平滑和Mean Center 预处理后的光谱所建立的模型的结果,从图3中可以看出,建模效果较好,预测能力较高,Rc2=0.994,Rp2=0.986,RMSEC=0.1993%,RMSEP=0.2585%,RMSECV=0.2518%。[align=center]表1 不同预处理后各模型参数[/align][align=center][img=,629,241]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151613_01_1626619_3.png[/img][/align][align=left]FD+SG:一阶导数+SG13点平滑[/align][align=left]SD+SG:二阶导数+SG13点平滑[/align][align=center][img=,572,305]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151616_01_1626619_3.png[/img][/align][align=center]图3 一阶导数+SG平滑+ Mean Center[/align]3.5 光谱区间的选择结果通过筛选光谱区间,可以选择与样品白蛋白含量相关性大的光谱变量进行建模,去掉大量无关信息,减少模型的计算量,使得模型的效果更好。本实验采用iPLS进行变量的选择。将光谱进行SG13点平滑+一阶导数+ Mean Center预处理后,分别采用Forward iPLS和Reverse iPLS方法选择最佳的光谱区间,改变窗口宽度,分别选择最佳变量,以RMSECV为标准选择谱区。3.5.1Forward iPLS选择波段采用FiPLS的方法以RMSECV为标准选取最佳的光谱区间,分别选择50、100、200个变量进行自动选择,如表2所示窗口宽度为100个变量时建模结果较佳,结果图4所示。[align=center]表2 Forward iPLS结果[/align] [align=center][img=,645,163]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151618_01_1626619_3.png[/img][/align][align=center][img=,517,246]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151619_01_1626619_3.png[/img][/align][align=center]图4 Forward iPLS波段结果图[/align]由图4中可以看出,绿色部分为建模的波段,图5为建模预测结果图。[align=center][img=,551,291]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151620_01_1626619_3.png[/img] [/align][align=center]图5 Forward iPLS建模结果图[/align]3.5.2 Reverse iPLS选择波段采用Reverse iPLS的方法选取最佳的光谱区间,同样,分别选择50、100、200个变量进行自动选择,如表3所示窗口宽度为50个变量时建模结果较佳,波段选择结果如图6所示。[align=center]表3 Reverse iPLS结果[/align][align=center][img=,652,456]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151622_01_1626619_3.png[/img][/align] [align=center]图6 Reserve iPLS 选波段结果图[/align]如图6中所示,其中绿色部分为建模波段,图7为预测结果。[align=center][img=,520,228]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151624_01_1626619_3.png[/img][/align][align=center]图7 Reserve iPLS 建模结果图[/align]通过采用Forward iPLS和Reservei PLS波段选择方法建立PLSR模型,经过两种方法中选择的最优变量的对比(见表4),选择窗口宽度为100变量的Forward iPLS变量选择方法建立的模型最佳。最终建立的PLSR模型结果:模型的参数为Rc2=0.997,Rp2=0.987,均方根误差RMSEC=0.1394%,RMSEP=0.2560%,RMSECV= 0.1831%,建模结果较好。[align=center]表4不同变量选择方法的建模结果[/align][align=center][img=,641,142]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151629_01_1626619_3.png[/img][/align]3.6 一级数据与预测值比较对16个验证集样品的传统方法获得的蛋白含量和NIRS蛋白含量预测值进行偏差分析,结果见表5所示。蛋白含量一级数据和预测值的平均偏差和相对平均偏差的计算公式见式1和式2,蛋白含量NIRS的预测值和一级数据间的平均偏差为0.17,相对平均偏差为0.81,两者都较低,说明了NIRS和传统的凯氏定氮法结果相差较小,表明NIRS用于蛋白含量测定的准确性和可靠性。[align=center][img=,372,89]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151631_01_1626619_3.png[/img][/align]式中yi, actual为传统凯氏定氮方法得到的一级数据值,yi, predicted为NIRS得到的预测值,n为验证集样品数量。[align=center]表5 验证集样品方法结果比较表[/align][align=center][img=,585,86]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151632_01_1626619_3.png[/img][/align]3.7 预测值的精密度通过重复测量光谱计算,建立的蛋白含量校正模型的预测精密度。随机选取验证集样品中的1号、15号、35号、42号和47号样品,每个样品重复测量10次,然后采用建立的蛋白含量模型采集以上样品的光谱,得到样品的预测值。然后计算每个样品预测值的平均值、标准偏差和相对标准偏差,用这些指标来表示预测的精密度,结果见表6。如表中所示, RSD值均在1.0%以下,远远低于5.0%,证明了模型的精密度良好。[align=center]表6 模型精密度考察结果[/align][align=center][img=,584,394]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151636_01_1626619_3.png[/img][/align]4结论和讨论本研究建立了人血白蛋白生产过程中蛋白含量测定的近红外定量模型,用于人血白蛋白原液蛋白质含量的测定,为下一步原液的生产配制提高依据。首先,取生产过程中的样品17个,用凯氏定氮法测得各个样品的蛋白含量,然后在实验室条件下,用生理盐水配制成49个不同浓度的蛋白样品。对49个样品进行[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]的采集,然后对样品进行校正集和验证集的划分,对光谱进行预处理方法和不同的变量选择方法进行了考察;采用Kennard-Stone(K-S)分类的算法,按照2:1的比例进行样品集的划分,优先选出Mean Center +一阶导数SG13点平滑的预处理方法,并采用窗口宽度为100变量的Forward iPLS变量选择方法选出变量区间,最终建立最佳的近红外定量模型。最终建立的PLSR模型结果:Rc2=0.997,Rp2=0.987,均方根误差RMSEC=0.1394%,RMSEP=0.2560%,RMSECV= 0.1831%。除此之外,对模型进行了重复性考察,从结果可知模型具有较好的重复性。在模型的建立中,选用Kennard-Stone(K-S)分类的算法进行样品集的划分,通过PCA分析得到具有代表性的校正集和验证集样品。在预处理方法的选择中,分别选用Autoscale、Mean Center、SG平滑一阶导数以及各预处理方法的组合进行预处理方法的考察,其中SG平滑中,不同的窗口宽度会对平滑产生不同的效果,窗口宽度越宽平滑效果越好,但也会丢掉有用的信息,经过考察选择13点平滑时结果较佳。参考文献吴清, 周法根. 脑梗死治疗中白蛋白应用价值的探讨 . 心脑血管病防治, 2005, 5(2): 49-50.王华平, 米宇俊. 人血白蛋白治疗肾综合征出血热低血压休克患者疗效观察 . 医师进修杂志, 2001, 24(8):20-21.郑红光, 杨志藩, 关欣. 静脉输注人血白蛋白对肾病综合征的正负临窗效应观察 . 中国实用内科杂志, 2003, 23(1):25-27.刘丽萍. 人血白蛋白在肝硬化资料中的应用 . 中国医院用药评价与分析, 2013, 13(5):388-390.常花蕾, 史涛. 人血白蛋白临床不合理应用及改进措施 . 中国药物应用与监测, 2014, 11(1): 52-54.孙世光, 余明莲, 王建民, 张国辉. 人血白蛋白的临床应用误区及其对策 .解放军药学学报, 2009, 25(4):366-368.
T/CSIQ 77001-2020 乳制品中ɑ-乳白蛋白含量的测定 高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法
奶粉蛋白质中乳清蛋白含量的测定 十二烷基硫酸钠-毛细管凝胶电泳法该标准还未正式发布
不知《GB/T21704-2008乳与乳制品中非蛋白氨含量的测定》能否拿下三聚氰胺?急求该标准,哪位有?QQ:3733818 E-mail:yardin@sina.com
用UV-1750型分光光度计中的多波长法测蛋白含量,我将蛋白含量稀释到光密度在0.2-2.0之间,但是仪器自带的计算公式算出的结果和用双縮脲法测出的结果不一样,仪器自带的公式有谁知道??还是我用的方法有什么问题?? 方法:用生理盐水将蛋白稀释后(光密度在0.2-2.0之间),仪器自动算出蛋白质含量,根据含量乘以稀释倍数得到最终含量!
这是日本关于质谱测定蛋白N端序列的文献,大家看看。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=120693]质谱测定蛋白N端序列[/url]
我们生产的菜籽粕水分基本在12.3—12.8之间,残油在1。5%以下,怎样能提高成品粕的粗蛋白含量
[b]【序号】:2【作者】:【题名】:[b][b][size=12px][font=&]T/CSIQ 77001—2020[/font] [/size][font=&][color=#333333]乳制品中ɑ-乳白蛋白含量的测定 高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法[/color][/font][/b][/b]【期刊】:【年、卷、期、起止页码】:【全文链接】:[/b]

Micro [url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]NIR[/color][/url]1700型[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]用于蛋白含量测定的可行性研究摘要:Micro [url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]NIR[/color][/url]1700型[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]与AntarisⅡ傅里叶变换[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]相比具有体积小、质量轻、便携的特点,更适合用于生产现场检测。本文采用Micro [url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]NIR[/color][/url] 1700型微型[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]对蛋白含量进行检测,对其用于蛋白含量测定的可行性进行分析。通过相关系数法选出更合理的波段,提高模型的预测能力,从而建立了用于人血白蛋白原液蛋白含量快速检测的定量模型。关键词:微型[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url];蛋白含量测定;定量分析模型1材料1.1 试剂49个不同蛋白含量的样品:采用半微量凯氏定氮法进行蛋白含量的测定,测定得到17个样品的蛋白含量。用生理盐水稀释样品,共得到49个不同蛋白质含量的样品。1.2 仪器和软件Micro[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]NIR[/color][/url]1700型[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url](JDSU公司,美国); MATLAB 2015a处理软件(Mathworks,美国);PLS_Toolbox工具箱(Eigenvector Research,美国)。2方法2.1样品光谱的采集采用Micro [url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]NIR[/color][/url]1700型微型[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]进行蛋白光谱的采集,采样方式为透射采样,波长范围908.1-1676.0 nm,积分时间为28000 μs,扫描次数为50次。用1 mm光程比色皿进行采样,每个蛋白样品采集3次,求其平均光谱作为样品光谱。每张[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]NIR[/color][/url]光谱由125个变量点组成。2.2校正集和验证集的划分样品集的划分采取SPXY分类算法,以1:1的比例进行校正集、验证集的划分,最终25个样品集被划分为校正集,24个样品被划分为验证集。分析样品的PCA得分图评价分类结果。2.3 预处理方法的选择采用标准化(Auto scale)、均值中心化(Mean Center)、一阶导数(First Derivative,FD)SG5点平滑、二阶导数(Second Derivative,SD)SG5点平滑等预处理方法进行了考察,以模型的RMSEP为指标,选择最佳的预处理方法。通过留一交互验证法,以RMSECV的值选择最佳主因子数。2.4光谱区间的选择采用Reverse iPLS方法、相关系数方法进行光谱区间的选择,优化光谱区间,以建立较优的模型。3 实验结果3.1近红外原始光谱图分析图1为Micro [url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]NIR[/color][/url]1700型微型[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]透射采样得到的原始[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]NIR[/color][/url]光谱图。从原始光谱图中无法得知有关蛋白含量的信息,因此本研究中需用化学计量学知识对样品的原始光谱进行处理。[align=center] [img=,475,213]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151936_01_1626619_3.png[/img][/align][align=center]图1原始[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]图[/align]3.2校正集和验证集的划分本研究选择SPXY算法,以1:1的比例进行校正集、验证集的划分,最终25个样品集被划分为校正集,24个样品被划分为验证集。图2为样品集的划分结果。图2为49个蛋白样品的前两个主成分的得分散点图,其中红色为验证集,灰色为校正集,从图中可知校正集样品和验证集的样品分散较好,这表明校正集、验证集划分较合理。[align=center] [img=,460,204]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151937_02_1626619_3.png[/img][/align][align=center]图2 样品主成分得分图[/align]3.3 光谱预处理结果本研究中,分别比较了Mean Center、Auto scale、平滑和导数以及不同处理方法组合的预处理方法对建模结果的影响,并以RMSEP作为模型的评价指标。表1为经不同预处理后的PLSR建模结果,由表中结果可知,经过二阶导数、SG5点平滑和Auto scale预处理后模型的Rp2提高, RMSEP明显下降,说明经过二阶导数、SG5点平滑和Auto scale预处理能够提高模型的有效性。图3为经预处理后较优模型的结果,模型结果为Rc2=0.993,Rp2=0.953,RMSEC=0.2143%,RMSEP=0.5354%,RMSECV=0.3382%。[align=center]表1不同预处理后各模型参数[/align][align=center][img=,638,223]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151938_01_1626619_3.png[/img][/align][align=center][img=,489,211]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151939_01_1626619_3.png[/img][/align] [align=center]图3二阶导数+SG平滑+Autoscale[/align]3.4 光谱区间选择结果分别采用Reverse iPLS方法、相关系数方法对模型的光谱区间进行优化,消除无关变量对模型的影响。以RMSEP值为指标来评价模型,其中RMSEP值越小模型结果越好。3.4.1Reverse iPLS选择波段本研究采用Reverse iPLS方法选择波段,考察50个变量间隔的选择结果。从图4可知,绿色部分为建模采用的波段,红色部分为舍弃波段范围。图5为采用Reverse iPLS方法选择的波段范围建立的模型的预测结果。其中RMSEP值有所降低,表明模型的预测误差降低。表明此区间包含的有效信息可提高模型的预测能力。[align=center][img=,532,234]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151940_01_1626619_3.png[/img][/align][align=center]图4 Reserve iPLS 选波段结果图[/align][align=center][img=,497,224]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151940_02_1626619_3.png[/img][/align][align=center]图5 Reserve iPLS法预测结果图[/align]3.4.2相关系数法选择光谱变量采用相关系数法求得光谱中各变量与蛋白浓度之间的相关系数图,相关系数越大,区间内包含的有效信息越多。图6为求得的相关系数图。[align=center][img=,483,211]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151942_01_1626619_3.png[/img][/align][align=center] 图6 相关系数图[/align]选择相关系数绝对值大于0.4的光谱区间建立近红外定量模型,选择建立模型的变量数为25个。图7为变量选择的结果图。[align=center][img=,520,229]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151943_01_1626619_3.png[/img][/align][align=center]图7 相关系数法变量选择图[/align]使用相关系数法选择的25个变量建立PLSR模型,建模结果见图8中所示。与全波段建模结果相比,模型的RMSEP值降低,表明模型的外部预测误差有所减小,从而提高了模型的准确性。[align=center][img=,474,209]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151945_01_1626619_3.png[/img][/align][align=center] 图8 建模结果图[/align]3.5 确定最佳定量分析模型采用二阶导数、SG5点平滑和Auto scale预处理后,使用Reverse iPLS方法和相关系数方法选择光谱的有效波段。两种变量选择方法建立的模型结果见表2所示。[align=center]表2不同变量建模结果比较[/align][align=center][img=,604,171]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151946_01_1626619_3.png[/img][/align]经过比较,其中相关系数法选择25个变量建立的PLSR定量模型的预测均方根误差结果最小,说明建立模型的预测能力更佳。所以本研究采用二阶导数、SG5点平滑和Auto scale预处理后选择相关系数法确定25个变量建立最佳定量分析模型。模型结果为Rc2=0.977,Rp2=0.958,RMSEC=0.3983%,RMSECV=0.5653%,RMSEP=0.5334%。4结论和讨论本研究用Micro [url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]NIR[/color][/url]1700型[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]对建立的人血白蛋白原液蛋白含量定量分析模型的可行性进行分析。采用Micro [url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]NIR[/color][/url]1700型[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]对49个样品进行光谱采集,然后选择不同的光谱预处理方法进行预处理,经过结果比较选择二阶导数、SG5点平滑和Auto scale进行光谱预处理;采用Reverse iPLS方法和相关系数方法,对光谱的有效区间进行选择,最终使用相关系数法选择25个变量建立蛋白含量的最佳定量分析模型。所建立的模型结果为Rc2 =0.977,Rp2=0.958,RMSEC=0.3983%,RMSECV=0.5653%,RMSEP=0.5334%。此研究结果表明,Micro [url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]NIR[/color][/url]1700型[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]所建立的模型用于人血白蛋白原液中蛋白含量的检测是可行的,同时Micro [url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]NIR[/color][/url]1700型[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]以其质量轻、体积小以及成本低的优势,在蛋白快速检测方面将有广阔的应用前景。参考文献吴清, 周法根. 脑梗死治疗中白蛋白应用价值的探讨 . 心脑血管病防治, 2005, 5(2): 49-50.王华平, 米宇俊. 人血白蛋白治疗肾综合征出血热低血压休克患者疗效观察 . 医师进修杂志, 2001, 24(8):20-21.郑红光, 杨志藩, 关欣. 静脉输注人血白蛋白对肾病综合征的正负临窗效应观察 . 中国实用内科杂志, 2003, 23(1):25-27.刘丽萍. 人血白蛋白在肝硬化资料中的应用 . 中国医院用药评价与分析, 2013, 13(5):388-390.常花蕾, 史涛. 人血白蛋白临床不合理应用及改进措施 . 中国药物应用与监测, 2014, 11(1): 52-54.孙世光, 余明莲, 王建民, 张国辉. 人血白蛋白的临床应用误区及其对策 .解放军药学学报, 2009, 25(4):366-368.
我想测一下鱼糜的蛋白质含量,由于时间紧促,觉得凯氏定氮太麻烦,想用一种快速的方法测其蛋白质含量,有人知道有什么快捷的方法吗?谢谢~~

酶标仪测定PD-L1蛋白含量-ELISA实验前期准备[img]https://ng1.17img.cn/bbsfiles/images/2023/06/202306301428204973_7472_5389809_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2023/06/202306301428209235_3239_5389809_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2023/06/202306301428211142_3359_5389809_3.png[/img]
[size=4]蛋白质含量测定的方法[/size][color=#DC143C]一、微量凯氏(Kjeldahl)定氮法[/color] 含氮有机物与浓硫酸共热,即分解产生氨(消化),氨又与硫酸作用,变成硫酸铵。经强碱碱化使之分解放出氨,借蒸汽将氨蒸至酸液中,根据此酸液被中和的程度可计算得样品之氮含量。若以甘氨酸为例,其反应式如下: H2NCH2COOH+ 3H2SO4 2CO2 + 3SO2 +4H2O +NH3 (1) 2NH3 + H2SO4 (NH4)2SO4 (2) (NH4)2SO4 + 2NaOH 2H2O +Na2SO4 + 2NH3 (3) 为了加速消化,可以加入CuSO4作催化剂,K2SO4以提高溶液的沸点。收集氨可用硼酸溶液,滴定则用强酸。 计算所得结果为样品总氮量,如欲求得样品中蛋白含量,应将总氮量减去非蛋白氮即得。如欲进一步求得样品中蛋白质的含量,即用样品中蛋白氮乘以6.25即得。[color=#DC143C][size=4]论文:14楼 杜马斯燃烧法与凯氏法测定饲料含氮量的比较研究15楼 用凯氏法和杜马斯法测定植物样品中的全氮16楼 乳及乳制品中蛋白质测定应注意的事项探讨17楼 杜马斯燃烧定氮法在农产品品质检测中的应用18楼 凯氏定氮法测定牛奶中蛋白质的不确定度分析19楼 消化时间对总氮测定结果的影响20楼 奶粉中蛋白质样品消化方法的改进21楼 凯氏定氮法测定食品中蛋白质的不确定度分析22楼 催化剂与浓硫酸组成比例对凯氏定氮消化时间的影响23楼 饲料酵母蛋白含量测定结果的分析24楼 微波消解—凯氏定氮法测定食品中蛋白质的方法研究25楼 Loery法和Bradford法测定玻璃酸钠中蛋白质含量的比较26楼 应用 Primacs SN总氮 蛋白质分析仪测定食品中的蛋白质[/size][/color]

下面这个是大豆与羊毛动物纤维,蚕丝二组分混合物分析方法,溶解大豆蛋白,利用蛋白含量占大豆蛋白复合纤维的比例来确定大豆蛋白复合纤维含量,有点不可理解?大豆蛋白复合纤维,目前是大豆蛋白和聚乙烯醇复合,仅仅用蛋白溶解后,剩余的聚乙烯醇的含量来‘推算’出来大豆蛋白复合纤维的含量,是有点欠妥,虽然规定了大豆蛋白复合纤维的蛋白含量,但是实际的大豆蛋白复合纤维中,大豆蛋白和聚乙烯醇含量的比例不一定的,也就是说比例不是那么固定的,这样的检测方法对检测公司来说是没有任何问题的,也是标准的一个进步,但对生产企业来说,确实是致命的,没有规定大豆蛋白复合纤维的配比必须是多少,这个检测很可能每批次大豆与羊毛动物纤维,蚕丝产品的标示和实际检测结果是不合格的。而实际生产添加的各成分是标准的?比如填充,大豆与羊毛动物纤维,蚕丝混合,生产企业是烘干后,按照回潮率计算,按重量比添加混合的,这样企业就根据这样的比例进行标示,这个是最准确的,也是最合理的?大家认为呢?[img=,690,172]http://ng1.17img.cn/bbsfiles/images/2017/10/201710250916_01_2154459_3.png!w690x172.jpg[/img][img=,690,138]http://ng1.17img.cn/bbsfiles/images/2017/10/201710250913_01_2154459_3.png!w690x138.jpg[/img]
最近实验的样品蛋白质含量有点儿高,大概氨基氮含量在1.3g/100 ml,所以搅拌的时候会产生很多泡沫,导致过滤困难。想请教一下,除了过膜处理之外,在不造成样品的挥发性物质损失或损失度较小都有什么除蛋白处理方式呢
英国研究人员说,他们发现了一种控制人体血红蛋白含量的基因,这将有助于研制治疗贫血症等病症的药物。 英国帝国理工学院研究人员11日在《自然遗传学》杂志上报告说,他们对1.6万人的基因图谱和血红蛋白含量进行了分析。结果显示,基因TMPRSS6控制着人体内的血红蛋白含量。研究对象中既有欧洲人也有亚洲人,说明这一基因的作用在全球人群中广泛存在。 血红蛋白是高等生物体内负责运送氧的一种蛋白质,如果体内血红蛋白含量过低,就会出现贫血等症状。但如果血红蛋白含量太高,也会增加中风等疾病的风险。 研究人员说,如果能研发出增强基因TMPRSS6活动性的药物,就可以提高人体内的血红蛋白含量,帮助治疗贫血症等。同样,如果能用药物抑制该基因的作用,也可以根据需要降低血红蛋白的含量。