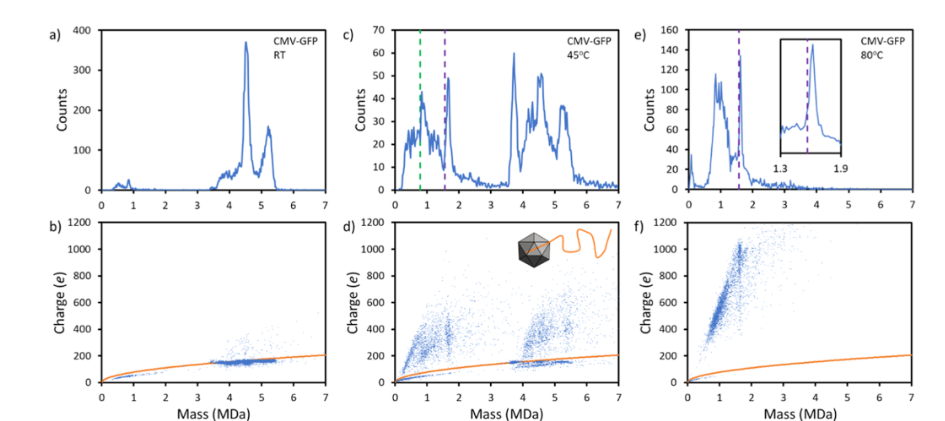
质谱技术的新方向—电荷检测质谱法(CDMS)
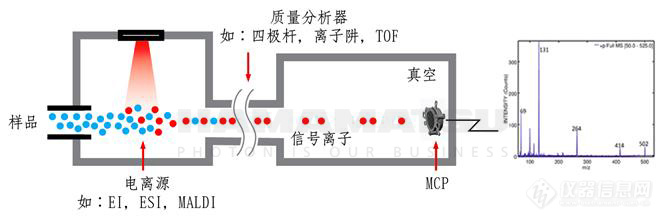
电荷检测质谱法是通过同时测量单个离子的质荷比和电荷数,进而算得离子质量m的单粒子统计方法,在测定超大分子离子的质量分布方面有独特的优势。现有质谱仪在超大分子量测量方面面临的挑战在质谱仪中,被分析物质首先被离子化,随后各种离子被引入真空中的质量分析器,在分析器中的电场磁场作用下,离子的运动特性随其质荷比不同而产生差异,因而造成时空上的分离,并由检测器依次检测出来,因此形成质谱。所以,目前的质谱仪测量的是离子的质荷比(m/z),而不是质量本身。经过一个多世纪的发展,质谱仪从原先只能分析无机元素和小分子,逐步发展到能够分析有机物分子、生物大分子直至具备生命体特征的病毒颗粒。2002年诺贝尔化学奖之一授予了用电喷雾电离(ESI)进行蛋白质质谱分析的创始人John Fenn。在电喷雾质谱对蛋白质进行分析时,溶液中的蛋白质样品被传送到加有高压的毛细管尖端,强电场促使样品溶液喷雾,喷雾中的液滴通过蒸发,库仑爆炸等过程,形成带有多个电荷的蛋白质离子,被引入处于真空中的质谱分析器。每个离子所带的电荷数的多少,取决于分子的大小、分子在溶液中的几何构象(折叠或打开)以及电喷雾尖端处的电压和气流等参数。通常对蛋白质这种大分子来说,ESI质谱中都会呈现多种价态的谱峰群,群落中的每一组为某个电荷态该蛋白质的各个同位素峰、盐峰以及加合物峰等。由于电荷态z通常是连续的整数分布(例如z = 11,12....21,22...),人们可以通过计算不同电荷数对应的群落m/z的间隔来推算各组的电荷数z,进而求出实际的质量m的分布,也可以用电脑程序退卷积得到m分布。对于分析较小(分子量在5万以下)、较简单纯净的蛋白样品,退卷积还是很有效的。然而,在实际应用中对蛋白和蛋白组的分析,特别是对天然蛋白和病毒颗粒的分析却不那么简单。随着分子量上升,分子结构越来越复杂,各种翻译后修饰使被测蛋白的分子量出现差异化(heterogeneity),很宽的质量m分布(可达上千Da)使得不同价态的峰群连接在一起。图1中,用高分辨质谱仪对二种病毒壳体的质量进行测定,由于各种价态的质谱峰群连城一片,根本无法辨别谱峰,得到样品分子的质量。同时,实际样品也可能因处理不善或自然裂解,使谱图混杂着不同大小的分子离子,它们各自的价态z分布可能导致它们的峰群在m/z轴上交叠在一起。目前对于很多糖蛋白,分子量超过3、4万就出现峰群交叠,无法用退卷积软件来获得分子量的分布信息。事实说明,对于大生物分子的质谱分析,仅靠提高仪器的分辨率是无济于事的。图1 ESI质谱对大型病毒壳体质量测定的困难。(a,b)晶体结构效果图 (c,d) 的“高分辨”质谱分析图。(摘自:Kafader, J. O., Nature methods, 17(4), 391-394)糖蛋白是生物制品中比例最大的一类药物,其糖修饰对其功能非常关键,准确解析此类药物的糖修饰是药物研发、报批和质量监控的关键内容。但它们在ESI-MS的质谱中,看到的好像是一堆杂草,无法辨别有什么蛋白组分。将一个糖蛋白药物中的各组分进行高分辨检测,是当前生物质谱面临的巨大挑战。电荷检测质谱仪的提出与技术发展早在上世纪90年代,美国西北太平洋国家实验室R.D.Smith组的 Bruce, J. E等就提出可以在傅里叶变换质谱仪中同时测量单个离子的电荷和质荷比,从而算出离子的质量m。随后,美国劳伦斯伯克利国家实验室W. H. Benner 发明了一种线形的静电离子阱,并用其测量单个高价离子的电荷数和质荷比,进而得到单个事件中的离子质量m。只要连续不断地进行大量的单个离子测量,就可以把总离子事件统计出来,形成按质量分布的直方图,而这就是一张电荷检测质谱。图2,Benner小组采用的直线形静电离子阱进行CDMS测量的原理图CDMS技术的关键是如何准确地测量单个离子的电荷。测量中,离子在静电离子阱内进行周期性运动并在电极上感应出“镜像电荷”信号。通过对信号的傅里叶变换,得到离子信号的频率从而决定离子的质荷比,而由频谱峰的强度得到离子所带的电荷数。虽然单个离子的镜像电荷频谱的峰强度与离子的电荷数成正比,它也同时与离子在阱内的轨道形状、离子存活时间有关,而这些参量都存在不定性;并且由于镜像电荷信号强度极弱,回路中的电子噪声对精确测量镜像电荷产生很大的影响,因此早期的电荷测量的RMS误差达2.2e以上,由此计算出的质量精度只比凝胶电泳好一点。近年来随着人们对天然、复杂蛋白分析的需求日益显现,CDMS技术也进一步得到了发展。美国印第安纳大学Jarrold小组通过对线形静电离子阱分析器的不断改进,特别是采用了低温前级信号放大器等优化设计后,实现了最小RMS 0.2 e的电荷测量误差,测量的样品包括2 MDa以上的蛋白复合体(protein complex)和20 MDa以上的病毒外壳。在这个RMS误差下,通过电荷数取整可以大概率获得精准的电荷值,从而得到精准的质谱分布。图3给出了用普通ToF质谱仪和CDMS测量天然态丙酮酸激酶(PKn)多聚体的效果比较。当3个以上四聚体组装在一起时,ToF质谱完全无法辨别其质量分布,而CDMS可以看到近10个四聚体组合的质量峰。图3.用常规ToF质谱(左)和用CDMS测量的丙酮酸激酶(PK)多聚体,使用相同样品和相同电喷雾条件。(摘自D. Keifer: Analyst, 2017,142,1654)目前,虽然用线形静电阱结合傅里叶变换可以得到较好的电荷测量精度,但该方法每次只能测一个离子,否则库伦相互作用会影响测量。在实际测试中,每次引入的离子数是随机分布的,需要用软件鉴别超过一个离子注入的事件,也要发现因为和残余气体碰撞而半路夭折的事件,并把这些“不良”记录剔除。考虑单次分析时间大约需要1s,得到一张良好统计的CDMS谱图需要几个小时甚至一天的数据积累。加利福尼亚大学E. Williams团队对线形静电离子阱分析器的设计和的数据处理方法进行了创新,能让宽能量范围的离子同时进入离子阱进行分析,避免了离子之间的空间电荷作用,可以在一个测量周期内测量10-20个离子,进而有望提高了检测效率。与此同时,其他尝试使用商业傅立叶FT质谱仪进行CDMS的研究团体也逐步浮现。美国西北大学Kelleher团队、荷兰乌得勒支大学的A.R.Heck团队先后使用热电公司的静电场轨道阱(Orbitrap) 系统,通过更新数据处理软件,对CDMS进行了应用研究。除了Orbitrap是成熟的商业化仪器这一优点外,轨道静电离子阱内的离子由于其轨道运动,导致电荷分布在中心电极周围,因此其空间电荷相互作用较小。Kelleher 在Nature Method上的论文声称,基于Orbitrap的CDMS可以同时分析100个离子。不过,在电荷测量精度上,Orbitrap-CDMS目前只达到RMS 1 e左右,较Jarrold的线形静电阱还有一定的差距,但Orbitrap对m/z的测量精度、分辨率远远超过ELIT,一定程度上帮助消除在多离子同时分析时可能出现的m/z相近离子的信号干涉效应。笔者在岛津公司的欧洲研发团队去年也在JASMS发表了用CDMS测量糖蛋白的尝试。该工作采用了一种盘状平面静电离子阱分析器,如图4,而这种分析器也能像Orbitrap那样获得超高分辨质谱。通过对测量硬件和软件进行改进,实现了CDMS实验。该报道给出了一种全新的CDMS数据处理方法,能够克服离子在分析过程中因碰撞夭折造成测量不准的问题,同时实验验证了该方法的有效性,还对多个离子同时分析时的信号干涉等问题提出分析和研判,为深入研究CDMS技术,消除造成电荷测量误差的障碍打下了基础。图4,用于CDMS 实验的平面静电离子阱系统 (A. Rusinov, L. Ding, JASMS, 32, 5, 2021)CDMS技术的应用现状目前,电荷检测质谱技术还处于早期发展阶段,还没有现成的商品仪器出售,只有能够自己开发质谱仪器硬件,或自己改编FTMS(含Orbitrap)软件的专家才能进行这样的实验。 今年初美国沃特世公司宣布成功收购专攻电荷检测质谱技术(CDMS)及服务的初创企业Megadalton Solutions Inc. Megadalton Solutions是由美国印第安纳大学的Martin Jarrold和David Clemmer两位教授于2018年创立,他们目前是研发的CDMS仪器最长久的团队并拥有最成熟的技术。沃特世曾于2021年将Megadalton的CDMS技术引进到了沃特世Immerse Cambridge创新和研究实验室,并应用于各项先进检测及研发工作。沃特世公司首席执行官Udit Batra博士表示要进一步开发Megadalton的CDMS技术并将其商业化。在国内,CDMS无论是仪器技术开发还是应用都属空白。虽然国内在复杂生物大分子结构与功能的研究、病毒载体空壳率监测方面对CDMS已经产生需求,但我们在高端质谱仪器研制方面远远落后于西方。CDMS在技术上是基于FTMS分析原理而演化产生的,但国内目前对FT类型的质谱仪器研究,除了少量理论分析与离子光学仿真工作外,还没有实质性的进展,也没有企业能够提供FTMS类商品仪器。针对这些需求,笔者打算在前期研究工作的基础上,研究开发静电离子阱分析器,并进一步结合开发CDMS特定的数据处理软件,建成一套拥有自主知识产权的新型质谱仪器。同时建立国内的研发应用合作机制,解决目前国内超大分子蛋白质生物药剂质量分析的问题。预测CDMS技术未来的市场空间如前所述,目前对复杂蛋白等大型生物分子进行质谱分析时,由于其分子量的差异性(heterogeneity), 存在着严重的多价态峰群重叠问题,导致无法通过质谱仪获得这些大分子在样品中的质量分布。而用电荷检测质谱仪,无需对电荷态退卷积,可以直接得到蛋白质、蛋白复合体、各种转译后修饰造成的特定质量分布图。因此,该仪器的发展在天然蛋白质、糖蛋白、病毒颗粒的成分和结构研究,抗原-抗体作用机理研究和疫苗研发方面有很大的未来市场空间,具体可以列举以下几个方面:(1)新型电荷检测质谱仪可实现复杂样品的蛋白离子精确分析,可时提供复杂样品中各蛋白分子的结构,密度分布等。(2)可直接测定糖蛋白及其它各种转译后修饰造成的特定质量分布图,为解释蛋白大分子及其转译后修饰分子量或结构表征变化信息等之间的关系,从而对糖蛋白相关的疾病诊断具有重要意义。(3)通过研究DNA等生物大分子离子的电荷分布,以及质量与电荷的关联,可以推断这些大分子的结构,比如它的聚合程度、纤维股数等。(4)在病毒研究中,可以用来确定病毒衣壳的蛋白复合体结构及其组装反应的过程,这将在抗病毒药物的研究中发挥作用。(5)在基因疗法研究和产品质控中,本项目研制的电荷检测质谱仪可以用来测定腺病毒载体的空壳率,检查载体内的基因完整度。推动现代临床医学的发展;(6)电荷检测质谱仪还可以用来测定纳米聚合物分子的聚合度和分散指数,推动材料科学的发展。值得关注的是新冠疫情给质谱分析带来了全新机遇,除了对新冠病毒本身的蛋白进行分析研究以外,也可以在灭活疫苗、病毒载体疫苗以及核酸疫苗产品的质量控制、效果评价、免疫机制研究以及载体类疫苗的体外模拟产物的评价等方面发挥优势。关于笔者:宁波大学材料科学与化学工程学院/质谱技术研究院 丁力1990年于复旦大学物理系获理学博士学位。先后工作于复旦大学材料科学系,以色列魏兹曼科学研究所,英国贝尔法斯特女王大学纯粹与应用物理系。1998年加入岛津欧洲研究所。2007年至2011年任岛津分析技术研发(上海)有限公司总经理。2011-2020年任岛津欧洲研究所高级研究员,研发二部经理。主要领导了多项质谱仪器的研发,是国际上数字离子阱质谱技术的创始人,在离子源,四极场离子阱,静电离子阱,飞行时间等分析器技术及其联用技术方面有很多创新和突破。发表论文、报告、专著一百余篇,有三十余项发明专利。领域:QIT、ToF、Quadrupole、MALDI、APMALDI、ESI、Digital Ion Trap、Linear Ion Trap、Electrostatic Ion Trap,FTMS、 CDMS、MSMS、ECD、Ambient Pressure Ion Sources 等。目前丁力在宁波大学组建团队,继续静电离子阱的设计和优化工作,已提出了静电“和谐阱”的设计概念,充分利用其高次谐波来提高质谱分析器的分辨本领。同时也在探索在国内实现这种精密分析器的加工和组装工艺,为下一步实现超高分辨质谱仪国产化做准备,也为在国内研制电荷检测质谱仪打好基础。