有篇英文原文的关于峰形改善的文章,阐述得很系统全面,上传给各位色友分享!http://www.instrument.com.cn/bbs/images/affix.gif反相色谱峰形拖尾的原因和对策.doc
用阴离子交换柱分离检测酸性有机物,色谱条件为:强酸性(pH1.8)高浓度缓冲盐(50mM),40%乙腈,出来的色谱峰严重拖尾,加1%的乙酸没有改善。大家有什么好的方法吗?
最近做一个检测方法的验证。使用岛津2030液相,4.1. 色谱条件色谱条件与系统适用性试验:色谱柱:Thermo Hypersil GOLD(250×4.6mm,5μm)C18柱;以四氢呋喃-0.1%柠檬酸(40:60,V/V)为流动相;检测波长为420nm,进样量20μL,柱温30℃,流速1.0ml/min用了一根赛默飞柱子,发现峰形偏胖,由于柱子不是新的,所以可能柱效原因,又换了一根与方法中一致的柱子,峰形相对改善,依然偏胖,温度提高10℃,并没有改善,峰形仍不好,拖尾因子有1.126这样。请问是否依然是柱子原因?如何改善,1.126的拖尾因子是否不能使用?[img]https://ng1.17img.cn/bbsfiles/images/2018/12/201812031522293749_2987_3116636_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2018/12/201812031522293429_1226_3116636_3.png[/img]
最近出峰偏平,拖尾,讨论,如何改善液相色谱的峰形,各位大侠多多指教!![em09509]
本人新接触一个项目,用CLND测样品中含氮杂质,用的是菲罗门的biosep-sec-s2000的凝胶色谱柱。在建立方法的时候遇到了几个问题,向各位大虾求助!1.样品浓度配到100mg/ml,进样量40ul的时候,需要测的杂质的峰信噪比才9.7,但标准品咖啡因浓度5ppm,在同样的进样量时峰形已经展宽的很厉害了。怎么样才能保证杂质被检出,同时又能比较准确的定量呢?2.我试了调节流动相里有机相的比例,改变流速,改变进样速度,发现有机相比例加大后,咖啡因的信噪比是提高了,但是峰变形严重,甚至还出现了分叉。流速增加也是同样的影响。有没有其他的方法可以提高信噪比同时又不会影响峰形呢?这2个问题其实归结起来就是怎么提高信噪比,请有经验的前辈提供一些思路,多谢啦
气相色谱是将样品气化后导入色谱柱进行分离分析,柱温直接影响样品中各组分的色谱行为。很多时候,大部分样品组分复杂、沸程较宽,这种情况下,如果使用恒温分析,则各组分难以完全分离并且峰形较差。同时以低极性色谱柱为例,宽沸程的复杂样品在恒温模式下进行分析,柱温设定太高则分离度下降,柱温设定太低则分析时间延长。因此,应该用柱温程序升温方法来改善后流出组分的峰形。

[center]【专题讨论第七期】怎样改善峰型?[/center][center][img]http://ng1.17img.cn/bbsfiles/images/2017/01/201701191652_628347_1600062_3.jpg[/img][/center][color=#DC143C]=======================================================================================================液相色谱【专题讨论】系列对液相色谱中的诸多专题进行讨论,希望能从各个专题讨论中多听见解,多吸取经验从而规范和完善我们的色谱操作技术,提高对色谱分析的认识,打造我们更年轻更专业化的队伍。同时,邀请色谱版块专家、版主积极参与,研讨和解答版友提出的问题,共同建设我们学习交流的平台。=======================================================================================================[/color]本期讨论话题:[B][color=#00008B]怎样改善峰型?[/color][/B]整理了部分版友的帖子,以便大家参考。[color=#DC143C]========================================================================================================[/color][B]hanxiuling1984[/B][B]——[/B]可以通过改变流动相得比例,或者通过改变流动相的ph来调节峰型 [B]tyys98——[/B]针对原因来处理,就是那些引起峰形劣变的原因。[B]王蒹葭——[/B]换质量好的柱子 [B]qinglei123——[/B]死体积的减少可以改善峰普带的宽度从而起到改善峰型的效果[B]泪珠里的海——[/B]我觉得上机前的样品所溶解的溶剂还是比较重要的,以前做沙星类药物残留检测的时候,标品稀释在甲醇里和乙腈里峰形差别很大,甲醇中要好很多。对于农药来说也存在这种情况,不同比例的甲醇水溶解/稀释的,不同比例的乙腈水溶解/稀释的,跑出来的差别悬殊。另外前处理考虑适当使用一些填料,吸附剂(如PSA)净化也可以很大程度上降低干扰,改善峰形的。对于gc-ms来说,分析保护剂也可以在一定程度上改善峰形。[B]Zxhcnf——[/B]峰形的改善,不外乎是三种,一前拖峰变对称,二后拖峰变对称,三宽峰变尖锐,下面的两个帖子对前拖和后拖进行了一些总结,大家可以看一下,至于峰形比较宽需要变得尖锐一些,通常调节pH可以实现这一目的。http://bbs.instrument.com.cn/shtml/20091030/2184029/http://bbs.instrument.com.cn/shtml/20091127/2234793/[B]lilytrue2003——[/B]我一般都在流动相里加TFA来改善峰型[B]qz——[/B]改善峰形的方法有:用流动相稀释样品(前提是被测物要溶于流动相)、改变流动相比例、更换色谱柱、调pH值等[B]weiweijunling——[/B]1.用较短的,窄内径的毛细管连接进样器和色谱柱以及色谱柱和检测器2.确认连接管的接头都相互匹配3.使用死体积小的流通池;4.减小进样量5.调节流动相的PH值,对于前延峰加醋酸,对于拖尾峰加三乙胺调节;6.尽量用流动相溶解样品。7.经常清洗系统,确保系统的干净。[B]yuxiaofen-2008——[/B]一般峰型不好可以通过改变流动相PH值,但有的时候流动相中有机相的比例也起到很重要的作用,像乙腈,之前有做过中成药的样品,改变PH值峰型还是拖尾很严重,后来就是增加乙腈的比例,对称度才合格。要是出现肩峰等劣峰,就有可能是预柱或是柱子脏了,换一根吧。
改善酸峰形的四种途径 色谱工作者时常对碱性化合物拖尾(峰形差)的现象比较熟悉。这种现象通常是由于碱性化合物中的碱性氮原子与固定相中酸性硅醇基的相互作用而至。分析者通常使用加入三乙胺的办法来减少拖尾现象的发生。酸性物质峰形差的现象不多见,但同样给分析结果造成不良影响。下文以布洛芬(对异丁基苯异丙酸)的分析为例,介绍几种改善峰形的方法。 1. 增加流动相中盐的浓度。 分析布洛芬的一种方法是使用60∶40(v/v)的乙腈-5mM磷酸二氢钠。图1(a)中是使用此流 动相所得色谱图,拖尾因子高达(Tf)3.9。高盐浓度(如,25-50mm)磷酸盐可改善酸性物 质的峰形,原因是高盐可抑制溶质与硅胶的离子化以及二者之间的第二相互作用。本例中,分析者应注意分析方法本身及所分析溶质。布洛芬的酸性官能团-羧基(见图1a)的 pka4.4。5mM磷酸二氢钠的pH也是4.4,此pH在磷酸盐的缓冲范围之外(1.1-3.1)。因此, pH4.4时,布洛芬的羧基刚好达到解离平衡(离子化状态与非离子化状态共存)。羧基 (特别是离子化状态羧基)可发生离子交换作用或与硅胶表面的质子竞争,导致拖尾或增加保留。为降低这些相互作用,分析者必须使流动相的pH值远离样品的pka值。 2. 降低流动相的pH值。 将流动相的pH值降低到3.0,峰形得以改善(见图1b)。pH3.0拖尾因子高达(Tf)3.9时,在流动相缓冲范围内,但缓冲能力较低。使盐浓度增加到大于20mM可改善色谱重现性,也能改善峰形。此时布洛芬的羧基不同于pH4.4时的离子化与非离子化混合状态,而 处于单一质子化状态。质子化状态时羧基与硅胶表面质子化的硅醇基相互作用的可能性就小得多。因此,低pH值与盐条件下,布洛芬的拖尾因子降至1.8(图1b)。此结果表明,第二种相互作用已被降低,但尚未消除。另外一种改善峰形的办法及使用添加剂。 3. 加入竞争有机酸。 与加入三乙胺抑制碱性化合物拖尾原理相似,有机酸可与酸性样品组分竞争硅胶表面的活性位置。在流动相中加入1%乙酸对峰形的改善可见图1c,其中得到了对称的布洛芬峰,拖尾因子为1.0。流动相也可再作改变以期获得所希望的结果。 4. 使用另一种有机酸- 0.1%三氟乙酸。 较高浓度的乙酸会产生较高的基线噪音(图1c)。使用0.1%三氟乙酸(约13mM) 取代乙 酸及磷酸盐,使流动相更为简单,仍可获得非常对称的布洛芬峰(图1d)。除此之外,这一流动相还改善了UV透过性,满足了[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]的挥发性需要。
在正相色谱分离模式中,水是一种溶剂强度非常高的溶剂,即便流动相中有少量的存在就能对保留时间产生强烈的影响,特别是在硅胶或氧化铝为固定相而使用的流动相非极性或疏水性很强的情况下尤其是这样。因为烷烃类溶剂天然含水量极低,基于无水烷烃的流动相,需要很长时间才能和环境中水分达成平衡。所以,正相色谱柱使用几天后就观察到保留时间有漂移的现象是司空见惯的。可能正是存在这个令人头疼的问题,成为了当今正相色谱没有反相色谱那么普及常用的主要原因。使用溶剂强度ε0大于0.35的流动相,保留时间漂移的问题不大,如用的是极性基团键合的正相固定相,流动相的ε0值还可以更小些。此外,还有一个非常有效的改善正相色谱保留时间重现性的方法:使用和水“半饱和”的正相流动相。“半饱和”流动相配置方法:将无水的非极性流动相分成两半;其中一半中加入一定量水,并混匀搅拌约一小时,静止分层后,将多余的水相全部除去;将无水的一半流动相和已与水饱和过的另一半流动相两部分重新混合在一起,就配成了“半饱和”流动相。使用“半饱和”流动相,使色谱柱平衡时间大大加快,色谱柱的含水量相对不会受环境中水份含量的很大影响,可以极大改善色谱保留时间的重现性;另外流动相中的一定量水分,首先和固定相表面的活性最大位点作用,结果使表面不均一性减少,非特异性吸附影响减弱,可获得更对称的峰形。
色谱峰的峰型怎么改善峰型不对称,有的向前偏(前延),有的向后偏(拖尾),怎么通过仪器设备来改善峰型 [b]问题补充:[/b]我们用的是紫外检测器,柱子是硅胶与C18键和而成的
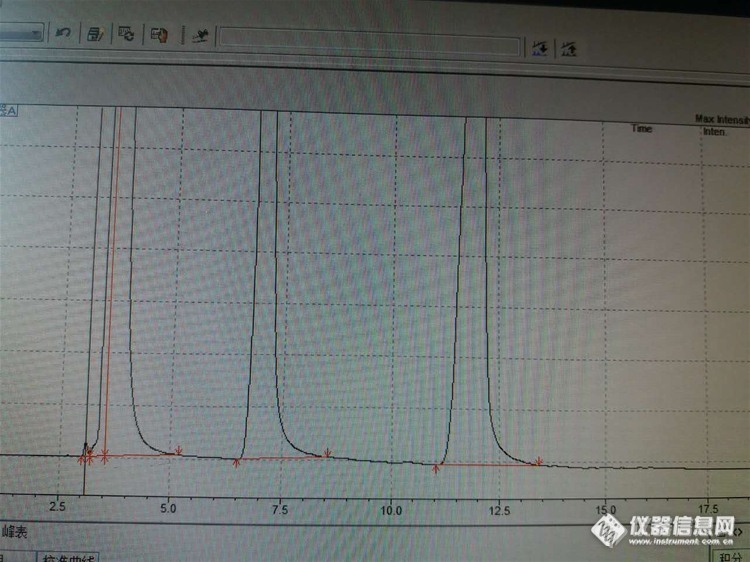
色谱条件:岛津LC-20AD, 示差折光检测器, agela innoval NH2色谱柱, 流速1.0ml/min, 柱温35℃, 柱压3.5Mpa, 按照GB/T23529-2009标准检测葡萄糖,海藻糖 进样量10Ul 流动相:86:14乙腈:水困惑:峰形较宽,拖尾,前沿。峰形改善:1,降低进样量为5Ul,峰形无明显改善,如下图:注:请忽略第三个峰,第一个峰为溶剂峰,样品为水定容。http://ng1.17img.cn/bbsfiles/images/2016/06/201606271612_598368_2738548_3.jpg 2,降低乙腈比例,使保留时间提前,如下图http://ng1.17img.cn/bbsfiles/images/2016/06/201606271614_598369_2738548_3.jpg求问: 虽然出峰提前,峰形变窄,峰面积无很大变化,但还是有前沿拖尾的情况,而且随着浓度增高柱效下降,各位有什么好的建议?
液相可以在流动相中加酸、加盐,气相色谱就不一样了,那我该怎么改善峰形呢

我用的是c18反相色谱柱,流动相是0.1%甲酸的水和0.1%甲酸的乙腈,这个峰是血清中提取的组氨酸的EIC图,走单标及混标时组氨酸的峰型很好,但是样本中时峰型就变成这样子了,请各位知道如何解决的老师帮我解答一下如何改善这个峰。如果我没有描述的可以提出来我再说明一下。file:///D:\294469399\Image\Group\http://ng1.17img.cn/bbsfiles/images/2016/11/201611041544_615819_0_3.jpg
你模式过色谱条件吗?你测定过多个组分吗?来分享下你使用离子色谱时改善分离度方法的方法吧,看看你都是怎么改善的!!!!
[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]峰裂分的原因有很多,如:1. 色谱柱过载;应对方法:可以通过降低进样量观察峰形是否改善来确定是否是过载导致的峰裂分。2. 色谱柱柱头污染或筛板部分堵塞;应对方法:可以通过更换同款色谱柱来排查或者反接色谱柱(如果确定色谱柱可以反接)观察峰形是否改善。3. 样品稀释剂洗脱能力较强而导致的溶剂效应;应对方法: 在不影响分析物溶解的前提下,尽量用(初始)流动相溶解样品或者用弱洗脱强度溶剂稀释样品以降低溶剂效应;在不影响灵敏度的前提下降低进样体积。4. 化合物自身的原因。比如化合物中存在多种互变形式;或者存在多个离子化位点,可能导致色谱峰裂分成双重甚至多重峰。应对方法:考察不同极性溶剂、流动相pH、温度等对峰形的改善情况,也可以针对性地选择特殊的色谱柱固定相,比如键合了带电基团的色谱柱来分析化合物等。
请教色谱柱检测过程中出现如图1和图2所示的不对称的峰型(之前还是正常的,不知道抽啥风),大概率是哪种原因,是否属于可以修复的范围?考虑如下原因:1:柱效降低(最好不要。。) 2、柱头塌陷(反冲能修复吗?) 3、柱头堵塞(正冲没啥效果,反冲效果好吗?)液相条件:流动相(氨水/甲醇=0.9:0.1)、色谱柱:ZorBax-C-18 Extend column(3.5um粒径)[img=,690,920]https://ng1.17img.cn/bbsfiles/images/2021/07/202107052250497400_6735_4008596_3.jpeg!w690x920.jpg[/img][img=,690,517]https://ng1.17img.cn/bbsfiles/images/2021/07/202107052251316098_4757_4008596_3.jpeg!w690x517.jpg[/img]下图是正常时候的峰型[img=,690,517]https://ng1.17img.cn/bbsfiles/images/2021/07/202107052252386775_1577_4008596_3.jpeg!w690x517.jpg[/img]
色谱柱正向进样时峰拖尾,反相进样时峰正常,色谱柱是出现了什么问题,如何改善
克林霉素BSTFA衍生全扫描,色谱柱:VF-5ht,程序升温条件:初始160℃保持1分钟,25℃/min升温至300℃,保持10分钟。不分流进样,流速:1ml/min 载气模式:恒流模式,分流流速:50ml/min,不分流时间:1min 进样口温度:280℃ 离子源:280℃ 传输线温度:280℃。峰型如下图所示,请问各路大神如何改善峰型?[img=,687,256]http://ng1.17img.cn/bbsfiles/images/2018/08/201808041441593827_479_3312593_3.png!w687x256.jpg[/img]
[color=#444444]我用的是HP-1,30m*0.53*2.65um[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]柱,测定1,4-丁二醇含量,峰形拖尾,向大家请教下有什么方法可以改善峰形?[/color]

234的离子色谱图峰形不好,经过改变流动相比例,流速等,峰形无明显改善。 请问有何好的建议对峰形进行修缮?谢谢!

如题,这是用DB-1做的某含氮杂环化合物的图,FID检测,He,峰型很差,怎么改善?应该换什么柱子?由于样品前处理比较繁琐,且有一定的碱性!温度程序:50度,5min后10度/min升至200度,载气线速度30cm/s[img]http://ng1.17img.cn/bbsfiles/images/2009/02/200902131438_132961_1621482_3.jpg[/img]
1 稀释样品对组成复杂的样品, 若待测离子对树脂亲合力相差颇大, 就要作几次进样, 并用不同浓度或强度的淋洗液或梯度淋洗. 对固定相亲合力差异较大的离子, 增加分离度的最简单方法是稀释样品或作样品前处理. 例如盐水中SO2 -4 和Cl - 的分离. 若直接进样, 其色谱峰很宽而且拖尾, 表明进样量已超过分离柱容量, 在常用的分析阴离子的色谱条件下, 30min 之后Cl - 的洗脱仍在继续. 在这种情况下,在未恢复稳定基线之前不能再进样. 若将样品稀释10 倍之后再进样就可得到Cl - 与痕量SO2 -4 之间的较好分离. 对阴离子分析推荐的最大进样量, 一般为柱容量的30 % , 超过这个范围就会出现大的平头峰或肩峰2 改变分离和检测方式若待测离子对固定相亲合力相近或相同, 样品稀释的效果常不令人满意. 对这种情况, 除了选择适当的流动相之外, 还应考虑选择适当的分离方式和检测方式. 例如, NO-3 和ClO-3 , 由于它们的电荷数和离子半径相似, 在阴离子交换分离柱上共淋洗. 但ClO-3 的疏水性大于NO-3 , 在离子对色谱柱上就很容易分开. 又如NO-2 与Cl - 在阴离子交换分离柱上的保留时间相近, 常见样品中Cl - 的浓度又远大于NO-2 , 使分离更加困难, 但NO-2 有强的UV 吸收, 而Cl - 则很弱, 因此, 应改用紫外作检测器测定NO-2 , 用电导检测Cl - , 或将两种检测器串联, 于一次进样同时检测Cl - 与NO-2 . 对高浓度强酸中有机酸的分析, 若采用离子排斥, 由于强酸不被保留, 在死体积排除, 将不干扰有机酸的分离.3 样品前处理对高浓度基体中痕量离子的测定, 例如海水中阴离子的测定, 最好的方法是对样品作适当的前处理. 除去过量Cl - 的前处理方法有: 使样品通过Ag+ 型前处理柱除去Cl - , 或进样前加AgNO3 到样品中沉淀Cl - 也可用阀切换技术, 其方法是使样品中弱保留的组分和90 %以上的Cl - 进入废液, 只让10 %左右的Cl - 和保留时间大于Cl - 的组分进入分离柱进行分离. 对含有大的有机分子的样品, 应于进样前除去有机物, 较简单的方法是用Dionex 的前处理柱OnGuard 的RP 或P 柱或在线阀切换除去有机基体.4 选择适当的淋洗液[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]分离是基于淋洗离子和样品离子之间对树脂有效交换容量的竞争, 为了得到有效的竞争, 样品离子和淋洗离子应有相近的亲合力. 下面举例说明选择淋洗液的一般原则. 用CO2 -3 2HCO-作淋洗液时, 在Cl - 之前洗脱的离子是弱保留离子, 包括一价无机阴离子、短碳链一元羧酸和一些弱离解的组分, 如F- , 甲酸, AsO-2 , CN- 和S2 - 等. 对乙酸, 甲酸与F- 、Cl - 等的分离应选用较弱的淋洗离子, 常用的弱淋洗离子有HCO-3 , OH- 和B4O2 -7 . 由于HCO-3 和OH- 易吸收空气中CO2 , CO2 在碱性溶液中会转变成CO2 -3 , CO2 -3 之淋洗强度较HCO-3 和OH- 大, 因而不利于上述弱保留离子的分离. B4O2 -7 亦为弱淋洗离子, 但溶液稳定, 是分离弱保留离子的推荐淋洗液. 中等强度的碳酸盐淋洗液对高亲和力组分的洗脱效率低.对离子交换树脂亲合力强的离子有两种情况, 一种是离子的电荷数大, 如PO3 -4 , AsO3 -4 和多聚磷酸盐等 一种是离子半径较大, 疏水性强, 如I - , SCN- , S2O2 -3 , 苯甲酸和柠檬酸等. 对前者以增加淋洗液的浓度或选择强的淋洗离子为主. 对后一种情况, 推荐的方法是在淋洗液中加入有机改进剂(如甲醇、乙腈和对氰酚等) 或选用亲水性的柱子, 有机改进剂的作用主要是减少样品离子与离子交换树脂之间的非离子交换作用, 占据树脂的疏水性位置, 减少疏水性离子在树脂上的吸附, 从而缩短保留时间, 减少峰的拖尾, 并增加测定灵敏度.在[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]中, 可由加入不同的淋洗液添加剂来改善选择性, 这种淋洗液添加剂只影响树脂和所测离子之间的相互作用, 而不影响离子交换. 对与树脂亲合力较强的离子, 如一些可极化的离子, I-和ClO4- , 以及疏水性的离子, 苯甲酸和三乙胺等, 在淋洗液中加入适量极性的有机溶剂如甲醇或乙腈, 可缩短这些组分的保留时间并改善峰形的不对称性. 为了减少样品离子与树脂之间的非离子交换作用, 减少树脂对疏水性离子的吸附, 在阴离子分析中, 可在淋洗液中加入对氰酚. 如测定1 %NaCl中的痕量I- 和SCN- 时, 加入对氰酚占据树脂对I- 和SCN- 的吸附位置, 从而减少峰的拖尾并增加测定灵敏度. [url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]IC[/color][/url] 中, 一价淋洗离子洗脱一价待测离子, 二价淋洗离子洗脱二价待测离子, 淋洗液浓度的改变对二价和多价待测离子保留时间的影响大于一价待测离子. 若多价离子的保留时间太长, 增加淋洗液的浓度是较好的方法.
1、稀释样品 对组成复杂的样品,若待测离子对树脂亲合力相差颇大,就要作几次进样,并用不同浓度或强度的淋洗液或梯度淋洗。对固定相亲合力差异较大的离子,增加分离度的最简单方法是稀释样品或作样品前处理。例如盐水中SO2-4和Cl-的分离。若直接进样,其色谱峰很宽而且拖尾,表明进样量已超过分离柱容量,在常用的分析阴离子的色谱条件下,30min之后Cl-的洗脱仍在继续。在这种情况下,在未恢复稳定基线之前不能再进样。若将样品稀释10倍之后再进样就可得到Cl-与痕量SO2-4之间的较好分离。对阴离子分析推荐的最大进样量,一般为柱容量的30%,超过这个范围就会出现大的平头峰或肩峰 2、改变分离和检测方式 若待测离子对固定相亲合力相近或相同,样品稀释的效果常不令人满意。对这种情况,除了选择适当的流动相之外,还应考虑选择适当的分离方式和检测方式。例如,NO-3和ClO-3,由于它们的电荷数和离子半径相似,在阴离子交换分离柱上共淋洗。但ClO-3的疏水性大于NO-3,在离子对色谱柱上就很容易分开。又如NO-2与Cl-在阴离子交换分离柱上的保留时间相近,常见样品中Cl-的浓度又远大于NO-2,使分离更加困难,但NO-2有强的UV吸收,而Cl-则很弱,因此,应改用紫外作检测器测定NO-2,用电导检测Cl-,或将两种检测器串联,于一次进样同时检测Cl-与NO-2。对高浓度强酸中有机酸的分析,若采用离子排斥,由于强酸不被保留,在死体积排除,将不干扰有机酸的分离。 3、样品前处理 对高浓度基体中痕量离子的测定,例如海水中阴离子的测定,最好的方法是对样品作适当的前处理。除去过量Cl-的前处理方法有:使样品通过Ag+型前处理柱除去Cl-,或进样前加AgNO3到样品中沉淀Cl-;也可用阀切换技术,其方法是使样品中弱保留的组分和90%以上的Cl-进入废液,只让10%左右的Cl-和保留时间大于Cl-的组分进入分离柱进行分离。对含有大的有机分子的样品,应于进样前除去有机物,较简单的方法是用Dionex的前处理柱OnGuard的RP或P柱或在线阀切换除去有机基体。 4、选择适当的淋洗液 离子色谱分离是基于淋洗离子和样品离子之间对树脂有效交换容量的竞争,为了得到有效的竞争,样品离子和淋洗离子应有相近的亲合力。下面举例说明选择淋洗液的一般原则。用CO2-32HCO-作淋洗液时,在Cl-之前洗脱的离子是弱保留离子,包括一价无机阴离子、短碳链一元羧酸和一些弱离解的组分,如F-,甲酸,AsO-2,CN-和S2-等。对乙酸,甲酸与F-、Cl-等的分离应选用较弱的淋洗离子,常用的弱淋洗离子有HCO-3,OH-和B4O2-7。由于HCO-3和OH-易吸收空气中CO2,CO2在碱性溶液中会转变成CO2-3,CO2-3之淋洗强度较HCO-3和OH-大,因而不利于上述弱保留离子的分离。B4O2-7亦为弱淋洗离子,但溶液稳定,是分离弱保留离子的推荐淋洗液。中等强度的碳酸盐淋洗液对高亲和力组分的洗脱效率低。 对离子交换树脂亲合力强的离子有两种情况,一种是离子的电荷数大,如PO3-4,AsO3-4和多聚磷酸盐等;一种是离子半径较大,疏水性强,如I-,SCN-,S2O2-3,苯甲酸和柠檬酸等。对前者以增加淋洗液的浓度或选择强的淋洗离子为主。对后一种情况,推荐的方法是在淋洗液中加入有机改进剂(如甲醇、乙腈和对氰酚等)或选用亲水性的柱子,有机改进剂的作用主要是减少样品离子与离子交换树脂之间的非离子交换作用,占据树脂的疏水性位置,减少疏水性离子在树脂上的吸附,从而缩短保留时间,减少峰的拖尾,并增加测定灵敏度。 在离子色谱中,可由加入不同的淋洗液添加剂来改善选择性,这种淋洗液添加剂只影响树脂和所测离子之间的相互作用,而不影响离子交换。对与树脂亲合力较强的离子,如一些可极化的离子,I-和ClO4-,以及疏水性的离子,苯甲酸和三乙胺等,在淋洗液中加入适量极性的有机溶剂如甲醇或乙腈,可缩短这些组分的保留时间并改善峰形的不对称性。为了减少样品离子与树脂之间的非离子交换作用,减少树脂对疏水性离子的吸附,在阴离子分析中,可在淋洗液中加入对氰酚。如测定1%NaCl中的痕量I-和SCN-时,加入对氰酚占据树脂对I-和SCN-的吸附位置,从而减少峰的拖尾并增加测定灵敏度。IC中,一价淋洗离子洗脱一价待测离子,二价淋洗离子洗脱二价待测离子,淋洗液浓度的改变对二价和多价待测离子保留时间的影响大于一价待测离子。若多价离子的保留时间太长,增加淋洗液的浓度是较好的方法。
对于气相分析,都希望峰型好看,对称因子越接近1越完美。但实际中往往产生峰前置或峰拖尾的情况。我们如何才能改善?1)减少进样量2)升高/降低进样口温度3)改变柱温或改变程序升温4)调整各气体的流量流速5)调节分流比以上那些方法是大家常用的?或大家有其他什么好的方法介绍吗?

安捷伦1100液相色谱 出峰峰型不好 ,主峰后面包个肚子,开始以为是和杂质没分开,换别的洗脱梯度没有改善,换到另外一台1260上,方法一样,峰型就比较对称 ,判断1100的柱子损坏了,换了一根新柱结果也一样的,小女子对液相了解不是很深,求专业人士指点,急!!!http://ng1.17img.cn/bbsfiles/images/2014/11/201411261537_524718_2710314_3.jpg
液相色谱出峰,拖尾因子在0.95-1.05范围内,但峰型矮胖,峰宽达到2.5左右,减小进样体积至5ul,有所改善,也换过流动相,换了两次色谱柱,峰宽还是很宽,可以再从哪些方面改善?
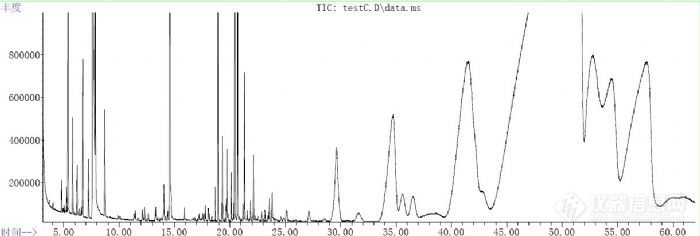
峰型不好,可以通过修改升温程序来改善吗?最近用气质做松脂化学组成,HP-5升温程序为60℃保持2min,2℃/min升到80℃,再以8℃/min升到200℃,最后以2℃/min升至270℃出来的图谱30Min以后的出峰情况很不理想,把后面升温程序改变了几个方案,效果不明显,请教下各位前辈,怎么解决呢?http://ng1.17img.cn/bbsfiles/images/2011/08/201108201055_311263_1912751_3.jpg
[color=#3e3e3e] 问题:我们开发了一种方法来检测食物样品中的苯二甲酸,此法是先对样品进行皂化处理,然后用反相离子对色谱法来分析。经皂化后,基体的酸性非常强。在所有分析方法中,是液相色谱(LC)法最好,还是离子交换色谱法更加适合呢?[/color][color=#3e3e3e][/color][color=#3e3e3e] 解答:对于如苯二甲酸的酸性样品,离子对色谱法是可取的,离子交换色谱法也是可行的,但我选择了从一种较为传统的技术开始。通常我喜欢使方法简洁一些。方法越是简单,引出的问题也就越少。因此,我从反相色谱法开始研究,它使用低pH值的流动相。(如果你决定用离子对或离子交换色谱法,在本节的末尾部分我就这两种方法如何进行添加了一些论述。)[/color][color=#3e3e3e] 从15或25cm×4.6mm,5um的C-8或C-18色谱柱开始。我比较喜欢用新型的碱灭活硅烷作为柱填料,而不喜欢旧型的色谱柱,因为碱灭活硅烷对拖尾较不敏感,并且在较宽的pH范围内稳定。为了在离子抑制的环境下操作,流动相的pH值应低于酸的pKa1-1.5个pH单位。苯二甲酸的第一个pKa为2.9,则需要在pH=1.4-1.9的环境下操作。一般情况下,除非你知道色谱柱在什么环境下是稳定的,否则我们应该尽量避免在pH〈2的环境下操作。我从pH=2.0开始,用25mM的磷酸盐缓冲液作为流动相的水溶液部分,同时用乙腈或甲醇作为有机溶剂。在这些条件下,苯二甲酸未能充分离子化而得不到好的峰形,并且表现得像中性化合物。因为芳香烃的特性,所以用UV检测在255nm应该有可能。[/color][color=#3e3e3e] 我较喜欢用搜索梯度来准确本身的流动相强度,正如以前的“液相色谱的确问题解决”和参考文献2所述。用有选择地逐步处理作为方法开发,开始时用90%有机溶剂作为起点,然后有机溶剂含量逐渐下降10%,直到得到合理的保留时间为止。在样品注射前可调节其pH值,使之与流动相的pH值接近。[/color][color=#3e3e3e] 低pH值流动相中的离子抑制比在高pH值流动相中的有更多优点。低pH值时,苯二甲酸的离子化受到抑制,所以会表现得像中性分子而其保留时间可预测且得到可接受的峰形。低pH值也抑制固定相中硅醇基团的离子化,这有助于减少峰拖尾。所有的反相色谱柱在3〈pH〈7的范围内是稳定的,而较新型的色谱柱可在2〈pH〈8甚至更宽的范围内操作。[/color][color=#3e3e3e] 如果你想在高pH值下操作,你应该知道pH值大于8时柱填料中的碱性硅会溶解。有些色谱柱比其它色谱柱稳定一些,较高的pH值下,封尾的色谱柱比没有封尾的色谱柱更加稳定。在碱性条件下,当用有机缓冲液(如柠檬酸)替代无机缓冲液(如磷酸盐)时色谱柱的稳定性得到改善。一种选择是使用聚合物反相色谱柱。这些聚合物色谱柱对pH值不敏感,但它们趋向于产生比硅胶色谱柱较低的理论塔板数和较宽的峰。[/color][color=#3e3e3e] 你提议的离子交换色谱法是在高pH值分离的另一个可能。离子交换相附着在聚合物小球上,具有你寻找的pH值稳定性,但与相应的反相色谱柱比较,其理论塔板数较低。[/color][color=#3e3e3e] [b]峰变形[/b][/color][color=#3e3e3e][/color][color=#3e3e3e] [/color][color=#3e3e3e]问题:上一部分就苯二甲酸开发分析方法时,我们发现了如果制备苯二甲酸标准溶液时用水代替甲醇则其峰形得到改善。是什么原因导致这样的结果呢?我们使用的流动相是20:80(V/V)的甲醇-5mM磷酸盐缓冲液,并加入10mM四戊铵溴化物作为离子对。[/color][color=#3e3e3e] 解答:这样的结果是由注射入太大量的过强的溶剂引致的。图1解析了这个问题。图1a所示是变形峰,是将30ul样品注射入流动相的结果,样品用乙腈溶解,而流动相是含乙腈18%的水溶液。图1b所示的是正常峰,是用流动相作为注射溶剂溶解相同的样品。如果样品用不同于流动相的溶剂溶解,当被注射入时,样品溶液与流动相混合,并被稀释。如果注射的溶液比流动相强度大,则样品像在较强溶剂中一样会立即移动,并且较快地通过色谱柱,正如图1a所示,其保留时间比较短。当注射入的溶液与流动相混合时,有些分子与流动相的混合比其它分子更快,则它们穿过色谱柱的速率将发生改变,则谱带发生变形。如图1a所示,峰变形现象对较早洗脱的峰影响较大。解决将注射溶液量减至最少的问题的关键是使稀释在瞬间发生或者用强度不大于流动相的溶剂来溶解样品。较弱的溶剂在色谱柱中将样品浓缩,因此得到的峰往往是比注射入较强溶剂时更窄。[/color][color=#3e3e3e] 因此作为一般规律,如果样品溶于比流动相强的溶剂,则注射体积应少于25ul。注射容积取决于注射溶剂与流动相之间到底存在多大的差异,此差异很容易凭经验判断――只是等体积地增加注射的量直到峰开始变形,然后返回两个单位就可以了。在读者的问题中,样品溶于甲醇,但甲醇比流动相强得多,所以他得到变形的较宽的峰。当他用水代替甲醇时,则样品溶液弱于流动相,峰形就得到了改善。在离子对色谱法中,总是用流动相作为样品溶剂以减少基线后移现象。[/color][color=#3e3e3e][/color][color=#3e3e3e] [b]干扰峰[/b][/color][color=#3e3e3e] 问题:在反相LC分离法中,怎样避免溶剂前置峰对分析峰产生的干扰呢?[/color][color=#3e3e3e][/color][color=#3e3e3e] 解答:有些化合物不具保留性,在开始分离时就被洗脱下来,避免这些物质的干扰的最好的方法是增加待分析化合物的保留时间。通常如果保留因子(k)大于1,则其色谱法和分离效果都会比较好。利用溶剂前沿作为规则可估计出k的值。色谱图的第一个峰通常是溶剂前沿峰或杂质峰,此峰的洗脱时间为色谱柱的死时间(t0),此时间表示一个在色谱柱中不保留的化合物通过色谱柱的时间。紧跟着死时间出来的是与色谱柱作用很小,并且很难从溶剂前沿和其它化合物的杂质峰中分离开来的物质。为了获得k值大于1,被检测的化合物的保留时间必须是死时间的两倍以上。例如,图1b中9.03min处的峰,其k值大约为1。[/color][color=#3e3e3e] 你可以通过使用较弱的溶剂来增加保留时间。对于反相LC,弱溶剂一般是水或缓冲溶液。每改变溶液中的有机溶剂含量的10%,则保留时间大约变化3倍。为了获得期望的保留时间,你可以利用这个“3倍规则”来估计需要改变多少有机溶剂。[/color][color=#3e3e3e] 如何开始?[/color][color=#3e3e3e][/color][color=#3e3e3e] 问题:就反相LC分离而言,我看了很多关于选择初始条件的文献,但总体来说觉得很混乱,C-8好还是C-18好呢?我需要一根长为15cm的色谱柱还是25cm的色谱柱呢?我应该用乙腈还是甲醇那一种作为有机溶剂呢?就初始条件的选择你能给我一些指引吗?[/color][color=#3e3e3e] 解答:让我们单独地分析每一个参数吧。首先,C-8好还是C-18好,又或者是其它固定相更好呢?就大多数的应用而言,你选择任何一种固定相都只有很少的差异。对于某些物质,C-18比C-8更具保留性,所以极性较小的样品选用C-8柱比较适合,同时,极性越强的物质在C-18柱中的保留性就越强。对大部分物质而言,这样选择色谱柱是正确的。填料物质的特性是一个更重要的选择。新型的、洁净的、碱性去活硅(B型)有利于新方法的开发。在我的经验中,这些固定相比旧型的固定相总是产生更好的峰形和更少的拖尾。我坚信,你为色谱柱付出多少就有多少收获--$200一根的色谱柱不可能给你$400一根的色谱柱的运行水平。当然例外是存在的,但对大部分情况而言,当你在方法的开发上花费了数千美元并在分析上花费了数万美元时,色谱柱的分离能力有可能很差吗?[/color][color=#3e3e3e] 色谱柱长度是另一个反复选择的内容。大部分微粒的分离需要8000-10000的塔板数,填充5um微粒的15cm长的色谱柱或含有3um微粒的7.5-10cm长的色谱柱对实际样品会产生这个塔板数。所以仅从塔板数来看,长为15或25cm的色谱柱都是合适的。我比较喜欢用15cm×4.6um,3.5-um的色谱柱,因为它们能在流速为2ml/min,同时柱压为2500psi的条件下操作。较长的25-cm的色谱柱对于相同的柱压要求较低的流速。较长的色谱柱产生大约3倍的通过时间,这是因为柱长和流速大约影响整个分析结果的30%。使用一根新型的7.5cm×4.6um,3.5-um的色谱柱是另一个选择。这些色谱柱在大约一半的时间内产生与15cm的色谱柱相近的塔板数。你必须使用较短的、小微粒色谱柱避免产生柱外带加宽现象。你也可以使用窄孔柱(1-2mmi.d.),但他们也对由柱外因子引起的带加宽非常敏感。[/color][color=#3e3e3e] 最后,有机溶剂也是经常选择的内容。溶剂应该与水完全混溶,与分析物及色谱柱均不起反应,粘度低,适用于所使用的检测器。最常用的三种溶剂是乙腈、甲醇和四氢呋喃。四氢呋喃是平时最坏的选择―操作时令人感觉不适,化学不稳定(放置一段时间后会形成过氧化物),平衡速度慢。甲醇是基本无毒的,并且对于检测波长高于220nm的物质是一个好的选择。然而,我的第一选择是乙腈,因为我的实验开发的许多方法都是需要在低波长检测的。[/color][color=#3e3e3e] 总而言之,我喜欢的初始条件是15cm×4.6mm,5um的C-8或C-18色谱柱,流速为2ml/min,乙腈-水或乙腈-缓冲溶液作为流动相。我也成功使用过7.5cm×4.6mm,3.5-um的色谱柱。这些色谱柱中的任何一根都会提供一个好的出发点,因为它们对于大部分的分离而言都提供了足够多的塔板数,能在较低波长下检测,并且移动速率快。说到这,我认为使用长为15或25cm的C-8或C-18色谱柱,选择乙腈或甲醇作为流动相,这里的任何一个组合都是非常可行的―这就是你的选择。[/color][color=#3e3e3e][/color][color=#3e3e3e] [b]结论[/b][/color][color=#3e3e3e] 为一个新方法选择初始条件,包括选择色谱柱、流动相和注射溶剂。虽然这些因素的许多组合都是可行的,但使用低pH值的流动相、反相色谱柱以及与流动相相似的注射溶剂,会给你开始的成功带来最大的可能。[/color]
[color=#444444]我用的是SUPELCOWAXTM 10 30m*0.32mm*1.0um色谱柱,测定DMAC中乙酸,峰形拖尾,柱温80℃,以10℃/min升温到200℃,保持10min,流速35cm/s,请教大家有什么方法可以改善峰形?[/color][color=#444444][color=#444444]用的是氮气,用的是安捷伦7890A,辅助气是20ml/min,进样口,安装检查了都没问题,请教下流速多少合适,还有什么参数可以改变?[/color][/color]
我用2010年版药典生地含量的测定方法测定样品中的梓醇含量,有些后拖尾,拖尾因子1.7,怎么改善峰形啊?