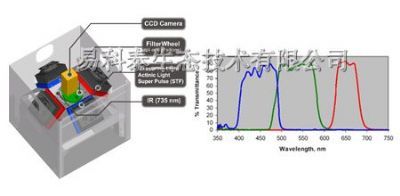
蜂巢矩阵叶绿素荧光成像系统HEXAGON-IMAGING-PAM叶绿素荧光成像系统的“六边形战士”精度高,面积大,功能全,应用广,文献多,数据可视化!HEXAGON-IMAGING-PAM是德国WALZ公司最新推出的大型蜂巢矩阵叶绿素荧光成像系统。它凭借高精度的脉冲振幅调制(PAM)技术,可以对20×24cm的区域进行成像。分辨率高达1.2 MP(1000 x 1200 px, 2x2 binning技术,实际是2000×2400),像素尺寸3.45 x 3.45 µm。超高分辨率的基础是成像区域光场的均匀性,在设计过程中,光源阵列中LED的位置是经过精心布局的,以保证测量区域内无阴影,所有成像区域内的样品均匀照光,样品间的差异可以尽收眼底。大功率LED面板的冷却效果非常好,可以最大限度的延长LED的使用寿命。增加远红光(FR)LED 面板,可用于测量所研究样品的Fo' 值。HEXAGON-IMAGING-PAM采用蜂巢矩阵式LED面板拼接技术,单个六边形蜂巢矩阵单元之间LED的不平横可以独立补偿,初衷是为实现样品区域的理想照明提供最佳选择。尽管成像区域很大,但是它依然足够灵活,可以测量各种类型的样品,如盆栽植物,穴盘中培养的植物,培养皿上的植物或多孔板中的藻类悬浮液。滑动门设计,集成安全关闭功能,开门状态下,饱和脉冲的强度会被抑制以保护操作人员的眼睛。主要功能l 原位测量:活体植物叶绿素荧光成像,直观显示样品光合作用光能利用差异,可导出彩色图像。l 成像功能:对Ft、Fo、Fm、Fv/Fm、F、Fm’、Y(II)、Y(NO)、Y(NPQ)、NPQ、qN、qP、qL、PS/50=ETR、Inh等参数进行成像分析。测定调节性能量耗散Y(NPQ),反映植物光保护能力,测定非调节性能量耗散Y(NO),反映植物光损伤程度。l 程序测量功能:可自动程序测量荧光诱导曲线、快速光曲线和暗弛豫,也可手动测量;在测量过程中能自动分析所有荧光参数的变化趋势;可以预编程进行自定义实验流程,如模拟波动光。l AOI功能:可在测量前或测量后任意选择感兴趣的区域(AOI),程序将自动对选择的AOI的数据进行变化趋势分析,并在报告文件中显示相关AOI的数据。所有报告文件中显示的数据都可导出到EXCEL文件中。l 成像异质性分析功能:对任意参数任意时间的成像,可在图像上任意选取两点,软件自动对两点间的数据进行横向异质性分析,并可导出到EXCEL文件中。l 成像数据范围分析功能:对任意参数任意时间的成像,可分析任意两个荧光数值之间有多少个像素点,多少面积(cm2)。l 突变株筛选功能:可跟据成像结果快速筛选光合、产氢/油、抗逆(抗盐、抗旱、抗病等)等突变株。l 微藻毒理研究功能:可同时测量4块96孔板,即384个微藻样品(对照和处理组)的光合活性,软件自动给出处理组样品相对于对照组的光合抑制百分比。应用领域l 光合作用研究:可以在完全相同的条件下同时对大量样品进行成像l 植物病理学:病斑部位(包括肉眼不可见时)成像以及病斑扩散的时空动力学l 植物胁迫生理学:肉眼不可见生物/非生物胁迫损伤的早期检测l 遗传育种:出苗后大规模快速筛选高光合/抗旱/抗热/抗冻/抗病等植株l 突变株筛选:快速筛选模式植物的光合突变株、抗逆突变株、产氢微藻突变株等l 微藻毒理学:不同毒物浓度多个重复的样品一次测完,软件自动计算抑制比率l 其它多种扩展研究成像参数Fo, Fm, F, Ft, Fm' , Fv/Fm, Y(II), qL, qP, qN, NPQ, Y(NPQ), Y(NO), PS/50=ETR,Inh.等产地:德国WALZ参考文献数据来源:光合作用文献Endnote数据库,原始数据来源:Google Scholar。注:HEXAGON-IMAGING-PAM为最新产品,暂无文献发表,最新研究成果可参考M-IMAGING-PAM发表文章。Salguero-Linares, J., et al. (2022). "Robust transcriptional indicators of immune cell death revealed by spatio-temporal transcriptome analyses." Molecular Plant.Sandoval-Ibáñez, O., et al. (2022). "De-etiolation-induced protein 1 (DEIP1) mediates assembly of the cytochrome b6f complex in Arabidopsis." Nature communications 13(1): 4045.Gao, Y., et al. (2022). "Chloroplast translational regulation uncovers nonessential photosynthesis genes as key players in plant cold acclimation." The Plant Cell.Ma, L., et al. (2022). "SlRBP1 promotes translational efficiency via SleIF4A2 to maintain chloroplast function in tomato." The Plant Cell.Szechynska-Hebda, M., et al. (2022). "Aboveground Plant-to-Plant Electrical Signaling Mediates Network Acquired Acclimation." Plant Cell.Xing, J., et al. (2022). "The plastid-encoded protein Orf2971 is required for protein translocation and chloroplast quality control." The Plant Cell.Dahro, B., et al. (2022). "Two AT-Hook proteins regulate A/NINV7 expression to modulate sucrose catabolism for cold tolerance in Poncirus trifoliata." New Phytologist n/a(n/a).Ivanova, A., et al. (2022). "Mitochondrial activity and biogenesis during resurrection of Haberlea rhodopensis." New Phytologist n/a(n/a).Li, L., et al. (2022). "Genomes shed light on the evolution of Begonia, a mega-diverse genus." New Phytologist n/a(n/a).Moog, M. W., et al. (2022). "The epidermal bladder cell-free mutant of the salt tolerant quinoa challenges our understanding of halophyte crop salinity tolerance." New Phytologist n/a(n/a).Zhang, Y., et al. (2022). "CLE42 delays leaf senescence by antagonizing ethylene pathway in Arabidopsis." New Phytologist n/a(n/a).Ashok, A., et al. (2022). "Food-chain length determines the level of phenanthrene bioaccumulation in corals." Environmental Pollution: 118789.Cai, W., et al. (2022). "CaSWC4 regulates the immunity-thermotolerance tradeoff by recruiting CabZIP63/CaWRKY40 to target genes and activating chromatin in pepper." PLOS Genetics 18(2): e1010023.Castro, P. H., et al. (2022). "SUMO E3 Ligase SIZ1 connects sumoylation and reactive oxygen species homeostasis processes in Arabidopsis." Plant Physiology.Che, L., et al. (2022). "Rubredoxin 1 Is Required for Formation of the Functional Photosystem II Core Complex in Arabidopsis thaliana." Frontiers in Plant Science 13.Chen, Q., et al. (2022). "Strategies of carbon use and photosynthetic performance of the two seaweeds Gracilaria chouae and Gracilariopsis lemaneiformis under different conditions of the carbonate system." Algal Research 64: 102713.Gao, S., et al. (2022). "The growth and photosynthetic responses of white LEDs with supplemental blue light in green onion (Allium fistulosum L.) unveiled by Illumina and single-molecule real-time (SMRT) RNA-sequencing." Environmental and Experimental Botany: 104835.He, J., et al. (2022). "The trans-Golgi-localized protein BICAT3 regulates manganese allocation and matrix polysaccharide biosynthesis." Plant Physiology.Hsieh, W.-Y., et al. (2022). "THIAMIN REQUIRING2 is involved in thiamin diphosphate biosynthesis and homeostasis." The Plant Journal n/a(n/a).Kareem, H. A., et al. (2022). "Nanosized zinc oxide (n-ZnO) particles pretreatment to alfalfa seedlings alleviate heat-induced morpho-physiological and ultrastructural damages." Environmental Pollution 303: 119069.Li, J., et al. (2022). "Melatonin enhances the low-temperature combined low-light tolerance of pepper (Capsicum annuum L.) seedlings by regulating photosynthesis, carotenoid, and hormone metabolism." Environmental and Experimental Botany 199: 104868.Li, T., et al. (2022). "Environmental nitrogen and phosphorus nutrient variability triggers intracellular resource reallocation in Gracilariopsis lemaneiformis (Rhodophyta)." Algal Research 66: 102778.Lin, S., et al. (2022). "Exogenous melatonin improved photosynthetic efficiency of photosystem II by reversible phosphorylation of thylakoid proteins in wheat under osmotic stress." Frontiers in Plant Science 13.Liu, K., et al. (2022). "Melatonin delays leaf senescence and improves cucumber yield by modulating chlorophyll degradation and photoinhibition of PSII and PSI." Environmental and Experimental Botany 200: 104915.Liu, Y., et al. (2022). "Brassinosteroids promote starch synthesis and the implication in low-light stress tolerance in Solanum lycopersicum." Environmental and Experimental Botany 201: 104990.Lu, S., et al. (2022). "VvERF17 mediates chlorophyll degradation by transcriptional activation of chlorophyll catabolic genes in grape berry skin." Environmental and Experimental Botany 193: 104678.Lynch, T., et al. (2022). "ABI5 binding protein2 inhibits ABA responses during germination without ABA-INSENSITIVE5 degradation." Plant Physiology.Lynch, T., et al. (2022). "ABI5 interacting protein2 inhibits ABA responses during germination without ABA-INSENSITIVE5 degradation." Plant Physiology.Okereke, C. N., et al. (2022). "Impact of heat stress of varying severity on papaya (Carica papaya) leaves: major changes in stress volatile signatures, but surprisingly small enhancement of total emissions." Environmental and Experimental Botany: 104777.Om, K., et al. (2022). "Pyruvate, phosphate dikinase regulatory protein impacts light response of C4 photosynthesis in Setaria viridis." Plant Physiology.Pan, X., et al. (2022). "Transcriptional and physiological data revealed cold tolerance in a photo-thermo sensitive genic male sterile line Yu17S." BMC Plant Biology 22(1): 44.Pandey, K., et al. (2022). "Coordinated regulation of photosynthesis and sugar metabolism in guar increases tolerance to drought." Environmental and Experimental Botany 194: 104701.Roach, T., et al. (2022). "Acquisition of desiccation tolerance in Haematococcus pluvialis requires photosynthesis and coincides with lipid and astaxanthin accumulation." Algal Research 64: 102699.Rotasperti, L., et al. (2022). "The barley mutant happy under the sun 1 (hus1): An additional contribution to pale green crops." Environmental and Experimental Botany 196: 104795.Shindo, A., et al. (2022). "Interactive effects of temperature and irradiance including spectral light quality on the photosynthesis of a brown alga Saccharina japonica (Laminariales) from Hokkaido, Japan." Algal Research 66: 102777.Sohail, H., et al. (2022). "Genome-wide identification of plasma-membrane intrinsic proteins in pumpkin and functional characterization of CmoPIP1-4 under salinity stress." Environmental and Experimental Botany: 104995.Song, W., et al. (2022). "Functional characterization and comparison of lycopene epsilon-cyclase genes in Nicotiana tabacum." BMC Plant Biology 22(1): 252.Szádeczky-Kardoss, I., et al. (2022). "Elongation factor TFIIS is essential for heat stress adaptation in plants." Nucleic Acids Research.Trainin, T., et al. (2022). "Physiological characterization of the wild almond Prunus arabica stem photosynthetic capability." Frontiers in Plant Science 13.Xue, S., et al. (2022). "Effects of enhanced UV-B radiation on photosynthetic performance and non-photochemical quenching process of intertidal red macroalgae Neoporphyra haitanensis." Environmental and Experimental Botany: 104888.Yang, L., et al. (2022). "Salt interferences to metabolite accumulation, flavonoid biosynthesis and photosynthetic activity in Tetrastigma hemsleyanum." Environmental and Experimental Botany 194: 104765.Yang, L., et al. (2022). "Physiological Mechanism of Exogenous 5-Aminolevulinic Acid Improved the Tolerance of Chinese Cabbage (Brassica pekinensis L.) to Cadmium Stress." Frontiers in Plant Science 13.Zhang, J., et al. (2022). "Early evaluation of adjuvant effects on topramezone efficacy under different temperature conditions using chlorophyll fluorescence tests." Frontiers in Plant Science 13.Zhou, X., et al. (2022). "Physiological mechanism of strigolactone enhancing tolerance to low light stress in cucumber seedlings." BMC Plant Biology 22(1): 30.Zhu, S., et al. (2022). "Cold stress tolerance of the intertidal red alga Neoporphyra haitanensis." BMC Plant Biology 22(1): 114.
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转4949
400-860-5168转4949
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转4662
400-860-5168转4662
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-801-3156
400-801-3156
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1218
400-860-5168转1218
 留言咨询
留言咨询

 400-860-5168转4662
400-860-5168转4662
 留言咨询
留言咨询
 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询
 400-680-0997
400-680-0997
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 留言咨询
留言咨询

 400-680-0997
400-680-0997
 留言咨询
留言咨询
 400-680-0997
400-680-0997
 留言咨询
留言咨询

 400-680-0997
400-680-0997
 留言咨询
留言咨询

 400-860-5168转0751
400-860-5168转0751
 留言咨询
留言咨询

 留言咨询
留言咨询

 400-860-5168转1218
400-860-5168转1218
 留言咨询
留言咨询