一种先进的用于高细胞浓度灌流培养的声学截留系统-BioSep
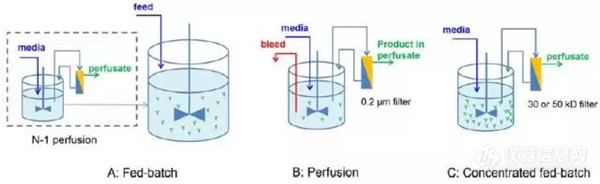
概述哺乳动物细胞培养对于生物技术行业的蛋白质生产具有重要意义[1]。制药行业中约70%的重组蛋白是使用中国仓鼠卵巢细胞(CHO)生产的。在灌流培养中,营养物质持续供应并去除副产物[2]。与批培养和流加补料技术相比,灌流为细胞提供了有利的环境和较短的产品停留时间。这对于不稳定产品的质量尤为重要。灌流模式的另一个优点是它允许使用较小的生物反应器并减少在位清洗操作[3]。灌流需要一种装置将细胞保留在培养基中。灌流中使用的大多数哺乳动物细胞保留系统都基于细胞尺寸差异,例如使用滤器。然而,由于滤器不可避免的污染,传统的过滤膜无法实现真正的稳态灌流培养。此外,频繁更换过滤器会增加成本和污染风险[4]。声学分离器是一种替代的细胞截留系统,利用超声波驻波场中产生的力将细胞与清液分离。细胞被困在驻波的压力平面中,并收集为松散的聚集体。这些细胞聚集体通过重力沉降返回生物反应器[4]。 在本研究中,使用了一种针对高密度细胞培养物灌流的Applikon Biosep 10 L声学细胞分离器的高级版本。生物反应器中,细胞密度在11~144*106 cells/mL之间的CHO细胞评估其性能。材料和方法01细胞声学截留装置 – BioSep BioSep 系统由声学腔室和控制器组成。 控制器功能是自动产生声学腔室内的声场。 来自生物反应器的细胞悬液被泵输入到安装在生物反应器头板上的声学腔室中。 驻波迫使悬浮细胞进入平面,在那里它们形成松散的聚集体(图 1)。 清液向上通过声场而收获,而浓缩的细胞则返回到生物反应器。 随着细胞浓度和灌流速率的增加,声学腔室的功率输入被调整到更高水平,以保持高分离效率[5]。 运行时间对应于细胞与清液分离的时间段。在运行时间结束时,声场暂时关闭,收获暂停,同时腔室中的细胞返回生物反应器。 在这项研究中,功率水平和运行时间发生了变化,以获得最佳设置,使高密度CHO 细胞培养超过 125* 106 cells/mL。02实验装置 为了评估在一系列高细胞浓度下的分离性能,将CHO 细胞在摇瓶中培养,浓缩、然后悬浮在使用my-Control 操作系统的Applikon 250 mL MiniBio 生物反应器中。 BioSep 10 L的功率水平为2~7W。 实验设置如图2所示。2丨A) 实验装置包括:进料罐、废液罐、收获泵、进料泵、声学室、MiniBio 250 mL、my-ControlB)典型的实验装置[5]3 | 分析方法&bull BioSep 的分离效率根据公式 1 计算:SE (%) = 1 - HX / BX *100 [1] 其中HX对应于收获管路的活细胞浓度,BX对应于生物反应器中的活细胞浓度[4]。为确保稳定和可重复的声学条件,在从收获管路和生物反应器取样之前,超声波功率输入、收获速率和运行/反冲洗定时器设置至少恒定 30 分钟。根据所选运行周期的持续时间,在时间点采集收获样本,以获得一致且可比较的数据(表1)。结果和讨论1| 循环流速 在高细胞密度的灌流培养过程中,需要高循环速率,这会导致声学室内的湍流增加。 这种湍流诱导会影响声学诱导的细胞聚集[6]。 在目前的研究中观察到新的BioSep版本允许声学诱导的细胞聚集体不受干扰地沉降,最大流入速率高达7 mL/min(~10 L/天),允许保留超过100*106cells/mL的生物反应器浓度。2| 分离性能 从收获管路和生物反应器中采集的70对样品中测定分离效率。 CHO细胞总浓度范围为11~144*106 cells/mL。 研究了1~15L/天的不同净收获率、2~7 W的功率水平和2至10分钟的运行时间(未显示值),结果总结在图3中。 从图3中可以看出,当CHO细胞总浓度为100*106cells/mL时,可以实现高达3L/天的净收获率,同时保持98%的典型活细胞分离效率。超过4L/天的净收获率会影响最高密度下的效率,但分离仍保留了90%以上的细胞。 在总浓度为125*106 cells/mL时,以2L/天的净收获率运行,细胞分离效率达到98%。 在细胞浓度增加或收获率高的情况下,使用高功率水平和更短的运行周期是必要的[5]。 优化功率(w)和运行时间(min)的配对,以实现高密度细胞。这些值的组合使得最高的分离效率是:2 w - 10 min 3 W - 5 min 5 W - 3 min 7 W - 2 min。这些结果是意料之中的,因为更高的功率水平允许在高浓度或高流量条件下增加细胞的保留,而更短的运行时间避免了细胞聚集体在声室中过度积聚,然后才有机会沉降回到生物反应器。Figure 3 分离效率以黑色方块表示,作为记录的流入管线的净收获率和CHO细胞总浓度的函数。功率水平矩阵表示在该特定净收获率下应用的最大HF功率。黄色虚线表示循环速率20L/天和10L/天之间的边界。实验结论目前的研究证明了Biosep作为CHO细胞浓度高达125*106cells/mL的细胞保留系统,增强了细胞的沉降效率。在该细胞浓度下,以2 L/天的净收获率下运行,分离效率高达98%。参考文献[1]S. M. Woodside, B. D. Bowen, and J. M. Piret, “Mammalian cell retention devices for stirred perfusion bioreactors,” Cytotechnology, vol. 28, pp. 163–175, 1998.[2]T. Kwon, N. Madziva, J. D. Oliveira, S. K. Chandramohan, L. Yin, H. Prentice, J. Han, ‘Long-term steady state perfusion culture of mammalian cells using a robust microfluidic cell retention device”. 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences, 2015.[3]M. F. Clincke, C. lleryd, Y. Zhang, E. Lindskog, K. Walsh, and V. Chotteau, “Very high density of CHO cells in perfusion by ATF or TFF in WAVE bioreactor. Part I: Effect of the cell density on the process,” Biotechnol. Prog., 2013.[4]V. M. Gorenflo, J. B. Ritter, D. S. Aeschliman, H. Drouin, B. D. Bowen, and J. M. Piret, “Characterization and optimization of acoustic filter performance by experimental design methodology,” Biotechnol. Bioeng., 2005.[5]Biosep manual 10 and 50 L per day, Applikon Biotechnology.[6]I. Z. Shirgaonkar, S. Lanthier & A. Kamen, Acoustic cell filter: A proven cell retention technology for perfusion of animal cell cultures. Biotechnology Advances, 22(6), 433–444, 2004.