核酸蛋白检测仪是层析分析的主要装置,核酸蛋白检测仪配上层析柱、恒流泵、部分收集器、层析谱分析系统(根据需要选配)和电脑打印设备即构成一套完整的核酸蛋白检测仪分离层析系统。它是当今从事生命科学研究、药物测定、化工、食品科学及医学研究等行业的现代分析实验仪器。核酸蛋白检测仪分析系统广泛用于工业、农业、科研和大专院校的科学研究和教学实验。其原理是根据物质(样品)对紫外光有明显吸收的特征,实现对样品成份含量比对分析,以便进行样品蛋白、核酸物质识别检测和含量测定。在生化分析、环保科学、食品研究、毒理研究、新药开发等领域中对核酸、蛋白检测、纯化和提取提供了一种独特的分析手段。
ZHD型紫外蛋白核酸检测仪使用说明 一、系统简介 蛋白核酸检测仪是层析分析的主要装置,配上层析柱、恒流泵、部分收集器(根据需要选配)和电脑打印设备即构成一套完整的液相色谱分离系统。它是当今从事生命科学研究、药物测定、化工、食品科学及医学研究等行业的现代分析实验仪器。广泛用于工业、农业、科研和大专院校的科学研究和教学实验。其原理是根据物质(样品)对紫外光有明显吸收的特征,实现对样品成份含量比对分析,以便进行样品蛋白、核酸物质识别检测和含量测定。然而,目前国内生产的蛋白检测仪虽然种类繁多,但均采用记录仪描谱且预热时间较长。 ZHD型紫外蛋白核酸检测仪的研制成功,为科研和实验人员利用电脑系统实现核酸蛋白检测和分析提供了一种先进的手段,其特点是系统稳定、操作简便、电脑显示谱图、数据分析和打印谱图。 二、系统特点 本系列检测仪有别于其他检测仪,主要有以下特点: 1、预热时间短,一般做实验只要预热10分钟左右。 2、稳定性高,预热后每小时漂移一般小于0.001。 3、操作简洁,开机后仪器自动调整透光率(T)到100%,吸光度(A)调整到0.000。 4、透光率(T)和吸光度(A)对应准确,点两者误差小于1%。 5、双数据显示,仪器适时显示吸光度(A)和透光率(T)。 6、仪器带有电脑接口和记录仪接口(吸光度0—200mv)。 7、工作软件提供谱图采集、分析计算、保存、打印等功能,可将谱图插入文档(word)文件中。 8、一台电脑可配多台检测仪(由电脑有效端口数决定)。 三、 技术性能 1、通过测量选择菜单,在电脑屏幕上可描出吸光度(A)谱图,透过率(T%)谱图以及A-T%谱图。 2、通过图形平移、复读伸缩和压缩选择等菜单,可对谱图并进行幅度、宽度调整和谱图参数计算,预览满意后打印输出。 3、在描谱过程中,电脑会自动将图形左移(也可人工调整),电脑描谱最长时间为20小时。 4、采集数据自动保存。 四、主要参数: 1、波长:254nm,280nm(可根据用户需要调配)。 2、样品池100ul,光程3mm。 3、量程:吸光度(A):0--2.000 透光率(T):1%—100%。 4、分辩率:吸光度(A):0.001 透光率(T):0.1%。 5、电脑分析参数:峰高、峰宽、峰面积、峰面积比、保留时间、面积含量(归一化)、层析柱分辩率等。 6、电源220V±10%,50HZ。 7、主机重量:约3.5Kg。 五、系统安装与操作步骤 1、将仪器背板上的输出端通过一根串行口连接电缆与电脑主机的COM1或COM2串行口相连。 2、打开紫外蛋白核酸检测仪电源,仪器预热10分钟左右。 3、打开电脑后,将应用软件(ZHD.exe)复制到硬盘上。钦一下仪器面板上的复位按钮,待仪器显示0.000A和100%T后,双击ZHD.exe启动应用软件,系统进入采集(分析)状态。 4、在“测量选择”菜单下,用鼠标选择检测项目。 5、在“检测操作”菜单下点击“测量开始”,电脑开始采集。 6、要停止采集,点击“检测操作”下的“测量结束”菜单,然后关闭紫外蛋白酸检检测仪。 六、层析普工作站软件使用 1、 对硬件的基本要求: a、电脑在简体中文Windowsxp操作系统上运行; b、显示器分辩率为1024*768,小字体,256色配置; c、图形打印机; d、电脑系统必须正常工作,并保证串行口(COM2或COM1)有效; 2、系统连接无误后先让检测仪工作,再执行应用软件ZHD.exe; 3、 点击文件操作菜单下的“打开谱图”,出现文件操作对话框,打开随机盘上的数据文件(.ran),图形被打开,熟悉菜单操作。菜单介绍如下: a、“文件操作”菜单下有打开谱图、保存谱图、打印谱图、打印预览等; b、“检测操作”菜单下有测量开始、测量结束(测量结束后,系统在应用程序目录下生成“文件名.TXT”文件,此格式文件可在Excel软件中打开,并可转贴到Word文档中使用); c、“灵敏度选择”菜单下有A、T%、A-T%选项; d、“谱图平移”菜单后有向左慢移动 []和向右快移动[]; e、“谱图重绘”菜单:从起始点描谱;清理屏幕;释放压缩; f、“谱图全貌”菜单:在屏幕上观察全部谱图。 g、“参数选择”菜单:可对谱图进行参数分析计算。方法如下:在吸光度状态下,点击鼠标左键选取基线及时间范围(第一次点击选取第一点,第二次点击选取第二点),点击“选择参数”下拉菜单的峰高、标准差、半峰宽、峰底宽、峰面积、峰面积比、面积含量及保留时间等参数进行计算,还可间接计算出层析柱分辨率;双击鼠标左键,即可取消本次计算。 h、在吸光度(A)或透光率(T%)状态下,单击鼠标右键,屏幕显示该鼠标点的数值;双击鼠标右健,擦除屏幕显示数值。 七、注意事项: a、 更改波长方法:打开样品池挡板后,可见到滤光片的燕尾型支架和印字(245或280代表当前所使用的波长),用手将其轻轻抽出,换向后插入原位,再将样品池挡板装上,拧紧固定螺钉即可。 b、 在检测仪和电脑正常工作后才能运行应用软件; c、 应用软件执行后,十秒钟后不出现采集分析界面,说明电脑未收到数据,需检查系统连接是否正常; d、 在A—T%描谱过程中,开始1小时内,T%谱以实蓝线表示;1小时后(或点击“图形重绘” ),已描过的T%谱会以虚蓝线表示; e、 测量开始后(特别是出峰以后)不要按复位按钮。 f、 要停止采集,请点击“测量结束”后,先点击“EXIT”,再关闭检测仪。 g、 开始测量时,屏幕会弹出保存文件对话框,要求输入数据文件名及存放路径;之后,电脑自动保存数据。 I、基线选取要保证基线与所选峰必须要有两个焦点,并与其他峰无焦点。
我们实验室用的是上海嘉鹏科技有限公司生产的的核算蛋白检测仪,型号为HD-2000,现在急需该仪器的说明书
国外的核酸蛋白检测仪比较起来哪个厂家的比较好,给推荐几个,价位
国外的核酸蛋白检测仪比较起来哪个厂家的比较好,给推荐几个,价位又是什么样的,谢谢
我现在在做蛋白和核酸的结合.我的蛋白和核酸可以结合. 蛋白是400多KDa的 核酸很小, 是30bp的dsDNA. 我现在的检测条件下只跑蛋白是可以跑出来的, 当我蛋白和核酸一起跑的时候, 也会在跟只跑蛋白在差不多的位置出峰. (我用的双波长检测,蛋白和核酸分别标记,所以都能看到.)问题就是,一起跑的时候, 出的所有峰, 都是既有蛋白又有核酸, 不管我加的比例是多少.我就很困惑. 如果我加的核酸量很小的话,不是应该有很多游离的蛋白吗,就是说应该有的蛋白峰对应的地方是没有核酸出峰才对的啊, 为什么没有这样的峰呢, 我什么地方理解错了吗?~ 请大家帮忙.谢谢~~~~!BTW, 我用的是bare fused silica capillary, 是CZE, 不是凝胶的 谢谢~~~
随着常规分子生物学研究的深入,越来越多的生物实验室日常需要测量的核酸、蛋白样品量也在不断地加大。传统的分光光度计虽然已经非常普及,但由于需要在测量后清洗比色杯,实际上消耗了不少宝贵的研究时间。同时,由于核酸样品的体积较小,即使使用昂贵的微量石英比色杯(容积数十ul左右),也往往需要对原始样品进行稀释,从而带来可能的操作偏差。对于一些稀有的样品来说,稀释即意味着测量后无法回收,同样也会对后续研究带来更高成本。因此,无需比色杯,仅需数ul即可测定样品浓度的超微量分光光度计现在受到很多实验室的关注和欢迎。NanoVue是GE Healthcare公司于2008年最新推出超微量分光光度计。GE Healthcare公司的分光光度计品牌Ultrospec和GeneQuant在市场上已经有了十多年的历史,在用户中有着很好的信誉和口碑。NanoVue在该系列仪器的基础上延续了出众的检测性能,同时大大改进了检测的光路设计,通过专利的检测技术使检测样品的体积最小仅需0.5ul, 190-1100nm的宽范围连续波长设计较市场上同类仪器宽了一倍左右,使得能够轻松检测核酸、蛋白样品和Cydye荧光染料标记物的浓度。仪器内置了RNA、DNA 和寡核苷酸浓度和纯度测定方法;寡核苷酸转换因子,分子量,理论Tm计算功能;包括一般紫外、Bradford、 Biuret、BCA、Lowry的蛋白定量法;以及波长扫描,动力学,标准曲线,多波长测定等扩展功能。除了强大的检测性能外,NanoVue还在许多操作性能上进行了精心的设计,能够给用户带来众多全新的体验,主要包括以下方面:1 唯一不需电脑就能在仪器面板上直接检测的超微量分光光度计。仪器配置了一块大面积高分辨率的背光液晶屏和操作面板。相对于点样后转去电脑控制,再回去仪器清洁的过程,NanoVue不仅节省了购买电脑的支出,同时点样,按键测量,擦拭一气呵成。可以通过整合的打印机直接打印分析数据。当然,如果需要在电脑上保存分析数据,NanoVue同样支持USB或蓝牙连接电脑,将珍贵的实验数据永久记录下来。2 通过特别设计的疏水点样表面,能够很容易回收稀有的样品,并且有效避免多个测量间的样品交叉污染,提高测量的准确性。NanoVue的点样表面具有专利设计,表面坚固而且光滑。不管是样品回收还是测量完直接擦去都非常简易,不会有任何样品粘附残留在点样面上。而且点样面耐用性也非常出众,保守估计可以至少测量20000个样品以上。3 最快的检测速度。NanoVue通过独特的光路设计,使得所有样品的检测都能够在5秒钟之内完成,把微量分光光度计的测量时间提升到了一个新的高度。而且NanoVue具备即开即用功能,避免了许多分光光度计开机需要预热的麻烦,真正做到省时省力。由此可见,NanoVue不仅性能出众,其易用性和灵活性也是目前超微量分光光度计中出类拔萃的。通过试用NanoVue的体验,使用者可以完全感受到,原来,核酸蛋白的测定可以这么简单,这么快速!目前,NanoVue已经正式在中国推出,欲了解更多的信息,请直接联系GE公司。
欲购买凝胶成像系统、核酸蛋白仪全自动定氮仪,请各位使用者及代理商广泛给予建议,谢谢!
求购核酸蛋白仪,
检测和分离脂多糖中的 [font=宋体]脂阿拉伯甘露糖([/font][font='Times New Roman']LAM[/font][font=宋体])和脂甘露糖([/font][font='Times New Roman']LM[/font][font=宋体])这二种糖在紫外检测器有吸收吗?且一般选什么柱子?检测蛋白一般用什么柱子和检测器?[/font]
[font=微软雅黑][color=#444444]实验步骤如下:[/color][/font][font=微软雅黑][color=#444444]变性,还原、烷基化、加入内标肽,酶解后固相萃取,干燥复溶,最后LC-ESI-MS/MS检测特征肽和内标肽,碰撞能和流动相都优化后,纯蛋白响应值很高。[/color][/font][font=微软雅黑][color=#444444]之后开始做血清标本,比处理蛋白多了一步去除高丰度蛋白步骤,也是严格按照试剂盒步骤做的,然而检测响应值只有500~1000。[/color][/font][font=微软雅黑][color=#444444]血清中是有目标蛋白的,因为质谱检测前已经在自动生化分析仪上面检测到靶蛋白浓度大约有20ug/ml。[/color][/font][font=微软雅黑][color=#444444]PS:质谱仪是AB SCIEX 5500QTRAP,以前师姐用上述的方法是可以在仪器上做出10000多的响应值,是不是说明方法建立这块没什么大问题。目前仪器坏了,借用了别处的仪器,型号和厂家也是相同的,响应值却很低[/color][/font][font=微软雅黑][color=#444444]求问各位大佬血清中检测不出是什么原因,万分感谢![/color][/font][font=微软雅黑][color=#444444][/color][/font]
求助:有什么仪器可以检测啤酒检测啤酒敏感蛋白和敏感多酚的仪器?
我想检测兔子全血的血红蛋白,不知道那个公司有这方面的试剂盒?如果我用血红蛋白计测量,xk-2血红蛋白计怎么样啊?还有就是全血的血红蛋白和血浆的血红蛋白的差别到底在哪啊?请各位老师指教!!
用核酸和蛋白样品测定NMR时,一般浓度多少比较合适?
你好,能不能请教个问题。我是做进口胶原蛋白的商家,当时我们在选择这个原料的时候,一个朋友去过检测,具体内容是这样的,他有个朋友赵医生在澳大利亚行医,赵医生的妹妹得了癌症,回国照顾妹妹,带回来了一台仪器,日本产的,在上海有卖的,我们收集了很多种胶原蛋白原料,请赵医生帮忙检测,我的朋友检测后跟我说,赵医生拔了自己的一根头发,然后检测了不同的胶原蛋白原料,得出结果是,有的吸收度(可能表达不准确)是8,有的 22,有的 56,而我们的是 366,非常好,还说,我们说人体一天需要4克不对,检测下来她需要8克。后来赵医生回澳大利亚,联系不上。我想请教的是,您知道这个仪器是什么仪器吗?据说可以做地质检测。还有如果我们还想检测原料。您可以做到赵医生哪样的检测吗?请加我 QQ4567466,或者打我电话13319788283,必有重谢!
请教下各位在检测大豆分离蛋白的可溶性蛋白含量,测定其溶解性和测定其氮溶指数的目的有什么区别?
牛奶蛋白质分析仪可以用于检测乳蛋白制品。以下是详细解释和相关信息: 功能与应用:牛奶蛋白质分析仪是一种专门用于分析牛奶及其制品中蛋白质含量的仪器。它基于先进的生化分析技术,如比色法、光谱法或电化学法等,能够准确、快速地检测样品中的蛋白质含量。 乳蛋白制品的检测:乳蛋白制品,如奶粉、酸奶、奶酪等,其蛋白质含量是产品质量和营养价值的重要指标。牛奶蛋白质分析仪可以有效地检测这些乳蛋白制品中的蛋白质含量,为生产厂家提供准确的质量控制手段。 优点与特点: 准确性高:牛奶蛋白质分析仪具有高灵敏度和高准确性,能够确保测量结果的可靠性。 快速便捷:该仪器操作简单,使用方便,可以快速得出测量结果,提高检测效率。 适用范围广:除了牛奶及其制品外,还可以用于其他含蛋白质样品的检测,如豆类制品、肉制品等。 在乳品工业中的重要性:随着乳品市场的不断扩大和消费者对乳制品质量要求的提高,牛奶蛋白质分析仪在乳品工业中的重要性日益凸显。它可以帮助乳品企业提高产品质量、降低生产成本,同时为消费者提供更加安全、健康的乳制品。 综上所述,牛奶蛋白质分析仪是一种功能强大、应用广泛的检测仪器,完全可以用于检测乳蛋白制品中的蛋白质含量。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/05/202405271615421543_8284_6238082_3.jpg!w690x690.jpg[/img]
对于乳制品中蛋白质及非蛋白氮的检测方法,国家在2008年发布了GB/T 21704-2008《乳与乳制品中非蛋白氮含量的测定》和NY/T1678-2008《乳与乳制品中蛋白质的测定 双缩脲比色法》,但GB/T 21704-2008是采用滴定的方法,NY/T1678-2008是双缩脲比色法,检测时间比较长,均无法实现乳制品中蛋白及非蛋白氮的快速检测,造成在鲜奶收购中检测速度慢,运奶车等待时间比较长的现象,是否有一种方法或仪器可快速定量的检测上述物质呢,最好分析时间控制在15分钟以内。
原理:C-反应蛋白(C-Reactive protein,简称CRP).早于1930年发现,是一种能与肺炎球菌C多糖体反应形成复合物的急性时相反应蛋白.CRP的检测在八十年代以前作为炎症和组织损伤的非特异性标志物大量应用于临床.问题:由于过去CRP的检测方法较为落后,假阳性和假阴性很高,影响了它在临床上的价值,而逐渐被临床所忽视. 前景:解决假性,前途无量!
真蛋白如何检测?
各位网友,在下想征集真蛋白的检测技术。80年代,曾有2种蛋白检测技术的诞生(可能不止两种,请大家集思广益),一种是凯氏定氮法,一种是杜马斯燃烧法。目前我们用的最多的是凯氏定氮法。 大家都知道,这两种方法都是以氮元素的量乘以相应的系数,得出蛋白的含量,是粗蛋白的含量。2008年的三鹿奶粉事件,就是因为不能检测真蛋白而发生的。 现在小弟在这个帖子中,征集各位大侠的检测方案。要求: 原理: 使用仪器: 检一个样的时长: 注意:每发一种新的检测帖,奖励30分,与楼上重复的不得分。各位先到先得了!http://simg.instrument.com.cn/bbs/images/default/em09502.gif==============================================非常感谢:hhciq对本帖的大力支持!送http://simg.instrument.com.cn/bbs/images/brow/em23.gifhttp://simg.instrument.com.cn/bbs/images/brow/em23.gifhttp://simg.instrument.com.cn/bbs/images/brow/em23.gifhttp://simg.instrument.com.cn/bbs/images/brow/em23.gifhttp://simg.instrument.com.cn/bbs/images/brow/em23.gifhttp://simg.instrument.com.cn/bbs/images/brow/em23.gif,感谢xujing0202520的补充。现将hhciq及xujing0202520的回帖整理如下:请hhciq把把关,看有没有什么重复的。1、采用化学发光方法, 结合有效氮吸收装置,测定饲料中的粗蛋白质。静态注射化学发光法选用2.0×10-4mol/L的Luminol溶液,用量为2.00ml,待测液的用量为2.00ml。静态注射化学发光法简化了测试方法,缩短了时间,加标回收率为86.91%~104.60%,RSD5%(n=5),适用于饲料生产部门的质量控制。 2、反相高效液相色谱法 反相高效液相色谱法通常采用低离子强度酸性有机冲洗液和烷基硅胶键合固定相, 影响分离的因素主要有流动相组成、洗脱湿度、洗脱液p H值、离子对试剂和流速等; 有利于分离的条件是低 p H值、流动相、室温或较高的温度及使用乙腈或异丙醇作为有 机部分,三氟乙酸 ( T F A)对于蛋白质及气相色谱公认是一种较好的流动相添加剂。 蛋白质的保留性质和选择性还与键合固定相的性质有关, 采用大孔硅胶和短链烷基 键合固定相在蛋白质分离中具有优势。3、正交轴逆流色谱法是新近发展起来的一种方法。 具体是:以n l ( 质量分数为 1 2 . 5 % 的P E G 8 0 o 0 ) :n l( 质量分数为2 5 %的磷酸氢二钾)=1 :1 或i n( 质量分数为 1 2 . 5 %的 P E G 8 0 0 0 ) : m ( 质量分数为3 0 % 磷酸氢二钾) =1 :1 为溶剂系统,以下相作流动相,上相 作固定相,操作时采用5 0 0 r / m i n的转速和6 0 0 ml / h的流动相流速。该方法在分离度不大 的基础上提高了进样量,适用于分离天然生物大分子。4、微乳液毛细管电动色谱分离法 ( ME E K c) 微乳液毛细管电动色谱分离法是在胶束电动色谱 ( ME K c)基础上发展起来的,在E K C中,分离载体为离子胶束,它由表面活性剂组成,不同的表面活性剂构成不同的胶束,因而具有不同选择性,若以水包油微乳液作为分离载体,则称之为ME E K C法, 该法是一种新型的分离技术,目前多用于小分子中性物质的分离。5、毛细管电泳法 电泳一直是研究蛋白质的重要方法。毛细管电泳除了具备凝胶电泳的高分辨力以 外,以其快速、定量、重复性好。灵敏度高及自动化程度高等诸多优点在近几年内成为 蛋白质分离分析一项崭新且重要的技术。 其分离机理是根据被分离物质的泳动率不同而 将其分开,毛细管电泳仪就是基于这个原理而设计的自动化分离分析样品的仪器,由于 毛细管电泳刚兴起,目前主要应用的模式仍是自由溶液毛细管电泳,虽然此法具备多项 优点,但仍有不足之处。首先它不能用于制备分离,再者当样品较稀时不能象H P L C那 样进样较多体积,使样品吸附在柱上,然后洗脱下来。 6、毛细管导电聚焦法 ( C mF ) C l E F法可用于分离等电点 ( P I )相差0 . 1 2 p H单位的蛋白质,其基本步骤是:先在 毛细管内对蛋白质进行等电聚焦,然后对分离的蛋白质区带进行检测,按照迁移技术的 不同,分离方法可分为两步法、一步法、固定区带法。C l E F分离蛋白质应先解决基本 问题:消除或减少电渗的涂层方法、检测方法和条件,蛋白质区带的迁移及 P I测定方法,影响C I E F分离效能的因素,两性电解质的组成和浓度、毛细管长度、聚焦电压等。 7、反胶团萃取法 反胶团萃取分离蛋白质是一种新型的有发展前途的生物产品的分离技术。 它是利用 表面活性剂在有机溶剂中形成反向胶团,从而实施了对蛋白质的有效萃取,是表面活性 剂在生物工程中的一种成功应用。8、累加进样分离法 它是指导蛋白质在梯度开始后的一段时间内可以多次重复进样而其保留值无可觉 察的变化的方法。实验证明:在洗脱液远离突跃点时,蛋白质可以多次重复进样而其保 留值与常规分离无明显的变化。 这种累加进样分离法在蛋白质的制各纯化中有重要的应 用价值,它可以提高有效柱容器,节省大量时间和消耗,在一次色谱分离中完成聚集和 分离两步操作,可用分析型仪器制各数量较大的样品。9、凯氏( K j e l d a h 1 ) 定氮法 将被测试的样品与浓硫酸在硫酸铜和硫酸钾存在下共热消化, 含氮有机物即分解产生氨、二氧化碳和水, 氨与硫酸反应变成硫酸铵。消化后向消化液中加入强碱碱化使之分解放出氨,用水蒸气将氨蒸至硼酸液中, 用标准强酸溶液滴定收集氨的硼酸溶液, 即可计算出样品的氮含量, 从而折算出样品的蛋白质含量( 通常由含氮量乘以系数 6 . 2 5计算出( 该系数为蛋白质平均含氮量的倒数) , 乳制品通过乘以系数 6 . 3 8计算出( 该系数为乳制品中蛋白质含氮量的倒 数) ) 。这种方法是K j e l d a h l 在 1 8 8 3年发明的, 当时他只使用硫酸分解试样, 测定谷物中的蛋白含量, 需要较长的反应时间。后来 G u n n i n g 搞清楚了消化机理, 在消化时加入 K s O 使反应温度由原来的3 8 0 ~ C( 硫酸沸点) 上升到4 0 0 ~ C, 并加入硫酸铜为催化剂, 提高了消化速度, 改进了凯氏定氮法。该方法的缺点是耗时长, 灵敏度低, 样品中的含氮化合物会影响蛋白含量的测定。要想准确测定出蛋白含量, 可以先测定出总含氮量。再用三氯乙酸将样品溶液中的蛋白沉淀除去, 然后测定溶液的非蛋白含氮量, 最后从总含氮量中扣除非蛋白含氮量就可以比较准确地测定出样品的真正蛋白含量。10、
请教各位:有没有办法把植物中的一步把蛋白降为氨基酸,淀粉降为葡萄糖,核酸降为核苷酸,油脂降为脂肪酸?也不一定要一步,就是所有的组分要尽量少损失。有高手知道吗?
[摘要] 质谱对于现代蛋白质化学研究是一项重要的技术。也可用于蛋白组分析,在同一时间监控上千种蛋白的表达情况。首先蛋白质混合物可以用双向凝胶电泳分开,再用质谱及随后的蛋白质数据库检索对单个蛋白进行鉴定和分析。最近几年,质谱领域取得了令人鼓舞的进展,使得全自动、高通量的蛋白检测成为可能。质谱也可以用来分析蛋白的转录后调节以及研究蛋白质复合体。本文将介绍目前蛋白组研究中质谱方法的应用并对其优缺点进行讨论。关键词: 质谱;二维电泳(2-DE);蛋白组分析MALDI-TOF1 前 言蛋白组学是研究生物特定组织或细胞内表达的所有蛋白质成分,蛋白质组的一门学科。蛋白组分析一般是用双向凝胶电泳(2-DE),质谱(MS)以及数据检索来完成。2-DE要回顾到20世纪70年代初[1],但是用质谱技术对蛋白质进行鉴定和分析是在近十年内才成为可能。其中最重要的一个原因是新的软离子技术即基质辅助激光解析电离(MALDI)[2]和电喷雾电离(ESI)[3,4]技术的发展和应用,以及样本制备技术和质谱仪的发展等。从数据库中获得成指数上升的序列信息也促进了质谱技术的发展。跟转录组学中的全自动DNA微阵列技术相比,蛋白组分析需要更多的手工操作,尤其在2-DE上会出现很多问题[5,6]。尽管存在很多困难,蛋白组学的重要性还是公认的。DNA微阵列技术是建立在对mRNA稳定水平的检测上,然而蛋白组学研究的对象是细胞中最活跃的因子——蛋白质。最近有研究证明,mRNA的表达和蛋白的水平并非具有相关性[7,8]。蛋白质有转录后修饰过程,并会以不同的形式出现。而这些修饰过程是相应的DNA测序技术所不能预测的。质谱技术在蛋白质修饰分析过程中具有重要的作用。2 质谱对蛋白质的检测质谱仪是由离子源,质量分析,离子检测器,以及数据检索等单元组成。首先,被分析的分子在离子源中被离子化,然后在质量分析器里根据不同的质荷比分开,再对分开的离子进行检测。随着MALDI和EIS的出现,质谱技术已经广泛用来分析蛋白质。质量分析器有很多种,最常用的方法是将飞行时间检测器(TOF)与MALDI或三级四级串联质谱仪联用,或者将四级杆-TOF,离子阱等连接到ESI上。蛋白组分析中,可以用两种不同的方法检测电泳分离后的单个蛋白质。最简单的方法叫做肽指纹谱测定(PMF)[9~13]。这个方法是用特殊的酶对2-DE分离后的蛋白质点进行降解,产生的肽从凝胶中分离出来后再用质谱分析和检测肽的分子量。数据库检测能够产生所有蛋白质理论上的PMF,把它们和质谱分析所获得的肽片进行比较就可以得出结果。第二种方法是在质谱仪中把凝胶分离后的肽分解成片段,产生局部的氨基酸序列(序列标签)。那么就可以用分子量或者序列信息进行数据库检索[14,15]。PMF一般用MALDI-TOF来实现,序列标签可以用串联质谱技术MS-MS进行检测[16~18]。用质谱检测蛋白的灵敏性可以精确到飞摩的水平,甚至已有报道其精确度可以达到阿摩水平[19]。3 用MALDI-TOF进行肽指纹谱分析凝胶分离后的蛋白质鉴定以及肽指纹谱分析是目前质谱实验室常规使用的方法。在进行MALDI分析之前需要最优化的凝胶上消化[20~22]和脱盐过程。胰岛素是最常用的凝胶消化酶,因为它在赖氨酸和精氨酸位点能够特异性切割蛋白质,产生分子量在600~2500Da之间的小分子肽,并能够从凝胶上有效的分离出来。MALDI-TOF是质谱技术中相对简单并很容易使用的一种方式,对样本中的盐和其他污染物有很高的耐受性,这点优于ESI。提取的肽片混合物中较小的片段可以直接沉积在靶板上做PMF分析,剩下的样本可以储存起来作为以后的ESI-MS分析。如果经凝胶分离后所有的肽全用来做MALDI分析,那么样本经脱盐以后将会取得更好的结果。脱盐的过程可以用商品化的试剂盒ZipTip(Millipore),或者在凝胶电泳仪的末端放置一个小的逆向塑料柱来实现[23,24]。PMF中非常重要的一个因素就是质谱测量分子量的准确度[25]。现代的MALDI-TOF仪都具有延迟取样反射器装置,用它们检测的肽段分子量可以精确到10~30ppm。这样的精确度使得4~5个肽段足以清楚的鉴定蛋白质的分子量。MALDI产生的大多数都是单电荷离子,所以它的图谱很容易解释。4 肽质指纹谱分析的自动化为了实现高通量蛋白检测,样本准备,质谱检测,资料分析和数据检索必须实现自动化操作。目前有些实验室用机器人对蛋白质进行自动化取点,凝胶上消化,样本脱盐以及对MALDI平板进行定点测定等。而且,现代化的MALDI-TOF仪完全能够让MALDI检测自动化。资料分析和数据检索过程同样可以自动化。在进行蛋白组分析时,如果在凝胶上不用单个分离就可以对所有蛋白质进行鉴定将是非常具有诱惑力的。为此,研究人员做了很多努力,由Hochestrasser及其同事建立了一套称作分子探测术的方法(molecular scanner)[26,27]。它是将整个2-DE胶上蛋白质样本同时酶解,并将酶解片段一起原位转移至另一张膜上,再直接用MALDI- TOF 质谱对膜上样本进行整体扫描,为实现蛋白质组学研究的自动化、规模化以及临床应用提供了一个崭新的思路和方法。这种思路的优点是显而易见的,不过按照目前的方法,要普及此种技术主要的难点是,质谱扫描一张图谱所需的时间过长,如用0.4mm的精度扫描一张4cm×4cm的膜需55个小时,这就意味着一张16cm×16cm的常用膜的扫描,至少需要36天不间断的工作和大约40G的磁盘空间存储如此庞大的原始数据。5 用ESI-MS/MS的方法创建序列标签只有当被消化的蛋白存在于已有的蛋白或基因组数据库中,并且能从MALDI分析器中得到四五个肽片的数据才能成功进行。如果在EST数据库中只有目的蛋白的部分序列,那么就需要知道肽片的序列信息。创建序列标签的优势在于,用肽的分子量和序列作为数据库检索对象比只用分子量作为检索对象具有更高的特异性。有了序列标签信息后,也可以用EST数据库进行检索[28]。通常来自于一个肽上的序列标签就足以鉴定蛋白质。同MALDI相比,纳升-ESI-MS/MS费时费力,而且在做ESI分析之前必须对样本进行脱盐处理。这些问题可以通过ESI-MS与HPLC联用得到解决。做ESI分析对样本浓度很敏感,用现代化的纳升-HPLC方法可以提供很高的局部肽片凝聚物,分离后的样本可以直接用于质谱分析,而不需要再分解。当分析混合物的时候,在质谱之前做LC分离尤其重要,因为它使得数据依赖的实验(DDE)成为可能,在DDE中,所有的离子都进入检测器进行测量,如果从HPLC到质谱之间出现一个峰的话,软件将自动从质谱转换到MS/MS模式并对产生的离子进行扫描。跟纳升-ESI相比,用这个方法可以从一份标本产生更多的MS/MS数据。Yates等已经详细叙述了如何进行[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS全自动蛋白检测的策略[29]。
我们关注的都是纯牛奶、奶粉,但是近些年乳饮料在市场上也很走俏,特别是双蛋白饮料,其实就是植物蛋白加上乳蛋白,但是在进行这类产品的检测时,特别是脂肪,大家用什么方法进行检测啊?我现在遇到的情况,用盖勃法检测数据偏低。还有植物蛋白饮料国家有没有相关的什么标准啊?我只查到一个农业部的标准。
我们有几个古代样品,通过质谱方法检测到了其中含有牛酪蛋白,但是因为当时的情况特殊,我们对此结果存疑,想进一步验证其中是否含有牛奶,所以想通过ELISA的方法定性检测其中的牛酪蛋白。大家知道,哪里做ELISA实验,能给我们代测牛酪蛋白吗(优先考虑北京的机构)?谢谢了!
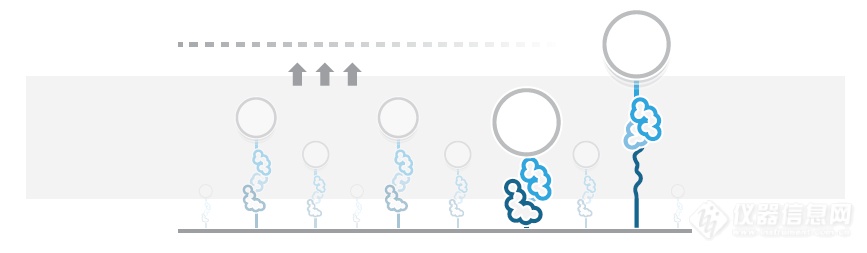
[b]使用声力研究蛋白去折叠[/b]单分子力谱(SMFS)技术是研究蛋白结构与蛋白去折叠中的生物力学性质的有力工具。SMFS能够为研究和药物开发提供有价值的信息。SMFS有助于揭示人类疾病病理的分子机制,而机制往往被认为与错误折叠的蛋白的形成和积聚有关,如阿茲海默症和帕金森氏症。然而现有的SMFS仪器缺少同时并行研究多个蛋白去折叠的功能,使得研究过程耗时很长。使用声波来对数以百计的生物分子施力并操控是非常理想的高通量研究方法。此案例中,声力谱学(AFS)是最新的用于研究蛋白去折叠的单分子操控方法。[img=,500,145]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021031435408_23_981_3.png!w690x201.jpg[/img]1 AFS检测蛋白去折叠的图解。蛋白一端栓住玻璃表面,另一端拴住聚苯乙烯微球。[img=,400,238]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021032257008_8827_981_3.png!w421x251.jpg[/img]2 对视野范围内被蛋白分子拴在玻璃表面的4.5 μm聚苯乙烯微球同时成像。物镜放大倍数为20x。AFS设备使用压电元件共振激发平面声阱穿过微流控芯片。共振波对与周围介质密度不同的微球施力,每个生物分子被单独地由微球拉伸(图1)。仪器可以实时并行操控视野范围内数以百计的微球,获得大量的数据以研究每个生物分子的随机与异质行为(图2)。在Yan Jie(NUS)的实验室的这项试点研究中,我们首次展示了AFS如何对蛋白施力并操控。实验对踝蛋白施力引发(去)折叠同时以高精确度记录蛋白的拉伸。踝蛋白属于机械敏感性大分子,在调控蛋白粘附于胞外基质中起作用。踝蛋白是细胞代谢过程和信号通路中的关键,并能够在力的作用下改变构象,在单分子生物物理学中备受关注。[img=,500,156]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021033524578_3892_981_3.png!w679x212.jpg[/img]3 使用AFS得到的单个踝蛋白分子的去折叠曲线,力变化速率为1 pN/s。轨迹在500 Hz下获得(彩色点),并平衡至50 Hz(黑色线)。3a 单个踝蛋白多次拉伸的力-距离曲线。3b 单个拉伸循环的力-距离曲线。3c 图3b中分子的时间-距离曲线。在这项研究中,连接了DNA的踝蛋白拴在聚苯乙烯微球和玻璃表面。启动声波后形成平面声阱,连接了踝蛋白的微球受到朝向声阱的力。实验中通过调节声波的振幅来改变力的大小。逐渐增加力的大小使得蛋白的结构域按顺序去折叠。实验循环进行拉伸与收缩的过程(力变化速率为1 pN/s)并同时以nm级的分辨率检测每个蛋白的拉伸长度(图3)。通过力-距离曲线(图3a)可以观察到单个踝蛋白的去折叠循环。将单个蛋白的去折叠轨迹叠加即可检测到单个结构域去折叠的发生,研究人员可以得到蛋白结构和蛋白去折叠自由能图谱信息。AFS仪器产生的超声并不会损害生物分子的结构完整性,因此蛋白可以连续去折叠和再折叠长达数小时,并能够得到单个蛋白多次去折叠和再折叠的曲线。相比于其他SMFS方法经过多次拉伸和收缩之后对蛋白造成光学损伤或力学损伤使得实验被迫终止,AFS能够获得更多的信息。图3b: 单个力-距离曲线中截取一小段,表示一个拉伸过程。将力从15 pN增加至19 pN,可以观察到4个去折叠过程,与蛋白的4个结构域相符合,拉伸长度为30 nm至100 nm。AFS的高分辨率检测功能可以很清晰地区分去折叠过程。AFS在x,y方向精度为2 nm,在z方向精度为4 nm(频率为25 Hz),可以大幅提高(去)折叠研究的精密程度。图3c: 图3b中分子的18秒范围内的时间-距离曲线。AFS可以检测短至毫秒级至长达10小时以上的事件,用于研究蛋白的热力学和动力学。通过检测踝蛋白的去折叠步骤并记录连续的高分辨率的去折叠轨迹,可以得出AFS如何用于研究蛋白去折叠。研究蛋白(去)折叠的详细机制能够在生物物理和生物医药领域产生突破性发现。今后的蛋白折叠以及蛋白相互作用的研究中,AFS的多分子并行操控功能将发挥重要作用,用户可以同时并行检测大量的蛋白分子。用户可以获得大量的实验数据,在不影响分辨率的同时对蛋白的机械性质数据作出分析。
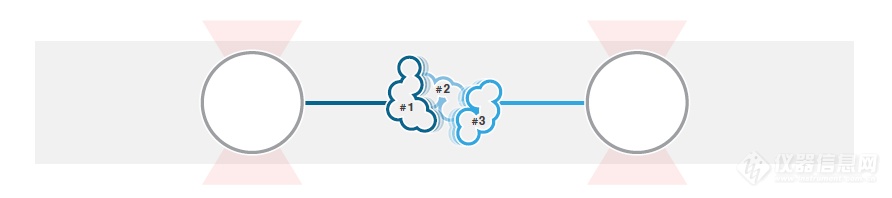
[b]研究多结构域蛋白阶段性去折叠[/b]很多生物大分子的功能与其构象和构象动力学密切相关,如蛋白质的生物功能需要其正确折叠成自然形态。错误折叠或者未折叠的蛋白会(部分)失活或者产生毒性,如错误折叠的蛋白与神经退行性疾病有关。研究蛋白如何正确折叠并改变构象以实现生物功能对理解其机制与疾病发生至关重要。单分子力谱(SMFS)是研究这些分子现象的理想工具,因为其具有独特的分离个体生物分子和实时观察构象变化及去折叠过程的功能。由于SMFS具有高敏感度和施加机械力的能力,可以直接操纵单个蛋白并通过测量其长度变化(亚nm级)观察构象改变。接下来我们使用LUMICKS开发的高分辨率光镊-荧光显微镜C-Trap演示了对钙调蛋白(CaM)的折叠过程的研究。[img=,500,110]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021105519876_1986_981_3.png!w690x153.jpg[/img][img=,218,200]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021106425366_604_981_3.png!w217x199.jpg[/img]1 多结构域蛋白的去折叠实验图解。具有3个结构域的蛋白通过DNA连接至两个被光所捕获的微球。2 通过改变光阱之间的距离可以对蛋白施力并检测断裂的发生。使用层流微流控和自动装载功能,N-端和C-端连接有DNA的单个CaM蛋白可被两个微球捕获(图1)。[img=,227,200]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021108116955_1942_981_3.png!w220x193.jpg[/img]3 10 mM Ca2+浓度下CaM的力-拉伸距离(蓝色)和力-收缩距离(红色)。拉伸与收缩的速度为100 nm/s。微球直径为1.0 μm,光阱的刚度为0.284 pN/nm。[img=,500,161]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021108223351_3734_981_3.png!w638x206.jpg[/img]4 10 mM Ca2+浓度下CaM的多个状态下的动态平衡。图为50 kHz(灰色)和200 kHz(红色)下记录的数据。在右侧直方图中可以看到两个清晰的峰即表现为蛋白最常处于的两个状态。第一个实验,在10 mM Ca2+条件下对CaM的机械拉伸与收缩行为进行了记录。首先对100 nm/s的速度下的拉伸与收缩的相关数据进行了记录(图3)。随着施加的力增加,可观察到两个去折叠的阶段,表现为力的突然下降,与两个螺旋-环-螺旋结构域的去折叠相符合。由此可以得出结论,基于C-Trap设备的力和距离的高分辨率(100 Hz时误差在0.2 pN以下和0.5nm以下),去折叠的发生可以用力谱的力-距离曲线来确定。这种测量非常适合用于比较正常蛋白与发生了改变或损伤的蛋白的折叠的相关数据。接下来研究光阱位置固定时CaM的折叠、去折叠的动态平衡,对蛋白长度的变化进行测量并确定中间态的转变(图4)。对CaM分子施加7.5 pN的力,可以观察到三种状态之间的波动,反映了螺旋-环-螺旋亚结构域的折叠和去折叠,波动的数据图像与之前的研究1,2相符(图4)。仪器所获得的稳定的高质量数据为蛋白的折叠和去折叠之间的动态转变的检测提供了大量有效的信息。通过这种方法可以对不同状态的驻留时间和转变动力学进行测量。这些信息使得我们对特定蛋白的折叠、去折叠过程产生进一步的了解。对折叠和去折叠的动力学以及构象改变的研究表现了一种突破性的生物学和生物物理学研究方法。使用C-Trap光镊-荧光技术可以观察到折叠和去折叠现象还有动态平衡,使得科研人员可以研究去折叠的中间态并获得蛋白的结构与功能信息。对蛋白折叠和构象的进一步研究仰仗于C-Trap的高敏感度和多通道荧光单分子FRET功能,通过检测FRET效率信号与力的波动的变化来进一步检测蛋白构象,可以得到蛋白的机械性质与结构之间的关系。[b][/b]
不知有谁使用过这个机器,是否能提供DU530核酸/蛋白分析仪使用说明书,谢谢!
北京易斯威特生物医学科技有限公司产品介绍 铁蛋白(FER)检测试剂盒 (胶体金法)1.国内第一家免疫层析法检测FER的产品。2.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的铁蛋白,适用于急性贫血,肝脏损伤等相关疾病的辅助诊断3.最快速准确的辅助诊断方法。4.血清铁蛋白是血液去铁蛋白和铁核心Fe3+形成的复合物。是检查体内铁缺乏的最灵敏的指标。血清铁蛋白测定在临床上常用于缺铁性贫血的诊断。简单 便捷 快速 灵敏 环保 肌红蛋白/肌酸激酶/心肌肌钙蛋白I,心梗三项检测试剂盒(胶体金法)1.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的肌红蛋白,肌酸激酶,心肌肌钙蛋白I检测,用于临床快速诊断急性心肌梗塞(AMI).2.最快速准确的辅助诊断方法。3.肌红蛋白:是心肌梗死的标志物,增高表示冠状动脉堵塞引起心肌严重缺血造成心肌梗死;4.肌钙蛋白:是一种心肌蛋白,升高见于心肌损伤,多见于心肌梗死,也见于心肌炎和心肺复苏后患者,特异性较高,阳性的话一般可确诊心肌损伤,阴性的话不能排除,因为肌钙蛋白的升高出现在心肌梗塞3-6小时之后,之前可能出现阴性。肌酸激酶敏感性较高,特异性较低,升高也出现在心梗3-8小时之后。5.肌酸激酶:主要存在于骨骼肌和心肌,在脑组织中也存在,是参与体内的能量代谢的一种酶。在临床上主要用于诊断心肌梗塞。心肌梗塞患者发病后2-4小时,血液中此酶活动即开始升高。比血清中谷草转酸酶和乳酸脱氢酶的活力变化都出现得早。 简单 便捷 快速 灵敏 环保 C反应蛋白(CRP)检测试剂盒(胶体金法)1.国内第一家免疫层析法检测CRP的产品。2.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的C反应蛋白,适用于感染,炎性疾病,组织损伤,手术创伤及组织坏死等病变情况的辅助诊断3.最快速准确的辅助诊断方法。4.是一种能与肺炎球菌C多糖体反应形成复合物的急性时相反应蛋白。可用于细菌和病毒感染的鉴别诊断简单 便捷 快速 灵敏 环保
自动定氮仪测水溶蛋白怎么进行???