Quantum Design中国合作引进 多功能高分辨率磁光克尔显微成像系统
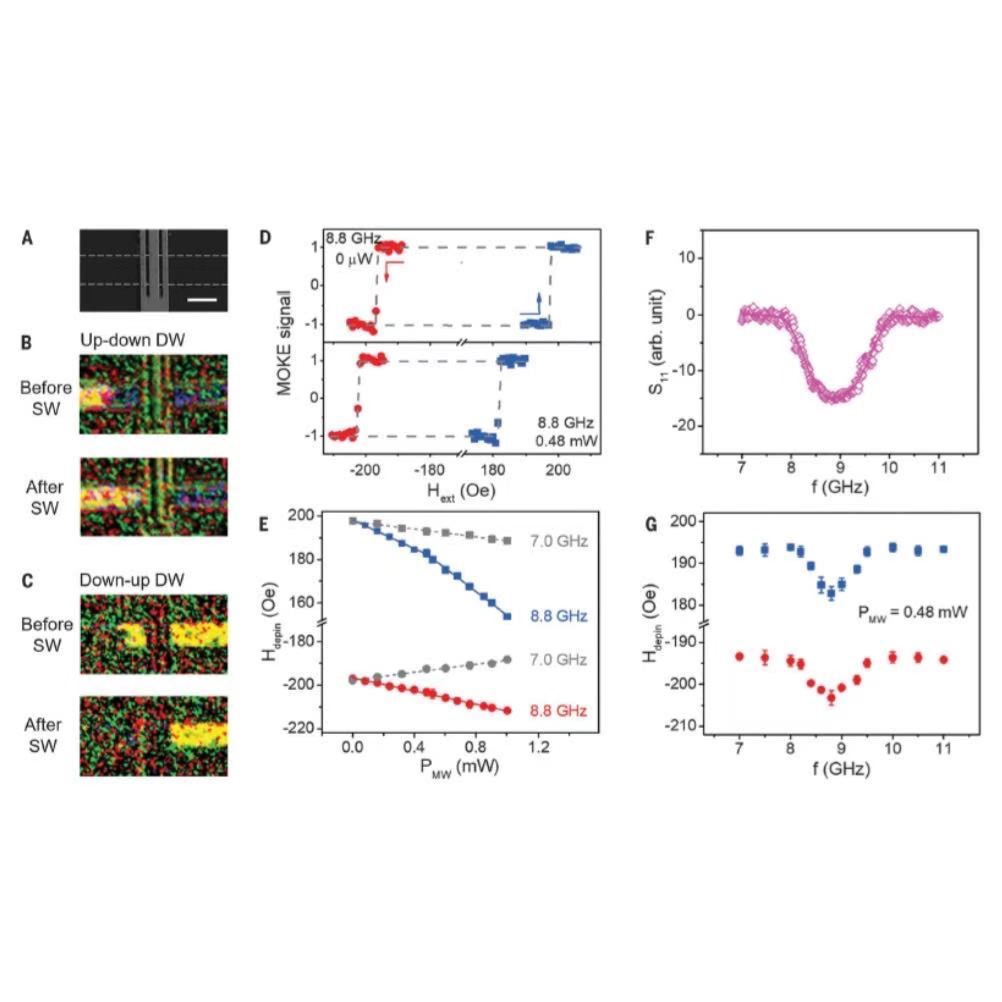
磁畴是铁磁体材料在自发磁化的过程中,为降低静磁能而产生分化的方向各异的小型磁化区域。它的研究可将材料的基本物理性质、宏观性质和应用联系起来。近年来,由于材料的日益完善和器件的小型化,人们对磁畴分析的兴趣与日俱增。目前市面上主要的磁畴观测设备有磁光克尔显微镜、磁力显微镜、洛伦兹电镜、以及近兴起的NV色心超分辨磁学显微镜等,其中,磁光克尔显微镜可以灵活的结合外加磁场、电流及温度环境等来对材料进行面内、面外的动态磁畴观测,成为目前常用的磁畴观测设备,可用于多种磁性材料的研究,如铁磁或亚铁磁薄膜、钕铁硼等硬磁材料、硅钢等软磁材料。 2020年11月,Quantum Design中国与致真精密仪器(青岛)有限公司签署了中国区战略合作协议,合作推出多功能高分辨率磁光克尔显微成像系统。通过此次战略合作,Quantum Design中国希望能够为磁学及自旋电子学等领域的研究提供更多的可能。图1 多功能高分辨率磁光克尔显微成像系统 多功能高分辨率磁光克尔显微成像系统由北京航空航天大学集成电路学院张学莹老师带领团队,根据多年的磁畴动力学实验技巧积累和新的磁学及自旋电子学领域的热点课题研究需求研发。它采用先进的点阵LED光源技术,能够在不切换机械结构的情况下,同时进行向和纵向克尔成像,不仅能同时检测样品垂直方向和面内方向的磁性,成像分辨率还能够达到270 nm,逼近光学衍射限。与传统的磁光克尔显微镜相比,多功能高分辨率磁光克尔显微成像系统配置了多功能磁铁探针台,能够在保证450 nm高分辨率的前提下,向被测样品同时施加面磁场、垂直磁场、电流和微波信号。 此外,多功能高分辨率磁光克尔显微成像系统拥有专门的智能控制系统,用户界面友好,无需复杂设置,一键触发既能实现多维度磁场、电学信号与克尔图像的同步操控。该系统的另一亮点是配置了反应速度高达1 μs的超快磁场,为微米器件中磁畴的产生、磁畴的高速运动捕捉等提供了可能。 张学莹老师师从北航赵巍胜教授和法国巴黎萨克雷大学Nicolas Vernier教授,从2015年开始研究磁光克尔成像技术和磁畴动力学,其有关磁性材料性质的论文获得北京航空航天大学博士学位论文。经过3年潜心研究,该团队于2018年完成了台克尔显微镜样机的集成,并创立致真精密仪器(青岛)有限公司。至2020年初,在北航青岛研究院和北航集成电路学院经过两轮迭代和打磨,已经完成了产品的稳定性验证,目前,该设备已经被清华大学、中科院物理所、北京工业大学等多家单位采购。 产品磁畴成像照片案例图2 CoFeB(1.3 nm)/W(0.2)/CoFeB(0.5)薄膜中的迷宫畴图3 斯格明子磁畴观测 多重信号的叠加,能够满足客户多种前沿课题的实验需求面内磁场和垂直磁场的叠加可以进行Dzyaloshinskii-Moriya作用(DMI)的测试[1,2]图4 样品Pt(4 nm)/Co(1 nm)/MgO(t nm)/Pt(4 nm)DMI作用测量[1] 自旋轨道矩(spin-orbit torque,简称SOT)是近年来发展起来的新一代电流驱动磁化翻转技术,如何更好的表征SOT翻转,在当今自旋电子学领域具有重要的理论和应用价值。 多功能高分辨率磁光克尔显微成像系统配置的面内磁场和电学测试系统,不但可以实现这个过程的电学测试,还可以利用相机与信号采集卡同步的功能,逐点解析翻转曲线对应的磁畴状态 [3,4]。图5 面内磁场和电流的叠加用于sot驱动的磁性变化过程研究 在某些材料中,无法观测到纯电流驱动的磁畴壁运动。这时,可以利用多功能高分辨率磁光克尔显微成像系统微秒别的超快磁场脉冲与电流同步,观测垂直磁场与电流共同驱动的畴壁运动,从而解析多种物理效应,如重金属/ 铁磁体系的自旋化率由于自旋散射降低的效应 [5]。图6 垂直磁场和电流的叠加可用于观测单磁场或者电流无法驱动的磁性动力学过程 克尔成像下磁场和微波的叠加则能够为自旋波和磁畴壁的相互作用研究提供可能[6]。图7 自旋波驱动的磁畴壁运动[6] 多功能高分辨率磁光克尔显微成像系统还可进行多种磁性参数的微区测量局部饱和磁化强度Ms表征[7]由于偶作用,磁畴壁在靠近时会相互排斥。通过观察不同磁场下磁畴壁的距离,可以提取局部区域的饱和磁化强度Ms。此方法由巴黎- 萨克雷大学Nicolas Vernier 教授(致真技术顾问)在2014 年先提出并验证,与VSM测量结果得到良好吻合。图8 局部饱和磁化强度Ms表征及与其他测试方法Ms结果对比 海森堡交换作用刚度[8]采用系统的磁场“自定义波形”功能,将样品震荡退磁,再将得到的迷宫畴图片进行傅里叶变换,能够得知磁畴宽度,从而提取海森堡交换作用刚度Aex。图9 海森堡交换作用刚度提取 自旋电子薄膜质量的表征、自旋电子器件的损坏检测等[9]图10 磁性薄膜质量检测 除此之外,该系统还开发了性价比超高的变温系统。针对永磁材料研究的用户,开发了能够兼容克尔成像的高温强磁场模块。针对硅钢等软磁材料研究用户,开发了大视野面内克尔显微镜。 动态磁畴成像案例图11 cofeb薄膜动态磁畴图12 sot磁场+电流驱动磁畴翻转图13 钕铁硼永磁动态磁畴观测图14 磁性材料内钉扎点的观测,可与巴克豪森噪声同步匹配 产品基本参数✔ 向和纵向克尔成像分辨率可达300 nm;✔ 配置二维磁场探针台,面内磁场高达1 t,垂直磁场高达0.3 t(配置磁场增强模块后可达1.5 t);✔ 快速磁场选件磁场反应速度可达1 μs;✔ 可根据需要选配直流/ 高频探针座及探针;✔ 可选配二次谐波、铁磁共振等输运测试;✔ 配置智能控制和图像处理系统,可同时施加面内磁场、垂直磁场和电学信号同步观测磁畴翻转;✔ 4k~800k,80k~500k 变温选件可选。 小结多功能高分辨率磁光克尔显微成像系统除了拥有超高分辨的动态磁畴观测能力外,还能结合多功能磁场探针台提供的外加电流、面内/面外磁场等对多种磁学参数进行提取。 样机体验目前,致真精密仪器(青岛)有限公司可对相关领域感兴趣的科学工作者提供了测样体验,欢迎感兴趣的老师或同学拨打电话010-85120280或发送邮件至info@qd-china.com体验磁光克尔显微成像全新技术! 参考文献[1] A. Cao et al., Nanoscale 10, 12062 (2018).[2] A. Cao et al., Nanotechnology 31, 155705 (2020).[3] X. Zhao et al., Appl. Phys. Lett. 116, 242401 (2020).[4] G. Wang et al., IEEE Trans. Circuits Syst. I Regul. Pap. 66, 215 (2019).[5] X. Zhang et al., Phys. Rev. Appl. 11, 054041 (2019).[6] J. Han et al., Science (80-. ). 366, 1121 (2019).[7] N. Vernier et al., Appl. Phys. Lett. 104, 122404 (2014).[8] M. Yamanouchi et al., IEEE Magn. Lett. 2, 3000304 (2011).[9] Y. Zhang et al., Phys. Rev. Appl. 9, 064027 (2018).