美国科学家称,利用世界上最先进的高分辨率光学显微镜,他们观察到了H2AX蛋白质在细胞核内的团状分布情况,以及DNA受损后它们如何移动到所需地方对基因进行“急救”或修复。 目前,有许多生物过程都是无法用视觉观察到的,原因是高分辨率电子显微镜常常因样品制备问题出现偏差,而光学显微镜虽然容易制备且能观察活细胞,但其分辨率却比较低。然而,通过对光波进行适当的操作,生物科学家扩展了光学显微镜的能力,成功地研制出4Pi显微镜,并通过它观察到了细胞的成分,其中包括细胞核的内部结构。 在新出版的美国《国家科学院学报》上,美国杰克逊实验室分子生物物理学所研究人员乔尔格• 毕瓦斯多夫及其合作者联合发表文章介绍说,借助4Pi光学显微镜,他们观察到了DNA双螺旋结构断裂情况下细胞的反应,并发现了DNA双螺旋结构断裂(即遗传物质严重受损)后引发的细胞内H2AX蛋白质一系列验证和修复损伤动作。如果细胞成分在修复过程中出现缺陷,则存在着发生癌症和免疫问题的危险,因此细胞内的反应十分重要。 H2AX是一种组蛋白。作为结构蛋白质,它们能缠绕在受损的DNA上,同时它们具有基因管理和基因修复的功能。H2AX在DNA受损后能快速做出反应,转变成γ-H2AX,这对协调发信号和修复等极其重要。 利用选择性着色技术和4Pi显微镜,毕瓦斯多夫还观察到H2AX组蛋白成团状均匀地分布在细胞核内。他认为,这种团状结构或许决定了DNA发生断裂时,γ-H2AX进行对应扩散的边界。 毕瓦斯多夫说:“H2AX团状分布也许为迅速和有效地应对DNA受损提供了平台。下一步,我们将分析H2AX团的位置及与其他细胞核成分的关系。”
近日,德国IBIDI公司成功开发出一款超高分辨率生物显微镜。该公司宣称基于新型随机光学重建显微技术“(d)STORM”,利用该公司独创的特殊塑料底板“μ-Slides”可实现超高分辨率观察活体细胞。 STED,SIM,(F)PALM 和(d)STORM等新型光学显微技术可有效避免衍射极限,获得纳米级水平的超高分辨率成像。这些超高分辨率显示技术可应用到生物实验研究,观察了解组织细胞分子结构。IBIDI公司采用了创新性的含有亲水性膜涂层的塑料材质底板“μ-Slides”替代传统玻璃底板,首次实现了“活体细胞”超高分辨率观察。这种被成为“ibi-Treat”的亲水性膜涂层性能可以与标准的细胞培养瓶和培养皿相媲美。 IBIDI公司相关研发工作受到了德国联邦教研部《生命科学领域光学技术—基本细胞功能》项目的资助。
分子级高分辨率的激光扫描共焦显微镜和结构照明显微镜是在细胞生物学和其他相关领域强有力的研究工具,但是它们高昂的价格也使很多潜在用户望而却步。波士顿大学的科学家最近开发出一种显微新技术 (HiLo Microscopy),能够将普通的广域荧光显微镜变成可与激光扫描共焦显微镜和结构照明显微镜相媲美的高分辨率生物显微镜。这一技术包括一个简单的可以在均衡光源和结构光源之间自由转换的显微镜附件和一套功能强大的图像处理软件。该软件仅通过处理在均衡光源和结构光源条件下拍摄的两张分辨率不同的照片就可以得到全分辨率的三维图像。这一技术可用于任何现有的广域荧光显微镜,而成本大大低于激光扫描共焦显微镜和结构照明显微镜。由于成像机理简单,该技术的成像速度是常用的生物显微技术中最快的,而且操作简便,不受样本移动的影响。波士顿大学目前正在积极寻求企业合作,争取早日将这一突破性的技术推向市场。
上个月末,通用电气医疗集团(GE Healthcare)签署了一项协议,收购细胞成像产品制造商Applied Precision,具体收购金额不详。随着这次收购行动,GE Healthcare有望进入快速增长的细胞成像领域。 总部位于华盛顿西雅图郊外的Applied Precision开发并制造高分辨率以及超高分辨率的显微镜仪器,让研究人员能够以其他类型显微镜无法实现的规模来研究细胞过程。 一般显微镜所拥有的分辨率能让研究人员观察到200 nm及以上的物体。因此,对于大小在10 nm左右的胰岛素,一般的显微镜是无法看到的。然而,有了超高分辨率显微镜,研究人员就能看到。电镜的分辨率与超高分辨率显微镜相似,但它们不能活体观察细胞,而后者能做到。 GE Healthcare负责细胞技术的总经理Amr Abid向国外媒体透露,通过在此水平研究细胞功能,研究人员能够对功能异常细胞的机制有了更深入的了解。他举了一些例子,比如利用超高分辨率显微镜来研究HIV病毒如何穿透细胞,这为新药开发提供了信息。 几个世纪以来,科学家们都是利用光学显微镜对肉眼无法看到的结构进行观测,目前光学显微镜已经成为了实验室必备的实验器材之一,但是随着研究的深入,光学显微镜的分辨率已经无法达到科学家们的要求了。2008年,《Nature》杂志将超高分辨率显微技术评为年度技术。 Abid估计,如今整个显微镜市场大概在20亿-30亿美元。其中,超高分辨率显微镜占了约20%。Applied Precision和徕卡(Leica)是硬件方面的行业领先者,他们各自的市场份额大约为30%-35%。 GE目前不提供超高分辨率显微镜,也不曾开发它们。Applied Precision的产品是对GE细胞分析产品线的很好补充。GE也在探索一些方法,将其现有的细胞研究技术与Applied Precision的仪器捆绑起来。 目前,GE在细胞成像方面的旗舰产品是2009年上市的IN Cell平台。IN Cell Analyzer平台提供了一整套从自动化图像获取到数据的定量和深度分析以及可视化的强大工具,来协助整个高内涵分析过程。前不久,GE推出了最新版本的分析平台——IN Cell 6000。 据Abid透露,由于Applied Precision在高分辨率以及超高分辨率显微镜方面声名卓著,故GE打算保留其名称。该公司还计划保留全部130名员工,并在技术上继续投资。 GE还打算加大力度提高Applied Precision在亚太地区(如中国、印度和日本)的知名度,对于超高分辨率显微镜而言,这些区域是一个增长点,然而,Applied Precision目前的份额还很有限。
共焦显微镜因其高分辨率和能三维立体成像的优点被广泛应用在生物、医疗、半导体等方面。文章首先分析了影响共焦显微镜分辨率的因素,主要有光源、探测器孔径和杂散光等;并结合这些因素介绍了双光子共焦碌微镜、彩色共焦显微镜、荧光共焦显微镜、光纤共焦显微镜;然后从提高系统成像速度的方面介绍了波分复用共焦显微镜和频分复用共焦显微镜;最后分析了共焦显微镜的发展趋势。一、引言随着人们对于生物医学的研究,传统的光学显微镜已经无法满足研究的需要,人们需要可以实现三维成像的显微镜。1957年Marvin Minsky提出了共焦扫描显微镜的原理。1969年,耶鲁大学的Paul Davidovits和M.David Egger设计了第一台共焦显微镜,1987年第一台商业化共焦显微镜的问世,真正实现了三维立体成像。与普通光学显微镜相比,共焦显微镜具有极其明显的优点:能对物体的不同层面进行逐层扫描,从而获得大量的物体断层图像;可以利用计算机进行图像处理;具有较高的横向分辨率和纵向分辨率;对于透明和半透明物体,可以得到其内部的结构图像;还可以对活体细胞进行观察,获取活细胞内的信息,并对获得的信息进行定量分析。自共焦显微原理被提出以来,引起了研究者的广泛关注,提高显微系统的分辨率和改善系统的性能是研究者开发新型显微镜时考虑的主要因素。近几十年,国内外学者通过对共焦显微成像系统的三维点扩散函数、光学传递函数等方面的分析,得出影响显微系统分辨率的因素,主要包括系统的激励光源、探测器孔径、杂散光等。此外,共焦显微镜的成像速度也是决定系统性能的一个重要因素,专家们也一直在进行提高系统成像速度的研究。本文主要从提高显微系统分辨率和系统成像速度这两个方面来介绍共焦显微镜的发展情况。二、共焦扫描显微镜分辨率的提高光源、探测器孔径和杂散光等是影响共焦显微镜分辨率的几个主要因素,因此可以通过改善这些方面来提高显微系统的分辨率。1.光源显微镜的成像性质在很大程度上取决于所采用光源的相干性,有关研究表明,光源相干性好的系统其分辨率要比相干性差的系统要好,并且照明光源对分辨率的改变范围达到了26.4%。因此,选取适合的照明光源对提高显微系统的分辨率有很大帮助。常规的共焦扫描显微镜主要使用普通单色激光作为光源,随着技术的进步,目前已经出现了使用飞秒激光、超白激光、高斯光束作为光源的共焦显微镜,以提高系统性能,获得更高的分辨率。①飞秒激光为光源的双先子扫描共焦显微镜双光子扫描共焦显微镜通常使用近红外的飞秒激光作为激发光源,由于红外光具有较强的穿透性,它能探测到生物样品表面下更深层的荧光图像,并且生物组织对红外光吸收少,随着探测深度的增加衰减会变小,另一方面红外光的衍射低,光束的形状保持性好。2005年,Wild等人利用双光子扫描共焦显微技术实时观察和定量分析了PAHs在植物叶片表面和内部的光降解过程。后来又进一步研究了菲从空气到叶片的迁移过程、菲在叶片内部的运动及其分布情况等,该技术可观测PAHs在叶片内部的最大深度约为200μm。②白激光( supercontinuum laser)为光源的彩色共焦显微镜彩色共焦显微镜是利用光学系统的彩色像差,光源的不同光谱成分会聚焦到样品的不同深度,通过分析由样品反射的光谱能有效地获得样品的扫描深度。2004年,美国宾夕法尼亚州立大学的Zhiwen Liu课题小组使用光子晶体光纤产生的超连续谱白光作为彩色共焦显微镜的光源,这种超连续谱白光具有大的带宽,能够提高系统的扫描范围,能达到7μm扫描深度。另外超白激光有较高的空间相干性,无斑点噪声,能提高系统的信噪比和扫描速度。③使用高斯光束的荧光共焦显微镜荧光共焦显微镜是通过激光照射样品激发样品发出荧光,再通过探测器接受荧光对样品进行观察的共焦显微镜。华南农业大学的杨初平等人研究了不同光源孔径和束斑尺寸的高斯光束对荧光共焦显微镜分辨率的影响表明:与一定孔径尺寸的平行光束相比,采用高斯光束系统可以获得更好的分辨率。 2. 探测器孔径和杂散光共焦显微镜中探测器孔径能滤除部分杂散光,提高系统的分辨率和信噪比。根据相关文献对共焦扫描显微镜的三维光学传递函数与探测器孔径之间的依赖关系的研究,可以得到探测小孔直径为:d=β*1.22λ/NA,式中,β为物镜的放大率,λ为光的波长,NA为物镜的数值孔径。由该公式确定探测器小孔的直径,一方面满足了共焦扫描系统对探测器小孔直径的要求,从而保证高的横向和纵向分辨率,另一方面,又最大限度地使由试样中发射的荧光能量被探测器接收。为了更进一步提高系统分辨率,许多研究者对共焦显微镜中探测孔径进行了改进,例如使用单模光纤代替普通针孔孔径,还有双D型孔径等。① 使用单模光纤的光纤共焦显微镜在光纤共焦显微镜中用光纤分路器代替传统共焦显微镜中的光束分路器,并以单模光纤来代替光源和探测器的微米尺寸针孔孔径。使用单模光纤的优点在于:首先,在采用寻常针孔制作的共焦显微镜中,光源、针孔、探测器等有可能不在一条直线上从而会引起像差;但是在光纤作为针孔的共焦显微镜中,即使有的部件偏离直线时也不会引入像差。其次,使用单模光纤代替微型针孔,容易清除针孔的污染,而且不易受污染。第三,在使用光纤的系统中,可以自由移动显微镜部分而不必挪动探测器。2006年德克萨斯大学使用光纤共焦显微镜进行口腔病变检测,测得的系统横向和轴向分辨率分别为2. 1µm和10µm,成像速度为15帧/s,可观测范围为200µm×200µm。② 具有D型孔径的共焦显微镜近几年,具有对称D型光瞳的共焦显微成像技术引起广泛的关注,图1所示是该系统示意图。2006年美国东北大学的Peter J.Dwyer等人使用这种共焦显微镜进行了人体皮肤内部成像的实验,测得横向分辨率为1.7士0.1µm。2009年新加坡国立大学的Wei Gong等人采用傍轴近似方法理论分析了在共焦显微镜中使用双D型孔径对轴向分辨率的影响。分析表明在图1中的d值给定时,进入瞳孔的光信号强度l会随着探测器尺寸的增加而增加;但是在探测器尺寸给定时,光信号强度I会随着d的增加而单调递减。在使用有限大小的探测器时,改变d的大小,轴向分辨率可以得到改善。 http://www.biomart.cn//upload/userfiles/image/2011/11/1321512815.png 图1 双D型孔径共焦成像系统示意图在共焦成像光学系统中,到达像面的杂散光会在像面上产生附加的强度分布,从而进一步降低了像面的对比度,限制了系统分辨率的提高,因此在显微系统设计时,杂散光的影响也是不容忽视的。一般除了使用探测小孔来抑制杂散光,其他的一些设备例如可变瞳滤波器等对杂散光也有很好的过滤作用。最近以色列魏茨曼科学研究所的O.sipSchwartz and Dan Oron等人提出在系统中使用可变瞳滤波器,这个滤波器能够使多光子荧光共焦显微镜达到分辨率阿贝极限的非线性模拟,从而改善系统的分辨率。三、共焦扫描显微成像速度的提高共焦显微镜快速的成像速度为研究者观察生物细胞中快速动态反应提供了良好的条件。在共焦扫描显微成像系统中,传统的方法是通过改善扫描探测技术来提高成像速度。现有的扫描探测技术主要有Nipkow转盘法、狭缝共焦检测法、多光束的微光学器件检测法。这些方法可以改善扫描速度,但是与系统分辨率,视场之间都存在矛盾,因此又诞生了两种提高成像速度的新型显微镜:波分复用共焦显微镜和频分复用共焦显微镜。
场发射透射电镜与高分辨率透射电镜有什么区别? 是不是场发射电镜的照片更清晰?急盼各位老师指点!!!!!!!!
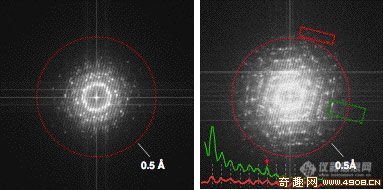
http://ng1.17img.cn/bbsfiles/images/2017/01/201701191653_630726_2224533_3.jpg 两个金晶原子以复杂的排列方式组合在一起,它们之间的距离为2.3埃http://ng1.17img.cn/bbsfiles/images/2017/10/201105141704371930_01_2224533_3.jpg 据外媒报道,美国能源部国家电子显微镜中心(NCEM)最近装配完成了世界上性能最强大的电子显微镜,该显微镜的分辨率可以达到0.5埃(1埃为一亿分之一厘米)。通过这台显微镜,科学家们可以观测到比单个氢原子还要小的微小物体。
[url=http://www.f-lab.cn/microscopes-system/picotweezers.html][b]高分辨率光镊系统[/b][/url]采用了德国picotweezers技术的细胞单分子力学捕获系统,是全球领先的超高分辨率激光光镊系统,是进口光镊品牌中具有超低光镊价格Optical Tweezers产品.[b]高分辨率光镊系统[/b]不仅具有光镊功能,还提供微视图像计算能力,非常方便单细胞生物力学分析.[b]高分辨率光镊系统通[/b]常与德国蔡司Axiovert、AxioA1或D1型显微镜配套使用,配备1W或5W的红外光纤激光器,提供激光捕获力高达400pN~2nN范围。高分辨率光镊系统配备压电定位位移台,在XYZ三轴三个方向具有200μm分辨率的扫描能力.[b]高分辨率光镊系统[/b]还具有视频分析功能,至少2.5nm的横向和轴向分辨率,其图像拍摄速率为200帧/秒,X、Y、Z互相成像速度为400赫兹,可对生物大分子进行0.1PN作用力分辨率的实时分析。[img=高分辨率光镊系统]http://www.f-lab.cn/Upload/ionovation-explorer.jpg[/img] [b]高分辨率光镊系统特色[/b]定量分析,在三维方向实现0.1 PN分辨率的生物为微力分析最大光阱捕获力可在1 W光纤激光器下达到400 PN通过光镊实现对捕获对象精度为纳米级别的操控 [b][b]高分辨率光镊系统[/b]应用[/b]单分子与活细胞的操控和分析 弹性模量分析、微流控分析 分子相互作用、纳米孔分析 [color=#666666][color=#000000]高分辨率光镊系统:[url]http://www.f-lab.cn/microscopes-system/picotweezers.html[/url][/color][/color]
显微镜的分辨率是衡量显微镜性能的又一个重要技术参数。 分辨率又称"鉴别率","解像力";是指显微镜(或人的眼睛距目标25cm处)能分辨物体最小间隔的能力,分辨力的大小决定于光的波长和数值孔径(又称:镜口率)以及介质的折射率。 显微镜的分辨率用公式表示为:d=l/NA;式中d为最小分辨距离;l为光线的波长;NA为物镜的数值孔径。可见物镜的分辨率是由物镜的NA值与照明光源的波长两个因素决定。NA值越大,照明光线波长越短,则d值越小,分辨率就越高。 如果要提高显微镜的分辨率,即减小d值,奥秋仪器建议采取以下措施1. 降低波长l值,使用短波长光源。2.曾大介质h值和提高NA值(NA=hsinu/2)。3.增大孔径角。4.增加明暗反差。
本人目前正准备一项目,欲改良,开发设计一高分辨率的XRF仪器,能够实现对湿沉积物样品的直接测试,并且能够附加X射线照相\颜色反射率\密度等设备.急需要精通XRF研发技术的人员共同合作,有志者请与本人联系,共同探讨.可直接与本人联系,邮件地址:yangqh@gig.ac.cn
超高分辨率场发射扫描电镜,日本电子,欢迎有需要求的测试,量大优惠大[img]https://ng1.17img.cn/bbsfiles/images/2024/03/202403041546441431_3168_4087606_3.png[/img]
http://www.cas.cn/ky/kyjz/201207/W020120712608069274506.jpg验收专家现场核查设备情况 7月11日,中国科学院计划财务局组织专家在生物物理研究所对徐涛研究员负责的“光敏定位超高光学分辨率显微镜系统”仪器研制项目进行了现场验收。 验收专家组听取了研制工作报告及经费决算报告、用户报告和技术测试报告,现场核查了设备的运行情况,审核了相关文件档案及财务账目。经过提问与讨论,验收专家组一致认为该项目实现了预期的研制目标,完成了实施方案规定的各项任务,同意通过验收。 2006年9月,美国科学家Eric首次在Science杂志上提出光敏定位显微镜(PALM)的概念,使得光学显微镜能够获得与电子显微镜相匹配的分辨率。PALM的基本原理是将荧光分子附著在目标蛋白上,利用全内反射显微镜(TIRFM)技术和单分子定位技术得到细胞内荧光蛋白纳米级分辨率的精确定位。“光敏定位超高光学分辨率显微镜系统”研制项目总体设计灵活高效,结合了TIRFM、EMCCD成像系统、闭环锁焦系统等技术,提出了新的单分子定位算法,实现了三维防漂移反馈校正、细胞内单分子的三维定位和超精细结构观察,完成了一套具有国际领先水平的超高分辨光学显微成像系统,具有较高的创新性。 目前,该系统已在细胞内单分子(如微管蛋白、离子通道等)成像方面发挥了关键作用。研究人员在Nature Methods、PNAS等杂志上发表了世界领先的研究成果,可应用于细胞生物学的超高分辨荧光成像,具有广泛的应用前景。 该项目研制的仪器符合目前蛋白质科学和系统生物学对创新仪器设备和技术的有关需求,有望产生一定的经济效益。
正常来说,光学显微镜的分辨率都是根据 D=0.61入/na,那白光下面光学的有效分辨率大约在0.35微米,但是如果用248纳米波长的紫外光,根据公式,也没有能达到80纳米的分辨率啊?不知是什么原因,望大师指导指导!!!
[url=http://www.f-lab.cn/microscopes-system/storm.html][b]实时超分辨率显微成像系统[/b][/url]突破了光学显微镜的半波长分辨率极限,提供了比宽视场,共聚焦显微镜更好分辨率。实时超分辨率显微成像系统采用尼康或奥林巴斯显微镜,Chroma 滤波片,Andor公司EMCCD相机以及独特的照明系统,为客户提供全球同步的超分辨率成像系统。[img=实时超分辨率显微成像系统]http://www.f-lab.cn/Upload/storm-2.JPG[/img][b]实时超分辨率显微成像系统特点[/b]横向分辨率可达20nm,轴向分辨率可达40nm实时和线下图像重建GPU加速处理图像先进的自动聚焦硬件高分辨率X-Y-Z工作台灵活的配置[img=实时超分辨率显微成像系统]http://www.f-lab.cn/Upload/storm-1.JPG[/img]实时超分辨率显微成像系统:[url]http://www.f-lab.cn/microscopes-system/storm.html[/url]
[align=center][font='times new roman'][size=16px][b]超高分辨[/b][/size][/font][font='times new roman'][size=16px][b]显微镜及其在生物医学领域的应用[/b][/size][/font][/align][align=center][font='times new roman'][size=14px]刘皎[/size][/font][font='times new roman'][sup][size=14px]1[/size][/sup][/font][font='times new roman'][size=14px],[/size][/font][font='times new roman'][sup][size=14px] [/size][/sup][/font][font='times new roman'][size=14px]吴晶[/size][/font][font='times new roman'][sup][size=14px]1[/size][/sup][/font][/align][align=center]1. [font='times new roman']北京大学医药卫生分析中心,北京,[/font][font='times new roman']100191[/font][/align][font='times new roman'][b]摘要[/b][/font][font='times new roman'][b] [/b][/font][font='times new roman']超高分辨显微镜([/font][font='times new roman']Super-Resolution Microscopy[/font][font='times new roman'])作为一类强大的科学工具,可以突破传统光学显微镜的分辨极限,实现对微小结构的高分辨率成像,已经在生物医学领域引起了广泛的关注和应用。本文将探讨超高分辨显微镜的不同类型和原理,介绍[/font][font='times new roman']其[/font][font='times new roman']在生物医学领域的应用[/font][font='times new roman']及展望其未来发展[/font][font='times new roman']。[/font][font='times new roman'][b]Abstract[/b][/font][font='times new roman']Super Resolution Microscopy[/font][font='times new roman'], as a powerful scientific tool, can break through the resolution limit of traditional optical microscopes and achieve high-resolution imaging of small structures. It has attracted widespread attention and application in the biomedical field. This article will explore the different types and principles of Super Resolution Microscopy, introduce their applications in the biomedical field, and look forward to their future development[/font][font='times new roman'].[/font][font='times new roman'][b]关键词[/b][/font][font='times new roman']超高分辨[/font][font='times new roman']显微镜,[/font][font='times new roman']成像技术[/font][font='times new roman'],应用[/font][font='times new roman'][b]1 [/b][/font][font='times new roman'][b]引言[/b][/font][font='times new roman']显微镜的产生和发展对于生命科学研究的进步有至关重要的作用[/font][font='times new roman'],它将微观世界呈现在大家面前,包括微生物的存在、组织细胞结构及生理病理活动等。显微镜技术的不断革新将成像分辨率不断提高,但相当长一段时间内光学成像无法突破一个极限值,即[/font][font='times new roman']xy[/font][font='times new roman']轴横向分辨率约[/font][font='times new roman']200nm[/font][font='times new roman'],[/font][font='times new roman']z[/font][font='times new roman']轴纵向分辨率约[/font][font='times new roman']500nm[/font][font='times new roman'],因此小于这个尺寸的生命活动和结构[/font][font='times new roman'],如病毒、亚细胞结构等,[/font][font='times new roman']是无法清楚地观察到的[/font][font='times new roman']。[/font][font='times new roman']聚焦点的光强会根据点扩散函数([/font][font='times new roman']point spread functio[/font][font='times new roman']n[/font][font='times new roman'],[/font][font='times new roman']PSF[/font][font='times new roman'])而展开[/font][font='times new roman'],[/font][font='times new roman']对于圆形孔径,[/font][font='times new roman']PSF[/font][font='times new roman']呈现为艾里斑([/font][font='times new roman']Airy disk[/font][font='times new roman'])的模式[/font][font='times new roman']。[/font][font='times new roman']激光扫描共聚焦显微镜([/font][font='times new roman']Confocal Laser Scanning Microscopy, CLSM[/font][font='times new roman'])的分辨率取决于[/font][font='times new roman']PSF[/font][font='times new roman']的大小,如果焦点很小,则每个像素[/font][font='times new roman']点[/font][font='times new roman']获取到的信息也很小,从而得到清晰锐利的图像;反之,则结果图像变得模糊。因此,[/font][font='times new roman']CLSM[/font][font='times new roman']成像的[/font][font='times new roman']主要挑战在于实现越来越小的[/font][font='times new roman']PSF[/font][font='times new roman']以获得更好的分辨率。德国物理学家恩斯特[/font][font='times new roman'][/font][font='times new roman']阿贝([/font][font='times new roman']Ernst Abbe[/font][font='times new roman'],[/font][font='times new roman']1840-1905[/font][font='times new roman']年)在[/font][font='times new roman']19[/font][font='times new roman']世纪[/font][font='times new roman']70[/font][font='times new roman']年代首次[/font][font='times new roman']提出阿贝衍射极限,即[/font][font='times new roman']由于衍射效应,[/font][font='times new roman']PSF[/font][font='times new roman']大[/font][font='times new roman']小与[/font][font='times new roman']λ/NA[/font][font='times new roman']成正比([/font][font='times new roman']d=0.61λ/NA[/font][font='times new roman']),其中[/font][font='times new roman']λ[/font][font='times new roman']是光的波长,[/font][font='times new roman']NA[/font][font='times new roman']是物镜最重要的参数[/font][font='times new roman']——[/font][font='times new roman']数值孔径[/font][font='times new roman']。由于可见光波长范围在[/font][font='times new roman']400-760nm[/font][font='times new roman']之间,[/font][font='times new roman']NA[/font][font='times new roman']值最大在[/font][font='times new roman']1.7[/font][font='times new roman']左右,所以分辨率极限在[/font][font='times new roman']200nm[/font][font='times new roman']左右。随着物理学和测量技术的进步,突破衍射极限的显微镜不断涌现,目前公认的超高分辨显微镜主要有三类,包括[/font][font='times new roman']结构照明显微镜([/font][font='times new roman']Structured Illumination Microscopy[/font][font='times new roman'],[/font][font='times new roman']SIM[/font][font='times new roman'])[/font][font='times new roman'],受激发射减耗显微镜([/font][font='times new roman']Stimulated Emission Depletion Microscopy[/font][font='times new roman'],[/font][font='times new roman']STED[/font][font='times new roman']),和[/font][font='times new roman']单分子定位显微镜。单分子定位显微镜包括光敏定位显微镜([/font][font='times new roman']Photoactivation Localization Microscopy[/font][font='times new roman'],[/font][font='times new roman']PALM[/font][font='times new roman'])和随机光学重建显微镜([/font][font='times new roman']Stochastic Optical Reconstruction Microscopy[/font][font='times new roman'],[/font][font='times new roman']STORM[/font][font='times new roman'])[/font][font='times new roman']。[/font][font='times new roman']2014[/font][font='times new roman']年三位科学家[/font][font='times new roman']史蒂芬[/font][font='times new roman'][/font][font='times new roman']霍尔([/font][font='times new roman']Stefan W. Hell[/font][font='times new roman'])[/font][font='times new roman']、埃里克[/font][font='times new roman'][/font][font='times new roman']贝兹([/font][font='times new roman']Eric Betzig[/font][font='times new roman'])和威廉[/font][font='times new roman'][/font][font='times new roman']莫纳([/font][font='times new roman']William E. Moerner[/font][font='times new roman'])因他们在超[/font][font='times new roman']高[/font][font='times new roman']分辨显微镜技术领域的贡献而获得了诺贝尔化学奖。[/font][font='times new roman'][b]2 [/b][/font][font='times new roman'][b]不同类型的超高分辨显微镜[/b][/font][font='times new roman'][b]2.1[/b][/font][font='times new roman'][b] [/b][/font][font='times new roman'][b]结构照明显微镜([/b][/font][font='times new roman'][b]Structured Illumination Microscopy[/b][/font][font='times new roman'][b],[/b][/font][font='times new roman'][b]SIM[/b][/font][font='times new roman'][b])[/b][/font][font='times new roman']SIM[/font][font='times new roman']本质是利用两束激发光在样品上进行干涉,产生明暗交替的莫尔条纹,高空间频率的莫尔条纹会放大激发条纹与样品空间频率不一致的结构,从而将样品中的高频信息整合入收集到的图像中。[/font][font='times new roman']通过投射特殊的光照明模式如格点或条纹光栅,以一定的模式照射样品,引入空间频率信息,采集多个图像并经过复杂的数据处理之后,重建高分辨率图像。由于每个图像都采用不同的结构照明模式,包含了不同的信息,合并后的图像能够展示出比传统显微镜更多的细节[/font][font='times new roman']。[/font][font='times new roman']相比于其他超高分辨成像技术,[/font][font='times new roman']SIM[/font][font='times new roman']最大的优势就是宽场[/font][font='times new roman']成像,速度快,基本可以达到实时观察。[/font][font='times new roman']SIM[/font][font='times new roman']技术的前身可以追溯到[/font][font='times new roman']20[/font][font='times new roman']世纪[/font][font='times new roman']70[/font][font='times new roman']年代初。当时,光学学家特奥多尔[/font][font='times new roman'][/font][font='times new roman']赫普恩([/font][font='times new roman']Theodor [/font][font='times new roman']H?upl[/font][font='times new roman'])首次提出了使用周期性光栅照明来提高显微镜分辨率的想法。这奠定了[/font][font='times new roman']SIM[/font][font='times new roman']技术的基础,尽管当时还没有实际的[/font][font='times new roman']SIM[/font][font='times new roman']显微镜。[/font][font='times new roman']21[/font][font='times new roman']世纪初期,史蒂芬[/font][font='times new roman'][/font][font='times new roman']霍尔([/font][font='times new roman']Stefan W. Hell[/font][font='times new roman'])和埃里克[/font][font='times new roman'][/font][font='times new roman']贝兹([/font][font='times new roman']Eric Betzig[/font][font='times new roman'])等科学家分别独立开发了[/font][font='times new roman']SIM[/font][font='times new roman']的现代版本。[/font][font='times new roman']SIM[/font][font='times new roman']技术开始广泛传播,吸引了生物学家和显微镜专家的关注。它被认为是一种相对低成本的[/font][font='times new roman']超高分辨[/font][font='times new roman']率成像方法,因为它不需要昂贵的激光设备或复杂的样品准备。[/font][font='times new roman'][b]2.2 [/b][/font][font='times new roman'][b]受激发射减耗[/b][/font][font='times new roman'][b]显微镜([/b][/font][font='times new roman'][b]Stimulated Emission Depletion Microscopy[/b][/font][font='times new roman'][b],[/b][/font][font='times new roman'][b]STED[/b][/font][font='times new roman'][b])[/b][/font][font='times new roman']STED[/font][font='times new roman']技术的概念最早由斯德哥尔摩大学的斯蒂芬[/font][font='times new roman'][/font][font='times new roman']霍尔([/font][font='times new roman']Stefan W. Hell[/font][font='times new roman'])提出。他的想法是通过将激发光束与一个特殊的抑制光束结合,从而实现对荧光标记物的光抑制,[/font][font='times new roman']通过受激辐射淬灭光斑外围的荧光分子,[/font][font='times new roman']使其在空间上变得更加紧凑,[/font][font='times new roman']减少[/font][font='times new roman']PSF[/font][font='times new roman']从而提高分辨率。[/font][font='times new roman']我们也叫“甜甜圈”技术。[/font][font='times new roman']STED[/font][font='times new roman']显微镜背后基本思想就是利用非线性光学设计一个低于阿贝衍射极限的更小[/font][font='times new roman']PSF[/font][font='times new roman']。[/font][font='times new roman']分辨率与[/font][font='times new roman']STED[/font][font='times new roman']光强有关,提高[/font][font='times new roman']STED[/font][font='times new roman']光的强度可以使荧光光斑焦[/font][font='times new roman']点中心直径趋于[/font][font='times new roman']0[/font][font='times new roman'],但是实际应用中,光损伤较大,[/font][font='times new roman']STED[/font][font='times new roman']光强不可能无限增加,顾[/font][font='times new roman']其分辨率[/font][font='times new roman']最高[/font][font='times new roman']可达到[/font][font='times new roman']3[/font][font='times new roman']0[/font][font='times new roman']nm[/font][font='times new roman']左右[/font][font='times new roman']。[/font][font='times new roman']目前的[/font][font='times new roman']STED[/font][font='times new roman']只能应用于较薄的组织器官或细胞,光毒性较强,成像厚度有限不太适合活体或活细胞长时间成像。[/font][font='times new roman']STED[/font][font='times new roman']光路较为复杂,对系统稳定性要求较高。[/font][font='times new roman'][b]2.3 [/b][/font][font='times new roman'][b]单分子定位显微镜[/b][/font][font='times new roman']单分子定位显微镜[/font][font='times new roman']中荧光标记的单个分子被分别激发和检测。单分子的中心可以以极高的精度确定从而实现高分辨率,包括光敏定位显微镜([/font][font='times new roman']Photoactivation Localization Microscopy[/font][font='times new roman'],[/font][font='times new roman']PALM[/font][font='times new roman'])和随机光学重建显微镜([/font][font='times new roman']Stochastic Optical Reconstruction Microscopy[/font][font='times new roman'],[/font][font='times new roman']STORM[/font][font='times new roman'])。[/font][font='times new roman']PALM[/font][font='times new roman']的历史可以追溯到[/font][font='times new roman']2006[/font][font='times new roman']年,由埃里克[/font][font='times new roman'][/font][font='times new roman']贝兹([/font][font='times new roman']Eric Betzig[/font][font='times new roman'])和哈拉尔德[/font][font='times new roman'][/font][font='times new roman']赫斯([/font][font='times new roman']Harald Hess[/font][font='times new roman'])提出了单分子定位这一概念。在[/font][font='times new roman']PALM[/font][font='times new roman']中,样品中的分子被标记上特定的荧光染料。这些染料可以通过光激活从一个基态转变到一个激发态,此过程可通过使用激活光(通常是紫外光)来实现。同期[/font][font='times new roman']STORM[/font][font='times new roman']的成像技术也发展起来,代表科学家是华人庄小威。[/font][font='times new roman']STORM[/font][font='times new roman']的工作原理与[/font][font='times new roman']PALM[/font][font='times new roman']类似,是通过特殊的分子标记和随机活性化,实现单分子定位进而实现超高分辨率成像。具有光激活能力的标记物通常在某种光照条件下会发光,但也会在某一时刻被随机地熄灭。这种随机光熄灭是[/font][font='times new roman']PALM[/font][font='times new roman']技术的关键,因为它允许在不同时间点捕获标记物的位置。通过记录标记物的位置,可以得到它们的坐标。这一过程需要在短时间内多次拍摄样品,以获得足够多的数据点。最后,通过将多个标记物的坐标叠加在一起,可以生成高分辨率的图像。这种以成像时间换取空间分辨率的形式,使得[/font][font='times new roman']PALM[/font][font='times new roman']或[/font][font='times new roman']STORM[/font][font='times new roman']的分辨率通常能够达到数十纳米。[/font][font='times new roman'][b]3 [/b][/font][font='times new roman'][b]应用领域和未来发展[/b][/font][font='times new roman']超高分辨显微镜可以探索微观世界的无限可能性,已经彻底改变了科学研究的方式。在细胞生物学领域,它被用于研究[/font][font='times new roman']亚细胞结构,如微丝、微管、肌动蛋白等,[/font][font='times new roman']细胞器[/font][font='times new roman']如线粒体、溶酶体等,[/font][font='times new roman']分子分布和细胞膜动态、观察蛋白质的相互作用;在神经科学领域,它可用于观察神经元的亚细胞结构和突触的细节,有助于解剖和理解神经系统的结构和功能,以及神经系统相关疾病的机制;在癌症研究领域,被用于研究癌细胞的特征、蛋白质分布以及肿瘤微环境,这对于癌症的早期诊断和治疗规划非常重要;在材料科学领域,它被用于研究纳米材料的结构和性质、帮助科学家精确控制和制备纳米结构;在药物研发领域,它可用于研究药物靶标蛋白的定位和与其他分子的相互作用,这对于药物设计和筛选非常重要[/font][font='times new roman'];在微生物领域,对于研究细菌[/font][font='times new roman']结构变化至关重要,规避了电子显微镜无法进行活体成像等弊端,可以更加推进微生物学发展。[/font][font='times new roman']当然,[/font][font='times new roman']超[/font][font='times new roman']高[/font][font='times new roman']分辨成像技术[/font][font='times new roman']也有一定的挑战。超高分辨成像技术[/font][font='times new roman']通常需要高度复杂的设备和精密的校准,这使得其设备成本相对较高,[/font][font='times new roman']再加上样本制备的困难,[/font][font='times new roman']限制了其广泛应用。[/font][font='times new roman']样品准备在超高分辨成像中具有重要作用,新的标记技术和荧光探针的发展将提高成像的灵敏度和特异性[/font][font='times new roman'],[/font][font='times new roman']开发更友好、无损伤的样品准备方法,以减少对样品的干扰[/font][font='times new roman'],[/font][font='times new roman']甚至[/font][font='times new roman']包括无标记成像技术以减少样品标记的需求。开源软件和自动化工作流程将使超高分辨成像技术更易于使用和共享,促进科学研究的进展。[/font][font='times new roman']超高分辨技术通常对于三维成像和大样本的深度成像有限制,需要克服分辨率和深度之间的权衡。[/font][font='times new roman']同时超高分辨[/font][font='times new roman']成像的时间分辨率还可以继续提升[/font][font='times new roman']。[/font][font='times new roman']虽然[/font][font='times new roman']目前[/font][font='times new roman']SIM[/font][font='times new roman']和[/font][font='times new roman']minflux[/font][font='times new roman']更适合[/font][font='times new roman']观察[/font][font='times new roman']活细胞[/font][font='times new roman']动态过程,但时间分辨率的提高仍然是一个挑战,特别是对于极短时间尺度的现象[/font][font='times new roman'],[/font][font='times new roman']这将使科学家能够更深入地探索微观世界,并获得更多信息。[/font][font='times new roman']随着技术的不断进步,[/font][font='times new roman']超高分辨[/font][font='times new roman']成像有望在[/font][font='times new roman']包括临床医学[/font][font='times new roman']等[/font][font='times new roman']更多领域得到广泛应用[/font][font='times new roman'],未[/font][font='times new roman']来如果能实现超高分辨的动物甚至人的[/font][font='times new roman']活体成像,减少样品固定和处理的需求,允许观察生物过程的实时发生[/font][font='times new roman']将会更有现实意义[/font][font='times new roman']。[/font][font='times new roman']并且在科学研究的需求下,[/font][font='times new roman']多模态[/font][font='times new roman']或多尺度[/font][font='times new roman']成像将[/font][font='times new roman']与[/font][font='times new roman']不同[/font][font='times new roman']的[/font][font='times new roman']超高分辨[/font][font='times new roman']技术相结合,[/font][font='times new roman']例如,结合光学成像和质谱成像[/font][font='times new roman'],[/font][font='times new roman']从分子水平到组织水平[/font][font='times new roman']提供[/font][font='times new roman']生命活动[/font][font='times new roman']更全面的信息。[/font][font='times new roman']也可以[/font][font='times new roman']发展高通量的样品处理和成像技术,以便更快速地获得大规模的数据。[/font][font='times new roman']超高分辨[/font][font='times new roman']成像生成的数据量巨大,处理和分析这些大数据需要强大的计算资源和高效的算法。数据存储和传输也是挑战。[/font][font='times new roman']超高分辨[/font][font='times new roman']成像数据可能受到噪声和伪迹的影响,这需要高级的图像处理技术来减少其影响,以获得准确的图像。数据分析通常需要复杂的算法和数学模型,需要专业知识和技能。对于某些应用,如神经科学中的活体成像,需要实时数据分析,这增加了挑战。深度学习和人工智能技术[/font][font='times new roman']有望[/font][font='times new roman']在数据分析中发挥越来越重要的作用,[/font][font='times new roman']实现[/font][font='times new roman']自动处理和解释图像数据。发展实时数据分析技术,使科学家能够在数据采集过程中获得及时反馈。开发更易用的高级图像处理工具,使非专业用户也能够进行数据分析。结合不同成像技术和数据源的信息,以提供更全面的信息。开发自动化和高通量的数据分析工作流程,以应对大规模数据的挑战。促进数据共享和开放科学,以促进合作和加速科学研究的进展。未来,随着计算能力的提高和新技术的引入,[/font][font='times new roman']超高分辨[/font][font='times new roman']成像数据分析将变得更加强大和高效。这将有助于更深入地理解微观世界,并在生物学、医学、材料科学等领域推动创新和发展。[/font][font='times new roman']总的来说,尽管[/font][font='times new roman']超高分辨[/font][font='times new roman']成像面临一些挑战,但其前景充满希望。未来的发展将使这一领域更加强大,有望在科学研究和实际应用中提供更多的机会和洞察力。[/font][font='times new roman'][b]4 [/b][/font][font='times new roman'][b]结论和展望[/b][/font][font='times new roman']超高分辨显微镜的成像原理基于破解传统显微镜的分辨极限,通过结构照明、图像重建[/font][font='times new roman']和单分子成像等策略,实现对微小结构的高分辨率成像。这一技术的应用领域包括生物学、材料科学、纳米技术和医学等,有望推动科学研究的进一步发展。超高分辨显微镜已经在生物医学领域取得了显著的突破,使研究人员更深入地理解细胞和分子结构。然而,仍然存在挑战,包括样品准备和数据分析的复杂性。未来,我们可以期待更多技术的发展,以进一步提高分辨率和扩大应用领域。[/font][font='times new roman']随着技术的不断发展,我们可以期待更多超分辨显微镜技术的突破,如更高分辨率、更高灵敏度和更快成像速度。超分辨显微镜的应用也将继续扩展到新的领域,如药物研发、个性化医学和环境科学。它将为我们提供更多工具来解决生物学的重要问题,如疾病机制、药物研发和生态系统健康。总之,超分辨显微镜技术的未来展望是光明的,它将继续推动科学研究向前迈进,揭示微观世界的微小奥秘,为改善生活质量和解决全球挑战做出贡献。这个领域的不断创新将激发更多科学家的热情,共同追求更深入的科学知识和更广泛的应用。[/font][font='times new roman'][b]参考文献[/b][/font][font='times new roman']Hell[/font][font='times new roman'] [/font][font='times new roman']S [/font][font='times new roman']W[/font][font='times new roman'].[/font][font='times new roman']Far-field[/font][font='times new roman'] [/font][font='times new roman']optical[/font][font='times new roman'] [/font][font='times new roman']nanoscopy[/font][font='times new roman'][J][/font][font='times new roman'].[/font][font='times new roman']Science[/font][font='times new roman'],[/font][font='times new roman']2007[/font][font='times new roman'],[/font][font='times new roman']316(5828)[/font][font='times new roman']:[/font][font='times new roman']1153-1158[/font][font='times new roman']Hell[/font][font='times new roman'] [/font][font='times new roman']S W[/font][font='times new roman'],[/font][font='times new roman']Wichmann J[/font][font='times new roman'].[/font][font='times new roman']Breaking[/font][font='times new roman'] [/font][font='times new roman']the diffraction[/font][font='times new roman'] [/font][font='times new roman']resolution[/font][font='times new roman'] [/font][font='times new roman']limit[/font][font='times new roman'] [/font][font='times new roman']by stimulated[/font][font='times new roman']-[/font][font='times new roman']emission[/font][font='times new roman']-[/font][font='times new roman']depletion fluorescence[/font][font='times new roman'] [/font][font='times new roman']microscopy[J][/font][font='times new roman'].[/font][font='times new roman']Optics[/font][font='times new roman'] [/font][font='times new roman']Letters[/font][font='times new roman'],[/font][font='times new roman']1994[/font][font='times new roman'],[/font][font='times new roman']19(11)[/font][font='times new roman']:[/font][font='times new roman']780-782[/font][font='times new roman']Dani A[/font][font='times new roman'],[/font][font='times new roman']Huang B[/font][font='times new roman'],[/font][font='times new roman']Bergan J[/font][font='times new roman'],[/font][font='times new roman']et[/font][font='times new roman'] [/font][font='times new roman']a1[/font][font='times new roman'].[/font][font='times new roman'] Super-resolution[/font][font='times new roman'] [/font][font='times new roman']imaging of chemical synapses[/font][font='times new roman'] [/font][font='times new roman']in the brain[J][/font][font='times new roman'].[/font][font='times new roman']Neuron[/font][font='times new roman'],[/font][font='times new roman']2010[/font][font='times new roman'],[/font][font='times new roman']68(5)[/font][font='times new roman']:[/font][font='times new roman']843[/font][font='times new roman']—[/font][font='times new roman']856[/font][font='times new roman']PATTERSON[/font][font='times new roman'] [/font][font='times new roman']G[/font][font='times new roman'],[/font][font='times new roman']DAVIDSON[/font][font='times new roman'] [/font][font='times new roman']M[/font][font='times new roman'],[/font][font='times new roman']MANLEY[/font][font='times new roman'] [/font][font='times new roman']S[/font][font='times new roman'],[/font][font='times new roman']et[/font][font='times new roman'] [/font][font='times new roman']al[/font][font='times new roman']. [/font][font='times new roman']Superresolution[/font][font='times new roman'] imaging using single-molecule localization[/font][font='times new roman'][J][/font][font='times new roman'].[/font][font='times new roman']A[/font][font='times new roman']nnual Review of Chemistry[/font][font='times new roman'],[/font][font='times new roman']2010[/font][font='times new roman'],[/font][font='times new roman']6[/font][font='times new roman']1:345-367[/font]
高分辨率质谱有哪些
哪位知道,目前原子力显微镜在国产及进口方面最高的分辨率分别是多少?是哪个品牌的?原子力显微镜目前是否可以达到横向0.1纳米、纵向0.01纳米的分辨率?
①照明源不同。电镜所用的照明源是电子枪发出的电子流,而光镜的照明源是可见光(日光或灯光),由于电子流的波长远短于光波波长,故电镜的放大及分辨率显著地高于光镜。 ②透镜不同。电镜中起放大作用的物镜是电磁透镜(能在中央部位产生磁场的环形电磁线圈),而光镜的物镜则是玻璃磨制而成的光学透镜。电镜中的电磁透镜共有三组,分别与光镜中聚光镜、物镜和目镜的功能相当。 ③成像原理不同。在电镜中,作用于被检样品的电子束经电磁透镜放大后打到荧光屏上成像或作用于感光胶片成像。其电子浓淡的差别产生的机理是,电子束作用于被检样品时,入射电子与物质的原子发生碰撞产生散射,由于样品不同部位对电子有不同散射度,故样品电子像以浓淡呈现。而光镜中样品的物像以亮度差呈现,它是由被检样品的不同结构吸收光线多少的不同所造成的。 ④所用标本制备方式不同,电镜观察所用组织细胞标本的制备程序较复杂,技术难度和费用都较高,在取材、固定、脱水和包埋等环节上需要特殊的试剂和操作,最后还需将包埋好的组织块放人超薄切片机切成50~100nm厚的超薄标本片。而光镜观察的标本则一般置于载玻片上,如普通组织切片标本、细胞涂片标本、组织压片标本和细胞滴片标本等。 电子显微镜由电子流代替可见光,由磁场代替透镜,让电子的运动代替。光子“数码显微镜”实际上就是在光学显微镜的基础上加了一个数码成像装置,可以将显微镜所成的像,在电脑屏幕上直接显示出来(Intel就推出过一款类似儿童玩具的“数码显微镜”),其基础还是光学显微镜,和电子显微镜的成像原理是有根本区别的。在这里我们要区别清楚分辨率和放大倍数的问题。细微物体在放大成像时,其最高分辨率取决于所反射的光波的波长,波长越短,分辨率就越高,电子显微镜是利用了波长比普通可见光短得多的X射线成像,当然具备很高的分辨率,而普通“数码显微镜”的放大倍数可以很大,但分辨率是无法提高的。 光学显微镜的分辨率与光波的波长有关。对于接近和小于光波波长的物体光学显微镜就无能为力了。电子运动的波长比光波波长短的多,就可以看到更细小的物体。光学显微镜是由一组光学镜头组成的放大成像系统,而电子显微镜由电子流代替可见光,由磁场代替透镜,让电子的运动代替光子,这样就可以看到比光学系统能看到的更小的物体。 所谓“数码显微镜”实际上就是在光学显微镜的基础上加了一个数码成像装置,可以将显微镜所成的像,在电脑屏幕上直接显示出来(Intel就推出过一款类似儿童玩具的“数码显微镜”),其基础还是光学显微镜,和电子显微镜的成像原理是有根本区别的。在这里我们要区别清楚分辨率和放大倍数的问题。细微物体在放大成像时,其最高分辨率取决于所反射的光波的波长,波长越短,分辨率就越高,电子显微镜是利用了波长比普通可见光短得多的X射线成像,当然具备很高的分辨率,而普通“数码显微镜”的放大倍数可以很大,但分辨率是无法提高的。
[em02] 由国家环境分析测试中心承建的二垩英实验室的主要设备,高分辨率质谱已经吊装完毕拉!一台将近1.4吨重的东西被顺利的吊上了三楼的实验室,真是不容易呀![em02]
现在红外显微镜最好的空间分辨率可以达到多少?拉曼显微镜的又是多少?我看了好几家著名厂家的仪器很少有这个数据的,大部分都是说有高的空间分辨率,但就是没给出一个具体的数值,我想了解一下这个数值最好的是多少?谢谢!有的仪器的介绍中还说到一个像素分辨率,这个概念和空间分辨率是一个吗?如果哪位有相关的资料的话能共享的话就更好了!谢谢!
[color=#444444]大家有没有遇到过 高分辨率质谱出现比分子离子峰的分子量还大的峰?[/color][color=#444444]这三个峰每相邻都差大概28,算了一下明显不是2M峰,【M+1】为479.9159, 3个大峰是683.5448, 711.5760, 739.6082.[/color][color=#444444]结构式一个喹啉环再连上一个 I 和1个1,2-二硫环戊4-烯-3-硫酮的片段。[/color][color=#444444]具体结构就不画啦![/color][color=#444444]谢谢大家啦[/color]
[color=#0162f4][size=4]新进了一台原子力显微镜,配的扫描器是20μm的,不知道分辨率是多少?我也检索了关于原子力显微镜的分辨率的一些问题,但不知道原子力的分辨率是不是与扫描器有关,不同扫描器除了扫描范围不一样,得到的扫描图像的精度也不一样,是不是就是说分辨率不一样呢?关于分辨率的问题常常都在困扰这我,这个问题说简单很简单,说复杂也觉得挺复杂的,请教各位,原子力显微镜分辨率与扫描器的关系如何?如果我希望能看到更高精度的图像,是不是需要升级我现在的20μm的扫描器?衷心感谢各位的解答![/size][/color]
交叉极化为何可以提高分辨率?它的原理是什么?
各位论坛的老师你们好,学生刚接触此方向,请教个有关超高分辨率傅里叶光谱仪的问题:超高分辨率傅里叶红外光谱仪的意义在哪里?具体实现起来有哪些技术难度不能被攻克?
高分辨率质谱有什么优势?只是相邻的峰之间分离度高了吗?
现在的科学技术发展迅速,也不知道现在最高分辨率的天平是多少?
扫描电镜(SEM)是介于透射电镜和光学显微镜之间的一种微观形貌观察手段,可直接利用样品表面材料的物质性能进行微观成像。[align=center][b][color=#ff0000]扫描电镜的优点[/color][/b][/align]①有较高的放大倍数,20-20万倍之间连续可调;②有很大的景深,视野大,成像富有立体感,可直接观察各种试样凹凸不平表面的细微结构;③试样制备简单。[align=center][b][color=#ff0000]影响扫描电镜(SEM)的几大要素[/color][/b][/align][b][color=#ff0000]分辨率[/color][/b]影响扫描电镜的分辨本领的主要因素有:A. 入射电子束束斑直径:为扫描电镜分辨本领的极限。一般,热阴极电子枪的最小束斑直径可缩小到6nm,场发射电子枪可使束斑直径小于3nm。B. 入射电子束在样品中的扩展效应:扩散程度取决于入射束电子能量和样品原子序数的高低。入射束能量越高,样品原子序数越小,则电子束作用体积越大,产生信号的区域随电子束的扩散而增大,从而降低了分辨率.C. 成像方式及所用的调制信号:当以二次电子为调制信号时,由于其能量低(小于50 eV),平均自由程短(10~100 nm左右),只有在表层50~100 nm的深度范围内的二次电子才能逸出样品表面, 发生散射次数很有限,基本未向侧向扩展,因此,二次电子像分辨率约等于束斑直径。当以背散射电子为调制信号时,由于背散射电子能量比较高,穿透能力强,可从样品中较深的区域逸出(约为有效作用深度的30%左右)。在此深度范围,入射电子已有了相当宽的侧向扩展,所以背散射电子像分辨率要比二次电子像低,一般在500~2000nm左右。如果以吸收电子、X射线、阴极荧光、束感生电导或电位等作为调制信号的其他操作方式,由于信号来自整个电子束散射区域,所得扫描像的分辨率都比较低,一般在l 000 nm或l0000nm以上不等。[b][color=#ff0000]放大倍数[/color][/b]扫描电镜的放大倍数可表示为M =Ac/As式中,Ac—荧光屏上图像的边长;As—电子束在样品上的扫描振幅。一般地,Ac 是固定的(通常为100 mm),则可通过改变As 来改变放大倍数。目前,大多数商品扫描电镜放大倍数为20~20,000倍,介于光学显微镜和透射电镜之间,即扫描电镜弥补了光学显微镜和透射电镜放大倍数的空挡。[b][color=#ff0000]景 深[/color][/b]景深是指焦点前后的一个距离范围,该范围内所有物点所成的图像符合分辨率要求,可以成清晰的图像;也即,景深是可以被看清的距离范围。扫描电子显微镜的景深比透射电子显微镜大10倍,比光学显微镜大几百倍。由于图像景深大,所得扫描电子像富有立体感。电子束的景深取决于临界分辨本领d0和电子束入射半角αc。其中,临界分辨本领与放大倍数有关,因人眼的分辨本领约为0.2 mm, 放大后,要使人感觉物像清晰,必须使电子束的分辨率高于临界分辨率d0 :电子束的入射角可通过改变光阑尺寸和工作距离来调整,用小尺寸的光阑和大的工作距离可获得小的入射电子角。[b][color=#ff0000]衬 度[/color][/b]包括:表面形貌衬度和原子序数衬度。表面形貌衬度由试样表面的不平整性引起。原子序数衬度指扫描电子束入射试祥时产生的背散射电子、吸收电子、X射线,对微区内原子序数的差异相当敏感。原子序数越大,图像越亮。二次电子受原子序数的影响较小。高分子中各组分之间的平均原子序数差别不大;所以只有—些特殊的高分子多相体系才能利用这种衬度成像。
显微技术原理显微镜的放大效能是由所用光波长短和物镜数值口径决定,缩短使用的光波波长或增加数值口径可以提高分辨率,可见光的光波幅度比较窄,紫外光波长短可以提高分辨率,但不能用肉眼直接观察。所以利用减小光波长来提高光学显微镜分辨率是有限的,提高数值口径是提高分辨率的理想措施。要增加数值口径,可以提高介质折射率,当空气为介质时折射率为1,而香柏油的折射率为1.51,和载玻片的玻璃折射率1.52 相近,这样光线可以不发生折射而直接通过载片、香伯油进入物镜,从而提高分辨率。显微镜总的放大倍数是目镜和物镜放大倍数的乘积,而物镜的放大倍数越高,分辨率越高
2006年度德国“未来奖”于23日揭晓,凭借发明突破200纳米“阿贝极限”的光学显微镜,德国马克斯-普朗克学会生物物理化学研究所所长施特芬黑尔获得了这一荣誉。 一年一度的“未来奖”是德国最重要的科学奖。黑尔在接过德国总统克勒颁发的奖杯时表示,将把所获得的25万欧元奖金作为一个科技公司的启动资金,为将来研究更好的显微镜奠定基础。18世纪70年代,德国物理学家恩斯特阿贝发现,可见光由于其波动特性会发生衍射,因而光束不能无限聚焦。根据这个阿贝定律,可见光能聚焦的最小直径是光波波长的三分之一,也就是200纳米。一个多世纪以来,200纳米的“阿贝极限”一直被认为是光学显微镜理论上的分辨率极限,小于这个尺寸的物体必须借助电子显微镜或隧道扫描显微镜才能观察。但黑尔等科学家却巧妙地借助脉冲激光的作用,突破了“阿贝极限”。他们发明的新型的光学显微镜能够观察20纳米左右的微小生物。据悉,这种新型光学显微镜将于明年投放市场,预计价格在80万欧元左右。
看书上说:不能通过增加光栅刻线密度来提高分辨率,为啥???