GB-T 13255.1-2009 工业用己内酰胺试验方法 第1部分:50%水溶液色度的测定 分光光度法GB-T 13255.2-2009 工业用己内酰胺试验方法 第2部分:结晶点的测定GB-T 13255.3-2009 工业用己内酰胺试验方法 第3部分:高锰酸钾吸收值的测定 分光光度法GB-T 13255.4-2009 工业用己内酰胺试验方法 第4部分:挥发性碱含量的测定 蒸馏后滴定法GB-T 13255.5-2009 工业用己内酰胺试验方法 第5部分:290nm波长处吸光度的测定GB-T 13255.6-2009 工业用己内酰胺试验方法 第6部分:酸度或碱度的测定GB-T 13255.7-2009 工业用己内酰胺试验方法 第7部分:铁含量的测定GB-T 13255.8-2009 工业用己内酰胺试验方法 第8部分:环己酮肟含量的测定[~190803~][~190804~][~190805~][~190806~][~190807~][~190808~][~190809~][~190810~]

空气中己内酰胺的测定方法 羟胺-氯化铁比色法 羟胺-氯化铁比色法1 原理已内酰胺和碱性羟胺反应生成异羟肟酸,再与三价铁反应形成红棕色络合物,比色定量。2 仪器2.1 冲击式吸收管。2.2 抽气机。2.3 流量计,0~5L/min。2.4 具塞比色管,10ml。2.5 水浴锅。2.6 分光光度计。3 试剂3.1 硫酸羟胺溶液,C〔(NH2OH)2H2SO4〕=2mol/L。3.2 氢氧化钠溶液,C(NaOH)=5mol/L。3.3 盐酸溶液,C(HCl)=2.5mol/L。3.4 盐酸溶液,C(HCl)=0.1mol/L。3.5 氯化铁溶液,200g/L。取20g氯化铁(FeCl36H2O)溶于盐酸溶液(3.4),并稀释至100ml。有混浊时过滤。3.6 标准溶液:称取0.5000g己内酰胺,用水溶解稀释至100ml,此标准储备液1ml含5mg己内酰胺,冰箱可保存1个月。临用前取5ml储备液,用水稀释至50ml,配成1ml含500?g己内酰胺标准溶液。4 采样串联两个各内装5ml水的冲击式吸收管,以3L/min的速度抽取15L空气。5 分析步骤5.1 对照试验:同采样,将吸收管装好吸收液带至现场,但不抽取空气,照样品分析。5.2 样品处理:用吸收管中的吸收液洗涤进气管内壁三次,取1.5ml溶液于10ml具塞比色管中供测定。5.3 标准曲线的绘制:取7只10ml具塞比色管,按表1配制标准管。表1 己内酰胺标准管的配制[img]http://ng1.17img.cn/bbsfiles/images/2007/05/200705201417_52375_1625938_3.jpg[/img]5.4 测定:向样品管和标准管各加2ml硫酸羟胺溶液(3.1)和0.5ml氢氧化钠溶液(3.2),摇匀,加塞。于沸水浴中加热75min。冷却后加1ml盐酸溶液(3.3),摇匀,再加入1ml氯化铁溶液(3.5),振摇1min后于波长500nm下比色测量吸光度。以标准管己内酰胺含量对吸光度(扣除空白吸光度)作图,绘制标准曲线。样品的吸光度减去空白后,由标准曲线查出己内酰胺含量。6 计算X=5(C1+C2)/1.5V0式中:X——空气中己内酰胺浓度,mg/m3;C1、C2——分别为第1,第2吸收管所取样品中己内酰胺的含量,微克;V0——标准状况下的样品体积,L。7 说明7.1 本法的检测限为20微克/1.5ml。当己内酰胺浓度分别为25、100和500微克时,变异系数分别为1.7%、0.8%和1.3%。合并变异系数为1.23%。采样5min,取1.5ml样品分析,其测定范围为4.5~110mg/m3。7.2 如空气中己内酰胺仅有蒸气和烟状态时,可用多孔玻璃板吸收管采样,流量为1L/min。7.3 铁络合物颜色稳定性较差,显色后20min内比色完毕。如果样品较多可分批加氯化铁溶液(3.5)。加氯化铁后应充分强烈振摇1min以便把气泡全部赶走。
IQTC15C13己内酰胺迁移量能力验证有人做么?
哪位测试过空气中己内酰胺?怎么进样的?
一个含有苯,环己烷,己内酰胺的样品如何用[url=https://insevent.instrument.com.cn/t/Mp]气相色谱仪[/url]分析出三种物质含量?
包装材料中己内酰胺征求意见稿,大家看看有没有什么问题。目前我的问题是检测标准中采用mg/kg作为单位,而产品中还是mg/L为单位,到时执行起来还是有问题
碘化钠的甲酰胺溶液的介电常数为大致是多少,比如碘化钠与甲酰胺的物质的量的比为1:10,氯化钠的水溶液介电常数的范围是多少。[em0808]
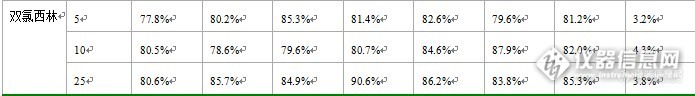
LC-MS/MS测定动物组织中10种β-内酰胺类抗生素残留 摘要:采用高效液相色谱-串联质谱法(LC-MS/MS)测定动物组织中青霉素G、青霉素V、阿莫西林、氨苄西林、苯唑青霉素、萘夫西林、双氯西林、哌拉西林、头孢氨苄、头孢唑林等10种β-内酰胺类抗生素残留量,以青霉素G-D7为内标。β-内酰胺类抗生素残留物用乙腈水溶液提取,用艾杰尔PEP-2固相萃取小柱净化,采用高效液相色谱-串联质谱测定,使用内标法定量。本方法采用5ug/kg、10ug/kg、25ug/kg,3个添加浓度,每个浓度添加6个平行样,上述10种β-内酰胺类抗生素的回收率在平均在70%-110%,相对偏差小于10%。关键词:液相色谱串联质谱法;β-内酰胺类药物;动物组织 β-内酰胺类抗生素(β-lactams)是指化学结构中具有β-内酰胺环的一类抗生素.其侧链的改变形成了许多不同抗菌谱和抗菌作用的抗生素,包括临床常用的青霉素与头孢菌素。此类药物广泛用于产肉动物的呼吸、肠胃、泌尿生殖和皮肤病毒感染的治疗和预防,它们的使用会引起动物源性食品中兽药残留的存在,这种残留将对青霉素过敏的人产生健康危害。更为重要的是,抗生素被长期低剂量摄入健康人肠道,会破坏健康人肠道正常菌群环境,导致人体免疫力的降低,而且长期使用会产生抗药性,危害人们的身体健康。欧盟、美国、日本、中国、国际食品法典委员会都对动物源食品中β-内酰胺类抗生素药物残留规定了最大残留限量。为确保消费者的食品安全,世界各地均对动物组织中β-内酰胺类抗生素有允许最大残留量的要求。本研究建立了采用高效液相色谱三重四级杆质谱法对动物组织中10种β-内酰胺类抗生素残留的检测方法,具有更高的回收率、稳定性和实用性。1. 材料与方法1.1仪器与试剂1.1.1试剂和材料乙腈、甲醇:德国默克,色谱纯;甲酸:色谱纯;氯化钠:分析纯;氢氧化钠:分析纯;磷酸二氢钾:分析纯;磷酸氢二钾:分析纯;固相萃取柱:艾杰尔PEP-2(500 mg/6mL)。标准品:购自DR公司。0.1 mol/L氢氧化钠:称取4g氢氧化钠,并用水稀释至1000mL。0.05mol/L 磷酸盐缓冲溶液(pH 8.5)。称取8.7 g磷酸氢二钾,超纯水溶解,稀释至1000mL,调节pH 至8.5±0.1。标准储备溶液:分别称取约0.01 g(精确至0.001 g)标准品,分别用乙腈:水溶液(1+9)溶解定容至[font=Times New Rom
乳及乳制品中舒巴坦敏感β-内酰胺酶类药物检验方法指定检验方法4.乳及乳制品中舒巴坦敏感β-内酰胺酶类药物检验方法杯碟法1、范围本标准规定了乳及乳制品中舒巴坦敏感β-内酰胺酶类药物的检验方法。本标准适用于乳及乳制品中舒巴坦敏感β-内酰胺酶类物质的检验。本方法的检出限为4U/mL。2、原理该方法采用对青霉素类药物绝对敏感的标准菌株,利用舒巴坦特异性抑制β-内酰胺酶的活性,并加入青霉素作为对照,通过比对加入β-内酰胺酶抑制剂与未加入抑制剂的样品所产生的抑制圈的大小来间接测定样品是否含有β-内酰胺酶类药物。3、设备和材料除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:3.1 抑菌圈测量仪或测量尺。3.2恒温培养箱:36℃±1℃。3.3 高压灭菌器。3.4 无菌培养皿:内径90 mm,底部平整光滑的玻璃皿,具陶瓦盖。3.5 无菌牛津杯:外径(8.0士0.1) mm,内径(6.0士0.1) mm,高度(10.0士0.1) mm。3.6 麦氏比浊仪或标准比浊管。3.7 pH计。3.8 无菌吸管:1mL(0.01mL刻度值),10mL(0.1mL刻度值)。3.9 加样器:5μL~20μL,20μL -200μL及配套吸头。4、培养基和试剂 除另有规定外,所用试剂均为分析纯,水为GB/T6682中规定的三级水。4.1 试验菌种:藤黄微球菌(Micrococcus luteus) CMCC(B) 28001,传代次数不得超过14次。4.2 磷酸盐缓冲溶液:按附录A中A.1规定。4.3生理盐水(8.5 g/L):按附录A中A.2规定。4.4 青霉素标准溶液:按附录A中A.3规定。4.5 β-内酰胺酶标准溶液:按附录A中A.4规定。4.6 舒巴坦标准溶液按附录A中A.5规定。。4.7 营养琼脂培养基:按附录A中A.6规定。4.8 抗生素检测用培养基Ⅱ:按附录A中A.7规定。5、操作步骤5.1 菌悬液的制备将藤黄微球菌接种于营养琼脂斜面上,经36士1℃培养18h-24 h,用生理盐水洗下菌苔即为菌悬液,测定菌悬液浓度,终浓度应大于1×1010 CFU/mL,4 ℃保存,贮存期限2周。5.2 样品的制备将待检样品充分混匀,取1 mL待检样品于1.5 mL离心管中共4管,分别标为:A、B、C、D,每个样品做三个平行,共12 管,同时每次检验应取纯水1 mL加入到1.5 mL离心管中作为对照。如样品为乳粉,则将乳粉按1:10的比例稀释。如样品为酸性乳制品,应调节pH值至6-7。5.3 检验用平板的制备取90mm灭菌玻璃培养皿,底层加10 mL灭菌的抗生素检测用培养基Ⅱ,凝固后上层加入5 mL含有浓度为1×108 CFU/mL藤黄微球菌的抗生素检测用培养基Ⅱ,凝固后备用。5.4 样品的测定按照下列顺序分别将青霉素标准溶液、β-内酰胺酶标准溶液、舒巴坦标准溶液加入到样品及纯水中:A 青霉素5 μL。B 舒巴坦25 μL、青霉素5 μL。C β-内酰胺酶25 μL、青霉素G5 μL。D β-内酰胺酶25 μL、舒巴坦25 μL、青霉素5 μL。混匀后,将上述A~D 试样各200 μL 加入放置于检验用平板上的4个无菌牛津杯中,36士1℃培养培养18~22 h ,测量抑菌圈直径。每个样品,取三次平行试验平均值。5.5 结果报告纯水样品结果应为:(A)、(B)、(D)均应产生抑菌圈;(A)的抑菌圈与(B)的抑菌圈相比,差异在3 mm以内(含3 mm),且重复性良好;(C)的抑菌圈小于(D)的抑菌圈,差异在3 mm以上(含3 mm),且重复性良好。如为此结果,则系统成立,可对样品结果进行如下判定:7.1 如果样品结果中(B)和、(D)均产生抑菌圈,且(C)与(D)抑菌圈差异在3 mm以上(含3 mm)时,可按7.1.1、7.1.2 判定结果。7.1.1(A)的抑菌圈小于(B)的抑菌圈差异在3 mm以上(含3 mm),且重复性良好,应判定该试样添加有β- 内酰胺酶,报告β- 内酰胺酶类药物检验结果阳性。7.1.2(A)的抑菌圈同(B)的抑菌圈差异小于3 mm,且重复性良好,应判定该试样未添加有β- 内酰胺酶,报告β- 内酰胺酶类药物检验结果阴性。7.2 如果(A)和(B)均不产生抑菌圈,应将样品稀释后再进行检测。附 录 A(规范性附录)培 养 基A.1 磷酸盐缓冲溶液(pH6.0)无水磷酸二氢钾8.0 g无水磷酸氢二钾2.0 g蒸馏水加至1000 mLA.2 生理盐水(8.5 g/L)氯化钠8.5 g蒸馏水1000 mL121℃高压灭菌15 min。A.3 青霉素标准溶液准确称取适量青霉素标准物质,用磷酸盐缓冲溶液溶解并定容为0.1mg/mL的标准溶液。当天配制,当天使用。A.4 β-内酰胺酶标准溶液准确量取或称取适量β-内酰胺酶标准物质,用磷酸盐缓冲溶液溶解并定容为16000 U/mL的标准溶液。当天配制,当天使用。A.5 舒巴坦标准溶液准确称取适量舒巴坦标准物质,用磷酸盐缓冲溶液溶解并定容为1 mg/mL的标准溶液,分装后-20 ℃保存备用,不可反复冻融使用。A.6 营养琼脂蛋白胨10 g牛肉膏3 g氯化钠5 g琼脂15-20 g蒸馏水1000 mL将上述成分加入蒸馏水中,搅混均匀,分装试管每管约5~8 mL,120℃高压灭菌15 min,灭菌后摆放斜面。A.7 抗生素检测培养基Ⅱ蛋白胨10 g牛肉浸膏3 g氯化钠5 g酵母膏3 g葡萄糖1 g琼脂14 g蒸馏水1000mL将上述成分加入蒸馏水中,搅混均匀,120 ℃高压灭菌15 min,其最终pH 值约为6.6。
各位大神,大家好。我要测试水溶液中的间苯二胺的浓度,这个气相色谱之前没有接触过。问之前的做过的,他直接水稀释进样。但貌似水溶液直接进样对仪器有损伤。请教大神,这个需要设计一个怎样的实验方案。我想萃取的话,萃取出来的间苯二胺就可以用乙醇作溶剂,若果萃取的话,要选择合适的萃取剂。主要是在线监测使用。谢谢大家。
附件牛乳中非法添加β-内酰胺酶检测方法随着国家对食品安全问题的关注和部分乳制品企业2010年无抗奶目标的提出,抗生素残留问题成为影响乳制品安全的重要因素之一。目前,青霉素作为β- 内酰胺类药物是治疗牛乳腺炎的首选药物,是牛奶中最常见的残留抗生素。由于国内多数乳品企业对抗生素残留超标的牛乳采取降价收购的原则,出于经济利益的驱动,一些不法奶站为了谋求自己的经济利益,人为的使用一些生物制剂去降解牛乳中残留的抗生素,生产人造“无抗奶”。2005年至今,已有数家公司公开宣称出售分解牛乳中残留抗生素的解抗剂。迄今为止,还没有针对这种人造“无抗奶”的相应检测方法、检测标准,无法从源头上监测、把控原奶质量。奶制品中三聚氰胺问题出现后,检科院按照国家局科技司的安排,对奶制品中可能的添加物进行了调查。经过前期的调研工作,初步判断市售解抗剂的主要成分是β-内酰胺酶,它是由革兰氏阳性细菌产生和分泌的,可选择性分解牛奶中残留的β- 内酰胺类抗生素。β-内酰胺酶为我国不允许使用的食品添加剂,该酶的使用掩盖了牛奶中实际含有的抗生素。β-内酰胺酶能够使青霉素内酰胺结构破坏而失去活性,导致青霉素、头孢菌素等抗生素类药物耐药性增高,从而大大降低了人们抵抗传染病的能力,给消费者的身体健康带来危害。微生物方法和理化方法均利用β-内酰胺酶能够裂解青霉素的β-内酰胺环形成青霉噻唑酸的原理检测乳制品中是否添加解抗剂。一、理化方法(一)高效液相色谱法1、间接法方法原理:利用β-内酰胺酶能够酶解青霉素的原理,向牛奶中添加一定量的青霉素,如果牛奶中存在一定浓度的β-内酰胺酶,那么青霉素经β-内酰胺酶酶解后浓度会减少,从而判断牛奶中是否存在β-内酰胺酶。实验步骤:称取20 g试样,在4℃、16000rpm条件下离心10 min。取下层清液10 g于50 mL塑料离心管,并将塑料离心管置于37℃水浴锅中振荡孵育30 min。向孵育后的离心管中加入无水乙醇15 mL。振荡提取30 min后离心,将上层清液过滤纸后收集于梨形瓶中。减压浓缩蒸发掉乙醇。向旋蒸后的梨形瓶中加入10 mL磷酸盐缓冲液(pH=8.5),涡旋1 min后调节pH为8.5。以1 mL/min的速度将提取液通过经过预处理的Oasis HLB固相萃取柱,用2 mL磷酸缓冲液(pH=8.5)淋洗萃取柱,再用2 mL水淋洗。最后用3 mL乙腈洗脱。将洗脱液在40℃下氮气吹干,用0.025 M磷酸盐缓冲液(pH=7.0)定容残渣至1 mL,待上机测定。色谱条件:色谱柱 Agilent Zorbax SB C18,4.6mm×150mm×5μm;流动相 甲醇/0.004 M磷酸二氢钾(pH=4.5)=40/60;检测波长 268 nm讨论:该方法只能给出定性结论即牛奶中是否含有β-内酰胺酶,而无法给出确切定量结果即牛奶中含有β-内酰胺酶的量(U/ml);前处理方法相对复杂、费时。2、直接法方法原理:牛乳中的青霉素钾在β-内酰胺酶的作用下,主要生成青霉噻唑酸钾,并伴随生成少量的青霉胺、青霉醛等物质。经去脂肪、蛋白等前处理后,可以将青霉噻唑酸钾提取出来,经高效液相色谱仪检测确认其是否存在,从而判定该牛乳是否为人造“无抗奶”。实验步骤:称取20 g试样,在4 ℃、16000 rpm条件下离心10 min。取下层清液10 g于50 mL塑料离心管,加入无水乙醇15 mL,振荡提取30 min后离心,取清液经0.45 μm的滤膜过滤,用高效液相色谱仪检测。标准溶液配制:称取0.01 g(精确至0.001 g)青霉素钾于100 ml容量瓶中,加入1ml市售抗生素分解剂,室温放置2h使青霉素钾酶解完全后用去离子水定容,得到青霉噻唑酸钾标准溶液,浓度100 μg/mL。根据实际情况稀释后使用。色谱条件:色谱柱 Agilent Zorbax SB C18,4.6mm×150mm×5μm;流动相 甲醇/0.004 M磷酸二氢钾(pH=4.5)=40/60;检测波长 230 nm讨论:该方法通过检测酶解产物青霉噻唑酸,只能给出定性结论即牛奶中是否含有β-内酰胺酶,而无法给出确切定量结果即牛奶中含有β-内酰胺酶的量(U/ml);青霉噻唑酸钾稳定性尚需进一步考察;实验成本较生物学方法高。
我收集了一点资料,希望大家来评价此方法[font=Verdana][color=#f10b00][size=4]1、间接法[/size][/color][color=#fd1289]方法原理:[/color] 利用β-内酰胺酶能够酶解青霉素的原理,向牛奶中添加一定量的青霉素,如果牛奶中存在一定浓度的β-内酰胺酶,那么青霉素经β-内酰胺酶酶解后浓度会减少,从而判断牛奶中是否存在β-内酰胺酶。[color=#fd1289]实验步骤:[/color] 称取20 g试样,在4℃、16000rpm条件下离心10 min。取下层清液10 g于50 mL塑离心管,并将塑料离心管置于37℃水浴锅中振荡孵育30 min。向孵育后的离心管中加入无水乙醇15mL。振荡提取30 min后离心,将上层清液过滤纸后收集于梨形瓶中。减压浓缩蒸发掉乙醇。向旋蒸后的梨形瓶中加入10 mL磷酸盐缓冲液(pH=8.5),涡旋1 min后调节pH为8.5。以1 L/min的速度将提取液通过经过预处理的Oasis HLB固相萃取柱,用2 mL磷酸缓冲液(pH=8.5)淋洗萃取柱,再用2 mL水淋洗。最后用3 mL乙腈洗脱。将洗脱液在40℃下氮气吹干,用0.025 M磷酸盐缓冲液(pH=7.0)定容残渣至1 mL,待上机测定。色谱条件:色谱柱 Agilent Zorbax SB C18,4.6mm×150mm×5μm;流动相 甲醇/0.004 M磷酸二氢钾(pH=4.5)=40/60;检测波长 268 nm[color=#fd1289]讨论:[/color] 该方法只能给出定性结论即牛奶中是否含有β-内酰胺酶,而无法给出确切定量结果即牛奶中含有β-内酰胺酶的量(U/ml);前处理方法相对复杂、费时。[/font]
1.酰卤酰卤 C-O吸收强,未共轭酰氯区间明:1815-1785 cm?1见强峰。 气态乙酰氟特,1869 cm?1附近有吸收声。共轭酰卤频稍降,共振减力常所致同。 芳酰氯强吸1800-1770,弱带近1750-1735中。 弱带成因Fermi振,C-O与低波倍频应。 2.羧酸 酐酸酐C-O伸缩,双谱带显特征,对称不对称成因。 饱和非环两强峰,1818与1750动;共轭频降共振功,1775至1720中。五元环频更高,张力作用显,琥珀酸酐例1865、1782同。 低频谱带五元强,伸缩振动其他详。非共轭直链1047见,环状频宽952至909,及1299至1176中。 3.酰胺和内酰 胺酰胺特征羰基显,酰胺Ⅰ谱带氢键连,物理状态定频偏。 伯酰胺N—H双带现,对称不对称分辨;仲内酰胺单带显,氢键频降少变迁。酰胺Ⅱ谱带弯振生,伯酰胺稀液低频清,浓液多重谱带呈。N—H伸缩频变多,溶剂状态谱不同,叔酰胺频稳氢键空。 C—N伸缩千四寻,N—H摇摆八至六,固态内酰胺强吸收,N—H伸缩三二动。六元环内酰胺C—O,一六五零处相逢;五元四元频更高,稠合频增二十到五十中。
[align=center][size=21px]β[/size][size=21px]- 内酰胺类药物检测国内标准比较解读[/size][/align][size=18px]β[/size][size=18px]-内酰胺类抗生素(β-lactams)[/size][size=18px]是[/size][size=18px]指[/size][size=18px]分子[/size][size=18px]结构中具有β-内酰胺环的一大类抗生[/size][size=18px]素,[/size][size=18px]主要包括[/size][size=18px]青霉素[/size][size=18px]类、[/size][size=18px]头孢[/size][size=18px]类[/size][size=18px],硫霉素类、单环β[/size][size=18px]-内酰胺类等。[/size][size=18px]这[/size][size=18px]类抗生素具有杀菌活性强、[/size][size=18px]毒性低、适应症广[/size][size=18px]等[/size][size=18px]优点[/size][size=18px],[/size][size=18px]在我国动物[/size][size=18px]养殖领域[/size][size=18px]应用非常广泛,为促进畜牧业健康发展提供了重要保障。但抗生素的长期使用、滥用或不[/size][size=18px]遵守[/size][size=18px]休药期使用[/size][size=18px]容易导致[/size][size=18px]动物体内残留,[/size][size=18px]进而[/size][size=18px]通过食物链传给人类,干扰人体正常菌群、[/size][size=18px]危害人体健康[/size][size=18px]。因此[/size][size=18px]GB/T 31650-2019 《食品安全国家标准 食品中兽药最大残留限量》中规定了[/size][size=18px]部分β[/size][size=18px]-内酰胺类药物在食品中的最大限量值[/size][size=18px],并颁布了一系列该类药物的检测方法标准,现将这些标准归纳、总结如下:[/size][table][tr][td]序号[/td][td]标准名称[/td][td]检测原理[/td][td]药物数量、种类[/td][/tr][tr][td]1[/td][td]GB/T18932.25-2005 蜂蜜中青霉素 G、青霉素 V、乙氧萘青霉素、苯唑青霉素、邻氯青霉素、双氯青霉素残留量的测定方法 [url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]一串联质谱法[/td][td]试样用去离子水溶解后,溶液用 HLB固相萃取柱净化,[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱仪测定,外标法定量。[/td][td]6 种:青霉素 G、青霉素 V、乙氧萘青霉素、苯唑青霉素、邻氯青霉素、双氯青霉素[/td][/tr][tr][td]2[/td][td]GB/T 20755-2006 畜禽肉中九种青霉素类药物残留量的测定 [url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱法[/td][td]试样用 0.15mol/L 磷酸 二氢钠(pH=8.5)缓冲溶液提取,经离心上清液用C18固相萃取柱净化,[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱仪测定,外标法定量。[/td][td]9 种:阿莫西林、氨苄西林、哌拉西林、青霉素 G、青霉素 V、苯唑西林、氯唑西林、萘夫西林、双氯西林[/td][/tr][tr][td]3[/td][td]GB/T 21315-2007 动物源性食品中青霉素族抗生素残留量检测方法 [url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-质谱/质谱法[/td][td]试样用乙腈-水溶液提取,提取液浓缩后,用缓冲溶液溶解,HLB固相萃取小柱净化,洗脱液氮吹干后,[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-质谱/质谱测定,外标法定量。[/td][td]11 种:羟氨苄青霉素、氨苄青霉素、邻氯青霉素、双氯青霉素、乙氧萘胺青霉素、苯唑青霉素、苄青霉素、苯氧甲基青霉素、苯咪青霉素、甲氧苯青霉素、苯氧乙基青霉素[/td][/tr][tr][td]4[/td][td]GB/T 21314-2007 动物源性食品中头孢匹林、头孢噻呋残留量检测方法 [url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-质谱/质谱法[/td][td]试样用乙腈-水溶液提取,提取液浓缩后,用缓冲溶液溶解,C18固相萃取小柱净化,洗脱液氮吹干后,[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-质谱/质谱测定,外标法定量。[/td][td]2 种:头孢匹林、头孢噻呋[/td][/tr][tr][td]5[/td][td]SN/T 1988-2007 进出口动物源食品中头孢氨苄、头孢匹林和头孢唑啉残留量检测方法 [url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]质谱/质谱法[/td][td]试样用乙腈-水提取样品中头孢氨苄、头孢匹林和头孢唑啉旋至乙腈,加入缓冲溶液,HLB固相萃取小柱净化,[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]串联质谱测定,外标法定量。[/td][td]3 种:头孢氨苄、头孢匹林、头孢唑啉[/td][/tr][tr][td]6[/td][td]GB/T 22989-2008 牛奶和奶粉中头孢匹林、头孢氨苄、头孢洛宁、头孢喹肟残留量的测定 [url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱法[/td][td]用乙腈、磷酸盐缓冲溶液提取,HLB固相萃取柱净化,[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱测定,外标法定量。[/td][td]4 种:头孢匹林、头孢氨苄、头孢洛宁、头孢喹肟[/td][/tr][tr][td]7[/td][td]GB/T 22975-2008 牛奶和奶粉中阿莫西林、氨苄西林、哌拉西林、青霉素 G、青霉素 V、苯唑西林、氯唑西林、萘夫西林和双氯西林残留量的测定 [url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱法[/td][td]试样用乙腈-水溶液(3+1)提取,磷酸盐稀释,HLB固相萃取小柱净化,[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]串联质谱测定,外标法定量。[/td][td]9 种:阿莫西林、氨苄西林、哌拉西林、青霉素 G、青霉素 V、苯唑西林、氯唑西林、萘夫西林、双氯西林[/td][/tr][tr][td]8[/td][td]GB/T 22960-2008 河豚鱼和鳗鱼中头孢唑林、头孢匹林、头孢氨苄、头孢洛宁、头孢喹肟残留量的测定 [url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱法[/td][td]试样用乙腈提取,旋转蒸发去除乙腈,用水定容,[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]串联质谱仪测定,外标法定量。[/td][td]5 种:头孢唑林、头孢匹林、头孢氨苄、头孢洛宁、头孢喹肟[/td][/tr][tr][td]9[/td][td]GB/T 22942-2008 蜂蜜中头孢唑林、头孢匹林、头孢氨苄、头孢洛宁、头孢喹肟残留量的测定 [url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱法[/td][td]试样用磷酸 二氢钠缓冲溶液提取,HLB固相萃取柱净化,[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱仪测定,外标法定量。[/td][td]5 种:头孢唑林、头孢匹林、头孢氨苄、头孢洛宁、头孢喹肟[/td][/tr][tr][td]10[/td][td]SN/T 2050-2008 进出口动物源食品中 14 种β内酰胺类抗生素残留量检测方法[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]质谱/质谱法[/td][td]样品用乙睛水溶液提取,旋转蒸发除去提取液中乙睛加入磷酸盐緩冲溶液。提取液用 HLB 固相萃取柱净化,洗脱液氮气吹干后用[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]串联质谱测定,外标法定量。[/td][td]14 种:羟氨苄青霉素、氨苄青霉素、邻氯青霉素、双氯青霉素、乙氧萘胺青霉素、苯唑青霉素、苄青霉素、苯氧甲基青霉素、苯咪青霉素、甲氧苯青霉素、苯氧乙基青霉素、头孢氨苄、头孢吡啉、头孢唑啉[/td][/tr][tr][td]11[/td][td]农业农村部 358号公告-3-2020 饲料中 7 种青霉素类药物含量的测定([url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url])[/td][td]配合饲料、浓缩饲料、精料补充料用 20%乙腈溶液提取,[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱仪测定,基质匹配外标法定量;维生素预混合饲料经 Na 2 EDTA-Mcllvaine 缓冲溶液提取,HLB 小柱净化,洗脱吹干后,用 20%乙腈溶液溶解,[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱仪测定,基质匹配外标法定量。[/td][td]7 种:青霉素、青霉素 V、氯唑西林、苯唑西林、氨苄西林、阿莫西林、双氯西林[/td][/tr][tr][td]12[/td][td]农业农村部 316号公告-3-2020 饲料中 17 种头孢菌素类药物的测定[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱法[/td][td]试样经 40%乙腈溶液提取,甲酸溶液稀释后,用[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱仪测定,基质匹配标准溶液校准,外标法定量。[/td][td]17种:头孢曲松、头孢氨苄、头孢拉定、头孢唑林、头孢哌酮、头孢乙腈、头孢匹林、头孢洛宁、头孢喹肟、头孢噻肟、头孢噻呋、头孢噻吩、头孢羟氨苄、头孢呋辛、头孢他定、头孢克洛、头孢丙烯[/td][/tr][/table]
如何检测乙醇水溶液和甲醇水溶液的浓度,需要简单、精确一些的方法?谢谢。

牛奶中β-内酰胺酶的检测1、质控液准备 取出一片阳性质控药片,加入试剂盒中提供的质控物配制管中,然后加入1ml蒸馏水,充分混匀配成阳性质控液。(48小时内有效)http://ng1.17img.cn/bbsfiles/images/2013/08/201308300857_460882_1641058_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/08/201308300857_460883_1641058_3.jpg2、检测步骤1) 将孵育器温度调节至560C。http://ng1.17img.cn/bbsfiles/images/2013/08/201308300858_460885_1641058_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/08/201308300858_460887_1641058_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/08/201308300858_460888_1641058_3.jpg2) 将50μl阳性质控溶液加入1ml的离心管中,再加入300μl待检测样品充分混匀,静置20-~40min,配成待检溶液。3) 取出相应数量的检测条,水平放置在孵育器上,小心揭开粘膜至指示线处。http://ng1.17img.cn/bbsfiles/images/2013/08/201308300859_460889_1641058_3.jpg4) 用移液器取300μl 已配好的待检溶液,缓慢竖直滴加至检测条的凹槽中。5) 将贴膜重新封好,可同时操作四个样品,但要在75秒内完成四个样品的操作。6) 盖上孵育器塑料盖,自动开始倒计时。7) 孵育8min结束后,蜂鸣器响动,取出检测条,3分钟内判读结果。3、判读标准 首先查看控制线(C线),如果不显色,本次检测结果无效。 在控制线(C线)正常显色的情况下,按以下标准判断结果:1)如果检测线(T线)的颜色和控制线(C线)的颜色一致或者比控制线颜色深,则判断样品为阳性,即牛奶样品中含有与检测限水平相当或者高出检测限水平的β-内酰胺酶,样品中含有β-内酰胺酶可将质控液中青霉素G降解。2)如果检测线(T线)的颜色不可见或者比控制线(C线)颜色浅,则判断样品为阴性,即被检牛奶样品中不含β-内酰胺酶,不能分解质控液中的青霉素G。http://ng1.17img.cn/bbsfiles/images/2013/08/201308300900_460891_1641058_3.jpg0
乳及乳制品中舒巴坦敏感β-内酰胺酶类药物检验方法杯碟法1、范围本标准规定了乳及乳制品中舒巴坦敏感β-内酰胺酶类药物的检验方法。本标准适用于乳及乳制品中舒巴坦敏感β-内酰胺酶类物质的检验。本方法的检出限为4U/mL。2、原理该方法采用对青霉素类药物绝对敏感的标准菌株,利用舒巴坦特异性抑制β-内酰胺酶的活性,并加入青霉素作为对照,通过比对加入β-内酰胺酶抑制剂与未加入抑制剂的样品所产生的抑制圈的大小来间接测定样品是否含有β-内酰胺酶类药物。3、设备和材料除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:3.1 抑菌圈测量仪或测量尺。3.2恒温培养箱:36℃±1℃。3.3 高压灭菌器。3.4 无菌培养皿:内径90 mm,底部平整光滑的玻璃皿,具陶瓦盖。3.5 无菌牛津杯:外径(8.0士0.1) mm,内径(6.0士0.1) mm,高度(10.0士0.1) mm。3.6 麦氏比浊仪或标准比浊管。3.7 pH计。3.8 无菌吸管:1mL(0.01mL刻度值),10mL(0.1mL刻度值)。3.9 加样器:5μL~20μL,20μL -200μL及配套吸头。4、培养基和试剂 除另有规定外,所用试剂均为分析纯,水为GB/T6682中规定的三级水。4.1 试验菌种:藤黄微球菌(Micrococcus luteus) CMCC(B) 28001,传代次数不得超过14次。4.2 磷酸盐缓冲溶液:按附录A中A.1规定。4.3生理盐水(8.5 g/L):按附录A中A.2规定。4.4 青霉素标准溶液:按附录A中A.3规定。[size=1
公司有一产品:樟脑磺内酰胺现测比旋度,用三氯甲烷做溶剂,C=1.0,每次数字显示很不稳定,大概一分钟才能显示数字,每次复测的结果相差很大仪器肯定没问题(标准旋光管校验过)是什么原因导致的呢?
1 范围本标准规定了乳及乳制品中舒巴坦敏感β-内酰胺酶类药物的检验方法。本标准适用于乳及乳制品中舒巴坦敏感β-内酰胺酶类物质的检验。本方法的检出限为4U/mL。 2 原理该方法采用对青霉素类药物绝对敏感的标准菌株,利用舒巴坦特异性抑制β-内酰胺酶的活性,并加入青霉素作为对照,通过比对加入β-内酰胺酶抑制剂与未加入抑制剂的样品所产生的抑制圈的大小来间接测定样品是否含有β-内酰胺酶类药物。 3 设备和材料除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:3.1 抑菌圈测量仪或测量尺。3.2恒温培养箱:36℃±1℃。3.3 高压灭菌器。3.4 无菌培养皿:内径90 mm,底部平整光滑的玻璃皿,具陶瓦盖。3.5 无菌牛津杯:外径(8.0士0.1) mm,内径(6.0士0.1) mm,高度(10.0士0.1) mm。3.6 麦氏比浊仪或标准比浊管。3.7 pH计。3.8 无菌吸管:1mL(0.01mL刻度值),10mL(0.1mL刻度值)。3.9 加样器:5μL~20μL,20μL -200μL及配套吸头。 4 培养基和试剂 除另有规定外,所用试剂均为分析纯,水为GB/T6682中规定的三级水。4.1 试验菌种:藤黄微球菌(Micrococcus luteus) CMCC(B) 28001,传代次数不得超过14次。4.2 磷酸盐缓冲溶液:按附录A中A.1规定。4.3生理盐水(8.5 g/L):按附录A中A.2规定。4.4 青霉素标准溶液:按附录A中A.3规定。4.5 β-内酰胺酶标准溶液:按附录A中A.4规定。4.6 舒巴坦标准溶液按附录A中A.5规定。。4.7 营养琼脂培养基:按附录A中A.6规定。4.8 抗生素检测用培养基Ⅱ:按附录A中A.7规定。
β-内酰胺酶是指能催化水解β-内酰胺环酰胺键的灭活酶,可分为青霉素酶、头孢菌素酶、 金属酶和超广谱酶四种。其对青霉素的分解效率非常高,因此,添加在牛奶中确实可以完全水解青霉素, 使之不被检测出来。但是同样其风险也是存在的:第一,β-内酰胺酶的安全性以及是否可以在食品中添加 尚未有定论;第二,在分解β-内酰胺药物后,可能引进其他有害物质;第三,这种做法纵容了奶牛饲养过 程中抗生素的滥用。【反应原理】根据碘量法快速高效重复性好的特点,能快速测定β-内酰胺酶的残留量。根据青霉素经β-内酰胺酶作用而产生的裂解酸与碘结合,可使蓝色的碘淀粉复合物褪色的原理:青霉素+β-内酰胺酶 → 青霉素裂解酸青霉素裂解酸 + 淀粉碘(蓝色)→ 褪色【试剂盒组成】试剂盒组份数量规格试剂A(棕色瓶)16ml试剂B (本色瓶)16ml样品处理液130ml稀释液(本色瓶)125ml样品管(蓝色离心管)24/4848孔板/96孔板1说明书1样品处理管24/48【注意事项】1. 本试剂盒仅供体外诊断用,不要将不同批号的试剂混合用,并请在有效期内使用。2. 如试剂盒不能一次用完,请使用灭菌的移液头进行取样。3. 本试剂盒适用于生乳中β-内酰胺酶检测,线性范围0~10U/ml,如有必要请用稀释液将样 品稀释后在进行试验。4. 含大量脂质或变质的标本可能影响检测结果;如有需要可在实验前对样品进行离心(4000rpm,10min)后取中间清液待测。【试验方法】1. 将试剂盒于室温回温30min 以上。2. 取1000ul 待测样品加入样品管中。
有分析内酰胺抗生素液相分析的朋友不妨一看,有用[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=70916] 内酰胺抗生素液相分析方法[/url]
[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]检测二甲胺水溶液里的甲胺与三甲胺,限度浓度的甲胺三甲胺出峰正常,峰面积最小的0.3,为什么稀释5倍后,两个都不出峰了,请教各位大佬
SN/T 2283-2009 食品接触材料 高分子材料 食品模拟物中己内酰胺和己内酰胺盐的测定 气相色谱法本标准规定了食品模拟物中己内酰胺和己内酰胺盐的测定方法。 本标准适用于食品模拟物水、3% 乙酸溶液、10% 乙醇溶液、橄榄油中己内酰胺和己内酰胺盐的测定。
各位老师好,最近要测甲胺水溶液中甲胺含量的测定,有没有好的方法啊?求指教
β内酰胺酶能自己生长吗? 牛奶中的β内酰胺酶都是从哪里来的?
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=152854][url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]法测定牛奶中5种_内酰胺类抗生素.pdf[/url]摘要: [目的] 建立采用LC - MS - MS分析牛奶中阿莫西林、氨苄西林、氯唑西林、苯唑西林和青霉素- G残留量的方法。 [方法] 牛奶样品中加入内标青霉素- D7,经乙腈沉淀后,离心并吸取上清液。上清液吹干后,通过固相萃取柱净化,然后进行检测。在液相色谱分离系统中,通过A tlantis C18柱,采用0. 1%甲酸水溶液与乙腈不同比例混合的梯度流动相,根据以上各成分的不同质量数的碎片离子的强度,将5种抗生素分离并测定。 [结果] 在2~20μg /L 范围内,与内标的峰面积比有良好的线性关系。相关系数(R2 )为0. 9943~0. 9981, 在5、10 μg /L 水平的标准加入回收率为88% ~127%。阿莫西林、氨苄西林、青霉素、氯唑西林、苯唑西林的最低检测限量分别为5、2、2、4、4μg /L (以信噪比为10∶1) 。 [结论] 该方法利用液- 液萃取和固相萃取相结合的方法,并加入同位素内标,有效地去除干扰因素,为该类抗生素的测定提供了可靠、实用的测定方法。
公司之前买了一个北分瑞利的[url=https://insevent.instrument.com.cn/t/Mp]气相色谱仪[/url]在测试间苯二胺的水溶液,重复性特别差,根本没法做标准曲线,柱子也换过,还想做DMF、甘油的水溶液标准曲线,求哪位大神给推荐个[url=https://insevent.instrument.com.cn/t/Mp]气相色谱仪[/url],最好是柱子也能给给推荐一下。
文/ 华测检测[b]引言[/b]随着人们生活水平的不断改善,人们越来越注重食品的营养和健康,对乳品的需求也越来越大。但近几年来,乳品质量安全的事故时有发生,给我国乳品市场造成了很大的冲击,乳及其乳制品的食品安全问题也越来越备受关注,然而奶源质量不高成为阻碍我国奶业健康发展的一个重要因素,其中最突出的问题就是鲜奶抗生素的残留。世界各国对鲜奶抗生素的残留都有严格的管控,并有明确的法令禁止抗生素残留超标的牛奶上市销售,我国于2002年颁布的农业部235号公告《动物性食品中兽药最高残留限量》对生鲜乳中的抗生素残留限量做出明确要求和规定。然而,目前仍有一些不法奶站和牧场出于经济利益的驱动,人为的向生鲜乳中添加一些生物制剂去降解生鲜乳中残留的抗生素,制造“无抗奶”,逃避乳品企业对抗生素的筛查及政府监管,造成严重的食品安全危害。本文针对生鲜乳中β-内酰胺酶的来源、危害、目前的管控及主要检测方法做一下阐述。[b]1 β-内酰胺酶简介[/b]β-内酰胺类药物主要是指青霉素类药物和头孢菌素类药物,是目前牧场使用的主要兽药种类,主要用于治疗奶牛乳房炎疾病和产后疾病,由于使用频率高,使用量大,导致β-内酰胺类兽药成为目前生鲜乳中最常见的残留抗生素。β-内酰胺酶俗称抗生素分解剂,又名解抗剂或者金玉兰酶制剂,以青霉素为底物的称为青霉素酶,以头孢菌素作为底物的称为头孢菌素酶。研究表明,有多种细菌能产生β-内酰胺酶,细菌菌体内产生的β-内酰胺酶能够裂解青霉素和头孢菌素等β-内酰胺类抗生素化学结构中的β-内酰胺环,从而灭活该类抗生素使其变成无抗菌活性的物质,从而表现出产酶细菌对β-内酰胺类抗生素产生耐药性。生鲜乳中的β-内酰胺酶分为内源性和外源性。内源性β-内酰胺酶较为复杂,种类较多,有200多种,主要为革兰氏阴性菌产生。内源性β-内酰胺酶来源有两种途径:一是牛本身感染了某些有抗性的细菌,而这些细菌在体内不断表达分泌β-内酰胺酶,这些β-内酰胺酶随奶牛挤奶进入生鲜乳中;二是生鲜乳在放置过程中,由于放置时间和存放温度的原因,在某些细菌的作用下产生内源性β-内酰胺酶。外源性β-内酰胺酶主要为革兰氏阳性菌产生,包括青霉素酶和头孢菌素酶,外源性β-内酰胺酶是不允许在食品中使用的化学物质。生鲜乳中违法添加的抗生素分解剂是革兰氏阳性菌产生的β-内酰胺酶,是人为添加的,而不是内源性β-内酰胺酶。[b]2 生鲜乳中添加β-内酰胺酶的危害[/b]尽管β-内酰胺酶对人体造成的直接损伤和危害目前没有确切的研究能够证明,但是生鲜乳中β-内酰胺酶残留对人体健康和奶业健康产生了一定的安全风险。目前对青霉素药物产生过敏反应的人群普遍存在,通过研究发现主要机理为两个方面:一方面是β-内酰胺酶可催化分解青霉素化学结构中的β-内酰胺四元环,使四元环开环,从而使青霉素失去杀菌能力,同时青霉素降解产物青霉素噻唑酸可与人体内蛋白质结合形成大分子抗原而导致过敏反应;另一方面,β-内酰胺酶催化青霉素化学结构中的β-内酰胺环开放,开环后的β-内酰胺环极易交联在一起,高度聚合形成高度聚合物,该高聚物有很强的致敏能力,很容易导致人体的过敏反应。另外,β-内酰胺酶分解其他β-内酰胺类抗生素后会产生大量的降解产物,这些降解产物中有许多是抗生素的类似物,而降解产物对人体是否存在危害,目前仍是个未知数,这些都是潜在的危害风险。若长期饮用含有β-内酰胺酶处理的牛奶,会使人体内的致病菌产生耐药性,当人体被感染需要使用抗生素药物治疗时,会使抗生素药物失去作用。此外,长期饮用含有β-内酰胺酶的牛奶还可能会引入其他的致病菌、致癌物质。另一方面,β-内酰胺酶的添加纵容了奶牛饲养过程中抗生素的滥用,扰乱市场,不利于我国奶业的健康可持续发展。[b]3 生鲜乳中β-内酰胺酶的管控[/b]2008年婴幼儿奶粉三聚氰胺事件发生后,乳与乳制品的质量安全问题越发的引人关注,国家也相继出台了针对食品中非法添加物质的各项管控政策。β-内酰胺酶可能添加到乳与乳制品中,起到分解抗生素的作用,由于乳与乳制品中添加β-内酰胺酶存在很大的食品安全风险,有可能对人体健康造成严重危害,因此国家出台相关的法律法规明令禁止在生鲜乳中添加此类物质,但是仍有部分国内的奶站和牧场为了追求经济利益,为了使被抗生素污染的生鲜乳达到“无抗”的标准, 在牛奶中人为添加β-内酰胺酶分解剂,给我国奶制品市场造成了混乱,损害了消费者的利益。为进一步保障乳与乳制品的质量和食品安全,打击食品中的各种违法添加,2008年11月28日国家发布“关于开展全国打击违法添加非食用物质和滥用食品添加剂专项整治的紧急通知”(卫监督发〔2008〕60号),该通知由卫生部、商务部、公安部、监察部、工商总局、工业和信息化部、农业部、质检总局和食品药品监管局联合发布,形成统一执法,通知指出:“当前在食品中违法添加非食用物质和滥用食品添加剂问题十分严重,对人民群众身体健康和生命安全造成极大威胁,严重损害了我国食品产品的声誉。”2009年2月4日,全国食品安全整顿工作办公室印发《食品中可能违法添加的非食用物质名单(第二批)》的通知(食品整治办〔2009〕5号),明确将β-内酰胺酶列入乳与乳制品中违法添加的非食用物质,进行全国性监控。2009年3月6日,卫生部印发《卫监督发〔2009〕21号》文件,该文件在《全国打击违法添加非食用物质和滥用食品添加剂专项整治近期工作重点及要求》中明确指出在乳及乳制品生产中添加β-内酰胺酶的违法行为是专项整治近期工作的重点。近几年,在农村农业部的牵头带领下,各省市自治区相继开展针对生鲜乳违法添加专项整治行动,同时国家监督抽查和风险监测等食品安全监控工作均把β-内酰胺酶作为重点监控项目进行抽检监控,并针对发现的少数违禁添加行为及时进行了处置。[b]4 生鲜乳中β-内酰胺酶的主要检测方法[/b]目前常用的β-内酰胺酶检测方法有微生物检测方法、免疫检测方法、液相/[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]/质谱联用检测方法,他们各有优缺点。微生物法是在规定条件下选用适当微生物测定某种物质含量的方法,微生物法中经典的检测β-内酰胺酶的方法为杯碟法,这种方法优点是成本低廉、准确性好,缺点是检测时间较长,不能做到生鲜乳的快速检测放行。目前微生物法仍作为β-内酰胺酶的主要检测方法,国家和地方标准仍以微生物检测方法为主要检测方法,涉及到的主要标准检测方法有DB13/T 1080-2009 乳及乳制品中β-内酰胺酶的测定(2009年5月27日由河北省质量技术监督局颁发的地方标准);乳及乳制品中舒巴坦敏感β-内酰胺酶类药物检验方法-杯碟法(2009年3月23日由卫生部在“关于印发全国打击违法添加非食用物质和滥用食品添加剂专项整治抽检工作指导原则和方案的通知(食品整治办〔2009〕29号)”中发布);SN/T 3979-2014 乳及乳制品中β-内酰胺酶的测定方法-杯碟法(2014年7月14日由国家质量监督检验检疫总局颁发的进出口行业标准);NY/T 3313-2018 生乳中β-内酰胺酶的测定第一法(2018年12月19日由农业农村部颁发的农业标准)。免疫检测法是根据抗原抗体特异性反应的基本特性而设计的检测方法,优点是操作简单、速度快、特异性强,缺点是费用较高,容易出现“假阳性”。免疫检测法目前是在生鲜乳β-内酰胺酶快检方面应用比较广泛的检测方法,主要应用于乳品企业在生鲜乳收购时快速检测放行,目前最主要的技术是胶体金免疫层析技术,现主要以商品化试剂盒为主。目前胶体金免疫层析技术涉及到的主要标准检测方法有SN/T 4533.1-2016 商品化试剂盒检测方法β-内酰胺酶方法一(2016年6月28日由国家质量监督检验检疫总局颁发的进出口行业标准);NY/T 3313-2018 生乳中β-内酰胺酶的测定第二法(2018年12月19日由农业农村部颁发的农业标准)。液相/[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]/质谱联用检测方法为近几年新兴的β-内酰胺酶检测方法,该方法准确性好、敏感性强、重现性好,但检测程序较为复杂,对于样品前处理具有较高的要求,检测费用较高。目前,利用高效液相色谱法测定乳制品中β-内酰胺酶残留的方法已经较为成熟,但仍没有形成相应的国标方法。对于生鲜乳中β-内酰胺酶的液相检测方法主要有两种:直接法和间接法。直接法的主要原理是在含有β-内酰胺酶的条件下或者碱性条件下,青霉素钾盐(钠盐)才能分解为青霉噻唑酸钾(钠),通过测定青霉噻唑酸钾(钠)含量来测定β-内酰胺酶含量;;间接法则是向生鲜乳中添加已知量的青霉素,经过一段时间孵育后,测定青霉素的含量,通过青霉素含量的变化来判断生鲜乳中是否含有β-内酰胺酶,如果含有β-内酰胺酶,青霉素的含量则会下降。液相/[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]/质谱联用检测方法可对β-内酰胺酶进行高通量定量检测,故常可用于实验室定量分析,但是因为需要专门人员进行操作、前处理比较复杂、所需设备比较昂贵等原因,在一些小实验室使用频率不高,且不适用于现场检测。[b]小结[/b]食品安全问题事关人的健康和生命,已经成为全社会关注的热点,生鲜乳质量安全是乳品质量安全最重要的因素。如何确保生鲜乳质量安全,杜绝各种违法现象的发生:一方面,需要政府部门建立健全奶业法规、标准,同时加强政府监管和监督抽检,严厉打击食品中的各种违法添加行为;另一方面,需要政府相关部门、乳品加工企业加大生鲜乳检测力度,投资配备先进生鲜乳检测设备,优化和研发对应的检测方法,引进先进的质量管理体系,落实各个关键控制点质量控制,同时开展第三方检测。通过以上措施,确保收购质量安全的生鲜牛奶,才能保证乳品加工厂生产出高质量安全的乳制品,确保消费者的健康安全。
各位仁兄仁姐:请教一下:5000mg /l 的聚丙烯酰胺水溶液10、20、30、40饱和蒸汽压和常温下的压缩率?如何进行测试呢?有没有相关测试服务的单位好介绍的呢?我在上海的,谢谢大家了!
各位高人,我现在做实验遇到一个难题:就是如何将聚乙烯亚胺水溶液干燥成固体。我用真空干燥的方法(60-70°C)干燥了好多天,都是粘状的,若再升高温度到100°C,则变成黄色,且还是粘状。用丙酮等有机溶剂析,但发现由浑浊变成黄色澄清溶液,可能发生反应。用其他有机溶剂,则聚乙烯亚胺均溶于其中。在文献中也查不到方法。请各位指导指导,不胜感激。