连发3篇hiPSC文章,单细胞可视化培养系统颠覆传统,分离效率高达100%!
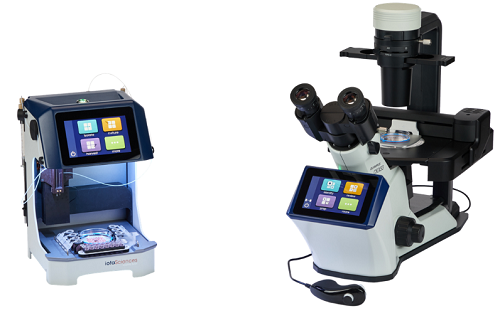
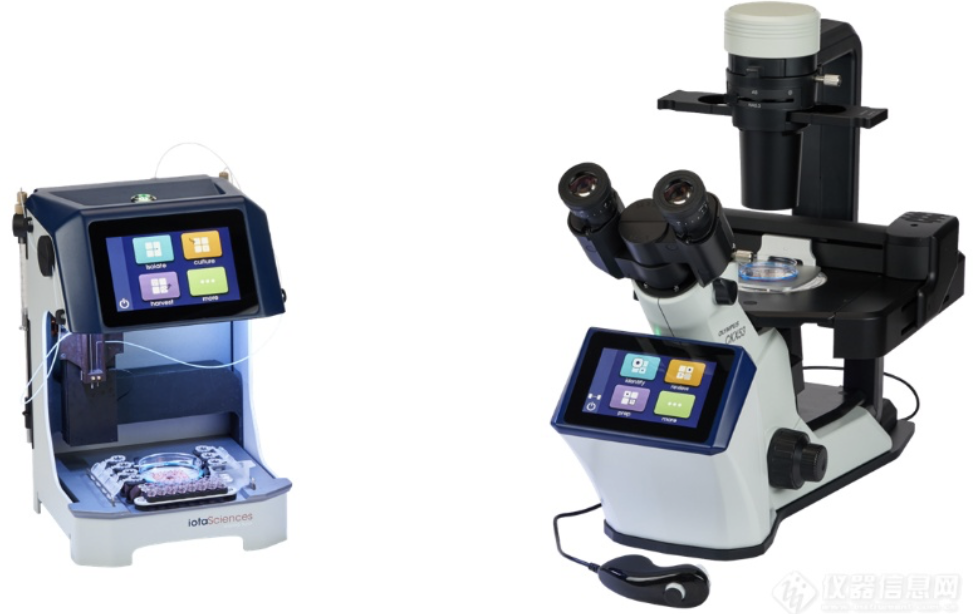
人类诱导多能干细胞 (hiPSC) 是通过基因编辑技术(如 CRISPR-Cas9)对已经高度分化的人体细胞进行重新逆分化得到的多能干细胞。传统的hiPSC细胞系构建与培养过程操作复杂、耗材昂贵且费时费力。特别是对于异质编辑细胞池中构建的克隆hiPSC系的培养,受到了传统细胞培养方法的桎梏,很难构建一个高效的hiPSC构建与培养工作流程。此外,现有的单细胞分离和培养方法通常对细胞的处理条件要求苛刻,操作步骤繁琐,无法充分保证单克隆性。为应对hiPSC细胞系构建与培养过程中的诸多挑战,iotaSicences公司采用了以GRID技术为核心的高度自动化的单细胞可视化培养系统isoCell,构建了用于 hiPSC细胞系培养的平台。该平台采用全自动化流程,操作条件温和,对单细胞无损伤,具有高通量、自动化、高成活率等优势,可确保分选出的细胞100%为单细胞。柏林医学大学多能干细胞和类器官研究中心的Harald Stachelscheid团队使用isoCell在Stem Cell Research期刊上发表了三篇构建不同功能的hiPSC细胞系的科研应用文章,展示了isoCell在hiPSC细胞系构建和培养方面的优势。图1 单细胞可视化培养系统isoCell实物图 1. 以isoCell为核心的hiPSC细胞培养平台isoCell系统组成的细胞培养平台是基于GRID技术的高度自动化的实验平台。GRID是指在细胞培养基上采用FC40液体分隔出的网格小室,体积小(耗材少),光学透明度高,可以容纳细胞在内生长,且各个小室之间物质不流通。isoCell系统配备了荧光和成像系统,用于在整个克隆工作流程中记录 GRID 小室的图像(见下图)。图2 GRID实物图 isoCell 可自动执行所有液体处理步骤,包括构建 GRID、将单细胞注射到GRID小室中以及交换培养基和收获单克隆集落,在整个工作流程中自动检测每一个 GRID 小室,并确保每一个单克隆hiPSC细胞系来源于单个细胞。图3 isoCell操作流程图 2. 生成具有 SLC16A2:G401R 或 SLC16A2 敲除的 iPSC系X染色体相关的AHDS综合征的发病特点是由编码甲状腺激素转运蛋白MCT8(单羧酸转运蛋白8)的SLC16A2基因突变引起精神运动发育严重受损。该团队使用CRISPR/Cas9技术(靶向 SLC16A2 的外显子3)将AHDS患者错义变体G401R和新型敲除缺失变体 (F400Sfs*17) 引入男性健康供体的hiPSC系(BIHi001-B)。通过isoCell培育成功地获得了SLC16A2基因敲除的hiPSC单克隆细胞系(BIHi001-B-7)和(BIHi001-B-8),并证明了这些新细胞系在模拟 MCT8 缺陷对人类神经发育的影响方面的实用性。文章以Generation of iPSC lines with SLC16A2:G401R or SLC16A2 knock out为题发表于Stem Cell Research期刊上。图4 WB验证SLC16A2 敲除的hiPSC系无法表达SLC16A2蛋白 3. 生成 THRB-GS(E125G_G126S) 和 THRB-KO 人类 iPSC 系以研究非典型甲状腺激素信号传导THRB是一种依赖甲状腺激素 (TH) 结合来调节基因表达的核受体。相同的受体也可以介导细胞质中信号通路的激活。目前尚无法区分这两种机制中的哪一种是造成 TH 生理效应的原因。该团队结合基因编辑与isoCell的单细胞培养基技术,成功建立了一种在 THRB DNA 结合域中具有两个突变 (E125G_G126S) 的hiPSC 细胞系(BIHi001-B-2/3),该突变消除了THRB的核受体作用,因此可以用该细胞系专门研究THRB的信号通路激活作用。该团队还生成了 THRB 敲除细胞系(BIHi001-B-6)以消除所有 THRB 效应。通过比较WT结果和这两种细胞系,将甲状腺激素的影响归因于潜在的机制。文章以Generation of THRB-GS(E125G_G126S) and THRB-KO human iPSC lines to study noncanonical thyroid hormone signalling为题发表于2024年2月的Stem Cell Research期刊上。图5 基因测序验证BIHi001-B-2/3和BIHi001-B-6细胞系敲除或突变了对应基因 4. 使用 CRISPR-Cas9 生成了两个 BAX/BAK 双敲除人类诱导多能干细胞系 (iPSC)脑缺血损伤很多是由于脑缺血状态下细胞凋亡导致的。Bcl-2基因相关的X 蛋白 (BAX) 和BCL2 拮抗因子(BAK)是 BCL2 家族的两个促凋亡因子,BAX 和BAK是线粒体凋亡的执行基因,与细胞凋亡密切相关。该团队使用 CRISPR-Cas9技术构建了两个 BAX/BAK 双敲除人类诱导多能干细胞BIHi005-A-17和BIHi250-A-1,并通过isoCell培养获得了对应的hiPSC单克隆细胞系。所得细胞系核型正常,具有典型的形态并表达未分化状态的典型标记,并通过基因技术验证了细胞系已敲除BAK基因。在后续的研究中,研究人员就可以将该BAX/BAK 双敲除的hiPSC细胞系广泛应用于脑缺血等细胞凋亡相关领域的发病机制与治疗干预机制研究中。文章以Generation of two human induced pluripotent stem cell lines with BAX and BAK1 double knock-out using CRISPR/Cas9为题发表于2024年4月的Stem Cell Research期刊上。图6 通过基因测序及WB验证BIHi005-A-17和BIHi250-A-1以敲除BAK与BAX基因 5. 结论以isoCell构建的hiPSC细胞培养平台可以对hiPSC细胞进行全自动化且温和地单细胞培养。通过isoCell特有的GRID小室网格技术与可视化分选相结合,可以确保每一个单克隆hiPSC细胞系均来自单个细胞,且节省培养耗材。isoCell的培养条件温和,在以上案例中协助科研人员构建了多个基因改造hiPSC单克隆细胞系,成活率高。 单细胞可视化培养系统isoCell的优势:✔ 全自动化流程✔ 操作条件温和,对单细胞无损伤✔ 全培养、分析流程可追踪✔ 单细胞率高达100%✔ 单克隆细胞系构建成活率高✔ 结构紧凑,体积小,节省耗材单细胞可视化分选培养系统-isoCell已在Cell、Advanced Science、Small Methods、Nature Communications等知名期刊发表多篇文章,如下摘引了近年三篇具有代表性的文献和大家分享。Soitu C, Stovall‐Kurtz N, Deroy C, et al. Jet‐Printing Microfluidic Devices on Demand[J]. Advanced Science, 2020, 7(23): 2001854.Gangoso E, Southgate B, Bradley L, et al. Glioblastomas acquire myeloid-affiliated transcriptional programs via epigeneticimmunoediting to elicit immune evasion[J]. Cell, 2021, 184(9): 2454-2470. e26.Deroy C, Nebuloni F, Cook P R, et al. Microfluidics on Standard Petri Dishes for Bioscientists[J]. Small Methods, 2021, 5(11): 2100724.Deroy C, Wheeler J H R, Rumianek A N, et al. Reconfigurable microfluidic circuits for isolating and retrieving cells of interest[J]. ACS Applied Materials & Interfaces, 2022, 14(22): 25209-25219.Oliveira N M, Wheeler J H R, Deroy C, et al. Suicidal chemotaxis in bacteria[J]. Nature Communications, 2022, 13(1): 7608.样机体验:为更好地服务中国科研工作者,Quantum Design 中国也建立了样机演示实验室,将为大家提供为专业的售前、销售、售后技术支持,欢迎各位老师通过拨打电话010-85120280、发送邮件info@qd-china.com、点击此处或扫描下方二维码参观试用!扫描上方二维码/点击此处,即刻咨询/体验! 用户名单用户评价路易莎埃姆斯,研究科学家:The Native Antigen Company(LGC 临床诊断集团旗下公司)“使用 isoCell 进行单细胞克隆工作从一开始就简单可靠,并且已无缝地融入我们的流程中。 该程序对细胞很温和,我们看到非常好的存活率,可以筛选大量克隆。 我们收到的客户服务是优质的。”相关产品1、单细胞可视化分选培养系统—isoCellhttps://www.instrument.com.cn/netshow/SH100980/C551413.htm