实验室进了一台[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url],同行推荐必须要配一台酸蒸馏纯化器,避免由于酸纯度不够引起的结果偏差;请问各位高手是否有此必要,如有必要,买哪家的比较合适,国产的能不能满足要求。同行推荐的那款要七八万呢,是进口的。
蒸馏和精馏:使用广泛的纯化方法,根据液体混合物中液体与蒸汽之间混合组分的分配差别进行纯化,是纯化挥发性和半挥发性化学试剂的第一选择。 蒸馏和精馏的实际应用:蒸馏和精馏主要用于液体、或是加热可成为液体的化学试剂,特别是用于有机化学试剂的纯化。在蒸馏或精馏之前,有时可加入某些化学试剂,与欲纯化的化学试剂中的杂质发生化学反应,生成沸点更高(或更低)的物质,在蒸馏或精馏是更容易除去。 在蒸馏或精馏时,往往是除去最初馏出的馏分和最后剩下的馏分,两头除去的越多,得到的化学试剂纯度就越高,但产率越低。。。 下面介绍几个用蒸馏或精馏方法纯化的化学试剂: 1.盐酸的提纯: (1)除去一般杂质的盐酸用三次离子交换水将一级盐酸按盐酸:水=7:3的体积比稀释(或按1:1稀释,按此比例稀释仅得到浓度为6N的盐酸)。将此盐酸1.5升装入2升的石英或硬质玻璃蒸馏瓶中,用可调变压器调节加热器,控制馏速为200毫升/小时,弃去前段馏出液150mL,取中段馏出液1升,所得的纯盐酸浓度为6.5~7.5N,铁、铝、钙、镁、铜、铅、锌、钴、镍、锰、铬、锡的含量在5′10-6--2′10-7%以下。 (2)除去砷的盐酸用三次离子交换水将一级盐酸按7:3的体积比稀释,加入适量氧化剂(按体积加入2.5%硝酸或2.5%过氧化氢或高锰酸钾0.3克/1.5升)。将此盐酸1.5升装入2升的石英或硬质玻璃蒸馏瓶中,放置15分钟后,以100毫升/小时的馏速进行蒸馏。弃去前段馏出液150毫升,取中段馏出液1升备用。砷的含量在1′10-6%以下。 2. 硝酸的提纯于2升硬质玻璃蒸馏器中,放入1.5升硝酸(一级品),在石墨电炉上借可调变压器调节电炉温度进行蒸馏,馏速为200-400毫升/小时,弃去初馏份150毫升,收集中间馏份1升。 将上述得到的中间馏份2升,放入3升石英蒸馏器中。将石英蒸馏器固定在石蜡浴中进行蒸馏,借可调变压器控制馏速为100毫升/小时。弃去初馏份150毫升,收集中间馏份1600毫升。铁、铝、钙、镁、铜、铅、锌、钴、镍、锰、铬、锡的含量在2′10-7%以下。
国产酸上icp-ms背景有点高,进口的酸用下来成本太高,想买一台酸纯化蒸馏仪来自己纯化,大家有用过的推荐一下
实验室新买了个“石英亚沸蒸馏水器”,加热管就是石英管里面放跟电阻丝,用了一次后就在石英内壁产生很多铁锈。请问:这正常吗?我们以前没有见过“石英亚沸蒸馏水器”。请问大家的石英亚沸蒸馏水器的加热管是什么样的?
请问石英亚沸蒸馏水器制取的纯水能用到液相上么?
实验室新买了个“石英亚沸蒸馏水器”,加热管就是石英管里面放跟电阻丝,用了一次后就在石英内壁产生很多铁锈。请问:这正常吗?我们以前没有见过“石英亚沸蒸馏水器”。请问大家的石英亚沸蒸馏水器的加热管是什么样的?
实验室新买了个“石英亚沸蒸馏水器”。可是加热管用了一次后就在石英内壁产生很多铁锈。现在装加热管的石英整个就是黑色的。请问:这正常吗?加热管里面产生的黑色是什么?
[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]需要蒸馏硝酸和有机溶剂,求购石英和四氟的亚沸蒸馏器,最好是进口的.联系方式:021-37990000-4902E-mail:zhuang.meihua@secco.com.cn

维权声明:本文为timstoicpms原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现的,均属侵权违法行为,我们将追究法律责任。 ICP-MS是面向 痕量分析(ppb-ppt)的精密仪器。在前期样品制备、化学处理过程中,所用的试剂必须足够纯净,才能降低“过程空白”,进而保证足够低的测定限(Limit of Determination)。我国试剂纯度可分为:优级纯 (Guaranteed reagent = GR) 深绿色标签分析纯 (Analytical reagent = AR) 红色标签化学纯 (Chemically Pure = CP) 中蓝色标签国外还有超级纯(Ultrapure),比国标优级纯好一些。 就我个人观点:在ICP-MS无机元素分析领域,分析纯、化学纯是直接被无视的;优级纯试剂则需要看厂家、看批次;超级纯是首选!经常见到网友发帖询问“哪家的酸液质量较好”,底下一堆回帖:德国默克、苏州晶锐、北京化学试剂研究所……这些试剂(每瓶 500ml)的售价从数百元到数千元不等。我就在想:为啥你们不自己动手,亚沸蒸馏酸液呢?亚沸,就是低于沸点。硝酸 HNO3 83℃盐酸 HCl 108.6℃氢氟酸 HF 112.2℃先介绍 几种亚沸蒸馏器。第一种是“对接瓶”1972年的一篇文献(见文末的附件)介绍了对接瓶,它使用光照作为热源,让母瓶中的浓酸缓慢挥发,进入冷凝收集瓶中。Mattinson, 1972. Preparation of hydrofluoric, hydrochloric, and nitric acids at ultralow lead levels. Analytical Chemistry 44(9), 1715-1716.http://ng1.17img.cn/bbsfiles/images/2010/09/201009081434_242341_1984479_3.jpg 也可在母瓶上紧密缠绕电阻线作为热源,但这些加热带容易着火。我们实验室将电阻线缠绕进一个绝缘壳中,再套在母瓶上,杜绝了火灾隐患。收集瓶可浸泡在冰水浴中,或者流动的自来水中。这种“对接瓶”成本很低,两个500ml的特氟龙瓶和一个链接头,自行组装一下。第二种是“石英蒸馏器”,售价不超过1500元。http://ng1.17img.cn/bbsfiles/images/2010/09/201009081435_242342_1984479_3.jpg从图中可以看到,加热电阻丝、冷却水与石英腔是物理隔绝的。浓酸受热缓慢挥发,在冷却水管表面冷凝,液滴滑向中部,最后滴入收集瓶。http://ng1.17img.cn/bbsfiles/images/2010/09/201009081435_242344_1984479_3.jpg第三种是 Savillex DST-1000,它不需要循环冷却水。加热数分钟后,自动停止;然后加热,停止……售价较贵,每套 3995美元。http://www.savillex.com/CategoryDetail.aspx?CategoryName=DST-1000-Sub-Boiling-Stillshttp://ng1.17img.cn/bbsfiles/images/2010/09/201009081435_242345_1984479_3.jpg分析纯酸液 经过两次亚沸蒸馏,完全能满足ICP-MS的应用需要。实验室至少要有2套亚沸蒸馏装置,分别用于 第一遍、第二遍蒸馏。我们实验室用对接瓶蒸馏第一遍HCl/HNO3/HF,石英器用于第二遍HCl/HNO3,Savillex则蒸馏第二遍HF。蒸馏开头的部分,富集Li B As等挥发元素。中间大部分,是蒸馏提纯的酸液。最后的部分,富集了各种重金属杂质。因此,亚沸蒸馏的原则就是“掐头去尾”。例如:前50ml抛弃,中间500ml留着,最后100ml抛弃,产率是500÷650=76.9%。一瓶550 ml国产分析纯硝酸,算10元钱吧。经过二次蒸馏,终产物是550×76.9%×76.9%=325ml,还是很划算的!有人会问,两次亚沸蒸馏的酸液,到底能达到多少纯度啊?我只能回答:这取决于你的实验环境。日本有个实验室为探月计划而建立(The Pheasant Memorial Laboratory for Geochemistry and Cosmochemistry, Institute for Study of the Earth's Interior, Okayama University at Misasa, Japan),他们在100级超净间中对酸液进行三次亚沸蒸馏,这被认为是实践意义上的“空白试剂”。
如题。主要用于[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]等检测痕量金属用酸的纯化。如利曼 BSB-939-IR价格多少?
被其管杀不管埋的售后弄的身心俱疲的我,本无力吐槽常州普天仪器有限公司,但本着为国产仪器企业着想的杂念,还是吐槽一番吧。公司几年前买了一台节能石英亚沸蒸馏器,专门用来制蒸馏水配制无机重金属标液用。不幸的是2014年初,它的一个四通玻璃接头烂掉了(可能是下属不小心给碰坏了)。主管实验室的我赶紧找了原厂家,厂家开始质疑是否是他们公司的产品。我们先是拍了仪器照片给他们,证明是他们的仪器,他们一个销售代小姐说可以免费给我们换一个(坏的四通接头也拍了照片给他们)。刚开始心里还觉得这仪器公司挺不错的,注重售后服务。后来收到了两个不配套的两通的接头,没办法用,只好寄还给原厂。把那个四通接头又发了一张照片给他们,说需要那个配件。代小姐说可以让师傅给我们做一个(他们另一同型号的蒸馏水器还在卖)。我们就开始了毫无结果的等待,等了半个月见没有回音后,我发邮件给他们,表示我们愿意买那个配件,不用他们送,让他们报个价。结果没回音,我们只好打电话联系他们,那公司其他销售人员接了电话,态度消极,一问三不知的那种,只推说帮你转给原来接手的人。不断和他们联系,不断被他们踢皮球,前后整了三个月,邮件、电话搞了很多遍。后来?就没有后来了,搞了一年,我们仪器还烂在那里没办法用。实在让人不解的是,我们愿意出钱买那个配件,又不是说非要占便宜,如果常州普天仪器有限公司你们不生产了,完全可以回复下让我们知道。就是不答复,算几个意思呢?国产仪器公司都这样,谁还敢用国产的东西呢?我想,也就是管杀不管埋这种服务理念导致我们很多行业做不大,做不长久,也做不健康。实验室同行们,见到本贴,在我们实验室未得到合理回复解决前,如果你恰有买蒸馏水器的需要,而你还有的选的时候,千万别走我们的老路。http://simg.instrument.com.cn/bbs/images/default/em09504.gif
化学试剂的纯化 在化学分析、仪器分析、无机制备、有机合成以及其他的科学实验工作中经常会遇到所用的化学试剂纯度不够,或买不到所需纯度的化学试剂,这就需要在实验室自己对现有的化学试剂进行纯化,以便得到所需纯度的化学试剂。实验室中常用的纯化化学试剂的方法有:蒸馏和精馏、重结晶、萃取、区域熔融和色谱分离等等,下面将分别加以简单介绍。 蒸馏和精馏 蒸馏和精馏是一种使用广泛的纯化方法,根据液体混合物中液体和蒸汽之间混合组分的分配差别进行纯化,是纯化挥发性和半挥发性化学试剂的第一选择。 蒸馏和精馏的实际应用 蒸馏和精馏主要用于液体、或是加热可成为液体的化学试剂,特别是用于有机化学试剂的纯化。在蒸馏或精馏之前,有时可加入某些化学试剂,与欲纯化的化学试剂中的杂质发生化学反应,生成沸点更高(或更低)的物质,在蒸馏或精馏是更容易除去。 在蒸馏或精馏时,往往是除去最初馏出的馏分和最后剩下的馏分,两头除去的越多,得到的化学试剂纯度就越高,但产率越低。 下面介绍几个用蒸馏或精馏方法纯化的化学试剂: 1. 盐酸的提纯: (1)除去一般杂质的盐酸 用三次离子交换水将一级盐酸按盐酸:水=7:3的体积比稀释(或按1:1稀释,按此比例稀释仅得到浓度为6N的盐酸)。将此盐酸1.5升装入2升的石英或硬质玻璃蒸馏瓶中,用可调变压器调节加热器,控制馏速为200毫升/小时,弃去前段馏出液150ml,取中段馏出液1升,所得的纯盐酸浓度为6.5-7.5N,铁、铝、钙、镁、铜、铅、锌、钴、镍、锰、铬、锡的含量在5′10-6--2′10-7%以下。 (2)除去砷的盐酸 用三次离子交换水将一级盐酸按7:3的体积比稀释,加入适量氧化剂(按体积加入2.5%硝酸或2.5%过氧化氢或高锰酸钾0.3克/1.5升)。将此盐酸1.5升装入2升的石英或硬质玻璃蒸馏瓶中,放置15分钟后,以100毫升/小时的馏速进行蒸馏。弃去前段馏出液150毫升,取中段馏出液1升备用。砷的含量在1′10-6%以下。 2. 硝酸的提纯 于2升硬质玻璃蒸馏器中,放入1.5升硝酸(一级品),在石墨电炉上借可调变压器调节电炉温度进行蒸馏,馏速为200-400毫升/小时,弃去初馏份150毫升,收集中间馏份1升。 将上述得到的中间馏份2升,放入3升石英蒸馏器中。将石英蒸馏器固定在石蜡浴中进行蒸馏,借可调变压器控制馏速为100毫升/小时。弃去初馏份150毫升,收集中间馏份1600毫升。铁、铝、钙、镁、铜、铅、锌、钴、镍、锰、铬、锡的含量在2′10-7%以下。
四氢呋喃纯化时蒸馏要氮气保护吗?我最近在做四氢呋喃的纯化,是用二苯甲酮、钠回流的,之前做好先用氢氧化钾干燥。等体系变墨绿色的时候就可以蒸馏出来了。我用干燥塔隔绝湿气,这时候要用氮气保护码 四氢呋喃有被氧化的机会。请给位高手指教!!!
平时实验对酸的要求较高,因此有意购买一款亚沸酸蒸馏器,主要处理硝酸,盐酸,等。有的话请介绍一下。邮箱hdyanz@sina.com.cn
常用有机试剂的纯化-丙酮 沸点56.2℃,折光率1.358 8,相对密度0.789 9。 普通丙酮常含有少量的水及甲醇、乙醛等还原性杂质。其纯化方法有: ⑴于250mL丙酮中加入2.5g高锰酸钾回流,若高锰酸钾紫色很快消失,再加入少量高锰酸钾继续回流,至紫色不褪为止。然后将丙酮蒸出,用无水碳酸钾或无水硫酸钙干燥,过滤后蒸馏,收集55~56.5℃的馏分。用此法纯化丙酮时,须注意丙酮中含还原性物质不能太多,否则会过多消耗高锰酸钾和丙酮,使处理时间增长。 ⑵将100mL丙酮装入分液漏斗中,先加入4mL10%硝酸银溶液,再加入3.6mL1mol/L氢氧化钠溶液,振摇10min,分出丙酮层,再加入无水硫酸钾或无水硫酸钙进行干燥。最后蒸馏收集55~56.5℃馏分。此法比方法⑴要快,但硝酸银较贵,只宜做小量纯化用。常用有机溶剂的纯化-四氢呋喃 沸点67℃(64.5℃),折光率1.405 0,相对密度0.889 2。 四氢呋喃与水能混溶,并常含有少量水分及过氧化物。如要制得无水四氢呋喃,可用氢化铝锂在隔绝潮气下回流(通常1000mL约需2~4g氢化铝锂)除去其中的水和过氧化物,然后蒸馏,收集66℃的馏分(蒸馏时不要蒸干,将剩余少量残液即倒出)。精制后的液体加入钠丝并应在氮气氛中保存。 处理四氢呋喃时,应先用小量进行试验,在确定其中只有少量水和过氧化物,作用不致过于激烈时,方可进行纯化。 四氢呋喃中的过氧化物可用酸化的碘化钾溶液来检验。如过氧化物较多,应另行处理为宜。常用有机溶剂的纯化-二氧六环 沸点101.5℃,熔点12℃,折光率1.442 4,相对密度1.033 6。 二氧六环能与水任意混合,常含有少量二乙醇缩醛与水,久贮的二氧六环可能含有过氧化物(鉴定和除去参阅乙醚)。二氧六环的纯化方法,在500mL二氧六环中加入8mL浓盐酸和50mL水的溶液,回流6~10h,在回流过程中,慢慢通入氮气以除去生成的乙醛。冷却后,加入固体氢氧化钾,直到不能再溶解为止,分去水层,再用固体氢氧化钾干燥24h。然后过滤,在金属钠存在下加热回流8~12h,最后在金属钠存在下蒸馏,压入饥丝密封保存。精制过的1,4-二氧环己烷应当避免与空气接触。常用有机溶剂的纯化-吡啶 沸点115.5℃,折光率1.509 5,相对密度0.981 9。 分析纯的吡啶含有少量水分,可供一般实验用。如要制得无水吡啶,可将吡啶与粒氢氧化钾(钠)一同回流,然后隔绝潮气蒸出备用。干燥的吡啶吸水性很强,保存时应将容器口用石蜡封好。 常用有机溶剂的纯化-石油醚 石油醚为轻质石油产品,是低相对分子质量烷烃类的混合物。其沸程为30~150℃,收集的温度区间一般为30℃左右。有30~60℃,60~90℃,90~120℃等沸程规格的石油醚。其中含有少量不饱和烃,沸点与烷烃相近,用蒸馏法无法分离。 石油醚的精制通常将石油醚用其体积的浓硫酸洗涤2~3次,再用10%硫酸加入高锰酸钾配成的饱和溶液洗涤,直至水层中的紫色不再消失为止。然后再用水洗,经无水氯化钙干燥后蒸馏。若需绝对干燥的石油醚,可加入钠丝(与纯化无水乙醚相同)。 常用有机溶剂的纯化-甲醇 沸点64.96℃,折光率1.328 8,相对密度0.791 4。 普通未精制的甲醇含有0.02%丙酮和0.1%水。而工业甲醇中这些杂质的含量达0.5%~1%。 为了制得纯度达99.9%以上的甲醇,可将甲醇用分馏柱分馏。收集64℃的馏分,再用镁去水(与制备无水乙醇相同)。甲醇有毒,处理时应防止吸入其蒸气。常用有机溶剂的纯化-乙酸乙酯 沸点77.06℃,折光率1.372 3,相对密度0.900 3。 乙酸乙酯一般含量为95%~98%, 含有少量水、乙醇和乙酸。可用下法纯化:于1000mL乙酸乙酯中加入100mL乙酸酐,10滴浓硫酸,加热回流4h,除去乙醇和水等杂质,然后进行蒸馏。馏液用20~30g无水碳酸钾振荡,再蒸馏。产物沸点为77℃,纯度可达以上99%。常用有机溶剂的纯化-乙醚 沸点34.51℃,折光率1.352 6,相对密度0.713 78。普通乙醚常含有2%乙醇和0.5%水。久藏的乙醚常含有少量过氧化物 过氧化物的检验和除去:在干净和试管中放入2~3滴浓硫酸,1mL2%碘化钾溶液(若碘化钾溶液已被空气氧化,可用稀亚硫酸钠溶液滴到黄色消失)和1~2滴淀粉溶液,混合均匀后加入乙醚,出现蓝色即表示有过氧化物存在。除去过氧化物可用新配制的硫酸亚铁稀溶液(配制方法是FeSO4?H2O60g,100mL水和6mL浓硫酸)。将100mL乙醚和10mL新配制的硫酸亚铁溶液放在分液漏斗中洗数次,至无过氧化物为止。 醇和水的检验和除去:乙醚中放入少许高锰酸钾粉末和一粒氢氧化钠。放置后,氢氧化钠表面附有棕色树脂,即证明有醇存在。水的存在用无水硫酸铜检验。先用无水氯化钙除去大部分水,再经金属钠干燥。其方法是:将100mL乙醚放在干燥锥形瓶中,加入20~25g无水氯化钙,瓶口用软木塞塞紧,放置一天以上,并间断摇动,然后蒸馏,收集33~37℃的馏分。用压钠机将1g金属钠直接压成钠丝放于盛乙醚的瓶中,用带有氯化钙干燥管的软木塞塞住。或在木塞中插一末端拉成毛细管的玻璃管,这样,既可防止潮气浸入,又可使产生的气体逸出。放置至无气泡发生即可使用;放置后,若钠丝表面已变黄变粗时,须再蒸一次,然后再压入钠丝。
常用有机试剂的纯化-丙酮 沸点56.2℃,折光率1.358 8,相对密度0.789 9。普通丙酮常含有少量的水及甲醇、乙醛等还原性杂质。其纯化方法有:⑴于250mL丙酮中加入2.5g高锰酸钾回流,若高锰酸钾紫色很快消失,再加入少量高锰酸钾继续回流,至紫色不褪为止。然后将丙酮蒸出,用无水碳酸钾或无水硫酸钙干燥,过滤后蒸馏,收集55~56.5℃的馏分。用此法纯化丙酮时,须注意丙酮中含还原性物质不能太多,否则会过多消耗高锰酸钾和丙酮,使处理时间增长。⑵将100mL丙酮装入分液漏斗中,先加入4mL10%硝酸银溶液,再加入3.6mL1mol/L氢氧化钠溶液,振摇10min,分出丙酮层,再加入无水硫酸钾或无水硫酸钙进行干燥。最后蒸馏收集55~56.5℃馏分。此法比方法⑴要快,但硝酸银较贵,只宜做小量纯化用。常用有机溶剂的纯化-四氢呋喃 沸点67℃(64.5℃),折光率1.405 0,相对密度0.889 2。四氢呋喃与水能混溶,并常含有少量水分及过氧化物。如要制得无水四氢呋喃,可用氢化铝锂在隔绝潮气下回流(通常1000mL约需2~4g氢化铝锂)除去其中的水和过氧化物,然后蒸馏,收集66℃的馏分(蒸馏时不要蒸干,将剩余少量残液即倒出)。精制后的液体加入钠丝并应在氮气氛中保存。处理四氢呋喃时,应先用小量进行试验,在确定其中只有少量水和过氧化物,作用不致过于激烈时,方可进行纯化。四氢呋喃中的过氧化物可用酸化的碘化钾溶液来检验。如过氧化物较多,应另行处理为宜。常用有机溶剂的纯化-二氧六环 沸点101.5℃,熔点12℃,折光率1.442 4,相对密度1.033 6。二氧六环能与水任意混合,常含有少量二乙醇缩醛与水,久贮的二氧六环可能含有过氧化物(鉴定和除去参阅乙醚)。二氧六环的纯化方法,在500mL二氧六环中加入8mL浓盐酸和50mL水的溶液,回流6~10h,在回流过程中,慢慢通入氮气以除去生成的乙醛。冷却后,加入固体氢氧化钾,直到不能再溶解为止,分去水层,再用固体氢氧化钾干燥24h。然后过滤,在金属钠存在下加热回流8~12h,最后在金属钠存在下蒸馏 ,压入饥丝密封保存。精制过的1,4-二氧环己烷应当避免与空气接触。常用有机溶剂的纯化-吡啶 沸点115.5℃,折光率1.509 5,相对密度0.981 9。分析纯的吡啶含有少量水分,可供一般实验用。如要制得无水吡啶,可将吡啶与粒氢氧化钾(钠)一同回流,然后隔绝潮气蒸出备用。干燥的吡啶吸水性很强,保存时应将容器口用石蜡封好。常用有机溶剂的纯化-石油醚 石油醚为轻质石油产品,是低相对分子质量烷烃类的混合物。其沸程为30~150℃,收集的温度区间一般为30℃左右。有30~60℃,60~90℃,90~120℃等沸程规格的石油醚。其中含有少量不饱和烃,沸点与烷烃相近,用蒸馏法无法分离。石油醚的精制通常将石油醚用其体积的浓硫酸洗涤2~3次,再用10%硫酸加入高锰酸钾配成的饱和溶液洗涤,直至水层中的紫色不再消失为止。然后再用水洗,经无水氯化钙干燥后蒸馏。若需绝对干燥的石油醚,可加入钠丝(与纯化无水乙醚相同)。常用有机溶剂的纯化-甲醇 沸点64.96℃,折光率1.328 8,相对密度0.791 4。普通未精制的甲醇含有0.02%丙酮和0.1%水。而工业甲醇中这些杂质的含量达0.5%~1%。为了制得纯度达99.9%以上的甲醇,可将甲醇用分馏柱分馏。收集64℃的馏分,再用镁去水(与制备无水乙醇相同)。甲醇有毒,处理时应防止吸入其蒸气。常用有机溶剂的纯化-乙酸乙酯 沸点77.06℃,折光率1.372 3,相对密度0.900 3。乙酸乙酯一般含量为95%~98%, 含有少量水、乙醇和乙酸。可用下法纯化:于1000mL乙酸乙酯中加入100mL乙酸酐,10滴浓硫酸,加热回流4h,除去乙醇和水等杂质,然后进行蒸馏。馏液用20~30g无水碳酸钾振荡,再蒸馏。产物沸点为77℃,纯度可达以上99%。常用有机溶剂的纯化-乙醚 沸点34.51℃,折光率1.352 6,相对密度0.713 78。普通乙醚常含有2%乙醇和0.5%水。久藏的乙醚常含有少量过氧化物过氧化物的检验和除去:在干净和试管中放入2~3滴浓硫酸,1mL2%碘化钾溶液(若碘化钾溶液已被空气氧化,可用稀亚硫酸钠溶液滴到黄色消失)和1~2滴淀粉溶液,混合均匀后加入乙醚,出现蓝色即表示有过氧化物存在。除去过氧化物可用新配制的硫酸亚铁稀溶液(配制方法是FeSO4?H2O60g,100mL水和6mL浓硫酸)。将100mL乙醚和10mL新配制的硫酸亚铁溶液放在分液漏斗中洗数次,至无过氧化物为止。醇和水的检验和除去:乙醚中放入少许高锰酸钾粉末和一粒氢氧化钠。放置后,氢氧化钠表面附有棕色树脂,即证明有醇存在。水的存在用无水硫酸铜检验。先用无水氯化钙除去大部分水,再经金属钠干燥。其方法是:将100mL乙醚放在干燥锥形瓶中,加入20~25g无水氯化钙,瓶口用软木塞塞紧,放置一天以上,并间断摇动,然后蒸馏,收集33~37℃的馏分。用压钠机将1g金属钠直接压成钠丝放于盛乙醚的瓶中,用带有氯化钙干燥管的软木塞塞住。或在木塞中插一末端拉成毛细管的玻璃管,这样,既可防止潮气浸入,又可使产生的气体逸出。放置至无气泡发生即可使用;放置后,若钠丝表面已变黄变粗时,须再蒸一次,然后再压入钠丝。
亚沸蒸馏是采用红外加热液体表面,让液体表面缓慢蒸发,那么可不可以用电热套在溶液底部缓慢加热,让溶液表面也缓慢蒸发,用电热套在底部加热可以代替红外光加热液体表面吗?可以代替吗?前提是电热套加热控制温度不超过溶液沸点。用电热套在底部加热可以代替红外光加热液体表面吗?我觉得两者的加热效果都是一样的,求解。小知识:蒸馏是一种最常见的提纯液体物质的方法,我们通常所说的蒸馏系指经典的沸腾蒸馏法。然而我们也早就发现这种蒸馏法提纯效果是极其有限的。例如当用蒸馏法制备蒸馏水时,其一次蒸馏水与五次蒸馏水中所吉金属离子的浓度变化不大,都还较高,其原因就在于一般蒸馏时要使溶液沸腾,而沸腾时出现了大量的蒸气雾粒,而每个蒸气雾粒则由几百乃至几百万个水分子组成,这样在蒸馏沸腾过程中,金屑离子或固体微粒就可能夹在蒸气雾粒中进入提纯后的液体中去。因而提纯效果十分有限为此,为了阻止金属离子或固体微粒在提纯中混入蒸气,就产生了亚沸蒸馏法,亚沸蒸馏的要点就在于将被提纯的液体加热到沸点以下的10~20℃ ,由于远未达到沸点,这时和液体平衡的气相也就不再是由大量蒸气雾粒所组成,基本是以分子状态与液相平衡 此时蒸气中就极少或可能不夹带进金属离子或固体微粒了,再在其气相空间放一个冷凝器,由于冷凝管表面温度远低于被加热的液体温度,所以以分子状态存在于气相空间的蒸气又在冷凝管上冷凝成液体,收集起来,就是用亚沸法提纯的液体了。由其原理我们可以清楚的知道.亚沸法在除去液体的金属离子或固体微粒方面是非常有效的,但在除去可溶于液体中的其它气体时,效果就微乎其微了,也就是说亚沸蒸馏是一种除去液体中金屑离子与固体微粒的极为有效的方法
常用有机溶剂的纯化-丙酮 沸点56.2℃,折光率1.358 8,相对密度0.789 9。 普通丙酮常含有少量的水及甲醇、乙醛等还原性杂质。其纯化方法有: ⑴于250mL丙酮中加入2.5g高锰酸钾回流,若高锰酸钾紫色很快消失,再加入少量高锰酸钾继续回流,至紫色不褪为止。然后将丙酮蒸出,用无水碳酸钾或无水硫酸钙干燥,过滤后蒸馏,收集55~56.5℃的馏分。用此法纯化丙酮时,须注意丙酮中含还原性物质不能太多,否则会过多消耗高锰酸钾和丙酮,使处理时间增长。⑵将100mL丙酮装入分液漏斗中,先加入4mL10%硝酸银溶液,再加3.6mL1mol/L氢氧化钠溶液,振摇10min,分出丙酮层,再加入无水硫酸钾或无水硫酸钙进行干燥。最后蒸馏收集55~56.5℃馏分。此法比方法⑴要快,但硝酸银较贵,只宜做小量纯化用。常用有机溶剂的纯化-四氢呋喃 沸点67℃(64.5℃),折光率1.405 0,相对密度0.889 2。四氢呋喃与水能混溶,并常含有少量水分及过氧化物。如要制得无水四氢呋喃,可用氢化铝锂在隔绝潮气下回流(通常1000mL约需2~4g氢化铝锂)除去其中的水和过氧化物,然后蒸馏,收集66℃的馏分蒸馏时不要蒸干,将剩余少量残液即倒出)。精制后的液体加入钠丝并应在氮气氛中保存。处理四氢呋喃时,应先用小量进行试验,在确定其中只有少量水和过氧化物,作用不致过于激烈时,方可进行纯化。四氢呋喃中的过氧化物可用酸化的碘化钾溶液来检验。如过氧化物较多,应另行处理为宜。常用有机溶剂的纯化-二氧六环 沸点101.5℃,熔点12℃,折光率1.442 4,相对密度1.033 6。二氧六环能与水任意混合,常含有少量二乙醇缩醛与水,久贮的二氧六环可能含有过氧化物(鉴定和除去参阅乙醚)。二氧六环的纯化方法,在500mL二氧六环中加入8mL浓盐酸和50mL水的溶液,回流6~10h,在回流过程中,慢慢通入氮气以除去生成的乙醛。冷却后,加入固体氢氧化钾,直到不能再溶解为止,分去水层,再用固体氢氧化钾干燥24h。然后过滤,在金属钠存在下加热回流8~12h,最后在金属钠存在下蒸馏 ,压入饥丝密封保存。精制过的1,4-二氧环己烷应当避免与空气接触。常用有机溶剂的纯化-吡啶沸点115.5℃,折光率1.509 5,相对密度0.981 9。分析纯的吡啶含有少量水分,可供一般实验用。如要制得无水吡啶,可将吡啶与粒氢氧化钾(钠)一同回流,然后隔绝潮气蒸出备用。干燥的吡啶吸水性很强,保存时应将容器口用石蜡封好。常用有机溶剂的纯化-石油醚石油醚为轻质石油产品,是低相对分子质量烷烃类的混合物。其沸程为30~150℃,收集的温度区间一般为30℃左右。有30~60℃,60~90℃,90~120℃等沸程规格的石油醚。其中含有少量不饱和烃,沸点与烷烃相近,用蒸馏法无法分离。石油醚的精制通常将石油醚用其体积的浓硫酸洗涤2~3次,再用10%硫酸加入高锰酸钾配成的饱和溶液洗涤,直至水层中的紫色不再消失为止。然后再用水洗,经无水氯化钙干燥后蒸馏。若需绝对干燥的石油醚,可加入钠丝(与纯化无水乙醚相同)。常用有机溶剂的纯化-甲醇 沸点64.96℃,折光率1.328 8,相对密度0.791 4。普通未精制的甲醇含有0.02%丙酮和0.1%水。而工业甲醇中这些杂质的含量达0.5%~1%。为了制得纯度达99.9%以上的甲醇,可将甲醇用分馏柱分馏。收集64℃的馏分,再用镁去水(与制备无水乙醇相同)。甲醇有毒,处理时应防止吸入其蒸气。 常用有机溶剂的纯化-乙酸乙酯沸点77.06℃,折光率1.372 3,相对密度0.900 3。乙酸乙酯一般含量为95%~98%, 含有少量水、乙醇和乙酸。可用下法纯化:于1000mL乙酸乙酯中加入100mL乙酸酐,10滴浓硫酸,加热回流4h,除去乙醇和水等杂质,然后进行蒸馏。馏液用20~30g无水碳酸钾振荡,再蒸馏。产物沸点为77℃,纯度可达以上99%。常用有机溶剂的纯化-乙醚沸点34.51℃,折光率1.352 6,相对密度0.713 78。普通乙醚常含有2%乙醇和0.5%水。久藏的乙醚常含有少量过氧化物过氧化物的检验和除去:在干净和试管中放入2~3滴浓硫酸,1mL2%碘化钾溶液(若碘化钾溶液已被空气氧化,可用稀亚硫酸钠溶液滴到黄色消失)和1~2滴淀粉溶液,混合均匀后加入乙醚,出现蓝色即表示有过氧化物存在。除去过氧化物可用新配制的硫酸亚铁稀溶液(配制方法是FeSO4?H2O60g,100mL水和6mL浓硫酸)。将100mL乙醚和10mL新配制的硫酸亚铁溶液放在分液漏斗中洗数次,至无过氧化物为止。醇和水的检验和除去:乙醚中放入少许高锰酸钾粉末和一粒氢氧化钠。放置后,氢氧化钠表面附有棕色树脂,即证明有醇存在。水的存在用无水硫酸铜检验。先用无水氯化钙除去大部分水,再经金属钠干燥。其方法是:将100mL乙醚放在干燥锥形瓶中,加入20~25g无水氯化钙,瓶口用软木塞塞紧,放置一天以上,并间断摇动,然后蒸馏,收集33~37℃的馏分。用压钠机将1g金属钠直接压成钠丝放于盛乙醚的瓶中,用带有氯化钙干燥管的软木塞塞住。或在木塞中插一末端拉成毛细管的玻璃管,这样,既可防止潮气浸入,又可使产生的气体逸出。放置至无气泡发生即可使用;放置后,若钠丝表面已变黄变粗时,须再蒸一次,然后再压入钠丝。
请问论坛里有使用“亚沸蒸馏装置”来提纯酸的朋友么?希望能和您了解这个东西的一些信息:1、CETAC是不是也有做这个?和Savillex的相比,哪个比较好呢?2、如果要求蒸馏出来的酸中P、B的含量不高于100ppt的话,使用GR级的酸做原料,产率大约有多少?3、提纯氢氟酸、硝酸、硫酸和高氯酸,在不考虑交叉污染的情况下,这个设备是不是通用的?4、按照每2天消耗:500ml的高纯氢氟酸、300ml的高纯硝酸来计算。CETAC和Savillex的价格大约是多少呢?先谢谢各位大虾了。PS:如有使用其他品牌的,也期望您能帮个忙。
常用有机溶剂的纯化-乙酸乙酯沸点77.06℃,折光率1.372 3,相对密度0.900 3。乙酸乙酯一般含量为95%~98%, 含有少量水、乙醇和乙酸。可用下法纯化:于1000mL乙酸乙酯中加入100mL乙酸酐,10滴浓硫酸,加热回流4h,除去乙醇和水等杂质,然后进行蒸馏。馏液用20~30g无水碳酸钾振荡,再蒸馏。产物沸点为77℃,纯度可达以上99%。常用有机溶剂的纯化-乙醚沸点34.51℃,折光率1.352 6,相对密度0.713 78。普通乙醚常含有2%乙醇和0.5%水。久藏的乙醚常含有少量过氧化物过氧化物的检验和除去:在干净和试管中放入2~3滴浓硫酸,1mL2%碘化钾溶液(若碘化钾溶液已被空气氧化,可用稀亚硫酸钠溶液滴到黄色消失)和1~2滴淀粉溶液,混合均匀后加入乙醚,出现蓝色即表示有过氧化物存在。除去过氧化物可用新配制的硫酸亚铁稀溶液(配制方法是FeSO4?H2O60g,100mL水和6mL浓硫酸)。将100mL乙醚和10mL新配制的硫酸亚铁溶液放在分液漏斗中洗数次,至无过氧化物为止。醇和水的检验和除去:乙醚中放入少许高锰酸钾粉末和一粒氢氧化钠。放置后,氢氧化钠表面附有棕色树脂,即证明有醇存在。水的存在用无水硫酸铜检验。先用无水氯化钙除去大部分水,再经金属钠干燥。其方法是:将100mL乙醚放在干燥锥形瓶中,加入20~25g无水氯化钙,瓶口用软木塞塞紧,放置一天以上,并间断摇动,然后蒸馏,收集33~37℃的馏分。用压钠机将1g金属钠直接压成钠丝放于盛乙醚的瓶中,用带有氯化钙干燥管的软木塞塞住。或在木塞中插一末端拉成毛细管的玻璃管,这样,既可防止潮气浸入,又可使产生的气体逸出。放置至无气泡发生即可使用;放置后,若钠丝表面已变黄变粗时,须再蒸一次,然后再压入钠丝。常用有机溶剂的纯化-乙醇 沸点78.5℃,折光率1.361 6,相对密度0.789 3。制备无水乙醇的方法很多,根据对无水乙醇质量的要求不同而选择不同的方法。若要求98%~99%的乙醇,可采用下列方法: ⑴利用苯、水和乙醇形成低共沸混合物的性质,将苯加入乙醇中,进行分馏,在64.9℃时蒸出苯、水、乙醇的三元恒沸混合物,多余的苯在68.3与乙醇形成二元恒沸混合物被蒸出,最后蒸出乙醇。工业多采用此法。⑵用生石灰脱水。于100mL95%乙醇中加入新鲜的块状生石灰20g,回流3~5h,然后进行蒸馏。若要99%以上的乙醇,可采用下列方法: ⑴在100mL99%乙醇中,加入7g金属钠,待反应完毕,再加入27.5g邻苯二甲酸二乙酯或25g草酸二乙酯,回流2~3h,然后进行蒸馏。金属钠虽能与乙醇中的水作用,产生氢手和氢氧化钠,但所生成的氢氧化钠又与乙醇发生平衡反应,因此单独使用金属钠不能完全除去乙醇中的水,须加入过量的高沸点酯,如邻苯二甲酸二乙酯与生成的氢氧化钠作用,抑制上述反应,从而达到进一步脱水的目的。⑵在60mL99%乙醇中,加入5g镁和0.5g碘,待镁溶解生成醇镁后,再加入900mL99%乙醇,回流5h后,蒸馏,可得到99.9%乙醇。由于乙醇具有非常强的吸湿性,所以在操作时,动作要迅速,尽量减少转移次数以防止空气中的水分进入,同时所用仪器必须事前干燥好。 常用有机溶剂的纯化-DMSO沸点189℃,熔点18.5℃,折光率1.4783,相对密度1.100。二甲基亚砜能与水混合,可用分子筛长期放置加以干燥。然后减压蒸馏,收集76℃/1600Pa(12mmHg)馏分。蒸馏时,温度不可高于90℃,否则会发生歧化反应生成二甲砜和二甲硫醚。也可用氧化钙、氢化钙、氧化钡或无水硫酸钡来干燥,然后减压蒸馏。也可用部分结晶的方法纯化。二甲基亚砜与某些物质混合时可能发生爆炸,例如氢化钠、高碘酸或高氯酸镁等应予注意。常用有机溶剂的纯化-DMF N,N-二甲基甲酰胺 沸点149~156℃,折光率1.430 5,相对密度0.948 7。无色液体,与多数有机溶剂和水可任意混合,对有机和无机化合物的溶解性能较好。N,N-二甲基甲酰胺含有少量水分。常压蒸馏时有些分解,产生二甲胺和一氧化碳。在有酸或碱存在时,分解加快。所以加入固体氢氧化钾(钠)在室温放置数小时后,即有部分分解。因此,最常用硫酸钙、硫酸镁、氧化钡、硅胶或分子筛干燥,然后减压蒸馏,收集76℃/4800Pa(36mmHg)的馏分。其中如含水较多时,可加入其1/10体积的苯,在常压及80℃以下蒸去水和苯,然后再用无水硫酸镁或氧化钡干燥,最后进行减压蒸馏。纯化后的N,N-二甲基甲酰胺要避光贮存。N,N-二甲基甲酰胺中如有游离胺存在,可用2,4二硝基氟苯产生颜色来检查。常用有机溶剂的纯化-二氯甲烷沸点40℃,折光率1.424 2,相对密度1.326 6。使用二氯甲烷比氯仿安全,因此常常用它来代替氯仿作为比水重的萃取剂。普通的二氯甲烷一般都能直接做萃取剂用。如需纯化,可用5%碳酸钠溶液洗涤,再用水洗涤,然后用无水氯化钙干燥,蒸馏收集40~41℃的馏分,保存在棕色瓶中。沸点101.5℃,熔点12℃,折光率1.442 4,相对密度1.033 6。二氧六环能与水任意混合,常含有少量二乙醇缩醛与水,久贮的二氧六环可能含有过氧化物(鉴定和除去参阅乙醚)。二氧六环的纯化方法,在500mL二氧六环中加入8mL浓盐酸和50mL水的溶液,回流6~10h,在回流过程中,慢慢通入氮气以除去生成的乙醛。冷却后,加入固体氢氧化钾,直到不能再溶解为止,分去水层,再用固体氢氧化钾干燥24h。然后过滤,在金属钠存在下加热回流8~12h,最后在金属钠存在下蒸馏 ,压入饥丝密封保存。精制过的1,4-二氧环己烷应当避免与空气接触。常用有机溶剂的纯化-二硫化碳沸点46.25℃,折光率1.631 9,相对密度1.2632。二硫化碳为有毒化合物,能使血液神经组织中毒。具有高度的挥发性和易燃性,因此,使用时应避免与其蒸气接触。对二硫化碳纯度要求不高的实验,在二硫化碳中加入少量无水氯化钙干燥几小时,在水浴55℃~65℃下加热蒸馏、收集。如需要制备较纯的二硫化碳,在试剂级的二硫化碳中加入0.5%高锰酸钾水溶液洗涤三次。除去硫化氢再用汞不断振荡以除去硫。最后用2.5%硫酸汞溶液洗涤,除去所有的硫化氢(洗至没有恶臭为止),再经氯化钙干燥,蒸馏收集。常用有机溶剂的纯化-氯仿沸点61.7℃,折光率1.445 9,相对密度1.483 2。氯仿在日光下易氧化成氯气、氯化氢和光气(剧毒),故氯仿应贮于棕色瓶中。市场上供应的氯仿多用1%酒精做稳定剂,以消除产生的光气。氯仿中乙醇的检验可用碘仿反应;游离氯化氢的检验可用硝酸银的醇溶液。除去乙醇可将氯仿用其二分之一体积的水振摇数次分离下层的氯仿,用氯化钙干燥24h,然后蒸馏。另一种纯化方法:将氯仿与少量浓硫酸一起振动两三次。每200mL氯仿用10mL浓硫酸,分去酸层以后的氯仿用水洗涤,干燥,然后蒸馏。除去乙醇后的无水氯仿应保存在棕色瓶中并避光存放,以免光化作用产生光气。常用有机溶剂的纯化-苯 沸点80.1℃,折光率1.501 1,相对密度0.87865。普通苯常含有少量水和噻吩,噻吩和沸点84℃,与苯接近,不能用蒸馏的方法除去。噻吩的检验:取1mL苯加入2mL溶有2mg吲哚醌的浓硫酸,振荡片刻,若酸层号蓝绿色,即表示有噻吩存在。噻吩和水的除去:将苯装入分液漏斗中,加入相当于苯体积七分之一的浓硫酸,振摇使噻吩磺化,弃去酸液,再加入新的浓硫酸,重复操作几次,直到酸层呈现无色或淡黄色并检验无噻吩为止。将上述无噻吩的苯依次用10%碳酸钠溶液和水洗至中性,再用氯化钙干燥,进行蒸馏,收集80℃的馏分,最后用金属钠脱去微量的水得无水苯。
因为有实验室说要购买不锈钢蒸馏水器和石英双重蒸馏水器,所以我想问问各位老师这个是为什么呢?是不是因为如果原水是自来水的话,先用不锈钢蒸馏水器蒸出的水再用石英双重蒸馏水器再蒸一次,这样的纯水会更好?那么如果我用自来水为原来直接用石英双重蒸馏水器蒸是不是就没有上述的水好?
各位大神谁有1810-B 石英双重纯水蒸馏器作业指导书,谢谢啊
常用有机溶剂的纯化-丙酮 沸点56.2℃,折光率1.358 8,相对密度0.789 9。 普通丙酮常含有少量的水及甲醇、乙醛等还原性杂质。其纯化方法有: ⑴于250mL丙酮中加入2.5g高锰酸钾回流,若高锰酸钾紫色很快消失,再加入少量高锰酸钾继续回流,至紫色不褪为止。然后将丙酮蒸出,用无水碳酸钾或无水硫酸钙干燥,过滤后蒸馏,收集55~56.5℃的馏分。用此法纯化丙酮时,须注意丙酮中含还原性物质不能太多,否则会过多消耗高锰酸钾和丙酮,使处理时间增长。⑵将100mL丙酮装入分液漏斗中,先加入4mL10%硝酸银溶液,再加入3.6mL1mol/L氢氧化钠溶液,振摇10min,分出丙酮层,再加入无水硫酸钾或无水硫酸钙进行干燥。最后蒸馏收集55~56.5℃馏分。此法比方法⑴要快,但硝酸银较贵,只宜做小量纯化用。常用有机溶剂的纯化-四氢呋喃 沸点67℃(64.5℃),折光率1.405 0,相对密度0.889 2。四氢呋喃与水能混溶,并常含有少量水分及过氧化物。如要制得无水四氢呋喃,可用氢化铝锂在隔绝潮气下回流(通常1000mL约需2~4g氢化铝锂)除去其中的水和过氧化物,然后蒸馏,收集66℃的馏分蒸馏时不要蒸干,将剩余少量残液即倒出)。精制后的液体加入钠丝并应在氮气氛中保存。处理四氢呋喃时,应先用小量进行试验,在确定其中只有少量水和过氧化物,作用不致过于激烈时,方可进行纯化。四氢呋喃中的过氧化物可用酸化的碘化钾溶液来检验。如过氧化物较多,应另行处理为宜。常用有机溶剂的纯化-二氧六环 沸点101.5℃,熔点12℃,折光率1.442 4,相对密度1.033 6。二氧六环能与水任意混合,常含有少量二乙醇缩醛与水,久贮的二氧六环可能含有过氧化物(鉴定和除去参阅乙醚)。二氧六环的纯化方法,在500mL二氧六环中加入8mL浓盐酸和50mL水的溶液,回流6~10h,在回流过程中,慢慢通入氮气以除去生成的乙醛。冷却后,加入固体氢氧化钾,直到不能再溶解为止,分去水层,再用固体氢氧化钾干燥24h。然后过滤,在金属钠存在下加热回流8~12h,最后在金属钠存在下蒸馏 ,压入饥丝密封保存。精制过的1,4-二氧环己烷应当避免与空气接触。常用有机溶剂的纯化-吡啶沸点115.5℃,折光率1.509 5,相对密度0.981 9。分析纯的吡啶含有少量水分,可供一般实验用。如要制得无水吡啶,可将吡啶与粒氢氧化钾(钠)一同回流,然后隔绝潮气蒸出备用。干燥的吡啶吸水性很强,保存时应将容器口用石蜡封好。常用有机溶剂的纯化-石油醚石油醚为轻质石油产品,是低相对分子质量烷烃类的混合物。其沸程为30~150℃,收集的温度区间一般为30℃左右。有30~60℃,60~90℃,90~120℃等沸程规格的石油醚。其中含有少量不饱和烃,沸点与烷烃相近,用蒸馏法无法分离。石油醚的精制通常将石油醚用其体积的浓硫酸洗涤2~3次,再用10%硫酸加入高锰酸钾配成的饱和溶液洗涤,直至水层中的紫色不再消失为止。然后再用水洗,经无水氯化钙干燥后蒸馏。若需绝对干燥的石油醚,可加入钠丝(与纯化无水乙醚相同)。常用有机溶剂的纯化-甲醇 沸点64.96℃,折光率1.328 8,相对密度0.791 4。普通未精制的甲醇含有0.02%丙酮和0.1%水。而工业甲醇中这些杂质的含量达0.5%~1%。为了制得纯度达99.9%以上的甲醇,可将甲醇用分馏柱分馏。收集64℃的馏分,再用镁去水(与制备无水乙醇相同)。甲醇有毒,处理时应防止吸入其蒸气。
乙酸乙酯沸点77.06℃,折光率1.372 3,相对密度0.9003。乙酸乙酯一般含量为95%~98%, 含有少量水、乙醇和乙酸。可用下法纯化:于1000mL乙酸乙酯中加入100mL乙酸酐,10滴浓硫酸,加热回流4h,除去乙醇和水等杂质,然后进行蒸馏。馏液用20~30g无水碳酸钾振荡,再蒸馏。产物沸点为77℃,纯度可达以上99%。
GB 11737-89‘二硫化碳用5%的浓硫酸甲醛溶液反复提取,直至硫酸无色为止,用蒸馏水洗二硫化碳至中性,再用无水硫酸钠干燥,重蒸馏,贮于冰箱中’,有做环境空气中苯系物检测的老师可以指导一下二硫化碳的纯化吗
如题。听说有个这种仪器可以蒸馏酸的仪器,不知道哪位大师用过?实用不?谢谢不吝赐教。
吡啶蒸馏纯化时用硅胶塞有无影响?
通俗的说,去离子水和蒸馏水是两类水,而不是两种水。普遍来说蒸馏水的离子比去离子水高,去离子去过不经过紫外消毒或者滤膜的话,可能会带点微生物,看具体工艺。去离子水是用离子交换树脂来去除水中的大量的阴阳离子,但是不能去除所有的离子。而蒸馏水,是蒸汽遇冷凝结的,所以基本不含离子(氢离子和氢氧根离子除外),所以蒸馏水的纯度要比去离子水的高,你测电导率就可以知道蒸馏水的电导率要低。一般分析的时候使用蒸馏水,而工厂生产是使用去离子水。这两种水的其他不同都是由制备方法不同所导致所以归根结底就是制备方法不同。各方法做出来的水的纯度都会随着重复次数的增加而提高。纯化任务要考虑的是原混合物的具体情况,选择有针对性的纯化方法。 所以,要比较的话,必须指明从什么水开始,经过几次蒸馏或几级渗透膜。而且膜也有很多种类。膜分离技术本身也在不断发展中。用不同的膜除的是不同的东西,会为了除很冷门的物质而开发很冷门的膜。细菌就可以通过过膜而除去,并不一定非要紫外。纯化不是向水中添加指定的物质,而是从水中除去指定的物质,所以成份有什么不一样,也跟你拿什么水去纯化有关。拿池塘水和自来水的结果当然就不一样。简单地说,去离子水是把水中的钠、镁、钙、锌、铁等离子去掉。看看矿泉水的包装,肯定能看到这些离子的含量。把这些离子除去,对做研究来说,实验结果就精确科学得多。对日常生活来说,水由“硬水”变成“软水”,洗衣服的时候不起泡沫的问题得到解决,而且烧水的水壶也不会结垢,据说患结石的概率也会减少。在家庭里,往往是通过直饮水的离子柱产生离子水。一般都有一根柱子来出去细菌。蒸馏水是要把水煮沸,水蒸气在锅盖受冷变回水滴,把这些水滴收集起来就是蒸馏水了。简单总结就是,去离子水可以用蒸馏水代替,蒸馏水的等级高于去离子水,但要用蒸馏水的不能用去离子水!
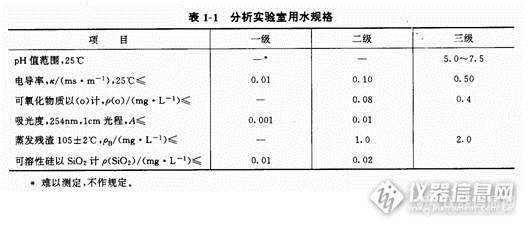
分析实验室进行稀释,溶解和清洗的水由于分析的要求不同,对水的纯度要求应根据不同的实验要求,进行制备。分析实验室用于溶解、稀释和配制溶液的水,都必须先经过纯化。分析要求不同,对水质纯度的要求也不同。故应根据不同要求,采用不同纯化方法制得纯水。一般实验室用的纯水有蒸馏水、二次蒸馏水、去离子水、无二氧化碳蒸馏水、无氨蒸馏水等。1、分析实验室用水的规格http://ng1.17img.cn/bbsfiles/images/2015/11/201511061540_572580_2961690_3.jpg根据中华人民共和国国家标准GB6682-92《分析实验室用水规格及试验方法》的规定,分析实验室用水分为三个级别:一级水、二级水和三级水。分析实验室用水应符合表1-1所列规格。一级水用于有严格要求的分析实验,包括对颗粒有要求的实验,如高效液相色谱用水。一级水可用二级水经过石英设备蒸馏或离子交换混合床处理后,再经0.2mm微孔滤膜过滤来制取。二级水用于无机痕量分析等试验,如原子吸收光谱分析用水。二级水可用多次蒸馏或离子交换等方法制取。三级水用于一般化学分析实验。三级水可用蒸馏或离子交换等方法制取。实验室使用的蒸馏水,为保持纯净,蒸馏水瓶要随时加塞,专用虹吸管内外均应保持干净。蒸馏水瓶附近不要存放浓NH3·H2O,HCl等易挥发试剂,以防污染。通常用洗瓶取蒸馏水。用洗瓶取水时,不要取出其塞子和玻管,也不要把蒸馏水瓶上的虹吸管插入洗瓶内。通常,普通蒸馏水保存在玻璃容器中,去离子水保存在聚乙烯塑料容器中。用于痕量分析的高纯水,如二次亚沸石英蒸馏水,则需要保存在石英或聚乙烯塑料容器中。2、水纯度的检查按照国家标准GB6682-92所规定的试验方法检查水的纯度是法定的水质检查方法。根据各实验室分析任务的要求和特点往往对实验用水也经常采用如下方法进行一些项目的检查:酸度 要求纯水的pH值在6~7。检查方法是在两支试管中各加10mL待测的水,一管中加2滴0.1%甲基红指示剂,不显红色;另一管加5滴0.1%澳百里酚蓝指示剂,不显蓝色,即为合格。硫酸根 取待测水2~3mL放入试管中,加2~3滴2mo1/L盐酸酸化,再加1滴0.1%氯化钡溶液,放置15h,不应有沉淀析出。氯离子 取2~3mL待测水,加1滴6mo1/L硝酸酸化,再加1滴0.1%硝酸银溶液,不应产生混浊。钙离子 取2~3mL待测水,加数滴6mo1/L氨水使呈碱性,再加饱和草酸铵溶液2滴,放置12h后,无沉淀析出。镁离子 取2~3mL待测水,加1滴0.1%鞑革达黄及数滴6mo1/L氢氧化钠溶液,如有淡红色出现,即有镁离子,如呈橙色则合格。铵离子 取2~3mL待测水,加1~2滴内氏试剂,如呈黄色则有铵离子。游离二氧化碳 取100mL待测水注入锥形瓶中,加3~4滴0.1%酚酞溶液,如呈淡红色,表示无游离二氧化碳;如为无色,可加0.1000mo1/L氢氧化钠溶液至淡红色,l min内不消失,即为终点。算出游离二氧化碳的含量。注意,氢氧化钠溶液用量不能超过0.1mL。3、水纯度分析结果的表示通常用以下几种表示方法:(1)毫克/升(mg/L):表示每升水中含有某物质的毫克数。(2)微克/升(mg/L ):表示每升水中含有某物质的微克数。(3)硬度 我国采用1L水中含有l0mg氧化钙作为硬度的1度,这和德国标准一致,所以有时也称作1德国度。4、各种纯度水的制备(1)蒸馏水将自来水在蒸馏装置中加热汽化,然后将蒸汽冷凝即可得到蒸馏水。由于杂质离子一般不挥发,所以蒸馏水中所含杂质比自来水少得多,比较纯净,可达到三级水的指标,但还有少量金属离子、二氧化碳等杂质。(2)二次石英亚沸蒸馏水为了获得比较纯净的蒸馏水,可以进行重蒸馏,并在准备重蒸馏的蒸馏水中加人适当的试剂以抑制某些杂质的挥发。如加入甘露醇能抑制硼的挥发。加入碱性高锰酸钾可破坏有机物并防止二氧化碳蒸出。二次蒸馏水一般可达到二级水指标。第二次蒸馏通常采用石英亚沸蒸馏器,其特点是在液面上方加热,使液面始终处于亚沸状态,可使水蒸气带出的杂质减至最低。(3)去离子水去离子水是使自来水或普通蒸馏水通过离子树脂交换柱后所得的水。制备时,一般将水依次通过阳离子树脂交换柱、阴离子树脂交换柱、阴阳离子树脂混合交换柱。这样得到的水纯度比蒸馏水纯度高,质量可达到二级或一级水指标,但对非电解质及胶体物质无效,同时会有微量的有机物从树脂溶出,因此,根据需要可将去离子水进行重蒸馏以得到高纯水。市售70型离子交换纯水器可用于实验室制备去离子水。(4)特殊用水的制备无氨水:①每升蒸馏水中加25mL 5%的氢氧化钠溶液后,再煮沸1h,然后用前述的方法检查按离子。②每升蒸馏水中加2mL浓硫酸,再重蒸馏,即得无氨蒸馏水。无二氧化碳蒸馏水:煮沸蒸馏水,直至煮去原体积的1/4或1/5,隔离空气,冷却即得。此水应贮存于连接碱石灰吸收管的瓶中,其pH值应为7。无氯蒸馏水:将蒸馏水在硬质玻璃蒸馏器中先煮沸,再进行蒸馏,收集中间馏出部分,即得无氯蒸馏水。
化学试剂的纯化 在化学分析、仪器分析、无机制备、有机合成以及其他的科学实验工作中经常会遇到所用的化学试剂纯度不够,或买不到所需纯度的化学试剂,这就需要在实验室自己对现有的化学试剂进行纯化,以便得到所需纯度的化学试剂。实验室中常用的纯化化学试剂的方法有:蒸馏和精馏、重结晶、萃取、区域熔融和色谱分离等等,下面将分别加以简单介绍。第一节 蒸馏和精馏 蒸馏和精馏是一种使用广泛的纯化方法,根据液体混合物中液体和蒸汽之间混合组分的分配差别进行纯化,是纯化挥发性和半挥发性化学试剂的第一选择。一、蒸馏原理 蒸馏的主要目的是从含有杂质的化学试剂中分离出挥发性和半挥发性的杂质或将易挥发和半挥发的主体蒸发出来,将不挥发和难挥发的杂质留下。一种物质在不同温度下的饱和蒸汽压变化是蒸馏分离的基础。大体说来,如果液体混合物中两种组分的蒸汽压具有较大差别,就可以富集蒸汽相中更多的挥发性和半挥发性的组分。两相-液相和蒸[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]-可以分别地被回收,挥发性和半挥发性的组分富集在[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]中而不挥发性组分被富集在液相中。 除了烃类混合物和少数其它例子之外,Raoult定律和Dalton定律可用于理想混合物体系,混合物溶液常常不遵循理想的蒸汽相-液相行为。应用这两个定律可以得到一个二元体系的两种组分的比挥发性(aAB): aAB = (YA/YB)/ (XA/XB) = P0A/ P0B 其中,YA和YB分别是平衡时[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]中组分A和B的摩尔分数,XA和XB分别是平衡时液相中组分A和B的摩尔分数,P0A和 P0B 分别是平衡时组分A和B的蒸汽压,均服从Raouilt定律。随着aAB增加,富集程度也增加。二、简单蒸馏 最简单的蒸馏装置,如图-1所示。当一个液体样品被加热并转变成蒸汽时,其中有一部分被冷凝而回到原来的蒸馏瓶中,而其余的被冷凝并转入收集容器中,前者叫回流液,后者叫流出液。由于蒸馏是连续进行,逸出的和保存在液体中的组成在慢慢地改变。作为一种纯化化学试剂的方法,简单蒸馏只能分离具有较大的沸点差别的杂质,诸如沸点与主体差别大于50℃的杂质。若要除去沸点与主体差别小于50℃的杂质,则要采用下面介绍的精馏方法。 简单的常压蒸馏装置主要由带有侧管的蒸馏烧瓶、温度计、冷凝器、收集器和加热装置等组成。安装时,温度计的水银球应插到较侧管稍低的位置,蒸馏烧瓶的侧管与冷凝器连接成卧式,冷凝器的下口与收集器连接(图-1)。使用蒸馏装置时,根据被蒸馏的化学试的沸点选择加热装置:被蒸馏液体的沸点在80℃以下时,用热水浴加热;液体沸点在100℃以上时,在石棉网上用直火或者用油浴加热;液体温度在200℃以上时,用金属浴加热。 蒸馏沸点在150℃以上的液体时,可使用空气冷凝器。为了使蒸馏顺利进行,在液体装入烧瓶后和加热之前,必须在烧瓶内加入沸石。因为烧瓶的内表面很光滑,容易发生过热而突然沸腾,致使蒸馏不能顺利进行。当添加新的沸石时,必须等烧瓶内的液体冷却到室温以后才可加入,否则有发生急剧沸腾的危险。沸石只能使用一次,当液体冷却之后,原来加入的沸石即失去效果,所以继续蒸馏时,须加入新的沸石。在常压蒸馏中,具有多孔、不易碎、与蒸馏物质不发生化学反应的物质,均可用作沸石。常用的沸石是切成1~2毫米的素烧陶土或碎的瓷片。 蒸馏装置安装完毕,就可以开始加热了。当蒸馏瓶中的物质开始沸腾时,温度急剧上升。当温度上升到被蒸馏物质沸点上下1℃时,将加热器的加热强度调节到每秒钟流出一滴的程度。此时,加热浴的温度应当保持在比蒸馏瓶中物质的沸点高20℃左右。蒸馏沸点较高的物质时,当蒸汽未达到侧管之前即被外气冷却而回流,使其无法蒸馏出来。此时可使用微小火焰均匀加热侧管的下面,但要避免加热过度,致使温度计不表示正确的沸点,也可对蒸馏瓶不加热部分进行适当的保温。。在蒸馏操作中,应当注意以下几点: (1) 控制好加热温度。如果采用加热浴,加热浴的温度应当比蒸馏液体的沸点高出若干度,否则难以将被蒸馏物蒸馏出来。加热浴温度比蒸馏液体沸点高出的越多,蒸馏速度越快。但是,加热浴的温度也不能过高,否则会导致蒸馏瓶和冷凝器上部的蒸汽压超过大气压,有可能产生事故,特别是在蒸馏低沸点物质时尤其越多注意。一般地,加热浴的温度不能比蒸馏物质的沸点高出30℃。 (2) 蒸馏高沸点物质时,由于易被冷凝,往往蒸汽未到达蒸馏烧瓶的侧管处即已经被冷凝而滴回蒸馏瓶中。因此,应选用短颈蒸馏瓶或者采取保温措施,保证蒸馏顺利进行。 (3) 蒸馏之前,必须了解被蒸馏的化学试剂及其杂质的沸点和饱和蒸汽压,以决定何时(即在什么温度时)收集纯化学试剂。 (4) 蒸馏烧瓶应当采用园底烧瓶。