【线上讲座233期】实时细胞分析技术在肿瘤研究和病毒抗体疫苗检测中的应用 主讲人:周尧 活动时间:2013年10月9日-10月19日 热烈欢迎 周尧 老师光临生命科学仪器版面进行讲座!http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647975_2685866_3.gif引言实时无标记细胞分析技术(RTCA, Real Time cell Analysis)是艾森生物全球独有的专利核心技术,该技术采用特殊工艺,将微电极列阵整合在细胞培养板的每个细胞生长孔底部,用以构建实时、动态、定量跟踪细胞形态和增殖分化改变的细胞阻抗检测传感系统。该技术可广泛应用于生物活性因子测定、细胞增殖检测、大规模抗肿瘤药物筛选、细胞毒性检测等研究。http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647975_2685866_3.gif提要一、 实时细胞分析技术原理 1.传统终点检测与实时无标记动态检测 2. 实时细胞分析技术原理 3. 实时细胞分析技术优势二、 实时细胞分析技术平台产品简介三、 实时细胞分析技术在肿瘤、药物细胞毒性检测领域的应用 1.RTCA实时动态细胞毒性检测 2.肿瘤与微环境之间的相互作用RTCA实时动态检测 四、 实时细胞分析技术在病毒、细胞毒素、中和抗体及疫苗检测与评估领域的应用 1.RTCA实时动态检测病毒Cytopathic Eff ect效应 2.RTCA实时定量检测病毒侵染效力及评估中和抗体效价http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647975_2685866_3.gif提问时间:2013年10月09日--10月19日答疑时间: 2013年10月09日--10月19日特邀佳宾:生命科学仪器版面版主、专家以及同行们参与人员:仪器论坛全体注册用户活动细则:1、请大家就ATR技术知识的相关问题进行提问,直接回复本帖子即可,自即日起提问截至日期2013年10月19日2、凡积极参与且有自己的观点或言论的都有积分奖励(1-50分不等),提问的也有奖励在活动期间我们将评选出20名积极参与奖和5名精彩问答奖。3、提问格式:为了规范大家的提问格式,请按下面的规则来提问 :周尧老师您好!我有以下问题想请教,http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647975_2685866_3.gif说明:本讲座内容仅用于个人学习,请勿用于商业用途,由此引发的法律纠纷本人概不负责。虽然讲座的内容主要是对知识与经验的讲解、整理和总结,但是也凝聚着笔者大量心血,版权归tianzhen老师和仪器信息网所有。本讲座是根据笔者对资料的理解写的,理解片面、错误之处肯定是有,欢迎大家指正。http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647975_2685866_3.gif
iCELLigence全自动细胞分析仪让您远离MTT实验不断重复还无法得到统一结果的烦恼,让您不再因只看到其中的一个点而损失了其它的细胞生物学信息而无计可施,因为它可以清楚的记录下细胞完整的一生! 一:全自动细胞分析仪仪器原理 iCELLigence实时无标记全自动细胞分析仪是一款新型的细胞分析平台,具有实时监测、高信息量、无需标记、全自动化、高灵敏度和高准确性等独特优点。该细胞分析仪通过嵌在E-plate板上孔底的微电子感应器阻抗变化去感受细胞的有无以及贴壁、黏附和生长程度的改变。在细胞毒性检测中,可实时、直观的反应细胞增殖、存活、凋亡、形态变化等细胞生物学变化。 二:全自动细胞分析仪仪器优势 iCELLigence全自动细胞分析仪的传感器阻抗技术在细胞分析中具有其独特的优势:它为整个的细胞毒性检测分析过程中提供了全程无损伤的监控,实时、连续显示的数据让您可以更加自信更加清楚的进行细胞毒性检测操作和其它的细胞分析,而不是假定细胞处于合适的处理阶段。一连串实时获取和显示的数据让您处理每一步结果都可以通过机理来预测,同时也可以结合全自动细胞分析仪实时的读数来决定传统终点细胞毒性检测分析的最佳时间点。只需几个简单的操作步骤您就可以获得高信息量的、直观的、准确的结果,就可以让您的细胞实验变得更加省时高效。 三:全自动细胞分析仪的应用领域基于iCELLigence全自动细胞分析仪的技术优势,该系统在基础生命科学领域具有广泛的应用,如细胞质量控制、细胞毒性检测、细胞粘附和细胞伸展等。
细胞在体外进行培养,失去了机体的调节和控制。因此,除满足营养的要求外,还必须使细胞生存环境尽量接近活体的环境。外环境的培养条件如温度、渗透压、酸碱度等均能影响细胞的生长。 一、温度 一般哺乳类及禽类细胞体外培养的适宜温度是37~38℃。温度过高或过低都会影响到细胞的生长。细胞耐受低温的能力比抗热的能力强,在低温下,细胞的代谢活力及核分裂降低。温度不低于0℃时,虽影响细胞代谢,但并无伤害作用;把细胞置于25~35℃时,细胞仍能生存和生长,但速度减缓;放在40℃数小时后,再置回37℃培养细胞仍能继续生长。但如果在40℃下暴露时间太长,对细胞生长不利,甚至变圆脱落于瓶壁。若温度过低,在降到冰点以下时,细胞因胞外水和胞质结冰而受损死亡。但若向培养液中加入甘油或二甲亚砜等保护剂,封入安瓿中后,置于液氮中,可起保护作用,此时细胞可耐受-70℃以下温度,能长期储存,解冻后细胞复苏,仍能继续生长增殖,细胞生物性状不受任何影响。此为保存细胞的主要手段。 高温对细胞培养不利。细胞在39~40℃培养1小时,能受到一定损伤,但仍有可能恢复,但不能忍受温度再升高2℃,持续数小时,即在41~42℃中培养1小时,细胞损伤严重,温度至43℃以上时细胞多数被杀死。高温主要引起酶的灭活、类脂质破坏,核分裂的破坏,产生凝固酶使细胞发生凝固,另外使蛋白质变性。因此,体外培养细胞时一定要避免高温。 二、渗透压 细胞在高渗溶液或低渗溶液中,可以立即发生皱缩或肿胀、破裂。所以,渗透压是体外培养细胞的重要条件之一。哺乳动物和其他动物组织细胞体外培养的渗透压的维持主要与NaCl有关,但不能忽视其他电介质渗透压的关系。渗透压与单位体积溶媒内溶质的分子数和离子数成正比。为此,按一定比例控制培养液中离子平衡,维持正常渗透压是很重要的。这不仅是为了维持细胞张力,而且是为了调节细胞的代谢。因为细胞外离子输送和离子浓度改变着其他营养物质的输送(如氨基酸、蔗糖等),直接影响细胞基本合成系统。 理想的渗透压因细胞的类型及种族而异,人血浆渗透压为290mmol/L,被视为是体外培养人类细胞的理想渗透压。哺乳类动物细胞的渗透压一般为290~300mmol/L。人胚肺成纤维细胞为250~325mmol/L,鼠则为310mmol/L左右。在实际应用中,260~320mmol/L的渗透压可适于大多数细胞。
发酵过程中,细胞浓度是一个非常重要的生理参数,不但可以计算比生长速率,底物消耗速率、生物量产率和维持系数等参数,还可以及时判断是否有染菌等异常情况发生。目前测量细胞浓度的方法主要有化学法(DNA/RNA分析)和物理法(干重、光密度、呼吸商等)两大类。一般来说,与物理法相比,化学法能较准确的测量有代谢活性的生物量,缺点是花费时间长,而利用物理法测量,无法区分区分处于悬浮状态的颗粒和微生物,也无法分别活死细胞。 实现在线活细胞浓度一直是发酵领域的热门话题,仅些年来出现了不少的测量方法,依据的工作原理也是五花八门,其中最具代表性的有声学,激光散色、荧光、核磁、量热或电容。 其中法国fogale公司的测量仪器,以电容法为工作原理,直接将传感器安装与发酵罐上,可承受121℃高温灭菌,理论技术也比较成熟,是目前最为理想的适合工业级别的在线活细胞传感器。工作原理:电容传感器采用活细胞的介电特性,实时连续测量活细胞的生物体积,可应用于实验室桌面型的反应器或者是工业规模的大型反应器两对对电极位于传感器的顶部,一对用于在培养基中产生交变的电场,在电场范围内,带有完整细胞膜的细胞会在培养基中发生极化现象,发生极化的细胞可以认为是极小的电容,死细胞或者其他粒子没有完整的细胞膜,所以不能形成电容型号。另一对电极用于检测培养基中的介电信号,培养基中的介电信号和细胞的浓度是精确关联的。细胞的极化率和电场的频率纯在函数关系,当频率增加时,培养基中细胞的介电常数由低频峰(最大极化)降低到高频峰(最小极化)。这种随频率增加极化率降低的现象称为β-散射。传感器采用双频测量模式:培养基的基线在10MHz左右得到,细胞的信号在临界频率区域获得,在曲线的拐点,(动物细胞和细菌在1MHz,酵母在2MHz)我们获得了最佳的信号线性。应用:这项技术可广泛应用于各种细胞培养,生物发酵过程。已被文献证实可应用的细胞如下:动物细胞:CHO, BHK, MDCK, PERC6, NSO, HEK, Hela,Hybridoma, Vero细 菌:E.Coli, Bacillus Thuringensis, Salmonella,Streptomyces, Lactic Bacteria酵 母:Pichia Pastoris, Saccharomyces Cervisiae, PolymorphaHasenula昆虫细胞:sf9, Hi-5真 菌:Absidia
[size=24px][b]课程详情[/b][/size]肿瘤的发生及发展机制是当前生命科学和基础医学的重要研究领域,对应的抗肿瘤药物和细胞治疗方法的研发也是行业研究热点。本次讲座将围绕肿瘤细胞和细胞治疗研究方法,介绍赛多利斯提供的活细胞水平检测方法及整体解决方案。[size=18px][b]讲师简介:[/b][/size]黄雯琪:黄雯琪,女,就职于赛多利斯公司生物分析部门,负责细胞检测产品线的应用支持、产品培训等业务,在细胞生物学检测技术及实验方法方面具有丰富的经验。[size=18px][b]相关领域:[/b][/size](生物产业)-(综合)[size=18px][b]相关仪器:[/b][/size](生命科学仪器及设备)-(细胞生物学仪器)-(高内涵细胞成像分析系统)点击链接立即报名:[url]https://www.instrument.com.cn/webinar/meeting_13888.html[/url]
[font=&][size=16px][color=#343a40] 肿瘤免疫治疗是一种利用人体免疫系统来战胜肿瘤的治疗方案。成功与否的关键就在于免疫系统能否被激活到足够去特异性地杀死肿瘤的程度。在临床实验前,人们需要借助体外实验先行评估治疗方案的效力。 Axion BioSystems公司革命性地推出了使用生物电感应技术的Maestro Z/ZHT平台,完美具备评估体外效力的必要条件。它能在免除标记物影响的同时,在长达几天的时间中,以非侵入的方式对细胞的健康和活动开展监测,并自动且实时地获得多至384个样本的完整实验信息。其秘诀就是通过埋设在微孔板底部的高灵敏度电极来进行生物电阻抗的测试。这种技术能够追踪微小的细胞变化,从而能够揭示出远低于其它技术最低检出限的生物学信息。[/color][/size][/font][font=&][size=16px][color=#343a40][b]--利用Maestro Z/ZHT评估T细胞对胶质母细胞瘤的杀伤效力(car T治疗):[/b][/color][/size][/font][font=&][size=16px][color=#343a40][b]人体免疫系统中的效应T细胞,对肿瘤细胞有着高特异性和与生俱来的细胞毒性,在未来的脑胶质瘤治疗中被人们寄予很高的期望。Maestro Z的阻抗测试有着高灵敏、无标记及无损的特点,能够实时监测肿瘤细胞的增殖和T细胞介导的细胞溶解等过程,在体外评估免疫治疗的效价方面有着突出的优势。美国乔治亚大学的科学家们借助Maestro Z平台,对不同条件活化后的T细胞,开展了恶性胶质母细胞瘤杀伤效力的对比评估。详情点击:[url=http://www.axionbio.cn/page_1.html]CAR-T治疗 (axionbio.cn)[/url][/b][/color][/size][/font][font=&][size=16px][color=#343a40][/color][/size][/font][font=&][size=16px][color=#343a40][b]--利用Maestro Z 评估药物对COVID-19病毒感染力的中和作用:[/b][/color][/size][/font][color=#343a40][b][font=&][size=16px]病毒学研究的重点就在于开发抗病毒药物用于预防和治疗病毒感染。其中的挑战在于筛选到能够选择性抑制病原体复制并对宿主没有损害的化合物。病毒导致的细胞病变效应(CPEs)常常和靶细胞在形态、胞间贴合度、附着力及活力等方面的变化相关联。研究者可在体外联合使用宿主细胞、病原体和药物来模拟三者在体内的互作,借助 Maestro Z 定量CPE引起的阻抗变化。轻松实现在筛选药效的同时,完成安全性的初步评沽。[b]详情点击:[/b][url=http://www.axionbio.cn/page_4.html]page_4 - (axionbio.cn)[/url][/size][/font][/b][/color][font=&][color=#343a40][b][font=&][/font][/b][/color][/font]
[url=http://www.f-lab.cn/microscopes-system/magnetic-tweezers.html][b]细胞单分子操纵磁镊系统[/b][/url],magnetic tweezers是继激光光镊技术仪器后又一种细胞操纵和细胞力学测量仪器.它采用倒置显微镜和电动平移旋转定位台和PicoTwist磁力细胞操纵捕获技术,组成强大的单分子操纵磁镊仪器。细胞单分子操纵磁镊系统是通过梯度分布的磁场对处于其中的可磁化微粒施力,通过显微镜观察并分析微粒运动过程,这套磁镊可同时对40个细胞分子视频采集和跟踪测量。[b]细胞单分子操纵磁镊系统特点[/b]操作稳定—图像漂移很低分辨率高,测力能力强—适合超薄样品可以同时对40个细胞单分子成像和跟踪测量磁铁来控制 DNA拉伸和超螺旋结构[b]细胞单分子操纵磁镊系统应用[/b]细胞单分子,生物单分子,细胞力学,生物力学等,在单分子水平上对生物分子行为(包括构象变化、相互作用、相互识别等)的实时﹑动态检测以及在此基础上的操纵﹑调控等;对单个生物大分子施以力或力矩,并测量它们的物理性质(如DNA弹性、蛋白质的力学变性等);对单个生物大分子施以力或力矩,测量它们的力学生化反应(如分子马达);研究机械力的作用如何影响细胞的生长、分裂、运动、粘附以及信号的传输,基因的表达;在生物大分子上施加力以使之发生构像上的变化,研究生物单分子形成新的结构,以及力学以及动力学之间的相互联系等。研究各种药物可能导致的DNA、蛋白质凝聚、变性过程;给出分子实时行为与性质的分布,有效避免对集群测量苛刻的同步(synchronization)要求,如DNA的解链(unzipping)、蛋白质的折叠(folding)等。[b][img=细胞单分子操纵磁镊系统]http://www.f-lab.cn/Upload/magnetic-tweezers.jpg[/img][/b]细胞单分子操纵磁镊系统:[url]http://www.f-lab.cn/microscopes-system/magnetic-tweezers.html[/url]
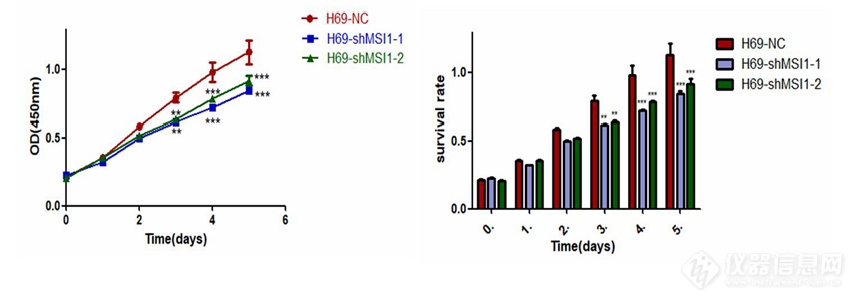
[align=center][size=18px]敲低[/size][size=18px] MSI1 对小细胞肺癌细胞生长增殖的影响[/size][/align][size=16px]检测 MSI1 对人小细胞肺癌细胞生长增殖的影响[/size][size=16px]收集[/size][size=16px] H69、H82、H526、SW1271 的对照组和实验组[/size][size=16px]细胞细胞[/size][size=16px]离心,并用完全培养基调整细胞浓度,H69-NC、H69-shMSI1-1、H69-shMSI1-2、H82-NC、H82-shMSI1-1、[/size][size=16px] [/size][size=16px]H82-shMSI1-2、H526-NC、H526-shMSI1-1、H526-shMSI1-2 以每孔 1×104 [/size][size=16px]个[/size][size=16px]细胞平铺于 96 孔板中,SW1271-NC、SW1271-shMSI1-1、SW1271-shMSI1-2,以每孔 1.3×[/size][size=16px]104 [/size][size=16px]个[/size][size=16px]细胞平铺于 96 孔板中,37℃ 恒温培养箱中培养。铺板后,分别于 24 h、48 h、72 h、96 h、120h 在每孔加入 10 [/size][size=16px]μL[/size][size=16px] CCK-8 溶液,37℃ 恒温培养箱中孵育 4h。并用酶标仪测定波长 450 nm 处 OD 值,利用 [/size][size=16px]Graphpad[/size][size=16px] prism5 计算增殖情况。[/size][size=16px]检测 MSI1 对人小细胞肺癌细胞药物敏感性的影响[/size][size=16px]收集[/size][size=16px] H69 、H82 、H526 、SW1271 的对照组和实验组细胞, 其中 H69-NC 、H69-shMSI1-1、H69-shMSI1-2、H82-NC、H82-shMSI1-1、H82-shMSI1-2、H526-NC、[/size][size=16px]H526-shMSI1-1、H526-shMSI1-2 细胞系以 1×104 [/size][size=16px]个[/size][size=16px]细胞/孔的细胞密度接种于 96 孔板中,SW1271-NC、SW1271-shMSI1-1、SW1271-shMSI1-2 以 1.3×104 [/size][size=16px]个[/size][size=16px]细胞/孔的细[/size][size=16px]胞[/size][size=16px]密度接种于[/size][size=16px] 96 孔板中。待细胞融合率约 80%,加入不同浓度顺[/size][size=16px]铂[/size][size=16px]。每组均设置对照组及空白组(仅有同体积培养基)。H69、H82、H526 的对照组和实验组[/size][size=16px]加药浓度梯度为 0、1、2、4、8、16、32、64 nmol/mL,SW1271 对照组和实验组细胞加药浓度梯度为 0、2、4、8、16、32、64、128、256 nmol/mL,(加药浓度梯度根据细胞类型、前期预实验结果及细胞对药物的敏感程度而定)。每种浓度设 6 [/size][size=16px]个[/size][size=16px]复孔,每孔总体积为 100 [/size][size=16px]μL[/size][size=16px],培养 24、48、72、96、120 h 后[/size][size=16px]分别检测细胞活力。每孔加入[/size][size=16px] 10 [/size][size=16px]μL[/size][size=16px] 的 CCK-8[/size][size=16px](避光),培养箱中孵育[/size][size=16px] 4 h 后取出,使用酶标仪测定波长为 450 nm 的吸光度(OD 值)。利用公式:抑制率=(加药组-空白组)/(对照组-空白组)计算增殖抑制率。实验重复 3 次,取平均值。以药物浓度为横坐标,细胞增殖抑制率为纵坐标,利用[/size][size=16px]Graphpad[/size][size=16px] prism5 绘图。[/size] [size=16px]敲低[/size][size=16px] MSI1 对人小细胞肺癌细胞增殖能力的影响[/size][size=16px]CCK-8 是一种基于 WST-8 而广泛应用于细胞增殖和细胞毒性的快速、高灵敏度、无放射性的比色检测试剂盒。WST-8 在电子耦合试剂存在的情况下,可以被线粒体内的一些脱氢酶还原生成橙黄色的甲[/size][size=16px]瓒[/size][size=16px],生成的甲[/size][size=16px]瓒[/size][size=16px]物的数量与活细胞的数量呈正比,因此可以直接进行细胞增殖和毒性分析。[/size][size=16px]CCK-8 法 测 生 长 曲 线 实 验 结 果 如 图[/size] [size=16px]3-1 显 示 , 实 验 组 H69-shMSI1-1 、[/size][size=16px]H69-shMSI1-2 、 H82-shMSI1-1 、 H82-shMSI1-2 、 H526-shMSI1-1 、 H526-shMSI1-2 、[/size][size=16px]SW1271-shMSI1-1、SW1271-shMSI1-2 细胞的 OD [/size][size=16px]值明显[/size][size=16px]低于对照组。[/size][size=16px]表明敲低[/size][size=16px] MSI1[/size][size=16px]抑制了[/size][size=16px] SCLC 细胞的生长增殖。[/size][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211302321138249_2126_5887180_3.png[/img][size=16px] [/size][size=16px]图[/size][size=16px] [/size] [size=16px]MSI1 低表达对 H69、H82、H526、SW1271 对照组和实验组细胞增殖的抑制情况。应用 [/size][size=16px]Graphpad[/size][size=16px] prism5 作图所示(*P0.05,**P0.01,***P0.001,表示与对照组相比,[/size][size=16px]敲低组[/size][size=16px] OD 值减小[/size][size=16px]具有统计学意义)。[/size] [size=16px]测敲低[/size][size=16px] MSI1 对人小细胞肺癌细胞药物敏感性的影响[/size][size=16px]药敏实验结果如图[/size][size=16px] 3-2 所示,与对照组相比,实验组 H69-shMSI1-1、H69-shMSI1-2、H82-shMSI1-1、H82-shMSI1-2、H526-shMSI1-1、H526-shMSI1-2、SW1271-shMSI1-1、[/size][size=16px]SW1271-shMSI1-2 经不同浓度[/size][size=16px]顺铂处理[/size][size=16px] 24、48、72、96、120 h 后细胞的药物敏感性无明显变化。[/size][size=16px] [/size][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211302321124223_9282_5887180_3.png[/img]
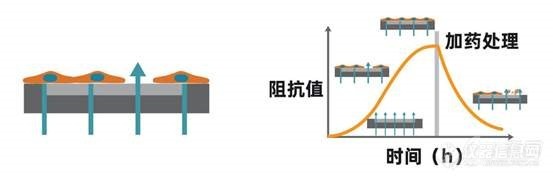
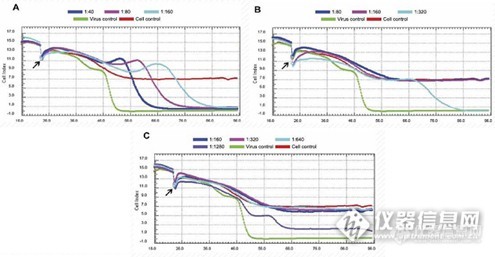
[align=center][font='Segoe UI', sans-serif] -[/font]基于阻抗方法实时、无标记、长期监测细胞表型[/align][align=center]([color=#333333]可用于[/color][b][font=宋体][color=#F76464]细胞增殖、肿瘤免疫、细胞毒性及活力检测、药物筛选、信号通路[/color][/font][font='Segoe UI',sans-serif][color=#F76464](GPCR/CFTR)[/color][/font][font=宋体][color=#F76464]、细胞间相互作用[/color][/font][font='Segoe UI',sans-serif][color=#F76464] ([/color][/font][font=宋体][color=#F76464]屏障功能[/color][/font][font='Segoe UI',sans-serif][color=#F76464])[/color][/font][font=宋体][color=#F76464]、病毒学研究及细胞迁移[/color][/font][/b][color=#333333]等细胞表型研究。[/color])[/align][font=等线][size=16px]细胞表型是涉及基因和蛋白表达的多个细胞过程的集合体,这些过程导致细胞特定的形态和功能。细胞表型检测主要类型有:[b]细胞的增殖、凋亡、迁移、侵袭、活力、信号通路及屏障功能[/b]等。[/size][/font][font=等线][/font][align=left][b][font=宋体][color=#333333]基本原理:[/color][/font][/b][font='Segoe UI',sans-serif][color=black] [/color][/font][font=宋体][color=black]将细胞样本置于[/color][/font][font='Segoe UI',sans-serif][color=black]CytoView-Z[/color][/font][font=宋体][color=black]阻抗板中(底部埋入电极的[/color][/font][font='Segoe UI',sans-serif][color=black]96[/color][/font][font=宋体][color=black]孔培养板)进行培养,当细胞贴附于电极并伸展开后,将微小的电信号施加于电极上,细胞间形成的联接将阻挡这些电信号的通过,导致阻抗值的读数增加,而细胞结构形态上的细微改变(比如源于受体介导的信号传递或细胞形态学变化)也会影响阻抗值。也就是说,细胞的贴壁、黏附、增殖及形变等过程都会引起阻抗的变化,细胞的增殖数量与阻抗呈现一个正相关的关系。[/color][/font][/align][align=left][font=宋体][color=black][img=,553,180]https://ng1.17img.cn/bbsfiles/images/2021/12/202112291044022777_5012_4146479_3.jpg!w553x180.jpg[/img][/color][/font][/align][align=left][font=宋体][color=black]阻抗检测会计算有多少电信号(上图中青色箭头所示)被电极-细胞的界面所阻挡。当电极未被覆盖时,电信号能轻松穿过,这时阻抗值比较低。当细胞盖住电极时,能够通过的电信号就变少了,相应的阻抗值就会增大。当细胞死亡或者脱离电极时,阻抗值就会恢复到基线水平。[/color][/font][/align][font=等线][/font][align=left][font=宋体][color=black]阻抗方法相比于传统的标记方法,具有[/color][/font][/align][align=left][b][font='Segoe UI',sans-serif][color=#F76464]1.[/color][/font][font=宋体][color=#F76464]灵敏度高[/color][/font][/b][/align][align=left][font=宋体][color=black]能够检测出成像技术难以捕捉的、微小的细胞形态、构象变化;[/color][/font][/align][align=left][b][font='Segoe UI',sans-serif][color=#F76464]2.[/color][/font][font=宋体][color=#F76464]长时间持续监测[/color][/font][/b][/align][align=left][font=宋体][color=black]不会错过药物反应时间框,在给药前可通过增殖曲线判断细胞状态;[/color][/font][/align][align=left][b][font='Segoe UI',sans-serif][color=#F76464]3.[/color][/font][font=宋体][color=#F76464]无标记、原位[/color][/font][/b][/align][align=left][font=宋体][color=black]测量过程完全不会影响细胞生物学特性,无需优化抗体用量、染料浓度;[/color][/font][/align][align=left][b][font='Segoe UI',sans-serif][color=#F76464]4.[/color][/font][font=宋体][color=#F76464]孵育时间等参数[/color][/font][/b][/align][align=left][font=宋体][color=black]自动采集数据,中间无需手动操作。[/color][/font][/align][align=left][font=宋体][color=black]目前阻抗平台可用于[/color][/font][b][font=宋体][color=#F76464]细胞增殖、肿瘤免疫、细胞毒性及活力检测、药物筛选、信号通路[/color][/font][font='Segoe UI',sans-serif][color=#F76464](GPCR/CFTR)[/color][/font][font=宋体][color=#F76464]、细胞间相互作用[/color][/font][font='Segoe UI',sans-serif][color=#F76464] ([/color][/font][font=宋体][color=#F76464]屏障功能[/color][/font][font='Segoe UI',sans-serif][color=#F76464])[/color][/font][font=宋体][color=#F76464]、病毒学研究及细胞迁移[/color][/font][/b][font=宋体][color=black]等细胞表型研究。[/color][/font][/align]
[align=center][size=24px]流式细胞仪监测适配体与靶细胞的结合[/size][/align][align=center]肖书棋 18122884967[/align][align=center][/align]本次说明是基于核酸适配体能与靶标进行特异性结合的原理,利用流式细胞仪监测适配体与靶细胞的结合状况,还能比较不同适配体与靶细胞之间的结合强度的比较;本次所使用的流式分析仪是BD FACSAria III。[font='times new roman'][size=16px]1.原理介绍:[/size][/font][font='times new roman'][size=16px]1.1核酸适配体:[/size][/font]核酸适配体(Aptamer,Apt):是一段寡核苷酸序列(ssDNA或RNA),是利用指数富集的系统进化技术(the Systematic Evolution of Ligands by Exponential Enrichment,SELEX)在多样寡核苷酸序列的文库中,进行体外筛选得到。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026239049_1528_5413603_3.jpeg[/img][/align][align=center][size=13px]Aptamer结合靶标原理[/size][size=13px]图[/size][/align]如图所示,在合适的缓冲液环境下,单链寡核苷酸序列具有弯曲以及折叠成特定的三级空间结构的能力,该结构可以与靶分子特异性结合,SELEX技术就是应用该原理来进行选择的。将信息量巨大且随机的的寡核苷酸文库与靶标孵育,经过多轮的优胜劣汰和PCR扩增,最后得到能与靶标高亲和力性结合的寡核苷酸序列,即核酸适配体(Aptamer)。由于核酸适配体具有靶向特异性的特点,因此应用广泛;那么如何监测适配体靶向细胞亲和力的方法,就需要用到流式细胞术进行表征。[font='times new roman'][size=16px]1.2流式细胞仪原理:[/size][/font]流式细胞术能够快速检测细胞或者生物颗粒的特征,其检测灵敏,能够定性或者定量分析颗粒的参数,还具有细胞分选的功能,功能强大,分析参数多,实用性较强。流式细胞仪(flow cytometer,FCM)的设计应用了光学、细胞化学、电子学等技术,拥有较强大的细胞及微粒分析功能,在临床医学、免疫学、微生物学等等研究领域发挥着巨大的作用。流式分析可以检测细胞表面颗粒复杂程度、核酸以及蛋白质的含量、细胞表面积或者细胞表面的抗体、细胞受体等等,在多种研究领域起到重要作用。在本研究中应用流式分析细胞荧光强度的基本步骤原理是:(1)制备成单细胞悬液:将待测细胞预处理进行荧光标记后制成单细胞悬液,通过气压将流式管中的细胞悬液通过管道压进流动室,同时喷出的鞘液将细胞包裹,形成圆形的鞘流,细胞在鞘液的包被下单行排列,依次通过流动室检测区域。(2)形成光散射:激发光源侧向垂直射向单个细胞,含有荧光的细胞形成两种光:①前向散射光(forward scatter, FSC):激光束照射细胞时,光束偏移量较小(10°以内),散射至前方,可用于检测细胞等粒子的表面信息,颗粒体积越大,信号越强。②侧向散射光(side scatter,SSC)激光束照射颗粒,产生偏移角度为直角的散射光,可反应细胞内含物的信息。(3)光信号转化成电信号:光信号导入到计算机中,依次形成电信号,再转化为数字信息。应用FlowJo软件处理数据,可以获得相应的散点图、直方图等形式,便于直观分析。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026241158_6946_5413603_3.jpeg[/img][/align][align=center][font='times new roman'][size=13px]流式分析基本原理图[/size][/font][/align][font='times new roman'][size=16px]2.分析步骤:[/size][/font][font='times new roman'][size=16px]2.1细胞预处理:[/size][/font]通过流式分析预处理,可以使细胞在特定的环境,与带有FAM荧光的适配体进行特异性结合,通过平行实验使细胞与不同的适配体文库进行标记,最终表征其荧光强度,进行亲和力的分析与比较。如表所示,流式分析条件为:[align=center][size=13px]流式细胞分析条件探寻[/size][/align][table][tr][td][align=center][size=13px][color=#000000]孵育时条件[/color][/size][/align][/td][td][size=13px][color=#000000]孵育时体积[/color][/size][/td][td=2,1][align=center][size=13px][color=#000000]孵育时浓度[/color][/size][/align][align=center][size=13px][color=#000000]细胞浓[/color][/size][size=13px][color=#000000]度 [/color][/size][size=13px][color=#000000]单链DNA浓度[/color][/size][/align][/td][td][align=center][size=13px][color=#000000]第二次洗涤用液[/color][/size][/align][/td][/tr][tr][td][align=center][size=13px][color=#000000]4 ℃,30 min,BB,摇晃[/color][/size][/align][/td][td][align=center][size=13px][color=#000000]500 μL[/color][/size][/align][/td][td][size=13px][color=#000000]2.5×10^6个/mL[/color][/size][/td][td][align=center][size=13px][color=#000000]125 nM[/color][/size][/align][/td][td][align=center][size=13px][color=#000000]PBS x 2[/color][/size][/align][/td][/tr][/table]流式分析的大致步骤为:消化细胞、细胞与文库孵育、润洗重悬、上样分析。最终确定,初始的细胞悬液浓度为5×10[font='times new roman'][size=16px]6[/size][/font] 个/mL,初始文库的浓度为250 nM;孵育时体系的总体积为250 L,细胞浓度为2.5×10[font='times new roman'][size=16px]6[/size][/font]个/mL,适配体浓度为125 nM,环境为4 ℃、30 min,震荡。最后上样的细胞悬液体积为500 L,细胞浓度为2.5×10[font='times new roman'][size=16px]6[/size][/font]个/mL。[align=left][font='times new roman'][size=16px]2.1.1材料准备:[/size][/font][/align][align=center][size=13px] 流式分析主要仪器与试剂[/size][/align][table][tr][td][align=center]名称[/align][/td][td][align=center]规格/型号[/align][/td][td][align=center]作用[/align][/td][/tr][tr][td][align=center]流式细胞仪[/align][/td][td][align=center]FACSAria III[/align][/td][td][align=center]对细胞进行流式分析[/align][/td][/tr][tr][td][align=center]可调式混匀仪[/align][/td][td][align=center]MX-S[/align][/td][td][align=center]混悬适配体悬液[/align][/td][/tr][tr][td][align=center]震荡仪[/align][/td][td][align=center]MX-M[/align][/td][td][align=center]震荡孵育体系,防止细胞贴壁[/align][/td][/tr][tr][td][align=center]制冷恒温金属浴[/align][/td][td][align=center]HX-20L[/align][/td][td][align=center]热击适配体,使核酸变性恢复到自由的无规则卷曲状态[/align][/td][/tr][tr][td][align=center]显微镜[/align][/td][td][align=center]DMI1[/align][/td][td][align=center]观察细胞[/align][/td][/tr][tr][td][align=center]水浴氮吹仪[/align][/td][td][align=center]FY-DCY12S[/align][/td][td][align=center]加热试剂[/align][/td][/tr][tr][td][align=center]电子天平[/align][/td][td][align=center]JA2003[/align][/td][td][align=center]称量药品[/align][/td][/tr][tr][td][align=center]离心管[/align][/td][td][align=center]15 mL×10、50mL×10[/align][/td][td][align=center]分装试剂,装载需离心的细胞[/align][/td][/tr][tr][td][align=center]低吸附离心管[/align][/td][td][align=center]2 mL×20[/align][/td][td][align=center]装适配体悬液,减少适配体与细胞在管壁上的吸附[/align][/td][/tr][tr][td][align=center]一次性使用吸管[/align][/td][td][align=center]3 mL×20[/align][/td][td][align=center]方便地吸取PBS[/align][/td][/tr][tr][td][align=center]细胞刮刀[/align][/td][td][align=center]3010×1[/align][/td][td][align=center]刮下贴壁生长的细胞[/align][/td][/tr][tr][td][align=center]PBS[/align][/td][td][align=center]50 mL×2[/align][/td][td][align=center]ScienCell[/align][/td][/tr][tr][td][align=center]Cell Dissociation Solution[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]消化细胞[/align][/td][/tr][tr][td][align=center]0.25%Trypsin-EDTA[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]Gibco[/align][/td][/tr][tr][td][align=center]1×PBS缓冲液[/align][/td][td][align=center]500 mL[/align][/td][td][align=center]润洗细胞,重悬细胞[/align][/td][/tr][tr][td][align=center]Cell Dissociation Solution[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]消化细胞[/align][/td][/tr][tr][td][align=center]0.25%Trypsin-EDTA[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]Gibco[/align][/td][/tr][tr][td][align=center]1×PBS缓冲液[/align][/td][td][align=center]500 mL[/align][/td][td][align=center]润洗细胞,重悬细胞[/align][/td][/tr][tr][td][align=center]无酶无菌水[/align][/td][td][align=center]500 mL[/align][/td][td][align=center]溶解适配体文库[/align][/td][/tr][tr][td][align=center]DMEM高糖培养基[/align][/td][td][align=center]50 mL[/align][/td][td][align=center]停止消化[/align][/td][/tr][tr][td][align=center]细胞[/align][/td][td][align=center]>5×10[font='times new roman'][size=16px]6[/size][/font]个[/align][/td][td][align=center]作为目的细胞进行流式表征[/align][/td][/tr][/table]①配置Binding buffer(结合缓冲液BB):配置10 g/L BSA:称量0.1g BSA,溶于10 mL Washing Buffer,过膜;取上述溶液5 mL,加入到445 mL Washing Buffer中;再加入500 L鲑精DNA,混匀。②将U盘格式化,提前打开制冰机和金属浴(95℃);③37℃水浴:将无酶消化液、ECM、PBS(1)放入37℃水浴。④4℃冰敷:向泡沫盒中加碎冰,离心管架、温度计,准备4℃孵育环境,放入PBS和BB预冷。⑤打开显微镜(酒精擦拭载物台)。⑥打开离心机:120 g,1 min,25℃。[align=left][font='times new roman'][size=16px]2.1.2[/size][/font][font='times new roman'][size=16px]计数和文库预处理[/size][/font][/align](1)细胞计数(20倍或者40倍显微镜):①采用直接计数法,在显微镜中随机选择五个点进行计数取平均值,根据视野的面积以及T75培养瓶面积计算细胞总数,推出公式:Y为总细胞数;X为视野中细胞平均数;Y=27886.12X(20倍镜下)/Y=111111.11X(40倍镜下)。为了保证流式有足够的细胞,需要保证细胞总数>5×10[font='times new roman'][size=16px]6[/size][/font]个/mL。②计算BB体积:V=Y/(2×10[font='times new roman'][size=16px]7[/size][/font])mL,用V体积的BB重悬细胞沉淀,可获得细胞浓度为5×10[font='times new roman'][size=16px]6[/size][/font]个/mL的初始细胞悬液。(2)文库预处理:①将粉末状适配体文库进行离心:4000 r,5 min,4℃;使适配体粉末聚集在离心管底部,防止打开离心管时干粉状适配体飞出。②按照说明用一定体积的无酶无菌水溶解适配体,使适配体母液浓度在5 M。③取100 L母液,并加入900 LBB,使适配体浓度在500 nM。④再去上述液体500 L,并用BB稀释至浓度为250 nM,最终得到250 nM的适配体文库悬液。⑤95℃热击3 min,热击后放在泡沫盒中冰敷。[align=left][font='times new roman'][size=16px]2.1.3[/size][/font][font='times new roman'][size=16px]细胞处理[/size][/font][/align](1)消化:①PBS(37℃)润洗3次。②无酶消化液3 mL,消化9 min(等待期间准备好孵育用离心管;确认离心机参数为:120 rcf,1 min,25 ℃),吹打细胞使其从培养瓶表面脱落。直接转移至15mL离心管中,吹打混匀约20次(吹散细胞团,分离成单个细胞)。③显微镜观察确认细胞均从培养瓶上脱落,加入2-3 mL ECM至培养瓶中润洗,然后转移至上述离心管中,吹打终止消化。④离心:120 rcf,1 min,25℃。(等待期间各加入250 L待测文库至低吸附离心管中,注意要快速,吸取之前需要先混悬文库)。⑤离心之后小心倒出,用枪吸出剩下的ECM,加入2V L BB,重悬吸打混匀,获得5×10[font='times new roman'][size=16px]6[/size][/font]个/mL的细胞悬液。[align=left][font='times new roman'][size=16px]2.1.4[/size][/font][font='times new roman'][size=16px]细胞与文库结合[/size][/font][/align]①孵育:分别加入250 μL上述细胞悬液至250 μL ssDNA文库中,进行孵育:4℃,30 min,打开摇床第二格。②等待期间离心机调至4℃;用密封袋装好洁净的1000 L枪头准备流式上样用;2.2.2.5 润洗重悬细胞①取出孵育好的体系,进行离心:4℃,120 g,1 min(等待期间准备好4℃ PBS)。②倒掉上清液,用枪头小心吸出管口残留的上清液,每管加500 L PBS(4℃)用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]吸打重悬约20次。③再次离心4℃,120 g,1 min。④第二次重悬:重复①-③步骤。⑤每管加入500 L PBS重悬,忽略实验损失,最后得到理论细胞浓度为2.5×10[font='times new roman'][size=16px]6[/size][/font]个/mL的细胞悬液。[font='times new roman'][size=16px]2.2[/size][/font][font='times new roman'][size=16px]送样分析[/size][/font]FAM荧光染色较弱,在预处理之后应尽快进行流式分析,流式分析上样程序复杂,需要正确进行开机,测样,关机的步骤,才能够得到准确的数据。[align=left](1)准备工作:[/align][align=left]准备1000 mL[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url],1000 mL 洁净枪头,流式管,质控微球。[/align][align=left]①开启液流系统:由上至下打开流式细胞仪开关;再开启计算机,打开FACSDiva软件,在“Cytometer仪器框”中确认流式细胞仪已与电脑连接,启动液流之前,确认液流系统水平,进行补充鞘液、去离子水、乙醇以及漂水,并清空废液。[/align][align=left]在“Cytometer”菜单中,点击“Fluidics Startup(启动液流系统)”,按照提示进行操作:确定气路和液路是从乙醇桶连接到了鞘液桶上:将蓝色液路管接到过滤器下方,透明气路管接到鞘液桶上;确定闭合的喷嘴是在流动检测池上。[/align][align=left]②将70 m的喷嘴放入装有超纯水的烧杯中,超声30 s,用无尘纸蘸干;抽出闭合的喷嘴;插入70 m的喷嘴(红圈朝上)。[/align][align=left]③点击“×steam”,开启液流,出现水滴状,调整使上端横线位于第二个或者第三个水滴的尾部,下端横线位于第三个或者第四个液滴的中部,调整好后关闭液流。[/align][align=left](2)做质控:[/align][align=left]①用CS&T微球,用之前一定将微球甩匀(保证取出的微球呈均匀体系)用涡旋震荡;取一支洁净的流式管加入333 L的鞘液,再加一滴微球(用之前用混悬仪混匀,正常的微球为浑浊状)。[/align][align=left]②打开液流系统,在“Cytometer”菜单下点击“CST”;展开Setup Control窗口:在Characterize菜单中中选择“Check Performence”;在Configuration流式设置中:喷嘴的大小:选择70m,点击左下角“set configuration”,再点击“OK”。[/align][align=left]③选择微球的Lot ID:与微球瓶身上编号对应:10549。[/align][align=left]④敲弹准备好的微球悬液使其混匀,进行上样,打开液流;确认激发光源没问题即可关掉页面并关掉液流。[/align][align=left](3)上样:[/align][align=left]①新建样品,并勾选FITC、SSC、FSC的H、A、W、log数据项。[/align][align=left]②作图:建立散点图,横坐标为FSC-H,纵坐标为SSC-H;再建立一个图:横坐标:FITC-H,纵坐标为:Count。[/align][align=left]③打开液流至3,选择对应样品;吹打混匀并放置样品,点击“LOAD”上样。调整FSC和SSC的电压,使散点图的中的点都集中在所圈的门中。(若散点偏右,则FSC电压过大,调整FSC电压使其变小,若散点偏上,则调整SSC使其变小。)当调整合适时点击“RECORD”记录数据。[/align][align=left]④计数完毕,调低流速,点击“unload”,选择第二个样品并重复第③步。[/align][align=left]⑤上样完毕之后,保存数据。[/align][align=left](4)关机步骤:[/align][align=left]①上一管clean液,高速冲2 min;再上一管去离子水,高速冲5 min;关闭液流,检查液路系统。[/align][align=left]②在“Cytometer”菜单中,选择“shutdown”,根据指示操作:取下70 m的喷嘴,超声清洗,安装闭合喷嘴(红色点朝上)。[/align][align=left]③把液路和气路连接到乙醇桶上,用乙醇冲洗(先拔气路再拔液路)。[/align][align=left]④装一管clean液,清洗上样针和流动池。[/align][align=left]完成上述步骤之后即可关闭界面。[/align][align=left][/align][font='times new roman'][size=16px]2.3数据处理:[/size][/font]将原始数据用Flowjo软件进行处理,得到散点图以及荧光强度直方图,接下来通过举例来说明数据如何分析:(1) 散点图分析:[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026242555_5228_5413603_3.jpeg[/img][size=13px]数据处理分析散点图[/size][/align]该图为散点图,可以看出大体分为两个集团,散点图有两个集团说明体系中有两种细胞粒子,并且在该图片的左下角粒子较少,说明细胞碎片较少,在预处理时较好地保护了细胞的完整性。散点图中可以区分出整个上样的体系中主要含有两种大小的细胞颗粒,在预处理的过程中,无酶消化液的消化能力较弱,并且细胞团密度较大,细胞间黏连较多,在最后孵育结束用PBS进行重悬的时候仍然能够肉眼可见有白色细微絮状物。FSC值越大,代表颗粒的体积越大;SSC值越大,代表颗粒内部的复杂程度越高。故可初步判断,G1门中的颗粒为未消化完全的细胞团,而G2门中的颗粒为分散的单个细胞。(2) 直方图分析:[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026243736_5071_5413603_3.jpeg[/img][size=13px]数据处理分析直方图[/size][/align]图中为G2门选中的样品的荧光强度,该图中有两个峰,横坐标10[font='times new roman'][size=16px]2[/size][/font]附近所产生的荧光峰可以判定是残留的细胞碎片,可视为背景值,横坐标10[font='times new roman'][size=16px]4[/size][/font]~10[font='times new roman'][size=16px]5[/size][/font]附近的峰代表四个适配体分别与细胞结合所产生的荧光强度,SYL3C-Aptamer结合偏移量最大,荧光较强,且高荧光事件次数较多,说明SYL3C-Aptamer与单个细胞的结合能力最强,并且G2门中的颗粒大多数为消化完全的单个细胞,呈现出较好的特异性。总之,该组结果对比体现出,单个细胞靶点较多,适配体与单个细胞结合能力较高,通过荧光强度波峰的偏移所反映的适配体与细胞特异性结合能力的大小依次为SYL3C-Aptamer>EP166-Aptamer>CA2-Aptamer>ARC1172-Aptamer。同时,由图中可以看出:10th-ssDNA pool与SYL3C-Aptamer在10[font='times new roman'][size=16px]4[/size][/font]~10[font='times new roman'][size=16px]5[/size][/font]荧光强度波峰较高,说明二者与单个细胞的结合能力较好,结合位点较多,呈现良好的特异性和亲和性。SYL3-Aptamer荧光波峰明显右移,与单个细胞的结合位点较多。[font='times new roman'][size=16px]三、总结[/size][/font]本次说明旨在利用带荧光的适配体靶向特异性结合目的细胞的原理,利用流式细胞仪监测适配体结合靶细胞能力的强弱,同时还可以应用于不同适配体靶向同一种细胞的结合能力强弱的比较。进一步利用流式细胞仪,还可以测定适配体的Kd值;还可以根据预处理的条件不同,与对照组比较,来测定适配体靶向细胞的受体是位于细胞膜表面还是细胞内,从而进一步测定适配体的生物学稳定性。同时,流式细胞仪还有很多方面的应用,例如鉴定细菌、检测细胞凋亡等,一些抗体-细胞复合物的结合情况也能够由流式细胞仪来进行监测。 在进行流式上样的过程中,预处理、上样以及数据处理阶段都有需要注意的细节,例如:本次所使用的细胞为贴壁生长的内皮细胞,故在细胞预处理时需要先消化细胞;在进行上样前,需要将样品进行吸打混匀,以免细胞沉积在流式管底部,导致未吸取到样品;在应用流式细胞仪的过程中,使用前的维护、质控流程十分重要,该流程会直接影响所得数据的稳定性;不同的流式细胞仪的维护程序稍有不同,本次说明中的使用方法只适用于BD FACSAria III,流式细胞仪具有强大的分析功能,其在细胞研究中具有重要的作用。[align=left][/align][align=left][/align][align=left][/align][align=left][/align]
拟购买新柏氏液基细胞学制备及电脑辅助检测系统,请问型号、配置及参数
Cellscreen系统第一次实现了可重复对细胞培养进行观察。无需染色、无需制样,通过光学图像分析将细胞培养的生长曲线保存;与其它现有测试方法相比,Cellscreen系统对细胞培养无损伤性,独立性。第一次实现了对同一细胞培养区域进行多次测量。Cellscreen技术证明是一种精确的、可靠的、自定义实验条件、操作方便、节省成本的方法。Cellscreen能优化和加速新产品和测试程序的开发。 Cellscreen应用领域 Cellscreen模块化设计能适用于更广范的领域,例如: 制药研究:Cellscreen系统能缩短常规科研究时间,能拍摄细胞生长因子的各种因素,如毒性测试及生物适应性的测试。 生物技术研究:Cellscreen系统适用于增殖研究、过程(培养基)最优化、质量控制。另外,用于拍摄克隆细胞实验的新性质,如应用在新的治疗蛋白和抗体的研究。 Cellscreen系统的优势: l缩短制药研发的时间周期 l对细胞培养无损伤—细胞可再用于其它研究 l可扩展的详细的结果描述,对细胞培养过程的文档和图像存档 l与现有的方法相比,更精确——可靠、重复性、自定义 l很容易融入到日常实验 l很容易操作Multiwellplate l特别低的操作成本-对所有的测量只需要一个培养皿,不需试剂、不需对细胞染色。 l节省时间—不需样品制备 l技术成熟—innovatesAG图像识别技术 l模块化设计—系统可扩展其它分析模块 Cellscreen系统模块化设计: 为满足广泛的分析需求,Cellscreen系统是按模块化设计,能运行不同的软件系统。硬件由一个双处理器电脑及控制单元组成,控制单元通过高精度电机台自动聚焦、自动调光来控制显微镜;不同的软件模块对数码相机获取的图像进行分析,分析所得的图像和数据存储在终端数据库。 软件模块包括: l悬浮细胞的增殖研究模块(PS模块) l贴壁细胞的增殖研究模块(PA) l克隆细胞实验模块(CL) 细胞增殖研究模块(PS和PA)能重复观测细胞培养的生长因子,CL模块观察克隆细胞,并能追随到起源的单克隆细胞。 克隆细胞实验模块(CL) 在整个培养过程中,CL模块自动监控单个克隆细胞到群体的生长过程;为了证明细胞群体的单克隆细胞起源,需要监控整个生长过程。 Cellscreen系统用40倍放大系数抓取容器低部的16幅图像,它能代表整个容器的状态。 所有获得的图像和数据存档到数据库,因此可以跟踪任何生物群体的成长过程,证明生物群体起源的单克隆细胞。 很好的保护—Cellscreen的培养器 Cellscreen的培养器精确的安装在显微镜上,在测量过程中,对您贵重的细胞培养,它保持一个稳定的环境。对温度和CO2的浓度能精确的控制。培养器可以长时间或频繁的监控微量滴定盘,而不需移动它。 贴壁细胞的增殖研究模块(PA) PA模块通过测量细胞覆盖区域,用户可以观察到贴壁细胞的增殖。PA以40放大倍数获得图像。系统可以自由选择培养皿的区域。这系统适用于所有通用的微量滴定盘规格(6-96眼)。结果以图像和曲线的形式表示出来。PA模块将所有的图像和结果存档,输出格式CSV(兼容Excel格式)。 PA模块精确的测量至少80%细胞的生长因子,用于科研、发展、研制新产品。 悬浮细胞的增殖研究模块(PS) PS模块通常应用在对细胞生长因子影响的研究。为了获得生长曲线,悬浮液里培育的细胞数量被重复的量化——时间、原料、操作的消耗成本。对同一培养皿里的细胞生长,PS模块能重复计数、消除对每次测量都需要更换盘子的影响。 另外,Cellscreen系统对每个细胞进行计数,相对现存的细胞计数方法,它有很高的精确性。PS模块用的是100放大倍数,它获得的图像有很好的分辨率,能提供出细胞直径和细胞形状的一些信息。 Cellscreen系统概述 很容易综合到您的日常工作中——易学易用 实验和测量的标准化 在准备阶段,用户按要求设定实验配置。对实验条件有详细选择和描述,例如:微量滴定盘上的哪个培养皿,培养皿里哪个区域需要检测;另外一些参数需要选定,如:体积、细胞类型、培养方法、细胞直径。因为无需吸液管,其它方法中隐含的误差就很容易避免。 图像清晰、分析准确 现在的测量方法里,用CCD相机拍摄图像,对每一幅图片用相同的技术指标聚焦。 Cellscreen精确的控制技术保证,在每一个测量过程中,准确的拍摄培养皿的同一区域;因此对每一选择的区域,用户可以跟踪细胞的生长过程;PS软件对选定区域的细胞进行计数;CL和PA软件用来测定克隆细胞和悬浮细胞的表面区域。 广泛和详细的结果陈述 用户可以选择结果的描述方式:如照片、生长曲线、细胞浓度曲线图或幻灯片,用来证明细胞生长发育的全过程。所有的信息,如实验设置、图像的获得、处理结果以及一些简单的实验文档都自动保存在终端数据库。
摘要: 微生物的检测,无论在理论研究还是在生产实践中都具有重要的意义,本文分生长量测定法,微生物计数法,生理指标法和商业化快速微生物检测简要介绍了利用微生物重量,体积,大小,生理代谢物等指标的二十余种常用的检测方法,简要介绍了这些方法的原理,应用范围和优缺点。 概述: 一个微生物细胞在合适的外界条件下,不断的吸收营养物质,并按自己的代谢方式进行新陈代谢。如果同化作用的速度超过了异化作用,则其原生质的总量(重量,体积,大小)就不断增加,于是出现了个体的生长现象。如果这是一种平衡生长,即各细胞组分是按恰当的比例增长时,则达到一定程度后就会发生繁殖,从而引起个体数目的增加,这时,原有的个体已经发展成一个群体。随着群体中各个个体的进一步生长,就引起了这一群体的生长,这可从其体积、重量、密度或浓度作指标来衡量。微生物的生长不同于其他生物的生长,微生物的个体生长在科研上有一定困难,通常情况下也没有实际意义。微生物是以量取胜的,因此,微生物的生长通常指群体的扩增。微生物的生长繁殖是其在内外各种环境因素相互作用下的综合反映。因此生长繁殖情况就可作为研究各种生理生化和遗传等问题的重要指标,同时,微生物在生产实践上的各种应用或是对致病,霉腐微生物的防治都和他们的生长抑制紧密相关。所以有必要介绍一下微生物生长情况的检测方法。既然生长意味着原生质含量的增加,所以测定的方法也都直接或间接的以次为根据,而测定繁殖则都要建立在计数这一基础上。微生物生长的衡量,可以从其重量,体积,密度,浓度,做指标来进行衡量。 生长量测定法 体积测量法:又称测菌丝浓度法。 通过测定一定体积培养液中所含菌丝的量来反映微生物的生长状况。方法是,取一定量的待测培养液(如10毫升)放在有刻度的离心管中,设定一定的离心时间(如5分钟)和转速(如5000 rpm),离心后,倒出上清夜,测出上清夜体积为v,则菌丝浓度为(10-v)/10。菌丝浓度测定法是大规模工业发酵生产上微生物生长的一个重要监测指标。这种方法比较粗放,简便,快速,但需要设定一致的处理条件,否则偏差很大,由于离心沉淀物中夹杂有一些固体营养物,结果会有一定偏差。 称干重法: 可用离心或过滤法测定。一般干重为湿重的10-20%。在离心法中,将一定体积待测培养液倒入离心管中,设定一定的离心时间和转速,进行离心,并用清水离心洗涤1-5次,进行干燥。干燥可用烘箱在105℃或100℃下烘干,或采用红外线烘干,也可在80℃或40℃下真空干燥,干燥后称重。如用过滤法,丝状真菌可用滤纸过滤,细菌可用醋酸纤维膜等滤膜过滤,过滤后用少量水洗涤,在40℃下进行真空干燥。称干重发法较为烦琐,通常获取的微生物产品为菌体时,常采用这种方法,如活性干酵母(activity dry yeast, ADY),一些以微生物菌体为活性物质的饲料和肥料。 比浊法: 微生物的生长引起培养物混浊度的增高。通过紫外分光光度计测定一定波长下的吸光值,判断微生物的生长状况。对某一培养物内的菌体生长作定时跟踪时,可采用一种特制的有侧臂的三角烧瓶。将侧臂插入光电比色计的比色座孔中,即可随时测定其生长情况,而不必取菌液。该法主要用于发酵工业菌体生长监测。如我所使用UNICO公司的紫外-可见分光光度计,在波长600nm 处用比色管定时测定发酵液的吸光光度值OD600,以此监控E.Coli的生长及诱导时间。 菌丝长度测量法: 对于丝状真菌和一些放线菌,可以在培养基上测定一定时间内菌丝生长的长度,或是利用一只一端开口并带有刻度的细玻璃管,到入合适的培养基,卧放,在开口的一端接种微生物,一段时间后记录其菌丝生长长度,借此衡量丝状微生物的生长。微生物计数法 血球计数板法: 血球计数板是一种有特别结构刻度和厚度的厚玻璃片,玻片上有四条沟和两条嵴,中央有一短横沟和两个平台,两嵴的表比两平台的表面高0.1 mm,每个平台上刻有不同规格的格网,中央0.1 mm2面积上刻有400个小方格。通过油镜观察,统计一定大格内微生物的数量,即可算出1毫升菌液中所含的菌体数。这种方法简便,直观,快捷,但只适宜于单细胞状态的微生物或丝状微生物所产生的孢子进行计数,并且所得结果是包括死细胞在内的总菌数。 染色计数法: 为了弥补一些微生物在油镜下不易观察计数,而直接用血球计数板法又无法区分死细胞和活细胞的不足,人们发明了染色计数法。借助不同的染料对菌体进行适当的染色,可以更方便的在显微镜下进行活菌计数。如酵母活细胞计数可用美蓝染色液,染色后在显微镜下观察,活细胞为无色,而死细胞为蓝色。 比例计数法: 将已知颗粒(如霉菌孢子或红细胞)浓度的液体与一待测细胞浓度的菌液按一定比例均匀混合,在显微镜视野中数出各自的数目,即可得未知菌液的细胞浓度。这种计数方法比较粗放。并且需要配制已知颗粒浓度的悬液做标准。 液体稀释法: 对未知菌样做连续十倍系列稀释,根据估计数,从最适宜的三个连续的10倍稀释液中各取5毫升试样,接种1毫升到3组共15只装培养液的试管中,经培养后记录每个稀释度出现生长的试管数,然后查最大或然数表MPN(most probably number)得出菌样的含菌数,根据样品稀释倍数计算出活菌含量。该法常用于食品中微生物的检测,例如饮用水和牛奶的微生物限量检查。 平板菌落计数法: 这是一种最常用的活菌计数法。将待测菌液进行梯度稀释,取一定体积的稀释菌液与合适的固体培养基在凝固前均匀混合,或将菌液涂布于已凝固的固体培养基平板上。保温培养后,用平板上出现的菌落数乘以菌液稀释度,即可算出原菌液的含菌数。一般以直径9cm的平板上出现50-500个菌落为宜。但方法比较麻烦,操作者需有熟练的技术。平板菌落计数法不仅可以得出菌液中活菌的含菌数,而且同时将菌液中的细菌进行了一次分离培养,获得了单克隆。 试剂纸法: 在平板计数法的基础上,发展了小型商品化产品以供快速计数用。形式有小型厚滤纸片,琼脂片等。在滤纸和琼脂片中吸有合适的培养基,其中加入活性指示剂2,3,5-氯化三苯基四氮唑(TTC,无色)待蘸取测试菌液后置密封包装袋中培养。短期培养后在滤纸上出现一定密度的玫瑰色微小菌落与标准纸色板上图谱比较即可估算出样品的含菌量。试剂纸法计数快捷准确,相比而言避免了平板计数法的人为操作误差。 膜过滤法: 用特殊的滤膜过滤一定体积的含菌样品,经丫叮橙染色,在紫外显微镜下观察细胞的荧光,活细胞会发橙色荧光,而死细胞则发绿色荧光。 生理指标法: 微生物的生长伴随着一系列生理指标发生变化,例如酸碱度,发酵液中的含氮量,含糖量,产气量等,与生长量相平行的生理指标很多,它们可作为生长测定的相对值。测定含氮量: 大多数细菌的含氮量为干重的12.5%,酵母为7.5%,霉菌为6.0%。根据含氮量×6.25,即可测定粗蛋白的含量。含氮量的测定方法有很多,如用硫酸,过氯酸,碘酸,磷酸等消化法和Dumas测N2气法。Dumas测N2气法是将样品与CuO混合,在CO2气流中加热后产生氮气,收集在呼吸计中,用KOH吸去CO2后即可测出N2的量。 测定含碳量: 将少量(干重0.2-2.0 mg)生物材料混入1毫升水或无机缓冲液中,用2毫升2%的K2Cr2O7溶液在100 0C下加热30分钟后冷却。加水稀释至5毫升,在580nm的波长下读取吸光光度值,即可推算出生长量。需用试剂做空白对照,用标准样品做标准曲线。 还原糖测定法:[/si
新华社华盛顿7月6日电(记者任海军)据美国新一期《细胞-干细胞》杂志报道,加拿大研究人员对小鼠进行的研究显示,常用Ⅱ型糖尿病药物二甲双胍能促进脑细胞分裂及新细胞形成。这项研究表明,二甲双胍将来有望用于治疗阿尔茨海默氏症等疾病。 二甲双胍的主要靶点是糖尿病患者肝细胞内的一个特殊通道。加拿大分子遗传学家弗雷达·米勒等研究人员发现,二甲双胍也能激活实验鼠脑细胞中的同样通道,促进新的脑细胞生长。 对在实验室培养皿中培养的人类脑细胞而言,这一结论同样成立。米勒表示,新生的脑细胞能修复阿尔茨海默氏症等神经退行性疾病给大脑带来的不利影响。 2008年曾有研究显示,同时患糖尿病和阿尔茨海默氏症的人如果服用二甲双胍,其阿尔茨海默氏症的症状有所改善。当时科学家认为,其机制可能在于二甲双胍治疗糖尿病时改善了患者的身体状况,这有助于改善阿尔茨海默氏症症状。 米勒认为,他们的新研究表明,二甲双胍本身就有改善脑功能的作用。目前,加拿大研究人员已着手开展二甲双胍治疗神经退行性疾病的临床试验。 二甲双胍是一种具有长期用药安全记录的药品。此前曾有研究显示,二甲双胍可抑制肺部和乳腺肿瘤的生长,降低糖尿病患者患乳腺癌的风险。
据美国物理学家组织网报道,北卡罗莱纳大学科学家的一项最新发现显示,细胞感染人类疱疹病毒(EBV)后,会产生小泡或被称为外体的液囊,从而改变细胞中所含的蛋白质和RNA(核糖核酸)。这种变质的外体一旦进入健康细胞,就能转变细胞的良性生长方式,使之变成不可控的致癌生长。这一发现刊登于美国《国家科学院院刊》网络版。EBV可能是世界上最成功的病毒,它无法被免疫系统彻底清除,几乎每个人终生都被它感染。它们不断进入唾液,在这里进行有效地传播。感染这种病毒很少致病,然而在几种主要的癌症中都发现了它的踪迹,包括淋巴瘤和鼻咽癌,它的蛋白质劫持了细胞生长调控机制,引发不可控的细胞生长,从而导致癌变。研究认为一种名为潜伏膜蛋白质1的蛋白质是EBV的致癌基因。通过外体,它们被传递给未受感染的细胞。研究人员还指出,EBV也彻底改变了外体的内含物,在细胞之间传递能激活癌症的蛋白质,这是值得注意的地方。这些发现表明,通过这种方式,病毒感染细胞能广泛影响并潜在控制全身其他细胞,引发它们的不可测生长。免疫系统不断地监视着外来病毒蛋白质,然而经外体携带的这些蛋白质可以不向免疫系统“报告”感染,并刺激癌细胞生长,由此容许了一种不可测的生长。该研究还显示,细胞能产生血管,这一被称为血管新生的过程很容易接受变质外体并引发潜在生长。北卡罗莱纳大学莱恩伯格综合癌症研究中心微生物与免疫学教授南希·瑞玻-特拉玻说:“外体就像特洛伊木马,EBV通过木马甚至能控制那些还没有感染的细胞。但重要的是,外体的产生可能为我们提供了一种新的治疗标靶,封锁它们就能控制癌症蔓延。”论文第一作者、瑞玻-特拉玻实验室博士后戴维·麦克表示,下一步研究是测定哪些蛋白质被选中进入外体,病毒如何控制了这些蛋白质,以及怎样才能遏制这一过程。
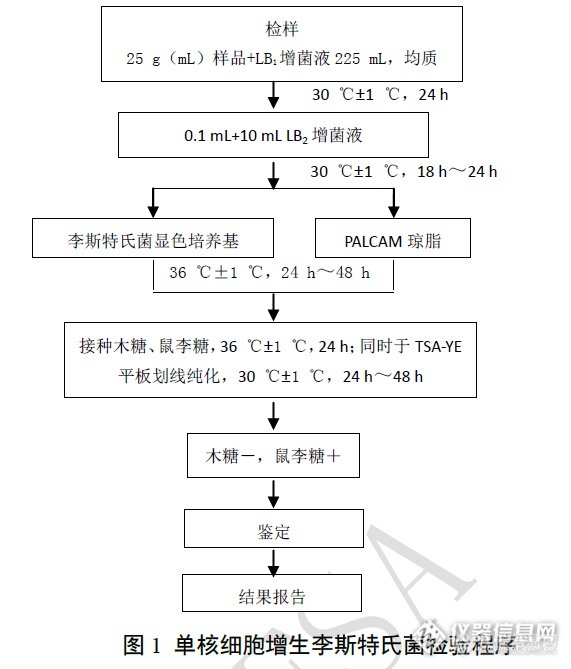
2014年食源性致病菌单核细胞增生李斯特菌风险监测分析单核细胞增生李斯特菌被看作是人畜共患和经食物传播的病原菌只有20多年的历史,由于它能在低温条件下生长,且患者死亡率高达20%-30%,因而受到国际卫生和食品组织以及各国政府的高度重视,多年来它一直是研究胞内致病机制的较好模型。单核细胞增生李斯特菌是通过受污染的食品,如奶酪、牛奶、午餐肉和法兰克福香肠而感染人类。尽管采取了许多预防措施,但近年来欧美等国家还是暴发了多起因单核细胞增生李斯特菌食源性污染导致的人群感染事件。为防范由单核细胞增生李斯特菌引起的食物中毒事件在这里发生,我们2014年共监测了5 类食品180份样品,现将监测结果报道如下。1材料与方法1.1试剂和仪器 使用的培养基有李氏增菌肉汤LB(LB1,LB2)、含0.6%酵母浸膏的胰酪胨大豆琼脂(TSA-YE)、1%盐酸吖啶黄(acriflavine HCl)溶液、1%萘啶酮酸钠盐(naladixic acid)溶液、PALCAM琼脂购买于北京路桥公司。主要仪器包括均质器,电子天平:感量0.1g,VITEK-2 Compact 全自动微生物鉴定系统。1.2依据和方法 根据国家食品安全风险评估中心制定的“食源性致病菌监测工作手册”要求进行增菌、分离、鉴定、菌种保存及送上级实验室复核。试验程序见图1。 http://ng1.17img.cn/bbsfiles/images/2014/12/201412062118_526074_2433088_3.jpg
http://photocdn.sohu.com/20120710/Img347740451.jpg 加州大学洛杉矶分校的工程师们开发了一种全新的光学显微镜,显微镜上配备了世界上最快速的相机,可用于探测“流氓”癌细胞。 【搜狐科学消息】据国外媒体报道,美国加州大学洛杉矶分校(UCLA)的工程师们近日研制出了一款世界上最快速的相机,可用于探测难以捉摸的“流氓”癌细胞。这一科研成果的研究报告发表在了最新一期的《美国国家科学院院刊》上。 从大量各类正常细胞中识别和分离出一些罕见细胞对于某些疾病的早期发现、监测和治疗来说正在变得越来越重要。这些罕见细胞中,在体内自由移动的癌细胞就是一个很好的例子。通常情况下,在10亿个健康细胞中也只有一小撮癌细胞,然而它们会抢先转移,癌细胞扩散导致癌症患者的死亡率高达约90%。这样的“流氓”细胞除了癌细胞以外,还包括用于再生医学的干细胞及其它类型的细胞。不幸的是,检测这样的细胞是很困难的。要取得良好的统计准确性需要一台自动化、高通量的仪器,可以在相当短的时间内对数以百万计的细胞进行检测。配备了数码相机的显微镜是目前分析细胞的唯一设备,但是该设备对于这项研究来说速度显得太慢了。 现在,美国加州大学洛杉矶分校(UCLA)的工程师们开发了一种全新的光学显微镜,可以让这项艰巨的任务变得轻松许多。加州大学洛杉矶分校电气工程学院的工程师巴赫拉姆•贾拉利(Bahram Jalali)说:“为了抓拍到这些难以捉摸的细胞,相机必须具备在非常高的帧速率下持续捕获并对数百万张图像进行数字化处理的能力。传统的CCD和CMOS摄像头达不到这样的速度和灵敏度,因为从像素阵列读取数据需要时间,它们在速度极快的情况下对光变得不那么敏感。” 目前的流式细胞仪具有较高的通量,但是因为它依靠单点的光散射而不是拍照,在检测非常罕见的细胞类型时还不够灵敏,比如对于那些目前处于早期阶段或癌细胞转移前的癌症患者不适用。为了克服这些限制,巴赫拉姆•贾拉利和UCLA的的生物工程学副教授迪诺•迪•卡罗( Dino Di Carlo)领导的一个包括生物技术、光学、高速电子和微流体的跨学科研究团队开发出了高通量流式光学显微镜,这款显微镜非常灵敏,具备实时探测含量为百万分之一的罕见细胞的能力。 贾拉利的团队以他们在2009年创建的光子时间飞梭相机技术为基础,研制出了世界上最快的连续运行的相机。贾拉利、迪•卡罗和他们的同事在报告中描述了他们如何将这台相机与先进的微流体和实时图像处理技术进行整合,以对血液样本中的细胞进行分类。新的血液筛查技术每秒可筛查10万个细胞,比传统的基于成像的血液分析仪高出约100倍的通量。迪•卡罗说:“这项科研成果需要与一些尖端技术进行整合,通过生物工程部门、电气工程部门和加州纳米技术研究院的合作,并采用了UCLA细胞诊断学部门开发的重要的技术基础设施。”贾拉利和迪•卡罗均是加州大学洛杉矶分校的加州纳米技术研究院的成员。 他们的研究演示了如何实时辨别血液中罕见的乳腺癌癌细胞。初步结果表明,这种新技术有可能迅速地在大量血液中检测到极稀少的循环癌细胞,并将提高癌症早期检测、监测药物和放射治疗的效率。加州大学洛杉矶分校的电气工程和生物工程的项目经理本田惠介(Keisuke Goda)说:“这项技术可以大大减少错误,并将降低医疗诊断成本。” 研究人员通过将实验室生长的癌细胞与模拟现实生活中的病人的不同比例的血液进行混合得到了检测结果。加州纳米技术研究院的一名成员格达(Goda)说:“为了进一步验证该技术的临床应用效果,我们目前正在与临床医生合作进行临床试验。这项技术也将可能用于进行尿液分析、水质监测和相关的应用。”(尚力)
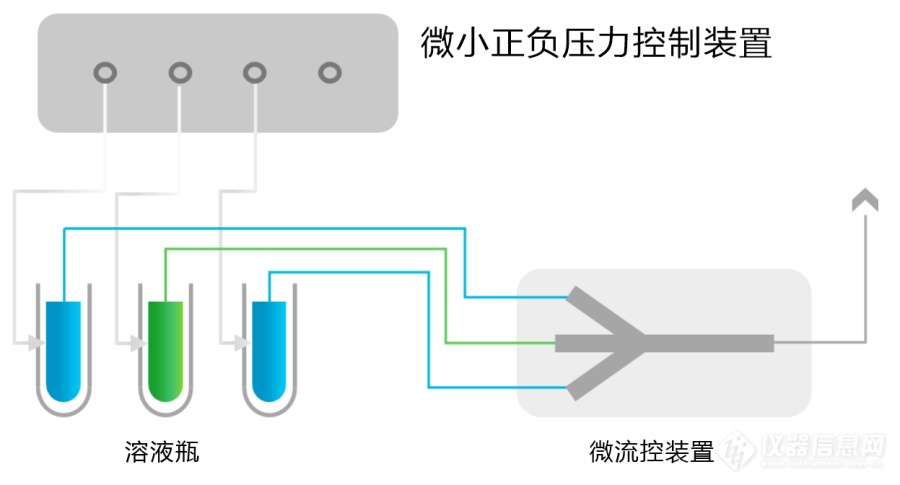
[align=center][img=压力驱动分选进样系统,690,371]https://ng1.17img.cn/bbsfiles/images/2022/06/202206231002395286_2664_3384_3.png!w690x371.jpg[/img][/align][color=#000099]摘要:在循环肿瘤细胞等细胞分选进样系统中,需要在一个标准大气压附近很小的正负压范围对压力进行精密控制,这就对控制方法、气体流量调节阀、压力传感器和控制器提出了更高的要求。本文将针对这些技术问题,提出高精度正负压精密控制解决方案,并详细介绍控制方法和其中软硬件的功能和技术指标,由此可实现0.5%的控制精度。[/color][align=center]~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~[/align][size=18px][color=#000099]一、问题的提出[/color][/size]循环肿瘤细胞(Circulating Tumor Cells,CTC)分选已被认为是癌症诊断和预后的有效工具,要求相应的检测装置能够执行所有实验过程而无需任何人工干预的自动、快速且灵敏。对于一些基于压力驱动液体流动原理的进样系统,要求通过精确控制气体的压力, 确保进样过程中流量稳定并实现自动反馈调节,并需要气压供应装置提供正压和负压以使检测装置中的泵及阀门动作。但在目前的CTC检测装置进样系统中,气压的精密控制还存在以下几方面的问题需要解决:(1)现有的气压供应装置无法提供微小的气压,常会导致泵的薄膜破损而无法使用,且现有的气压供应装置亦无法提供常压,使泵的薄膜在检测过程中无法回到平坦状态,造成细胞破损,故需要有可以提供微气压及常压至检测装置的气压供应装置。为了解决此问题,给微流道芯片提供正压、负压或常压,专利CN 216499436U“气压供应装置”中提出了一种非常复杂的概念性解决方案,标称正压气体的压力大小调节至 1~6psi,负压气体的压力大小调节至?1~6psi,正负压微调节阀可以精密至±0 .01psi。但这些指标恰恰是微压力调节阀的关键,如果没有能达到这种技术指标的调节阀,所述方案根本无法实现。(2)上海理工大学王固兵等人在2020年发表的“基于气压驱动的循环肿瘤细胞分选进样系统的设计与实现“一文中,提出了一种采用德国tecno PS120000 比例电磁阀的技术方案。但这种工业用比例阀主要是用于高压气体的压力控制,口径也较大,控制精度显然不能满足微小正负压的精密控制,而且无法外接高精度压力传感器来提升控制精度,根本无法实现文中提出的达到压力输出精度为1mbar(0.015psi)的指标,相对于1bar大气压这相当于达到0.1%的控制精度,这个指标显然不切合实际。从上述报道可以看出,细胞分选进样系统的压力控制需要在一个标准大气压附近很小的正负压范围对真空压力进行精密控制,这就对控制方法、气体流量调节阀、压力传感器和控制器提出了更高的要求。本文将针对这些技术问题,提出高精度正负压精密控制解决方案,并详细介绍控制方法和其中软硬件的功能和技术指标,由此可实现0.5%的控制精度。[size=18px][color=#000099]二、解决方案[/color][/size]本文所提出的解决方案是实现在一个标准大气压附近±10psi(或±700mbar)范围内的正负压精密控制,控制精度达到0.5%。即提供一个可控气压源解决方案,采用双向控制模式的动态平衡法,结合高精度步进电机和微小流量电动针阀、高精度压力传感器和双通道PID控制器,气压源可进行高精度的正压、负压和一个大气压的可编程输出。微小正负压精密控制的基本原理如图1所示,具体内容为:[align=center][img=气压驱动分选进样系统,690,377]https://ng1.17img.cn/bbsfiles/images/2022/06/202206231005336655_4666_3384_3.png!w690x377.jpg[/img][/align][align=center]图1 微小正负压精密控制原理框图[/align](1)控制原理基于密闭空腔进气和出气的动态平衡法。这是一个典型闭环控制回路,2通道PID控制器采集真空压力传感器信号并与设定值进行比较,然后调节进气和抽气调节阀的开度,最终使传感器测量值与设定值相等而实现真空压力的准确控制。(2)控制回路分别配备了抽气泵(负压源)和气源(正压源),以提供足够的负压和正压能力。(3)为了覆盖负压到正压的所要求的真空压力范围(如-10psi至+10psi),配置一个测试量程覆盖要求范围内的高精度绝对压力传感器,绝对压力传感器对应上述真空压力范围输出数值从小到大的直流模拟信号(如0~10VDC)。此模拟信号输入给PID控制器,由PID控制器调节进气阀和排气阀的开度而实现压力精确控制。采用绝对压力传感器的优势是不受当地大气气压变化的影响,无需采取气压修正,更能保证测试的准确性和重复性。(4)当控制是从负压到正压进行变化时,一开始的进气调节阀开度(进气流量)要远小于抽气调节阀开度(抽气流量),通过自动调节进出气流量达到不同的平衡状态来实现不同的负压控制,最终进气调节阀开度逐渐要远大于抽气调节阀开度,由此实现负压到正压范围内一系列设定点或斜线的连续精密控制。对于从正压到负压压的变化控制,上述过程正好相反。[size=18px][color=#000099]三、方案具体内容[/color][/size]解决方案中所涉及的微小正负压力发生器的具体结构如图2所示,主要包括高压气源、电动针阀、密闭空腔、压力传感器、高精度PID控制器和抽气泵。[align=center][img=气压驱动分选进样系统,690,465]https://ng1.17img.cn/bbsfiles/images/2022/06/202206231006045409_5247_3384_3.png!w690x465.jpg[/img][/align][align=center]图2 微小正负压精密控制的压力发生器结构示意图[/align]在图2所示的微小正负压控制系统中,密闭空腔上的工作压力出口连接检测仪器,密闭空腔左右安装两个NCNV系列的步进电机电动针阀,此电动针阀本身就是正负压两用调节阀,其绝对真空压力范围为0.0001mbar~7bar,最大流量为40mL/min,步进电机单步长为12.7微米,完全能满足小空腔的正负压精密控制。在图2所示的控制系统中使用了两个电动针阀来实现正负压任意设定点的精确控制,也可以从正压到负压的压力线性变化控制,也可以从负压到正压的压力线性变化控制。对于循环肿瘤细胞(CTCs)检测仪器进样系统中的微小正负压控制,要求是在标准大气压附近的真空压力精确控制,如控制精度为±0.5%甚至更小,一般都需要采用调节抽气阀的双向动态模式,即通过双通道PID控制器,一个通道用来恒定进气口处电动针阀的开度基本不变,另一个通道根据PID算法来调节排气口处的电动针阀开度。除了上述恒定进气流量调节抽气流量的控制方法之外,循环肿瘤细胞(CTCs)检测仪器进样系统中的微小正负压的控制精度,主要由压力传感器、PID控制器和电动针阀的精度决定。本方案中的PID控制器采用的是24位AD和16位的DA,电动针阀则是高精度步进电机,因此本解决方案的测试精度主要取决于压力传感器精度,一般至少要选择0.1%精度的压力传感器。对于进样系统中的微小压力控制,往往会要求密闭容器在正负压范围内进行多次往复变化,因此采用了可存储多个编辑程序的PID控制器,设定程度是一条多个折线段构成的曲线,由此可实现正负压往复变化的自动程序控制。在本文所述的解决方案中,为实现正负压的精密控制,如图2所示,针对负压的形成配置了抽气泵。抽气泵相当于一个负压源,但采用真空发生器同样可以达到负压源的效果,负压源采用真空发生器的优点是整个系统只需配备一个高压气源,减少了整个系统的造价、体积和重量,真空发生器连接高压气源即可达到相同的抽气效果。[size=18px][color=#000099]四、总结[/color][/size]本文所述解决方案,完全可以实现循环肿瘤细胞(CTCs)检测仪器进样系统中微小正负压的任意设定点和连续程序形式的精密控制,并且可以达到很高的控制精度和速度,全程自动化。本方案除了微小正负压的自动精密控制之外,另外一个特点是系统简单,正负压控制范围也可以比较宽泛,整个系统小巧和集成化,便于形成小型化的检测仪器。本文解决方案的技术成熟度很高,方案中所涉及的电动针阀和PID控制器,都是目前上海依阳实业有限公司特有的标准产品,其他的压力传感器、抽气泵、真空发生器和高压气源等也是目前市场上常见的标准产品。本文所述解决方案,同样可以适用于各种其他基于气压驱动的微流控进样系统。[align=center]~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~[/align]
微生物的检测,无论在理论研究还是在生产实践中都具有重要的意义,本文分生长量测定法,微生物计数法,生理指标法和商业化快速微生物检测简要介绍了利用微生物重量,体积,大小,生理代谢物等指标的二十余种常用的检测方法,简要介绍了这些方法的原理,应用范围和优缺点。 概述: 一个微生物细胞在合适的外界条件下,不断的吸收营养物质,并按自己的代谢方式进行新陈代谢。如果同化作用的速度超过了异化作用,则其原生质的总量(重量,体积,大小)就不断增加,于是出现了个体的生长现象。如果这是一种平衡生长,即各细胞组分是按恰当的比例增长时,则达到一定程度后就会发生繁殖,从而引起个体数目的增加,这时,原有的个体已经发展成一个群体。随着群体中各个个体的进一步生长,就引起了这一群体的生长,这可从其体积、重量、密度或浓度作指标来衡量。微生物的生长不同于其他生物的生长,微生物的个体生长在科研上有一定困难,通常情况下也没有实际意义。微生物是以量取胜的,因此,微生物的生长通常指群体的扩增。微生物的生长繁殖是其在内外各种环境因素相互作用下的综合反映。因此生长繁殖情况就可作为研究各种生理生化和遗传等问题的重要指标,同时,微生物在生产实践上的各种应用或是对致病,霉腐微生物的防治都和他们的生长抑制紧密相关。所以有必要介绍一下微生物生长情况的检测方法。既然生长意味着原生质含量的增加,所以测定的方法也都直接或间接的以次为根据,而测定繁殖则都要建立在计数这一基础上。微生物生长的衡量,可以从其重量,体积,密度,浓度,做指标来进行衡量。 生长量测定法 体积测量法:又称测菌丝浓度法。 通过测定一定体积培养液中所含菌丝的量来反映微生物的生长状况。方法是,取一定量的待测培养液(如10毫升)放在有刻度的离心管中,设定一定的离心时间(如5分钟)和转速(如5000 rpm),离心后,倒出上清夜,测出上清夜体积为v,则菌丝浓度为(10-v)/10。菌丝浓度测定法是大规模工业发酵生产上微生物生长的一个重要监测指标。这种方法比较粗放,简便,快速,但需要设定一致的处理条件,否则偏差很大,由于离心沉淀物中夹杂有一些固体营养物,结果会有一定偏差。
肌肉能提供干细胞来促进肌肉的生长和受伤肌肉的再生,但肌肉干细胞必须驻留在特殊的部位才能有助肌肉的生长和修复。德尔柏林布吕克分子医学中心(MDC)发育生物学家Dominique Bröhl和Carmen Birchmeier教授已经阐明这些干细胞是如何定植于肌肉干细胞“巢穴”中的。肌肉干细胞也被称为卫星细胞,位于平滑肌细胞的质膜和周围基底层之间。可发育分化为成肌细胞,后者可互相融合成为多核的肌纤维,形成骨骼肌最基本的结构。http://www.bioon.com/biology/UploadFiles/201209/2012091813042153.jpg在本研究中,Bröhl博士和教授Birchmeier表明,小鼠的肌肉祖细胞缺乏Notch信号后,不能定植于干细胞“巢穴”。相反,肌肉祖细胞会定植于肌纤维之间的组织中。发育生物学家认为,这是肌肉弱化的原因。干细胞定植于错误的地方就不再像以前那样拥有多种生物学功能,难以有助于肌肉生长。此外,Notch信号通路在肌肉的发育过程中具有第二大功能。它可以通过抑制肌肉发育促进因子MyoD防止干细胞分化成肌肉细胞,从而确保肌肉中总会存在能保存有修复和再生功能的干细胞“巢穴”。这项工作对肌肉再生和肌肉无力的研究具有重大意义。这实验势必为肌肉严重损伤和肌肉萎缩的患者提供新的希望!多么希望此技术能在中国普及。
[font=宋体][font=宋体]在生物学和医学研究中,细胞增殖是一个关键过程,对于理解生命活动的基本规律以及疾病的发病机理具有重要意义。随着科技的发展,流式细胞仪作为一种高效、灵敏的分析工具,广泛应用于细胞增殖的检测。流式细胞仪通过快速分析单个细胞,可以对细胞周期、细胞增殖活性、细胞凋亡等多个方面进行研究。本文将探讨流式细胞仪在检测细胞增殖方面的主要方法,包括但不限于溴脱氧尿苷([/font][font=Calibri]BrdU[/font][font=宋体])掺入法、细胞周期蛋白检测法以及细胞大小分析法等,以期为读者提供全面的技术应用概览。流式细胞仪检测细胞增殖方法:[/font][/font][b][font=宋体][font=Calibri]1[/font][font=宋体]、[/font][font=Calibri]3H[/font][font=宋体](氚离子)掺入法[/font][/font][/b][font=宋体][font=宋体]原理:是在细胞[/font][font=Calibri]DNA[/font][font=宋体]合成时,用[/font][font=Calibri]3H[/font][font=宋体]脱氧胸腺嘧啶核苷代替普通的脱氧胸腺嘧啶核苷掺入新合成的[/font][font=Calibri]DNA[/font][font=宋体]中,增殖的细胞因为掺入[/font][font=Calibri]3H[/font][font=宋体]而具有放射性,通过定量检测样品细胞的放射性大小而反映细胞的增值活性[/font][/font][font=宋体][font=宋体]缺点:[/font][font=Calibri]1[/font][font=宋体])使用的是具有放射性的同位素,操作较为复杂,同时需要采取放射性保护措施 [/font][font=Calibri]2[/font][font=宋体])低比例高活跃增殖和高比例低活跃增殖可能得到的是相同的结果,用此方法无法进行鉴别 [/font][font=Calibri]3[/font][font=宋体])此方法无法进一步得到具有活性的增值细胞用于下一步的研究 [/font][font=Calibri]4[/font][font=宋体]) 此方法时间较短,无法检测加入前细胞的增殖情况,而且检测到放射性只能说明细胞[/font][font=Calibri]DNA[/font][font=宋体]合成,而不能提供合成[/font][font=Calibri]DNA[/font][font=宋体]的细胞是否进入增殖阶段的信息[/font][/font][b][font=宋体][font=Calibri]2[/font][font=宋体]、相对计数法[/font][/font][/b][font=宋体]原理:将对照组和各实验组控制在相同条件下直接计数然后比较计数结果得到增殖结论[/font][font=宋体]注意点:[/font][font=宋体][font=宋体]对照组与实验组每种细胞所加浓度必须相同,每组至少设置[/font][font=Calibri]3[/font][font=宋体]个复孔,这样每个孔可以得到[/font][font=Calibri]1[/font][font=宋体]个细胞数,将[/font][font=Calibri]3[/font][font=宋体]个复孔取平均值后就是这个组的结果。如果同时需要得到每孔目标细胞增殖后的绝对参数,在每孔细胞中加入[/font][font=Calibri]1*105PE[/font][font=宋体]标记的人工微球作为内参[/font][/font][font=宋体] [/font][font=宋体][font=宋体]收集各组的细胞于[/font][font=Calibri]EP[/font][font=宋体]管中,注意必须尽量将各组的所有细胞都收集起来。标记需要计数细胞的标志表型的荧光素偶联抗体,[/font][font=Calibri]4[/font][font=宋体]℃静置[/font][font=Calibri]30min[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]PBS[/font][font=宋体]洗涤一次,洗去游离的抗体[/font][/font][b][font=宋体][font=Calibri]3[/font][font=宋体]、示踪染料标记法[/font][/font][/b][font=宋体][font=宋体]示踪染料与细胞结合的方式:[/font][font=Calibri]1[/font][font=宋体])能够与细胞内的蛋白质上的氨基发生非特异性的共价结合 [/font][font=Calibri]2[/font][font=宋体])能够非特异性地嵌入细胞膜的脂质双分子层中与细胞发生非共价性结合[/font][/font][font=宋体] [/font][font=宋体][font=宋体]原理:示踪染料的荧光信号都很强,当细胞分裂时,母细胞内的染料会被平均分配到子细胞中,细胞荧光信号会被减弱一半,所以通过检测减弱的、发射示踪染料荧光信号的细胞比例就可以判断细胞增殖的强弱。当荧光强度减弱到标记时的[/font][font=Calibri]1/2[/font][font=宋体]以及以下的细胞都是增殖后的细胞,这些细胞所占比例越高则代表细胞增殖越活跃[/font][/font][font=宋体] [/font][font=宋体]标记方法:[/font][font=宋体][font=宋体]①纯化增殖反应的目标细胞,将细胞的浓度调整为[/font][font=Calibri]1*106/ml[/font][font=宋体],加入[/font][font=Calibri]CFSE[/font][font=宋体],其标记浓度为[/font][font=Calibri]5[/font][font=宋体]微摩尔[/font][font=Calibri]/[/font][font=宋体]升。置于[/font][font=Calibri]37[/font][font=宋体]℃水浴中标记[/font][font=Calibri]15min[/font][font=宋体],在标记过程中每隔一段时间混匀细胞一次[/font][/font][font=宋体] [/font][font=宋体][font=宋体]②加入预冷、含有血清的培养基终止标记,在[/font][font=Calibri]4[/font][font=宋体]℃冰箱中静置[/font][font=Calibri]5min[/font][font=宋体],离心沉淀[/font][/font][font=宋体] [/font][font=宋体][font=宋体]③用培养基再洗涤一次,尽量洗净未结合的游离的[/font][font=Calibri]CFSE[/font][font=宋体],然后将目标细胞静置在增殖体系中[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]4[/font][font=宋体]、[/font][font=Calibri]BrdU[/font][font=宋体]和[/font][font=Calibri]EdU[/font][font=宋体]掺入法[/font][/font][/b][font=宋体][font=Calibri]BrdU[/font][font=宋体]:[/font][font=Calibri]5-[/font][font=宋体]溴脱氧尿嘧啶核苷是胸腺嘧啶核苷的类似物,其特点是胸腺嘧啶环上[/font][font=Calibri]5[/font][font=宋体]位[/font][font=Calibri]C[/font][font=宋体]连接的甲基被溴取代,在细胞增殖[/font][font=Calibri]DNA[/font][font=宋体]合成时可以与内源性的胸腺嘧啶核苷竞争掺入到新合成的[/font][font=Calibri]DNA[/font][font=宋体]中,而[/font][font=Calibri]BrdU[/font][font=宋体]抗体可以特异性的识别[/font][font=Calibri]BrdU[/font][font=宋体],不与胸腺嘧啶核苷结合,所以可以用于检测细胞增殖[/font][/font][font=宋体][font=宋体]适用范围:适用于体内检测目标细胞的增殖,一般将[/font][font=Calibri]BrdU[/font][font=宋体]掺入小鼠的应用水中或经腹腔注射,经过一段时间后,取出目标细胞制成单细胞悬液然后用多聚甲醛固定细胞,后用打孔剂皂苷在细胞膜上打孔,最后标记荧光素偶联抗[/font][font=Calibri]BrdU[/font][font=宋体]抗体,目标细胞的[/font][font=Calibri]BrdU[/font][font=宋体]阳性细胞就是增殖的细胞,阳性比例越高,增殖越活跃。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]5[/font][font=宋体]、其他方法[/font][/font][/b][font=宋体][font=宋体]细胞周期法检测细胞增殖:流式细胞术能够检测细胞内[/font][font=Calibri]DNA[/font][font=宋体]的含量,所以可以检测细胞周期。处于[/font][font=Calibri]S[/font][font=宋体]期的细胞,[/font][font=Calibri]DNA[/font][font=宋体]的量处于二倍体和四倍体之间[/font][font=Calibri] [/font][font=宋体]处于[/font][font=Calibri]G2/M[/font][font=宋体]期时,[/font][font=Calibri]DNA[/font][font=宋体]量为四倍体。处于[/font][font=Calibri]S[/font][font=宋体]期和[/font][font=Calibri]G2/M[/font][font=宋体]期的细胞比例越高说明细胞增殖越活跃[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]PCNA[/font][font=宋体]检测细胞增殖:[/font][font=Calibri]PCNA[/font][font=宋体](增殖细胞核抗原),在细胞核合成且只存在于细胞核内,是[/font][font=Calibri]DNA[/font][font=宋体]聚合酶的辅助蛋白,所以与细胞[/font][font=Calibri]DNA[/font][font=宋体]的合成关系密切,是反映细胞增殖状态的良好指标[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Ki-67[/font][font=宋体]检测细胞增殖:是一种与细胞增殖特异相关的核抗原[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]CD71[/font][font=宋体]检测细胞增殖:是转铁蛋白受体,表达于细胞的表面,该受体广泛表达于各种恶性肿瘤细胞表面,正常细胞表达较少,与肿瘤细胞的增殖密切相关[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/flow-cytometry-service][b]流式细胞检测技术服务[/b][/url],更多关于流式细胞仪检测细胞增殖详情欢迎咨询,详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/flow-cytometry-service[/font][/font][b][font=宋体] [/font][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
水果树莓可明显抑制肝癌细胞系增殖,使肝癌细胞血管内皮生长因子(VEGF)的表达减弱,并使抑癌基因野生p53的表达增强。由哈医大附属第四医院刘明博士完成的一项国家自然基金课题,首次成功锁定树莓预防肝癌生长的两个特异性蛋白质作用靶点,为果蔬预防原发性肝癌提供了重要的理论依据。这一成果近日获得2008年度黑龙江省医药卫生科技进步一等奖。 2000年,刘明博士赴美国康奈尔大学研修深造期间,尝试将树莓中的鞣化酸与肝癌细胞混合培养,发现前者能显著抑制后者的生长。近年来,他从医学、营养学等角度开展了“树莓预防及抑制肝癌机制的研究”。 研究结果表明,随着树莓中植物化学物质浓度的增加,总抗氧化自由基清除能力也随之增强。0.25毫克/毫升至10毫克/毫升的树莓提取物对肝癌细胞系HepG-2的抑制率呈逐渐增加趋势,最高抑制率可达90%%左右。 在利用化学毒物黄曲霉毒素和二乙基亚硝胺建立的稳定大鼠原发肝癌模型上,随着树莓提取物浓度的增高,实验组大鼠肝脏上的瘤径变小,肿瘤的数量减少,成瘤率减低,结节程度减轻;肝癌细胞VEGF、增殖细胞核抗原表达的程度亦明显降低。同时,实验组大鼠血清在两种特异蛋白(M2597、M4513)质峰上与树莓干预组及正常大鼠血清差异明显,说明蛋白质峰M2597、M4513极有可能为树莓预防肝癌的蛋白质作用靶点。 专家评价,今后,利用树莓中提取的植物化学成分,进行合理搭配及组成预防剂,十分有助于防范肝癌的发生,并能抑制肝癌的发展,提高患者生存率。

自去年我公司推出全自动核酸分析系统的免费试用后,今天我们又再次为各位老师奉上强大的细胞分析平台:一款可以解决您MTT实验烦恼、无需标记、全自动化,带给您高信息量、高灵敏度和高准确性的iCELLigence全自动细胞分析仪将会出现在您的面前。iCELLigence全自动细胞分析仪通过嵌在E-plate板上孔底的微电子感应器阻抗变化去感受细胞的有无以及贴壁、黏附和生长程度的改变,无需标记即可实时、直观的反应细胞增殖、存活、凋亡、形态变化等细胞生物学变化。iCELLigence全自动细胞分析仪的传感器阻抗技术在细胞分析中具有其独特的优势:它为整个的实验分析过程包括细胞黏附、细胞增殖和细胞融合提供了全程无损伤的监控,实时、连续显示的数据让您可以更加自信更加清楚的进行细胞操作和细胞增殖等分析,而不是假定细胞处于合适的处理阶段。一连串实时获取和显示的数据让您处理每一步结果都可以通过机理来预测,同时也可以结合iCELLigence全自动细胞分析仪连续的读数来决定传统终点细胞分析的最佳时间点。只需几个简单的操作步骤您就可以获得高信息量的、直观的、准确的结果,就可以让您的细胞增殖等分析实验变得更加省时与高效。莫再犹豫,快来参加体验吧,经历过你就会发现有时候细胞增殖等实验会是这么的easy。赶快报名,免费的试用在等着您哦···活动期间,凡是参与试用的用户均可获得昊诺斯8GU盘或瑞士军刀背包一个(奖品以实物为准)。http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647437_1622715_3.jpg真心英雄活动第二关试用报名网址:http://www.instrument.com.cn/custom/SH100700/20130522/free.shtml另外,您也可以致电北京昊诺斯科技有限公司市场部产品负责人孙健13710746995sunjian@herosbio.com(因为区域划分,活动仅限北方区域,具体问题欢迎来电垂询)。
【序号】:4【作者】:孙银凤1张国荣【题名】:组织工程肌腱种子细胞、支架材料和生长因子的研究进展【期刊】:中国医学创新. 【年、卷、期、起止页码】:2018,15(04)【全文链接】:https://kns.cnki.net/kcms2/article/abstract?v=3uoqIhG8C44YLTlOAiTRKibYlV5Vjs7i0-kJR0HYBJ80QN9L51zrPzkailMgzjgNTQgeWpo-Fz_26SEHjmZmMDCcUPLJxDxT&uniplatform=NZKPT
[b][url=http://www.f-lab.cn/cell-analyzers/ctc-enumeration.html]CTC细胞计数成像系统[/url][/b]集细胞荧光成像和罕见细胞计数功能于一体,自动聚焦成像,能够探测超级罕见细胞,包括[color=#333333]循环肿瘤[/color]细胞(Circulating Tumor Cells, CTCs),CTCs细胞。CTC细胞计数成像系统采用Nikon Ti-2倒置荧光显微镜,配备自动扫描显微镜载物台,自动聚焦器件,高灵敏度荧光CCD相机和LED激发光源组建而成。[img=CTC细胞计数成像系统]http://www.f-lab.cn/Upload/CTCs-enumeration.JPG[/img][img=CTC细胞计数成像系统]http://www.f-lab.cn/Upload/CTC-enumeration.JPG[/img]CTC细胞计数成像系统:[url]http://www.f-lab.cn/cell-analyzers/ctc-enumeration.html[/url][b][/b]
[font=宋体]流式细胞术,作为一种先进的生物技术,已经在生物医学研究中占据了举足轻重的地位。这种技术以其高精度、高速度以及多参数同时检测的能力,广泛应用于细胞生物学、免疫学、肿瘤学等多个领域。流式细胞术不仅可以对单个细胞进行多参数定量分析和分选,还能够对细胞内部的蛋白质、核酸、细胞受体以及细胞表面抗原等进行检测。因此,它在疾病诊断、药物筛选、细胞功能研究等方面具有广泛的应用前景。本文将对流式细胞术的检测原理、应用领域以及发展前景进行详细介绍,旨在为读者提供对这一技术全面而深入的了解。流式细胞术可以检测什么?下面是具体检测信息及应用:[/font][font=宋体] [/font][b][font=宋体][font=Calibri]1.[/font][font=宋体]细胞表型检测[/font][/font][/b][font=宋体]免疫细胞表型是流式细胞术最突出应用。[/font][font=宋体][font=宋体]通过检测免疫细胞群的表面或细胞内标志物,对其进行鉴定和表征。流式细胞术能够精确鉴定和分类免疫细胞群,例如[/font] [font=Calibri]T [/font][font=宋体]细胞、[/font][font=Calibri]B [/font][font=宋体]细胞、[/font][font=Calibri]NK [/font][font=宋体]细胞、树突状细胞、单核细胞、巨噬细胞、血小板和粒细胞等。[/font][/font][font=宋体] [/font][font=宋体]研究人员可以识别和量化异质群体中的各种免疫细胞亚群。[/font][font=宋体] [/font][font=宋体][font=宋体]临床医生可以诊断和监测各种血液系统疾病、进行免疫免疫评估([/font][font=Calibri]8[/font][font=宋体]大类免疫细胞构成与肿瘤预后)。[/font][/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体][font=Calibri]2.[/font][font=宋体]细胞活力检测[/font][/font][/b][font=宋体] [/font][font=宋体]流式细胞术能够定量测量群体内和体外培养的活细胞和非活细胞。[/font][font=宋体] [/font][font=宋体]通过使用选择性标记活细胞或死细胞的荧光染料,流式细胞术可以提供精确可靠的活力测定,有助于确定细胞活力百分比。[/font][font=宋体] [/font][font=宋体]流式细胞术可以根据特定的标志物或染料区分活细胞、凋亡细胞和坏死细胞,从而更详细地了解细胞的健康和状态。通过将活力染料与细胞表面抗原、细胞内蛋白或功能测定的标记物相结合,研究人员可以在特定细胞类型或实验条件下获得有关细胞活力及其发生机制的全面信息。[/font][font=宋体] [/font][font=宋体]最常用的活性检测染料[/font][font=宋体] [/font][font=宋体][font=宋体]死细胞:碘化丙啶([/font] [font=Calibri]propidium iodide[/font][font=宋体],[/font][font=Calibri]PI[/font][font=宋体])和[/font][font=Calibri]7-AAD[/font][font=宋体],与[/font][font=Calibri]DNA[/font][font=宋体]结合,但只能进入膜受损的细胞,使死细胞发出荧光。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]凋亡细胞:[/font][font=Calibri]annexin V[/font][font=宋体]:对磷脂酰丝氨酸具有强结合亲和力的蛋白质,在细胞凋亡的早期阶段暴露在质膜的外表面[/font][font=Calibri]annexin V+PI[/font][font=宋体]是常用区分凋亡细胞和坏死细胞的组合。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]活细胞:[/font][font=Calibri]calcein AM[/font][font=宋体]、[/font][font=Calibri]CFDA[/font][font=宋体]([/font][font=Calibri]carboxyfluorescein diacetate[/font][font=宋体])、[/font][font=Calibri]FDA [/font][font=宋体]([/font][font=Calibri]fluorescein diacetate[/font][font=宋体]) :进入活细胞,但只有在与细胞内酶相互作用时才会发出荧光[/font][/font][font=宋体] [/font][font=宋体][font=宋体]细胞体内增殖:[/font][font=Calibri]CFSE(CFDA-SE)[/font][font=宋体]穿透细胞膜,在活细胞内与胞内蛋白共价结合,水解后释放出绿色荧光。在细胞分裂增殖过程中,它的荧光强度会随着细胞的分裂而逐级递减,标记荧光可平均分配至两个子代细胞中,因此其荧光强度是亲代细胞的一半,根据这一特性,它可被用于检测细胞增殖,细胞周期的估算及细胞分裂等方面。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]3.[/font][font=宋体]细胞周期分析[/font][/font][/b][font=宋体] [/font][font=宋体]从流式细胞术的早期开始,细胞周期分析就成为有价值的应用。[/font][font=宋体] [/font][font=宋体]原理是基于荧光和核酸的量之间的关系。[/font][font=宋体] [/font][font=宋体][font=宋体]常用核酸结合染料:碘化丙啶([/font][font=Calibri]PI[/font][font=宋体]),[/font][font=Calibri]Hoechst[/font][font=宋体],[/font][font=Calibri]DAPI[/font][font=宋体],[/font][font=Calibri]7-AAD[/font][font=宋体],溴化乙锭等。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]流式细胞术细胞周期分可以有很多方面的应用,例如,[/font][font=Calibri]DNA/Ki67[/font][font=宋体]测定可以将表型选择与细胞周期分析相结合,用于监测[/font][font=Calibri]p53[/font][font=宋体]细胞周期停滞,评估抗癌活,多药耐药性等。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]4.[/font][font=宋体]离子通道测定[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]钙作为关键的第二信使,在许多细胞信号通路中起着至关重要的作用。它在免疫细胞活化中尤为重要,包括[/font][font=Calibri]T[/font][font=宋体]细胞、[/font][font=Calibri]B[/font][font=宋体]细胞和[/font][font=Calibri]NK[/font][font=宋体]细胞。[/font][/font][font=宋体]此外,钙信号传导还参与肥大细胞脱颗粒、神经元兴奋性、突触传递和神经递质释放至关重要。[/font][font=宋体] [/font][font=宋体][font=宋体]细胞脱颗粒的早期测量值是通过使用钙离子载体[/font][font=Calibri]A23187[/font][font=宋体]的流式细胞术确定的。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]常用荧光染料:[/font][font=Calibri]fluo-3 [/font][font=宋体]和[/font][font=Calibri]indo-1[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]虽然[/font][font=Calibri]Ca2+[/font][font=宋体]通道测量是最常见的应用之一,但其他离子如镁、钾、钠和氢也可以使用流式细胞术进行监测。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]5.[/font][font=宋体]细胞功能检测[/font][/font][/b][font=宋体]最早的检测是细胞酯酶。[/font][font=宋体] [/font][font=宋体][font=宋体]使用响应氧化态变化的活性染料检测粒细胞的氧化电位。例如,氢乙啶([/font][font=Calibri]hydroethidine[/font][font=宋体])用于中性粒细胞呼吸爆发。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]二乙酸二氯荧光素([/font][font=Calibri]dichlorofluorescein diacetate[/font][font=宋体]),已被用于吞噬细胞功能研究。[/font][/font][font=宋体] [/font][font=宋体]效应细胞杀伤功能,是流式细胞术的另外一个重要应用。[/font][font=宋体] [/font][font=宋体]细胞因子是免疫细胞功能的重要执行分子,对科学研究,免疫细胞治疗,临床诊疗都及其关键。基于流式细胞术开发的多重细胞因子检测,已经有广泛应用。[/font][font=宋体] [/font][b][font=宋体][font=Calibri]6.[/font][font=宋体]蛋白质工程[/font][/font][/b][font=宋体] [/font][font=宋体]流式细胞术和分选传统上不是蛋白质工程中最常用的技术之一。然而,近年来,在该领域的应用越来越多。[/font][font=宋体] [/font][font=宋体][font=宋体]流式细胞术被用于酶学蛋白质研究,包括细胞色素[/font][font=Calibri]P450[/font][font=宋体]、葡萄糖氧化酶、几丁质酶、纤维素酶、过氧化物酶、酯酶、转移酶、β半乳糖苷酶、硫代内酯酶等。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]蛋白质工程,包括在基因水平上引入突变(随机或特异性),以创建由数千到数百万个单个蛋白质变体组成的文库(如上图),使用流式细胞术[/font] [font=宋体]每天能够分析多达[/font] [font=Calibri]10^8[/font][font=宋体]–[/font][font=Calibri]10^9 [/font][font=宋体]个克隆,并对具有所需特性的克隆进行分类。[/font][/font][b][font=宋体] [/font][font=宋体][font=Calibri]7.[/font][font=宋体]哺乳动物细胞和细菌细胞分选[/font][/font][/b][font=宋体] [/font][font=宋体]细胞分选是流式细胞的重要应用之一,哺乳动物细胞相对成熟,不做赘述。细菌细胞方面的应用,也逐渐开始建立。[/font][font=宋体] [/font][font=宋体]与耗时的传统琼脂铺板检测方法相比,流式分选可以快速检测和分选悬浮液中的单个细菌细胞。[/font][font=宋体] [/font][font=宋体]尽管细胞分选仪具有高性能,但它们在微生物学中的应用一直受到限制。[/font][font=宋体] [/font][font=宋体]这主要是由于微生物体积小,因此很难将它们与培养基中的细胞碎片或背景颗粒区分开来。另一个潜在的问题是,通常没有细菌菌株特有的抗体。[/font][font=宋体] [/font][font=宋体][font=宋体]限制细胞分选仪在细菌检测和分选中的适用性的其他因素主要与分选仪硬件功能本身有关,在流式细胞术仪器的早期,数量有限的激光器和检测器,限制一次只能使用一种或两种荧光染料。随着最新仪器的发展,多激光器和检测起的仪器被开发:包括赛默飞世尔的[/font][font=Calibri]Bigfoot[/font][font=宋体]光谱细胞分选仪,[/font][font=Calibri]BD FACSAria III[/font][font=宋体]分选仪,索尼[/font][font=Calibri]MA900[/font][font=宋体]细胞分选仪和贝克曼库尔特的[/font][font=Calibri]MoFlo Astrios EQ[/font][font=宋体]等。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]此外,部分致病性细菌,需要在[/font][font=Calibri]BSL2[/font][font=宋体]以上的实验环境下进行,现在部分流式细胞术带有[/font][font=Calibri]BSL 2 hood[/font][font=宋体]。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]8.[/font][font=宋体]液滴微流体[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]液滴微流体是一个相对较新的领域,专注于皮升体积中含有细胞或[/font][font=Calibri]DNA[/font][font=宋体]的离散液滴的形成,操作和分析,应用于生物学、化学、材料科学和医学。[/font][/font][font=宋体] [/font][font=宋体]在生物学中,液滴微流体可实现单细胞分析、生物分子的高通量筛选、细胞异质性研究和药物发现。[/font][font=宋体] [/font][font=宋体][font=宋体]流式细胞术分析是研究单细胞的强大技术,可提供有关各种参数的宝贵信息。然而,它的测量仅限于直接连接到细胞的分子,例如表面或细胞内标记物,限制研究由细胞分泌或由[/font][font=Calibri]DNA[/font][font=宋体]分子产生但不物理附的分子。液滴微流体提供了一种克服这一限制的新方法。将细胞或[/font][font=Calibri]DNA[/font][font=宋体]封装在单个液滴中会产生离散的区室,从而能够分析由封装实体释放或产生的化合物。[/font][/font][b][font=宋体] [/font][font=宋体][font=Calibri]9.[/font][font=宋体]下一代生物制剂[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]生物制药已经占据了药物市场的重要份额,包括治疗性蛋白质([/font][font=Calibri]65%[/font][font=宋体]),疫苗([/font][font=Calibri]20%[/font][font=宋体])等。通过测序([/font][font=Calibri]NGS[/font][font=宋体])进行单[/font][font=Calibri]B[/font][font=宋体]细胞库分析和克隆扩增鉴定,直接从人类幸存者克隆免疫球蛋白基因,分离出高亲和力中和抗体,加快了单克隆抗体药物的研发,然而,这种方法比较昂贵,且依旧需要后续的功能验证等。新策略可使用流式细胞术、[/font][font=Calibri]MACS[/font][font=宋体]或微流体将单细胞分离与功能筛选相结合,降低开发成本并消除失败的候选药物,是流式细胞术新的应用开发方向。[/font][/font][font=宋体] [/font][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/flow-cytometry-service][b]流式细胞检测技术服务[/b][/url],拥有[/font][font=宋体][font=宋体]①具有 [/font][font=Calibri]20,000 [/font][font=宋体]次以上流式抗体筛选鉴定经验及多年流式诊断抗体研发经验,在实验方案设计、样品制备、数据分析等方面确保科学性、准确性和可靠性[/font][font=Calibri] [/font][/font][font=宋体][font=宋体]②拥有 [/font][font=Calibri]1,000 [/font][font=宋体]余株自产精品流式抗体,覆盖细胞膜、胞内、核内及分泌抗原;[/font][/font][font=宋体][font=宋体]③自产 [/font][font=Calibri]Annexin V/7-AAD [/font][font=宋体]凋亡检测试剂盒,并储备多种流式检测常用试剂,大大节约购买试剂的等待时间和实际费用;[/font][/font][font=宋体][font=宋体]④可以提供近 [/font][font=Calibri]200 [/font][font=宋体]种细胞系选择,省去细胞样本寄送过程中的风险,并可以免费提供健康人外周血细胞对照品。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/flow-cytometry-service[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b][font=宋体] [/font][font=Calibri] [/font]
[align=center][font='calibri'][size=13px]生乳体细胞检测[/size][/font][/align]1、 [size=18px]生乳体细胞检测目的及意义[/size][size=18px]体细胞数的英文是Somatic Cell Count , 缩写为SCC是指出现在正常牛奶中少量的动物身体细胞。以每毫升牛奶中的体细胞数表示,通常以千个计数。体细胞( scc ) 的组成,白细胞 (即巨噬细胞、嗜中性白细胞和淋巴细胞)和上皮细胞。[/size][size=18px]体细胞(SCC)越低牛奶质量越高SCC越高对原奶质量的影响越大,并对牛奶的保质期和乳制品如酸奶、奶酪等的产量、质量、风味等产生极大的不利影响。因此各国都将体细胞数作为牛奶质量标准中最重要的指标之一。[/size]2、 [size=18px]检测原理[/size][size=18px]采用荧光染色自动镜检原理,染色剂外无需额外的化学试剂;干粉式染色剂无需要样品稀释液。排除液体染色剂挥发的影响;体细胞检测范围1-1000万,建议有效计数范围为5万以上。[/size]3、 [size=18px]操作过程[/size][align=left][size=18px]第一步:充分搅拌后在取样瓶中用 100ul 的[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url]抽取 [/size][size=18px]100ul [/size][size=18px]奶[/size][size=18px],[/size][size=18px]加入到染色瓶中;第二步:把加入奶样后的染色剂瓶放置在搅拌器上,按 2 秒,松 [/size][size=18px]2 [/size][size=18px]秒,共搅拌 [/size][size=18px]10 [/size][size=18px]次, 静止 [/size][size=18px]2 [/size][size=18px]分钟让它充分染色,然后再放在搅拌器上按压搅拌 [/size][size=18px]3 [/size][size=18px]次。第三步:打开盖子,用另外一个[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url]取样出 8ul 奶样在检测板半圆孔处缓慢排出,无需排气, 让样品慢慢渗过去,然后静置 [/size][size=18px]30 [/size][size=18px]秒,直至对面直线处充满样品。[/size][/align][align=left]4、 [size=18px]注意事项[/size][/align][align=left][size=18px]1、开机时,先接电源,打开机器,最后开平板,避免第二步自检不成功[/size][/align][align=left][size=18px]2、在进行检测时,若点击按钮没有反应,则机器可能进入了仿真模式,若出现 [/size][/align][align=left][size=18px]这种情况,可返回自检界面,调整箭头所指模式即可。[/size][/align][align=left]3、 [size=18px]仪器使用较长时间后,会出现卡顿现象,这种情况下可以清除以往检测数据,点击参数选项,进入页面。[/size][/align][align=left][size=18px]4、仪器使用时,请勿在平板上下载游戏,视频等占内存的软件,避免出现卡顿现象。 [/size][/align][align=left][size=18px]5[/size][size=18px]、仪器使用结束后,关机时请先关闭平板,再关闭机器,最后拔下电源。[/size][/align]
市场上供应的大多数培养液的配方非常接近,这使得细胞很容易适应新的培养液。这里我将详细介绍一个方法,这个方法是保守的,在大多数情况下可以进行删减一些步骤。最简单最节省时间的情况是把细胞直接分装到新的培养液中,观察几代以保证细胞的生长参数是可以接受的。这个方法适于悬浮细胞,不过也很容易扩展到贴壁细胞。细胞的生长参数1. 翻倍时间( Doubling Time )细胞的翻倍时间在评价昆虫细胞健康程度的参数中是最容易测量的。翻倍时间应该在细胞处于对数期复制时测量,对于 Sf9 和 Sf21 细胞来说通常是介于 16-24 小时之间,不过大多数在 20-22 小时。dt=t × ln2/ln(Ct/Co) ,其中 dt 为翻倍时间, Co 为起始细胞数目, Ct 为经过时间 t 后的细胞数目, t 为 Co 和Ct 两次计数之间的间隔时间,所有的时间都以小时为单位。2. 细胞大小( Cell Size )细胞的大小是监测细胞健康程度的一个非常有用的参数。如果细胞是健康的,细胞的大小均一,都处于该细胞株体积正常变化范围的下限。细胞的大小在不同的细胞株变化是很大的。对于我用过的 Sf9 和 Sf21 ,典型的直径是 16-18 m m ,不过我知道有些细胞株小至 14 m m 或者大至 19 m m 仍然很健康。3. 滞后期( Duration of Lag )当细胞的密度较低时,会有一个滞后期,其长短取决于分装或者传代后细胞的密度。一般说来,该密度越低,滞后期越长。对于一个特定的细胞株来说,当这个密度高出一个阈值时,滞后期的长短与密度无关;而低于一个阈值时,滞后期无限长,细胞不再增殖。4. 低密度分装极限( Low Density Split Tolerance )能够在一个较短的滞后期(小于 12 小时)复苏的细胞形状较好。不过这是细胞株的特性,需要进行实验来确定你的细胞株的密度极限。我的细胞株有些在分装成密度为 5 × 104 细胞 /ml 时仍然可以很好复苏,有些细胞株分装成 5 × 105 细胞 /ml 就不能复苏了。5. 高密度极限( High Density Maximum )这是你的细胞能生长的最大密度,高于这个密度你的细胞将进入平台期。这个指标既和细胞株有关,又和使用的培养液有关。我建议先把你的细胞株培养至平台期,然后把一些分装到新鲜的培养液中以后,使剩下的继续生长至平台期,同时密切监测细胞状况。一般来说,细胞的培养要避免密度超过高密度极限的 80% 。对于我培养的细胞,这个极限值从 2 × 106 至 12 × 106 细胞 /ml 不等。实验步骤第一阶段:1. 准备合适体积的由 25% 体积新培养液和 75% 旧培养液(即细胞原先适应的培养液)组成的混合培养液 I。2. 将细胞以通常分装时使用的最低分装密度的两倍分装到混合培养液 I 中。3. 使细胞生长到通常培养时的较高密度,监测细胞生长参数。4. 继续以步骤 2 中的密度分装细胞到新鲜的混合培养液 I 中,直到生长参数达到可以接受的水平。有时候分装一次就可达到要求。5. 一旦细胞稳定下来,以通常使用的最低分装密度分装细胞至新鲜的混合培养液 I 中,同样监测细胞参数。6. 细胞达到较高密度后,继续以步骤 5 中的分装密度把细胞分装到新鲜的混合培养液 I 中,直到细胞的生长参数达到可以接受的水平。7. 如果细胞恢复到正常状态,进行第二阶段的实验。8. 如果细胞不能达到正常状态,新培养液可能不适于培养这种细胞。9. 如果细胞在新培养液中的生长参数达到平衡状态,虽然与正常状态不同,但是可以为实验接受,也可进行第二阶段的实验。第二阶段:1. 准备适量的由 50% 新培养液和 50% 旧培养液组成的混合培养液 II 。2. 将细胞以两倍最低分装密度分装至混合培养液 II 中。3. 如第一阶段一样,监测细胞生长指数,使细胞达到稳定状态。然后将分装密度降到最低分装密度,再使细胞达到稳定状态。第三阶段:步骤同第一阶段和第二阶段,使细胞适应混合培养液 III ( 75% 新培养液和 25% 旧培养液)。第四阶段:1. 步骤同第一阶段、第二阶段和第三阶段,使细胞适应新培养液。2 . 当细胞在新培养液中达到稳定后,监测细胞的生长指数,看是否波动过大。
[b][url=http://www.f-lab.cn/cell-analyzers/puncher.html][b]单细胞转移分离系统[/b][/url]是可用于单细胞转移,单细胞分离和单细胞隔离,单细胞成像应用的多功能单细胞分离操作仪器,它可以实现从微孔芯片转移单细胞到细胞收集管中。单细胞转移分离系统[/b][color=#666666]集单细胞成像,单细胞隔离,单细胞选择功能于一体,自动聚焦成像。[/color][b]单细胞转移分离系统转移单细胞到Eppendorf微管,PCR微孔板或其它反应微管中,[/b][color=#666666]在隔离单细胞后,它可以对选定收集的细胞进行扫描并成像。[/color][b]单细胞转移分离系统[/b][color=#666666]采用Nikon Ti-2倒置荧光显微镜,配备自动扫描显微镜载物台,自动聚焦器件,高灵敏度荧光CCD相机和LED激发光源组建而成。[/color][img=单细胞转移分离系统]http://www.f-lab.cn/Upload/single-cell-isolation.JPG[/img][b]单细胞转移分离系统[/b]特点完全自动化,步进系统高质量单细胞荧光成像单细胞分离的效率超过90% 超过70%分离的细胞增殖 分离后兼容所有的单细胞的WGA工具包(放大器的‐1,picoplex,复制‐G)实惠微Wells基于硅微孔微腔。由薄膜封闭70µ m,井底直径(1µ m),包含一个单孔。样品流体进入威尔斯并从底部的孔隙中流出。单个细胞被拖着走。一旦单个细胞降落到孔隙上,流动停止,其他细胞就不会进入井内。有用的细胞被识别出来。选定的细胞穿孔从微孔到384孔PCR板或离心管等等。单细胞转移分离系统:[url]http://www.f-lab.cn/cell-analyzers/puncher.html[/url]
试剂盒使用说明书本试剂仅供研究使用 目的:本试剂盒用于测定人血清,血浆及相关液体样本中肝细胞生长因子受体(HGFR/ c-MET)的含量。实验原理: 本试剂盒应用双抗体夹心法测定标本中人肝细胞生长因子受体(HGFR/ c-MET)水平。用纯化的人肝细胞生长因子受体(HGFR/ c-MET)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入肝细胞生长因子受体(HGFR/ c-MET),再与HRP标记的羊抗人抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的肝细胞生长因子受体(HGFR/ c-MET)呈正相关。用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人肝细胞生长因子受体(HGFR/ c-MET)浓度。试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×481×962-8℃保存标准品:1350ng/L0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液1.5ml×1瓶1.5ml×1瓶2-8℃保存酶标试剂3 ml×1瓶6 ml×1瓶2-8℃保存样品稀释液3 ml×1瓶6 ml×1瓶2-8℃保存显色剂A液3 ml×1瓶6 ml×1瓶2-8℃保存显色剂B液3 ml×1瓶6 ml×1瓶2-8℃保存终止液[align=cente