液相色谱故障排除之谱图的各种问题:液相色谱系统的许多问题都能在谱图上反映出来。其中有一些问题可以通过改变设备参数得到解决;而其他的问题必须通过修改操作程序来解决。对于色谱柱和流动相的正确选择是得到好的色谱图的关键。 A、 峰拖尾 1、筛板阻塞 a、反冲色谱柱 b、更换进口筛板 c、更换色谱柱 2、色谱柱塌陷 a、填充色谱柱 3、干扰峰 a、使用更长的色谱柱 b、改变流动相或更换色谱柱 4、流动相PH选择错误 a、调整PH值。对于碱性化合物,低PH值更有利于得到对称峰 5、样品与填料表面的溶化点发生反应 a、加入离子对试剂或碱性挥发性修饰剂 b、更改色谱柱 B、 峰前延 可能的原因 在大峰前,有小峰流出 柱死体积 样品溶剂不适当 过滤片部分堵塞 柱过载 1、柱温低 a、升高柱温 2、样品溶剂选择不恰当 a、使用流动相作为样品溶剂 3、样品过载 a、降低样品含量 4、色谱柱损坏 a、见A1、A2 C、 峰分叉 1、 保护柱或分析柱污染【柱中有死体积】 a、取下保护柱再进行分析。如果必要更换保护柱。如果分析柱阻塞,拆下来清洗。如果问题仍然存在, 可能是柱子被强保留物质污染,运用适当的再生措施。如果问题仍然存在,入口可能被阻塞,更换筛板或更换色谱柱。 2、样品溶剂不溶于流动相 a、改变样品溶剂。如果可能采取流动相作为样品溶剂。 [font='Times New
我们用的是安捷伦1100的高效液相色谱仪,在做一个软膏剂的时候,标准规定的浓度进样10μl,峰形有前延峰,把浓度稀释一半,进样10μl,峰的对称性在1.0左右,如果再把浓度稀释一半,进样20μl的话,峰形又不对称了。大家分析一下是什么原因?液相色谱的进样量与峰形之间的关系怎样?(药品名字是“复方地塞米松乳膏”,内标法测定地塞米松含量,内标物是甲睾酮)
[color=#00008B][B]该帖为楼主自己整理,帖中所有楼主撰写的内容未经授权不得转载,否则属侵权违法行为![/B][/color]看到很多版友发帖求助讨论准确性的问题,我特意整理了一个关于定量分析误差问题的帖子,希望对大家有所帮助。高效液相色谱定量分析过程可分为样品的前处理、标准品的配制、进样、色谱分离、检测及数据处理等七个步骤。[B]一 误差的主要来源[/B]随着现在市场销售仪器自动化程度的提高,进样、色谱分离、检测及数据处理等实验环节对实验结果产生的误差越来越小,尤其在高效液相色谱定量分析中,实验结果的误差可能主要来源于样品的前处理及标准品的配制。[B]1、样品的前处理 [/B]样品的萃取率是样品前处理时存在的主要问题。当固-液萃取(含柱分离的前处理方法),液-液萃取时,存在萃取率不高且不稳定的问题。尤其在除去蛋白质时,存在变性蛋白质会吸附一些被测组分,导致萃取率降低的情况。通常,萃取率是通过在式样中添加被测成分在萃取的方法评价的。也就是说,被测成分的增加量和液相色谱中的峰面增大成比例关系,通过这种方法可以确定溶液中被测成分的变化趋势。 如果存在萃取率不稳定的问题,就有必要改变萃取的方法,要预先添加内标,然后萃取。这种情况采用的内标,必须与被测物质的化学结构类似,萃取的萃取率才可能相近。如果回收率不但接近100%而且较为稳定,可以证明这种前处理方法较为可靠。在分析中如果能充分考虑以上误差产生的各种原因,才有可能得到精确的分析结果。 [B]2、标准品的配制[/B]本帖中讨论的问题带有普遍性,影响高效液相色谱分析结果准确性的因素较多,仅在标准溶液的配置过程中,可以分为标准物质的称量,溶液的配制和溶液的储存三个环节。 作为标准溶液使用的标准物质其纯度要求很高,应避免使用纯度不符合要求的试剂,作为标准溶液使用的标准物质具有不可替代性,现在市场有销售的HPLC专用的溶剂及各种标准试剂可供实验选择;其次选择与样品浓度要求相适应的天平,应该尽可能使用高精度的天平,这样才能把由于天平使用带来的称量操作误差降至最低。[B]二 消除误差的方法[/B] 要提高分析结果的准确度,必须考虑在分析过程中可能产生的各种误差,采取有效措施,将这些误差减到最小。[B]1、选择合适的分析方法[/B] 各种分析方法的准确度是不同的。化学分析法对高含量组分的测定能获得准确和较满意的结果,相对误差一般在千分之几。而对低含量组分的测定,化学分析法就达不到这个要求。仪器分析法虽然误差较大,但是由于灵敏度高,可以测出低含量组分。在选择分析方法时,一定要根据组分含量及对准确度的要求,在可能条件下选最佳分析方法。[B]2、增加平行测定的次数[/B] 如前所述增加测定次数可以减少随机误差。在一般分析工作中,测定次数为2—4次。如果没有意外误差发生,基本上可以得到比较准确的分析结果。[B]3、消除测定中的系统误差[/B] 消除测定中系统误差可采取以下措施:其一是做空白实验,即在不加试样的情况下,按试样分析规程在同样操作条件下进行的分析。所得结果的数值称为空白值。然后从试样结果中扣除空白值就得到比较可靠的分析结果。其二是注意仪器校正,具有准确体积的和质量的仪器,如滴定管、移液管、容量瓶和分析天平,都应进行校正,以消除仪器不准所引起的系统误差。因为这些测量数据都是参加分析结果计算的。其三是作对照试验,对照试验就是用同样的分析方法在同样的条件下,用标样代替试样进行的平行测定。将对照试验的测定结果与标样的已知含量相比,其比值称为校正系数。 校正系数=标准试样组分的标准含量/标准试样测定的含量 被测试样的组分含量=测得含量×校正系数 综上所述,在分析过程中检查有无系统误差存在,作对照试验是最有效的办法。通过对照试验可以校正测试结果,消除系统误差。[B]4、样品定量分析过程中的误差[/B]样品处理要尽量减少操作者的技术问题带来的误差,样品的稀释次数、稀释工具都是误差的祸根,应尽量减少稀释次数,稀释工具用高准确度的。样品中的干扰组分会直接影响分析的准确度,而且有些组分会损坏柱子。纯化样品的过程尽量少用蒸发至干的步骤(在色谱分析中这一步又是不可少的),正确操作固相柱萃取、纯化小柱使用的步骤,注意提高每一步的回收率,使用内标法也是一个能准确定量的方法。 在手动进样中进样体积至少是样品定量环管体积的3倍,色谱分离程序要使色谱峰的分离度大于1.5,控制流动相、流量、温度等的平稳。流动相的污染都会抬高基线或减少信噪比,分辨率下降,试验条件的变化,如柱退化、不好的流动相等都能引起保留时间变化,引起一个峰或更多的峰不能被鉴别。正确设定仪器参数,选用合理的数据处理参数,用峰面积计算结果比峰高更精确。[B]三 结论 [/B]以上的分析的是我们能尽量控制的误差,还有一些不是操作者所能控制的误差,如被测定组分易分解、组分的含量高低、介质效应等。我们把能控制的误差减小到最低,那你的结果准确度将更高。
我在用液相色谱分析一样品时,各种条件都没改变,但白天(23度)与晚上(10度)出峰保留时间相差3分钟,是温度造成的吗?
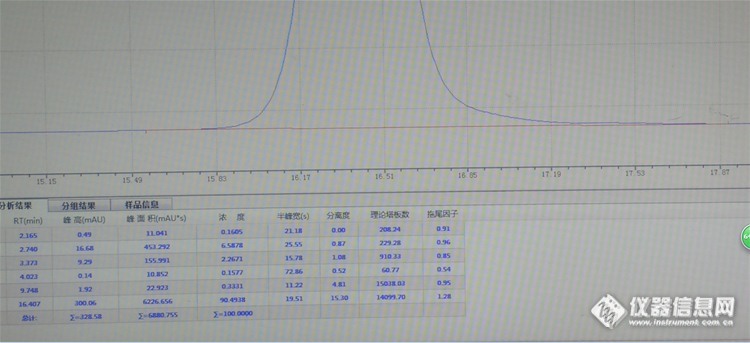
液相色谱峰形拖峰与预柱的判断及处理一、案例介绍:l 测定油悬浮剂中的有效成份:双草醚;l 采用国产仪器伍丰LC-100分别搭配250×4.6mmODS柱和250×4.6mm BRISA LC2 C18柱,对应流动相比例分别为甲:乙:水=20:35:45和甲:乙:水=20:40:40,检测波长为246nm;l 发生该异常(严重的峰形拖尾)状况时,仪器可见部分均正常运行,系统反馈压力较正常的上升2.0~3.2Mpa,其它操作均符合实验操作之要求;l 按标准操作所得液相图谱峰形异常,主要是拖尾因子1.00变化至1.77;二、案例图谱标准图谱:http://ng1.17img.cn/bbsfiles/images/2017/01/201701191700_668316_2239775_3.png双草醚-液相分析标准图谱 1拖尾因子1.00注:实验条件250×4.6mm BRISA LC2 C18柱,流动相甲:乙:水=20:40:40,检测波长为246nm,目标峰保留时间为16.232min异常图谱:(不可接受)http://ng1.17img.cn/bbsfiles/images/2017/10/2016071409341955_01_2239775_3.png双草醚-液相异常分析图谱1 拖尾因子1.77 注:实验条件250×4.6mm BRISA LC2 C18柱,流动相甲:乙:水=20:40:40,检测波长为246nm,目标峰保留时间为16.232minhttp://ng1.17img.cn/bbsfiles/images/2017/10/2016071409345934_01_2239775_3.png双草醚-液相异常分析图谱2 拖尾因子1.79 注:实验条件250×4.6mm BRISA LC2 C18柱,流动相甲:乙:水=20:35:45,检测波长为246nm,目标峰保留时间为19.240minhttp://ng1.17img.cn/bbsfiles/images/2017/10/2016071409353819_01_2239775_3.png双草醚-液相异常分析图谱3-1 拖尾因子1.28注:实验条件250×4.6mm ODS柱,流动相甲:乙:水=20:35:45,检测波长为246nm,目标峰保留时间为16.407minhttp://ng1.17img.cn/bbsfiles/images/2017/10/2016071409361418_01_2239775_3.png双草醚-液相异常分析图谱3-2 拖尾因子1.28(上图目标峰起始部分和结束部分放大图)三、异常问题与分析1. 异常问题简述: 在进行正确的操作后,通过观察双草醚液相分析的图谱发现在同条件下所得目标峰的保留时间无明显变化,但出现明显或不可接受的峰形拖尾现象。按经验调整流动相中有机相(降低5%)与水相(增加5%)的比例再次进样分析,所得图谱发现目标峰的保留时间有明显变化但峰形的拖尾因子仍未得到改善。即正常情况下和微调后无法对分析条件进行优化。2. 原因分析:http://ng1.17img.cn/bbsfiles/images/2017/10/2016071409371743_01_2239775_3.png 鉴于液相分析条件的确定性(科学合理)、人为操作的正确性(准确无误)、色谱柱的使用寿命(才启用8个月)以系统运行压力的异常结果(正常压力为16.3~16.6Mpa上升到18.3Mpa及以上),故判断为流动相传输系统异常故障。四、异常状况处理http://ng1.17img.cn/bbsfiles/images/2016/07/201607140938_600425_2984502_3.pnghttp://ng1.17img.cn/bbsfiles/images/2016/07/201607140938_600426_2984502_3.png更换新的预柱1注:更换预柱柱芯后之所以更换整个预柱主要是为止先前的柱套内仍有异物,如此可避免产生污染,从而达到更换预柱柱芯的目的;旧的预柱可超声清洗后留待备用……装上新预柱后,顺道把色谱柱反冲洗了一下……然后……然后就好……五、异常状况处理之结果 经处理后液相分析所得图谱恢复正常(0.95≤拖尾因子≤1.05),确定是预柱内有异物造成流动相传输系统故障导致系统压力升高和目标峰峰形严重拖尾。不可以打脸……
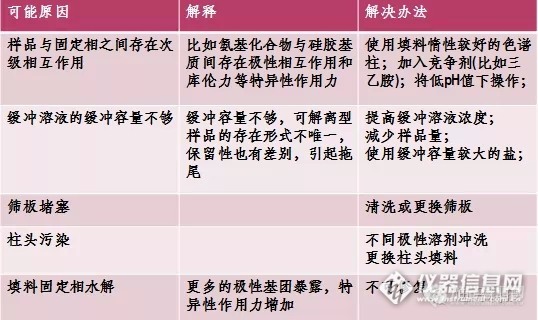
w 液相色谱峰拖尾分析从色谱柱分离机理角度 造成拖尾的原因多数是因为要分离的化合物是碱性的。 硅胶表面的硅羟基 pKa 值是2-3, 也就是当流动相的 pH 值大于这个值,硅羟基就会解离,这时这个氧带的外层电子对碱的吸 附是特别强的,很多人知道硅羟基对碱性物质吸附,解决办法:应选择封尾的柱子,但是即 使封尾,不管工艺怎么好,都不会是100%能封住。那么就争取从 pH 值角度考虑,减小流 动相 pH,或者说加三乙胺,三乙胺容易被这个解离的硅羟基吸附,其实作用相当于对色谱 柱封尾。 从流动相的角度 用甲醇做碱性物质要相对比乙腈好,因为甲醇含有-OH,多少能抑制硅羟基解离,加缓冲盐 的目的也是抑制硅羟基解离。 所以说种种方法都是抑制硅羟基解离或竞争吸附, 尽量减少解 离的硅羟基对碱性物质的吸附。 前沿峰图 非常有可能是色谱柱的硅胶溶解造成的。 前沿峰还有可能是由溶解性效应引起, 就是溶解样 品的溶液对样品的溶解性远大于流动相。 现在市场上有种色谱柱经过表面处理之后残留的硅 羟基 pKa 值能达到5.5-6我不说哪家生产的,用这种柱子做你的流动相 pH 控制在5.5以下拖 尾的效果非常好, 另外建议做碱性化合物时选择色谱柱尽量选择比表面积小, 含碳量低些的 色谱柱,效果会好。 A、 峰拖尾 、 1、筛板阻塞(a、反冲色谱柱 b、更换进口筛板 c、更换色谱柱) 2、色谱柱塌陷(填充色谱柱) 3、干扰峰(a、使用更长的色谱柱 b、改变流动相或更换色谱柱) 4、流动相 PH 选择错误 (调整 PH 值。对于碱性化合物,低 PH 值更有利于得到对称峰) 5、样品与填料表面的溶化点发生反应(a、加入离子对试剂或碱性挥发性修饰剂 b、换柱子) B、 峰前延 、 1、柱温低(升高柱温) 2、样品溶剂选择不恰当 (使用流动相作为样品溶剂) 3、样品过载 (降低样品含量) 4、色谱柱损坏 (见 A1、A2) C、 峰分叉 、 1、保护柱或分析柱污染图 (取下保护柱再进行分析。如果必要更换保护柱。如果分析柱阻 塞, 拆下来清洗。 如果问题仍然存在, 可能是柱子被强保留物质污染, 运用适当的再生措施。 如果问题仍然存在,入口可能被阻塞,更换筛板或更换色谱柱。) 2、样品溶剂不溶于流动相 (改变样品溶剂。如果可能采取流动相作为样品溶剂。) D、 峰变形 、 1、样品过载 (减少样品载量) E、 早出的峰变形 、 1、样品溶剂选择不恰当 (a、减少进样体积 b、运用低极性样品溶剂) F、 早出的峰拖尾程度大于晚出的峰 、 1、柱外效应(a、调整系统连接(使用更短、内径更小的管路) b、使用小体积的流通池) G、 K’增加时,脱尾更严重 增加时, 、 增加时 1、二级保留效应,反相模式(a、加入三乙胺(或碱性样品)b、加入乙酸(或酸性样品)c、加入 盐或缓冲剂(或离子化样品)d、更换一支柱子) 2、二级保留效应,正相模式(a、加入三乙胺(或碱性样品)b、加入乙酸(或酸性样品)c、加入 水(或多官能团化合物)d、试用另一种方法) 3、二级保留效应,离子对 (加入三乙胺(或碱性样品)) H、 酸性或碱性化合物的峰拖尾 、 1、缓冲不合适 (a、使用浓度50-100mM 的缓冲液 b、使用 Pka 等于流动相 PH 值的缓冲液) I、 额外的峰 、 1、样品中有其他组份 (正常) 2、前一次进样的洗脱峰 (a、增加运行时间或梯度斜率 b、提高流速) 3、空位或鬼峰 (a、检查流动相是否纯净 b、使用流动相作为样品溶剂 c、减少进样体积) J、 保留时间波动 、 1、温控不当 (调好柱温) 2、流动相组分变化 (防止变化(蒸发、反应等)) 3、色谱柱没有平衡 (在每一次运行之前给予足够的时间平衡色谱柱) K、 保留时间不断变化 、 1、流速变化 (重新设定流速) 2、泵中有气泡 (从泵中除去气泡) 3、流动相选择不恰当 (a、更换合适的流动相 b、选择合适的混合流动相) L、 基线漂移 、 1、柱温波动,即使是很小的温度变化都会引起基线的波动。通常影响示差检测器、电导检测 器、较低灵敏度的紫外检测器或其它光电类检测器。 (控制好柱子和流动相的温度,在检测 器之前使用热交换器图) 2、 流动相不均匀,流动相条件变化引起的基线漂移大于温度导致的漂移。 (使用 HPLC 级的溶 剂,高纯度的盐和添加剂。流动相在使用前进行脱气,使用中使用氦气。) 3、流通池被污染或有气体 (用甲醇或其他强极性溶剂冲洗流通池。如有需要,可以用1M 的 硝酸。(不要用盐酸)) 4、检测器出口阻塞,高压造成流通池窗口破裂,产生噪音基线 (取出阻塞物或更换管子。参 考检测器手册更换流通池窗) 5、流动相配比不当或流速变化 (更改配比或流速,定期检查流动相组成及流速) 6、柱平衡慢,特别是流动相发生变化时 (用中等强度的溶剂进行冲洗,更改流动相时,在 分析前用10-20倍体积的新流动相对柱子进行冲洗) 7、流动相污染、变质或由低品质溶剂配成 (检查流动相的组成。使用高品质的化学试剂及 HPLC 级的溶剂) 8、 样品中有强保留的物质(高 K’值)以馒头峰样被洗脱出, 从而表现出一个逐步升高的基线。 (使用保护柱,如有必要,在进样之间或在分析过程中,定期用强溶剂冲洗柱子) 9、使用循环溶剂,但检测器未调整(重新设定基线。当检测器动力学范围发生变化时,使用 新的流动相) 10、检测器没有设定在最大吸收波长处。(将波长调整至最大吸收波长处)柱头有空隙。解决 办法:使用填料或玻璃珠填充柱顶部 柱上样品超载。解决办法:使用更高负载量的固定相。增加色谱柱内径、减少样品量、 单峰- 存在干扰性组分。解决办法:净化样品;预分离 存在未扫的死体积。解决办法:减少接头的数量、确保进样器密封垫紧密、确保接头正 确固定 碱性化合物- 硅醇相互作用。解决办法:换成聚合物固定相 碱性基质- 硅醇相互作用。 解决办法: 使用更强的流动相或添加竞争碱 (例如, 三甲胺) 硅胶基- 柱降解。解决办法:使用特种色谱柱;聚合物柱或空间位阻 硅胶基- 柱降解。解决办法:使用特种色谱柱;聚合物柱或空间位阻+
[color=#444444]在做环己烷空气氧化制己二酸的实验[/color][color=#444444]产物的分析,丁二酸、戊二酸、己二酸 须由液相色谱检测[/color][color=#444444]由于杂峰太多,所以要求峰型好,易分离。[/color][color=#444444]可现在峰型不好,我怀疑是流动相的问题[/color][color=#444444]现在的流动相:[/color][color=#444444]甲醇-水溶液,千分之一甲酸。[/color][color=#444444]请问各位高人,如何改善峰型?[/color][color=#444444]流动相是否需要缓冲溶液,如果需要,该如何调配?[/color]

一、仪器:Varian HPLC 230泵/325紫外检测器(单波长)、配国产柱温箱、手动进样、Varian C18(5μm,4.6mm×150mm).二、实验过程:测丹参片中丹参酮IIA溶出度 1、配系列丹参酮IIA标准溶液(溶剂用85%甲醇),共5个标样,先在紫外分光光度计上进行光谱扫描,峰值检出,在269.3nm有最大吸收峰,再做定量测定,标准曲线相关系数为0.998,溶出介质为稀盐酸,溶出样品按时间点分别取样7个,针筒过滤器过滤,不稀释上紫外测试,30分钟前溶出不明显,测出吸光度值低,30分钟后有明显溶出,吸光度值高,位于标3与标4之间。 下面是标样的及溶出样品的紫外定量测定图:(见17楼的补充贴) 2、溶出条件不变,溶出样品采用液相进行测试,液相条件:检测波长270nm;流动相:85%甲醇:15%水;等度洗脱,分析时间10分钟;柱温:30度;流速:1ml/min。 3、取丹参酮IIA标准溶液(溶剂用85%甲醇),共5个标样,分别依次手动进样,进样量100uL(定量环20uL),标样均在5.4min左右出峰,各标样保留时间非常重合,对照品标准曲线相关系数:0.996。 下面是5个标样的色谱图,色谱图进行了偏置2%,为了利于版友观察,从前往后分别是标1-5:http://ng1.17img.cn/bbsfiles/images/2010/11/201011012003_256541_1630080_3.jpg 下面的图是标准曲线图,标1的峰面积有的偏小,但还是基本成线性:http://ng1.17img.cn/bbsfiles/images/2010/11/201011011954_256536_1630080_3.jpg 4、前面实验过程都比较顺利,在预想在范围内,问题出现在最后时刻,开始对溶出的7个时间点样品(直接从溶出杯中取样,溶剂为稀盐酸,针筒过滤器过滤)上HPLC进行测定,怪事发生了,竟然没出有一个出峰的,连一个其它的杂峰都没有,只有开始时的一个溶剂峰。 下面是7个溶出样品的色谱图,色谱图进行了偏置2%,为了利于版友观察:http://ng1.17img.cn/bbsfiles/images/2010/11/201011012030_256550_1630080_3.jpg 5、原来我们做过丹参片中丹参酮IIA含量的液相测定,方法基本一致,标准曲线比较容易做,样品用85%甲醇超声定容,除了和标样在同样位置出峰外,在这峰之前还有其它成分的峰。 下面是以前做的丹参片样品及丹参酮IIA标样的色谱图,色谱图进行了偏置2%,为了利于版友观察,前面的丹参片,后面的丹参酮IIA:http://ng1.17img.cn/bbsfiles/images/2010/11/201011012020_256546_1630080_3.jpg 6、我怀疑稀盐酸在其中做怪,于是调整样品配置方法,将第6、7时间点采集的溶出样品各取1mL,用85%甲醇定量到10mL,以图消除稀盐酸的影响,重新配制的第6、7的溶出样品分别进样,结果还是让人晕倒,竟然还是一条直线,除了溶剂峰外,一个峰都没有,跟进一针试剂空白一样,由于今天太晚了,没有再做其它方案调整,于是冲柱2h后走人了,谱图也忘记拷贝了。 下面是用甲醇稀释过的溶出样品6、7的色谱图,色谱图进行了偏置2%,为了利于版友观察:http://ng1.17img.cn/bbsfiles/images/2010/11/201011012026_256548_1630080_3.jpg三、回家后,想想今天真是郁闷啊!本想今天实验十拿九稳,大不了线性不好,但竟然不出峰,让我摸不着头脑,做液相以来,这次让我最纠结,急盼高手指点迷津,万分感谢!四、第二天调整了色谱条件,同等度洗脱改为梯度洗脱,甲醇由60%梯度到90%,先进了一针标样,看出峰靠后,于是增加了分析时间,又进了一针同样的标样,但结果都让人不满意,标样出峰很怪,标样峰前面的驼峰正常吗? 下面是梯度洗脱方法做的两次标样,两次的分析时间不同,第一针是15分钟,第二针改为了20分钟:http://ng1.17img.cn/bbsfiles/images/2010/11/201011012040_256557_1630080_3.jpghttp://ng1.17img.cn/bbsfiles/images/2010/11/201011012044_256561_1630080_3.jpg五、再次调整了色谱条件,改变梯度洗脱方式,先前甲醇由60%梯度到90%,改为甲醇由70%梯度到95%,进了一针溶出样品,看是否有出峰? 下面是改变梯度洗脱方法进的一针溶出样品,分析时间是20分钟:http://ng1.17img.cn/bbsfiles/images/2010/11/201011012049_256563_1630080_3.jpg六、问题不但没有解决,反而梯度洗脱又出了让人看不懂的色谱图,第一次梯度的色谱图中的驼峰还可以理解成梯度洗脱使得基线上漂,而第二次梯度的色谱图中驼峰与目标峰中间竟然又多出了一个峰,无法理解,再次陷入了困局,望高手再度出山,来拨云见日,多谢了! 主贴内容在不断更新,望各位版友能持续观注!!!
[color=#444444]对一种植物里面的黄酮成分进行液相分析,有几个大峰不知道是什么,可以通过[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]进行打质谱然后解谱分析确定那几个大峰吧?[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]的出峰顺序和我当时液相色谱分析时的出峰顺序会有变化吗?而且我做[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]时的条件直接用液相色谱条件就可以吗?[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]的流动相和液相色谱的流动相一样吗?[/color]
这段时间,在做液相色谱分析时,峰面积重现性不好,是什么原因导致的,我用的是外标法。
[color=#444444]我目前在对一种植物里面的黄酮成分进行液相分析,有几个大峰不知道是什么,可以通过[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]进行打质谱然后解谱分析确定那几个大峰吧?[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]的出峰顺序和我当时液相色谱分析时的出峰顺序会有变化吗?而且我做[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]时的条件直接用液相色谱条件就可以吗?[/color]
峰型异常问题 峰型问题是液相的主要问题,在做液相过程中,我们就是要变换不同的条件来改善不好的峰型,对于各种各样的异常峰,要区别对待,从主要问题出发,一个一个加以解决。 1、色谱图中未出峰。解决方法:系统未进样或样品分解;泵未输液或流动相使用不正确;检测器设置不正确;针对以上情况成因作相应调整即可。 2、一个峰或几个峰是负峰。解决方法:流动相吸收本底高;进样过程中进入空气;样品组分的吸收低于流动相。 3、所有峰均为负峰。解决方法:信号电缆接反或检测器输出极性设置颠倒;光学装置尚未达到平衡。 4、所有峰均为宽峰。解决方法:系统未达到平衡;溶解样品的溶剂极性比流动相差很多;色谱柱尺寸及类型选择不正确;色谱柱或保护柱被污染或柱效降低;温度变化造成的影响。 、 5、所出峰比预想的小。解决方法:样品黏度过大;进样品故障或进样体积误差;检测器设置不正确.定量环体积不正确;检测池污染;检测器灯出现问题。 6、出现双峰或肩峰。解决方法:进样量过大;样品浓度过高;保护柱或色谱柱柱头堵塞;保护拄或色谱柱污染或失效;柱塌陷或形成短通道。 7、前伸峰。解决方法:进样量或样品浓度高;溶解样品的溶剂较流动相极性强;保护柱或色谱柱污染或失效。 8、拖尾峰。解决方法:柱超载,降低样品量;增加柱直径采用较高容量的固定相;峰干扰,对样品进行清洁过滤;调整流动相;硅羟基作用,加入三乙胺,用碱致钝化柱增加缓冲液或盐的浓度降低流动相pH值;柱内烧结不锈钢失效,更换烧结不锈钢;加在线过滤器,对样品进行过滤;死体积或柱外体积过大,将连接点降至最低;尽可能使用内径较细的连接管;柱效下降,更换柱子;采用保护柱,对柱子进行再生。 9、出现平头峰。解决方法:检测器设置不正确;进样体积太大或样品浓度太高。 10、出现鬼峰。解决方法:进样阀残余峰,在每次进完样后用充足的时间来平衡和清洗系统;样品中存在未知物,改进样品的预处理;流动相污染,更换新流动相,尽可能现配现用,隔夜的流动相再次使用时要过滤;尽可能使用HPLC级试剂;流路中有小的气泡,打开Purge阀,加大流速排除。
请问有没有在分析型的高效液相色谱上配的自动馏分收集器,Waters的液相色谱。
液相色谱分析条件的选择字体: 小 中 大 | 打印 发布: 2010-09-14 14:46:32 来源: 上海禾工科学仪器有限公司 在液相色谱分析过程中,我们经常遇到的问题主要有二种,一种与液相色谱仪器本身因素有关,如液相色谱的阀门、混合器、检测器的光源以及其它的一些硬件设备。出现这类问题后,如果能找出问题根源,解决起来一般很简单,而且这类问题可以通过对仪器的精心维护来避免;而另一类问题则是分析方法本身造成的问题,如出现色谱峰形状不好、峰与峰之间不能分开、基线飘移等等。不幸的是,如果出现这类问题,看起来似乎很明显,但是要找出原因并解决这类问题却非常困难。为了减少出现这一类型的问题,就必须在分析之前,仔细研究并选择一个好的分析方法,有了一个好的分析方法,就很容易获得理想的分离效果,而且在出现问题是也很便于找出原因。要选择一个好的分析方法,就必须对液相色谱分析的一些基本原则要有一个很深的了解。下面是我们实验室对色谱分析人员进行技能培训的一些基本知识。 一:分析方法选择的基本原则 假如你想做一顿丰盛的晚餐,首先必须看一下食谱,然后检查一下你所需的东西是否齐全,如果少了配料还必须去商店购买,这样你才可能做出一顿可口的晚餐。同样进行液相色谱分析时,也必须按照一定的程序进行,首先你必须要有专门的仪器和试剂,然后有目的地选择分析方法,这样你才可能得到好的分析结果,避免走一些弯路。 二:柱子的选择 在液相色谱分析方法中最重要的就是色谱柱的选择,色谱分析人员面对几百种色谱柱,你从何入手呢?我采取的方法就是订阅 LCGC亚太版中RonMajors 的“色谱柱观察”这一专栏,自1984(1)年以来,RonMajors在这一专栏中介绍许多新柱子、色谱柱新技术、色谱柱使用方法等方面的信息。 现在大部分液相色谱分析都是使用反相液相色谱柱,其中以C18 和C8柱最为流行。然而色谱分析并不是流行歌曲,这两种色谱柱之所以运用广泛是因为在大多数情况下,使用这两种柱子都能获得理想的分离效果。尽管一些样品的分离并不是这两种柱子(如表一所示),但[font=
TNT经Fenton氧化后为什么用液相色谱分析时峰是乱的
在液相色谱分析过程中,我们经常遇到的问题主要有二种,一种与液相色谱仪器本身因素有关,如液相色谱的阀门、混合器、检测器的光源以及其它的一些硬件设备。出现这类问题后,如果能找出问题根源,解决起来一般很简单,而且这类问题可以通过对仪器的精心维护来避免;而另一类问题则是分析方法本身造成的问题,如出现色谱峰形状不好、峰与峰之间不能分开、基线飘移等等。不幸的是,如果出现这类问题,看起来似乎很明显,但是要找出原因并解决这类问题却非常困难。为了减少出现这一类型的问题,就必须在分析之前,仔细研究并选择一个好的分析方法,有了一个好的分析方法,就很容易获得理想的分离效果,而且在出现问题是也很便于找出原因。要选择一个好的分析方法,就必须对液相色谱分析的一些基本原则要有一个很深的了解。下面是我们实验室对色谱分析人员进行技能培训的一些基本知识。 一:分析方法选择的基本原则 假如你想做一顿丰盛的晚餐,首先必须看一下食谱,然后检查一下你所需的东西是否齐全,如果少了配料还必须去商店购买,这样你才可能做出一顿可口的晚餐。同样进行液相色谱分析时,也必须按照一定的程序进行,首先你必须要有专门的仪器和试剂,然后有目的地选择分析方法,这样你才可能得到好的分析结果,避免走一些弯路。 二:柱子的选择 在液相色谱分析方法中最重要的就是色谱柱的选择,色谱分析人员面对几百种色谱柱,你从何入手呢?我采取的方法就是订阅 LCGC亚太版中RonMajors 的“色谱柱观察”这一专栏,自1984(1)年以来,RonMajors在这一专栏中介绍许多新柱子、色谱柱新技术、色谱柱使用方法等方面的信息。 现在大部分液相色谱分析都是使用反相液相色谱柱,其中以C18 和C8柱最为流行。然而色谱分析并不是流行歌曲,这两种色谱柱之所以运用广泛是因为在大多数情况下,使用这两种柱子都能获得理想的分离效果。尽管一些样品的分离并不是这两种柱子(如表一所示),但 C18和C8经常是最好的固定相,C18和C8柱两者之间并无明显的差别,但在我们实验室中以常使用的是C8柱。 色谱分析人员遇到的多数样品需要利用反相色谱柱进行分析,但一些样品可能需要其它的分析技术才能成功地分离,这些样品及分离方法在表一中作了简要的叙述,在以后的章节中将进一步阐述。 表一:样品及分析方法[color=bla
[align=center]高效液相色谱组分定性分析方法简述[/align]1、保留时间对照法(1)外标对照法 即在相同的色谱条件下,分别进样品溶液与高纯度的单一组分对照品溶液,这里推荐先进样品溶液,确定系统适应性没有问题了再进对照品溶液,对比两组分的保留时间,一般保留时间相对差异在5%以内,同时绝对误差在0.1min以内的认定为同一个物质,但仍遵守“同一组分保留时间肯定一样,但保留时间一样不一定是同一组分,保留时间不一样的肯定不是同一组分”的原则。(2)标准加入法 即在相同的色谱条件下,将高纯度的对照品加入样品溶液中再上机检测,与相同浓度未加对照品的样品溶液比较,峰高或峰面积应呈等比例增加的,可认定为是同一物质。此法比较适用于组分比较复杂,邻近有干扰组分峰时。上述方法尽量使用柱效高或长柱,峰高尽量小一些,甚至可以小到定量限浓度,一些在高响应下是单个峰的,在低响应时可能是两个峰,所以一定要注意峰形,只要峰形与对照品不一致,就要怀疑不是同一个物质。再严谨一点,还可以改变流动相组成、色谱柱、柱温等,样品中的组分峰应与对照品的组分峰有相同的变化。2、利用检测器选择性进行鉴别(1)DAD检测器波长扫描法 对于配有DAD检测器的还可以对比三维扫描图谱和峰纯度计算进行辅助定性。如果没有配DAD检测器,但有具波长扫描功能的可变波长检测器的,可以使用停泵扫描功能,查看扫描图谱进行鉴别。(2)质谱检测器鉴别法 该方法适用于联用有质谱分析仪的高效液相色谱仪,通过比较碎片峰进行比较鉴别。3、破坏法 将物质进行化学破坏,可以是酸、碱降解,也可以是衍生后再进行检测,看组分峰的变化。当然,此方法不适用于组分复杂的样品。
理想的色谱峰遵循正态分布,应该符合高斯曲线,是完美而对称的峰形(如图A);然而由于化合物性质的特殊性、色谱柱故障、操作条件等问题存在,峰形可能会不对称,前延(B)或拖尾(C),在此将引起峰形不理想的原因陈述一下。http://ng1.17img.cn/bbsfiles/images/2015/04/201504221556_543052_2452211_3.jpg(1)峰形前延(B):http://ng1.17img.cn/bbsfiles/images/2015/04/201504221557_543053_2452211_3.jpg(2)峰形拖尾(C):http://ng1.17img.cn/bbsfiles/images/2015/04/201504221558_543054_2452211_3.jpg总结:图谱前沿和拖尾的原因主要是流动相选择不合适,可以相应调整流动相的极性,或者适当加入酸来调整,可以得到较好的改善。一般来讲,酸碱在流动相中对于前沿和拖尾影响较大。柱前沿是可能因为柱超载,拖尾是可能因为样品被污染,选择合适的流动相,调节好PH能够改善这以情况。而产生托尾峰往往是有机性相近杂质没有分开,可以优化分析方法,或更换柱子试一试;也可能由于柱子使用时间太久柱效下降出现塌陷等原因;再有也会根样品本身性质有关,基团需要流动相中添加能与之结合优化峰形的化学物质,要根据具体情况而定。柱子可能污染了吧,溶剂也可能有,或柱效下降等等
现我有一样品!用高效液相色谱对其进行分析!但出峰较晚!流动相用95%甲醇5%(0.02M磷酸盐缓冲液),出峰时间在8分钟,但峰型很差!请求大家帮帮忙好不好?帮我想想有没有其它的办法呢?!先谢了哦!
高效液相色谱法分析中药及植物药的进展植物药越来越受到人们的重视。据报道,全世界大约有70%的人口医疗依靠各种类型的植物药〔1,2〕。对植物药的兴趣主要基于以下两个原因,一是人们普遍认为植物药具有较小的毒性,二是用合成方法寻求新药物的可能性变得越来越小,同时已有的西药对一些疑难病症无能为力。随着对植物药需求的不断增长,开展植物药的药代动力学、毒理学研究和质量控制,开发快速、灵敏、具有选择性的分析方法也越来越迫切。过去20年的实践经验表明,高效液相色谱(HPLC)是一种非常有效和普遍适用的植物药分析方法。近来,由于各种分析柱、高选择性和高灵敏度的检测器和复杂的商品化仪器联用系统的出现,植物药分析领域已被大大地推进。本文就HPLC在中药及植物药研究中应用的最新进展做简要评述。
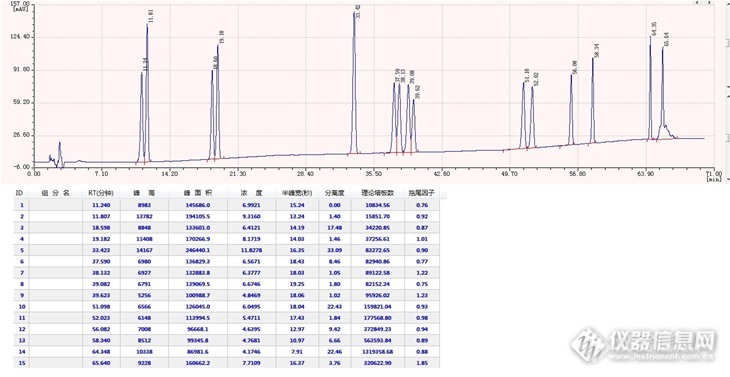
16种塑化剂的液相色谱方法开发终于算是完成了,整整一个月的时间,换过不同的柱子,尝试过各种不同的流动相种类和配比,250多次方法摸索和进样,一针一个多小时啊,项目逼得紧,周末无休,简直都快疯掉了。这16种塑化剂同时分离太难了,好不容易把这两个挨得很近的化合物分开,那两个又并一块儿去了,特别是第三组的四个峰DIBP、BBP、DBP和DBEP,真的是按下葫芦浮起瓢,如果流动相中乙腈多一点前两个峰分得开,可后两个峰却粘得更紧了,而甲醇多一点则前两个峰又粘一块儿去了,而且水的多少也是一个不可忽视的变量。由于是同时分析,所以每个峰必须都要能看得到,头大啊,一个月中大概有3/4的时间都是在解决这四个峰的分离度问题,最后把流动相调成A相是水:乙腈=60:40、B相是甲醇:乙腈=60:40的情况下才实现了这四个峰各自1.0以上的分离度。邻苯二甲酸二辛基酯和二壬基酯在C18上根本分不开,选择性不行,在C8上却很好的实现了基线分离,看来C8和辛基(也是8个碳原子)确实体现了比较好的选择性的一面。以下是谱图和数据,与大家一起分享。液相色谱仪:WUFENG LC100 二元高压梯度系统色谱柱:PntulipsTM BP-C18, 5um, 4.6×250mm流动相:梯度时间(min)A相:水/乙腈=60/40B相:甲醇/乙腈=60/4001000310002150[align=cent

液相色谱分析出现以下图,请各位高手帮忙分析下原因,该如何解决?谢谢了http://ng1.17img.cn/bbsfiles/images/2011/09/201109211115_318298_1608710_3.jpg
如图,[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]峰形异常,且出峰太快什么原因?[img]https://ng1.17img.cn/bbsfiles/images/2023/08/202308141505027343_8952_5998080_3.png[/img]
中药是一个典型的复杂未知样品,其化学物质基础的阐明是中药现代化的关键科学问题之一。液相色谱是中药分析中应用最普遍的技术,也是进一步与质谱、核磁共振等联用的基本分离手段。本论文在总结了中药复杂体系的特点和分析中需要解决的问题后,提出了中药分析的思路,开展了线性梯度下的液相色谱保留值规律、峰形规律的研究,发展了快速获取液相色谱保留参数、峰形参数的方法,从而将未知样品快速转化为色谱已知样品。并以实际样品藏茵陈和黄芪为例,应用发展的方法建立了相应的液相色谱参数数据库,提供中药活指纹图谱的信息基础。同时,面向实际应用,发展了中药组分的目标优化方法。建立了液-质联用表征黄芪皂甙的方法,建立了高效液相制备色谱快速制备黄芪组分的方法并初步发现了具有诱导分化白血病细胞的组分。发展了用五次线性梯度快速、准确地获取液相色谱保留值方程的方法。以线性梯度a、c 值预测任意梯度下的溶质的保留时间,并发展了基于内标峰的校正方法。应用于藏茵陈和黄芪样品的色谱保留参数获取,对c-a 关系进行了考察。基于EMG模型和自动曲线拟合技术,首次建立了以线性梯度快速获取液相色谱液相色谱峰形参数和峰形规律的方法。以线性梯度峰形规律预测了任意梯度条...[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=31320]中药高效液相色谱分析方法发展的理论基础研究[/url]
在测试中心液相色谱组呆了20多年,见过无数的客户,不同的客户对色谱的理解不一。很多人认为色谱就是打一针,出个谱图而已,容易的很,跟他们的科研档次无法比。觉得样品给你了,你必须做出来,而且很快得到其所需要的结果,全然不管你的仪器能否满足要求。做不好或者不想做,就会去告状,服务态度不好之类的。所以一旦征求意见,必然出现各种各样的服务问题。测试人员的地位在学校可见一斑。也有少数本身做液相色谱的,这些人沟通起来非常融洽,因为知道其实际做起来不容易,可惜这类的客户仅有百分之几。在色谱分析的三大分支中,我对液相、离子熟悉,对气相只是很了解,没动手做过。对于这三大类型,其实在实际中做的差别是很大的。先以我精通的离子色谱而言,我几乎涉及了所有的类型,离子色谱能否做关键在于设备,常规的很简单,特殊的全靠设备支撑,因为大部分离子色谱的分析都是优化的方法,固定的模式做起来并不难。但非常规的样品,则难度大大增加,即使同一个组分,由于基体差别,分析方案也是千差万别。也就是常规的很简单,特殊的则很难。现在厂家离子色谱方法开发就是一种特化的过程。离子色谱主要分析离子以及一些极性的化合物,表面上看应用范围比较窄,其实在很多领域有很好的应用,可以解决液相色谱无法解决的一些问题。对于气相色谱,复杂性比离子色谱要高,因为被测的有机化合物种类大大增加,但从气相的结构看,其载气的选择是非常有限的,主要靠色谱柱(极性,非极性,弱极性等),分离则依赖温度的程序升温,它真正的变化在色谱柱,在一般的分析中,大多变化在温度,柱子的变化并不多。因此对于气相色谱,基本就几根柱子。当然一些特别的检测则需要更高级特殊的装置,这跟离子色谱一样。由于受沸点的制约,气相色谱的应用受到很大的限制。而对于液相色谱,就我20年的经历,我认为其复杂性远远高于离子色谱和气相色谱。因为其变化比前二者更多,一是液相色谱分离有很多机理,每种机理都有对应的色谱柱类型,液相色谱的分离机理大约有十来个,很少有人会用过全部机理类型的色谱柱。虽然反相是最常见的分离手段,但由于反相的广泛使用,C18柱的变化类型极多差异很大,这不同C18柱之间的差异有时不亚于不同机理之间的差异。二是,液相色谱最大变化是流动相,不仅有机相类型有变,添加剂类型和浓度有变,不同pH差别很大,面对变化无穷的样品,这个流动相选择变化规律全靠长期的经验积累,很难用文字一言以蔽之。三是,液相色谱的检测器类型最多,离子色谱就三种,气相四五种,而液相色谱的检测器有十来种,相互之间差别极大,不同的检测器对色谱分离机理也有很大的选择性。因此要做好一张液相色谱图,很多情况下只能是你现有条件下的最佳分离,并不是这个化合物的最佳分析条件。对于特殊样品的分析,液相色谱更多的依赖于检测器和柱子的变化,同离子色谱不同。给你一个样品,用那类色谱(液相、气相还是离子),什么柱和条件,则完全依赖你的功底和阅历,当你拥有尽可能多的仪器装备,你才能充分发挥你的能力,依据化合物的特点,样品的特性,选择合适的仪器和配置,做出最佳的色谱图。
我在液相方法检测抗氧化剂产品的有效成分时,色谱图的中色谱峰出现因基线抬高而出现的包状峰,请问这是由那些原因引起的????图谱见附件,色普条件是:C18柱(250mm,4.6mm,5um)流动相:A液为乙酸-甲醇-乙腈,B液为去离子水,梯度洗脱,进样20uL样品处理后分别用甲醇、甲醇-乙腈(1:1)、乙腈溶解,上机检测后的图谱与附件中的图谱依次对应。请高人分析下原因!
[color=#444444]乙酰丙酸用液相色谱进行分析时,如果用268nm检测只有一个峰,在215nm下检测会出现两个峰,且两个峰时间间隔有近2min,有哪位大神能帮解释一下这是为什么啊[/color]
老师打算让我将不健康粪样中的水溶物提取出来,直接上样跑;然后再和健康粪样跑的峰作比对,看看差异,然后再分析是什么差异。 这能行吗?液相色谱分析不是有针对性的吗?像这样笼统的跑可行吗?能分离出来吗?
[color=#444444]我最近再做5-羟甲基糠醛还原制备2,5-二(羟甲基)-呋喃,但是让人不解的事情是,在底物基本完全转化后,产物的产率居然超过100%,达到120%甚至150%(液相色谱分析,PDA检测器,基于产物的标准曲线,标准曲线我们也重复做过好几次,重现性还行,所以应该不是标准曲线的问题),这真是让人不解。在液相中产物的峰型非常完整,也没有出现肩峰之类的。我推迟可能是有其他物质参杂在产物色谱峰中,但是改变各种分析条件和色谱柱,都是没有发现该峰中出现肩峰之类的。[/color][color=#444444]请问各位有没有什么办法,能够确定该峰中是否含有其他与产物性质相似的物质??[/color]
在液相色谱分析过程中,我们经常遇到的问题主要有二种,一种与液相色谱仪器本身因素有关,如液相色谱的阀门、混合器、检测器的光源以及其它的一些硬件设备。出现这类问题后,如果能找出问题根源,解决起来一般很简单,而且这类问题可以通过对仪器的精心维护来避免;而另一类问题则是分析方法本身造成的问题,如出现色谱峰形状不好、峰与峰之间不能分开、基线飘移等等。不幸的是,如果出现这类问题,看起来似乎很明显,但是要找出原因并解决这类问题却非常困难。为了减少出现这一类型的问题,就必须在分析之前,仔细研究并选择一个好的分析方法,有了一个好的分析方法,就很容易获得理想的分离效果,而且在出现问题是也很便于找出原因。要选择一个好的分析方法,就必须对液相色谱分析的一些基本原则要有一个很深的了解。下面是我们实验室对色谱分析人员进行技能培训的一些基本知识。 一:分析方法选择的基本原则 假如你想做一顿丰盛的晚餐,首先必须看一下食谱,然后检查一下你所需的东西是否齐全,如果少了配料还必须去商店购买,这样你才可能做出一顿可口的晚餐。同样进行液相色谱分析时,也必须按照一定的程序进行,首先你必须要有专门的仪器和试剂,然后有目的地选择分析方法,这样你才可能得到好的分析结果,避免走一些弯路。http://simg.instrument.com.cn/bbs/images/brow/em09510.gif