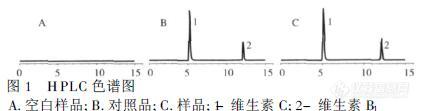
[color=#444444]近日,我使用日立液相色谱仪测定维生素A E D 含量,所用标准品为sigmar的,不知道为啥标准走出来的每一个单标峰旁边都会有一个与之相连很近的峰,难以分离,不好定量, 第一次做这个,不只是标准品的问题还是色谱仪的问题,希望有做过的朋友,能够给些建议或可能存在的问题,比较着急,不胜感激!!![/color]
液相色谱法测定水果中的维生素B2含量,样品前处理时加入0.1mol/L HCl的作用是什么,也有的人用磷酸。这两个有什么区别啊?配置标准品溶液时为什么加入1:1的盐酸超声溶解
作者:http://d.g.wanfangdata.com.cn/Images/head_pic.gif吴琳 作者单位:湖南省衡阳市药品检验所,421001 摘要: 目的:建立反相高效液相色谱法测定维生素B1片含量的方法.方法 :采用DLamonsLlTM(钻石)色谱柱C18(250×4.6mm,5um);流动相为0.05mol/L辛烷磺酸钠的1%冰醋酸溶液-甲醇-乙腈(50:30:20);流速:1.0ml·min-1;检测波长:254nm.结果 :维生素B1在50~350ug·ml-1范围内线性关系良好,平均回收率为99.6%,RSD=0.9%(n=7).结论 :该方法简便可行、结果准确可靠,可作为维生素B1片的质量控制.
请教:液相色谱如何分析维生素C的含量,是饲料中的维生素C,样品如何处理。操作步骤。谢谢各位老师指点迷津。
作者:胡少卿; (广东省人民医院药学部;)摘要:目的:建立高效液相色谱法测定复合鱼肝油制剂中维生素A含量的方法。方法:采用高效液相色谱法,选择迪马(Diamonsil)C18(4.6 mm×250 mm,5μm)色谱柱,流动相为:甲醇-水(95∶5),流速1.0 ml/min,检测波长为326 nm,柱温为35℃。结果:维生素A进样量在2.907 0~34.883 7 IU/ml范围内呈良好的线性关系(r=0.999 6),平均回收率为98.84%。三个批次的复方鱼肝油制剂的含量分别为62.082、62.163、62.558 mg/瓶。结论:以高效液相色谱法检测复合鱼肝油制剂中维生素A的含量,结果准确、重现性好,精密度高,可作为该制剂的质量控制方法。谱图:无
液相色谱-串联质谱法检测食品中维生素D含量 如何用液相色谱-串联质谱法(LC-MS/MS)检测食品中的维生素D含量。这项技术可是现代食品分析中的佼佼者,能够帮助我们精准地掌握食品中的营养信息。 样品前处理 提取:首先,我们需要从食品样品中提取维生素D。这一步很关键,因为提取效率直接影响最终的检测结果。通常,我们会使用有机溶剂,比如乙腈或甲醇,来提取维生素D。 净化:提取后的样品往往含有很多杂质,这些杂质会影响检测结果。因此,我们需要对提取液进行净化处理。常用的净化方法有固相萃取(SPE)和液液萃取(LLE)。 浓缩:净化后的样品溶液需要进行浓缩,以提高维生素D的浓度。常用的浓缩方法有氮气吹干和旋转蒸发。 仪器操作 流动相选择:选择合适的流动相对分离效果至关重要。通常,我们会使用水和有机溶剂(如甲醇或乙腈)的混合物作为流动相,并根据需要添加少量酸或缓冲液。 色谱柱选择:选择适合的色谱柱也很关键。C18反相色谱柱是常用的选择,因为它对维生素D有很好的保留效果。 质谱条件:设置合适的质谱条件,包括离子源温度、喷雾电压、碰撞能量等。这些参数的优化可以大大提高检测灵敏度和特异性。 故障排除 峰形不好:如果发现峰形不好,可能是由于流动相比例不合适或色谱柱污染。尝试调整流动相比例或清洗色谱柱。 灵敏度低:如果灵敏度不够,可能是由于样品提取效率低或仪器参数设置不当。检查提取方法并优化仪器参数。 杂峰干扰:如果出现杂峰干扰,可能是由于样品净化不彻底或流动相选择不当。尝试改进净化方法或更换流动相。 仪器故障:遇到仪器故障时,首先要保持冷静,然后根据仪器的报错信息查找原因。必要时,可以联系仪器厂家进行维修。 总之,液相色谱-串联质谱法检测食品中维生素D含量是一项复杂但非常重要的技术。通过掌握这些操作要点和故障排除方法,我们可以更加准确、高效地完成检测任务。

【作者中文名】 何梅凤; 吴伟; 唐细兰; 【作者单位】 中山大学中山眼科中心药剂科; 中山大学中山眼科中心药剂科 广东广州; 广东广州; 【摘要】 建立测定复方碘化钾滴眼液中维生素C含量的高效液相色谱法。采用Diamonsil C18柱(250 mm×4.6 mm,5μm),以0.05 mol·L-1磷酸二氢钾溶液为流动相,检测波长为266 nm,柱温为20℃,样品用0.01 mol·L-1盐酸溶液稀释25倍,进样40μL。结果表明,维生素C的线性范围为4.056~40.56μg·mL-1,平均回收率为99.58%,RSD=1.22%。可见本方法操作简便,快速,结果准确。http://ng1.17img.cn/bbsfiles/images/2012/08/201208011235_381010_1761902_3.jpg
【作者】 何梅凤; 吴伟; 唐细兰; 王延东;【机构】 中山大学中山眼科中心; 中山大学中山眼科中心 广东广州510060; 广东广州510060;【摘要】 目的:建立同时测定复方碘化钾滴眼液中维生素B1和维生素C含量的高效液相色谱法。方法:采用DiamonsilC18柱(250mm×4.6mm,5μm),以甲醇-0.05mol.L-1磷酸二氢钾溶液为流动相进行梯度洗脱,流速为0.7mL.min-1,检测波长维生素B1为246nm,维生素C为266nm,柱温为20℃。结果:维生素B1的线性范围为2.112~21.12mg.L-1,r=0.999 9(n=6),平均回收率为100.38%,RSD为0.82%(n=9);维生素C的线性范围为4.072~40.720mg.L-1,r=0.999 8(n=6),平均回收率为99.63%,RSD为1.16%(n=9)。结论:该方法操作简便,快速,结果准确,可以有效地控制产品的质量。 【谱图】http://ng1.17img.cn/bbsfiles/images/2012/08/201208142226_383909_1609970_3.jpg
正反相液相色谱检测维生素的区别 咱们来聊聊正反相液相色谱检测维生素的那些事儿。别看这题目挺专业,其实讲的都是咱们平时吃的水果蔬菜里的维生素咋测出来的事儿。 先说说正相液相色谱。这种方法呢,就像是个喜欢“抓”极性分子的“小能手”。啥是极性分子?简单来说,就是那些爱跟水玩在一起的小分子,比如维生素C这种水溶性的维生素。正相液相色谱用的固定相就像是个“磁铁”,专门吸引这些极性分子,把它们牢牢留在柱子里。这样一来,咱们就能慢慢分析出样品里有多少维生素了。 再来看看反相液相色谱。这家伙正好跟正相相反,它更喜欢非极性分子。比如说维生素E这种油溶性的维生素,就容易被反相液相色谱给“抓住”。反相液相色谱用的流动相通常是一些有机溶剂,就像是个“护送队”,把非极性分子一路护送到检测器,让咱们能精确地知道样品里有多少维生素E。 简单总结一下,正相液相色谱和反相液相色谱的区别,就像是“磁铁”和“护送队”的区别。一个喜欢“抓”水溶性的维生素,一个喜欢“护送”油溶性的维生素。 那么问题来了,为啥要用这两种不同的方法呢?其实啊,就像咱们做饭要用不同的锅一样,不同的维生素性质不同,就得用不同的方法来测。正相液相色谱适合测水溶性的维生素,比如维生素C、B族维生素;反相液相色谱则适合测油溶性的维生素,比如维生素A、D、E、K。 这下明白了吧?正反相液相色谱检测维生素,就像是个“量身定制”的过程,不同的维生素用不同的方法,才能测得更准。
国家卫生健康委员会、国家市场监管总局联合发布了85项食品安全国家标准和3项修改单的公告,其中包括了GB 5009. 296-2023《食品安全国家标准 食品中维生素D的测定》(以下称新标准)。新标准代替GB 5009.82-2016《食品安全国家标准食品中维生素A、D、E的测定》中第三法“食品中维生素D的测定[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]串联质谱法”和第四法“食品中维生素D的测定高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法”。新标准最大的变化便是增加了在线柱切换反相[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法。在此背景下,为了进一步促进维生素D检测工作的交流与合作,仪器信息网特别发起“维生素D新标准解读与应对”话题。本文邀请到科诺美(北京)科技有限公司[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]产品经理公敬欣分享相关的技术及解决方案。[align=center][size=20px][color=#ff0000][back=#d7e3bc][b] 01 [/b][/back][/color][/size][size=20px][b]引言[/b][/size][/align][b][color=#ff0000]维生素D[/color][/b]是机体维持正常代谢和调节机能所必须的脂溶性维生素,主要包括维生素D2(麦角钙化醇)和维生素D3(胆钙化醇),具有促进肠道对钙、磷的吸收和在骨骼中沉积,维持骨骼的正常生长与发育的作用,因此维生素D的准确测定对于产品质量控制具有重要的意义。在维生素D的测定中,由于添加量相对较低,且样品基质复杂,存在脂肪、蛋白等干扰物。[b][color=#ff0000]现行标准GB 5009.82-2016中第四法中,在对样品进行皂化、提取、洗涤、浓缩后,通过正相[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]净化,浓缩复溶后再通过反相色谱法分离检测。[/color][/b]该方法分析单个样品的时间较长,降低了分析效率,并且过于繁琐的前处理操作,也会对回收率的结果产生较大影响。因此,在即将生效的《GB 5009.296-2023食品国家安全标准 食品中维生素D的测定》中,将在线柱切换-反相[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法作为该标准的第二法,优化了样品前处理流程,提升检测灵敏度,更快速地获取分析结果,提高了样品的检测效率。面对新标准的即将实施,科诺美的技术应用团队制定了符合标准要求的解决方案。本方案采用Chromai Lotus C8作为一维色谱柱,Lotus PAH作为二维色谱柱,基于Chromai Leaps双三元二维[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]平台,建立了在线柱切换-反相[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]测定食品中维生素D的方法,并通过实际样品的测试,确认该方法稳定可靠。[align=center][img=屏幕截图 2024-01-02 164918.png,1100,261]https://img1.17img.cn/17img/images/202401/uepic/2601ecb0-472f-42f8-84ee-480896d81cbb.jpg[/img][img=屏幕截图 2024-01-02 164933.png,1100,207]https://img1.17img.cn/17img/images/202401/uepic/8aa6ab48-bb22-4e68-8819-b009c9d9ad76.jpg[/img][/align][align=center][size=20px][color=#ff0000][back=#d7e3bc][b] 02 [/b][/back][/color][/size][size=20px][b]实验方法[/b][/size][/align][color=#366092][b][size=18px]2.1 仪器[/size][/b][/color]Chromai Leaps高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]系统(1)一维、二维泵:Leaps双三元梯度泵(P60)(2)自动进样器:Leaps标准型自动进样器(带制冷)(A10C)(3)柱温箱:Leaps 标准加热型柱温箱(1个两位六通+1个两位10通)(C10V6)(4)检测器:Leaps紫外-可见检测器(D10)Leaps紫外二极管阵列检测器(D20)[color=#366092][b][size=18px]2.2 色谱柱[/size][/b][/color]一维色谱柱:Chromai Lotus C8(4.6*100 mm, 5 [font=&]μ[/font]m)二维色谱柱:Chromai Lotus PAH(4.6*150mm, 5 [font=&]μ[/font]m)富集柱:Chromai Louts TC C1(4.0*10mm,5 [font=&]μ[/font]m)[color=#366092][b][size=18px]2.3 软件[/size][/b][/color]Eyoulab CDS企业版[color=#366092][b][size=18px]2.4 色谱条件[/size][/b][/color][table][tr][td]流动相[/td][td]一维流动相:A:水,B:乙腈/甲醇(75/25,V/V),梯度洗脱,流速:1 mL/min二维流动相:A:乙腈/水(95/5,V/V),B:甲醇,等度洗脱,流速:0.6 mL/min[/td][/tr][tr][td]梯度洗脱及阀切换程序[/td][td]一维梯度洗脱程序[align=center][img=1.png,300,143]https://img1.17img.cn/17img/images/202401/uepic/cdd17b53-d0d1-4f10-b07a-efb12beba8c4.jpg[/img][/align]二维等度洗脱[align=center][img=2.png,300,89]https://img1.17img.cn/17img/images/202401/uepic/e426fbb1-ae7f-4698-82eb-06300ba0665a.jpg[/img][/align]阀切换程序[align=center][img=3.png,300,174]https://img1.17img.cn/17img/images/202401/uepic/fd4fcf88-d89f-4f9c-9ba0-07589bd303f9.jpg[/img][/align][/td][/tr][tr][td]检测波长[/td][td]264 nm[/td][/tr][tr][td]进样量[/td][td]100 [font=&]μ[/font][font=&]L[/font][/td][/tr][/table][align=center][size=20px][color=#ff0000][back=#d7e3bc][b] 03 [/b][/back][/color][/size][size=20px][b]实验结果[/b][/size][/align][color=#366092][b][size=18px]3.1 标准曲线的测定[/size][/b][/color]将不同浓度的标准系列工作溶液分别进样100 [font=&]μ[/font][font=&]L[/font][font=&],得到[/font]维生素D[font=calibri][sub][size=13px]2[/size][/sub][/font]和维生素D[font=calibri][sub][size=13px]3[/size][/sub][/font]标准曲线结果见表3。在2.5 -100 [font=&]μ[/font][font=&]g[/font][font=&]/L[/font][font=&]浓度范围内,[/font]维生素D[font=calibri][sub][size=13px]2[/size][/sub][/font]和维生素D[font=calibri][sub][size=13px]3[/size][/sub][/font]线性良好,线性相关系数均大于0.999。[align=center]表3 维生素D[font=calibri][sub][size=13px]2[/size][/sub][/font]和维生素D[font=calibri][sub][size=13px]3[/size][/sub][/font]标准曲线测定结果[/align][align=center][img=屏幕截图 2024-01-02 165826.png]https://img1.17img.cn/17img/images/202401/uepic/76fe96f6-21ee-4f43-b1b9-8b38e6811af4.jpg[/img][/align][align=center][img=,300,296]https://img1.17img.cn/17img/images/202401/uepic/80e3e36e-2cc5-42f4-99ef-cd27783d6371.jpg[/img][img=,300,296]https://img1.17img.cn/17img/images/202401/uepic/b2f0f2a6-2f7b-476f-a7e0-32739ec0bea5.jpg[/img][/align][align=center]图1 维生素D[font=calibri][sub][size=13px]2[/size][/sub][/font]和维生素D[font=calibri][sub][size=13px]3[/size][/sub][/font]标准曲线图[/align][align=center][img=,600,147]https://img1.17img.cn/17img/images/202401/uepic/27b2dfe1-228d-4bf6-89b1-3c66bf4d99fe.jpg[/img][/align][align=center]图2 维生素D[font=calibri][sub][size=13px]2[/size][/sub][/font]和维生素D[font=calibri][sub][size=13px]3[/size][/sub][/font]标准溶液(2.5 ng/mL)二维[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]图[/align][color=#366092][b][size=18px]3.2 实际样品测定[/size][/b][/color]参考GB 5009.296-2023第二法对样品进行皂化、液液萃取等前处理操作,得到样品溶液后上机分析,计算得到样品含量结果见表4。[align=center][img=,600,166]https://img1.17img.cn/17img/images/202401/uepic/af501539-75ae-4c3f-b845-c29bbd7b6cdf.jpg[/img][/align][align=center][img=,600,166]https://img1.17img.cn/17img/images/202401/uepic/85b9d115-9d3d-43ee-93eb-c66b5b22b734.jpg[/img][/align][align=center]图3 某婴配粉样品1和2测定二维[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]图[/align][align=center]表4 某婴配粉样品测定结果[/align][align=center][img=屏幕截图 2024-01-02 165905.png,750,123]https://img1.17img.cn/17img/images/202401/uepic/ab2bbd5e-f96d-4b5e-b768-e4302dc4e684.jpg[/img][/align][align=center][size=20px][color=#ff0000][back=#d7e3bc][b] 04 [/b][/back][/color][/size][size=20px][b]结论[/b][/size][/align]本解决方案采用科诺美自主研发的Leaps双三元[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]系统,参考GB 5009.296-2023第二法在线柱切换-反相[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法,实现了维生素D测定中高效的样品前处理,检测效率显著提高。Leaps双三元[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]系统模块式组装,仅使用一个双三元泵就可以实现二维[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]操作,避免了两组泵模块组装占地面积大或者仪器系统高度过高、操作不便的弊端,该系统可作为维生素D测定的首选配置。对于需要一次进样实现样品中维生素A、维生素D及四种维生素E异构体的同时测定分析,科诺美也可以提供在线前处理—二维[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]的完整解决方案。该方案灵敏度高、专属性强,可以有效去除样品中的杂质对维生素A、D、E的分析干扰。[align=center][img=,350,407]https://img1.17img.cn/17img/images/202401/uepic/1022a309-30f4-43ff-a564-db6f511fb862.jpg[/img][/align][align=center]供稿人:科诺美(北京)科技有限公司[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]产品经理 公敬欣[/align][b]科诺美[/b](英文:Chromai),是中国领先的从事分析检测仪器与医疗诊断研发、生产、销售和服务的高科技技术企业。是中国仪器仪表学会、中国分析测试协会、中国医疗器械行业协会会员。公司旗下设立北京研发中心、苏州供应链中心等多家子公司。科诺美公司一直致力于脂溶性维生素测定方法的研究与应用,除了食品中维生素的测定外,Chromai二维[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]系统已经取得二类医疗器械注册证(苏械注准20222222069),该系统已经成功应用于血清中脂溶维生素的测定。[来源:仪器信息网] 未经授权不得转载[align=right][/align]
【作者中文名】方灿; 李慧敏;【作者英文名】Fang Can~1; Li Hui-min~2(1.Institute for Drug Control of Guizhou; Guiyang 550004; 2.Institute for Drug Control of Hunan Yueyang; Yueyang 414000);【作者单位】贵州省药检所; 湖南省岳阳市药检所 贵阳;【摘要】目的采用高效液相色谱法测定七维牛磺酸口服溶液中维生素C的含量。方法采用Diamonsil ODS C18柱(150 mm×4.6 mm,5μm);流动相为0.01 mol.L-1磷酸二氢钠溶液(pH值为2.4)-乙腈(99∶1);检测波长为244 nm。结果线性范围2.689~43.03μg,r=0.999 7,平均回收率100.0%,RSD=2.0%(n=9)。结论该方法简便,结果准确可靠,重现性好。http://ng1.17img.cn/bbsfiles/images/2012/08/201208061403_381867_2379123_3.jpg

【作者】 傅若秋; 孟德胜; 卢来春; 余孟君; 欧阳冰; 鞠桦;【Author】 Fu Ruoqiu1,Meng Desheng1,Lu Laichun1,Yu Mengjun1,Ouyang Bing1,Ju Hua2(1.Department of Pharmacy,the Third Affiliated Hospital,Third Military Medical University,Chongqing,China 400042;2.Department of Pharmacy,Bengbu Medical College,Bengbu,Anhui,China 233030)【机构】 中国人民解放军第三军医大学第三附属医院; 安微蚌埠医学院药学系;【摘要】 目的建立测定薇依霜中维生素E和羟苯乙酯含量的高效液相色谱法。方法色谱柱为Diamonsil C18柱(250 mm×4.6 mm,5μm),维生素E测定以甲醇为流动相,流速为2.0 mL/min,紫外检测波长为285 nm;羟苯乙酯测定以甲醇∶水(45∶55)为流动相,流速为1.0 mL/min,检测波长为258 nm。结果维生素E质量浓度在0.099 6~0.498 g/L范围内与峰面积线性关系良好,r=0.999 5(n=5),平均回收率为99.25%,RSD为1.21%(n=9);羟苯乙酯质量浓度在2.16~10.80μg/mL进样范围内与峰面积线性关系良好,r=0.999 7(n=5),平均回收率为100.31%,RSD为1.02%(n=9)。结论所建立的方法简便、专属性强,重现性好,可有效控制薇依霜的质量。 更多还原http://ng1.17img.cn/bbsfiles/images/2012/08/201208271649_386537_2379123_3.jpg
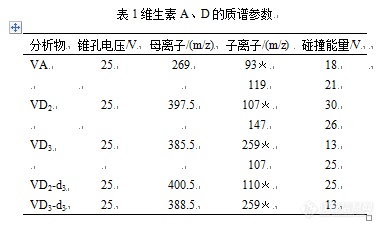
超高效液相色谱-串联质谱法测定奶粉中维生素A、D的含量[align=left][font=宋体]摘要:采用超高效液相色谱[/font]-[font=宋体]串联质谱法建立了检测奶粉中维生素[/font]A[font=宋体]、[/font]D[font=宋体]含量的分析方法。试样经氢氧化钾[/font]-[font=宋体]乙醇皂化反应后,正己烷提取,氮气吹干后用甲醇定容,维生素[/font]A[font=宋体]、[/font]D[font=宋体]在[/font]C[sub]18[/sub][font=宋体]色谱柱上以[/font]0.1%[font=宋体]甲酸水溶液和甲醇为流动相,进行液相色谱分离;质谱检测采用电喷雾正离子化模式和多反应监测模式([/font]MRM[font=宋体])。结果表明,维生素[/font]A[font=宋体]、[/font]D[font=宋体]在各自浓度范围内线性关系良好,相关系数([/font]r[font=宋体])大于[/font]0.999[font=宋体],定量下限([/font]LOQ[font=宋体])分别为[/font]10[font=宋体]、[/font]5 [color=black]u[/color]g/kg[font=宋体],加标回收率为[/font]87.2%~110%[font=宋体],相对标准偏差([/font]RSD[font=宋体])为[/font]2.3%~5.2%[font=宋体]([/font]n=6[font=宋体])。本方法简便、灵敏、准确,适用于奶粉中维生素[/font]A[font=宋体]、[/font]D[font=宋体]含量检测[/font][font=宋体]。[/font][/align][align=left][font=宋体]关键词:超高效液相色谱[/font]-[font=宋体]串联质谱;奶粉;维生素[/font]A[font=宋体]、[/font]D[/align][align=left][font=宋体]维生素在人体生长、代谢、发育过程中发挥着重要的作用,是人类为维持正常的生理功能而必须从食物中获得的一类微量有机物质。根据溶解性质不同,分为水溶性维生素(如[/font]B[font=宋体]族维生素、维生素[/font]C[font=宋体]等)和脂溶性维生素(如维生素[/font]A[font=宋体]、[/font]D[font=宋体]、[/font]E[font=宋体]、[/font]K[font=宋体]等)。[/font][font=宋体][color=#333333][back=white]维生素[/back][/color][/font][font='Arial','sans-serif'][color=#333333][back=white]A[/back][/color][/font][font=宋体][color=#333333][back=white]、[/back][/color][/font][font='Arial','sans-serif'][color=#333333][back=white]D[/back][/color][/font][font=宋体][color=#333333][back=white]对人体视觉能力、免疫力、骨骼生长发育等方面都有重要的生理功能,但这类物质在人体内不能合成或合成量不足,必须经常由食物供给,因此维生素[/back][/color][/font][font='Arial','sans-serif'][color=#333333][back=white]A[/back][/color][/font][font=宋体][color=#333333][back=white]、[/back][/color][/font][font='Arial','sans-serif'][color=#333333][back=white]D[/back][/color][/font][font=宋体][color=#333333][back=white]被广泛添加在作为人类获取营养物质食物来源之一的奶粉中(特别是婴幼儿配方奶粉),但研究也表明若过量摄入,也会对人体造成危害,所以准确检测奶粉中维生素[/back][/color][/font][font='Arial','sans-serif'][color=#333333][back=white]A[/back][/color][/font][font=宋体][color=#333333][back=white]、[/back][/color][/font][font='Arial','sans-serif'][color=#333333][back=white]D[/back][/color][/font][font=宋体][color=#333333][back=white]含量十分重要。[/back][/color][/font][/align][align=left][font=宋体]目前,食品安全国家标准《[/font]GB 5009.82-2016 [font=宋体]食品中维生素[/font]A[font=宋体]、[/font]D[font=宋体]、[/font]E[font=宋体]的测定》中规定的维生素[/font]A[font=宋体]测定是液相色谱法,维生素[/font]D[font=宋体]包括[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]法和制备[/font]-[font=宋体]液相色谱法。用该标准检测维生素[/font]A[font=宋体]和维生素[/font]D[font=宋体]时,需要把样品分开进行两种前处理,费时费力费试剂,而且由于奶粉中蛋白脂肪含量较高,用液相色谱法检测维生素[/font]A[font=宋体]时基质干扰较大,可能造成定量不够准确[/font][font=宋体]。而不少研究表明,维生素[/font]A[font=宋体]在[/font][url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS[font=宋体]上响应很好,同时[/font]MRM[font=宋体]模式能有效去除杂质干扰,定量更加准确可靠。本文借鉴[/font]GB 5009.82-2016[font=宋体]的造化过程,通过后续优化提取步骤,最终选用正己烷作为造化后溶液中维生素[/font]A[font=宋体]和[/font]D[font=宋体]的共同提取试剂,实现了利用[/font][url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS[font=宋体]法一个前处理可以同时测定维生素[/font]A[font=宋体]和[/font]D[font=宋体]。[/font][font=宋体][color=black]该方法前处理过程简便、分析时间短、灵敏度高、抗干扰能力强,适用于大批量奶粉样品中维生素[/color][/font][color=black]A[/color][font=宋体][color=black]、[/color][/font][color=black]D[/color][font=宋体]含量的检测。[/font][/align][align=left][b][size=12.0pt]1 [/size][font=宋体][size=12.0pt]实验部分[/size][/font][/b][/align][align=left]1.1 [font=宋体]材料与试剂[/font][/align][align=left][font=宋体][color=black]维生素[/color][/font][color=black]A[/color][font=宋体][color=black]、维生素[/color][/font][color=black]D[sub]2[/sub][/color][font=宋体][color=black]、维生素[/color][/font][color=black]D[sub]3[/sub][/color][font=宋体][color=black]标准品(纯度[/color][/font][font=宋体][color=black]≥[/color][/font][color=black]99%[/color][font=宋体][color=black],[/color][/font][color=black]Sigma[/color][font=宋体][color=black]公司);婴儿配方乳粉定量分析质控样品([/color][/font][color=black]QC-IP-704[/color][font=宋体][color=black],中国检验检疫科学研究院);正己烷、甲醇、乙酸乙酯、甲酸(色谱纯,[/color][/font][color=black]Fisher[/color][font=宋体][color=black]公司);无水乙醇、氢氧化钾、抗坏血酸(优级纯,科密欧公司);硅胶固相萃取柱([/color][/font][color=black]500 mg[/color][font=宋体][color=black],[/color][/font][color=black]6 mL[/color][font=宋体][color=black],[/color][/font][font=宋体]Waters[/font][font=宋体][color=black]公司);实验用水为[/color][/font][color=black]Millipore[/color][font=宋体][color=black]纯水仪制备。[/color][/font][/align]1.2 [font=宋体]仪器与设备[/font][font=宋体]UPLC XEVO TQ-S[/font][font=宋体]超高效液相色谱串联质谱仪(Waters公司);水浴振荡器;涡旋混合器;氮吹仪。[/font]1.3 [font=宋体][color=black]维生素[/color][/font][color=black]A[/color][font=宋体][color=black]、[/color][/font][color=black]D[sub]2[/sub][/color][font=宋体][color=black]、[/color][/font][color=black]D[sub]3[/sub][/color][font=宋体]标准储备液的配置[/font][font=宋体]分别称取一定量的[/font][font=宋体][color=black]维生素[/color][/font][color=black]A[/color][font=宋体][color=black]、[/color][/font][color=black]D[sub]2[/sub][/color][font=宋体][color=black]、[/color][/font][color=black]D[sub]3[/sub][/color][font=宋体]标准[/font][font=宋体][color=black]标准品[/color][/font][font=宋体],用无水乙醇配置成质量浓度为[/font]100 ug/mL[font=宋体]标准储备液,于[/font]-20[font=宋体]℃冰箱保存(有效期[/font]1[font=宋体]个月),待用;临用前将溶液回温至室温,并按照[/font]GB5009.82-2016[font=宋体]附录[/font]B[font=宋体]表格进行浓度校正,然后用甲醇逐级稀释成所需浓度的标准工作液。[/font]1.4 [font=宋体]样品前处理[/font][font=宋体]准确称取[/font]2.00 g([font=宋体]精确到[/font]0.01 g)[font=宋体]奶粉试样于[/font]150 mL[font=宋体]三角瓶中,加入[/font]100 uL 1 ug/mL[font=宋体]维生素[/font][color=black]D[sub]2[/sub]-d[sub]3[/sub][/color][font=宋体][color=black]、[/color][/font][color=black]D[sub]3[/sub]-d[sub]3[/sub][/color][font=宋体][color=black]混合内标混匀,静置[/color][/font][color=black]30 min[/color][font=宋体][color=black],然后[/color][/font][font=宋体]依次加入[/font]0.5 g[font=宋体]抗坏血酸、[/font]40[font=宋体]℃[/font][font=宋体]温水[/font]10 mL[font=宋体],涡旋混匀;加入[/font]20 mL[font=宋体]无水乙醇混匀,再加入[/font]10 mL 50%[font=宋体]氢氧化钾溶液涡旋混匀,放入恒温振荡器中[/font]55[font=宋体]℃避光水浴震荡皂化60 min,皂化后立即用冷水冷却至室温[/font][font=宋体]。[/font][font=宋体]将皂化液转入[/font]250 mL[font=宋体]分液漏斗中,加入[/font]20 mL[font=宋体]正己烷,轻轻摇动震荡萃取[/font]5 min[font=宋体]后静置分层,将下层溶液转移至另一分液漏斗中按上述方法再次提取,合并有机相,水洗至中性,将洗涤后的正己烷层通过无水硫酸钠过滤脱水,收集滤液待用。[/font]a[font=宋体])维生素[/font]A[font=宋体]测定:准确吸取[/font]2 mL[font=宋体]上述滤液于试管中,氮气吹干后加入[/font]1 mL[font=宋体]甲醇定容,涡旋混匀后过[/font]0.22[font=宋体]u[/font]m[font=宋体]有机系微孔滤膜后供[/font]UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS[font=宋体]分析测定;[/font]b[font=宋体])维生素[/font]D[font=宋体]测定:将硅胶固相萃取柱依次用[/font]8 mL[font=宋体]乙酸乙酯活化、[/font]8 mL[font=宋体]正己烷平衡,准确吸取[/font]20 mL[font=宋体]上述滤液全部过柱,再用[/font]6 mL[font=宋体]乙酸乙酯[/font]-[font=宋体]正己烷([/font]5+95[font=宋体])淋洗,用[/font]6 mL[font=宋体]乙酸乙酯[/font]-[font=宋体]正己烷([/font]15+85[font=宋体])洗脱收集。洗脱液用氮气吹干后加入[/font]1 mL[font=宋体]甲醇定容,涡旋混匀后过[/font]0.22[font=宋体]u[/font]m[font=宋体]有机系微孔滤膜后供[/font]UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS[font=宋体]分析测定。[/font][font=宋体][size=9.0pt]注意:因维生素容易受到光照影响,在整个前处理操作过程中注意避光,前处理完成后尽快上机测定。[/size][/font]1.5 [font=宋体]液相色谱及质谱条件[/font][font=宋体]液相色谱:色谱柱:Waters [/font]BEH C[sub]18[/sub][font=宋体]([/font]1.7 μm[font=宋体],[/font]50mm×2.1mm[font=宋体]);柱温:[/font]30[font=宋体]℃[/font][font=宋体];流速:[/font]0.4 [font=宋体]mL/min[/font][font=宋体];进样量:[/font]2μL[font=宋体];流动相[/font]A[font=宋体]:甲醇;流动相[/font]B[font=宋体]:[/font]0.1%[font=宋体]的甲酸水溶液。梯度洗脱程序:[/font]0~0.5min[font=宋体],[/font]90% A[font=宋体];[/font]0.5~2. 0 min[font=宋体],[/font]90%~100% A[font=宋体];[/font]2. 0 ~4. 0 min[font=宋体],[/font]100%A[font=宋体],[/font]4 ~4.1min[font=宋体],[/font]100% A~90% A[font=宋体],[/font]4.1 ~5.0min 90% A[font=宋体]。[/font][font=宋体]质谱:离子源:电喷雾离子源[/font]( ESI [sup]+[/sup] ) [font=宋体];扫描方式:正离子扫描;检测方式:多反应监测[/font]( MRM)[font=宋体];毛细管电压:[/font]3.2 kv[font=宋体];离子源温度:[/font]150[font=宋体]℃;去溶剂气温度:[/font]500[font=宋体]℃;去溶剂气流量:[/font]1000 L /h[font=宋体];定性、定量离子对及碰撞能量见表[/font]1[font=宋体]。[/font][align=center][img=,385,230]https://ng1.17img.cn/bbsfiles/images/2020/07/202007201340233582_537_3299836_3.png!w385x230.jpg[/img][/align][align=center][font=宋体][size=9.0pt]﹡为定量离子[/size][/font][/align][align=left][b][size=12.0pt]2 [/size][font=宋体][size=12.0pt]结果与讨论[/size][/font][/b][/align]2.1 [font=宋体]色谱质谱条件及前处理过程的优化[/font][font=宋体]流动相的选择:对比了酸性体系([/font]0.1%[font=宋体]甲酸水溶液)与甲醇、乙腈的流动相体系组合,结果发现目标物在乙腈体系中容易造成出峰时间较长导致峰宽变大,而在甲醇体系中响应值比乙腈高很多,且峰型得到明显改善,故本研究采用[/font]0.1%[font=宋体]甲酸水溶液[/font]+[font=宋体]甲醇流动相体系。[/font][align=left][font=宋体]质谱参数优化:[/font][font=宋体]用甲醇配置[/font]1.0 mg/L [font=宋体]维生素[/font]A[font=宋体]、[/font][color=black]D[sub]2[/sub][/color][font=宋体][color=black]、[/color][/font][color=black]D[sub]3[/sub][/color][font=宋体]标准溶液直接注射到质谱中,在正离子模式下进行母离子全扫描,发现目标物各自对应的准分子离子峰[/font][M+H][sup]+[/sup][font=宋体]具有很好的响应,然后在分别进行子离子全扫描,各得到两对丰度高、干扰小的子离子对进行[/font]MRM[font=宋体]监测,最终确定的质谱条件见表[/font]1[font=宋体],相应的色谱质谱图见图[/font]1[font=宋体]、图[/font]2[font=宋体]。[/font][/align][align=left][font=宋体]前处理过程优化:通过实验发现,将皂化液用正己烷提取后直接氮气吹干定容上机,维生素[/font][color=black]D[sub]2[/sub][/color][font=宋体][color=black]、[/color][/font][color=black]D[sub]3[/sub][/color][font=宋体][color=black]图谱有很大干扰,容易影响定量准确性;而正己烷提取液经硅胶固相萃取柱净化[/color][/font][font=宋体],用乙酸乙酯[/font]-[font=宋体]正己烷([/font]5+95[font=宋体])淋洗,然后再用乙酸乙酯[/font]-[font=宋体]正己烷([/font]15+85[font=宋体])洗脱收集氮吹后测定能有效去除杂质干扰,使[/font]VD[font=宋体]定量更加准确。同时在使用[/font][font=宋体][color=black]硅胶固相萃取柱测定[/color][/font][color=black]VA[/color][font=宋体][color=black]柱效时[/color][/font][font=宋体]发现,[/font][font=宋体]使用[/font][font=宋体]乙酸乙酯[/font]-[font=宋体]正己烷([/font]5+95[font=宋体])淋洗液会使一部分[/font]VA[font=宋体]从柱子洗脱下来造成损失,可能是由于[/font]VA[font=宋体]极性相对[/font]VD[font=宋体]要强一些,更容易被乙酸乙酯洗脱,但不加乙酸乙酯不能有效去除杂质对[/font]VD[font=宋体]的干扰,考虑到[/font]VA[font=宋体]质谱响应比[/font]VD[font=宋体]高很多,且在[/font]1.5[font=宋体]液相条件下[/font]VA[font=宋体]保留时间相对靠前,基线干扰较少,故本实验最终采用了[/font]1.4[font=宋体]的前处理方法。[/font][/align][align=center][img=,690,492]https://ng1.17img.cn/bbsfiles/images/2020/07/202007201343054976_3145_3299836_3.png!w690x492.jpg[/img][/align][align=center][img=,690,502]https://ng1.17img.cn/bbsfiles/images/2020/07/202007201343223289_9830_3299836_3.png!w690x502.jpg[/img][/align][align=left][color=black]2.2 [/color][font=宋体][color=black]线性范围和定量限[/color][/font][font=宋体][color=black]吸取不同体积的维生素[/color][/font][color=black]A[/color][font=宋体][color=black]、[/color][/font][color=black]D[sub]2[/sub][/color][font=宋体][color=black]、[/color][/font][color=black]D[sub]3[/sub][/color][font=宋体][color=black]标准储备液([/color][/font][color=black]1.3[/color][font=宋体][color=black]),用[/color][/font][font=宋体]甲醇[color=black]分别配置不同浓度的[/color]上机标准溶液,以各自定量离子的峰面积(或与内标峰面积比值)为[/font]Y[font=宋体]对应质量浓度[/font]X[font=宋体]([/font][color=black]m[/color]g/L[font=宋体])做标准曲线,得到的线性方程和相关系数见表[/font]2[font=宋体];以[/font]10[font=宋体]倍信噪比([/font]S/N[font=宋体])计算得到各维生素的定量下限,结果见表[/font]2[font=宋体]。[/font][/align] [align=center][img=,690,214]https://ng1.17img.cn/bbsfiles/images/2020/07/202007201344110532_6564_3299836_3.png!w690x214.jpg[/img][/align][align=left][color=black]2.4[/color][font=宋体][color=black]回收率和精密度[/color][/font][font=宋体][color=black]脂溶性维生素在奶粉中天然存在[/color][/font][font=宋体],查阅相关资料发现脱脂奶粉中[/font]VA[font=宋体]、[/font]VD[font=宋体]含量较低,故本方法准确度实验采用脱脂奶粉作为空白样品进行加标。具体添加水平为:[/font]VA[font=宋体]为[/font]10[font=宋体],[/font]100[font=宋体],[/font]500 [size=9.0pt]ug/kg[/size][font=宋体][size=9.0pt];[/size][/font]V[color=black]D[sub]2[/sub][/color][font=宋体][color=black]、[/color][/font][color=black]VD[sub]3[/sub][/color][font=宋体][color=black]为[/color][/font][color=black]5[/color][font=宋体][color=black],[/color][/font][color=black]50[/color][font=宋体][color=black],[/color][/font][color=black]200[/color][size=9.0pt] ug/kg[/size][font=宋体][size=9.0pt]。[/size][/font][font=宋体][color=black]每个[/color][/font][font=宋体]水平重复[/font]6[font=宋体]次,[color=black]同时做该脱脂奶粉的空白本底实验。[/color]按照[/font]1.4[font=宋体]前处理方法处理后上机检测,回收率计算结果(扣除空白后)见表[/font]3[font=宋体]。结果表明,该方法维生素[/font]A[font=宋体]、[/font]D[sub]2[/sub][font=宋体]、[/font]D[sub]3[/sub][font=宋体]的平均回收率为[/font]87.2%~110%[font=宋体],相对标准偏差([/font]RSD[font=宋体],[/font]n=6[font=宋体])为[/font]2.3%~5.2%[font=宋体],均满足实验要求。[/font][/align][align=center][font=宋体][img=,690,433]https://ng1.17img.cn/bbsfiles/images/2020/07/202007201345292998_9572_3299836_3.png!w690x433.jpg[/img][/font][/align][align=left][font=宋体][color=black]2.5[/color][font=宋体][color=black]实际样品分析[/color][/font][font=宋体][color=black]为进一步验证该方法的准确性,采用本方法测定中国检科院的奶粉质控样品[/color][/font][color=black]QC-IP-704[/color][font=宋体][color=black],结果见表[/color][/font][color=black]4[/color][font=宋体][color=black];采用本方法对市场上不同品牌的婴幼儿配方奶粉进行检测,结果显示均未检出[/color][/font][font=宋体]维生素[/font]D[sub]2[/sub][font=宋体],维生素[/font]A[font=宋体]、[/font]D[sub]3[/sub][font=宋体]含量均符合《[/font]GB 10765-2010 [font=宋体]食品安全国家标准[/font][font=宋体]婴儿配方食品》的规定。[/font][/font][/align][align=center][font=宋体][font=宋体][img=,690,181]https://ng1.17img.cn/bbsfiles/images/2020/07/202007201346372756_5303_3299836_3.png!w690x181.jpg[/img][/font][/font][/align][align=left][font=宋体][font=宋体][b][size=12.0pt]3 [/size][font=宋体]结语[/font][/b][font=宋体]本文建立了超高效液相色谱[/font]-[font=宋体]串联质谱法([/font]UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS[font=宋体])同时测定奶粉中维生素[/font]A[font=宋体]、[/font]D[sub]2[/sub][font=宋体]、[/font]D[sub]3[/sub][font=宋体]含量的分析方法。该方法具有较高的灵敏度、准确度和精密度,前处理步骤简单,分析速度快,特别适合大批量样品的检测。[/font][font=宋体]参考文献:[/font][size=9.0pt][1][/size][size=9.0pt]GB 5009.82-2016 [/size][font=宋体]食品中维生素[/font][size=9.0pt]A[/size][font=宋体]、[/font][size=9.0pt]D[/size][font=宋体]、[/font][size=9.0pt]E[/size][font=宋体]的测定[/font][size=9.0pt].[/size][size=9.0pt][2] GB 10765-2010 [/size][font=宋体]食品安全国家标准[/font][font=宋体]婴儿配方食品[/font][size=9.0pt].[/size][size=9.0pt][3][/size][font=宋体]严丽娟[/font][size=9.0pt],[/size][font=宋体]李文斌[/font][size=9.0pt],[/size][font=宋体]洪煜琛[/font][size=9.0pt],[/size][font=宋体]等[/font][size=9.0pt]. [/size][font=宋体]液相色谱[/font][size=9.0pt]-[/size][font=宋体]大气压化学电离串联质谱法测定婴幼儿配方奶粉中的维生素[/font][size=9.0pt]D [J]. [/size][font=宋体]色谱[/font][size=9.0pt], 2017 , 04 :427-431.[/size][size=9.0pt][4][/size][font=宋体]黄百芬[/font][size=9.0pt],[/size][font=宋体]柯星[/font][size=9.0pt],[/size][font=宋体]郑菲菲[/font][size=9.0pt],[/size][font=宋体]等[/font][size=9.0pt]. [/size][font=宋体]固相萃取[/font][size=9.0pt]-[/size][font=宋体]超高效液相色谱串联质谱法同时测定婴幼儿配方食品中维生素[/font][size=9.0pt]D[sub]2[/sub][/size][font=宋体]和[/font][size=9.0pt]D[sub]3[/sub] [J]. [/size][font=宋体]中国卫生检验杂志[/font][size=9.0pt], 2014 , 22 :3203-3207.[/size][size=9.0pt][5][/size][font=宋体]赵孔祥[/font][size=9.0pt],[/size][font=宋体]娄婷婷[/font][size=9.0pt],[/size][font=宋体]何佳[/font][size=9.0pt],[/size][font=宋体]等[/font][size=9.0pt]. [/size][font=宋体]同位素稀释[/font][size=9.0pt]/[/size][font=宋体]液相色谱[/font][size=9.0pt]-[/size][font=宋体]串联质谱法测定婴幼儿配方奶粉中脂溶性维生素[/font][size=9.0pt][J]. [/size][font=宋体]分析测试学报[/font][size=9.0pt], 2015 , 12 :1372-1376.[/size][/font][/font][/align]
1.利用C18柱反相高效液相测定维生素D3的含量时流动相能否加入缓冲液?一般加入的缓冲液有哪些?以及缓冲液的ph值和所占流动相的比例是多少?2.利用C18柱反相高效液相测定维生素D3的含量时,它的含量如何计算?计算公式是什么?如何推导?与中国药典2010版有什么不一样?影响因子在反相高效液相中如何测定以及计算?3.测定维生素D3含量时,对照品的单位是mg,而样品中含有的维生素D3的单位是国际单位(IU),在配制溶液时,单位是否要换成一致,对后面的含量计算有什么影响?一般维生素D3在上反相液相是进样所配制的浓度范围是多少?
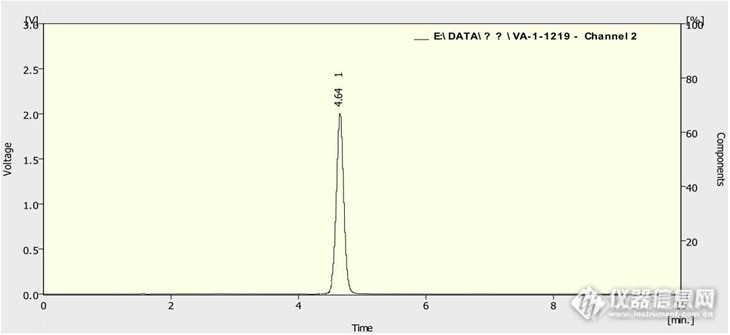
高效液相色谱法检测维生素A维生素A是人体所必须的营养物质,具有调节表皮及角质层新陈代谢的功效,保持组织或器官表层的健康,维持正常视觉功能促进骨骼正常生长发育,抑制肿瘤生长。海能仪器股份有限公司应用中心实验室依据国标GB/T 17817-2010中高效液相测定维生素A的方法,对维生素A软胶囊中组分进行分析确认,方法如下:使用仪器:海能LC7000二元高压色谱系统(色谱泵,紫外检测器,手动进样器)Hanon-Clarity 色谱工作站试剂:超纯水、甲醇、维生素A 软胶囊色谱条件:色谱柱:Thermo C18 4.6*150mm 5um流速:1ml/min检测波长:326nm柱温:40℃流动相A:超纯水流动相B:甲醇进样量:20ul 时间 流动相A(%) 流动相B(%) 0 5 95 10 5 95 标准品制备:取一粒维生素A 软胶囊1.5mg溶于25ml甲醇中,超声半小时使之溶解,0.45um有机滤膜过滤后得标准样品,浓度为0.06 mg/ml。所得谱图如下:http://ng1.17img.cn/bbsfiles/images/2013/01/201301101241_419544_1444635_3.jpg本实验采用反相高效液相色谱法进行测定,出峰时间4.64min,与文献参考值一致。
反相高效液相色谱法测定食品中维生素A和E的实操技巧与故障排除 一、操作要点 样品处理 首先,得把样品里的维生素A和E给提取出来。这一步通常要用到皂化处理,就是用碱把样品中的脂肪给分解掉,留下维生素A和E。然后,再用有机溶剂把这些维生素从样品中提取出来。 提取过程中要注意,使用的有机溶剂一定要纯净,不能含有杂质,否则会影响检测结果。 色谱条件设置 色谱柱一般用C18反相柱,这种柱子对维生素A和E的分离效果比较好。 流动相一般用甲醇和水,比如88:12的比例,流速控制在1.0ml/min左右。 检测波长一般选294nm,这个波长下维生素A和E的吸收效果最好。 进样量一般用10μL,进样前要确保样品溶液过滤干净,避免堵塞色谱柱。 数据分析 用高效液相色谱仪检测后,会得到一系列峰。根据峰的面积和保留时间,可以计算出样品中维生素A和E的含量。 这里可以用外标法或者内标法进行定量分析,具体方法根据实际情况选择。 二、故障排除 峰形不好 如果发现峰形拖尾或者分叉,可能是色谱柱污染了。可以尝试用强溶剂冲洗色谱柱,或者更换新的色谱柱。 还有可能是流动相比例不合适,可以微调一下甲醇和水的比例试试。 检测不到峰 首先检查样品是否提取完全,提取过程中有没有损失。 再检查检测器是否正常工作,波长设置是否正确。 最后检查进样针有没有堵塞,样品溶液是否过滤干净。 结果重复性差 检查仪器是否稳定,可以做几次空白试验看看结果是否一致。 再检查样品处理过程是否一致,每次提取和进样的量是否准确。 最后检查数据处理过程有没有误差,尽量使用自动化软件进行数据处理。 总之,反相高效液相色谱法测定食品中维生素A和E的含量虽然步骤繁琐,但只要掌握好操作要点,注意细节,就能得到准确可靠的结果。
有没有做过维生素A杂质的液相色谱分析?维生素A及其杂质维生素A环氧化物、维生素A醛、维生素A酸没有杂质对照品,以上物质在甲醇-水(90:10)流动相,C18*250mm柱能不能分的开?
液相色谱测定维生素B2标准品,配成0.05μg/mL,0.10μg/mL,0.20μg/mL,0.50μg/mL,1.00μg/mL维生素B2标曲,只有0.50μg/mL和1.00μg/mL(峰高有3.6mAU,峰面积有71.99mAU*S)有出峰,而100μg/mL维生素B2标准品测得的峰高有317.9mAU,峰面积有7075.74mAU*S,出峰时间为5.889min,(色谱条件:0.05mol/L乙酸钠:甲醇=65:35,30℃柱温,1mL/min,进样20μL,270nm的检测波长)怎么回事?问题:1.为什么前面三中浓度的标曲不出峰2.峰高合适么
请教各位师兄师姐,岛津的液相可以分析维生素C的含量吗?用什么流动相。柱子。是否需要柱温箱?

仪器: LC-100高效液相色谱仪色谱柱: SHOEDEX C18-120-5, 4.6*250mm, 5um流动相: 甲醇 流速: 1mL/min检测波长:326nm;7.5min后264nm,10.5min后285nm进样量: 10uL柱温: 28℃ http://ng1.17img.cn/bbsfiles/images/2015/06/201506110949_549816_1635904_3.png 按照出峰顺序依次为 VA, VD3, VE注意事项:维生素A乙酸酯需保存在棕色瓶中,溶液配好后尽快检测 VA,1微克/毫升;VD3,5微克/毫升;VE,0.1微克/毫升
不知有没有用,请参考。目的:开发一种快速测定婴儿配方乳粉中维生素A 酯类含量的反相高效液相色谱法。方法:直接使用二氯甲烷和甲醇体积比为2.5:1 的混合溶剂对样品进行提取,在30℃的条件下采用等度洗脱,流动相采用体积比为80:20 的甲醇- 三氯甲烷溶剂,流动相流速1.0mL/min;色谱柱温度30℃,检测波长325nm。结果:维生素A 醋酸酯和维生素A 棕榈酸酯的回收率分别为100.1% 和102.8%,多次测定结果的相对偏差分别为1.18% 和0.96%,检出限分别为3.1ng 和4.3ng。结论:本方法操作简单、精密度、回收率和灵敏度高,适用于婴幼儿配方乳粉中的维生素A 酯类的检测。
请问哪位老师有液相色谱测定水容性维生素和烟酸的方法,非常感谢
问题: 请教一下大家 测饮料中维生素A.D.E含量 为什么AD正常 E总是偏低呢,低一倍。嗯呢 标品正常 色谱柱也排查过了。我今天测的乳粉D正常 AE低 但是A是稍微偏低 E是非常低
[b][b]高效液相色谱仪测奶粉中的维生素D3 维生素D3的加标回收操作步骤和检测步骤有区别吗?[/b][/b]
维生素C又叫抗坏血酸(Ascorbicid),广泛存在于植物组织中,新鲜的水果、蔬菜中含量较多。是一种水溶性小分子生物活性物质,也是人体需要量最大的一种维生素。维生素C具有还原性(其结构式如图1),可以与许多氧化剂发生氧化还原反应,因此可以利用其还原性测定维生素C的含量。目前食品中测定维生素C含量的方法主要有碘量法,是利用维生素C的氧化还原性为基础的一种氧化还原方法。冈其酸度不易把握,碘需要标定且易挥发,而Vc不易稳定保存,使测定结果易出现偏差,且这种方法不适合微量分析;国标GB/T6195-1986是采用2,6一二氯靛酚滴定法。利用样品溶液由蓝色转变为粉红色来辨别其滴定终点的到达。但是多数水果、蔬菜样品其提取液都具有一定的色泽而导致滴定终点不明显,使测定准确度降低。另外还有荧光光谱分析法 J、紫外一可见分光度法、色谱法、电化学法等,这些方法都存在着一定的局限性,如操作过程复杂,所用试剂不稳定,速度慢、背景¨干扰大。近年来,建立的测定Vc的其他方法还有催化动力学和光度法相结合的方法,及VC传感器测定方法,固定pH滴定法等。 该论文将对蔬菜、水果常用的维生素C含量的检测方法进行综述、比较。 图1 维生素C的结构式1原子吸收分光光度法利用原子吸收分光光度法问接测定维生素C的含量,是利用维生素C可以与一些金属离子发生氧化还原反应,通过测定反应掉的金属离子的量,进而间接计算出维生素c的含量。1.1以银离子作为氧化剂的间接原子吸收分光光度法以银离子作为氧化剂的间接原子吸收分光光度法,是利用维生素C分子中的有二烯醇基具强还原性,可被硝酸银氧化为去氢维生素C,同时产生黑色银沉淀(反应式如图2)。 图2维生素C与银离子反应的反应式 沉淀经离心分离后,将分离得到的沉淀用硝酸溶解后,再利用原子吸收分光光度计测定银离子的含量,从而接测得维生素C含量,具体测定方法如下: 配制一系列浓度的维生素C标准溶液,依次吸取一定量的维生素C标准溶液置于10mL离心管中,分别加入2mL(1mg/mL) Ag+标准溶液,然后加水使总体积为4mL,摇匀,在室温下避光放置35min离心分离弃去上清液,用2mL超纯水洗涤沉淀3次,然后用l:1的浓硝酸3mL溶解沉淀,移入50mL的容量瓶中,加水稀释至刻度。喷入空气-乙炔火焰分别测定其吸光度,以维生素C标准溶液的浓度为横坐标,以测得的吸光度值为纵坐标绘制标准曲线。最后将处理过的待测样按上述方法测定其维生素C含量。 上述方法巾维生素C标准溶液及样品的配制都是利用2%的柠檬酸作为溶剂,并在棕色瓶中保存,原因是维生素C在溶液中不稳定,遇氧气、光、热、碱性物质易受破坏,而在适当的酸性条件下比较稳定,用2%的柠檬酸溶液来配制维生素C标准溶液,减缓了维生素C被氧化的速度,同时消除了一定外界因素的十扰,使得测定结果比较稳定。1.2 以铜离子作为氧化剂的间接原子吸收分光光度法文献中报道了以铜离子作为氧化剂的间接原子吸收分光光度法。该方法也是利用维生素C在酸性介质中维生素C可将Cu2+定量的还原为Cu+,然后Cu+与SCN-反应生成CuSCN沉淀,在高速离心机下有效地分离出CuSCN沉淀,洗涤后再经浓硝酸溶解,用原子吸收法测定沉淀中的含铜量,即可推知样品中维生素C的含量。具体测定方法如下: 分别吸取1mL配制的含一定量维生素C的标准溶液(随配随用)(分别含维生素C 50、100、200、300、400、500 µg)和样品提取液,依次放置于已编号的15mL离心管中,各加入1mLCuSO4饱和溶液、1mL浓度为2%硫氰酸铵溶液、0.5mL盐酸-醋酸钠缓冲液和0.5 mL饱和NaCl溶液充分混和,稍后离心分离,弃去上层清液,小心地用少量水洗涤沉淀2~3次(注意每次用水不能超过1 mL),加入0.5mL硝酸溶解后,转移至lO0mL的容量瓶中加水定容至刻度线,摇匀。分别用原子吸收分光光度计测定其含铜量,由所得的维生素C含量的标准曲线,可以得到相应样品的试验结果。 该方法所得的试验结果相对标准偏差RSD在5%以内加标回收率在96.56%~100.67%,其精密度和准确度均达到痕量分析要求。此方法的线性相关系数R=O 9989,表明相关性很好。2紫外可见分光光度法利用紫外分光光度法测定维生素C的含量是基于维生素c在紫外光区有特征吸收,但是因为维生素C结构中具有不饱和键,具有还原性,不易稳定存在,直接测定误差较大。所以在利用紫外分光光度法测定时,维生素标准溶液和待测样的配制条件非常重要。曾国富,黄玉英研究发现,维生索C在CTAB-C5H11OH-H2O微乳液体系中非常稳定,它存在于微乳液滴膜的内侧,与渗透进入液滴膜外侧的溶液氧接触的机会极少,该体系能极大地提高维生素C的稳定性。 郑京平等利用维生素C具有对紫外产生吸收和对碱稳定的特性,建立了紫外分光光度快速测定水果、蔬菜维生素c的新方法。根据维生素C具有对紫外产生吸收和对碱不稳定的特性,于波长243nm处测定样品溶液与碱处理样品两者吸光度之差,通过查校准曲线,即可计算样品巾维生素C的含量。此法操作简单、快速准确、重现性好,结果令人满意。特别适合含深色样品的测定。实验结果表明该方法简单易行,结果准确、灵敏度高,检出限低,可快速测定水果、蔬菜中维生素C,值得推广应用。 张立科等介绍了在0~450µg/mL线性范围内,以cu2+作催化剂,以溶解氧将还原型维生素C氧化为在246.0 nm处无吸收的氧化型Vc,实现了样品各紫外干扰成分的本底校正,建立了种测定果蔬Vc的新方法。该方法中维生素C破坏条件的选择尤为重要,确定条件为:Cu用量为30 g,反应温度为70℃,反应时间为20min,加热条件下,反应速度快,无需加掩蔽剂。方法简便、快速、准确,测定了香蕉、西红柿等果蔬中的VC含量,结果令人满意。经多次实验得出该方法RsD在0.32%~0.89%之间,实际测定了香蕉、西红柿等样品中的VC的含量,检出限为0.2791g/mL,加标回收率在97.16%~100.18%之间 。3高效液相色谱法前面介绍的方法由于在使用中有一定的限制,操作复杂、前处理较麻烦。因此在使用中有较大的局限性,目的已逐渐被高效液相色谱法所取代。HPLC法具有检测速度快、操作简单、实验结果可靠等特点。 王艳颖,姜国斌等采用HYPERSIL-C8fz谱柱、浓度0.1%的草酸作流动相的高效液相色谱法,分析了草莓中的维生素c含量,取得了理想的效果。HPLC检测条件如下: 流动相0.1%草酸溶液,流速1.0 mL/min;检测波长254 nm,进样量5µL,柱箱温度3O℃。该方法分析中受样品中其他杂质的影响较小。测定草莓中维生素C的含量,回收率为97.4%~102.1%,说明该方法具有所需试剂少、稳定、操作简便等特点。精密度实验的相对标准偏差小于3%,说明该方法重复性和再现性都是比较高的。 陈昌云等采用0.05 mol/L磷酸二氢钾缓冲液:甲醇=80:20(v/v)作流动相。流速为1.0 mL/min,二极管阵列检测器,检测波长为254 nm。测定蜜柚中维生素C含量在质量浓度为20~100mg/L范围内有良好的线性关系,方法回收率为92.4%~107.5%,相对标准偏差小于2%。4 结语测定维生素C含量方法很多,各种方法各有优缺点,因为维生素C自身的不稳定,导致了很多方法测定结果误差较大,所以对维生素C稳定存在条件的探索非常重要。高效液相色谱法因为测定较准确、灵敏度高、选择性好,有较好的发展前景,是目前发展较快的一种方法。
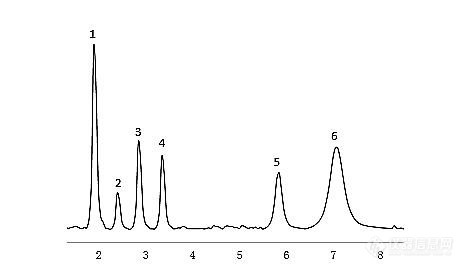
[b][font=宋体]解答:[/font][/b][font=宋体]维生素主要分为水溶性维生素和脂溶性维生素两大类,基本都可以用液相色谱法检测,下面分别进行介绍。[/font][font=宋体]([/font]1[font=宋体])水溶性维生素的检测[/font][font=宋体]由于水溶性维生素(主要是[/font]B[font=宋体]族维生素和维生素[/font]C[font=宋体])易溶于水,极性较强,很难直接在如[/font]C[sub]18[/sub][font=宋体]等反相柱上保留。因此该类物质分析一般有两种方式:一是用含[/font]NH[sub]2[/sub][font=宋体]等极性键合相的正相色谱柱,如图[/font]6-24[font=宋体]的[/font]HILLIC[font=宋体]模式;二是在反相色谱(如[/font]C[sub]18[/sub][font=宋体]、[/font]C[sub]8[/sub][font=宋体]等)流动相中添加离子对缓冲试剂(如[/font]Na[sub]3[/sub]PO[sub]4[/sub][font=宋体]、[/font]KH[sub]2[/sub]PO[sub]4[/sub][font=宋体]、己烷磺酸盐等)增加其保留时间,见图[/font]6-25[font=宋体]。[/font][align=center][img=,465,269]https://ng1.17img.cn/bbsfiles/images/2021/03/202103231425192145_3285_3389662_3.jpg!w465x269.jpg[/img][/align][align=center][i][font=宋体]图[/font]6-24 HILIC[font=宋体]模式色谱柱分离水溶性维生素的色谱图[/font][/i][/align][align=center][i]1—[font=宋体]烟酰胺;[/font]2—[font=宋体]维生素[/font]B[sub]7[/sub][font=宋体];[/font]3—[font=宋体]维生素[/font]B[sub]6[/sub][font=宋体];[/font]4—[font=宋体]维生素[/font]C[font=宋体];[/font]5—[font=宋体]维生素[/font]B[sub]12[/sub][font=宋体];[/font]6—[font=宋体]维生素[/font]B[sub]1[/sub][/i][/align][align=center][img=,428,242]https://ng1.17img.cn/bbsfiles/images/2021/03/202103231425367458_9741_3389662_3.jpg!w428x242.jpg[/img][/align][align=center][i][font=宋体]图[/font]6-25 C18[font=宋体]柱分离水溶性维生素色谱图[/font][/i][/align][align=center][i]1—[font=宋体]维生素[/font]B[sub]1[/sub][font=宋体];[/font]2—[font=宋体]维生素[/font]C[font=宋体];[/font]3—[font=宋体]烟酸;[/font]4—[font=宋体]维生素[/font]B[sub]6[/sub][font=宋体];[/font]5—[font=宋体]泛酸;[/font]6—[font=宋体]叶酸;[/font]7—[font=宋体]维生素[/font]B[sub]12[/sub][font=宋体];[/font]8—[font=宋体]维生素[/font]B[sub]2[/sub][/i][/align][font=宋体]([/font]2[font=宋体])脂溶性维生素的[/font]HPLC[font=宋体]检测[/font][font=宋体]脂溶性维生素(维生素[/font]A[font=宋体]、[/font]D[font=宋体]、[/font]E[font=宋体]等)极性较弱,可以直接用[/font]C[sub]18[/sub][font=宋体]、[/font]C[sub]8[/sub][font=宋体]等反相色谱柱分离。需要注意的是,维生素[/font]E[font=宋体](生育酚)共有[/font]α[font=宋体]、[/font]β[font=宋体]、[/font]γ[font=宋体]、[/font]δ[font=宋体]四种结构类型,[/font]C[sub]18[/sub][font=宋体]等反相柱很难将这四种完全分开,而硅胶、二醇基([/font]Diol[font=宋体])等正相柱能很好地分离这四种结构,见图[/font]6-26[font=宋体]。[/font][align=center][img=,403,187]https://ng1.17img.cn/bbsfiles/images/2021/03/202103231425477785_8072_3389662_3.jpg!w403x187.jpg[/img][/align][align=center][i][font=宋体]图[/font]6-26[font=宋体]维生素[/font]E[font=宋体]在二醇基色谱柱上的色谱图[/font][/i][/align][align=center][i]1—α-[font=宋体]维生素[/font]E[font=宋体];[/font]2—β-[font=宋体]维生素[/font]E[font=宋体];[/font]3—γ-[font=宋体]维生素[/font]E[font=宋体];[/font]4—δ-[font=宋体]维生素[/font]E[/i][/align][font='微软雅黑','sans-serif'][color=black][back=white]领取更多《实战宝典》请进:[url]http://instrument-vip.mikecrm.com/2bbmrpI[/url][/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white] [/back][/color][/font]
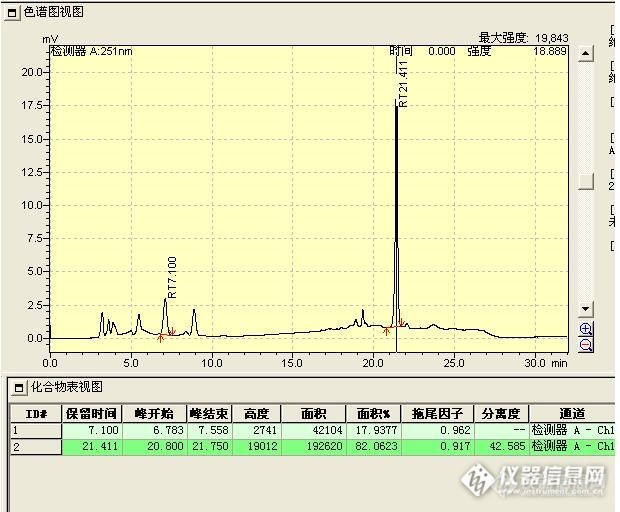
前段时间拿到一个饲料样品,要检测饲料中维生素A和维生素K3,看标准两者用的流动相都是甲醇-水,第一反映就是不是可以梯度洗脱同时测定两个成分,采用定时变换检测波长的方法实现检测。结果很失败,在此分享一下分析过程。 先看标准方法: GB/T 17817-2010 饲料中维生素A的测定 高效液相色谱法[img=,682,136]http://ng1.17img.cn/bbsfiles/images/2017/09/201709292030_01_1638724_3.png[/img][img=,690,336]http://ng1.17img.cn/bbsfiles/images/2017/09/201709292030_02_1638724_3.png[/img] GB/T 7294-2009 饲料添加剂亚硫酸氢钠甲萘醌(维生素K3)[img=,690,506]http://ng1.17img.cn/bbsfiles/images/2017/09/201709292024_01_1638724_3.png[/img] GB/T 18872-2002 饲料中维生素K3的测定 高效液相色谱法 维生素K3的检测原理是在碱性条件下,水溶性的亚硫酸氢钠甲萘醌脱去亚硫酸氢钠生成脂溶性的甲萘醌,用三氯甲烷萃取,吸取适量经甲醇稀释后上机检测。[img=,680,508]http://ng1.17img.cn/bbsfiles/images/2017/09/201709292025_01_1638724_3.png[/img]一、第一次实验:按标准维生素K3的提取过程太麻烦了,且三氯甲烷并不是随便可以买到,那能不能像维生素A一样直接甲醇提取后检测?1、查维生素K3(亚硫酸氢钠甲萘醌)理化特性:易溶于水和热乙醇,难溶于冰乙醇,不溶于苯和乙醚,水溶液PH4.7-7.常温下稳定,遇光易分解。看下面的结构式:[img=,247,199]http://ng1.17img.cn/bbsfiles/images/2017/09/201709292009_01_1638724_3.png[/img]看性质肯定可以溶解在90%甲醇-水里,取亚硫酸氢钠甲萘醌适量,在棕色容量瓶中90%甲醇溶解后上机检测。2、结果出峰极快,受亚硫酸根强极性基团的影响,维生素K3在反相色谱上完全不保留且峰形很差,说明不能直接提取后上机检测,第一次以失败告终。[img]http://ng1.17img.cn/bbsfiles/images/2017/09/201709081927_01_1638724_3.jpg[/img]二、第二次实验:老实的按标准方法(GB/T 18872-2002 饲料中维生素K3的测定 高效液相色谱法)?显然不好,还是不能同时测定维生素A和维生素K3,能不能碱性条件下脱亚硫酸氢钠后纯甲醇提取后上机检测呢?1、由于维生素A的提取方法是65度纯甲醇超声提取30分钟,那么就先取适量维生素A和维生素K3置100mL棕色容量瓶中,由于手上没有氢氧化铵,所以加入5mL碳酸钠溶液代替,加入后超声振摇1min,即有白色沉淀析出(可能是碳酸钠与甲萘醌的混合物),立即加入80mL甲醇,65度超声提取30分钟,过滤取,取滤液稀释至合适浓度上机检测。2、结果几乎无甲萘醌峰出现,观察提取液的颜色,基本可以确定是甲萘醌都氧化成了[color=#cc0000]羟基苯醌[/color]。如下呈褐色的滤液。第二次失败。[img=,602,337]http://ng1.17img.cn/bbsfiles/images/2017/09/201709292059_01_1638724_3.png[/img] 还有一个原因是用甲醇提取与用三氯甲烷提取有明显的区别,是甲醇与碳酸钠溶液是有一定互溶性的,而三氯甲烷与碳酸钠溶液不互溶。甲醇的碳酸钠溶液可能也会促进甲萘醌的破坏。三、第三次实验1、实验方法:维生素A与维生素K3分别按标准方法提取,再吸取甲萘醌的三氯甲烷溶液适量置提取好的维生素A提取液中,混匀,上机检测,梯度洗脱程序如下:[img=,509,384]http://ng1.17img.cn/bbsfiles/images/2017/09/201709292142_01_1638724_3.png[/img]2、结果甲萘醌与维生素A可以实现分离与同时检测,但每针的分析时间太长,与分别单独检测维生素A与维生素K3,每针分析时间只要10分钟相比,没有优势,如果还要同时分析维生素D与维生素E的话,分析时间就会更长,另外也有可能存在提取维生素A时有少量甲萘醌生成,造成结果偏高的误差。其它实验证明维生素A、D、E可能在98%甲醇下同时分析。至此,第三次实验也算失败。[img=,620,512]http://ng1.17img.cn/bbsfiles/images/2017/09/201709300842_01_1638724_3.jpg[/img] 维生素K3(7.1min)与维生素A(21.4min)同时检测图谱[img=,581,500]http://ng1.17img.cn/bbsfiles/images/2017/09/201709300842_02_1638724_3.jpg[/img] 维生素A样品图谱(98%甲醇等度洗脱)[img=,588,492]http://ng1.17img.cn/bbsfiles/images/2017/09/201709300842_03_1638724_3.jpg[/img] 维生素K3样品图谱(80%甲醇等度洗脱) 综上,本次最终还是选择按标准方法分别检测维生素A与维生素K3,在检测维生素K3由标准方法的旋转振荡器改为普通摇床振荡。这次的经验告诉我,要改进方法真的不容易,进行方法开发前一定要充分了解待测组分的理化性质,充分理解参考文献的检测原理与注意事项。看到亚硫酸根有没有人会考虑使用离子对试剂四丁基氢氧化铵和四丁基溴化铵的,估计也是不行的,碱性条件下会水解。
有液相色谱测定维生素的方法吗,奶粉和饼干的前处理方法
求GB/T 17817-2010 饲料中维生素A的测定 高效液相色谱法
有谁用液相做过维生素A含量的测定吗?好做不?回收率有多少?我做的标准曲线的相关系数只有两个9.