[b]1、鸡肉和鸡蛋中氟喹诺酮残留检测方法 液相色谱—质谱/质谱法(中国农业科学院农业质量标准与检测技术研究所自建方法);2、磺胺类药物在动物可食性组织中残留的高效液相色谱检测方法(参见农质发〔2014〕5号文件附录)[/b]
各位老师,想请教个液相质谱残留的问题:进完待测物后,空白一直有待测物的响应而且很高,连续进空白,残留也没有明显改善,跪求解答,谢谢

液相色谱-串联质谱条件测定水果中的多农药残留方法优化本法建立了水果多种农药残留量的快速、简便、准确的测定方法,通过对样品前处理方法、仪器检测方法的考察优化,建立液相色谱-串联质谱检测方法。其中以日本制定的“肯定列表”中的“一律标准”最为严格,限量为 0.01mg/kg,而我国的残留限量标准还不够完善,很多农药还没有制定限量标准,其方法的测定低限(定量限)能达到 0.01mg/kg的要求。1、液相色谱条件考察:在方法建立过程中对液相色谱条件进行了考察,主要考察了色谱柱、流动相等。在色谱柱选择时,比较了BEH C18、 HSS T3、 Zorbax Eclipse Plus C18等色谱柱,发现HSS T3色谱柱对甲胺磷、乙酰甲胺磷等大极性农药的色谱保留效果较好,所以选择HSS T3色谱柱进行下一步的研究。在流动相考察时,发现在流动相中加入0.1%的甲酸可以改善多菌灵、噻菌灵等农药的分离,而且加入甲酸可以在电喷雾正离子( ESI+)模式电离时提供H+,提高电离效果,所以选择在流动相中加入0.1%的甲酸,比较了在水相和有机相中均加入0.1%的甲酸、仅在水相中加入0.1%的甲酸两种情况,发现色谱分离及质谱电离无显著差别,为简化操作和便于使用,选择仅在水相中加入0.1%的甲酸。流动相的有机相选择时考察了甲醇、甲醇-乙腈( 1+1, V/V)、乙腈三种情况,发现采用乙腈时色谱柱的柱压较低,色谱分离也较好,但毒死蜱、辛硫磷、特丁硫磷、敌敌畏等常用有机磷农药的质谱响应值低、重现性差,而选用甲醇时可以显著提高这些化合物的质谱响应及重现性,综合考虑后选择甲醇为流动相的有机相。由于此次分析的多农药的化学性质差别较大,从高极性到低极性均有分布,所以色谱分离时需要采用梯度洗脱模式,通过实验考察,最终确的液相色谱条件如下:a)色谱柱: HSS T3柱,长100 mm,内径2.1 mm,粒径1.8 μm,或相当者; b) 流动相:甲醇-0.1%甲酸溶液梯度洗脱,参见表 1。 https://ng1.17img.cn/bbsfiles/images/2020/09/202009211516176216_1219_2166779_3.png!w607x264.jpgc) 柱温: 35 ºC
SNT 2316-2009 动物源性食品中阿散酸、硝苯砷酸、洛克沙砷残留联的检测方法 液相色谱-电感耦合等离子体 质谱法
GB/T 23412-2009 蜂蜜中19种喹诺酮类药物残留量的测定方法 液相色谱-质谱/质谱法2009-03-28发布,2009-07-01实施,现行有效。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=176991]GB∕T 23412-2009 蜂蜜中19种喹诺酮类药物残留量的测定方法 液相色谱-质谱∕质谱法.pdf[/url]
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=152822]液相色谱-质谱法测定土壤和甘蓝中的虫酰肼残留[/url]摘要:建立了分散固相萃取一液相色谱一电喷雾质谱联用方法定量检测土壤和甘蓝中虫酰肼残留量。应用分散固相萃取方法进行前处理,即以乙二胺一N一丙基硅烷(PSA)为吸附剂,乙腈为萃取溶剂,实现样品快速制备:在Zorbax Eclipse XDB—C18色谱柱上。以0.1% 乙酸水一乙腈溶液(50/50.V/v)为流动相。采用电喷雾质谱检测器.选择离子监测模式,以m/z 297为检测定量离子。虫酰肼保留时间在15 min左右.线性范围为0.01~2O g ,相关系数为0.999 5,添加浓度为0.02,0.20,2.00mgL一 时,土壤和甘蓝中虫酰肼的平均添加回收率在90.5% 103.0%之间,相对标准偏差(RSD,n=5)在1.2% 8.0%之间,最低检测浓度为0.02mgkg~。该方法灵敏、准确、可靠,定量范围宽,耐用性强,可作为土壤和甘蓝中虫酰肼残留的可靠检测方法。
正在做一个多磺胺,喹诺酮,四环素,的多残留检测. 遇到多个问题,提取效率不高.第二个基质抑制效应明显, 四环空白有干扰.老师让通过改进提取方法,解决问题,我认为应该通过液相色谱解决问题,我想请问一下,建立兽药多残留检测方法,用液质,标准品是否应该分开,如果不分开,是否存在标准品间的干扰? 基质干扰是否应该去除?
SNT 2317-2009 进出口动物源性食品中哌嗪残留量检测方法 液相色谱-质谱 质谱法
SNT 2325-2009 进出口食品中四唑嘧磺隆、甲基苯苏呋安、醚磺隆等45种农药残留量的检测方法 高效液相色谱-质谱 质谱法
SNT 2325-2009 进出口食品中四唑嘧磺隆、甲基苯苏呋安、醚磺隆等45种农药残留量的检测方法 高效液相色谱-质谱 质谱法
SNT 2323-2009 进出口食品中蚍虫胺、呋虫胺等20种农药残留量检测方法 液相色谱-质谱 质谱法
各位大神,单位新买的液相质谱,头为省钱让自己做抗生素残留检测http://simg.instrument.com.cn/bbs/images/default/em09509.gif现有这样的疑问,文献中已有的离子对,碰撞能量等参数能直接用吗?还是必须要针对这个仪器重新做?如果要重新做的话,几类不同的抗生素(四环素类,喹诺酮类,大环内酯类等)能混到一起,用蠕动泵打进质谱分别扫吗?还是必须一种一种单独来?仪器型号:Thermo LTQ XL;离子阱质谱谢谢各位了!!
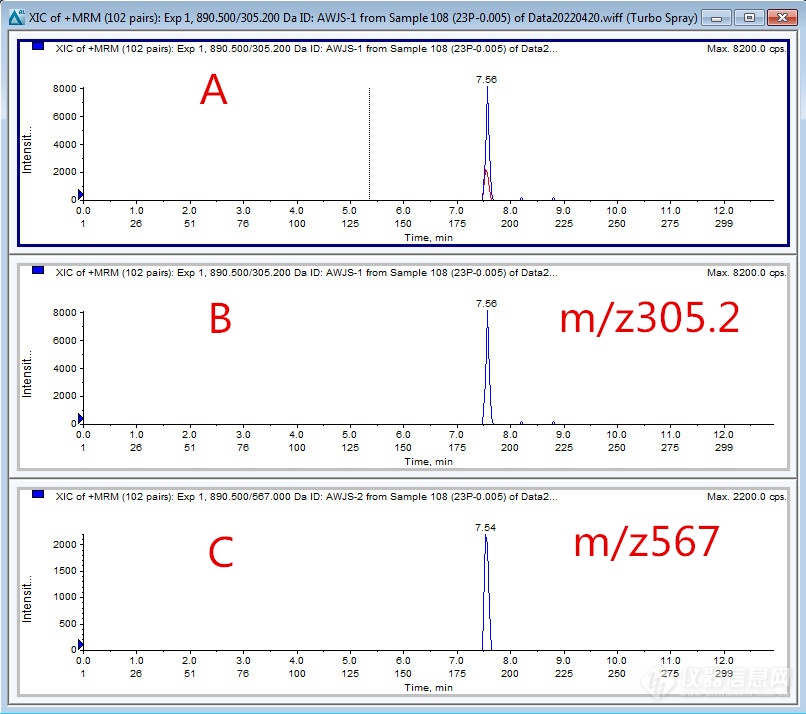
[align=center][size=24px]超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱检测农产品中阿维菌素残留方法研究[/size][/align][align=center][size=18px]鹤壁市农产品检验检测中心 张艳丽[font=宋体] 王丽娟[/font][/size][/align][align=left] 阿维菌素是一种新型类广谱性杀虫杀螨剂,由阿维链霉素经液体发酵加工而成,具有高效、广谱、有效期长、不易产生抗药性等特点,已经作为高毒有机磷农药的替代品而广泛应用。目前阿维菌素已广泛用于要水果样品中果树(苹果、梨、桃)、蔬菜(黄瓜、番茄)有害生物的防治,GB 2763-2021《食品安全国家标准 食品中农药最大残留限量》中阿维菌素的残留限量(MRL)要求很高,规定其在柑桔、梨和黄瓜中的MRL为0.02mg/kg,叶菜和豆中为0.05mg/kg。目前阿维菌素的检测方法主要有高效液相色谱法(HPLC)[sup][1-5][/sup]、酶联免疫法(ELISA)、液质联用仪法(LC-MS)[sup][6-10][/sup]等。近几年液相色谱质谱法应用日益广泛,它可以提高目标物质的灵敏度以及回收率,缩短进样时间,提高检测效率。但在实际工作中,阿维菌素的响应值低、灵敏度低、标准曲线线性差等问题一直存在,本文应用超高效液相色谱-串联质谱仪(UPLC-MS/MS),对阿维菌素的检测条件进行色谱、质谱条件的优化,可以在检测农产品中阿维菌素时,得到快速、准确的检测方法。[/align]1 实验部分1.1 仪器与试剂AB Sciex4500高效液相色谱-串联质谱仪(配有电喷雾电离(ESI)源,美国AB SCIEX公司);GL-21M高速冷冻离心机(湖南湘仪);混匀器(德国heidolph公司);涡旋混匀器(德国IKA公司)。阿维菌素(100ug/mL)甲醇作为溶剂,购于农业部环境保护科研监测所;乙腈(HPLC级,上海安谱公司);甲醇(HPLC级,美国Merck公司)。甲酸(LCMS,美国Fisher公司);甲酸铵(LCMS,美国Fisher公司);十八烷基键合硅胶(C18)、N-丙基乙二胺(PSA)、无水MgSO[sub]4 [/sub][font=calibri]、[/font]NaCL均为分析纯(深圳逗点生物)。1.2 标准溶液的配置精确称取一定量的阿维菌素标液,用甲醇溶解后定容,配制成2.0ug/mL贮备溶液,于-20℃避光储存。1.3前处理方法称取10g(精确至0.01g)试样于50mL塑料离心管中,加人10mL乙腈及1颗陶瓷均质子,剧烈振荡1min.加人4g无水硫酸镁、1g氯化钠、1g柠檬酸钠二水合物、0.5g柠檬酸二钠盐倍半水合物,剧烈振荡1min后4200r/min离心5min。吸取8mL上清液至内含除水剂和净化材料的塑料离心管中 对于颜色较深的试样,离心管中另加人GCB,涡旋混匀1min。4200r/min离心5min,吸取上清液过0.22μm有机微孔滤膜后上机测定。1.4 仪器条件条件1.4.1色谱条件色谱柱:Altantis T3柱(150mm×2.1mm,3.0μm);柱温:40℃;流动相:A相为水(含0.01%甲酸(v/v)和1mM/L甲酸铵),B相为甲醇(含0.005%甲酸(v/v)和2mM/L甲酸铵)。柱流速为0.40mL/min。梯度洗脱程序:0~2.0min,90%A;5.0~12min,5%A;12.1~13min,90%A;流速:0.4mL/min;进样量:1μL。1.4.2质谱条件离子源:ESI;扫描方式:正离子扫描;扫描方式:多反应监测(MRM)模式;电喷雾电压:4500V;雾化气压力:50psi;气帘气压力:30psi;辅助加热气:60psi;离子源温度:300℃;碰撞气压力:9psi。2 结果与讨论2.1样品前处理的优化本实验采用GB23200.121《食品安全国家标准植物源性食品中331种农药及其代谢物残留量的测定 液相色谱-质谱联用法》,以乙腈作为提取溶剂,将目标物质、色素等有机物质提出,然后采用饱和盐进行层析分层,用吸附剂进行净化。2.2色谱条件的优化2.2.1色谱柱选择分别用Shimadzu C18(75mmx2.0m,1.6μm)、Agilent EC-C18(100mmx3.0m,2.7μm)、Altlantis T3(150mm×2.1mm,3μm)等3种液相色谱柱对阿维菌素进行响应值与分离效果的比对,所有色谱柱均能出峰,但采用Altlantis T3和Shimadzu C18色谱柱时峰形对称性好,半峰宽窄、且出峰时间相同,但采用Altlantis T3色谱柱时峰面积明显高于Shimadzu C18色谱柱。因此最终选择Altlantis T3色谱柱进行分离。2.2.2流动相选择流动相条件是影响目标化合物的色谱分离和仪器响应的一个重要方面,根据阿维菌素的性质,比较了甲醇和乙腈两种有机相,结果表明,甲醇是质子性溶剂,更易离子化,[M+NH[sub]4[/sub]][sup]+[/sup]峰的响应值要高于乙腈流动相,所以在本实验中选用甲醇和水作为流动相。在水相中加入甲酸铵和甲酸等试剂,是改善色谱峰形、提高仪器响应值和离子化率的常用手段,通常采用酸性流动相有利于在正离子模式下进行质谱检测,试验考察了不同浓度的甲酸与甲酸铵溶液与甲醇组合,发现随着甲酸铵浓度含量增大,阿维菌素的响应值也在增强,若甲酸铵浓度超过2mmol/L时,响应值开始降低。因此,最终选择0.005%甲酸加2mmol/L甲酸铵作为水相。优化后的液相条件下,可得到标准图谱如图1。[align=center][img=,690,611]https://ng1.17img.cn/bbsfiles/images/2022/09/202209011806214247_4665_1645480_3.png!w690x611.jpg[/img][/align] 图1 阿维菌素标液的MRM总离子及选择离子的离子流色谱图(10μg/L)2.3质谱条件的选择2.3.1检测离子的选择阿维菌素的分子式是C[sub]48[/sub]H[sub]72[/sub]O[sub]14[/sub],理论分子量为872.4921。采用母离子扫描(MS Scan),获得一级质谱图,通过分子质量确定阿维菌素多以加合离子[M+NH[sub]4[/sub]][sup]+[/sup]、[M+Na][sup]+[/sup]、[M+H][sup]+[/sup]形式存在,本实验选择离子丰度极强的[M+NH[sub]4[/sub]][sup]+[/sup](m/z890.5)作为母离子。然后,优化毛细管电压等参数,使母离子强度达到最高。选择母离子后,进行子离子扫描(Daughter Scan),获得二级质谱图,得到305.2、567和145.1。进行MRM多反应监测扫描,再次优化碰撞能量,使其离子化效率达到最佳。最终,本实验选择丰度最强、受干扰小的890.5/567作为定性离子对,而890.5/305.2作为定量离子对。阿维菌素检测的质谱参数见表1。 表1 阿维菌素检测的质谱条件[table][tr][td][align=center][color=black]化合物[/color][/align][/td][td][align=center][color=black]母离子/[/color][/align][align=center][color=black](m/z)[/color][/align][/td][td][align=center][color=black]保留时间/min[/color][/align][/td][td][align=center][color=black]产物离子/(m/z)[/color][/align][/td][td][align=center][color=black]碰撞能量/eV[/color][/align][/td][td][align=center][color=black]去簇电压/V[/color][/align][/td][/tr][tr][td][align=center][color=black]阿维菌素[/color][/align][/td][td][align=center][color=black]890.5[/color][/align][/td][td][align=center][color=black]7.56[/color][/align][/td][td][align=center][color=black]305.2[/color][/align][/td][td][align=center][color=black]32[/color][/align][/td][td][align=center][color=black]65[/color][/align][/td][/tr][tr][td] [/td][td] [/td][td] [/td][td][align=center][color=black]567[/color][/align][/td][td][align=center][color=black]19[/color][/align][/td][td][align=center][color=black]65[/color][/align][/td][/tr][/table]2.3.2离子源温度的选择考察了电喷雾离子源(ESI[sup]+[/sup])对阿维菌素的灵敏度影响,结果表明:ESI[sup]+[/sup]源受离子源温度影响比较明显,阿维菌素用的[M+NH4][sup]+[/sup]峰作母离子,温度过高或过低都会抑制目标物离子化,分别用300℃、350℃、400℃离子源温度作了试验,由表2可知:随着离子源温度的升高,响应值越低,当离子源温度为300℃时,灵敏度最高。表2 不同离子源温度的灵敏度[table][tr][td][align=center][color=black]化合物[/color][/align][/td][td][align=center][color=black]母离子/[/color][/align][align=center][color=black](m/z)[/color][/align][/td][td][align=center][color=black]保留时间/min[/color][/align][/td][td][align=center][color=black]产物离子/(m/z)[/color][/align][/td][td][align=center][color=black]离子源温度/℃[/color][/align][/td][td][align=center][color=black]响应强度/%[/color][/align][/td][/tr][tr][td][align=center][color=black]阿维菌素[/color][/align][/td][td][align=center][color=black]890.5[/color][/align][/td][td][align=center][color=black]7.56[/color][/align][/td][td][align=center][color=black]305.2[/color][/align][/td][td][align=center][color=black]300[/color][/align][/td][td][align=center][color=black]3.1e[/color][sup][color=black]4[/color][/sup][/align][/td][/tr][tr][td] [/td][td] [/td][td] [/td][td][align=center][color=black]567[/color][/align][/td][td] [/td][td][align=center][color=black]1.1e[/color][sup][color=black]4[/color][/sup][/align][/td][/tr][tr][td][align=center][color=black]阿维菌素[/color][/align][/td][td][align=center][color=black]890.5[/color][/align][/td][td][align=center][color=black]7.56[/color][/align][/td][td][align=center][color=black]305.2[/color][/align][/td][td][align=center][color=black]350[/color][/align][/td][td][align=center][color=black]2.1e[/color][sup][color=black]4[/color][/sup][/align][/td][/tr][tr][td] [/td][td] [/td][td] [/td][td][align=center][color=black]567[/color][/align][/td][td] [/td][td][align=center][color=black]6000[/color][/align][/td][/tr][tr][td][align=center][color=black]阿维菌素[/color][/align][/td][td][align=center][color=black]890.5[/color][/align][/td][td][align=center][color=black]7.56[/color][/align][/td][td][align=center][color=black]305.2[/color][/align][/td][td][align=center][color=black]400[/color][/align][/td][td][align=center][color=black]2.0e[/color][sup][color=black]4[/color][/sup][/align][/td][/tr][tr][td] [/td][td] [/td][td] [/td][td][align=center][color=black]567[/color][/align][/td][td] [/td][td][align=center][color=black]5000[/color][/align][/td][/tr][/table]2.4标准曲线、线性范围及检出限分别用甲醇配制含量分别为0.005mg/L、0.01mg/L、0.05mg/L、0.1mg/L、0.2mg/L的阿维菌素标准溶液,在上述实验条件下进样1.0μL,以峰面积为纵坐标,浓度为横坐标绘制线性关系曲线,结果表明阿维菌素标准溶液与相对应峰面积呈现良好的线性关系,其线性回归方程:A=6.82989e6+11635.39890,R=0.99913。按上述样品前处理方法及液相色谱检测条件分析得出阿维菌素在农产品样品中的定量限为0.01mg/kg。2.5方法准确度及精密度选取不同的果蔬、食用菌等农产品,进行添加水平为0.01mg/kg、0.05mg/kg、0.10mg/kg等加标回收试验,添加回收率为80%[font=宋体]~[/font]102.5%,RSD1.5[font=宋体]~[/font]8.5%,见表3,其结果满足农药残留检测回收率和相对标准偏差的分析要求。表3 不同农产品样品中阿维菌素添加回收测定结果(n=3)[table][tr][td=1,2][align=center][color=black]样品名称[/color][/align][/td][td=2,1][align=center][color=black]0.01mg/kg[/color][/align][/td][td=2,1][align=center][color=black]0.05mg/kg[/color][/align][/td][td=2,1][align=center][color=black]0.10mg/kg[/color][/align][/td][/tr][tr][td][color=black]回收率/(%)[/color][/td][td][align=center][color=black]RSD/(%)[/color][/align][/td][td][align=center][color=black]回收率/(%)[/color][/align][/td][td][align=center][color=black]RSD/(%)[/color][/align][/td][td][color=black]回收率/(%)[/color][/td][td][align=center][color=black]RSD/(%)[/color][/align][/td][/tr][tr][td][align=center][color=black]西葫芦[/color][/align][/td][td][align=center][color=black]85.6[/color][/align][/td][td][align=center][color=black]5.1[/color][/align][/td][td][align=center][color=black]89.5[/color][/align][/td][td][align=center][color=black]6.0[/color][/align][/td][td][align=center][color=black]91.4[/color][/align][/td][td][align=center][color=black]1.5[/color][/align][/td][/tr][tr][td][align=center][color=black]西红柿[/color][/align][/td][td][align=center][color=black]92.5[/color][/align][/td][td][align=center][color=black]3.5[/color][/align][/td][td][align=center][color=black]94.6[/color][/align][/td][td][align=center][color=black]2.2[/color][/align][/td][td][align=center][color=black]98.1[/color][/align][/td][td][align=center][color=black]3.4[/color][/align][/td][/tr][tr][td][align=center][color=black]芹菜[/color][/align][/td][td][align=center][color=black]90.1[/color][/align][/td][td][align=center][color=black]4.3[/color][/align][/td][td][align=center][color=black]92.1[/color][/align][/td][td][align=center][color=black]5.6[/color][/align][/td][td][align=center][color=black]102.5[/color][/align][/td][td][align=center][color=black]7.8[/color][/align][/td][/tr][tr][td][align=center][color=black]桔子[/color][/align][/td][td][align=center][color=black]86.1[/color][/align][/td][td][align=center][color=black]6.5[/color][/align][/td][td][align=center][color=black]90.3[/color][/align][/td][td][align=center][color=black]7.1[/color][/align][/td][td][align=center][color=black]92.9[/color][/align][/td][td][align=center][color=black]5.9[/color][/align][/td][/tr][tr][td][align=center][color=black]苹果[/color][/align][/td][td][align=center][color=black]82.3[/color][/align][/td][td][align=center][color=black]5.8[/color][/align][/td][td][align=center][color=black]87.8[/color][/align][/td][td][align=center][color=black]4.6[/color][/align][/td][td][align=center][color=black]90.1[/color][/align][/td][td][align=center][color=black]2.2[/color][/align][/td][/tr][tr][td][align=center][color=black]葡萄[/color][/align][/td][td][align=center][color=black]95.4[/color][/align][/td][td][align=center][color=black]3.6[/color][/align][/td][td][align=center][color=black]95.8[/color][/align][/td][td][align=center][color=black]2.0[/color][/align][/td][td][align=center][color=black]91.8[/color][/align][/td][td][align=center][color=black]7.9[/color][/align][/td][/tr][/table]3结论本研究对液相质谱法检测农产品中阿维菌素残留的仪器条件,进行了优化,解决了阿维菌素检出限高、灵敏度低、标准曲线线性差等问题,优化后的仪器条件方法检出限符合标准要求,阿维菌素的灵敏度高,在浓度0.005mg/L[font=宋体]~[/font]0.20mg/L范围内有良好的线性关系;添加回收率和相对标准偏差均符合分析的要求,是比较理想的阿维菌素残留量的分析方法。参考文献:[1]李晶,董丰收,刘新刚.高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]检测梨中阿维菌素残留方法研究[J]. 农药科学与管理,2008,29(2):17-22.[2]谢显传,张少华,王冬生等.柱前行生高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法测定果蔬产品阿维菌素及其有毒代谢物的残留量[J].中国农业科学,2005,38(11):2254-2260.[3]梁振益,李嘉诚,罗盛旭,等.高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法检测水果中阿维菌素残留量[J].现代农药,2005,4(4):20-22.[4]张儒令,安凤颖,胡德禹,等.高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法检测菜豆中阿维菌素残留量[J].现代农业科技,2020(06):106-108.[5]刘桂伶,李婷婷.高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法检测8种果蔬中阿维菌素残留量的分析方法[J].新疆农业科技,2020(01):38-39.[6]李增梅,邓立刚,赵涉及.超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]串联质谱法测定苹果和土壤中阿维菌素的残留量[J].分析化学,2010,(10):1505-1509.[7]林涛,邵金良,刘兴勇,等.QuEChERS-超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱测定蔬菜中41种农药残留[J].色谱,2015,33(3):235-241.[8]王连珠,黄小燕,陈游,等.QuEChERS前处理-[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱测定果蔬中18种弱酸性农药残留[J].分析测试学报,2014,33(10):1102-1108.[9]李欣,孙素群,张卫锋,等.QuEChERS-[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱测定蔬菜中56种农药残留[J].现代食品科技,2017,33(10):245-253,177.[10]李瑞雪,王晶蕾,龚慧.超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱测定蔬菜水果中阿维菌素残留量[J].现代食品,2020,(22):180-182,189.
使用[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]检测样品,样品进样后峰面积逐渐增大,连续进样10多针,前几针峰面积增长速度较快,后几针增长速度较慢。进样后进空白溶剂,空白溶剂中有较大的样品峰,连续进空白,峰在逐渐减小。所检测的样品是一个分子量为1万左右的聚合物。请大佬帮忙分析一下引起此吸附残留的原因,以及有什么办法可以消除此吸附。另外补充一点,经过排查,该样品残留在[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]系统中各个部位,包括进样器和色谱柱。
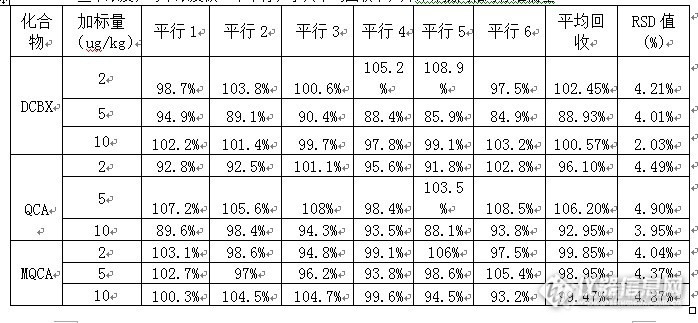
液相色谱串联质谱法测定动物组织中卡巴氧和喹乙醇代谢物残留量 摘要:采用高效液相色谱-电喷雾串联质谱仪(LC-ESI-MS-MS),建立了猪肉中卡巴氧代谢物脱氧卡巴氧、喹恶啉-2-羧酸和喹乙醇代谢物3-甲基喹恶啉-2-羧酸残留量的药物残留的检测方法,样品用甲酸溶液消化,蛋白酶水解,盐酸酸化,离心过滤后,过Oasis MAX固相萃取住或相当者净化。先用二氯甲烷洗脱脱氧卡巴氧,再用%甲酸乙酸乙酯溶液洗脱喹恶啉-2-羧酸和3-甲基喹恶啉-2-羧酸,氮气吹干洗脱液,残渣用甲酸+甲醇(19+1)溶液溶解,样液供液相色谱-串联质谱仪测定,内标法定量。本方法采用了2ug/kg,5ug/kg,10ug/kg,3个添加浓度,每个浓度6个平行样品,上述3种药物残留的回收率在80%~110%,相对偏差在2.03%~4.94%。关键词:液相色谱串联质谱法;脱氧卡巴氧;喹恶啉-2-羧酸;3-甲基喹恶啉-2-羧酸。1 引言卡巴氧(Carbadox) 和喹乙醇(Olaquindox) 同属喹喔啉类化合物 , 该类药物具有显著的促进动物生长的作用 , 用作猪等养殖动物的饲料添加剂。二者本身具有潜在的致畸变、致癌作用 , 其代谢物也可能带来健康风险。因此许多国家将以卡巴氧和喹乙醇列为对食用动物禁用或限用的药物 , 欧盟、中国、日本、美国、澳大利亚等对二者在动物组织内迅速代谢而产生的相应的代谢产物喹喔啉-2-羧酸(QCA)和 3-甲基喹喔啉-2-羧酸(MQ-CA)制定了残留监控的限量标准。在动物体内,喹乙醇和卡巴氧、经脱单氧、脱双氧后主要生成脱氧卡巴氧、喹恶啉-2-羧酸、3-甲基喹恶啉-2-羧酸,相对应的代谢物比较稳定,通常作为残留分析和监控的目标物质,代谢途径见图1。鉴于喹乙醇和卡巴氧的毒性和潜在的危害,为了更好的对动物食品进行监控,本文旨在建立喹乙醇、卡巴氧代谢物的残留液质联用仪检测方法。 http://ng1.17img.cn/bbsfiles/images/2013/10/201310242215_472741_2082444_3.jpg2 实验部分1.1仪器与试剂1.1.1试剂和材料甲醇:德国默克,色谱纯。乙腈:德国默克,色谱纯;乙酸乙酯:德国默克,色谱纯;水:1.25L哇哈哈纯净水(杭州产);正己烷:Honeywell,色谱纯。甲酸:色谱纯乙酸:色谱纯浓盐酸:分析纯乙酸钠:分析纯甲酸乙酸乙酯溶液:2% 向400mL乙酸乙酯中加入10mL甲酸,用乙酸乙酯定容至500mL。甲酸溶液
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=152834]液相色谱-串联质谱法检测牛乳中多肽类抗生素残留量[/url]摘 要选用牛奶为研究对象.建立了一种可同时测定多粘菌素B、粘杆菌素、杆菌肽和维吉尼霉素等4种多肽类抗生素残留量的液相色谱一串联质谱法(Lc—Ms/Ms)检测方法。样品经甲醇一0.1%甲酸体系提取,正己烷脱脂,固相萃取柱净化后,利用Lc—Ms/Ms进行定性和定量分析。结果表明,该方法4种多肽类抗生素检出限分剐为:多粘茵素B 25O g/kg,粘杆菌素25 g/kg,杆菌肽A 5O g/kg,维吉尼霉素2O g/kg。平均回收率分别为:多粘茵素B 92.16%—95.89%,粘杆菌素92.24% 97.87%,杆菌肽94.54%—97.96%,维吉尼霉素 93.58% 8.25%。变异系数为2-54^ .55。
超高效液相色谱-串联质谱检测动物源性食品中β-受体激动剂残留分析方法的优化
正相硅胶_选择洗脱-气相色谱法、液相色谱-质谱法检测食品中甲胺磷残留及其作用机理研究.pdf
SN/T 2514-2010 进出口食品中噻酰菌胺残留量的测定 液相色谱-质谱/质谱法(中英文版) 注:全文见资料中心。
液相色谱-串联质谱法检测牛奶和奶粉中保泰松残留量方法的研究摘 要 建立一种测定牛奶和奶粉中保泰松残留的液相色谱-串联质谱法测定方法。用乙醇、氨水提取,乙醚、石油醚分离脂肪,酸化四氢呋喃-正己烷萃取,流动相定容、外标法定量。回收率86.0%~96.1%,室内四个水平相对标准偏差均在10.63%以内,重复性相对标准偏差(RSDr)在3.34%~3.99%之间,再现性相对标准偏差(RSDR)在6.96%~10.34%之间。在0.03 ng~6 ng范围内均呈线性关系,检出限(LOD)为1.0 μg/kg。 方法准确、简便,可以应用于牛奶和奶粉中保泰松残留量的测定。保泰松(Phenylbutazone),又名苯丁唑啉、4-丁基-1,2-二苯基-3,5-吡咯烷二酮、布他酮、布他唑立丁、布泰其安。化学名称:3,5-Pyrazolidinedione,苯基丁氮酮,为吡唑酮类衍生物。RTECS编号:UQ8225000,CAS登记号:50-33-9。分子式:C19H20N2O2,分子量308.41。白色或类白色结晶性粉末,易溶于丙酮;氯仿或苯,溶于乙醇或乙醚,几乎不溶于水,溶于氢氧化钠溶液。无臭,味略苦。具有解热镇痛、抗炎及抗风湿作用,主要用于治疗风湿性,类风湿性关节炎及痛风。由于抗炎抗风湿作用强,曾广泛用于人类的治疗。但代谢产物(Oxyphenbutazone)有不良反应,引起肝炎、中毒甚至致死等。在兽药和饲料添加剂中使用,不可避免地造成动物产品中该药物的残留。因此,建立一种与世界发达国家同一水平的牛奶和奶粉中保泰松残留检测方法,对提高我国食品安全与卫生质量、保护国民的健康、促进动物产品出口是十分必要的。目前检验方法主要有HPLC法、气相色谱法、紫外法毛细管电泳法和电化学检测方法。文献报道的测定保泰松分析方法多应用于药品中和畜禽中,未检索到可应用于牛奶和奶粉中保泰松残留量的资料。本文主要参考AOAC建立的分析方法,重新优化了提取体系和测定条件,建立了碱性去除脂肪、酸性条件下提取牛奶和奶粉中的保泰松、液相色谱-串联质谱法检测、外标方法定量测定保泰松的新方法。1 试验部分1.1 主要仪器与试剂1.1.1 仪器美国应用生物系统公司AB 3200 Q TRAP液相色谱-串联质谱仪(配有电喷雾离子源),天平(感量0.01 g,0.000 1 g),漩涡混合器,氮气浓缩仪,10 mL具塞聚丙烯离心管,离心机(2600 g),超声波清洗仪,振荡器。1.1.2 试剂除另有说明外,所用试剂均为AR级。水:GB/T 6682,一级。甲醇,乙醇,乙醚,石油醚,乙酸乙酯,盐酸,甲酸铵。氨水,CP。四氢呋喃,正己烷,乙腈,HPLC级。二硫苏糖醇(dithiothreitol。CAS:3483-12-3):C4H10O2S2,纯度≥99%。N,N-二甲基甲酰胺(CAS:68-12-2,含量99.5%)。稳定液:0.25 mg/mL二硫苏糖醇-乙酸乙酯溶液(125mg二硫苏糖醇(DL-dithiothreitol)溶于乙酸乙脂并定容至500ml)。0.05 mol/L醋酸铵(1.95g醋酸铵溶于500ml水中,过0.2μm的水相滤膜。使用前过滤)。保泰松标准储备溶液:称取适量保泰松标准物质(CAS:50-33-9,纯度≥95%),用80 mL甲醇溶解,加入5mL稳定液,用甲醇定容于100 mL容量瓶中。同时,根据不同测定需要,稀释适当浓度的保泰松标准应用溶液。1.2 仪器工作条件2.1 试验方法2.1.1 样品分析牛奶:称取1 g试样,精确至0.01 g,置于10 mL具塞聚丙烯离心管中,加入1.0 mL乙醇混匀;加入0.1 mL氨水,混匀;加入2.5 mL乙醚,于漩涡混合器混匀20 s,静置5 min;加入2.5 mL石油醚,于漩涡混合器混匀20 s,静置5 min。小心吸弃上清液
摘要:本文建立了蔬菜和水果中赤霉素残留的高效液相色谱-串联四极杆质谱联用测定方法。该方法经50%乙腈水溶液(pH值2.5)提取样品,以ZORBAX SB-Aq柱(2.1mm×150.0mm,3.5μm)分离,流动相为0.1%甲酸水溶液和甲醇(体积比为60∶40),电喷雾正离子MRM模式检测。该方法的检出限2.0μg/L,方法定量下限10μg/kg,线性范围2.0~10.0μg/L,加标回收率90.1%~102.3%,相对标准偏差为4.07%。
我们在使用液质联用仪的过程中,经常会出现化合物残留或者污染现象,该现象在一定程度上影响了定量下限的检测,亦影响了实验结果的准度和精度。为了更好的用好液质联用仪,避免污染/残留现象,我们在此讨论一下污染/残留的产生及避免。一、污染/残留的区分原则在发现空白里面有化合物的干扰峰后,我们首先要判断该干扰峰是由系统污染引起的,还是由系统残留导致的。主要的原则是:连续进空白多针,如果干扰峰的响应有逐渐降低的趋势,可判断为系统残留;如果干扰峰响应基本保持不变,则可能是系统污染。如果是污染导致,可能比较大的可能性在于流动相或者样品污染所致。本文中我们主要讨论系统的残留。二、残留分类1、确定是LC还是MS残留a)使用干净的流动相清洗注射器和ESI probeb)再用注射器注入流动相到MS内(例如50:50的流动相), 而不通过LC系统.c)如果残留的水平下降, 污染来自LC系统d)如果残留的水平一样, 污染来自MS系统2、LC残留a)检查色谱柱 ——UPLC或HPLC色谱柱会保留微粒、沉淀的蛋白、和其它的有机化合物而污染色谱柱,这些污染物会减小柱子的寿命、增加柱子的工作压力、改变柱子的选择性、增加背景噪声b)检查进样器——把清洗液泵入进样器,使用full loop 进样方式重复把清洗液注入系统中进行清洗,再用回流动相清洗系统,运行样品,如果污染还在,检查是否来自于样品、稀释剂、样品容器c)检查稀释用溶剂、水、酸——如水、甲醇或乙氰及0.1%甲酸的混合液到质谱仪内,如果没有污染,则污染来自于样品。 3、MS残留 质谱容易引起残留的主要部件如下:-ESI probe (probe tip, capillary, unions)-Sample cone(取样锥口)-Lockspray baffle(锥口取样阀)-Ion source block-PEEK tubing connecting column outlet to API source-六通阀-LC tubing如确认残留系MS引起,首先需要清洗以上部件,如清洗无法祛除的,需要更换。三、清洗仪器:1、清洗LC系统——使用最高纯度的溶剂清洗LC系统中的污染,使用下述混合溶剂清洗,减少背景(使用25%乙氰25%甲醇25%异丙醇25%水0.2%甲酸)清洗完后,使用50%的乙氰或流动相洗去清洗液,且清洗时同时大体积进样清洗液。2、清洗MS系统——移去、清洗或更换可能产生污染的MS部件,使用高纯度的溶剂清洗,把部件表面的污染物清洗掉。 在清洗过程中要避免二次污染或是对新部件的污染,按清洗方法进行清洗,有时一次清洗或更换一个部件。也可以一次对所有怀疑的部件进行清洗和更换。在清洗过程中要使用高纯的溶剂,戴上洁净的手套。 在擦拭部件时要使用清洁的棉签。四、如何避免残留1.首先使用使用洁净的,无颗粒的溶剂——流动相总是使用色谱纯、无颗粒的溶剂和试剂(最好是原装进口),且试剂必需已经以0.2μm 或更小孔径过滤。2.防止微生物生长——水性流动相尽量每天新鲜配置。3.尽量减少流动相中的添加剂——为了减小基线背景信号,使用最低浓度的和色谱兼容的附加剂(例如:0.1%甲酸,不要使用1%) 使用最高质量(进口色谱纯)的附加剂 ,同时使用可挥发的、和质谱兼容的附加剂,例如ammonium (NH4+), acetate, formate, or carbonate.4.正确制备样品和流动相——使用洁净的样品瓶、盖子。小心劣质的瓶垫可能会有增塑剂的污染,最好使用0.22um孔径的膜过滤样品。液质联用仪的高灵敏度,给我们带来了痕量检测的精度和准度,但同时这就要求我们在操作过程中一定谨慎操作,避免将流动相、试剂瓶或者样品污染,从而干扰我们的检测。
GB/T 23411—2009《蜂王浆中17种喹诺酮类药物残留量的测定 液相色谱-质谱/质谱法》[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=176969]GBT 23411-2009蜂王浆中17种喹诺酮类药物残留量的测定 液相色谱-质谱 质谱法.pdf[/url]

QuEChERS前处理方法联合液相色谱-质谱联用法测定水果中7种农药残留的测定摘要: 采用QuEChERS前处理方法联合液相色谱-质谱联用法测定水果中7种农药残留。首先用QuEChERS方法进行样品前处理,即乙腈提取,提取溶液经脱水后离心,用分散性吸附剂去除离心提取液中的干扰基质(如脂肪酸和色素等),然后直接进行[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]质分析。添加回收4种样品(苹果、桃、葡萄、梨)的回收率均在70%~130%之间,相对标准偏差(RSD)均小于20%。关键词:农药残留 QuEChERS前处理方法 液相色谱-质谱联用法克百威、三羟基克百威、涕灭威砜、涕灭威亚砜、涕灭威、灭多威、辛硫磷是水果中普遍使用的杀虫剂、杀菌剂。液相色谱-质谱联用法测定农药残留量国标方法麻烦繁琐,本文采用QuEChERS前处理方法,快速、简单、价廉、高效、耐用,致力于降低成本,提高效率。1 试剂和材料除非另有说明,在分析中仅使用分析纯的试剂,水为GB/T 6682规定的一级水。1.1 试剂1.1.1乙腈(CH3CN,CAS号:75-05-8):色谱纯1.1.2 乙酸乙酯(CH3COOC2H5,CAS号:141-78-6):色谱纯1.1.3 醋酸钠(CH3COONa,CAS号:6131-90-4)1.1.4 硫酸镁(MgSO4,CAS号:7487-88-9)1.1.5 甲醇(CH3OH,CAS号:67-56-1或170082-17-4):色谱纯1.1.6 乙酸铵[url=http://www.baidu.com/link?url=1hPRJC7f7DDz12RzPO-jTHmrKwRUqDEiZQSUN0TlimYuJhx8epyGcjFjdie3QDKyYVY7eVkYz9Ev9NeXhsHqi9OQMr7tx7xOMeAHe6lp0Na&wd=&eqid=89bc022c000326a6000000045baf260a%22 \t %22https://www.baidu.com/_blank](CH3COONH4,CAS号: 631-61-8)[/url]1.1.7 甲酸(CH2O2,CAS号:[url=http://www.baidu.com/link?url=Av64NPyZhMS0q2LTttTEQGv6bQX7sXNpWCW1o6rStbiDGoD-MfUaDKkQspQzvWknPLgBdY1yqJqOcCXV3J11T5lmeQUPp20dzHdL5RuNlxm%22 \t %22https://www.baidu.com/_blank]64-18-6[/url]):色谱纯1.2 溶液配制1.2.1乙腈-醋酸溶液(99+1):量取10 mL醋酸加入990mL乙腈中,混匀。1.2.2乙酸铵溶液:1mol/L1.2.3 流动相:流动相A 乙酸-铵水溶液(2mmol/L,含0.1%甲酸):1000 mL一级水,加入2 ml乙酸铵溶液(1mol/L),1 mL甲酸 流动相B 甲醇1.3 标准品克百威、三羟基克百威、涕灭威砜、涕灭威亚砜、涕灭威、灭多威、辛硫磷标准品1.4 标准溶液配制1.4.1标准储备溶液(100 mg/L)1.4.2混合标准溶液:吸取一定量的农药标准储备溶液于10mL容量瓶中,用甲醇容至刻度,10.0 mg/L。混合标准溶液避光0℃~4℃保存,有效期3个月。1.4.3基质混合标准工作溶液:空白基质溶液氮气吹干,加入1 mL相应质量浓度的混合标准溶液复溶,过微孔滤膜(4.5.6)。基质混合标准工作溶液应现用现配。注:空白基质溶液取样量应与相应的试样处理取样量一致。1.5 材料1.5.1乙二胺-N-丙基硅烷化硅胶(PSA):40~60μm。1.5.2陶瓷均质子:2cm(长)×1cm(外径)1.5.3微孔滤膜(有机相):13 mm×0.22 μm。2 仪器2.1液相色谱-三重四极杆质谱联用仪:配有ESI源,型号岛津[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LCMS[/color][/url]-80402.2分析天平:感量0.1 mg和0.01 g。2.3高速匀浆机:转速不低于15 000 r/min。2.4离心机:转速不低于10000r/min。2.5组织捣碎机。2.6旋转蒸发仪。2.7 氮吹仪:可控温。2.8涡旋混合器。3 试样制备3.1 试样制备水果随机取样1 kg,样品取样部位按照GB 2763规定执行。对于个体较小的样品,取样后全部处理;对于个体较大的基本均匀样品,可在对称轴或对称面上分割或切成小块后处理;取后的样品将其切碎,充分混匀,用四分法取样或直接放入组织捣碎机中捣碎成匀浆,放入聚乙烯瓶中。3.2 试样贮存将试样按照测试和备用分别存放。于-18 ℃条件下保存。4 分析步骤4.1 QuEChERS前处理称取10 g试样(精确至0.01 g)于50 mL塑料离心管中,加入15 mL1%醋酸乙腈溶液,用涡旋混合器涡旋1min。加入6g硫酸镁、1.5g NaAc及1颗陶瓷均质子,盖上离心管盖,剧烈震荡1 min后8000 r/min离心5 min。吸取10 mL上清液加到内含1.5g硫酸镁及500mg PSA的15 mL塑料离心管中涡旋混匀1 min。4000 r/min离心5 min,准确吸取3 mL上清液于10 mL试管中,40℃水浴中氮气吹至近干。加入2 mL甲醇复溶,过微孔滤膜(4.5.6),用于测定。4.2测定4.2.1仪器参考条件a) 色谱柱:Shim-pack GISS 2.1m×100mm,1.9μmb) 色谱柱温度:40℃c)流动相梯度洗脱程序见表1。表1 流动相梯度洗脱程序[table][tr][td]Time/min[/td][td]0.50[/td][td]1.00[/td][td]4.00[/td][td]4.10[/td][td]7.00[/td][td]7.20[/td][td]8.50[/td][/tr][tr][td]流速/mL/min[/td][td]0.3[/td][td]0.3[/td][td]0.3[/td][td]0.3[/td][td]0.3[/td][td]0.3[/td][td]0.3[/td][/tr][tr][td]B Conc /%[/td][td]10[/td][td]50[/td][td]50[/td][td]90[/td][td]90[/td][td]10[/td][td]stop[/td][/tr][/table]4.2.2 标准工作曲线精确吸取一定量的混合标准溶液,逐级用甲醇稀释工作液梯度为0.005、0.02、0.05、0.2、0.4 mg/L标准工作溶液。空白基质溶液氮气吹干,分别加入1 mL上述标准工作溶液复溶,过微孔滤膜(4.5.6)配制成系列基质混合标准工作溶液,供液相色谱-质谱联用仪测定。以农药定量离子峰面积纵坐标,农药标准溶[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]量浓度横坐标,绘制标准曲线。线性方程和相关系数见图1。[align=center]图1 7种农残曲线线性方程和相关系数[/align][img]https://ng1.17img.cn/bbsfiles/images/2020/08/202008191405525261_2058_3505249_3.jpg[/img][img]https://ng1.17img.cn/bbsfiles/images/2020/08/202008191405527244_1752_3505249_3.jpg[/img][img]https://ng1.17img.cn/bbsfiles/images/2020/08/202008191405528572_9559_3505249_3.jpg[/img][img]https://ng1.17img.cn/bbsfiles/images/2020/08/202008191405529353_9701_3505249_3.jpg[/img][img]https://ng1.17img.cn/bbsfiles/images/2020/08/202008191405530066_2062_3505249_3.jpg[/img][img]https://ng1.17img.cn/bbsfiles/images/2020/08/202008191405534607_5396_3505249_3.jpg[/img][img]https://ng1.17img.cn/bbsfiles/images/2020/08/202008191405537381_7474_3505249_3.jpg[/img]4.3试样溶液的测定将基质混合标准工作溶液和试样溶液依次注入液相色谱-质谱联用仪中,保留时间和特征离子定性,测得定量离子峰面积,待测样液中农药的响应值应在仪器检测的定量测定线性范围之内,超过线性范围时应根据测定浓度进行适当倍数稀释后再进行分析。在选定的条件下对农药混合标样进行分析,采集数据,其特征离子见表2。表2 7种农残保留时间及特征离子[table][tr][td] [/td][td]克百威[/td][td]三羟基克百威[/td][td]涕灭威砜[/td][td]涕灭威亚砜[/td][td]涕灭威[/td][td]灭多威[/td][td]辛硫磷[/td][/tr][tr][td]Tr/min[/td][td]4.087[/td][td]2.915[/td][td]2.482[/td][td]2.423[/td][td]3.396[/td][td]2.620[/td][td]5.829[/td][/tr][tr][td]定量离子(m/z)[/td][td]222.00165.00[/td][td]222.00165.00[/td][td]240.1086.00[/td][td]207.1089.00[/td][td]208.10116.10[/td][td]163.0588.00[/td][td]299.0077.10[/td][/tr][tr][td]定性离子[/td][td]222.00123[/td][td]222.00123[/td][td]240.10223[/td][td]207.10132[/td][td]208.1089.1[/td][td]163.05106[/td][td]299.00129[/td][/tr][/table]4.4平行试验按以上步骤对同一试样进行平行试验测定。4.5空白试验除不加试料外,采用完全相同的测定步骤进行平行操作。具体数据见表3。表3 不同样品基质中8中农残的空白浓度值[table][tr][td] [/td][td]克百威[/td][td]三羟基克百威[/td][td]涕灭威砜[/td][td]涕灭威亚砜[/td][td]涕灭威[/td][td]灭多威[/td][td]辛硫磷[/td][/tr][tr][td]桃[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][/tr][tr][td]梨[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][/tr][tr][td]葡萄[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][/tr][tr][td]苹果[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][td]N.D.[/td][/tr][/table]5 结果计算试样中各农药残留量以质量分数ω计,数值以毫克每千克(mg/kg)表示,外标法按公式计算。 [img]https://ng1.17img.cn/bbsfiles/images/2020/08/202008191405542215_8982_3505249_3.png[/img]式中:ω———试样中被测物残留量,单位为毫克每千克(mg/kg);ρ———基质标准工作溶液中被测物的质量浓度,单位为微克每毫升(μg/mL);A——试样溶液中被测物的色谱峰面积;As——基质标准工作溶液中被测物的色谱峰面积;V——试样溶液最终定容体积,单位为毫升(mL);m——试样溶液所代表试样的质量,单位为克(g)。计算结果应扣除空白值,计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示6添加回收率实验本实验分别用苹果、葡萄、梨、桃作为供试样品,采用外标法定量。分别向样品中添加量为0.08 、0.05 mg/kg的7种农残储备液,平行测定2次,按照上述提取,净化、和检测方法,比较添加回收率结果,具体见表4和表5,苹果中7种农残添加回收谱图见图3。由数据分析可知,QuEChERS前处理方法能够很好提取目标物质,并保证添加回收率在70-130 %之间。表4 不同样品基质中7种农残的添加浓度值(μg/L)[table][tr][td]基质/目标物[/td][td]克百威[/td][td]三羟基克百威[/td][td]涕灭威砜[/td][td]涕灭威亚砜[/td][td]涕灭威[/td][td]灭多威[/td][td]辛硫磷[/td][/tr][tr][td]桃[/td][td]76.299[/td][td]51.896[/td][td]65.838[/td][td]68.015[/td][td]57.745[/td][td]43.007[/td][td]39.069[/td][/tr][tr][td]梨[/td][td]76.570[/td][td]67.940[/td][td]77.809[/td][td]74.489[/td][td]72.503[/td][td]65.943[/td][td]46.892[/td][/tr][tr][td]葡萄[/td][td]78.063[/td][td]67.233[/td][td]71.043[/td][td]67.507[/td][td]72.451[/td][td]63.767[/td][td]42.136[/td][/tr][tr][td]苹果[/td][td]77.009[/td][td]70.949[/td][td]65.010[/td][td]64.581[/td][td]74.540[/td][td]56.289[/td][td]36.681[/td][/tr][tr][td]理论值[/td][td]80[/td][td]80[/td][td]80[/td][td]80[/td][td]80[/td][td]50[/td][td]50[/td][/tr][/table]表5不同样品基质中7种农残的添加回收率(%)[table][tr][td]基质/目标物[/td][td]克百威[/td][td]三羟基克百威[/td][td]涕灭威砜[/td][td]涕灭威亚砜[/td][td]涕灭威[/td][td]灭多威[/td][td]辛硫磷[/td][/tr][tr][td]桃[/td][td]95.4[/td][td]77.3[/td][td]82.3[/td][td]85.0[/td][td]72.2[/td][td]86.0[/td][td]78.1[/td][/tr][tr][td]梨[/td][td]95.7[/td][td]84.9[/td][td]97.3[/td][td]93.1[/td][td]90.6[/td][td]126[/td][td]93.8[/td][/tr][tr][td]葡萄[/td][td]97.6[/td][td]84.0[/td][td]88.8[/td][td]84.4[/td][td]90.6[/td][td]128[/td][td]84.2[/td][/tr][tr][td]苹果[/td][td]96.3[/td][td]88.7[/td][td]81.3[/td][td]80.7[/td][td]93.2[/td][td]113[/td][td]73.3[/td][/tr][/table][align=center]图 3 7种农残的添加回谱图[/align][img]https://ng1.17img.cn/bbsfiles/images/2020/08/202008191405543318_1334_3505249_3.jpg[/img]7 结论 本方法采用QuEChERS前处理方法,用乙腈提取目标物质,简化了农残前处理步骤,并能在液相色谱-质谱联用仪上取得满意的添加回收率。整个过程用时较短,成本低廉,方法的准确性及重复性好。液相色谱-质谱联用仪液相部分就可实现7种农残完全分离,为方法的准确度和精密度提供了很好的保证。
SNT 2453-2010 进出口动物源性食品中二硝托胺残留量的测定 液相色谱-质谱 质谱法.pdf
GBT 20744-2006 蜂蜜中甲硝唑、洛硝哒唑、二甲硝咪唑残留量的测定 液相色谱-串联质谱法
[color=#333333]建立了苹果、番茄和甘蓝中281种农药残留的QuEChERS结合液相色谱-四极杆/飞行时间质谱(LC-Q-TOF/MS)快速筛查方法。方法采用1%醋酸乙腈提取样品,经丙基乙二胺(PSA)净化,LC-Q-TOF/MS测定。281种农药在苹果、番茄和甘蓝中3个添加水平下的回收率在70%~120%范围的比例分别为98.6%、99.3%和98.2% 回收率的相对标准偏差(RSD)均≤20%(n=5) 在0.25~10倍最大残留限量(MRL)的含量范围内,线性相关系数r2≥0.99的农药比例分别为95.7%、96.1%和98.2% 检出限分别为0.03~4.47、0.01~4.49和0.02~3.61μg/kg。本方法采用精确质量数据库和谱图库检索的方式,实现了不用农药标准品对照而完成对果蔬中农药残留的快速筛查,提高了定性鉴别的准确性。应用所建立的方法对30个市售果蔬样品进行筛查,共检出13种农药残留。其中,甘蓝中甲胺磷的含量超过了GB 2763-2012《食品安全国家标准.食品中农药最大残留限量》和欧盟的MRL 番茄中鱼藤酮的含量超出欧盟的MRL。[/color]
蔬菜、水果及其制品中吡虫啉、多菌灵、甲基硫菌灵、霜霉威、灭多威、霜脲氰残留量的检测方法-超高效液相色谱-质谱/质谱法 唐玉萍1 范围本非标方法规定了蔬菜、水果及其制品中吡虫啉、多菌灵、甲基硫菌灵、霜霉威、霜脲氰和灭多威残留量的超高效液相色谱-质谱/质谱检测方法。本非标方法适用于蔬菜、水果及其制品中吡虫啉、多菌灵、甲基硫菌灵、霜霉威、霜脲氰和灭多威残留量的检测,该方法在番茄、番茄酱、梨、脱水洋葱等样品中经过验证。2 规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB/T 6682 分析实验室用水规格和试验方法3 原理样品用乙酸-甲醇-水溶液提取,C18色谱柱进行分离,用超高效液相色谱-质谱/质谱检测,内标或外标法定量。4 试剂及材料除另有规定外,所用试剂均为分析纯,水为GB/T 6682 规定的一级水。4.1 甲醇:色谱纯。4.2 乙酸铵。4.3 10mmol/L乙酸铵:准确称取1.926g乙酸铵,定容至500mL容量瓶中,配制成50mmol/L乙酸铵。用溶剂过滤装置过0.2µm水相滤膜,0~4℃保存,有效期15天。临用时用水稀释成10mmol/L。4.4 冰乙酸。4.5 甲醇-水溶液(30+70,V/V)。4.6 提取液Ⅰ:乙酸-甲醇-水溶液(0.1+50+50,V/V/V)。4.7 提取液Ⅱ:乙酸-甲醇-水溶液(0.1+80+20,V/V/V)。4.8 吡虫啉、多菌灵、甲基硫菌灵、霜霉威、霜脲氰、灭多威和D4-吡虫啉标准品:均为德国Dr.公司,纯度≥98.0%。4.9 6种农残标准储备液:分别准确称取吡虫啉、多菌灵、甲基硫菌灵、霜霉威、霜脲氰、灭多威标准品10mg~15mg(精确到0.1mg)于50mL容量瓶中,用甲醇溶解并定容至刻度,配制成浓度约为200~300µg/mL的标准储备液,于-18℃避光保存,有效期18个月。4.10 中间浓度混合标准溶液:根据需要,取适量6种农残标准储备液,用甲醇-水溶液(4.5)稀释配制成2µg/mL的混合标准中间液,0~4℃保存,有效期6个月。4.11 内标标准储备液:准确称取D4-吡虫啉标准品约10mg(精确到0.1mg)于50mL容量瓶中,用甲醇溶解并定容至刻度,配制成浓度约为200µg/mL的内标标准储备液,于-18℃避光保存,有效期18个月。4.12 中间浓度内标溶液:取D4-吡虫啉标准储备液,用甲醇-水溶液(4.5)逐级稀释配制成4µg /mL和200ng/mL,0~4℃保存,有效期6个月。4.13 混合标准工作溶液:准确吸取一定量的中间浓度混合标准溶液(4.10)和中间浓度内标溶液(200 ng/mL),用甲醇-水溶液(4.5)配制成10,20,50,100,200 ng/mL系列浓度的混合标准工作溶液,内标浓度均为20 ng/mL,0~4℃保存,有效期3个月。4.14 微孔滤膜:0.2µm,有机相。4.15 流动相过滤滤膜:0.2µm,水相。5 仪器和设备5.1 高效液相色谱-串联质谱仪(LC-MS/MS):配有电喷雾离子源(ESI)。5.2 电子分析天平:感量分别为0.1 mg和0.01 g。5.3 超声波水浴。5.4 漩涡混合器:3000r/min。5.5 离心机:9000r/min。5.6 离心管:聚四氟乙烯,50mL。5.7 溶剂过滤装置。6 试样的制备和保存6.1 试样的制备与保存取番茄、梨等果蔬样品约500g,将其可食用部分切碎后,用粉碎机粉碎成浆状,混匀,均分成两份作为试样,分装入洁净的容器中,密封。将试样于-18℃以下冷冻保存。取番茄酱样品约500g,混匀,均分成两份作为试样,分装入洁净的容器中,密封。将试样于-18℃以下冷冻保存。取脱水洋葱样品约200g,混匀,均分成两份作为试样,分装入洁净的容器中,密封。将试样于0~4℃保存。注:在制样过程中,应防止样品受到污染或发生农药残留量的变化。7 测定步骤[
那位大虾有NY/T 1453-2007 蔬菜及水果中多菌灵等16种农药残留测定液相色谱-质谱-质谱联用法的标准,帮帮忙,谢了
GB/T 23584—2009《水果、蔬菜中啶虫脒残留量的测定 液相色谱-串联质谱法》[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=180639]GBT 23584-2009 水果、蔬菜中啶虫脒残留量的测定 液相色谱-串联质谱法.pdf[/url]