电位差计分直流电位差计和交流电位差计。直流电位差计用于测量直流电压,使用时调节标准电压的大小,以达到两个电压的补偿。交流电位差计用于测量工频到声频的正弦交流电压。两同频率正弦交流电压相等时,要求其幅值和相位均相等,因此交流电位差计的线路要复杂一些,并且至少有两个可调量。交流电位差计在市场上只有用于工频的产品,其他频率的交流电位差计均需自行设计制作。 随着直流电流比较仪的理论和技术不断发展和完善,出现了准确度很高的直流电流比较仪式电位差计,其测量误差约为百万分之一数量级。 在用电位差计校准电流表时,是通过用电位差计测量标准电阻上的电压来转化成标准电流,进而对电流表各点进行校正。估算电表校验装置的误差,并判断它是否小于电表基本误差限的1/3,进而得出校验装置是否合理的结论。估算时只要求考虑电位差计的基本误差限及标准电阻 的误差。 显然,电表校验装置的误差还应包括标准电动势 欠准、工作电流波动、线间绝缘不良等其它因素的影响,但考虑这些因素对教学实验就过于复杂了。式中电位差计测电压的不确定度 用上面(5.8.1)式式来估算; 级的标准电阻(本实验 )的不确定度 可用下式简化估算
请问哪位见过哪有卖多点信号发生器的,就是最简单的那种。可以输出毫伏信号使多通道的电子电位差计连续运行,观察仪表记录是否良好?
采用标准加入法,温度为251)测30ml ,0.001mol/L的氯化钠浓液的浓度CX 测得电位差为166.626 然后我加入10ml 0.0001mol/L的氯化钠浓液,玻璃棒搅拌后,电位差172.119 用能斯特方程算出 CX=0.0001397,正确值应该为0.0012)测30ml ,0.0001mol/L的氯化钠浓液的浓度CX 测得电位差为223.999 然后我加入10ml 0.001mol/L的氯化钠浓液,玻璃棒搅拌后,电位差193.481 用能斯特方程算出 CX=-0.0004794,正确值应该为0.0001看上面的值显然不对,怎么还有负值 按照理论,浓度每变化10,应该有59MV的电位差 223.999-166.626=57.373MV ,这个倒是相差不大的
[em0804]文献铱配合物(铱有一价和三价)在铂盘电极上电位差是80MV,而我合成的类似的铱配合物,工作电极用的玻碳电极,而电位差却是160多MV,重复了七八遍,数据一直是这样。问题1、为什么会差这么多?同一物质会由于基体电极不同电位差也会跟着发生变化吗?2、是不是两电子转移过程啊,是的话,理论值应该在29mv啊,怎么文献是在80mv? 有做过配合物电化学的朋友吗,急盼高手指教!
有哪家公司在卖电位差检测仪?
铁氰化钾作为探针,在玻碳电极上是一个电子转移,理论峰电位差是59mv,那在铂电极上呢?用的是铂盘电极。由于天气冷,工作站无法正常工作,所以在这里求助大家了,谢谢。
我公司原一计量标准器UJ31电子电位差计因到期检定不合格,现需另购.现本地市场UJ31与UJ33A价格只相差一百元左右,但UJ33A功能较多无需再增加检流计和标准电池就可使用(本公司检流计也不是很好),而且使用比较方便.希望大家一起与我共同探讨一下UJ31与UJ33A的优劣,到底购买哪一种比较方便?
求直流电位差计的检定和测量不确定度的评定方面的论文呀 求大哥哥姐姐们帮助一下呀
环境大气氟化物的标准里要求曲线浓度每变化10倍,电位值变化58±2是说浓度1和10的点电位差应该在这个范围内么
我想找一些关于UJ51电位差计的技术资料,例如允许误差,技术等级,谢谢专家提供一些线索!!!
液接电位的概念是:当两个不同浓度的溶液直接接触时由于浓度梯度使离子在相界面上产生迁移当这种迁移速率不同时会产生电位差或产生了液接电位。我的问题是当两溶液接触时早已混溶无界面出现何有电位差?
若两电对的电子转移数分别为1和2,为使反应完全程度达到99.9%,两电对的条件电位差至少应大于多少?
通常测定纯物质的zeta电位物理意义为颗粒表面滑动层与溶液的电位差。那么混合物质溶液中测得的zeta电位,其意义是什么?表示的是几何平均值还是真实的zeta电位,即所有混合物质的zeta电位都一样。
应同学要求,想了解比表面积测定仪,纵观进口及国产各大厂家的产品,规格繁多,众说纷纭,那么在硅酸锂,生物炭,MOF材料的比表面积测定中,选择哪个厂家的哪款型号更合适呢?希望得到此领域应用技术人员的解答,留言。不甚感谢
电位分析是通过在零电流条件下测定两电极间的电位差(电池电动势)所进行的分析测定。 ΔE = E+ - E- + E液接电位 装置:参比电极、指示电极、电位差计; 当测定时,参比电极的电极电位保持不变,电池电动势随指示电极的电极电位而变,而指示电极的电极电位随溶液中待测离子活度而变。理论基础:能斯特方程(电极电位与溶液中待测离子间的定量关系)。 对于氧化还原体系: Ox + ne- = Red
想购买一台电位滴定仪,主要是用于中药材半夏的含量测定,请问有没有什么性价比比较高的,主要考虑国产的。另外药典上写电位滴定可以用电位滴定仪、酸度计或电位差计做,可以用哪个型号的酸度计,精度如何?感谢各位!
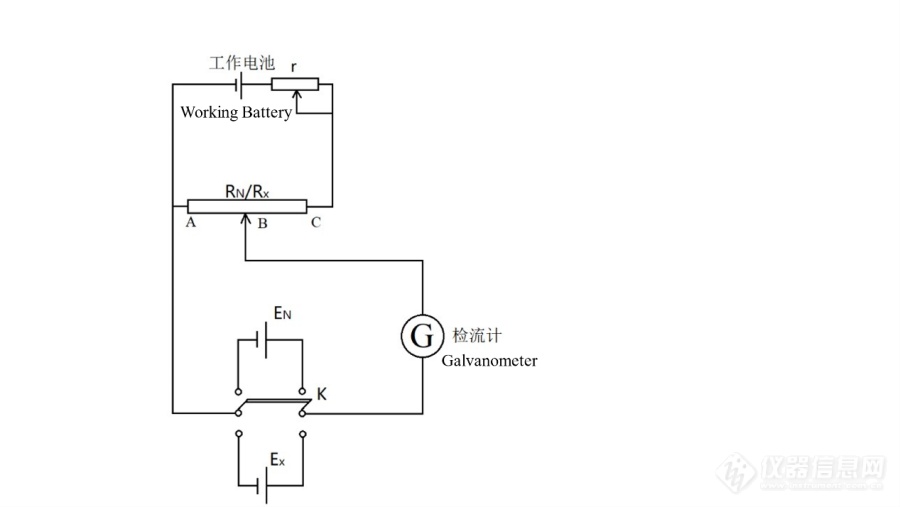
[align=center][size=18px][font='黑体']机械式UJ[/font][font='黑体']25仪器[/font][font='黑体']与数字式SDC-Ⅱ[/font][font='黑体']在原电池[/font][font='黑体']电动势[/font][font='黑体']测定实验中的[/font][font='黑体']对比研究[/font][/size][/align][align=center][size=18px][font='楷体']范[/font][font='楷体']亨利[/font][font='楷体']1[/font][font='楷体'],叶姝琴[/font][font='楷体']1[/font][font='楷体'],崔猛[/font][font='楷体']2,[/font][font='楷体']*[/font][font='楷体'] [/font][/size][/align][align=center][size=18px][font='楷体'](1[/font][font='楷体'].[/font][font='楷体']北京化工大学,生命科学与技术学院,北京,1[/font][font='楷体']00029[/font][font='楷体'];2.北京化工大学,化学学院,北京,1[/font][font='楷体']00029[/font][font='楷体'])[/font][/size][/align][align=left][font='楷体'][size=18px]作者简介:[/size][/font][/align][align=left][size=18px][font='楷体']崔猛([/font][font='楷体']1980[/font][font='楷体']年4月[/font][font='楷体'])[/font][font='楷体'],男,实验师,理学博士,cuimeng[/font][font='楷体']@mail.[/font][font='楷体']buct.edu.cn,[/font][font='楷体']通讯联系人。[/font][/size][/align][align=left][size=18px][font='楷体']范[/font][font='楷体']亨利([/font][font='楷体']2001[/font][font='楷体']年[/font][font='楷体']1[/font][font='楷体']月),男,生物工程专业本科在读。[/font][/size][/align][align=left][size=18px][font='楷体']叶姝琴([/font][font='楷体']2002[/font][font='楷体']年[/font][font='楷体']1[/font][font='楷体']月),女,生物[/font][font='楷体']医学[/font][font='楷体']工程专业本科在读。[/font][/size][/align][size=18px][font='等线 light']摘要[/font][font='华文仿宋']原电池电动势的测定实验是经典的物理化学实验,学生通过进行本实验能够理解和学会对消法的基本原理,了解原电池电动势的测定和应用。UJ25型直流高电势电位差计是使用于该实验的传统测量仪器,但在测量过程中操作繁琐。同时,指针式检流计的使用,也会带来一定的不利影响。本文为探究该实验的改进方案,进一步提高实验的准确度及精确度,提升学生的实验体验,引入新型数字化仪器进行对比,分别通过传统机械式仪器和新型数字化仪器进行了原电池电动势测定。实验发现与传统机械式仪器相比,新型数字化仪器的操作更简单而且智能化,测量值的准确性和灵敏度较高,可以较好地替代传统机械式仪器。[/font][font='等线 light']关键[/font][font='等线 light']词:[/font][font='等线 light']原电池、实验教学改进[/font][/size][align=center][size=18px][font='cambria math']The Comparison [/font][font='cambria math']Re[/font][font='cambria math']search of UJ25 Mechanical Instrument And SDC-[/font][font='cambria math']Ⅱ[/font][font='cambria math']D[/font][font='cambria math']igital Instrument U[/font][font='cambria math']se[/font][font='cambria math']d in [/font][font='cambria math']Galvanic Cell Electromotive Force Measurement Experiment[/font][/size][/align][size=18px][font='等线 light']Abstract[/font][font='cambria math']Galvanic cell electromotive force measurement experiment is a classic physical chemistry experiment, students can understand and learn the basic principle of [/font][font='cambria math']elimination method[/font][font='cambria math'] through this experiment, as well as understand galvanic cell electromotive force measurement and application. [/font][font='cambria math']UJ25 DC High Potential Potentiometer [/font][font='cambria math']is a traditional measuring instrument used in this experiment, but the operation is cumbersome in the measurement process. At the [/font][font='cambria math']same time, the use of pointer galvanometer will also bring some adverse effects. In this paper, in order to explore the improvement scheme of the experiment, further improve the accuracy and precision of the experiment, and enhance students’ experimental experience, a new digital instrument is introduced for this experiment and comparison,[/font] [font='cambria math']respectively through the traditional mechanical instrument and the new digital instrument for galvanic cell electromotive force measurement. Experimental results show that compared with the traditional mechanical instrument, the new digital instrument is [/font][font='cambria math']more simple[/font][font='cambria math'] to operate and intelligent, the accuracy and sensitivity of the measurement value is higher, and it can better replace the traditional mechanical instrument.[/font][font='等线 light']Keyword: [/font][font='等线 light']galvanic cell, improvement in experimental teaching[/font][font='等线 light']0[/font][font='等线 light']引言[/font][font='华文仿宋']物理化学是一门培养高素质化学化工专业人才的学科基础课,生活中它无处不在,学好这门课程是每一个工科学子所必备的素质。而物理化学实验由物理化学延伸出来,旨在培养学生动手能力,提升学生自主思考、用于创新的科研水平。电化学在现实中应用广泛,电池、酸度计的使用等都运用到电化学知识,生活中随处可见原电池,了解其电动势大小和放电充电原理有助于我们更高效地利用和保存它们。原电池电动势的测定是经典的物理化学实验,目前在大学实验教学中是将UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型直流高电势电位差计和检流计组合使用,采用对消法测量待测电池电动势,这种方法不用测量电流大小,具有较高的准确性,但在使用时连接线路较麻烦,学生易出错。此外,该仪器在调节阻值大小时需要判断检流计指针变化,容易造成误差。同时,锌棒、铜棒以及惰性电极的选择和处理也会对原电池电动势的测定造成一定的影响。[/font][font='华文仿宋']目前,人们针对该实验的改进已经进行了较多的探索,使实验更加符合绿色化学的要求。锌[/font][font='华文仿宋']棒作为[/font][font='华文仿宋']电极其上发生电极反应会产生表面极化现象[/font][font='华文仿宋'],[/font][font='华文仿宋']李[/font][font='华文仿宋']苞[/font][font='华文仿宋'][[/font][font='华文仿宋']1][/font][font='华文仿宋']等人利用微米压印技术制备[/font][font='华文仿宋']锌[/font][font='华文仿宋']电极,采用[/font][font='华文仿宋']150[/font][font='华文仿宋']和[/font][font='华文仿宋']280[/font][font='华文仿宋']微米压印电极能使测定结果的绝对误差相对小。饱和甘汞电极由于底部较细容易损坏,赵会玲[/font][font='华文仿宋'][[/font][font='华文仿宋']2][/font][font='华文仿宋']等人在保持饱和甘汞电极电极面积不变的情况下将底部较细部分改造为较粗的形状[/font][font='华文仿宋'],[/font][font='华文仿宋']大大增强了其抗损坏能力。为了加强恒温效果,胡俊平[/font][font='华文仿宋'][[/font][font='华文仿宋']3][/font][font='华文仿宋']等人设计了一种同时测定三电极体系的电池电动势的装置[/font][font='华文仿宋'],[/font][font='华文仿宋']在循环水恒温的密闭装置内可以保持整个装置的恒温环境[/font][font='华文仿宋'],[/font][font='华文仿宋']从而有效提高测量数据的重复性[/font][font='华文仿宋']。[/font][font='华文仿宋']此外,为克服对消法本身测量程序复杂[/font][font='华文仿宋']、[/font][font='华文仿宋']实验时间长的缺陷[/font][font='华文仿宋'],[/font][font='华文仿宋']宋江闯[/font][font='华文仿宋'][[/font][font='华文仿宋']4][/font][font='华文仿宋']等人使用高阻抗法测定原电池电动势及其温度系数[/font][font='华文仿宋'],[/font][font='华文仿宋']测量结果准确且大大降低了实验操作的复杂程度节省了实验时间。而范国康[/font][font='华文仿宋'][[/font][font='华文仿宋']5][/font][font='华文仿宋']等人利用离心管架作为支架[/font][font='华文仿宋']、[/font][font='华文仿宋']离心管作为容器[/font][font='华文仿宋'],[/font][font='华文仿宋']铜丝[/font][font='华文仿宋']、[/font][font='华文仿宋']锌[/font][font='华文仿宋']、[/font][font='华文仿宋']改造的银[/font][font='华文仿宋']-[/font][font='华文仿宋']氯化银电极来测量各原电池电动势[/font][font='华文仿宋'],[/font][font='华文仿宋']使得本实验成本大大降低[/font][font='华文仿宋'],[/font][font='华文仿宋']浪费减少[/font][font='华文仿宋']。[/font][font='华文仿宋']针对测量仪器本身,人们已经使用过较多种类的仪器,但未曾明确阐述过仪器的优势和缺陷。本文采用更加智能化数字化的测量仪器来替换传统机械式仪器,并进行了一系列的对比实验,旨在简化实验流程,加深学生对该实验原理的理解,探索该实验的应用层面。[/font][font='等线 light']1[/font][font='等线 light']实验原理[/font][font='华文仿宋']1.1[/font][font='华文仿宋']可逆电池电动势的测量[/font][font='华文仿宋']可逆电池[/font][font='华文仿宋'][[/font][font='华文仿宋']6][/font][font='华文仿宋']要求化学反应可逆、能量转换和传递可逆,即电池的充电反应是放电反应的逆反应,且电池中不存在液体接界电势等因素引起的实际不可逆性,可逆电动势即平衡电动势。本实验其中一个待测电池丹聂耳电池[/font][font='华文仿宋']是双液电池[/font][font='华文仿宋'],液体接界处存在不可逆的离子扩散过程,但测量过程中通过电池的电流[/font][font='华文仿宋'],可忽略此微小差异,因此该电池可近似看成可逆电池,测量其电池电势。[/font][font='华文仿宋']可逆电池电动势可与热力学函数联系起来,恒温恒压过程,可逆放电过程中所做的非体积功等于系统吉布斯自由能的变化[/font][font='华文仿宋'],由法拉第定律得通过电池的电荷量为[/font][font='华文仿宋'],则可逆电功为[/font][font='华文仿宋'],可得到[/font][font='华文仿宋']。又[/font][font='华文仿宋'],且由热力学定律可知,[/font][/size][align=center][size=18px][/size][/align][align=center][size=18px][/size][/align][size=18px][font='华文仿宋']其中[/font][font='华文仿宋']称为电动势的温度系数。[/font][font='华文仿宋']1.2[/font][font='华文仿宋']波根多夫([/font][font='华文仿宋']Poggendorff)[/font][font='华文仿宋']对消法[/font][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301820167996_390_5439527_3.png[/img][font='华文仿宋']波根多夫([/font][font='华文仿宋']Poggendorff)[/font][font='华文仿宋']对消法[/font][font='华文仿宋'][[/font][font='华文仿宋']6][/font][font='华文仿宋']是人们常采用的测量电池电动势的方法,其原理是利用一个与待测电动势大小相等、方向相反的外加电压对抗待测电池所产生的电动势,使被测量回路不再有电流通过,此时的外加电压即等于待测电池电动势。[/font][font='华文仿宋']本实验电路图如下所示[/font][/size][align=center][size=18px][font='华文仿宋']图1[/font][font='华文仿宋'].[/font][font='华文仿宋']波根多夫对消法实验电路图[/font][/size][/align][align=center][size=18px][font='times new roman']P[/font][font='times new roman']icture 1. Poggendorff elimination method experimental circuit diagram[/font][/size][/align][align=left][size=18px][font='华文仿宋']E[/font][font='华文仿宋']N[/font][font='华文仿宋']为标准电池,R[/font][font='华文仿宋']N[/font][font='华文仿宋']为可调节电阻,E[/font][font='华文仿宋']X[/font][font='华文仿宋']为待测电池,K为换向开关。[/font][/size][/align][align=left][size=18px][font='华文仿宋']本实验[/font][font='华文仿宋'][[/font][font='华文仿宋']6[/font][font='华文仿宋']、7[/font][font='华文仿宋']][/font][font='华文仿宋']中工作回路的工作电流I保持恒定。首先,调节电阻R[/font][font='华文仿宋']N[/font][font='华文仿宋']使标准电池电动势[/font][/size][/align][align=left][size=18px][font='华文仿宋'], 随后将测量电路中的开关K拨向E[/font][font='华文仿宋']N[/font][font='华文仿宋']端,调节内阻r使工作电路的电流为I[/font][font='华文仿宋'],[/font][font='华文仿宋']即使滑动电阻R[/font][font='华文仿宋']N[/font][font='华文仿宋']两端电势差与标准电池电动势对消,此时测量电路中电流趋近于零。将开关K拨向待测电池E[/font][font='华文仿宋']X[/font][font='华文仿宋'],保证R[/font][font='华文仿宋']N[/font][font='华文仿宋']不变,调节AB间的电阻值,使检流计G的指针指向0。此时有[/font][/size][/align][align=center][size=18px][/size][/align][align=left][font='华文仿宋'][size=18px]则有[/size][/font][/align][align=center][size=18px][/size][/align][size=18px][font='华文仿宋']可得到[/font][/size][align=center][size=18px][/size][/align][size=18px][font='华文仿宋']本实验不需要测定电流值,E[/font][font='华文仿宋']N[/font][font='华文仿宋']已知,因此只需要知道R[/font][font='华文仿宋']X[/font][font='华文仿宋']与R[/font][font='华文仿宋']N[/font][font='华文仿宋']的比值即可计算得到待测电池电动势的数值。通常,电阻值的测量精度较高,利用对消法测定原电池电动势具有较高的精度[/font][font='华文仿宋'][[/font][font='华文仿宋']8][/font][font='华文仿宋']。[/font][font='等线 light']2[/font][font='等线 light']实验部分[/font][font='华文仿宋']2.1[/font][font='华文仿宋']仪器与试剂[/font][font='华文仿宋']UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型直流高电势电位差计;[/font][font='华文仿宋']SDC-[/font][font='华文仿宋']Ⅱ数字[/font][font='华文仿宋']电位差综合测试仪[/font][font='华文仿宋'];S[/font][font='华文仿宋']YC-158[/font][font='华文仿宋']超级恒温水浴;BC[/font][font='华文仿宋']9[/font][font='华文仿宋']a便携式饱和标准电池;AZ[/font][font='华文仿宋']19[/font][font='华文仿宋']直流检流计;电源([/font][font='华文仿宋']2.9-3.3[/font][font='华文仿宋']V[/font][font='华文仿宋'])[/font][font='华文仿宋'][color=#ff0000];[/color][/font][font='华文仿宋']硫酸锌;硫酸铜;邻苯二甲酸氢钾;醌氢醌;铜棒;锌棒;甘汞电极;[/font][font='华文仿宋']铂[/font][font='华文仿宋']电极;盐桥[/font][font='华文仿宋'][color=#ff0000]。[/color][/font][font='华文仿宋']2.2[/font][font='华文仿宋']实验步骤[/font][font='华文仿宋']恒温水浴中,分别使用UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型直流高电势电位差计和SDC-[/font][font='华文仿宋']Ⅱ数字[/font][font='华文仿宋']电位差综合测试[/font][font='华文仿宋']仪按照[/font][font='华文仿宋']标准实验步骤[/font][font='华文仿宋'][[/font][font='华文仿宋']7][/font][font='华文仿宋']步骤测量以下电池电势,其中铜棒和锌棒在经过充分的打磨使其表面光滑铮亮后使用,待测醌氢醌溶液由[/font][font='华文仿宋']邻苯[/font][font='华文仿宋']二甲氢钾[/font][font='华文仿宋']溶液加少量醌氢醌粉末配置而成。[/font][font='华文仿宋']电池([/font][font='华文仿宋']1)[/font][font='华文仿宋']:[/font][font='华文仿宋'](饱和水溶液[/font][font='华文仿宋'])[/font][font='华文仿宋'](待测[/font][font='华文仿宋'])[/font][/size][align=left][size=18px][font='华文仿宋']电池(2[/font][font='华文仿宋'])[/font][font='华文仿宋']:[/font][font='华文仿宋'](饱和水溶液[/font][font='华文仿宋'])[/font][font='华文仿宋']([/font][font='华文仿宋'])[/font][/size][/align][align=left][size=18px][font='华文仿宋']电池(3[/font][font='华文仿宋'])[/font][font='华文仿宋']:[/font][font='华文仿宋']([/font][font='华文仿宋'])[/font][font='华文仿宋'](饱和水溶液[/font][font='华文仿宋'])[/font][/size][/align][align=left][size=18px][font='华文仿宋']电池(4[/font][font='华文仿宋']):[/font][font='华文仿宋']([/font][font='华文仿宋'])[/font][font='华文仿宋']([/font][font='华文仿宋'])[/font][/size][/align][align=left][size=18px][font='华文仿宋']使用UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型直流高电势电位差计时,首先需要调节温度补偿旋钮是其示数等于标准电池电势,而标准电池电势与温度的关系如下,[/font][/size][/align][align=center][size=18px][/size][/align][size=18px][font='华文仿宋']其中,T为环境温度,单位为[/font][font='华文仿宋']。然后接入电源、待测电池、检流计等进行调零和测量。[/font][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301820170731_6190_5439527_3.png[/img][/size][align=center][size=18px][font='华文仿宋']图2[/font][font='华文仿宋'].[/font][font='华文仿宋']UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型直流高电势电位差计示意图[/font][/size][/align][align=center][size=18px][font='times new roman']P[/font][font='times new roman']icture 2. UJ25 DC High Potential Potentiometer diagram[/font][/size][/align][align=center][size=18px][/size][/align][size=18px][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301820171699_3268_5439527_3.png[/img][font='华文仿宋']而SDC[/font][font='华文仿宋']-[/font][font='华文仿宋']Ⅱ数字[/font][font='华文仿宋']电位差综合测试仪与UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型电位差计使用方法略有不同。该仪器在使用前应先进行1[/font][font='华文仿宋']5min[/font][font='华文仿宋']的预热。本文在采用内标法测量电池电动势时,只需用导线将待测电池连接入电路中即可,不需要使用标准电池。测量时,首先旋至内标状态,接入[/font][font='华文仿宋']测试线[/font][font='华文仿宋']并调节五个数值旋钮使电位指示显示为“1[/font][font='华文仿宋'].000000[/font][font='华文仿宋']”V,补偿旋钮逆时针[/font][font='华文仿宋']旋[/font][font='华文仿宋']到底,随后将两测量线短接,待检零指示[/font][font='华文仿宋']示[/font][font='华文仿宋']数稳定后按下“归零”使指示为“0[/font][font='华文仿宋']000”[/font][font='华文仿宋']。然后接入待测电池,在仪器测量状态下由大到小调节测量旋钮,尽可能[/font][font='华文仿宋']使检零[/font][font='华文仿宋']指示接近于零,最后调节至补偿旋钮[/font][font='华文仿宋']时检零[/font][font='华文仿宋']指示[/font][font='华文仿宋']示[/font][font='华文仿宋']数基本不变或者变化很缓慢时即可记录下电位示数,此时示数就是待测电池电动势。外标法测量时除了不用外接检流计外,使用步骤与UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型电位差计相同,本文并未使用。[/font][/size][align=center][size=18px][font='华文仿宋']图3[/font][font='华文仿宋'].[/font][font='华文仿宋'] [/font][font='华文仿宋']SDC[/font][font='华文仿宋']-[/font][font='华文仿宋']Ⅱ[/font][font='华文仿宋']数字[/font][font='华文仿宋']电位差综合测试仪示意图[/font][/size][/align][align=center][size=18px][font='times new roman']P[/font][font='times new roman']icture 3. [/font][font='times new roman']SDC[/font][font='times new roman']-[/font][font='times new roman']Ⅱ[/font][font='times new roman']D[/font][font='times new roman']igital Potential Difference Comprehensive Test Instrument diagram[/font][/size][/align][size=18px][font='等线 light']3[/font][font='等线 light']实验结果和讨论[/font][font='华文仿宋']3.1[/font][font='华文仿宋']溶液p[/font][font='华文仿宋']H[/font][font='华文仿宋']的测定[/font][/size][align=left][size=18px][font='华文仿宋']醌氢醌电池测量溶液pH的原理同酸度计([/font][font='华文仿宋']pH[/font][font='华文仿宋']计[/font][font='华文仿宋'])[/font][font='华文仿宋']一样,都是由电极反应包含氢离子的指示电极和参比电极组成,其中参比电极的电极电势是确定已知的[/font][font='华文仿宋'][[/font][font='华文仿宋']9][/font][font='华文仿宋']。本实验中,参比电极为甘汞电极,指示电极为铂电极,铂电极上发生的电极反应为,[/font][/size][/align][align=center][size=18px][/size][/align][size=18px][font='华文仿宋']稀溶液状态下,[/font][font='华文仿宋']醌[/font][font='华文仿宋']和氢醌浓度相等且活度近似为[/font][font='华文仿宋']1[/font][font='华文仿宋'],可得,[/font][/size][align=center][size=18px][/size][/align][size=18px][font='华文仿宋']而在甘汞电极同样有电极反应发生,产生一定电极电势,由此可计算得到醌氢醌电极和甘汞电极构成的原电池的电动势为,[/font][font='华文仿宋']将式[/font][font='华文仿宋'](1[/font][font='华文仿宋'])和([/font][font='华文仿宋']2)[/font][font='华文仿宋']联立可得溶液[/font][font='华文仿宋']pH[/font][font='华文仿宋']的计算公式。[/font][font='华文仿宋']将恒温水浴调节至[/font][font='华文仿宋']时,测得醌氢醌电池电动势如下,利用公式[/font][font='华文仿宋']计算得到溶液[/font][font='华文仿宋']pH[/font][font='华文仿宋'],其中,[/font][/size][align=center][size=18px][/size][/align][align=center][size=18px][/size][/align][size=18px][font='华文仿宋']将计算结果与文献值([/font][font='华文仿宋'])[/font][font='华文仿宋']相比较,得到下列数据。[/font][/size][align=center][size=18px][font='华文仿宋']表1[/font][font='华文仿宋'].[/font][font='华文仿宋']UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型仪器测量数据[/font][/size][/align][align=center][size=18px][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301820175057_6309_5439527_3.png[/img][font='times new roman']Figure 1. UJ25 Instrument measure data[/font][/size][/align][align=center][size=18px][/size][/align][align=center][size=18px][/size][/align][align=center][size=18px][/size][/align][align=center][size=18px][/size][/align][align=center][size=18px][/size][/align][align=center][size=18px][/size][/align][align=center][size=18px][font='华文仿宋']表2[/font][font='华文仿宋'].[/font][font='华文仿宋'] [/font][font='华文仿宋']SDC[/font][font='华文仿宋']-[/font][font='华文仿宋']Ⅱ[/font][font='华文仿宋']型仪器测量数据[/font][/size][/align][align=center][size=18px][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301820175771_6426_5439527_3.png[/img][font='times new roman']F[/font][font='times new roman']igure 2. [/font][font='times new roman']SDC[/font][font='times new roman']-[/font][font='times new roman']Ⅱ[/font][font='times new roman']I[/font][font='times new roman']nstrument measure data[/font][/size][/align][size=18px][font='华文仿宋']分别计算使用两种仪器测量时[/font][font='华文仿宋']pH[/font][font='华文仿宋']计算结果的平均值,并采用如下方法计算出本实验测量结果同文献值的偏离程度S,[/font][/size][align=center][size=18px][/size][/align][size=18px][font='华文仿宋']可得到以下结果,[/font][font='华文仿宋']此外,根据以上计算结果可以计算得到平均值的相对误差,分别为[/font][font='华文仿宋'],[/font][font='华文仿宋']。从计算结果来看,[/font][font='华文仿宋'],[/font][font='华文仿宋'],很明显针对测量溶液pH这一实验步骤,使用SDC[/font][font='华文仿宋']-[/font][font='华文仿宋']Ⅱ数字[/font][font='华文仿宋']电位差综合测试仪的计算结果更加准确和稳定。除此之外,利用p[/font][font='华文仿宋']H[/font][font='华文仿宋']计测定所配制醌氢醌溶液的pH时,其示数稳定在4[/font][font='华文仿宋'].0[/font][font='华文仿宋']左右。将9组pH计算结果绘制成如下图表,可以看到,相比于UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型电位差计,使用SDC[/font][font='华文仿宋']-[/font][font='华文仿宋']Ⅱ数字式仪器的计算结果更多地稳定在相对误差1[/font][font='华文仿宋'].0%[/font][font='华文仿宋']之内,而前者则部分稳定在0[/font][font='华文仿宋'].5%[/font][font='华文仿宋']之内,但相对来说[/font][font='华文仿宋']SDC[/font][font='华文仿宋']-[/font][font='华文仿宋']Ⅱ型仪器[/font][font='华文仿宋']稳定性较高一点,这与两种仪器测量过程中的使用方式有关。UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型仪器使用时需要不断按压按键有关,[/font][font='华文仿宋']有时会因对检流计指针偏转观察不到位,而导致按压时间过长,使待测电池通过较大电流,破坏了电池的平衡条件,使测量结果产生误差。同时,使用UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型仪器时,误差同样会出现在对检流计指针是否指向零和指针偏向的判断上,这难以避免,但系统误差出现于每一次测量中,不过在本实验中这样的误差影响很小,可以忽略。SDC[/font][font='华文仿宋']-[/font][font='华文仿宋']Ⅱ型仪器使用时不用判断指针偏转,而是[/font][font='华文仿宋']通过检流指示[/font][font='华文仿宋']的数值来确定被测电动势的值,大大简化了调节和测量过程。理想状态下,调节补偿旋钮[/font][font='华文仿宋']至检流[/font][font='华文仿宋']指示为“0[/font][font='华文仿宋']000[/font][font='华文仿宋']”时可记录下被测电动势的值,但在实际情况中,示数会不断变动,使得测量时不易判断测量电路电流为零的时刻,这对仪器测量结果的稳定性有一定影响。[/font][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301820177860_9891_5439527_3.png[/img][/size][align=center][size=18px][font='华文仿宋']图4[/font][font='华文仿宋']. [/font][font='华文仿宋']UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型与SDC[/font][font='华文仿宋']-[/font][font='华文仿宋']Ⅱ型仪器计算结果距离图[/font][/size][/align][align=center][size=18px][font='times new roman']P[/font][font='times new roman']icture 4. UJ25 and [/font][font='times new roman']SDC[/font][font='times new roman']-[/font][font='times new roman']Ⅱ[/font][font='times new roman']I[/font][font='times new roman']nstrument result distance diagram[/font][/size][/align][align=center][size=18px][/size][/align][size=18px][font='华文仿宋']一定温度下,醌氢醌电池电动势仅与溶液中氢离子活度有关,温度改变时溶液氢离子活度会发生变化,这种变化则会反应在电池电势上,因此可以利用电化学方法测定溶液酸碱度,本实验所搭建的醌氢醌电池是测定溶液p[/font][font='华文仿宋']H[/font][font='华文仿宋']比较准确的方法。为探究温度对电池电势及溶液p[/font][font='华文仿宋']H[/font][font='华文仿宋']的影响,本文分别利用UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型仪器和SDC[/font][font='华文仿宋']-[/font][font='华文仿宋']Ⅱ型仪器测定了不同温度下电池[/font][font='华文仿宋'](1)[/font][font='华文仿宋']的电池电势,结果如下,[/font][/size][align=center][size=18px][font='华文仿宋']表3[/font][font='华文仿宋']. [/font][font='华文仿宋']两种仪器醌氢醌电池电势测量数据表[/font][/size][/align][align=center][size=18px][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301820178506_4759_5439527_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301820180106_1033_5439527_3.png[/img][font='times new roman']F[/font][font='times new roman']igure 3. The Q/HQ battery potential measure data of two instrument [/font][/size][/align][size=18px][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301820180926_4920_5439527_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301820182088_5502_5439527_3.png[/img][font='楷体'] [/font][font='楷体'] [/font][font='华文仿宋'] [/font][font='华文仿宋'] [/font][font='华文仿宋']UJ[/font][font='华文仿宋']25[/font][font='楷体'] [/font][font='楷体'] [/font][font='华文仿宋'] [/font][font='华文仿宋']SDC[/font][font='华文仿宋']-[/font][font='华文仿宋']Ⅱ[/font][/size][align=center][size=18px][font='华文仿宋']图5[/font][font='华文仿宋'].[/font][font='华文仿宋']两种仪器醌氢醌电池电势随温度的变化趋势图[/font][/size][/align][align=center][size=18px][font='times new roman']P[/font][font='times new roman']icture 5. The variation [/font][font='times new roman']t[/font][font='times new roman']rend diagram on battery potential with temperature of two instrument[/font][/size][/align][align=center][size=18px][/size][/align][size=18px][font='华文仿宋']观察到电池电势随温度的升高而下降,并且[/font][font='华文仿宋']UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型直流高电势电位差计和SDC-[/font][font='华文仿宋']Ⅱ[/font][font='华文仿宋']数字[/font][font='华文仿宋']电位差综合测试仪所测得的电动势随温度变化的拟合效果都比较好,均可以应用于该实验当中。以SDC[/font][font='华文仿宋']-[/font][font='华文仿宋']Ⅱ数字[/font][font='华文仿宋']电位差综合测试仪为例,以温度为横坐标,电池电势为纵坐标作图可得到一条电势随温度变化曲线,其斜率为该电池的温度系数,即[/font][font='华文仿宋'],利用温度系数即可计算得到不同温度下电池反应的[/font][font='华文仿宋']、[/font][font='华文仿宋']、[/font][font='华文仿宋'],计算结果如下[/font][font='华文仿宋'],[/font][font='华文仿宋']时,[/font][/size][align=center][size=18px][/size][/align][align=center][size=18px][/size][/align][size=18px][font='华文仿宋']3.2[/font][font='华文仿宋']铜、[/font][font='华文仿宋']锌标准[/font][font='华文仿宋']电极电势及丹聂耳电池电势的测定[/font][font='华文仿宋']查阅文献可知,[/font][font='华文仿宋']溶液的离子活度系数分别为0[/font][font='华文仿宋'].016[/font][font='华文仿宋']和0[/font][font='华文仿宋'].015[/font][font='华文仿宋'][6][/font][font='华文仿宋']。可利用下列公式计算得到铜、[/font][font='华文仿宋']锌标准[/font][font='华文仿宋']电极电势及丹聂耳电池电势的数值,[/font][font='华文仿宋']已知文献值([/font][font='华文仿宋']),可计算得到相对误差如下表所示,[/font][/size][align=center][size=18px][font='华文仿宋']表4[/font][font='华文仿宋'].[/font][font='华文仿宋']甘汞-铜电池电势测量数据[/font][/size][/align][align=center][size=18px][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301820182685_4381_5439527_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301820183789_1957_5439527_3.png[/img][font='times new roman']F[/font][font='times new roman']igure 4. Calomel-Copper Cell potential measure data[/font][/size][/align][align=center][size=18px] [/size][/align][align=center][size=18px][/size][/align][align=center][size=18px][/size][/align][align=center][size=18px][font='华文仿宋']表5[/font][font='华文仿宋']. [/font][font='华文仿宋']锌-甘汞电池电势测量数据[/font][/size][/align][align=center][size=18px][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301820184600_8826_5439527_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301820185635_5928_5439527_3.png[/img][font='times new roman']F[/font][font='times new roman']igure 5. Zinc-Calomel Cell potential measure data[/font][/size][/align][align=center][size=18px][/size][/align][align=center][size=18px][font='华文仿宋']表6[/font][font='华文仿宋'].[/font][font='华文仿宋']锌-铜电池电势测量数据[/font][/size][/align][align=center][size=18px][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301820187225_2491_5439527_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301820187510_1403_5439527_3.png[/img][font='times new roman']F[/font][font='times new roman']igure 6. Zn-Cu Cell potential measure data[/font][/size][/align][size=18px][font='华文仿宋']由这些图表我们观察到,使用SDC-Ⅱ型仪器测量时相对误差要小于使用UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型仪器时的相对误差,整体来看其测量结果准确性略高,可以用于代替传统仪器进行原电池实验的测定。此外,我们发现配制浓度为[/font][font='华文仿宋']溶液同样可以计算得到铜电极和锌电极的标准电极电势,且相对误差均较小,在一定程度上可以节省金属盐类试剂用量,减轻实验废液回收的压力。[/font][/size][align=center][size=18px][font='华文仿宋']表7[/font][font='华文仿宋'].[/font][font='华文仿宋']低浓度溶液电池电势测量数据[/font][/size][/align][align=center][size=18px][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301820188359_6793_5439527_3.png[/img][font='times new roman']F[/font][font='times new roman']igure 7. low-concentration solution cell potential measure data[/font][/size][/align][align=center][size=18px][/size][/align][size=18px][font='华文仿宋']此外,本次实验记录了完成四个电池电势测量所需要的完整时长,如下表所示。[/font][font='华文仿宋']UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']仪器配合检流计使用,检流计指针[/font][font='华文仿宋']转动对实验有一定影响,而[/font][font='华文仿宋']SDC[/font][font='华文仿宋']-[/font][font='华文仿宋']Ⅱ[/font][font='华文仿宋']仪器的[/font][font='华文仿宋']“检零示数”[/font][font='华文仿宋']常出现数值左右摆动的情况,做实验时[/font][font='华文仿宋']无法快速记录数据[/font][font='华文仿宋'],[/font][font='华文仿宋']会[/font][font='华文仿宋']在一定程度上延长实验操作时间,[/font][font='华文仿宋']所以总体来说[/font][font='华文仿宋']使用两种仪器进行实验的耗时相差不大,但是使用SDC[/font][font='华文仿宋']-[/font][font='华文仿宋']Ⅱ型[/font][font='华文仿宋']仪器[/font][font='华文仿宋']相对于UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型电位差计在操作上会[/font][font='华文仿宋']更加简便和智能化[/font][font='华文仿宋']。[/font][/size][align=center][size=18px][font='华文仿宋']表8[/font][font='华文仿宋']. [/font][font='华文仿宋']原电池电动势测定实验时间统计数据[/font][/size][/align][align=center][size=18px][font='times new roman']F[/font][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301820189764_6869_5439527_3.png[/img][font='times new roman']igure 8. Galvanic Cell Electromotive Force Measurement Experiment time data[/font][/size][/align][align=center][size=18px][/size][/align][align=center][size=18px][/size][/align][size=18px][font='等线 light']4[/font][font='等线 light']结论与展望[/font][font='华文仿宋']UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型直流高电势电位差计使用时需要与检流计连接,通过观察检流计指针变化来调节测量旋钮测定待测电池电动势。在测量过程中,UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型仪器需要不断按压使测量电路中通过电流,使检流计指针偏转从而调节阻值旋钮,而这容易出现按压时间过长的情况,使通过原电池的电流不趋于零,产生较大的极化电势,影响实验结果。此外,对检流计指针是否[/font][font='华文仿宋']指零易产生[/font][font='华文仿宋']误判,从而记录下不准确的测量结果。标准电池精确与否也容易给实验带来大的误差。使用UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型仪器开始测量前,需要用导线将检流计、标准电池、电源、待测电池连接进电路中,这一过程比较繁琐,导线数量的增多可能会对仪器内部阻值分布造成影响。长久以来,该仪器一直被使用于原电池电动势的测定实验中,具有一定的准确性,且经过验证其测量结果的相对误差较小,符合实验规范。[/font][font='华文仿宋']SDC-[/font][font='华文仿宋']Ⅱ数字[/font][font='华文仿宋']电位差综合测试[/font][font='华文仿宋']仪相对[/font][font='华文仿宋']于传统仪器使用更加方便,不需要连接繁琐的电路,其配备有专门的导线,使导线对实验的影响降到最低。该仪器采用数字化的表盘,避免了判断指针偏向的失误,其相对于UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型仪器更加智能化,更加灵敏,能够检测到由于微小扰动所造成的电池电动势变化。但在判断测量电路中电流为零的时间点的把握上,[/font][font='华文仿宋']即检流示[/font][font='华文仿宋']数何时算是趋近于零,SDC-Ⅱ型仪器主观性更大。实验过程中,[/font][font='华文仿宋']检流示[/font][font='华文仿宋']数时常晃动,干扰结果判定,无法准确确定测量结果,在无形中会延长实验时间。此外,相较于UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型仪器,SDC-[/font][font='华文仿宋']Ⅱ数字[/font][font='华文仿宋']电位差综合测试仪采用内标法测量时,不用接入标准电池,不会受到标准电池老化、受潮等因素的影响,测量结果准确,相对误差小。[/font][font='华文仿宋']总体来看,SDC-Ⅱ型仪器操作更加简单方便,准确性较高,可以在原电池电动势的测定实验中代替UJ[/font][font='华文仿宋']25[/font][font='华文仿宋']型仪器作为测量仪器使用。[/font][font='华文仿宋']对于物理化学实验来说,掌握测量过程和实验步骤是次要的,理解每一个实验的物理化学原理才是主要的。只有真正理解实验原理,运用原理于实践中才能得心应手。现代社会中,智能化是大趋势,然而在许多智能化仪器的帮助下,学生们只知道如何使用,却往往不会去了解实验背后的化学原理,因此,如何权衡数字化仪器带来简便快捷的同时又不利于加深学生对实验原理理解的矛盾,是需要进一步深入思考的问题。[/font][font='等线 light']5[/font][font='等线 light']参考文献[/font][font='宋体'][[/font][font='宋体']1][/font][font='宋体']李[/font][font='宋体']苞[/font][font='宋体'],张虎成,张树霞,等.对消法测定原电池电动势实验中电极制备的改进[[/font][font='宋体']J].[/font][font='宋体']大学化学,2[/font][font='宋体']014,29([/font][font='宋体']2[/font][font='宋体']):59-63.[/font][font='宋体'][[/font][font='宋体']2][/font][font='宋体']赵会玲,宋江闯,[/font][font='宋体']熊焰[/font][font='宋体'].“原电池电动势的测定”实验的几点改进[[/font][font='宋体']J][/font][font='宋体'].广州化工,2[/font][font='宋体']015,(9):196-197.[/font][/size][align=left][size=18px][font='宋体'][[/font][font='宋体']3[/font][font='宋体']]胡俊平,刘妍,毕慧敏,等.物理化学实验项目改进创新——以“原电池电动势的测定及在热力学上的应用”为例[J].化学教育,2016,37(10):32-34. [/font][/size][/align][size=18px][font='宋体'][[/font][font='宋体']4[/font][font='宋体']]宋江闯,赵会玲,马淑然,等.高阻抗法测定原电池电动势及其温度系数[J][/font][font='宋体'].[/font][font='宋体']电源技术,2013,37(12):2182-2184,2264. [/font][font='宋体'][[/font][font='宋体']5[/font][font='宋体']]范国康,方卉慧.原电池电动势测定实验的微量化改进[J].科教导刊-电子版(中旬),2020(6):175.[/font][font='宋体'][[/font][font='宋体']6][/font][font='宋体']天津大学物理化学教研室编.物理化学第六版(下)[/font][font='宋体'][M].[/font][font='宋体']北京:高等教育出版社,[/font][font='宋体'] [/font][font='宋体']2[/font][font='宋体']017[/font][font='宋体'].[/font][font='宋体'][[/font][font='宋体']7][/font][font='宋体']柯以侃,王桂花.大学化学实验第二版[[/font][font='宋体']M].[/font][font='宋体']北京:化学工业出版社,[/font][font='宋体'] 2010.[/font][font='宋体'][[/font][font='宋体']8]杨小勇,蔡飞宇,高康康,等.《原电池电动势测定》教学方法思考[J].课程教育研究[/font][font='宋体']([/font][font='宋体']新教师教学[/font][font='宋体'])[/font][font='宋体'],2013(34):314-314.[/font][font='宋体'][[/font][font='宋体']9]刘金峰.pH计的原理、使用方法和维护[J].口腔护理用品工业,2019,29(2):35-36.[/font][/size]
不知道什么型号zeta电位测定仪适合测定污水污泥的zeta电位?
不知道什么型号的zeta电位测定仪适合测定污水处理厂污泥的zeta电位?
电位分析法教学目的:1、了解电位分析法的特点,测定pH的原理、参比电极和指示电极。2、掌握酸度计的原理和维护。3、了解电位滴定技术。教学重点与难点:酸度计的原理。教学内容: 一、电化学基础知识1、电极电位: M Mn+ + ne 金属溶解进水中遗留下自由电子,而金属离子受金属表面负电子的吸引聚集在金属表面,达到动态平衡,双电层也就是金属和盐溶液之产生一定电位差,这种电位差叫做电极电位。2、能斯特方程(电极电位方程)对于 aA + bB cC + dD 0.059 a b j = jo × lg (25℃) n c d例: Mn+ + ne M 0.059 0.059 j = jo + lg = jo + lg n n 3、标准电极电位当待测电极氧化态的活度和还原态的活度均为1时,以标准氢电极作参比,
请问有哪位高手能指点一下小弟,综合测定水的基本步骤和一些方法,非常感谢!!![em09]
如题,在测试某样品时,发现在滴定终点附近仪器不是以我设置的最小加液量0.01mL来添加,而是0.024,0.020,0.026,我将电位差由原来的8mV变为现在的4mV,虽然有好转,但是最小加液量还是不是以最小加液量来添加的。除了更改电位差外,还有什么更好的办法?另外,将电位差变为4mV后,最大加液量出现的次数减小了,以前的话在测试过程中有4-5次,而现在只有一次?
电位滴定仪和水分测定仪有什么区别呢?
雷磁ZDJ-4A自动电位测定仪有关参数请教,例如测定水中碱度,参数如何设置?
各位前辈,我想测矿石中的氟,要买一台电位测定仪,用氟离子选择电极来测氟含量,梅特勒和赛多利斯有没有合适的型号推荐一下?大家有做过的也给说说
硫醇硫测定仪怎么去的电位突变范围?
【篇名】 微波消解光度法测定COD及综合效益分析【摘要】 微波密闭消解水样(10mL)15min,然后用分光光度法测定消解液中Cr3+的浓度,通过作纯物质标准系列的重复实验,对其标准曲线的相关性、斜率、截距进行检验。通过实际水样进行应用可行性及综合效益分析,研究结果表明:微波消解光度法所测COD值与标准法测定值有很好的一致性,准确度较好 在单次测试中,本法测试成本约为标准法的50%,其潜在的二次污染比标准法低。因此,微波消解光度法具有良好的应用前景。 [img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=35118]微波消解光度法测定COD及综合效益分析.pdf[/url]
【篇名】 微波消解光度法测定COD及综合效益分析【摘要】 微波密闭消解水样(10mL)15min,然后用分光光度法测定消解液中Cr3+的浓度,通过作纯物质标准系列的重复实验,对其标准曲线的相关性、斜率、截距进行检验。通过实际水样进行应用可行性及综合效益分析,研究结果表明:微波消解光度法所测COD值与标准法测定值有很好的一致性,准确度较好 在单次测试中,本法测试成本约为标准法的50%,其潜在的二次污染比标准法低。因此,微波消解光度法具有良好的应用前景。 [img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=35118]微波消解光度法测定COD及综合效益分析.pdf[/url]
谁有日本COM-1600自动电位滴定仪、AQ-2100库仑法水份测定仪、AQV-300容量法卡尔费休水份测定仪、AQV-2100容量法卡尔费休水份测定仪的电子版中文手册啊?有的话给我传一份,或者发送到我的邮箱里,我将赠送1000积分给提供资料的人。我的邮箱是zhwaisw@163.com

http://ng1.17img.cn/bbsfiles/images/2015/07/201507231345_556896_2820254_3.jpg高锰酸盐指数,现行国家标准中,测定水体中少量有机和无机可氧化性物质的常用指标,即化学需氧量低浓度的测定。一般测定范围为(0.5—4.5)mg/L。此方法以高锰酸钾为氧化剂,氧化水样中的某些有机物及无机还原性物质。 高锰酸盐指数在以往的水质监测分析书上,也被称为化学需氧量的高锰酸钾法。由于在规定条件下,水中有机物只能部分被氧化,并不是理论上的需氧量,也不是反映水体中总有机物含量的尺度。因此,用高锰酸盐指数这一术语作为水质的一项指标,以有别于重铬酸钾法的化学需氧量(应用于工业废水),更符合于客观实际。KN-CM10型高锰酸盐指数测定仪是参照GB11892--89中规定的相关测定内容,采用独创试剂和检测方法,利用单片机技术进行数据处理的实验室精密分析仪器。该仪器的设计性能满足国家相关环境保护行业标准的要求,并采用了全数码数字显示,使浓度示值显示简洁明了。相较于传统高锰酸盐指数滴定的方法,KN-CM10型高锰酸盐指数测定仪具有以下几个特点:1、采用固定波长分光光光度法,内置大量实验综合测定参数,实验数据更加精准。2、仪器属低耗能设备,且试剂用量少,整体运行费用较低。3、实验操作简单,适合在实验室进行大批次水样测定,能够广泛的应用于各种行业(环保、卫生、印染、化工、石油、焦化、造纸、冶金、酿造、医药)废水的检测。