磷酸化蛋白质及多肽相关研究的技术进展 摘要磷酸化修饰是一种重要的蛋白质化学修饰,对蛋白质功能的完成或改变起到重要作用。该领域的研究存在很多技术难点,对该领域研究形成了挑战。近年来相关技术有了很多突破,磷酸化研究也取得了很多新的成就。文章将从磷酸化蛋白的检出、磷酸化蛋白质和肽段的富集、生物质谱技术的改进以及磷酸化蛋白和多肽的定量与比较几个方面介绍该研究领域的技术进展。关键词磷酸化蛋白磷酸化肽生物质谱定量分析生命活动与蛋白质的动态变化密切 摘要 磷酸化修饰是一种重要的蛋白质化学修饰, 对蛋白质功能的完成或改变起到重要作用。该领域的研究存在很多技术难点, 对该领域研究形成了挑战。近年来相关技术有了很多突破, 磷酸化研究也取得了很多新的成就。文章将从磷酸化蛋白的检出、磷酸化蛋白质和肽段的富集、生物质谱技术的改进以及磷酸化蛋白和多肽的定量与比较几个方面介绍该研究领域的技术进展。 关键词 磷酸化蛋白 磷酸化肽 生物质谱 定量分析
一、 前言基因工程已令人难以置信的扩展了我们关于有机体DNA序列的认识。但是仍有许多新识别的基因的功能还不知道,也不知道基因产物是如何相互作用从而产生活的有机体的。功能基因组试图通过大规模实验方法来回答这些问题。但由于仅从DNA序列尚不能回答某基因的表达时间、表达量、蛋白质翻译后加工和修饰的情况、以及它们的亚细胞分布等等,因此在整体水平上研究蛋白质表达及其功能变得日益显得重要。这些在基因组中不能解决的问题可望在蛋白质组研究中找到答案。蛋白质组研究的数据与基因组数据的整合,将会在后基因组研究中发挥重要作用。目前蛋白质组研究采用的主要技术是双向凝胶电泳和质谱方法。双向凝胶电泳的基本原理是蛋白质首先根据其等电点,第一向在pH梯度胶内等电聚焦,然后转90度按他们的分子量大小进行第二向的SDS-PAGE分离。质谱在90年代得到了长足的发展,生物质谱当上了主角,蛋白质组学又为生物质谱提供了一个大舞台。他们中首选的是MALDI-TOF,其分析容量大,单电荷为主的测定分子量高达30万,干扰因素少,适合蛋白质组的大规模分析。其次ESI为主的LC-MS联机适于精细的研究。本文将简介几种常用的生物质谱技术,并着重介绍生物质谱技术在蛋白质组学各领域的应用。二、 生物质谱技术1.电喷雾质谱技术(ESI)电喷雾质谱技术( Electrospray Ionization Mass Spectrometry , ESI - MS) 是在毛细管的出口处施加一高电压,所产生的高电场使从毛细管流出的液体雾化成细小的带电液滴,随着溶剂蒸发,液滴表面的电荷强度逐渐增大,最后液滴崩解为大量带一个或多个电荷的离子,致使分析物以单电荷或多电荷离子的形式进入气相。电喷雾离子化的特点是产生高电荷离子而不是碎片离子, 使质量电荷比(m/ z) 降低到多数质量分析仪器都可以检测的范围,因而大大扩展了分子量的分析范围,离子的真实分子质量也可以根据质荷比及电荷数算出。2.基质辅助激光解吸附质谱技术(MOLDI)基质辅助激光解析电离(MOLDI)是由德国科学家Karas和Hillenkamp发现的。将微量蛋白质与过量的小分子基体的混合液体点到样品靶上,经加热或风吹烘干形成共结晶,放入离子源内。当激光照射到靶点上时,基体吸收了激光的能力跃迁到激发态,导致蛋白质电离和汽化,电离的结果通常是基体的质子转移到蛋白质上。然后由高电压将电离的蛋白质从离子源转送到质量分析器内,再经离子检测器和数据处理得到质谱图。TOF质量分析器被认为是与MALDI的最佳搭配,因为二者都是脉冲工作方式,在质量分析过程中离子损失很少,可以获得很高的灵敏度。TOF质量分析器结果简单,容易换算,蛋白质离子在飞行管内的飞行速度仅与他的(m/z)-1/2成正比,因此容易通过计算蛋白质离子在飞行管内的飞行时间推算出蛋白质离子的m/z值。与传统质量分析器相比,更易得到高分辨率和高测量精度;速度快,离子飞行时间仅为几个μs和约100μs之间;质量范围宽,可以直接检测到几十万道尔顿的单电荷离子。飞行时间质量分析器被认为是21世纪最有应用前景的质量分析器。3.傅立叶变换-离子回旋共振质谱(FT-ICR MS)傅立叶变换-离子回旋共振质谱法(FT-ICR MS)是离子回旋共振波谱法与现代计算机技术相结合的产物。傅立叶变换-离子回旋共振质谱法是基于离子在均匀磁场中的回旋运动, 离子的回旋频率、半径、速度和能量是离子质量和离子电荷及磁场强度的函数, 当对离子施加与其回旋频率相同的射频场作用时, 离子将同相位加速到一较大的半径回旋, 从而产生可被接受的类似电流的信号。傅立叶变换-离子回旋共振质谱法所采用的射频范围覆盖了欲测定的质量范围,所有离子同时被激发, 所检测的信号经过傅立叶变换, 转换为质谱图。其主要优点有:容易获得高分辨;便于实现串极质谱分析;便于使用外电离源并与色谱仪器联用。此外,他还有灵敏度高,质量范围宽,速度快,性能可靠等优点。4.快原子轰击质谱技术(FABMS)快原子轰击质谱技术( Fast Atom Bomebardment Mass Spectrometry , FABMS) 是一种软电离技术,是用快速惰性原子射击存在于底物中的样品,使样品离子溅出进入分析器,这种软电离技术适于极性强、热不稳定的化合物的分析,特别适用于多肽和蛋白质等的分析研究。FABMS能提供有关离子的精确质量,从而可以确定样品的元素组成和分子式。而FABMS -MS 串联技术的应用可以提供样品较为详细的分子结构信息,从而使其在生物医学分析中迅速发展起来。三、蛋白质的分析鉴定随着质谱技术的发展,分子量的测定已从传统的有机小分子扩展到了生物大分子。MALDI-MS技术以其极高的灵敏度、精确度在蛋白质分析中得到了广泛的应用。该技术不仅可测定各种疏水性、亲水性和糖蛋白的分子量,还可直接测定蛋白质混合物的分子量。这可认为是蛋白质分析领域的一项重大突破。蛋白质组的研究是从整体水平上研究细胞或有机体内蛋白质的组成及其活动规律。质谱技术作为蛋白质组研究的三大支撑技术之一,除了用于多肽,蛋白质的分子量测定外,还广泛的应用于肽指纹图谱测定及氨基酸序列测定。肽指纹图谱(Peptide Mass Fingerprinting, PMF)测定是对蛋白酶解或降解后所得多肽混合物进行质谱分析的方法。质谱分析所得肽断与多肽蛋白数据库中蛋白质的理论肽断进行比较,判断出所测蛋白是已知还是未知。由于不同的蛋白质具有不同的氨基酸序列,不同蛋白质所得肽断具有指纹特征。采用肽指纹谱的方法已对酵母、大肠杆菌、人心肌等多种蛋白质组进行了研究。对肽序列的测定往往要应用串连质谱技术,采用不同的技术选择特定质核比的离子,并对其进行碰撞诱导解离,通过分析肽段的断裂情况推导出肽序列。四、后转录修饰的蛋白质的检测和识别在蛋白质组的研究中,蛋白质和多肽的序列分析已不局限于阐明蛋白质的一级结构,对翻译后的修饰的进一步分析也是蛋白质化学的一项重要任务。这种修饰对于蛋白质的功能非常重要,如:细胞识别中的蛋白质相互作用,信号传导和蛋白质定位。1. 蛋白质的糖基化糖蛋白在细胞内部,细胞膜和细胞外均有发现,实际上大部分蛋白质是糖蛋白。对糖蛋白的检测和分析发现,糖蛋白中糖组分的结构和功能具有多样性。糖蛋白中的糖通常是不同种类的,而且是由一些可控数量的单糖组成。糖基化的多样性与细胞周期,细胞分化和发展的状态有关。在蛋白组时代中,蛋白质的修饰会引起其理化性质的改变,因此是不容忽视的。从1D或2D凝胶得到的糖基化蛋白的识别,一般是进行MALDI-MS指纹分析, 或是对MALDI-PAD或ESI-MS/MS得到的碎片谱进行分析。对完整的糖蛋白的研究是非常困难的,所有已知的离子化技术都有其局限性。目前,人们主要研究糖肽,其好处之一就是质量减小了,这就会得到更好的分辨率,而且糖肽仍保留了糖基化位点。将分离的糖蛋白用不同的蛋白酶消化后就可进行糖肽的研究。一旦糖肽被识别出,就可以用串连质谱(ESI-MS/MS)来阐明肽序列。当蛋白的序列已知时,计算质量差就可推出其上附着的寡糖的质量。要将糖部分从糖蛋白中释放出来,可用化学切割或酶切割(流程图见图1)。目前,连有结构专一性糖苷酶的质谱在提供序列,分支和链接数据方面是最有力的技术。对于N糖基化常用的糖苷内切酶有PNGase-F, PNGase-A, EndoF和EndoH。化学切割也可以用来释放O-连接和N-连接的多糖,但经常出现的缺点是他会完全破坏所有的肽键,因而丢失了关于糖附着位点的信息。而且这些切割不能从糖肽中连续释放单糖。用肼的化学切割可以除去两种类型的糖基化。在60℃可专一性的释放O-连接的糖,而在95℃能释放N-连接的糖。释放O-原子更常用的方法是用碱进行β消除。通常,糖基中加入金属离子在MALDI和ESI中离子化。用MALDI-MS分析糖类的一个好的选择是将之与其他一些化合物混合,这样可以进一步提高灵敏度和分辨率。不同的质谱方法可以产生多糖的源后裂解(PSD)和碰撞诱导解离 (CID)谱,这可以给出有关糖的序列,分支及糖间的连接等信息。2. 蛋白质的磷酸化蛋白质中氨基酸的磷酸化在生命系统中起重要的作用。磷酸化经常作为分子开关控制不同过程蛋白质的活性,如新陈代谢,信号传导,细胞分裂等过程。因此,蛋白质中磷酰氨基酸的识别在蛋白质分析中是一项重要的工作。已知的磷酰氨基酸的类型有四种:1.O-磷酸盐,通过羟氨酸的磷酸化形成的,如丝氨酸,苏氨酸,酪氨酸。2.N-磷酸盐,通过精氨酸,赖氨酸或组氨酸中的氨基的磷酸化形成的。3.乙酰磷酸盐,通过天冬氨酸或谷氨酸的磷酸化形成的。4.S-磷酸酯,通过半胱氨酸的磷酸化形成的。
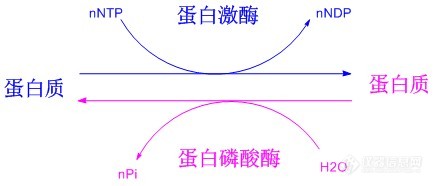
生命活动与蛋白质的动态变化密切相关, 很多情况下某些蛋白质是通过各种翻译后修饰来完成或改变其功能。在数量众多的蛋白质翻译后修饰中,蛋白质磷酸化修饰无疑是最重要的一类,它是指通过蛋白激酶(Protein kinase,PK)介导的酶促反应把磷酸基团从一个化合物转移到另一个化合物上的过程(Figure 1所示),是生物体内存在的一种普遍的调节方式。现今发现的所有人类蛋白质中超过30%可被磷酸化修饰,这一修饰在细胞信号的传递过程中占有极其重要的地位,与生命活动的许多过程都密切相关,对此的研究已经成为蛋白质科学的热点之一。 http://img.dxycdn.com/trademd/upload/userfiles/image/2012/09/1346918444_small.jpg磷酸化多肽(主要指肽链中的酪氨酸、丝氨酸和苏氨酸残基的侧链羟基被磷酸化生成酸式磷酸酯的修饰多肽)是研究蛋白质磷酸化过程的必不可少的工具,它可作为磷酸酶模型底物,或作为可产生抗磷酸化蛋白抗体的抗原,也可以在确定磷酸化蛋白的物理参数时作为参考化合物等。因此磷酸化多肽的合成在过去的几年中吸引了相当大的兴趣,目前已确定了较为成熟的合成路线,使磷酸化多肽的合成趋于常规。目前磷酸化多肽的合成主要有两个策略:后磷酸化法(Global phosphorylation)和单体法(Building block approach),如Figure 2所示。前者是在多肽序列合成结束后再在固相载体上对丝氨酸、苏氨酸或酪氨酸的侧链羟基进行磷酸化,可以在同一次合成中同时得到带有和不带有磷酸化位点的多肽;而后者则将适当保护的磷酸化氨基酸直接引入到多肽序列中,操作较前者更为简单,现已成为磷酸化多肽合成的首选策略。在采用单体法构建磷酸化多肽时,目前广泛采用的原料为侧链单苄基保护的氨基酸:Fmoc-AA(PO(OBzl)OH)-OH (AA = Ser, Thr or Tyr)。这类保护的磷酸化位点由于侧链磷酸化基团的离子化而产生较大的位阻效应,并且磷酸化位点的引入往往能促进肽链二级结构的形成,故而磷酸化位点及其后的氨基酸的引入会比较困难。这些问题在合成含有多个磷酸化位点的多肽时将会变得尤为严重,往往会使最终产物的组成非常复杂,难以进行纯化,甚至直接导致合成的失败。http://img.dxycdn.com/trademd/upload/userfiles/image/2012/09/1346918477_small.jpg一般来讲,增加投料量和延长反应时间都能促使连接反应趋于完全,但增加投料量无疑会提高合成成本,对于较昂贵的带有保护的磷酸化氨基酸更是这样,而延长反应时间则可能增加其它副反应发生的风险,故而在合成磷酸化多肽时,需要对氨基酸投料量、反应方法以及反应时长等进行优化调整以期达到更理想、更经济的合成效果。我们有针对性地对磷酸化多肽合成条件进行了探索和调整,采用最终的优化条件成功合成了含有多达六个磷酸化丝氨酸残基的多肽:FAM-Ahx-X(pS)XX(pS)X(pS)X(pS)XX(pS)X(pS)-NH2(客户肽,详细序列未给出;其氨基端标记FAM以进行荧光检测),经过RP-HPLC纯化后最终纯品的纯度高达95%(见Figure 3)。http://img.dxycdn.com/trademd/upload/userfiles/image/2012/09/1346918493_small.jpg参考文献:1. P. Cohen, “The Role of Protein Phosphorylation in Neural and Hormonal Control of Cellular Activity”, Nature, 1982, 296 (5858): 613-620.2. From: http://en.wikipedia.org/wiki/Protein_kinase.3. L. A. Pinna, A. Donella-Deana, “Phosphorylated Synthetic Peptides as Tools for Studying Protein Phosphatases”, Biochim. Biophys. Acta., 1994, 1222 (3): 415-431.4. W. C. Chan, P. D. White, “Fmoc Solid Phase Peptide Synthesis-A Practical Approach” (2000), Oxford University Press.
PS1利用基质辅助激光解吸电离-飞行时间(MALDI-TOF)技术来表征生物分子。样品溶于固定的底物中形成晶体,用激光脉冲使其离子化,离子被加速后通过飞行管时分离,所有离子均可被检测。系统包括三个组成部件:样品点样制备工作站(SymBiot 1)、生物质谱工作站(Voyager-DE PRO)和自动化分析软件(AutoMS-Fit)。SymBiot1 是一个自动样品处理系统,支持亚微升级微量点样,具有快速省时、重现性好的特点;Voyager-DE PRO是为蛋白质组研究专门设计的自动飞行时间质谱分析系统,配有AB公司之专利—延迟检测技术,具有高分辨率、质荷比宽等特点;AutoMS软件可以批处理方式或实时动态方式检索Protein Prospector蛋白数据库或您指定的蛋白数据库,查询参数可以任意设定,检索结果以Microsoft Access格式分类编号及储存。 PS 1技术平台建立伊始便受到了许多蛋白质课题研究组的关注。中国科学院上海生物化学研究所戚正武院士课题组从猪肝中提取某一活性蛋白组分,该组分理化性质不清楚,天然含量十分低,并无相关文献报道。用HPLC分离以后对活性组分的成分不能确定。上海基康生物技术有限公司运用PS 1系统对HPLC分离后的活性组分作了质谱分析,仅在一个工作日内就精确确定该组分由分子量极为相近的几种蛋白质构成,分子量精确度达到10 ppm。后经HPLC再次细分(洗脱梯度增加了2.5倍),证实了质谱的结论。此活性组分曾滤过1kD分子筛,基康的质谱数据纠正了研究人员过去对该活性组分分子量的误判,为研究人员明确实验方向、优化实验步骤提供了强有力的依据。 PS1除了可以进行生物大分子的精确分子量测定,还可用于蛋白的肽指纹图谱分析(peptide mass fingerprint,PMF),提供相关生物信息学服务,并且还可以利用源后衰变(Post Source Decay,PSD)技术来获得样品的MS/MS数据,以得到一级结构信息。PSD方法通常增加了激发激光的功率,使其超过产生一般肽指纹谱图所需功率的阈值,过剩的能量使前体离子在源内离子化之后发生裂解,产生一系列碎片离子,在反射器的作用下,最终可以得到一张连续的碎片离子图谱。经特定的软件分析后,即可在数据库中检索到肽段的氨基酸序列。利用PSD分析技术,还可以对磷酸化,糖基化等翻译后修饰进行定位分析,同样也可以鉴定产生翻译后修饰肽段的蛋白质。Neville et al.(1997)将这一方法成功的用于磷酸肽的序列分析。作为重要的蛋白质鉴定手段之一,PS1的精确度可以达到10 ppm,灵敏度为fmol,分子量检测范围可达到500 kDa,每天可自动分析40-100个样品,适用于大规模“蛋白质组学”研究。

【专家讲座】:第三讲:蛋白质磷酸化研究(Antibody base protein phosphorylatoion)【讲座时间】:2016年1月14日 10:00【主讲人】:胡克平:目前为中国医学科学院/北京协和医学院药用植物研究所研究员,博士生导师, 药理毒理研究中心主任。主要研究方向:从事Rett syndrome及MeCP2,并开展了与能量代谢直接关联的三羧酸循环(TCA)复合物研究。【会议简介】以DNA甲基化结合蛋白MeCP2磷酸化发现及功能研究为故事展现如何确定一个蛋白的磷酸化以及磷酸化位点的确定及后继的功能研究。-------------------------------------------------------------------------------1、报名条件:只要您是仪器网注册用户均可报名参加。2、报名截止时间:2016年1月14日9:303、报名参会:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/17704、报名及参会咨询:QQ群—171692483http://ng1.17img.cn/bbsfiles/images/2017/10/2015042911235201_01_2507958_3.jpg
转从:中国分析网,很不错的一网站。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=16097]YYSWXS0296 蛋白质 糖蛋白重组人白介素 4受体 N-糖基化位点测定 基质辅助激光解吸附电离飞行时间质谱法[/url][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=16098]YYSWXS0281 蛋白质 β-casein的磷酸化分析 电喷雾质谱法[/url][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=16099]YYSWDB0131 蛋白质细胞色素C 分子量的测定电喷雾质谱法[/url]
[font=宋体]磷酸化抗体是一种特殊的抗体,能够识别并结合到已经被磷酸化的蛋白质。磷酸化是一种重要的蛋白质修饰方式,通过将磷酸基团结合到特定的氨基酸残基上,可以改变蛋白质的结构和功能。在许多生物学过程中,磷酸化都扮演着重要的角色,因此磷酸化抗体成为了研究生物学和生物化学的重要工具。[/font][font=宋体] [/font][font=宋体]蛋白质磷酸化是指蛋白在激酶作用下在特定氨基酸位点(最常见的是丝氨酸、苏氨酸、酪氨酸残基)发生磷酸化的过程。蛋白磷酸化是极其重要的翻译后修饰,其动态调控是信号转导中不可或缺的一环,调控着细胞生长、分化、代谢、凋亡等等过程。[/font][font=宋体] [/font][font=宋体]磷酸化抗体主要是针对磷酸化位点制备的,可以特异性识别磷酸化氨基酸位点,对磷酸化蛋白进行定性、定量分析,检测蛋白受刺激后磷酸化水平变化情况。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州可以为客户提供一系列具有高特异性(经内源性、磷酸化特异性等多方面验证)、高灵敏度([/font][font=Calibri]1:200000[/font][font=宋体]稀释度)特点的磷酸化抗体,满足[/font][font=Calibri]WB[/font][font=宋体]、[/font][font=Calibri]IHC[/font][font=宋体]等应用。同时我们还可以为客户提供定制化的磷酸化抗体定制服务。[/font][/font][font=宋体] [/font][font=宋体][b]义翘神州磷酸化抗体服务优势:[/b][/font][font=宋体] [/font][font=宋体][font=宋体]①专业高效的多肽设计软件及高效偶联方法,保证多肽免疫成功率[/font][font=Calibri]95%[/font][font=宋体]以上。[/font][/font][font=宋体]②多种纯化策略,正负筛选平台,确保得到高特异识别指定磷酸化位点的抗体。[/font][font=宋体]③竞争性的价格[/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供多种生物的制备服务,包括磷酸化兔多克隆抗体制备服务、磷酸化鼠单克隆抗体制备服务、磷酸化兔单克隆抗体制备服务[/font][font=宋体]……详情可以关注[/font][font=Calibri]https://cn.sinobiological.com/services/phospho-specific-antibody-service[/font][/font][font=宋体] [/font][font=宋体]总之,义翘神州[url=https://cn.sinobiological.com/services/phospho-specific-antibody-service][b]磷酸化抗体定制服务[/b][/url]能够满足您的个性化需求,帮助您在研究领域获得更多的突破。我们致力于为您提供高质量、高效率的抗体定制服务,助力您的科研事业更上一层楼。[/font]
6 质谱仪的最新进展用质谱检测蛋白,首先考虑到用PMF与 MALDI-TOF联用,如果无法检测,下一步就用ESI-MS/MS创建序列标签。在PMF分析中,MALDI的平板中只需一小部分样本就足以检测,剩下的样本就可以用来创建序列标签。并且,在MALDI-TOF仪器上,用一种叫做“源后延迟”的方法可以对只有部分序列的肽段进行检测。然而,用这个方法产生的质谱图比较难说明,精确性也很差。最近,用MALDI联合四级杆-时间质谱分析器[30,31]以及原始的MALDI-TOF/TOF[32]方法产生了。因此同一份标本可以首先考虑用PMF检测蛋白[33],如果有必要的话,再用MS/MS创建序列标签。MALDI联合四级杆-TOF检测高通量蛋白是有希望的[31]。7 蛋白质组研究中的转录后修饰分析蛋白组分析很重要的一点就是能对蛋白表达水平以及转录后修饰,如磷酸化和糖基化进行研究。蛋白质的磷酸化是很有趣的,因为在信号转导途径中它扮演了重要的角色。最早检测蛋白质表达水平的方法是进行2-DE之前用35S-Met对样本进行代谢性标记,再在2-DE上进行放射自显影[34-36]。在凝胶中,不同蛋白的磷酸化和糖基化位点通常在凝胶中显示一连串蛋白质点,但是还需要做更详细的分析来确定修饰类型。蛋白质磷酸化的改变既可以用32P标记细胞,也可以用特异性磷酸化抗体做western blotting进行研究。如果用32P标记的方法,仍然需要做2-DE。经过凝胶比较后,把感兴趣的点从胶上切下来,然后用质谱鉴定[36]。Soskic使用的是印迹法,两个2-DE同时进行,一个用于做特异的磷酸化抗体实验,另一个做常规染色。蛋白质磷酸化和糖基化更为详细的特性可以用质谱来检测,但是需要更多的起始材料而不仅仅是二维凝胶上的一个点。另外这些分析不能产生直接的序列信息,技术上也比用质谱检测蛋白要难的多。在蛋白上查找磷酸化位点有很多种方法。为了检测消化后的混和肽中哪一个是磷酸化的,可以用MALDI-MS在磷酸化前后对混合肽做PMF分析:经过磷酸酯酶处理后,磷酸化的肽将会失去一个磷酸基团,分子量将比处理前小80Da.糖基化研究中,多聚糖从蛋白中释放出来,对多聚糖结构的检测就是从这些游离的多聚糖中得到的。一般把MALDI仪和外源性糖苷酶[37-40]联合使用进行检测。如果需要更为详细的信息,可以用ESI-MS联合使用前体离子扫描仪[41-44]。到目前为止,能够用电泳分离后的蛋白进行糖蛋白结构检测的报道很少。其中有一项研究是N端糖蛋白酶切以后用一维SDS-PAGE分离,然后用MALDI-MS以及外源性的糖苷酶进行结构分析[45]。8 用质谱研究蛋白-蛋白之间的作用经典的蛋白组学着重于研究蛋白质在何时何处表达。因为大部分的细胞功能都是由蛋白质复合体而不是由单个蛋白来执行的,所以鉴定蛋白质的成分和相互作用是非常重要的。这个过程可以用生物化学方法纯化蛋白质后用质谱来鉴定不同的成分,如人类剪接体的成分,酵母的核孔复合体[46]以及核蛋白体等都可以用此策略检测出来。一般的蛋白复合体是用亲和层析的方法纯化和分离,如免疫沉淀反应[47,48]。 DNA结合蛋白可以用同它们有特异性亲和力的核酸来分离,然后用质谱来鉴定[49]。Rigaut等人在串联层析的基础上,建立了一种通用的蛋白质复合体纯化方法[50]。在这个方法中,一种TAP标签和靶蛋白融合在一起,然后把蛋白转移到宿主细胞或者组织中,融合蛋白在宿主细胞和组织中能持续表达。TAP标签包括一种A蛋白和一种钙调蛋白,在标签之间有一个TEV蛋白酶切位点。用串联亲和层析法能将融合蛋白及与它相互作用的蛋白成分从细胞提取物中有效的分离,纯化出来。Rappsiber等人分别用亲和层析,交叉耦合以及质谱等方法[51]对酵母的核孔复合物Nup85p的亲和性进行研究。经过层析以后,用一维SDS-PAGE方法就可以分离蛋白复合体中的各个成分,因此二维电泳的不足之处就可以避免。同样也有可能直接用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]方法分析大分子量蛋白质复合体[52]。蛋白组分析的优越之处主要是用于蛋白和蛋白之间的相互作用以及蛋白的转录后修饰的研究,同时也可以用于基因表达水平的研究。质谱对于蛋白组分析来说是一项非常重要的技术,近年来仪器以及数据库软件的发展使得质谱成为能力更强大的工具。参考文献[1] O’Farrell PH. J Biol Chem,1975,250:4007–4021.[2] Karas M, Bachmann D, Bahr U, et al. Int J MassSpecrom Ion Process,1987,78:53–68.[3] Meng CK, Mann M, Fenn JB. et al. Atoms, Mol Clusters,1988,10:361–368.[4] Fenn JB, Mann M, Meng CK, et al.Science,1989,6(246):64–71.[5] Corthals GL, Wasinger VC, Hochstrasser DF, et al.Electrophoresis,2000,21:1104–1115.[6] Celis JE, Kruhoffer M, Gromova I, et al. FEBS Lett,2000,480:2–16.[7] Anderson L, Seilhamer J. Electrophoresis,1997,18:533–537.[8] Gygi SP, Rochon Y, Franza BR, et al. Mol Cell Biol,1999,19:1720–1730.[9] Henzel WJ, Stults JT, Wong SC, et al. ProcNatl Acad Sci USA,1993,90:5011–5015.[10] Mann M, Hojrup P, Roeppstorff P. Biol Mass Spectrom,1993,22:338–345.[11] Pappin DJ, Hojrup P, Bleasby AJ. Curr Biol,1993,3:327–332.[12] James P, Quadroni M, Carafoli E, et al. Biochem BiophysRes Commun,1993,195:58–64.[13] Yates JRD, Speicher S, Griffin PR, et al. AnalBiochem,1993,214:397–408.[14] Mann M, Wilm M. Anal Chem,1994,66:4390–4399.[15] Eng JK, McCormack AL, Yates JR. J Am Soc Mass Spectrom,1994,5:976–989.[16] Wilm M, Mann M. Int J Mass Spectrom Ion Process,1994,136:167–180.[17] Wilm M, Shevchenko A, Houthaeve T, et al. Nature 1996 379:466–469.[18] Wilm M, Mann M. Anal Chem,1996,68:1–8.[19] Morris HR, Paxton T, Panico M, et al. JProtein Chem,1997,16:469–479.[20] Rosenfeld J, Capedeville J, Guillemot JC, et al. AnalBiochem,1992,203:173–179.[21] Shevchenko A, Wilm M, Mann M. Anal Chem,1996,68:850–858.[22] Pandey A, Andersen JS, Mann M. Science’s STKE: www.stke.org/cgi/content/full/OC–sigtrans 2000/37/pl1.[23] Kussmann M, Nordhoff E, Rahbek-Nielsen H, et al. J Mass Spectrom,1997,32:593–601.[24] Gobom J, Nordhoff E, Mirgorodskaya E, et al. J Mass Spectrom,1999,34:105–116.[25] Clauser KR, Baker P, Burlingame AL. Anal Chem,1999,71:2871–2882.[26] Binz PA, Muller M, Walther D, et al. Anal Chem,1999,71:4981–4988.[27] Bienvenut WV, Sanchez JC, Karmime A, et al. Anal Chem,1999,71:4800–4807.[28] Neubauer G, King A, Rappsilber J, et al. Nat Genet,1998,20:46–50.[29] Yates III JR, Carmack E, Hays L, et al. MethodsMol Biol,1999,112:553–569.[30] Loboda AV, Krutchinsky AN, Bromirski M, et al. Rapid Commun Mass Spectrom,2000,14:1047–1057.[31] Shevchenko A, Loboda A, Schevchenko A, et al. Anal Chem,2000,72:2132–2141.[32] Medzihradszky KF, Campbell JM, Baldwin MA, et al. Anal Chem 2000,72:552–558.[33] Krutchinsky AN, Zhang W, Chait BT. J Am Soc Mass Spectrom,2000,11:493–504.[34] Nyman TA, Matikainen S, Sareneva T, et al. Eur J Biochem 2000 267:4011–4019.[35] Celis JE, editor. Cell Biology: A Laboratory Handbook, vol. 4,2nd. Academic Press, 1998,375–385.[36] Gerner C, Frohwein U, Gotzmann J, et al. J Biol Chem,2000,Sep 7 [epubahead of print].[37] Colangelo J, Orlando R. Anal Chem,1999,71:1479–1482.[38] Geyer H, Schmitt S, Wuhrer M, et al. Anal Chem1999 71:476–482.[39] Harvey DJ. Mass Spectrom Rev,1999,18:349–450.[40] Nyman TA, Kalkkinen N, et al. Eur J Biochem,1998,253:485–493.[41] Sheeley DM, Reinhold VN. Anal Chem,1998,70:3053–3059.[42] Reinhold VN, Reinhold BB, Costello CE. Anal Chem,1995,67:1772–1784.[43] Kuster B, Hunter AP, Wheeler SF, et al. Electrophoresis,1998,19:1950–1959.[44] Rout MP, Aitchison JD, Suprapto A, et al. J Cell Biol,2000,148:635–651.[45] Yamaguchi K, Subramanian AR. J Biol Chem ,2000,275:28 466–28 482.[46] Yamaguchi K, von Knoblauch K, Subramanian AR. J BiolChem,2000,275:28 455–28 465.[47] Rotheneder H, Geymayer S, Haidweger E. J Mol Biol,1999,293:1005–1015.[48] Boehning D, Joseph SK. EMBO J,2000,19:5450–5459.[49] Nordhoff E, Krogsdam AM, Jorgensen HF, et al. Nat Biotechnol,1999,17:884–888.[50] Rigaut G, Shevchenko A, Rutz B, et al. Nat Biotechnol,1999,17:1030–1032.[51] Rappsilber J, Siniossoglou S, Hurt EC, et al. Anal Chem2000 72:267–275.[52] Link AJ, Eng J, Schieltz DM, et al. Nat Biotechnol,1999,17:676–682.T.A. Nyman /Biomolecular Engineering, 2001:18 .221–227.
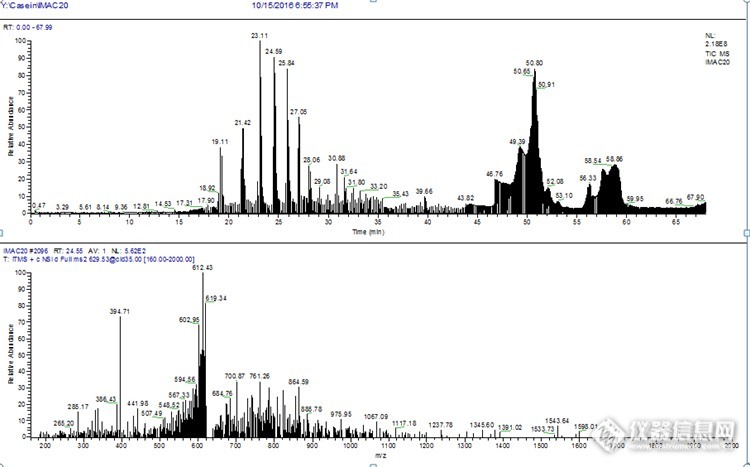
各位老师:求助哪位老师有IMAC富集磷酸化肽段的经验?磷酸化肽段采用IMAC富集后,nano-LC-orbitrap检测后出现奇怪峰,从19.11到28.06分钟出现的峰都不是蛋白及肽段。哪位老师有经验知道这些峰有可能是什么,并且经数据库检测后只获得了7个磷酸化肽段。图见附件谢谢各位老师,上图是IMAC以后的图,下图是IMAC以前,in-gel digesition之后的
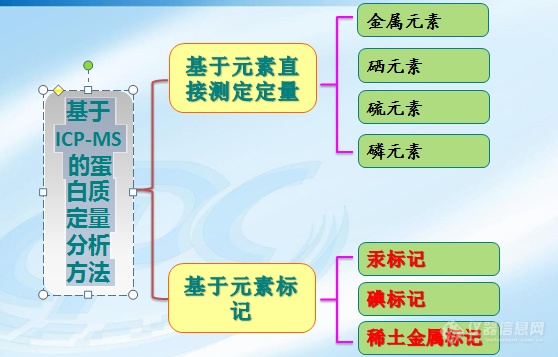
[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]技术是80年代发展起来的新的分析测试技术。它以将ICP的高温(8000K)电离特性与四极杆质谱计的灵敏快速扫描的优点相结合而形成一种新型的最强有力的元素分析、同位素分析和形态分析技术。该技术提供了极低的检出限、极宽的动态线性范围、谱线简单、干扰少、分析精密度高、分析速度快以及可提供同位素信息等分析特性。目前,在[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]电感耦合等离子体质谱[/color][/url]技术上面的突破性技术已经越来越少,但在[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICPMS[/color][/url]应用方面却在不断的扩大,比如应用[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]对蛋白质进行定量分析。一般来说蛋白质的定量分析主要借助于生物质谱,但是随着生命科学的迅猛发展,[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]凭借其诸多优点也开始进入并活跃在蛋白质分析领域。本文就带你走进[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]的应用前沿,领略下基于[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]蛋白质定量分析的几种相关技术。基于[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 的蛋白质定量分析方法主要有以下几种,如下图所示,本文将一一叙述。[color=teal][/color][img=,538,358]http://ng1.17img.cn/bbsfiles/images/2018/04/201804041432166086_2066_1615758_3.png!w538x358.jpg[/img]一、基于金属元素的蛋白质[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]定量技术[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]对蛋白的定量主要是通过测定金属元素的含量,再根据每种蛋白质所含金属的计量比,计算出蛋白质的绝对量。有文献利用65Cu作为稀释剂,采用[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]同位素稀释法法对含铜的蛋白进行绝对定量。[img=,578,314]http://ng1.17img.cn/bbsfiles/images/2018/04/201804041433401796_21_1615758_3.png!w578x314.jpg[/img]二、基于硒元素的[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]蛋白质定量技术硒在体内主要通过硒蛋白发挥作用,人体血液中96%~98%的硒是和蛋白质结合的,一般以硒代半胱氨酸(Sec)、硒代甲硫氨酸的形式结合在蛋白质中。同位素稀释质谱[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 定量法利用标记77Se 的硒代甲硫氨酸作为稀释剂,通过测定硒代甲硫氨酸77Se 和80Se 的丰度比从而进行定量。[img=,664,306]http://ng1.17img.cn/bbsfiles/images/2018/04/201804041446313436_7795_1615758_3.png!w664x306.jpg[/img]三、基于硫元素的[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]蛋白质定量技术在[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 可以测量的所有元素中,硫是最适合作为蛋白质定量分析的内标元素.这是由于S 是蛋白质中一种常见的元素,S 原子多以共价键稳定地存在于蛋白质分子中.蛋白质有两种氨基酸,即蛋氨酸和半胱氨酸含有硫元素。如果某种蛋白质已经由生物质谱鉴定,或者这种蛋白质分子的氨基酸序列和其中含有的S 原子数已知,那么就可以通过[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 直接测定半胱氨酸或甲硫氨酸中硫的含量实现蛋白质的绝对定量。[img=,664,269]http://ng1.17img.cn/bbsfiles/images/2018/04/201804041449050956_1648_1615758_3.png!w664x269.jpg[/img]四、基于磷元素[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 测定的蛋白质定量技术磷是生物体中最重要的元素之一。磷酸化过程是调节蛋白质活性的重要过程,揭示蛋白质磷酸化修饰发生规律是理解生物体复杂多样的生物进程的一个重要前提。磷酸化蛋白在样本中含量低且动态范围广、蛋白质磷酸化水平不均一、磷酸化修饰类型多,这些特点决定了对磷酸化蛋白的研究具有挑战性。蛋白质分子中磷的测定可以对蛋白质的磷酸化状态提供重要信息。[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 对元素的测定与分析物的结构无关,只与分析物中元素的含量有关,因此[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 不仅能够鉴定蛋白质中磷的存在,而且可准确测定蛋白质的磷酸化程度。[img=,563,296]http://ng1.17img.cn/bbsfiles/images/2018/04/201804041449182306_4389_1615758_3.png!w563x296.jpg[/img]五、基于元素标记的[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]蛋白质定量技术稀土金属元素的化学物理性质非常相近,在液相上能共金属元素的化学物理性质非常相近,在液相上能共洗脱。与硫、磷等元素相比,稀土金属元素在[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 中质谱响应更强,受到的同量异位素干扰较少,更容易检测。因此,利用[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 检测蛋白质标记的稀土金属从而进行蛋白质定量的方法具有很大的应用前景。将标记元素引入蛋白质的方法主要有两种:通过共价键直接将杂原子与特定氨基酸结合;通过配位化合物引入金属元素。标记时既可以标记蛋白质或肽的主链(N或C端) ,也可以标记其中的氨基酸(Cys、Met、Lys 等)。主要有碘、汞、稀土等。[img=,639,345]http://ng1.17img.cn/bbsfiles/images/2018/04/201804041451025126_6783_1615758_3.png!w639x345.jpg[/img][img=,615,352]http://ng1.17img.cn/bbsfiles/images/2018/04/201804041451027144_9325_1615758_3.png!w615x352.jpg[/img][url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 作为元素的分析手段, 需要ESI-MS、MALDI-TOF 等生物质谱提供蛋白质结构信息,将元素定量分析的无机质谱和蛋白质结构分析的生物质谱有机地结合。基于分离技术的发展和其他质谱技术的辅助,蛋白质的[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 定量技术在生物样本的蛋白质定量和蛋白质组学研究中会具有潜在广泛的应用价值。
质谱与蛋白质组学蛋白质组学对一个细胞或组织所表达的蛋白质进行的系统分析,而质谱是它的关键性分析工具。在过去的两年中,标准蛋白质组技术中的进展增进了更高水平自动化和敏感性的蛋白质识别技术。另外,新的技术促成了鉴定蛋白质功能相关特性的里程碑性的进展,包括它们的定量和在蛋白质复合物中复杂情况。缩写2DE two-dimensional gel electrophoresis双向凝胶电泳CID collision-induced dissociation碰撞诱导的解离ESI electrospray ionization电喷雾离子化FT-ICR Fourier-transform ion cyclotron resonance傅里叶-变换离子回旋加速器共振ICAT isotope-coded affinity tagsIEF isoelectric focusing等电聚焦MALDI matrix-assisted laser desorption ionization基质辅助的激光解析离子化Q-TOF quadrupole-TOFRP reversed phase反向TOF time-of-flight飞行时间简介蛋白质组学的核心组成是系统识别一个细胞或组织中表达的每一个蛋白质,以及确定每个蛋白质的突出特征(比如,丰度、修饰状态以及在多蛋白质复合体中的复杂状态)。这些分析的技术包括分离蛋白质和肽的分离科学、识别和定量分析物的分析科学和数据管理和分析的生物信息学。它的初步工具包括使用IEF(等电点聚焦)/SDS-PAGE凝胶的高分辨率的双向凝胶电泳(2DE),结合质谱和数据库搜索来分离、识别和定量在一个复合样本中存在的个体蛋白质,最终识别被分离的蛋白质。一个常用的方法用在Fig1中用图解说明。此技术以及由此而来的变化(综述见[1])已经被用来识别和分类在复杂样本中存在的大量蛋白质,并在蛋白质组数据库中呈现它们,该过程我们这里称之为"描述蛋白质组学"比如,Shevchenko等[2]从2D凝胶上系统地鉴定了150个蛋白质。数目庞大的这样的数据库现在可以找到。同样的技术现在已经被作为普遍的发现工具来动态检测一个细胞或组织对外来或内部干扰反应而在蛋白质组中的改变。因为检测动态改变需要精确定量每个被检测成分,我们使用"定量蛋白质组学"来定义。在此报告中,我们总结了自1999年1月至2000年4月来报道的与蛋白质组学和质谱相关的最重要的进展。在核心质谱技术中的进展已经导致2DE为基础的蛋白质组学技术的进一步改进。它们同时又促进了传统凝胶为基础的方法的替代方法,诸如引入以同位素稀释理论为基础的精确蛋白质定量技术和蛋白质复合物的系统分析。蛋白质组分析的MS技术进展在此部分,我们总结了在MS设备、它们的控制和操作中的进展,以及比较质谱数据和序列数据库识别蛋白质所用的搜索工具的进展。随着新型质谱仪的引入,蛋白质组学研究现存类型的质谱仪性能已经显著改进了。在此综述期间最普遍使用的仪器是可以分为两类:单一阶段的质谱仪和串联质谱为基础的系统。单一阶段的质谱仪,最显著的是基质辅助的激光解吸电离(MALDI)飞行时间(TOF)仪器,被用于无数通过肽质谱图谱技术大规模蛋白质识别的项目中。此方法在鉴别表达自小一些的和完全测序的基因组的蛋白质特别成功[3,4]。串联质谱仪器诸如triple quadrpole、离子捕获(ion-trap)和近来引进的混合quadrupole飞行时间(Q-TOF)被常规应用于[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS或用电喷雾电离(ESI)来生成肽片段离子谱,以便通过搜寻序列数据库进行蛋白质鉴定。使用仪器控制程序来自动选择肽离子进行碰撞诱导的解离(CID)(数据依赖CID)的不断增多是这些MS/MS仪器的一个明显的趋势。一些新的构造的具有高潜能的质谱仪被引入到蛋白质组学研究中产生深刻影响。两个研究组近来一个MALDI离子源和一个混合Q-TOF耦联了起来[5,6]。Q-TOF提供的质量准确性和敏感性提升了数据库搜寻结果并同时使它成为MS/MS从头测序的当然仪器选择。MALDI Q-TOF构造提供了激动人心的机会进行自动化和高通量应用以及在一个样品盘上存档样品进行日后研究的可能。Medzihradszky等[7]描述了一个不同的混合仪器称之为MALDI TOF TOF。此设备享有许多MALDI Q-TOF的优点,另外能够进行高能量CID和非常快速的扫描速率。傅里叶-变换离子回旋加速器共振(FT-ICR)质谱对于蛋白质组学来说相对陌生。这些设备具有非常高的敏感性和分辨率,质量精确性可以达到1ppm。这些特征被用来在一次分析中测量和定量几百种蛋白质的完整的分子质量[8]。Goodlett等[9]表明FT-MS测量的一个肽的准确质量以及可以容易获得的限制因素能够通过序列数据库搜索被用来识别蛋白质。蛋白质组学如果没有软件工具来进行质谱数据和序列数据库的关联将变得几无可能。现存的数据库搜索程序已经变得越来越成熟和可以(从网络)可获得。另外,引入了新的算法。主要相关程序是Sequest[10],MASCOT[11],PeptedeSearch[12],PROWL[13]和Protein Prospector[14]。在它们中间,Sequest使用CID谱设置了蛋白质识别的实验室标准(benchmark),因为它与边界MS/MS数据工作得最好,并高度可信,可以从整个[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS实验中自动分析数据,并不需要任何使用者的破译工作。在所提的程序中,然而,只有Sequest不能在网络上搜索。MASCOT是一个新的、快速、网络可进入和多功能的程序,具有进行肽指纹分析、用部分破译或未破译的CID谱进行数据库搜索的功能。
磷酸化的Ser、Tyr和Thr修饰的多肽:我们国肽生物提供单磷酸化和多磷酸化多肽服务,目前我们已经能够提供四个磷酸化位点修饰的多肽。[img=,434,186]https://ng1.17img.cn/bbsfiles/images/2019/04/201904191649355554_2764_3531468_3.jpg!w434x186.jpg[/img][img=,486,498]https://ng1.17img.cn/bbsfiles/images/2019/04/201904191649358877_2957_3531468_3.jpg!w486x498.jpg[/img]我们主要提供:多肽定制、磷酸肽、生物素标记肽、荧光标记肽、同位素标记肽、人工胰岛素、药物肽、多肽合成、目录肽、偶联蛋白、化妆品肽、多肽文库构建、抗体服务、糖肽、订书肽、RGD环肽等。合肥国肽生物官网:http://www.bankpeptide.com欢迎咨询服务热线:17718122172;17718122684;17730030476;17718122397
基因组(genome)包含的遗传信息经转录产生mRNA,一个细胞在特定生理或病理状态下表达的所有种类的mRNA称为转录子组(transcriptome)。很显然,不同细胞在不同生理或病理状态下转录子组包含的mRNA的种类不尽相同。mRNA经翻译产生蛋白质,一个细胞在特定生理或病理状态下表达的所有种类的蛋白质称为蛋白质组(proteome)。同理,不同细胞在不同生理或病理状态下所表达的蛋白质的种类也不尽相同。蛋白质是基因功能的实施者,因此对蛋白质结构,定位和蛋白质-蛋白质相互作用的研究将为阐明生命现象的本质提供直接的基础。生命科学是实验科学,因此生命科学的发展极大地依赖于实验技术的发展。以DNA序列分析技术为核心的基因组研究技术推动了基因组研究的日新月异,而以基因芯片技术为代表的基因表达研究技术为科学家了解基因表达规律立下汗马功劳。在蛋白质组研究中,二维电泳和质谱技术的黄金组合又为科学家掌握蛋白质表达规律再铸辉煌。蛋白质组学(proteomics)就是指研究蛋白质组的技术及这些研究得到的结果。蛋白质组学的研究试图比较细胞在不同生理或病理条件下蛋白质表达的异同,对相关蛋白质进行分类和鉴定。更重要的是蛋白质组学的研究要分析蛋白质间相互作用和蛋白质的功能。蛋白质组学的研究内容包括:1.蛋白质鉴定:可以利用一维电泳和二维电泳并结合Western等技术,利用蛋白质芯片和抗体芯片及免疫共沉淀等技术对蛋白质进行鉴定研究。2.翻译后修饰:很多mRNA表达产生的蛋白质要经历翻译后修饰如磷酸化,糖基化,酶原激活等。翻译后修饰是蛋白质调节功能的重要方式,因此对蛋白质翻译后修饰的研究对阐明蛋白质的功能具有重要作用。3.蛋白质功能确定:如分析酶活性和确定酶底物,细胞因子的生物分析/配基-受体结合分析。可以利用基因敲除和反义技术分析基因表达产物-蛋白质的功能。另外对蛋白质表达出来后在细胞内的定位研究也在一定程度上有助于蛋白质功能的了解。Clontech的荧光蛋白表达系统就是研究蛋白质在细胞内定位的一个很好的工具。4.对人类而言,蛋白质组学的研究最终要服务于人类的健康,主要指促进分子医学的发展。如寻找药物的靶分子。很多药物本身就是蛋白质,而很多药物的靶分子也是蛋白质。药物也可以干预蛋白质-蛋白质相互作用。在基础医学和疾病机理研究中,了解人不同发育、生长期和不同生理、病理条件下及不同细胞类型的基因表达的特点具有特别重要的意义。这些研究可能找到直接与特定生理或病理状态相关的分子,进一步为设计作用于特定靶分子的药物奠定基础。不同发育、生长期和不同生理、病理条件下不同的细胞类型的基因表达是不一致的,因此对蛋白质表达的研究应该精确到细胞甚至亚细胞水平。可以利用免疫组织化学技术达到这个目的,但该技术的致命缺点是通量低。LCM技术可以精确地从组织切片中取出研究者感兴趣的细胞类型,因此LCM技术实际上是一种原位技术。取出的细胞用于蛋白质样品的制备,结合抗体芯片或二维电泳-质谱的技术路线,可以对蛋白质的表达进行原位的高通量的研究。很多研究采用匀浆组织制备蛋白质样品的技术路线,其研究结论值得怀疑,因为组织匀浆后不同细胞类型的蛋白质混杂在一起,最后得到的研究数据根本无法解释蛋白质在每类细胞中的表达情况。虽然培养细胞可以得到单一类型细胞,但体外培养的细胞很难模拟体内细胞的环境,因此这样研究得出的结论也很难用于解释在体实际情况。因此在研究中首先应该将不同细胞类型分离,分离出来的不同类型细胞可以用于基因表达研究,包括mRNA和蛋白质的表达。LCM技术获得的细胞可以用于蛋白质样品的制备。可以根据需要制备总蛋白,或膜蛋白,或核蛋白等,也可以富集糖蛋白,或通过去除白蛋白来减少蛋白质类型的复杂程度。相关试剂盒均有厂商提供。蛋白质样品中的不同类型的蛋白质可以通过二维电泳进行分离。二维电泳可以将不同种类的蛋白质按照等电点和分子量差异进行高分辨率的分离。成功的二维电泳可以将2000到3000种蛋白质进行分离。电泳后对胶进行高灵敏度的染色如银染和荧光染色。如果是比较两种样品之间蛋白质表达的异同,可以在同样条件下分别制备二者的蛋白质样品,然后在同样条件下进行二维电泳,染色后比较两块胶。也可以将二者的蛋白质样品分别用不同的荧光染料标记,然后两种蛋白质样品在一块胶上进行二维电泳的分离,最后通过荧光扫描技术分析结果。胶染色后可以利用凝胶图象分析系统成像,然后通过分析软件对蛋白质点进行定量分析,并且对感兴趣的蛋白质点进行定位。通过专门的蛋白质点切割系统,可以将蛋白质点所在的胶区域进行精确切割。接着对胶中蛋白质进行酶切消化,酶切后的消化物经脱盐/浓缩处理后就可以通过点样系统将蛋白质点样到特定的材料的表面(MALDI-TOF)。最后这些蛋白质就可以在质谱系统中进行分析,从而得到蛋白质的定性数据;这些数据可以用于构建数据库或和已有的数据库进行比较分析。实际上像人类的血浆,尿液,脑脊液,乳腺,心脏,膀胱癌和磷状细胞癌及多种病原微生物的蛋白质样品的二维电泳数据库已经建立起来,研究者可以登录www.expasy.ch/www/tools.html等网站进行查询,并和自己的同类研究进行对比分析。Genomic Solution可以为研究者提供除质谱外的所有蛋白质组学研究工具,包括二维电泳系统,成像系统及分析软件,胶切割系统,蛋白质消化浓缩工作站,点样工作站等;同时还可以提供相关试剂和消耗品。LCM-二维电泳-质谱的技术路线是典型的一条蛋白质组学研究的技术路线,除此以外,LCM-抗体芯片也是一条重要的蛋白质组学研究的技术路线。即通过LCM技术获得感兴趣的细胞类型,制备细胞蛋白质样品,蛋白质经荧光染料标记后和抗体芯片杂交,从而可以比较两种样品蛋白质表达的异同。Clontech最近开发了一张抗体芯片,可以对378种膜蛋白和胞浆蛋白进行分析。该芯片同时配合了抗体芯片的全部操作过程的重要试剂,包括蛋白质制备试剂,蛋白质的荧光染料标记试剂,标记体系的纯化试剂,杂交试剂等。对于蛋白质相互作用的研究,酵母双杂交和噬菌体展示技术无疑是很好的研究方法。Clontech开发的酵母双杂交系统和NEB公司开发的噬菌体展示技术可供研究者选用。关于蛋白质组的研究,也可以将蛋白质组的部分或全部种类的蛋白质制作成蛋白质芯片,这样的蛋白质芯片可以用于蛋白质相互作用研究,蛋白表达研究和小分子蛋白结合研究。Science,Vol.293,Issue 5537,2101-2105,September 14,2001发表了一篇关于酵母蛋白质组芯片的论文。该文主要研究内容为:将酵母的5800个ORF表达成蛋白质并进行纯化点样制作芯片,然后用该芯片筛选钙调素和磷脂分子的相互作用分子。最后有必要指出的是,传统的蛋白质研究注重研究单一蛋白质,而蛋白质组学注重研究参与特定生理或病理状态的所有的蛋白质种类及其与周围环境(分子)的关系。因此蛋白质组学的研究通常是高通量的。适应这个要求,蛋白质组学相关研究工具通常都是高度自动化的系统,通量高而速度快,配合相应分析软件和数据库,研究者可以在最短的时间内处理最多的数据。
20世纪基因组学研究取得的巨大成就为蛋白质组学的发展奠定了基础。蛋白质组学是从整体水平上分析生命体、组织或细胞的蛋白质组成及其活动规律的科学,以基因表达产物为研究对象,延伸了基因组学研究深度,更深层次地揭示了生命活动规律。蛋白质组学的研究内容主要包括蛋白质表达存在方式(修饰形式)的鉴定、结构与功能分析、蛋白质定位、蛋白质差异表达以及蛋白质间相互作用分析等[1]。目前蛋白质组学研究技术主要包括:二维电泳技术、蛋白质芯片技术、质谱技术等[2]。其中,二维电泳技术是早期蛋白质组学的重要技术之一,但是由于实验步骤多,耗时长,重复性差等特点,已经逐步被新型技术所取代。蛋白质芯片技术是将多种蛋白质纯品点于芯片表面,形成蛋白质矩阵进行免疫等标记反应,主要受限于很多蛋白质无法获得纯品而不能用于芯片制备。质谱技术由于灵敏度高、特异性强、分析范围宽等优点逐渐成为蛋白质组学的主要研究手段,可以对特定生命过程中的功能性蛋白质分子进行定性和定量检测,因此在基础科研和临床研究中得到了广泛的应用[3,4]。一、基于质谱的蛋白质组学技术1.基于质谱的蛋白质组学定性技术:蛋白质定性鉴定的基本原理在于:蛋白质组的基本序列已经通过基因组学信息获得,可以用来鉴定多肽的氨基酸序列,并且获得多肽与蛋白质的对应关系[1],即质谱提供的多肽碎片数据可以与蛋白质数据库自动匹配来确定多肽序列与蛋白质归属。基本技术策略分为:(1)自上而下(Top–down)策略[5],即完整蛋白质在质谱中进行分析,可以提供完整蛋白质的质量数,但是由于质谱仪受到质量分析范围的限制,此方法在常规实验室不易实现。(2)自下而上(Bottom–up)策略[6],即蛋白质被蛋白酶水解成多肽,然后对多肽进行质谱分析和碎裂。基于这条策略的大致步骤为:蛋白质样品首先经过酶解降解为多肽,然后对多肽进行色谱–质谱分离与鉴定,最后通过搜索引擎(MASCOT:http://www.matrixscience.com/server.html, SEQUEST:http://fields.scripps.edu/sequest等)在公共蛋白质组学数据库(SWISS–PORT: http://web.expasy.org/groups/swissprot, NCBI:http://www.ncbi.nlm.nih.gov/pubmed等)中自动完成质谱数据的解析,确定多肽序列与蛋白质种类。该技术灵敏度高,特异性好,仪器自动化程度高,可以鉴定出生物样品中成千上万种蛋白质,被认为是大规模、高通量蛋白质定性检测的首选方法。2.基于质谱的蛋白质组学相对定量技术:对于大多数生命科学和医学研究来说,仅完成样品中蛋白质组的定性研究是远远不够的,还需要对蛋白质组进行定量分析。由于组学的研究对象是多个蛋白质,单次检测很难实现所有蛋白质的绝对定量,因此蛋白质组学定量多为相对定量检测。蛋白质组学定量的质谱技术包括谱图计数、质谱峰强度定量、同位素定量技术等。其中使用同位素作为内标定量的方法是目前质谱定量的最佳手段,即对整体蛋白质组进行同位素标记,并使用每一种天然蛋白质与同位素蛋白质的比值进行相对定量分析。主要分为细胞层面标记和蛋白质层面标记两种技术路线:(1)细胞层面标记的细胞培养氨基酸稳定同位素标记(stable isotope labeling with amino acids in cell culture,SILAC)方法[7]:即在两种细胞样品中分别加入轻重同位素标记的培养基,经过传代培养后,两种细胞样品中的全部蛋白质中分别嵌合了轻重同位素,可以在质谱上根据同位素的不同质荷比直接判断样品来源并进行定量比对。(2)蛋白质层面标记:使用含有同位素的小分子与样品全部蛋白质直接标记,如同位素标记相对和绝对定量技术(isobaric tags for relative and absolute quantification,iTRAQ)[8]、同位素编码亲和标记(isotope–coded affinity tag,iCAT) [9]、18O标记[10]等方法,此类方法使用带有稳定同位素的小分子与特定氨基酸侧链反应,使得多个样品可以分别连接含有不同同位素个数(多至8个)的小分子,从而产生一级数据相同但是二级数据不同的质谱谱图,通过二级谱图强度比对进行多个样品的定量分析。3.基于质谱的目标蛋白质绝对定量技术:质谱技术对目标蛋白质的绝对定量检测主要通过质谱多反应监控技术与同位素多肽内标技术联用来实现[11]。该方法首先选定目标蛋白质的一个或多个多肽,合成序列相同但含有稳定同位素的多肽作为内标,定量加入样品中,通过监测特定多肽及其同位素多肽的质谱峰强度进行比对和计算获得目标蛋白质的定量值。质谱多反应监控技术通过进行母离子筛选与子离子筛选等二次选择过程,筛选出目标蛋白质,而非目标蛋白质由于无法通过筛选达到检测器,极大降低了噪音干扰。因此,此方法针对性强,本底噪音低,是目前质谱技术中定量能力最好的一种,可以控制变异系数小于15%,检测限低至纳克每毫升,适合血液、组织等临床样品的定量检测[11]。二、质谱技术发现肿瘤蛋白质标志物质谱技术作为一项强有力的研究工具在科学研究中发挥着巨大的作用,特别在肿瘤相关研究中,目前已经获得美国食品药品监督管理局(Food and Drug Administration,FDA)批准的肿瘤标志物包括多种蛋白质前列腺特异性抗原(prostate–specific antigen, PSA), 癌胚抗原(carcinoembryonic antigen CEA), 人类表皮生长因子受体2(human epidermal growth factor receptor 2,Her–2), 人绒毛膜促性腺激素(human chorionic gonadotropin, HCG), 糖类抗原CA125等,均揭示了蛋白质与肿瘤发生发展密切相关。这些已有成果极大促进了质谱技术在肿瘤蛋白质标志物研究中的应用,并取得了标志性进展。例如:美国约翰霍普金斯大学的Chan课题组发现了新型卵巢癌蛋白质标志物,他们使用表面增强激光解析电离质谱技术(surface enhanced laser desorption and ionization time–of–flight mass spectrometry, SELDI–TOF MS)技术对503个妇女的血清进行了蛋白质组学的分析[12],在随后的大量临床验证中最终确定CA125、β2微球蛋白,转铁蛋白,甲状腺运载蛋白和载脂蛋白A1的联合检测可以作为卵巢癌的新型临床诊断指标。2009年9月该试剂盒OVA1(商品名称:http://ova–1.com)获得了美国FDA的认证,进入临床使用,被认为是国际肿瘤蛋白质标志物研究的重要标志性成果。同时,肿瘤仍然是国际上致死率最高的疾病之一,缺乏早期检测技术和有效治疗方案,临床中还存在着大量问题需要解决,新型标志物的研发迫在眉睫。由于肿瘤蛋白质标志物研究的难度大,风险高,因此近十年来仅有几例试剂盒获得了美国FDA批准,进入临床使用。大量标志物研究还停留在论文研究水平,其中临床问题、研究思路和技术方案的选择直接关系到研究的成功与否。1.临床问题选择:在肿瘤蛋白质标志物研究中,临床问题的选择是研究核心。在肿瘤研究中,需要解决的临床问题往往包括肿瘤早期检测、肿瘤分期检测、治疗方案与药物选择、疗效评估等多个方面。研究者需要根据不同肿瘤的临床情况,具体分析并凝练不同肿瘤的主要临床问题。例如,对于病程发展快、五年存活率低、没有有效手术或化疗手段的肿瘤,早期诊断是研究重点,如胰腺癌、卵巢癌、肺癌等;对于病程发展慢、手术效果明显的肿瘤,肿瘤的愈后与复发是需要关注的问题,如前列腺癌、肠癌等;还有一些肿瘤有特殊的检测需求,如乳腺癌虽然有临床有效的雌激素受体(estrogen receptor,ER),孕激素受体(progesterone receptor,PR),HER2等基因标志物,可以进行药物靶点治疗,但是三阴性乳腺癌的检测还缺乏有效的标志物与治疗方案。因此,在肿瘤蛋白质标志物研究实验开展之前,明确临床问题,并以此确定临床样品入组标准,是研究成功的核心基础。2.研究思路设计:不同于基础科学实验,临床实验需要在大量样本中进行实验结果的验证,因此肿瘤蛋白质标志物研究往往包括新型标志物发现和验证两部分。标志物发现实验是在疾病组和对照组之间进行蛋白质组学分析,鉴定样本中的未知蛋白质组并进行相对定量比较,分析数据选择出在两组样本中差异最大的一个或几个蛋白质作为新型标志物的候选物。随后,标志物验证实验在大量未知样本中进行蛋白质候选物的定量检测,使用发现实验中建立的区分标准进行判读,计算检测灵敏性(sensitivity)和特异性(specificity)。有效的蛋白质标志物研究往往需要发现与验证的两步设计思路来相互保证。3.技术方案选择:根据蛋白质标志物研究的两步设计思路,发现实验中使用基于质谱的蛋白质组学定性技术与相对定量技术对样本中的大量未知蛋白质进行分析,获得标志物候选物名单。验证实验中根据已有名单,进行目标蛋白质(非蛋白质组学)的精确定量检测。这几种质谱技术的配合使用,可以满足不同实验情况和目的,最终实现新型蛋白质标志物的成功研发。三、展望质谱技术是现阶段蛋白质组学研究的核心技术,具有灵敏度高、特异性强、分析通量大等优势,特别是其与同位素内标的联合使用,大大提高了质谱定量能力,因此在多种肿瘤标志物研究中取得了突破性进展并被广泛应用。目前,大量肿瘤蛋白质标志物候选物已经通过使用质谱技术被从血液、组织、体液中筛选出来,预计在完成大规模临床验证后可以作为新型标志物在临床使用,促进肿瘤检测水平的发展。同时值得注意的是,质谱技术还不具备进行蛋白质组的绝对定量能力。相对于免疫等传统蛋白质检测技术,仪器昂贵,操作复杂,自动化程度低,这些因素决定了质谱目前适用于蛋白质的临床研究,但不适用于蛋白质的临床检验,这是质谱技术面临的重要挑战之一。参考文献[1]何华勤. 简明蛋白质组学[M]. 北京:中国林业出版社, 2011:1,76,85-95,119,125-138.[2]RuediA, MatthiasM. Mass spectrometry-based proteomics[J]. Nature, 2003, 422(13):198-207.[3]甄艳, 施季森. 质谱技术在蛋白质组学研究中的应用[J]. 南京林业大学学报:自然科学版, 2011, 35(1):103-108.[4]孙瑞祥, 付岩, 李德泉,等. 基于质谱技术的计算蛋白质组学研究[J]. 中国科学E辑信息科学, 2006, 36(2):222-234.[5]WhiteleggeJ,HalgandF,SoudaP, et al. Top-down mass spectrometry of integral membrane proteins [J]. Expert Review Proteomics, 2006, 3(6):585-596.[6]ChaitBT. Mass spectrometry:bottom-up or top-down? [J]. Science, 2006, 314(5796):65-66.[7]TranDT, AdhikariJ, FitzgeraldMC. StableIsotope Labeling with Amino Acids in Cell Culture (SILAC)-based strategy for proteome-wide thermodynamic analysis of protein-ligand binding interactions [J]. Mol Cell Proteomics, 2014,13(7):1800-1813.[8]DytfeldD, KandarpaM, StrahlerJR, et al. Proteomic Profiling of Multiple Myeloma (MM) Cells Using iTRAQ and Label-Free Quantitative Proteomics for the Prediction of Complete or near Complete Response (CR/nCR) In Frontline Treatment with Lenalidomide, Bortezomib, and Dexamethasone [J]. Blood, 2010, 116(21):271-272.[9]García-SantamarinaS, BoronatS, DomènechA, et al. Monitoring in vivo reversible cysteine oxidation in proteins using ICAT and mass spectrometry [J]. Nat Protoc,2014,9(5):1131-1145.[10]MirzaSP, GreeneAS, OlivierM. 18O labeling over a coffee break:a rapid strategy for quantitative proteomics [J]. J Proteome Res, 2008,7(7):3042-3048.[11]曹冬, 张养军, 钱小红. 基于生物质谱的蛋白质组学绝对定量方法研究进展[J]. 质谱学报, 2008, 29(3):185-190.[12]ZhangZ, BastRC, YuY,et al. Three biomarkers identified from serum proteomic analysis for the detection of early stage ovarian cancer[J]. Cancer Res,2004,64(16), 5882-5890.
2003年人类基因组精细图绘制完成,是人类科学史上一个里程碑式的事件。后基因组时代的研究重点自然落在了蛋白质头上。为啥?因为中心法则告诉我们,基因的产物——蛋白质,是生命活动的最终执行者。与基因组类比,研究生物体内全套蛋白质的科学,就是蛋白质组学。基因组计划完成的同年,人类蛋白质组计划启动,令人激动的是,2014年人类蛋白质组的草图也完成了。而蛋白质组学能够飞速发展的最大功臣非质谱莫属。质谱的应用范围非常广泛,但这里只讨论蛋白质组学中的质谱。简单地说,质谱法(mass spectrometry)就是对肽段离子的重量(质荷比,m/z)进行测量的分析方法。样品经质谱仪(mass spectrometer)检测得到质谱图(mass spectrum),通过对质谱图的分析就可以对样品中的蛋白进行鉴定、定量。亲,图1的这种典型的蛋白质组学流程都很熟悉吧。蛋白首先都要被特异性的酶(通常为Trypsin)切割为肽段,再进行后续分析,这在蛋白质组学中被称为“自下而上”的研究策略(Bottom-up proteomics)。我们平时见到的质谱分析基本都是这种类型。提到蛋白质组,即会联想到一系列高大上的名词,iTRAQ、SWATH、SILAC、Shotgun、Label-free等等。很多概念容易弄混淆,下面我们就来理理清楚。图1. 典型的蛋白质组学流程大体上,质谱研究蛋白主要是鉴定和定量。通过二级质谱图(MS2或者MS/MS)进行数据库搜索匹配鉴定蛋白。通过各种标记或非标记的手段对不同样品中的蛋白进行比较就是定量。蛋白定量比较是质谱最重要的用途,图2是对定量方法的一个简单总结。非标定量(Label-free)不需要标记,不同样品分别处理、分别进质谱检测;优点是处理简单、无需标记、价格便宜、可以比较很多组样品,缺点是对操作步骤、LC、质谱稳定性要求严格。SILAC是在细胞培养基中加入稳定同位素标记的氨基酸,在代谢水平标记蛋白,一级质谱图进行定量,可以做到三组样品混合后进行比较,定量准确,但是不能标记组织样本,养细胞成本也较贵。双甲基化标记是通过化学反应的办法在肽段水平进行标记,一级质谱定量,也可以三组对比,标记试剂都比较便宜,而且可以标记任何来源的样品。iTRAQ和TMT是商品化的试剂盒,肽段水平标记,二级质谱定量;分别可以做到最多8组和10组样品间蛋白质组的比较。图2. 质谱定量方法以上这几个是一家的,还有几个名词是属于另外一家,比如Shotgun (DDA)、SWATH/DIA、SRM (MRM)、MRMHR/PRM。质谱进行数据采集的方式大致分为三种:鸟枪法(Shotgun)、选择反应监控(SRM)和全景式的SWATH/DIA。下面对照图3再来简单介绍一下。图3. 质谱扫描方式DDA、IDA、Shotgun和鸟枪法说的是相同的东西,意思是质谱在每个循环的中从一级里挑选丰度高的TopN个肽段去打碎做二级扫描,得到的结果通过与已知数据库中的理论蛋白进行匹配。DDA简单有效,分析流程比较成熟,也是目前质谱分析的主流方式。DDA也有其固有的缺陷,即具有一定的随机性,偏向于检测丰度较高的肽段,而抑制了低丰度肽段的检测。靶向策略被称为质谱领域的Western blot。质谱只去采集目标肽段大小的离子信息,因而提高了灵敏度和特异性。这种方法用来研究感兴趣的特定蛋白,定量准确,但是通量很有限。SWATH/DIA这种全景式的数据采集方式在最近几年突然火了起来,被认为在不远的未来可能会取代DDA的主流位置。该方法采取的策略是将扫描范围内的所有肽段按照质荷比分为若干个窗口,再对每个窗口里所有的肽段一起打碎,采二级,数据分析时通过抽提蛋白的子离子信息进行定量。SWATH/DIA解决了DDA中随机性选择肽段的缺陷,所以重复性更好,定量的准确性基本达到了SRM的水平,而且可以实现大规模定量。借用听来的一个比喻来说明:DDA就像机关枪扫射,数量多、体积大的目标命中的概率要大一些。靶向扫描(SRM或PRM)就像精准狙击,排除干扰,目标明确,每一枪直指目标,但是难以大规模消灭敌人。SWATH/DIA就是地毯式轰炸,只要暴露在我方攻击范围内的敌人,不管三七二十一,全部炸完。图4. 定量方法与采集方式结合如果将上述的定量方法(图2)和质谱数据采集方式(图3)结合起来,就得到了现在基于质谱的蛋白质组学研究的各种策略(图4)。再打个比方,保证吃货们一听就懂:鸡、鱼、肉、蛋、蔬菜要通过炒锅、烤箱、高压锅、微波炉等烹调之后才能变为美食,填饱肚子。同样的,各种定量方法(非标的和标记的)处理的样品,要通过质谱各种采集方式变为电脑中的数据,才能分析并从中得到蛋白的信息。本次的介绍就先到这里了,如果其中有什么问题,欢迎您批评和建议,我们会努力变得更好;如果需要跟我们进行技术交流和讨论,欢迎大家联系武汉金开瑞。后续我们还会继续推出对质谱技术各方面进行解析的文章,敬请期待。ReferencesA draft map of the human proteome. Nature 509: 575–581 (2014)Mass-spectrometry-based draft of the human proteome. Nature 509: 582–587 (2014)A review: Annu. Rev. Biochem. 80: 273–99 (2011)SILAC: Molecular & Cellular Proteomics 1: 376-386 (2002)iTRAQ: Molecular & Cellular Proteomics 343: 91–99 (2010)SRM: Nature Methods 9: 555–566 (2012)SWATH: Molecular & Cellular Proteomics 11: 1–17 (2012)
褚福亮,王福生, 中国人民解放军第302医院全军艾滋病与病毒性肝炎重点实验室 北京市 100039项目负责人 王福生, 100039 ,北京市丰台路26号, 中国人民解放军第302医院全军艾滋病与病毒性肝炎重点实验室. fswang@public.bta.net.cn电话:010-66933332 传真:010-63831870收稿日期 2002-08-15 接受日期 2002-09-03摘要新近广泛应用蛋白质芯片(ProteinChipâ Array)系统成功鉴定出了一些重要疾病(如肿瘤和危害性较大的传染病)新的、特异性的生物标记(biomarkers),后者不仅在生物医学的基础方面具有重要的科学价值,而且在临床疾病的诊断、治疗和预防发挥重要的指导作用,显示了良好的发展前景.本文就表面增强的激光解析电离-飞行时间-质谱(SELDI-TOF-MS)相关的原理、特点、在临床和基础研究中的应用新进展和未来的发展趋势做一综述.此外,我们就蛋白质谱分析技术在病毒性肝炎、肝硬化和肝癌等一系列肝病方面的应用策略和前景进行了分析.褚福亮,王福生. 蛋白质谱分析方法特点及其在蛋白组学研究领域中的应用.世界华人消化杂志 2002 10(12):1431-14350 引言人类基因组计划已经进入后基因组时代-即功能基因组时代[1],作为基因功能的直接体现者-蛋白质,及其之间的相互作用越来越引起基础和临床科学家们的关注[2-6] .因为要彻底了解生命的本质,只把基因测出来还是不够的,还必须要了解其在生物生长、发育、衰老和整个生命过程中的功能、不同蛋白质之间的相互作用以及他们与疾病发生、发展和转化的规律[7-14] .正因为如此,有关上述问题的蛋白质组学研究成了今天生命科学最重要的焦点之一[15] .为了阐明蛋白质在上述生命现象中的作用和相关机制,人们设计了许多新的方法技术,如:二维电泳、质谱分析、微距阵列、酵母双杂交和噬菌体展示等,这些方法在一些特定的情况下,虽然显示出了他们各自不同的优点,但是同样也存在着较大的局限性,难以开展大规模、超微量、高通量、全自动筛选蛋白质等方面的分析,因而设计更全面、同时研究多种蛋白质相互作用的技术,在功能基因组和蛋白组学的研究中建立一个更有效的技术平台,成为本领域中优先关注的问题[16] .近来,美国Ciphergen(赛弗吉)公司研制的ProteinChipâ Array的仪器,并建立了一种新的蛋白质飞行质谱-表面增强的激光解析离子化-飞行时间-质谱(surface-enhanced laser desorption/inionation-time of flight-mass spectra, SELDI-TOF-MS),已取得可喜的进展,筛选出了许多与疾病相关的新型生物标志,不仅为临床疾病的诊断和治疗等提供了新的选择,而且在基础科学、新药研制和疾病预防等方面具有广泛的应用前景[16-18] .本文就SELDI-TOF-MS相关的原理、特点、在临床和基础研究中的应用新进展和未来的发展趋势做一综述.1 ProteinChipâ Array系统和SELDI-TOF-MS的特点1.1 蛋白质芯片系统的组成和原理 蛋白质芯片系统由三部分组成:蛋白质芯片、芯片阅读器和芯片软件.供研究用芯片上有6-10芯池,不同的芯片表面上的化学物质不同,芯片表面分为两大类:一类为化学类表面,包括经典的色谱分析表面,如:结合普通蛋白质的正相表面,用于反相捕获的疏水表面,阴阳离子交换表面和捕获金属结合蛋白的静态金属亲合捕获表面;另一类称为生物类,特定的蛋白质共价结合于预先活化的表面阵列,可以用来研究传统的抗体一抗原反应,DNA和蛋白质作用,受体、配体作用和其他的一些分子之间的相互作用[19] . 根据检测目的不同,可以选用不同的芯片,或者自己设计芯片.将样本和对照点到芯池上以后,经过一段时间的结合反应,用缓冲液或水洗去一些不结合的非特异分子,再加上能量吸收分子(energy absorbing molelule,EAM)溶液,使样本固定在芯片表面.当溶液干燥后,一个含有分析物和大量能量吸收分子“晶体”就形成了.能量吸收分子对于电离来说非常重要.经过以上步骤,就可经把芯片放到芯片阅读器中进行质谱分析. 在阅读器的固定激光束下,芯片上、下移动,使样本上每一个特定点都被“读”到.激光束的每一次闪光释放的能量都聚集在该区一个非常小的点上(focused laser beam,聚焦激光束).这样,每个区都含有丰富的,可寻址(addressable)的位置.蛋白质芯片处理软件精确控制激光寻读过程.当样本受到激发,就开始电离和解除吸附.不同质量的带电离子在电场中飞行的时间长短不同,计算检测到的不同时间,就可以得出质量电荷比,把他输入电脑,形成图像[19].Ball et al [20]采用一种称为人工神经网络(artifical neural network,ANN)的算法处理出现的成千上万的峰,鉴定出三个分子量为13 454、13 457和14 278的生物标记分子,使疾病预测率达到97.1 %.1.2 ProteinChipâ Array芯片和SELDI-TOF-MS的特点 新型蛋白芯片与以往的蛋白芯片不同之处:SELDI-TOF-MS,他是在MALDI(matrix-assisted laser desorption/inionation)[21,22]基础上,改进后实行表面增强的飞行质谱.SELDI-TOF-MS优于MALDI-TOF表现为他不会破坏蛋白质,或使样本与可溶的基质共结晶来产生质谱信号.对SELDI-TOF来说,可以直接将血清、尿液、组织抽取物等不需处理直接点样检测[40] 由于一部分非特异结合的分析物被洗去,因而出现的质峰非常一致,有利于后期分析[23,24] . 与二维电泳相比:二维电泳分析蛋白质的分子量在30 KDa以上时电泳图谱较清楚,对在组织抽提物中占很大比例的低丰度的蛋白质不能被检出;其次,二维电泳胶上的蛋白质斑点很大一部分包含一种以上的蛋白质;而且,二维电泳耗时长,工作量大,对象染色转移等技术要求高,不能完全实现自动化.而SELDI-TOF在200 Da-500 KDa区间都可以给出很好的质谱,对一个样本的分析在几十分钟内就可以完成[19],处理的信息量远远大于二维电泳;对于低丰度物质,即使浓度仅attomole(10-18)的分子,只要与表面探针结合,就可以检测到,这也是二维电泳所不具备的[24,25] . 对于微距阵蛋白芯片来说,需要一种不破坏折叠的蛋白质构象的固定技术,再与另外的蛋白质反应,经检测莹光来观察蛋白质之间的作用[26] .而基于SELDI-TOF-MS的ProteinChip分析蛋白质不需溶解、不需染色、廉价、针对性强. 因而蛋白质芯片仪具有以下优势:(1)可直接使用粗样本,如:血清、尿液、细胞抽提物等[27] .(2)使大规模、超微量、高通量、全自动筛选蛋白质成为可能;(3)他不仅可发现一种蛋白质或生物标记分子,而且还可以发现不同的多种方式的组合蛋白质谱,可能与某种疾病有关[28] (4)推动基因组学发展,验证基因组学方面的变化,基于蛋白质特点发现新的基因.可以推测疾病状态下,基因启动何以与正常状态下不同,受到那些因素的影响,从而跟踪基因的变化[2,14,15] . 其存在的问题:对于不同的样本,根据检测的目标采取或者设计几种芯片,理论上可以把所有的相同性质蛋白质捕获,但是实际上仍有少量的分子没与表面探针结合.使用SELDI-TOF-MS,仅能给出蛋白质的分子量,不能给出C端、N端的序列,也没法知道蛋白质的构型,因此需要将蛋白质充分纯化后,用蛋白酶消化芯片上的蛋白质,分析肽段,再用生物信息学方法鉴定蛋白质序列[18,24] .另外,在国内,该芯片费用较高,分析质谱需要大量后续工作支持.
合肥国肽生物科技有限公司(简称:国肽生物TM)成立于2014年,是一家专业从事多肽产品的研发、生产和销售以及多肽技术转让的高新技术企业。BP公司成立之初,便成功收购了国内几家多肽、抗体公司,是目前国内的专业多肽合成、抗体制备、蛋白表达的规模型生产企业。国肽生物专长于荧光标记肽、同位素标记肽、人工胰岛素、药物肽、化妆品肽、长肽困难肽等产品的合成与研发,致力于学术水平的科研提升,搭建学术交流平台,促进前沿、专业的学术知识推广,推动多肽在生物医学材料等领域的研究与应用。公司产品广泛应用于药物研发,抗体的制备(包括单抗与双抗),荧光分子探针的构建以及细胞透膜研究、活体成像、新型材料研发和质谱分析等研究领域国肽生物按照客户定制要求供应高品质普通多肽。我们拥有成熟的多肽合成纯化方法,利用SPPS方法和液相合成方法为客户提供高品质多肽。我们的服务特点是:1. 纯度:我们提供粗品肽和纯度纯度为70%,75%,80%,85%,90%,95%,98%,99%的纯品多肽。2.脱盐和转盐:根据客户要求,我们可以对多肽进行脱TFA盐处理,也可以转为醋酸盐。3.交货期限:30个氨基酸之内,一般2-3周,最快1-2周。4.质量控制:每条多肽都免费提供合格的HPLC,MS和COA文件。5.售后服务:1-2周内可以提出异议,我们免费复测,不合格免费退货,1-3个月内使用不合格可以免费提供复测,样品免费保存3个月。国肽生物根据客户要求,供应各种修饰型多肽。1.磷酸化的Ser、Tyr和Thr修饰的多肽:我们提供单磷酸化和多磷酸化多肽服务,目前我们已经能够提供四个磷酸化位点修饰的多肽。2.5(6)-FAM,FITC,CY5,RhodamineB,PNA,EDNAS/dabcyl等荧光标记修饰的多肽:荧光标记修饰多肽技术是我们国肽生物的代表性多肽合成技术,我们的这项技术已经相当成熟。3.生物素Biotin,Lys(Biotin)修饰的多肽:生物素是维生素B2的组成部分,Biotin,Lys(Biotin)修饰的多肽也是客户经常定制的多肽。我们提供生物素修饰的多肽已经有将近100%的成功率。4.含有一对或多对二硫键修饰的多肽:二硫键在蛋白质的结构稳定中起到重要作用,目前我们已经能够为客户提供四对二硫键修饰的多肽。5.含有同位素C13,N15修饰的多肽:同位素标记的多肽主要应用于医学和生物学领域,通常价格较高,为了满足客户需要,我们接受微克级的同位素多肽定制。6.含有特殊氨基酸修饰的多肽:例如,D型氨基酸,氨基酸衍生物,脂肪族羧酸等等,都在我们接受的定制范围内。国肽生物提供150个氨基酸以内的长肽合成服务。多肽合成过程中,肽链过长时,经常会出现缺残基,氨基酸缩合困难等情况,基于这些现象,我们开发了三种有效提高反应成功率的方案:1. 微波合成法:对于合成过程中出现的一些难以缩合的氨基酸,我们采用微波法进行合成,该方法效果显著,并且大大缩短了反应时间。2. 片段合成法:当某些多肽用常规合成方法合成困难,我们也会采用将多肽中某一段的某几个氨基酸缩合之后作为一个整体缩合到肽链上去,这种方法也能够解决许多合成中存在的问题。3.酰肼合成法:酰肼法合成多肽的方法是将固相合成的 N末端Cys 多肽和 C末端多肽酰肼之间的化学选择性反应形成酰胺键而实现多肽的连接,该方法根据肽链中Cys的位置,将整条肽链分成多条序列分别合成,最终经过液相缩合反应得到目标肽,显著地提高了最终产物纯度,广泛适用于含有Cys的长链多肽的合成。国肽生物拥有成熟的长肽合成工艺,能够根据客户定制的多肽序列,快速有效地设计合成方案并迅速开始合成,更快更好的为客户提供所需的服务是我们不变的坚持。详情请咨询合肥国肽生物www.bankpeptide.com
蛋白质是生物体中含量最高,功能最重要的生物大分子,存在于所有生物细胞,约占细胞干质量的50%以上, 作为生命的物质基础之一,蛋白质在催化生命体内各种反应进行、调节代谢、抵御外来物质入侵及控制遗传信息等方面都起着至关重要的作用,因此蛋白质也是生命科学中极为重要的研究对象。关于蛋白质的分析研究,一直是化学家及生物学家极为关注的问题,其研究的内容主要包括分子量测定,氨基酸鉴定,蛋白质序列分析及立体化学分析等。随着生命科学的发展,仪器分析手段的更新,尤其是质谱分析技术的不断成熟,使这一领域的研究发展迅速。 自约翰.芬恩(JohnB.Fenn)和田中耕一(Koichi.Tanaka)发明了对生物大分子进行确认和结构分析的方法及发明了对生物大分子的质谱分析法以来,随着生命科学及生物技术的迅速发展,生物质谱目前已成为有机质谱中最活跃、最富生命力的前沿研究领域之一[1]。它的发展强有力地推动了人类基因组计划及其后基因组计划的提前完成和有力实施。质谱法已成为研究生物大分子特别是蛋白质研究的主要支撑技术之一,在对蛋白质结构分析的研究中占据了重要地位[2]。 1.质谱分析的特点 质谱分析用于蛋白质等生物活性分子的研究具有如下优点:很高的灵敏度能为亚微克级试样提供信息,能最有效地与色谱联用,适用于复杂体系中痕量物质的鉴定或结构测定,同时具有准确性、易操作性、快速性及很好的普适性。 2.质谱分析的方法 近年来涌现出较成功地用于生物大分子质谱分析的软电离技术主要有下列几种:1)电喷雾电离质谱;2)基质辅助激光解吸电离质谱;3)快原子轰击质谱;4)离子喷雾电离质谱;5)大气压电离质谱。在这些软电离技术中,以前面三种近年来研究得最多,应用得也最广泛[3]。 3.蛋白质的质谱分析 蛋自质是一条或多条肽链以特殊方式组合的生物大分子,复杂结构主要包括以肽链为基础的肽链线型序列[称为一级结构]及由肽链卷曲折叠而形成三维[称为二级,三级或四级]结构。目前质谱主要测定蛋自质一级结构包括分子量、肽链氨基酸排序及多肽或二硫键数目和位置。 3.1蛋白质的质谱分析原理 以往质谱(MS)仅用于小分子挥发物质的分析,由于新的离子化技术的出现,如介质辅助的激光解析/离子化、电喷雾离子化,各种新的质谱技术开始用于生物大分子的分析。其原理是:通过电离源将蛋白质分子转化为[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]离子,然后利用质谱分析仪的电场、磁场将具有特定质量与电荷比值(M/Z值)的蛋白质离子分离开来,经过离子检测器收集分离的离子,确定离子的M/Z值,分析鉴定未知蛋白质。 3.2蛋白质和肽的序列分析 现代研究结果发现越来越多的小肽同蛋白质一样具有生物功能,建立具有特殊、高效的生物功能肽的肽库是现在的研究热点之一。因此需要高效率、高灵敏度的肽和蛋白质序列测定方法支持这些研究的进行。现有的肽和蛋白质测序方法包括N末端序列测定的化学方法Edman法、C末端酶解方法、C末端化学降解法等,这些方法都存在一些缺陷。例如作为肽和蛋白质序列测定标准方法的N末端氨基酸苯异硫氰酸酯(phenylisothiocyanate)PITC分析法(即Edman法,又称PTH法),测序速度较慢(50个氨基酸残基/天);样品用量较大(nmol级或几十pmol级);对样品纯度要求很高;对于修饰氨基酸残基往往会错误识别,而对N末端保护的肽链则无法测序[4]。C末端化学降解测序法则由于无法找到PITC这样理想的化学探针,其发展仍面临着很大的困难。在这种背景下,质谱由于很高的灵敏度、准确性、易操作性、快速性及很好的普适性而倍受科学家的广泛注意。在质谱测序中,灵敏度及准确性随分子量增大有明显降低,所以肽的序列分析比蛋白容易许多,许多研究也都是以肽作为分析对象进行的。近年来随着电喷雾电离质谱(electrospray ionisation,ESI)及基质辅助激光解吸质谱(matrix assisted laser desorption/ionization,MALDI)等质谱软电离技术的发展与完善,极性肽分子的分析成为可能,检测限下降到fmol级别,可测定分子量范围则高达100000Da,目前基质辅助的激光解吸电离飞行时间质谱法(MALDI TOF MS)已成为测定生物大分子尤其是蛋白质、多肽分子量和一级结构的有效工具,也是当今生命科学领域中重大课题——蛋白质组研究所必不可缺的关键技术之一 [5] 。目前在欧洲分子生物实验室(EMBL)及美国、瑞士等国的一些高校已建立了MALDI TOF MS蛋白质一级结构(序列)谱库,能为解析FAST谱图提供极大的帮助,并为确证分析结果提供可靠的依据[6]。
蛋白质组学研究--生物质谱技术 对分离的蛋白质进行鉴定是蛋白质组研究的重要内容,蛋白质微量测序、氨基酸组成分析等传统的蛋白质鉴定技术不能满足高通量和高效率的要求,生物质谱技术是蛋白质组学的另一支撑技术。 生物质谱技术在离子化方法上主要有两种软电离技术,即基质辅助激光解吸电离(matrix—assisted laser desorption/ionization,MALDl)和电喷雾电离(electrospray ionization,ESl)。MALDI是在激光脉冲的激发下,使样品从基质晶体中挥发并离子化。ESI使分析物从溶液相中电离,适合与液相分离手段(如液相色谱和毛细管电泳)联用。MALDI适于分析简单的肽混合物,而液相色谱与ESI—MS的联用(LC—MS)适合复杂样品的分析。 软电离技术的出现拓展了质谱的应用空间,而质量分析器的改善也推动了质谱仪技术的发展。生物质谱的质量分析器主要有4种:离子阱(iontrap,IT)、飞行时间(TOF)、四极杆(quadrupole)和傅立叶变换离子回旋共振(Fourier transform ion cyclotron resonance,FTICR)。它们的结构和性能各不相同,每一种都有自己的长处与不足。它们可以单独使用,也可以互相组合形成功能更强大的仪器。 离子阱质谱灵敏度较高,性能稳定,具备多级质谱能力,因此被广泛应用于蛋白质组学研究,不足之处是质量精度较低。与离子阱相似,傅立叶变换离子回旋共振(FTICR)质谱也是一种可以“捕获”离子的仪器,但是其腔体内部为高真空和高磁场环境,具有高灵敏度、宽动态范围、高分辨率和质量精度(质量准确度可很容易地小于1mg/L),这使得它可以在一次分析中对数百个完整蛋白质分子进行质量测定和定量。FTICR—MS的一个重要功能是多元串级质谱,与通常的只能选一个母离子的串级质谱方式不同,FTICR—MS可以同时选择几个母离子进行解离,这无疑可以大大增加蛋白质鉴定工作的通量。但是它的缺点也很明显,操作复杂、肽段断裂效率低、价格昂贵等,这些缺点限制了它在蛋白质组学中的广泛应用。MALDI通常与TOF质量分析器联用分析肽段的精确质量,而ESI常与离子阱或三级四极杆质谱联用,通过碰撞诱导解离(collision—induceddissociation,CID)获取肽段的碎片信息。 1. MALDI—TOF—MS (1)MALDI—TOF—MS的技术特点:①具有分离、鉴定双重功能,可用于混合物的分析;②测量范围宽,相对分子质量可达300 000;③精度高,蛋白质相对分子质量测定精度可达0.01%;④灵敏度高,所需样品量少,可达fmol级;⑤分析时间短,5~10rain可完成一次分析;⑥样品制备简便,操作易自动化;⑦对样品要求低,能忍耐较高浓度的盐、缓冲剂和非挥发性杂质,所以特别适合于鉴定二维凝胶电泳分离的蛋白质。 (2)MALDI—TOF—MS的技术改进:近年来MALDI—TOF—MS又有许多新的技术改进,以提高其检测灵敏性和准确度,增强其蛋白质鉴定的功能。如将MALDI离子源与四极杆—飞行时间—串联质谱对接,实现了同一样品在同一质谱仪上的肽指纹图谱与肽序列标签分析同时进行,提高于蛋白质鉴定的速度和准确性。还有MALDI—TOF—TOF—MS等。但这些技术共同的缺点是仪器非常昂贵。 (3)MALDI—TOF—MS的发展方向:①寻求新的基质(如混合基质、室温离子化液体等)和新的制样方法(如超微量进样,n1级);②将新技术应用在分析中(如酶切技术、毫微升溶剂提取技术等);③对质谱仪进行改进或与其他分析仪器联用,如MALDI与傅立叶转换离子回旋共振质谱(MALDI—FTMS)联用能得到更多的蛋白结构信息;④小型化、智能化、简易化及自动化已成为趋势。 2.ESI (1)ESI的优势:①检测范围宽,生物大分子经电喷雾后质荷比大大下降,因而可测相对分子质量高达十几万甚至更高的生物样品;②分辨率和灵敏度高,可达10-15—10-12mol;③不需要特定基质,避免子基质峰的干扰;④适用于结构分析,可分析生物大分子的构象及非共价相互作用,与串联质谱结合可分析蛋白质、多肽的一级结构和共价修饰位点等;⑤自动化程度高,可与液相色谱、毛细管电泳等高效分离手段在线联用;⑥MALDI是脉冲式离子化技术,而ESI是连续离子化技术,检测所需时间更短;⑦ESI常和四极杆质谱联用,仪器价格相对便宜。 (2)ESI的局限性:①对样品中的盐类耐受性差;②对混合物图谱的解析较复杂;③受溶剂的影响和限制很大。目前ESI主要用于亲水生物大分子的分析,较少用于疏水生物样品的分析。总体来说,MALDI和ESI各有长处,有各自的适用范围,是两种互补的技术。 (3)ESI的技术发展:近年来,ESI也有许多新的技术发展。液相色谱与电喷雾质谱连用(LC—ESI—
一、 前言 基因工程已令人难以置信的扩展了我们关于有机体DNA序列的认识。但是仍有许多新识别的基因的功能还不知道,也不知道基因产物是如何相互作用从而产生活的有机体的。功能基因组试图通过大规模实验方法来回答这些问题。但由于仅从DNA序列尚不能回答某基因的表达时间、表达量、蛋白质翻译后加工和修饰的情况、以及它们的亚细胞分布等等,因此在整体水平上研究蛋白质表达及其功能变得日益显得重要。这些在基因组中不能解决的问题可望在蛋白质组研究中找到答案。蛋白质组研究的数据与基因组数据的整合,将会在后基因组研究中发挥重要作用。 目前蛋白质组研究采用的主要技术是双向凝胶电泳和质谱方法。双向凝胶电泳的基本原理是蛋白质首先根据其等电点,第一向在pH梯度胶内等电聚焦,然后转90度按他们的分子量大小进行第二向的SDS-PAGE分离。质谱在90年代得到了长足的发展,生物质谱当上了主角,蛋白质组学又为生物质谱提供了一个大舞台。他们中首选的是MALDI-TOF,其分析容量大,单电荷为主的测定分子量高达30万,干扰因素少,适合蛋白质组的大规模分析。其次ESI为主的 LC-MS联机适于精细的研究。本文将简介几种常用的生物质谱技术,并着重介绍生物质谱技术在蛋白质组学各领域的应用。 二、 生物质谱技术 1.电喷雾质谱技术(ESI) 电喷雾质谱技术( Electrospray Ionization Mass Spectrometry , ESI - MS) 是在毛细管的出口处施加一高电压,所产生的高电场使从毛细管流出的液体雾化成细小的带电液滴,随着溶剂蒸发,液滴表面的电荷强度逐渐增大,最后液滴崩解为大量带一个或多个电荷的离子,致使分析物以单电荷或多电荷离子的形式进入气相。电喷雾离子化的特点是产生高电荷离子而不是碎片离子, 使质量电荷比(m/ z) 降低到多数质量分析仪器都可以检测的范围,因而大大扩展了分子量的分析范围,离子的真实分子质量也可以根据质荷比及电荷数算出。本帖与http://bbs.instrument.com.cn/shtml/20081130/1613156/重复,故锁帖!请版友在发帖前先搜索一下,以免出现重复贴。谢谢!斑竹您给的重复贴链接有误,并且我写贴前已经搜索了标题。SORRY,请LZ检索一下这个网址,开始那个是弄错了。
蛋白质分子量肌球蛋白甲状腺球蛋白β-半乳糖苷酶副肌球蛋白磷酸化酶a血清白蛋白L-氨基酸氧化酶地氧化氢酶丙酮酸激活酶谷氨酸脱氢酶亮氨酸氨肽酶γ-球蛋白,H链延胡索酸酶(反丁烯二酸酶)卵白蛋白醇脱氢酶(肝)烯醇酶醛缩酶肌酸激酶胃蛋白酶原D-氨基酸氧化酶醇脱氢酶(酵母)甘油醛磷酸脱氢酶原肌球蛋白乳酸脱氢酶胃蛋白酶转磷酸核糖基酶天冬氨酸氨甲酰转移酶,C链羧肽酶 A碳酸酐酶枯草杆菌蛋白酶γ-球蛋白,L链γ-blobulin,L chain糜蛋白酶原(胰凝乳蛋白酶原)木瓜蛋白酶(羧甲基)β-乳球蛋白[font=Tim
蛋白质组学研究的一般工具与方法随着人类基因组计划取得巨大的成功和许多物种基因组测序的完成,仅仅靠基因组的序列来试图阐明生命现象是远远不够的,因此,研究重心已经开始从揭示生命的所有遗传信息转移到在分子整体水平对功能的研究上,生命科学已实质性地跨入了后基因组时代。 尽管现在已经有多个物种的基因组被测序,但这些基因组中通常有一半以上基因的功能是未知的。目前功能基因组研究中所采用的策略,如微阵列法(microarray)(Wodicka et al., 1997)、基因芯片(gene chips)(Ramsay et al., 1998)、基因表达序列分析(SAGE)(Velculescu et al., 1995)等,都是从细胞中mRNA的角度来考虑的。但事实上,从DNA、mRNA到蛋白质存在三个层次的调控,mRNA自身也存在着贮存、转运和降解等问题,从mRNA角度考虑,实际上仅包括了转录水平调控,并不能全面代表蛋白质表达水平。实验也证明,组织中mRNA丰度与蛋白质丰度的相关性并不好,尤其对于低丰度蛋白质来说,相关性更差。蛋白质复杂的翻译后修饰,蛋白质的亚细胞定位或迁移,蛋白质-蛋白质相互作用则几乎无法从mRNA水平来判断(曾嵘,夏其昌,2002)。新生肽链合成后存在多种加工、修饰过程,蛋白质间也存在类似于mRNA分子内的剪切、拼接,研究证明基本元件“intein”广泛存在于蛋白质中(Perler et al., 1997)。基因与其编码产物蛋白的线性对应关系只存在于新生肽链而不是最终的功能蛋白质中。 蛋白质是生理功能的执行者和生命现象的直接体现者,对蛋白质结构和功能的研究将直接阐明生命在生理或病理条件下的变化机制;蛋白质本身的存在形式和活动规律,如翻译后修饰、蛋白质间相互作用及蛋白质构象等问题,仍依赖于直接对蛋白质的研究来解决。因此要对生命的复杂活动有全面和深入的认识,必然要在整体、动态、网络的水平上对蛋白质进行研究(钱小红,贺福初,2003)。 蛋白质组学研究中常用的技术体系 方法学上,二维凝胶电泳-质谱仍然是目前最流行和可靠的技术平台(Rabilloud et al., 2000)。其一般过程是:细胞或组织样品——样品制备——二维凝胶电泳(2D-PAGE)分离蛋白质——计算机辅助分析2D-PAGE图象——对感兴趣的蛋白质进行酶解——质谱分析——数据库检索——蛋白质鉴定——分析蛋白质在细胞与组织中的表达情况。 2-D PAGE 样品制备 2D-PAGE 的操作流程基本上实现了程序化。但是,样品制备是一个非常关键与复杂的过程。成功的2D-PAGE取决于对样品中蛋白质有效的抽提和它的溶解性。与核酸不同,目前没有一种通用的方法适用于所有的蛋白质,来源不同的蛋白质都受到自身蛋白质制备方法的挑战。 正确的样品制备方法从收集样品开始时就要防止样品的裂解和被蛋白水解酶降解(Rabilloud et al., 2000)。要尽可能溶解更多的蛋白,并且在2D-PAGE过程中保持它的溶解性,阻止蛋白质的人为修饰。在样品制备过程中,各个实验室也通过实验建立了更为可行的方法。目前通过建立分步提取方法可以有效地提取出更多的蛋白质(兰彦等,2001)。另一种对蛋白质采用预分离的方法称为“多间隔电解法(multi-compartment-electrolyser)”,采用这种方法后,分辨率和胶的质量均明显改善(Herbert et al., 2000)。 但是,由于生物样品的多样性和复杂性,目前所采用的样品制备方法具有局限性。其它物质对蛋白质样品制备存在干扰。核酸通过与蛋白质结合,增加样品黏度而干扰等点聚焦(IEF)分离的效果。当然,通过实验探索,采取一些措施可以减轻它的干扰。例如,在样品制备过程中加入非特异性的核酸酶或RNase与DNase的混合物,在等电聚焦时将每个胶条的电流限制在50mA以内通常可以消除其影响。脂类物质的影响可以通过利用有机溶剂的方法将其去除,但是这常常会导致蛋白质的不可逆沉淀。除了蛋白质的降解之外,糖基化是蛋白质的最重要的人工修饰,样品中的尿素在这一过程中起着非常重要的作用。样品中的尿素在降解的过程中会形成能够与蛋白质的氨基反应的氰酸盐,这种结果会导致蛋白质带有更多的正电荷。所以,在2D-PAGE中要用新鲜的尿素溶液,在等电聚焦过程中要控制温度不能太高(Beranova-Giorgianni, 2003)。但是,目前还没有一种简单有效的方法来去除样品中的多糖。 样品分离和分析 样品制备完成后运用IEF和SDS-PAGE电泳对它进行分离,常采用银染和考马斯亮兰染色即可观察到具有许多蛋白质斑点的凝胶图像。等电聚焦电泳与SDS-PAGE的具体操作步骤已经实现了程序化,均有详细操作流程参考,但是由于样品的不同,不同样品的具体条件还需要试验探索。第二相SDS-PAGE运行结束,染色完毕后,利用计算机软件对凝胶图像进行分析,如PD-QUEST软件,LIPS,HERMES,GEMINI等,对凝胶图像上的蛋白质斑点进行匹配,对图像进行数字化处理等分析(贾宇峰等,2001),对感兴趣的蛋白质采用质谱分析。 低丰度蛋白质的检测 低丰度蛋白在蛋白质组学研究中常常是人们非常感兴趣的,因为细胞或组织中的一些生物活性物质,如细胞分泌的一些活性物质,受体等表达量都非常低。按照一般电泳的上样量,这些小分子是根本看不到的,但如果单纯地增加上样量,细胞或组织中的大量表达的蛋白就会将其覆盖,而且上样量过大也会影响电泳结果。所以对这些低丰度的样品可以进行富集,富集的方法可以通过层析,如亲和层析,离子交换层析等方法,还可以通过利用样品等电点性质等方法将pH范围相近的蛋白质富集(Santoni et al., 2000; Beranova-Giorgianni, 2003)。
请问从sigma购买货号为C6780 的α-casein(α-酪蛋白)中,磷酸化的比例是多少?希望大家可以提供帮助,谢谢
请问从sigma购买货号为C6780 的α-casein(α-酪蛋白)中,磷酸化的比例是多少?希望大家可以提供帮助,谢谢
实验室准备转做蛋白质组学,哪种质谱仪最好?价格大概在100万左右的哪个公司的质谱仪最适合做蛋白质组学?有推荐的请联系我,QQ:332677682,注明质谱仪。
[font=宋体][url=https://cn.sinobiological.com/category/wb-faq][b][font=Calibri]WB([/font][font=宋体]蛋白质印迹[/font][font=Calibri])[/font][/b][/url][font=宋体]是一种用于检测样本(如细胞提取物或组织匀浆)中特异性蛋白的技术,也用于分析体外合成的重组蛋白。蛋白免疫印迹法还可以根据某种抗原与其相对抗体之间的特殊亲和力来鉴定靶蛋白。蛋白免疫印迹法一般包含三个主要步骤分别为[/font][font=Calibri]SDS-PAGE[/font][font=宋体]、样品印迹和免疫学检测。通过蛋白免疫印迹法可以获得关于靶蛋白的定性和半定量数据。在蛋白质领域,蛋白免疫印迹法被广泛用于蛋白表达水平的检测。下面针对[/font][b][font=Calibri]WB[/font][font=宋体]在实验过程中遇到的问题进行罗列及解答:[/font][/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、为什么抗磷酸化酪氨酸抗体会出现高背景或信号减弱?[/font][/font][font=宋体][font=宋体]请您检查所使用的封闭液并注意封闭以及洗膜的时间。有两种常用的封闭液:脱脂奶粉或[/font][font=Calibri]BSA[/font][font=宋体]。脱脂奶粉成本低但不能用于磷酸化蛋白的封闭,因为脱脂奶粉含有酪蛋白,该蛋白本身就是一种磷酸化蛋白,会结合在膜上并与磷酸化特异性抗体结合导致高背景。并且稀释抗磷酸化酪氨酸抗体与脱脂奶粉中的酪蛋白结合后,用于检测的抗体较少导致信号减弱。此外,避免封闭时间过长,否则会掩盖抗原表位,阻止抗体结合。洗膜时间不宜过长或过短,过长会导致信号减弱(抗体被洗脱),过短则会导致高背景。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]我们建议使用含[/font][font=Calibri]1% BSA[/font][font=宋体]的[/font][font=Calibri]TBS[/font][font=宋体],含吐温[/font][font=Calibri]20[/font][font=宋体]作为封闭液,请勿使用脱脂奶粉。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、为什么随着时间的推移,蛋白免疫印迹法中的抗体活性会降低?[/font][/font][font=宋体]如果您使用我们的一种抗体进行蛋白免疫印迹分析,并且反应性似乎随着时间的推移而降低,可能的原因及解决方案如下:[/font][font=宋体] [/font][font=宋体]①可能的原因一:使用了不同的样本。[/font][font=宋体]解决方案:培养的细胞会随着时间的推移而变性,因此我们建议解冻新鲜细胞。[/font][font=宋体]②可能的原因二:样品在储存期间或反复冻融后降解。[/font][font=宋体]解决方案:制备新鲜样品,避免反复冻融。[/font][font=宋体]③可能的原因三:抗体被污染。解决方案: 旋转小瓶,检查是否有沉淀。[/font][font=宋体]④可能的原因四:二抗失效。解决方案:更换新的二抗。[/font][font=宋体]⑤可能的原因五:蛋白质转膜效率低。解决方案:配置新的转膜液;根据蛋白分子量大小调整转膜时间。[/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、如何避免转膜不充分或结果不理想的问题?[/font][/font][font=宋体][font=宋体]确定蛋白质的大小。如果蛋白质大于[/font][font=Calibri]180 kDa[/font][font=宋体],则需要通过以下方式优化转膜条件:[/font][/font][font=宋体][font=宋体]? 使用[/font][font=Calibri]20% MeOH[/font][font=宋体]。[/font][/font][font=宋体][font=宋体]? 加入[/font][font=Calibri]0.05% SDS[/font][font=宋体]转膜缓冲液。[/font][/font][font=宋体]? 增加裂解物的上样量。[/font][font=宋体][font=宋体]? [/font][font=Calibri]110 V[/font][font=宋体]恒压转[/font][font=Calibri]150 min[/font][font=宋体],湿法转膜。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4[/font][font=宋体]、如何避免“斑点状”或不均匀的蛋白免疫印迹?[/font][/font][font=宋体][font=宋体]为避免进行蛋白免疫印迹法时出现[/font][font=宋体]“斑点状”或不均匀的印迹,有以下几种方法[/font][font=Calibri]: [/font][/font][font=宋体]? 延长封闭时间,以优化封闭效果。[/font][font=宋体]? 延长洗涤次数 (这对组织匀浆样品尤为重要)。[/font][font=宋体]? 在配置封闭液时,确保奶粉完全溶于溶液。[/font][font=宋体]? 在取出抗体溶液使用之前,旋转装有抗体溶液的试管,防止出现蛋白沉淀。[/font][font=宋体] [/font][font=宋体][font=Calibri]5[/font][font=宋体]、如何避免印迹上出现“点状”、不均匀的斑点?[/font][/font][font=宋体][font=宋体]为避免印迹上出现[/font][font=宋体]“点状”或不均匀斑点,请尝试以下几种方法:[/font][/font][font=宋体]? 检查所有缓冲液是否被细菌污染。[/font][font=宋体]? 确保在抗体和清洗孵育过程中膜完全浸入。[/font][font=宋体]? 在转膜时,排除薄膜和凝胶之间的所有气泡。[/font][font=宋体]? 将膜放在摇床上,确保均匀地接触。[/font][font=宋体]? 清洗蛋白免疫印迹所需的设备。[/font][font=宋体][font=宋体]? 过滤[/font][font=Calibri]HRP[/font][font=宋体]结合物,除去任何可能的聚集物。[/font][/font][font=宋体]?减少底物暴露时间。[/font][font=宋体] [/font][font=宋体][font=Calibri]6[/font][font=宋体]、选择什么作为[/font][font=Calibri]WB[/font][font=宋体]抗体的阳性对照?[/font][/font][font=宋体]为了使您的蛋白免疫印迹抗体中获得最佳性能,请使用技术数据表中推荐的阳性对照。阳性对照将帮助您按照制定的方案,在实验中获得准确的结果。[/font][font=宋体][font=宋体]我们建议将这些裂解物放置在[/font][font=Calibri]-20[/font][font=宋体]℃下长期储存。裂解物非常稳定,它们是细胞制剂,所有酶均变性和灭活。我们做了大量的研究,证实了不同条件下的稳定性。例如,大多数裂解物的完整性和质量不受反复冻融的影响,可在[/font][font=Calibri]25[/font][font=宋体]℃下储存长达[/font][font=Calibri]12[/font][font=宋体]周。但裂解物在[/font][font=Calibri]37[/font][font=宋体]°[/font][font=Calibri]C[/font][font=宋体]下[/font][font=Calibri]4[/font][font=宋体]周时开始降解。然而,根据裂解物的来源,稳定性可能存在一些轻微差异,因此我们建议将其储存在[/font][font=Calibri]-20[/font][font=宋体]℃下。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]7[/font][font=宋体]、应该分析多少蛋白质?[/font][/font][font=宋体]我们建议:[/font][font=宋体]样本类型[/font][font=宋体]每条泳道[/font][font=宋体]全细胞裂解液[/font][font=宋体][font=Calibri]50 [/font][font=宋体]μ[/font][font=Calibri]g[/font][/font][font=宋体]细胞核提取物[/font][font=宋体][font=Calibri]25 [/font][font=宋体]μ[/font][font=Calibri]g[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]8[/font][font=宋体]、应该使用多少浓度的丙烯酰胺凝胶来分离蛋白?[/font][/font][font=宋体]为了更好地分离感兴趣蛋白,丙烯酰胺凝胶的百分比应基于蛋白分子量。我们建议:[/font][font=宋体][font=宋体]蛋白大小([/font][font=Calibri]kDa[/font][font=宋体])[/font][/font][font=宋体][font=宋体]丙烯酰胺凝胶百分比([/font][font=Calibri]%[/font][font=宋体])[/font][/font][font=宋体][font=Calibri] 80[/font][/font][font=宋体][font=Calibri]7.5[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]9[/font][font=宋体]、蛋白免疫印迹法应使用哪种印迹膜?[/font][/font][font=宋体][font=宋体]我们建议使用硝酸纤维素([/font][font=Calibri]NC[/font][font=宋体])膜。虽然聚偏二氟乙烯([/font][font=Calibri]PVDF[/font][font=宋体])膜、尼龙膜和[/font][font=Calibri]DEAE[/font][font=宋体]纤维素膜也可以使用,但有时会产生升高的背景,特别是实验过程中使用山羊多克隆抗体。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]10[/font][font=宋体]、应该使用什么封闭缓冲液?[/font][/font][font=宋体][font=宋体]封闭液的选择与目标蛋白有关,我们建议一般使用[/font][font=Calibri]1X TBS[/font][font=宋体]、[/font][font=Calibri]5%[/font][font=宋体]脱脂奶粉、[/font][font=Calibri]0.05%[/font][font=宋体]吐温[/font][font=Calibri]-20[/font][font=宋体]作为封闭液,在室温下封闭[/font][font=Calibri]30-60[/font][font=宋体]分钟或在[/font][font=Calibri]4[/font][font=宋体]℃下封闭过夜。请注意,如果封闭过夜,缓冲液中应不加吐温[/font][font=Calibri]-20[/font][font=宋体]。如果目标蛋白较特殊(如磷酸化),建议使用[/font][font=Calibri]1X TBS[/font][font=宋体]、[/font][font=Calibri]1% BSA[/font][font=宋体]并含有吐温[/font][font=Calibri]-20[/font][font=宋体]的封闭液,可得到较清晰条带。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]11[/font][font=宋体]、一抗的稀释倍数一般是多少?[/font][/font][font=宋体]请查看各个抗体的数据表,因为这通常记录起始稀释度。如果数据表上没有具体稀释信息,我们建议您对相关的阳性和阴性对照进行连续滴定。[/font][font=宋体] [/font][font=宋体][font=Calibri]12[/font][font=宋体]、为什么实际的蛋白免疫印迹条带大小与预期的不同?[/font][/font][font=宋体][font=宋体]蛋白免疫印迹法是根据蛋白质大小分离蛋白的技术。一般来说,蛋白越小,其在[/font][font=Calibri]SDS-PAGE[/font][font=宋体]凝胶中移动的速度就越快。然而,移动速率也受到其他因素的影响,因此实际条带大小可能与预测不一致。[/font][/font][font=宋体] [/font][font=宋体]可能的原因[/font][font=宋体]备注[/font][font=宋体]①翻译后修饰[/font][font=宋体]例如磷酸化、糖基化等,可增加蛋白质的大小。[/font][font=宋体]②翻译后切割[/font][font=宋体]大多数蛋白质首先合成为前体蛋白形式,再经切割产生活性形式,例如前体半胱天冬酶。[/font][font=宋体]③剪接变体[/font][font=宋体][font=宋体]可变剪切会产生从同一基因产生不同大小的蛋白质。剪接变体的表达具有高度变异性,取决于使用的特定组织和实验条件[/font] [font=宋体]。[/font][/font][font=宋体]④亚型[/font][font=宋体]许多蛋白质表达多种不同大小的亚型。相同靶蛋白不同亚型的表达具有高度变异性,取决于使用的特定组织和实验条件。参照不同的网站,确定特定靶标的亚型。[/font][font=宋体]⑤相对电荷[/font][font=宋体][font=宋体]氨基酸组成(带电[/font][font=Calibri]vs.[/font][font=宋体]不带电)。[/font][/font][font=宋体]⑥多聚体[/font][font=宋体]例如蛋白质二聚化。尽管相互作用可能导致出现较高条带,但在还原条件下需防止该情况。[/font][font=宋体] [/font][font=宋体][font=Calibri]13[/font][font=宋体]、为什么蛋白免疫印迹结果信号微弱或完全没有信号?[/font][/font][font=宋体] [/font][font=宋体]可能的原因[/font][font=宋体]备注[/font][font=宋体]①抗体滴定 [/font][font=宋体][font=宋体]应使用多种抗体浓度进行抗体滴定实验,以确定最佳信噪比的合适抗体浓度。一般而言,滴定浓度应在[/font][font=Calibri]0.2-5.0 [/font][font=宋体]μ[/font][font=Calibri]g/mL[/font][font=宋体]。[/font][/font][font=宋体][font=宋体]②组织[/font][font=Calibri]/[/font][font=宋体]细胞特异性 [/font][/font][font=宋体]靶蛋白表达取决于待测的细胞或组织。应进行文献检索,确保您正在使用的细胞等条件适用于检测靶蛋白。[/font][font=宋体]③复溶 [/font][font=宋体]在重新溶解冻干抗体时应注意,确保抗体全部溶解。尽管冻干抗体沉淀通常位于试管底部,但有时粉末可能位于管壁上。因此,溶解时应覆盖试管的整个表面,以确保抗体完全溶解。然后进行短暂离心,确保将所有粉末收集在试管底部。[/font][font=宋体]④阳性对照 [/font][font=宋体]在您的蛋白免疫印迹中添加阳性对照泳道是评价抗体是否正常工作和实验条件是否适当的最佳方法。另外,基于文献或实验结果的阳性对照也可以用来评估抗体是否正常发挥作用。[/font][font=宋体] [/font][font=宋体][font=宋体]更多[/font][font=Calibri]WB[/font][font=宋体]蛋白免疫印迹法常见问题详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/category/wb-faq[/font][/font][font=宋体][font=Calibri][url=https://cn.sinobiological.com/services/western-blot-wb-service][b]Western Blot[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/services/western-blot-wb-service][b]检测服[/b][/url]务:[/font][font=Calibri]https://cn.sinobiological.com/services/western-blot-wb-service[/font][/font]
一、 前言基因工程已令人难以置信的扩展了我们关于有机体DNA序列的认识。但是仍有许多新识别的基因的功能还不知道,也不知道基因产物是如何相互作用从而产生活的有机体的。功能基因组试图通过大规模实验方法来回答这些问题。但由于仅从DNA序列尚不能回答某基因的表达时间、表达量、蛋白质翻译后加工和修饰的情况、以及它们的亚细胞分布等等,因此在整体水平上研究蛋白质表达及其功能变得日益显得重要。这些在基因组中不能解决的问题可望在蛋白质组研究中找到答案。蛋白质组研究的数据与基因组数据的整合,将会在后基因组研究中发挥重要作用。目前蛋白质组研究采用的主要技术是双向凝胶电泳和质谱方法。双向凝胶电泳的基本原理是蛋白质首先根据其等电点,第一向在pH梯度胶内等电聚焦,然后转90度按他们的分子量大小进行第二向的SDS-PAGE分离。质谱在90年代得到了长足的发展,生物质谱当上了主角,蛋白质组学又为生物质谱提供了一个大舞台。他们中首选的是MALDI-TOF,其分析容量大,单电荷为主的测定分子量高达30万,干扰因素少,适合蛋白质组的大规模分析。其次ESI为主的LC-MS联机适于精细的研究。本文将简介几种常用的生物质谱技术,并着重介绍生物质谱技术在蛋白质组学各领域的应用。此贴与http://bbs.instrument.com.cn/shtml/20081130/1613156/重复,请版友在发帖前先搜索一下,以免重复发帖,谢谢!
请教各位:考马斯亮兰检测蛋白质中磷酸起什么作用?在配置考马斯亮兰时(称100mg考马斯亮兰G-250,溶于50ml95%的乙醇后,再加入120ml85%的磷酸,用水稀释至1L)其中,乙醇和磷酸起什么作用?可不可以改变磷酸的浓度?
自80年代以来一系列新的软电离技术如快原子轰击电离 、基质辅助激光解吸电离 、电喷雾电离等发现后,生物质谱技术迅速发展,已成为现代科学研究前沿的热点之一。而其中又以基质辅助激光解吸质谱(MALD I2MS)和电喷雾电离质谱(ESI2MS)应用最为广泛。基质辅助激光解吸质谱灵敏度高、可操作性强且对生物样品中的无机盐和缓冲溶液具有较好包容性;电喷雾电离质谱选择性好、分析质量范围宽、样品消耗量小、易于与各种色谱联用。在生物样品的处理中常常需要用到非挥发性的盐,用于为细胞营造无毒的环境,稳定溶剂化的样品及维持酶的活性等。此外,许多用于分离生物分子的分离方法也需要高浓度的盐和缓冲溶液 。但是,样品处理及分离过程中所用的NaCl、十二烷基磺酸钠、盐酸胍、尿素、甘油、二甲基亚砜等都会影响后续质谱高灵敏的分析 。因为这些不挥发的低分子量污染物会导致复杂加合物的形成,增加噪音及造成明显的信号抑制 。此外,在复杂的组织或细胞蛋白质组中,与疾病和信号传导相关的蛋白质往往是属于低丰度的蛋白质,这些重要的蛋白质由于本身存在的量极少而很难得以有效鉴定 。因此,对蛋白质/多肽样品的预富集处理将是MALD I2MS或ESI2MS得到高质量质谱图的前提,也是成功鉴定蛋白质的关键。该文献主要侧重于相关工作的概述。

[size=16px][font=-apple-system, BlinkMacSystemFont, &][color=#05073b]蛋白质检测仪是什么仪器[/color][/font]蛋白质检测仪是一种用于检测食品、生物样品和其他物质中蛋白质含量的仪器。它通过不同的方法,如凯氏定氮法、分光光度法、[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]法等,对样品中的蛋白质进行定量和定性分析。蛋白质检测仪可以广泛应用于实验室、质量控制部门和科研机构等领域。它具有操作简便、快速准确、灵敏度高、重复性好等优点,能够满足不同领域的需求。蛋白质检测仪的原理主要是根据蛋白质与特定试剂的反应,如与双缩脲试剂的显色反应,或与某些染料的结合反应,来测定样品的蛋白质含量。不同的蛋白质检测仪采用不同的原理和方法,但它们都具有相同的目的是准确测定样品中的蛋白质含量。在使用蛋白质检测仪时,需要注意样品的处理和试剂的选择。不同的样品需要不同的处理方法,如血液样品需要进行离心分离,组织样品需要进行匀浆等。同时,试剂的选择也需要注意,如双缩脲试剂需要使用硫酸铜和氢氧化钠等试剂进行配制。总之,蛋白质检测仪是一种重要的实验室仪器,可以用于测定样品中的蛋白质含量。它具有操作简便、快速准确等优点,能够满足不同领域的需求。同时,需要注意样品的处理和试剂的选择,以确保测定的准确性和可靠性。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2023/11/202311131032246528_1186_6098850_3.jpg!w690x690.jpg[/img][/size]