推荐厂家
暂无
暂无
 400-878-6829
400-878-6829
 留言咨询
留言咨询
 400-633-0963
400-633-0963
 留言咨询
留言咨询
 400-860-5168转3750
400-860-5168转3750
 留言咨询
留言咨询

 4008-166-717
4008-166-717
 留言咨询
留言咨询

 留言咨询
留言咨询

 400-812-0959
400-812-0959
 留言咨询
留言咨询
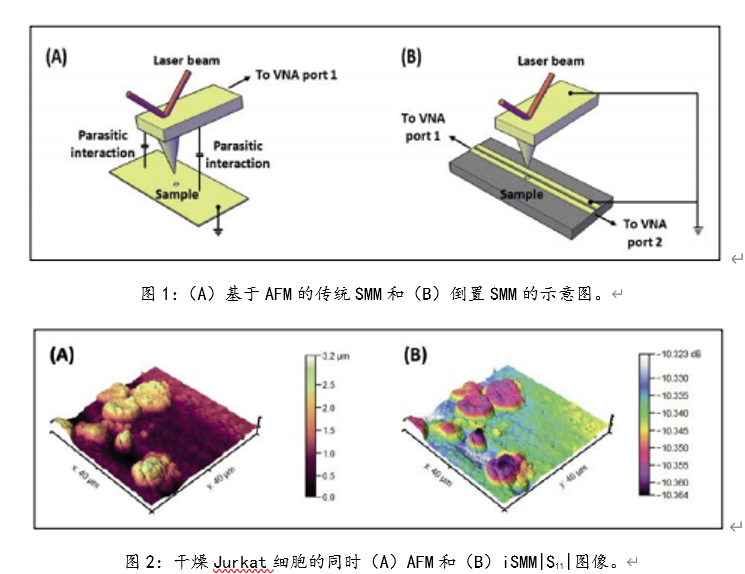





[align=center][b]双光子激光扫描显微镜的检测模式及其在生物医学领域的应用[/b][/align][align=center][font=宋体]刘皎[/font][sup]1[/sup],吴晶[sup]1[/sup][/align][align=center]1. [font=宋体]北京大学医药卫生分析中心,北京,[/font]100191[/align][b][font=黑体][[/font]摘要] [/b]双光子激光扫描显微镜(two-photon laser scan microscope, TPLSM[font=宋体])具有低光毒性、高时空分辨率、高信噪比等优点,结合了激光扫描共聚焦显微镜和双光子激发技术,广泛应用于脑科学、免疫学、肿瘤、胚胎发育等生物医学相关研究领域。本文结合作者所在的北京大学医药卫生分析中心共聚焦平台的工作经验,概述了[/font]TPLSM适用的样本、检测模式以及在生物医学领域的应用,以期为相关科研技术人员提供参考。[b][font=&][Abstract][/font] [/b]Two-photon laser scan microscopy (TPLSM) has the advantages of low phototoxicity, high spatial and temporal resolution, and high signal-to-noise ratio.TPLSM combines laser scanning confocal microscopy with two-photon excitationtechnology and it is widely used in brain science, immunology, tumor, embryodevelopment and other biomedical related research fields. Based on the author'swork experience in the confocal center of Peking University Medical and HealthAnalysis Center, this paper summarizes the applicable samples, detection modesand applications of TPLSM in the biomedical field, in order to provide referencefor related scientific researchers and technicians.[b][font=黑体][[/font]关键词] [/b]显微镜双光子,检测模式,应用[b]1 引言[/b]双光子激发技术的基本原理是在高光子密度情况下,荧光分子可同时吸收2个长波长光子,产生一个一半波长光子去激发荧光分子的相同效果。双光子激光扫描显微镜(two-photon laser scan microscope, TPLSM[font=宋体])在激光扫描共聚焦显微镜的基础上,以红外飞秒激光作为光源,长波长的近红外激光受散射影响小,易穿透标本,可深入组织内部非线性激发荧光,对细胞毒性小且具有高空间分辨率,适合生物样品的深层成像及活体样品的长时间观察成像[/font][1]。使用高能量锁模脉冲激光器,物镜焦点处的光子密度最高,在焦点平面上才有光漂白及光毒性,焦点外不损伤细胞。双光子效应只发生在焦点处,所以双光子显微镜无需共聚焦针孔,也能做到点激发点探测,提高了荧光检测效率[2]。[b][/b]双光子激光扫描显微镜显微镜可以通过XYZ,XYT,XYλ,XYZT,XYλT等多种模式实现多维成像,亦可进行更复杂实验的拍摄,比如二次谐波成像(Second Harmonic Generation Imaging,SHG[font=宋体])、双光子荧光寿命成像([/font]Two-photon Fluorescence Lifetime Imaging Microscopy, TP-FLIM[font=宋体])、荧光寿命[/font]-[font=宋体]荧光共振能量转移成像([/font]FluorescenceLifetime - Fluorescence Resonance Energy Transfer Imaging, FLIM-FRET[font=宋体])等实验以满足对样品的定性、定量、定位、共定位等多维度多功能的研究。[/font]TPLSM已成为生命科学各领域重要的研究工具,可在细胞及亚细胞水平对活体动物的神经细胞形态结构、离子浓度、细胞运动、分子相互作用等生理现象进行直接的长时间成像监测,还能进行光激活染及光损伤等光学操纵,广泛应用于脑科学、免疫学、肿瘤、胚胎发育等生物医学相关研究[3-5]。本文拟通过按TPLSM常见的检测模式分别阐述其在生物医学领域的应用,以其为相关科研技术人员提供参考。[b]2. TPLSM适用的样本[/b]TPLSM适用的样本非常广泛,从液体、固体等形式的材料或制剂、细菌、细胞、细胞团、类器官、组织切片、到各种模式动物(如线虫、果蝇、斑马鱼、小鼠、大鼠、兔、猴等)及其[font=宋体]脑、脊髓、肝脏、肺、皮肤等器官[/font],都可以通过搭载不同载物台进行测试。相对于传统激光扫描共聚焦显微镜200μm的成像深度极限,双光子显微镜成像深度可达800μm,如果是透明化样品可更厚。TPLSM尤其适合活体动物成像,且比小动物荧光成像有更高的分辨率和信噪比,一般TPLSM的XY轴分辨率为200 nm左右,Z轴分辨率为300 nm左右。[b]3. TPLSM的检测模式[/b]3.1 二维成像模式TPLSM可以实现点扫描、点探测,得到生物样品高反差、高分辨率、高灵敏度的二维图像,从而获得细胞/组织等光学切片的物理、生物化学特性及变化。也可以对所感兴趣的区域进行准确的定性、定量及定位分析。激光扫描显微镜的zoom功能,可以用来调节扫描区域的放大倍数。但受物镜分辨率的限制,一味的增大zoom值,不能得到相应的高清图像,需根据实际情况参考piexl size进行设定。TPLSM可以实现XY、XZ或XT的二维成像模式,XT线扫会在后文与XYT时间序列成像一起进行举例说明(图2b)。3.2 三维成像模式3.2.1 Z轴序列三维成像(XYZ)[align=left]TPLSM可沿Z轴方向通过电动载物台的连续扫描对样品进行无损伤的光学切片(XYZ),获得三维立体图像。同理,通过沿Y轴方向连续扫描,可获得连续的XZY图像。如图1所示TPLSM[font=宋体]可以顺利观察到可以观察到血管清晰形态结构:单个胚胎的胎盘微血管(图[/font]1a)、肝脏血窦微血管(图1b)和后肢微血管(图1c)[6]。[/align][align=center][img=,690,230]https://ng1.17img.cn/bbsfiles/images/2022/12/202212151626576232_4807_3237657_3.png!w690x230.jpg[/img][/align][align=center]图1(a)胚胎胎盘微(b)肝脏血窦和(c)后肢的微血管三维成像[/align]3.2.2 时间序列扫描模式(XYT)[align=left]按照一定的时间间隔重复采集,则可实现对该样品的实时监测(XYT)。此类实验可观察组织区域内特异荧光探针标记的单个细胞或细胞内不同部位接受刺激后的整个变化过程。[font=宋体]如图[/font]2[font=宋体]([/font]a[font=宋体]),可以根据微血管[/font]XYT[font=宋体]序列扫描的成像结果中某一血细胞在前后两张图的位置移动和这两帧图的扫描时间间隔计算血流速度。若血流速度很快,[/font]XYT扫描不足以捕捉实际流速,可以使用XT线扫计算。如图2(b),微血管XT扫描图像中绿色荧光背景里的黑色线条代表单个血细胞的流动轨迹,每条线条的横坐标代表血细胞移动的距离(distance / μm[font=宋体]),纵坐标代表此段时间([/font]time/ ms[font=宋体]),根据这两个数据可以计算出单位时间内血细胞的流动速度([/font]μm / ms)[6]。[/align][align=center][img=,690,262]https://ng1.17img.cn/bbsfiles/images/2022/12/202212151627102569_8367_3237657_3.png!w690x262.jpg[/img] [/align][align=center]图2 微血管(a)XYT扫描结果和(b)XT一维扫描结果图像计算血流说明示意图[/align]3.2.3 光谱扫描模式(XYλ/XYΛ)通常配置有可调节接受范围的检测器的TPLSM,可以实现从400nm-800nm的发射波谱扫描。通过配置具有连续可调波长的双光子激光器,还可以实现750nm-1300nm激发波谱扫描。这对于开发研制特殊染料探针的课题来说是很方便、全面的检测功能。3.3四维成像模式(XYZT/XYλT/XYΛT)基于上述三维成像模式,结合时间序列扫描,可以实现TPLSM的四维成像。3.4二次谐波成像(SHG)SHG是一个二阶非线性过程,且一般为非共振过程,适合富含胶原纤维的样本成像,如角膜、鼠尾肌腱、皮肤等。生物组织产生的二次谐波最主要的转换源自胶原,不同生物组织中的二次谐波信号强弱与组织中的胶原含量密切相关,含胶原丰富的组织包括结缔组织和肌肉组织等二次谐波信号也比较强,另外还有一些能产生强二次谐波的生物结构是微管,如细胞分裂中纺锤体。对于具有中心对称性的生物结构,如果局部中心对称性的破坏也会产生二次谐波:在两中心对称介质的界面,不同物态分子的相互作用使局部微观场特性在交界面(如细胞膜)发生突变,从而产生界面二次谐波[7]。除了动物组织外,一些含有特殊分子结构的植物组织也能产生二次谐波。二次谐波显微成像具有高空间分辨率、深成像深度、低损伤、以及对结构对称性的高度敏感性的特点,如果能与其他成像技术结合,将成为生物样品研究的有力工具[8]。3.5双光子荧光寿命成像(TP-FLIM)[9]FLIM技术是研究细胞内生命活动状态的一种非常可靠的方法。荧光寿命是荧光团在返回基态之前处于激发态的平均时间,是荧光团的固有性质,因此其不受探针浓度、激发光强度和光漂白效应等因素影响,且能区分荧光光谱非常接近的不同荧光团,故具有非常好的特异性和很高的灵敏度。此外,由于荧光分子的荧光寿命能十分灵敏地反映激发态分子与周围微环境的相互作用及能量转移,因此FLIM技术常被用来实现对微环境中许多生化参数的定量测量,如细胞中折射率、黏度、温度、pH值的分布和动力学变化等,这在生物医学研究中具有非常重要的意义。目前FLIM技术在细胞生物学中一些重要科学问题的研究、临床医学上一些重大疾病的诊断与治疗研究以及纳米材料的生物医学应用研究等方面均有广泛应用,并取得了许多利用传统的研究手段无法获取的数据。FLIM检测需要脉冲激光,TPLSM带有的高能量锁模脉冲激光器可以满足激发要求。3.6荧光寿命-荧光共振能量转移成像(FLIM-FRET)[10]传统的FRET过程分析通常是基于荧光强度成像来实现,分析的结果容易受光谱串扰的影响。而将FLIM技术应用于FRET过程分析,利用FLIM技术可定量测量这一优势,可非常灵敏地反映供体荧光分子与受体荧光分子之间的能量转移过程。当受体分子与供体之间的距离10nm时,供体的能量转移到受体,受体从基态发生能量跃迁,从而影响供体的荧光寿命。与没有受体分子的时候相比,发生FRET的供体分子的荧光寿命降低。因此,FRET-FLIM联合能够实时监测生物细胞中蛋白质的动态变化,如蛋白质折叠、分子间(蛋白-蛋白,蛋白-核酸)相互作用和细胞间信号分子传递、分子运输以及病理学研究等。[b]4 结论和展望[/b]综上,TPLSM应用灵活,具备多种检测模式,适用于多种样本,亦可实现多种实验目的,如荧光的定量、定性、定位、共定位,动态荧光的测定等。一些特殊的实验模式,将TPLSM在生物医学领域的应用进一步扩大。通过结合其他技术(多手段联合拓展,如膜片钳、原子力显微镜、光电联用等),TPLSM必将成为助力生物医学领域研究的有力工具。双光子荧光成像由于具有天生的三维层析能力以及深穿透能力,在活体生物组织成像上广受欢迎。双光子显微镜镜下空间增大后,可广泛应用于猴、大小鼠、兔等较大的模式动物的活体成像。且可结合电生理技术、光遗传技术,广泛应用于麻醉、清醒或运行行为等生理状态下的动物脑科学神经相关研究,在单细胞、单树突精度上对神经元群体活动进行监控。如结合膜片钳技术,对活体脑组组急性切片神经元进行双光子深层成像[11];结合光遗传技术,实现视觉皮层同一神经元和神经元群体的稳定操控和长期多次重复记录[12];对在健身球上移动的头部固定小鼠小脑进行成像,探讨觉醒状态和运动行为对胶质网络中钙离子的激发的影响[13];结合多种疾病模型,探讨大脑皮层神经元及胶质细胞活性的改变及作用等[14]。随着多种双光子显微镜系统的出现,双光子显微镜成像技术将以其实时、无损地探测、诊断及检测能力,在生物医药及临床医学应用中发挥更大作用。[b]参考文献[/b][1] [font=宋体]李娟[/font],[font=宋体]张岚岚[/font],[font=宋体]吴珏珩[/font].[font=宋体]双光子显微镜的应用优势与维护要素[/font][J].[font=宋体]中国医学装备[/font],2021,18(12):158-163.[2] HendelT,Mank M, Schnell B,et al.Fluorescence changes of genetic calcium indicatorsand OGB1correlated with neural ac tivity and calcium in vivo and in vitro[J].JNeurosci, 2008,28(29):7399-7411.[3] DolginE.What leva lamps and vinaigrette can teach us about cellbiology[J].Nature,2018,555(7696):300-302.[4] Noguchi J,Nagaoka A, Watanabe S,et al.in vivo two-photon uncaging of glutamate revealingthe structure-function relatio nships of dendritic spines in the neocortex ofadult mice[J]. J Physiol,2011,589(Pt 10):2447-2457.[5] BishopD,Nikiél, Brinkoetter M,et al.Nearinfrared branding efficiently correlateslight and electron microscopy[J]. Nat Methods,2011,8(7):568-570.[6] [font=宋体]刘皎[/font],[font=宋体]丛馨[/font],[font=宋体]何其华[/font].[font=宋体]活体小鼠微血管血流倒置双光子激光扫描显微镜检测方法的建立[/font][J].解剖学报,2022,53(02):261-265.[7] [font=宋体]屈军乐[/font],[font=宋体]陈丹妮[/font],[font=宋体]杨建军[/font],[font=宋体]许改霞[/font],[font=宋体]林子扬[/font],[font=宋体]刘立新[/font],[font=宋体]牛憨笨[/font].[font=宋体]二次谐波成像及其在生物医学中的应用[/font][J].[font=宋体]深圳大学学报[/font],2006,(01):1-9.[8] [font=宋体]孙娅楠[/font],[font=宋体]赵静[/font],[font=宋体]李超华[/font],[font=宋体]等[/font].[font=宋体]二次谐波结合双光子荧光成像方法观察人源胶原蛋白透皮吸收情况[/font][J].激光生物学报,2017,26(1):24-29.[9] [font=宋体]刘雄波,林丹樱,吴茜茜,严伟,罗腾,杨志刚,屈军乐,荧光寿命显微成像技术及应用的最新研究进展。物理学报,[/font]2018,67(17):178701-1-178701-14[10] [font=宋体]罗淋淋,牛敬敬,莫蓓莘,林丹樱,刘琳,荧光共振能量转移[/font]-荧光寿命显微成像(FRET-FLIM[font=宋体])技术在生命科学研究中的应用进展。光谱学与光谱分析,[/font]2021,41(4):1023-1031[11] Isom-BatzG,Zimmem PE.Collagen injection for female urinary incontinence after urethralor periurethral surgery[J].J Unol,2009,181(2):701-704.[12] JuN,Jiang R,Mrcknik SL,et al.Long-term all-optical interrogation of corticalneurons in awake-behaving nonhuman prim ates[J].LOSBiology,2018,16(8):e2005839.[13]Nimmerjahn A,Mukamel EA, Schnitzer MJ.Motor behavior activates Bergmann glialnetworks[J].Neuron,2009,62(3):400-412.[23] Huang L, Lafaille JJ, YangG.LearningDependent dendritic spine plasticity is impaired in spontaneousautoimmune encep halomyelitis[J].Dev Neurobiol,2021,81(5):736-745.[14] Huang L,Lafaille JJ,Yang G.LearningDependent dendritic spine plasticity is impaired inspontaneous autoimmune encep halomyelitis[J].Dev Neurobiol, 2021,81(5):736-745.
超声波扫描显微镜的主要用途:(1)材料的密度及晶格组织分布(2)材料内部的裂纹(3)材料内部分层缺陷,夹杂物等(4)材料的杂质颗粒,夹杂物,沉淀物等(5)材料的空洞,气泡,间隙等超声波扫描显微镜的应用领域:(1)在半导体及太阳能晶锭材料上的应用:分析晶锭内部缺陷等。(2)在半导体Wafer和太阳能晶圆上的应用:涂覆后和印刷后晶圆片上的分层缺陷等。(3)在半导体封装检测上的应用:塑封层、芯片顶部、 芯片粘接层、导线框、BGA 样品以及Flip Chip Underfill 上的分层缺陷等。 (4)在SMT贴装电路器件上的应用贴装后的MLF器件检测的重点是金线周围、基底和引出线之间的的分层缺陷,检测SMD贴片电容的内部缺陷等。(5)在MEMS器件上的应用:晶圆键合的超声检测。(6)在其他工业产品上的应用:钻头材料焊接面的结合情况,电池密封性的超声检测。(7)在材料科学领域的应用:镀层界面、铬合金镀层界面、镀膜层界面、多碳合金的超声金相分析、材料的硬度分析、材料内部的裂纹分析、高性能陶瓷内部的裂纹分析等。 (8)在生物医疗研究领域的应用:活体细胞组织裂变过程,不同活体细胞组织裂变过程,骨骼切片的超声图像等。
一、在细胞及分子生物学中的应用1. 细胞、组织的三维观察和定量测量 共聚焦显微镜的分辨率超过普通光学显微镜,染色过程简便,可以在活细胞上进行无创伤性的染色,最大程度地维持细胞的正常形态。多种自发性的荧光染料,已被广泛地用于诸如RNA、DNA细胞核、线粒体、内质网、肌动蛋白、细胞膜等结构的标记。运用免疫荧光技术,将不同波长的两三种荧光物质标记在内部不同结构的相应抗体上,以这几种荧光物质特定的光谱特性选择激发光和滤光片,则可以观察到细胞内部各结构间的毗邻关系。特别是在荧光着丝点易被遮盖(如荧光原位杂交实验)的情况下,这种三维图像的多角度观察提供了极大的优越性。细胞有丝分裂中细胞核内染色体数目(双倍体、多倍体)、形态和位置的变化,一直是细胞生物学肿瘤研究中的热点。着丝点是细胞核内的重要结构,被认为在有丝分裂中起重要的作用,应用共聚焦显微镜的定量测量技术,可以较精确地测定着丝点在不同分裂期的位置。共聚焦显微镜生成厚度小于0.2微米的依次相连的光学切片,即使较厚的组织的三维数据也可被计算机获取,运用适当的图像分析软件,可以测量并确定所观察结构的表面特征,体积等参数,为相互结合定量测量提供了新手段。2. 活细胞生理信号的动态监测:活细胞的功能监测在细胞生物学、神经生理学、药理学等领域都有重要意义。许多荧光染料可以聚集在细胞的特定结构,而对细胞的活性基本上不产生影响。可以利用这一特性来反映细胞受到刺激后形态或功能的改变。如亲脂性染料DiOC6(3)主要聚集在内质网,且对细胞的毒副作用极小。肌细胞中的肌浆网与ER有相同的属性,是胞内钙库,应用共聚焦显微镜,就可以动态观察肌细胞兴奋时SR的变化。许多参与神经元兴奋传导的离子如K+、Na+、Ca2+及H+、Cl-、Mg2+ 等,都有其自发性的荧光染料。Ca2+ 在细胞的兴奋、分化、死亡等过程中都起重要作用,是许多生理反应的胞内第二信使,是目前研究得最为充分的离子; 通过激光扫描共聚焦显微镜对胞内、核内钙转移的研究、对心肌细胞的钙变化研究、免疫细胞钙信号的研究、对Ca2+信号在凋亡细胞中作用的研究都取得了可喜的结果,而更多的研究则是将激光扫描共聚焦显微镜应用于神经生物学中对神经元Ca2+动态测量的研究。目前激光扫描共聚焦显微镜以其独特的优势成为钙研究中的重要手段之一。3. 粘附细胞的分选(adherent cell sorting) 对特异细胞的分选和克隆,是研究单个细胞或细胞系生物特性的先决条件。 将细胞贴壁培养在特制培养皿上,培养皿底部有一层特殊的膜,用高能量激光在欲选细胞四周切割成八角形几何形状,掀去培养皿底部的膜,非选择细胞则被去除。目前对粘附细胞分选方法多用于对杂交瘤和突变细胞的分选,也有用于对经转化的平滑肌细胞,卵巢癌细胞及人畸胎瘤干细胞等的分选和克隆,还可用于基因调控、基因治疗等研究。4. 细胞激光显微外科和光陷阱功能: 激光扫描共聚焦显微镜可将激光当作一把“光刀子”使用,完成诸如细胞膜瞬间穿孔,染色体切割,神经元突起切除等一系列细胞外科手术。光镊是利用激光的力学效应,将一个微米级大小的细胞或其它结构钳制于激光束的焦平面上,也称为光陷阱。光镊可以用来进行细胞融合(如卵细胞受精)、机械刺激或细胞骨架弹性测量等,特别是在测量植物细胞的细胞骨架时很有意义。5. 光漂白后的荧光恢复(FRAP): 细胞在相互接触后彼此间即有低阻抗的通道形成,以进行细胞间通讯;被经合成肽测试法证明只允许低于1.5KD分子通过的通道被称作缝隙连接。缝隙连接是存在于相邻细胞间的一类蛋白通道,普遍认为缝隙连接通过介导细胞间的信息传递,在诸如增殖、分化、代谢等过程中发挥极其重要作用。FRAP技术借助脉冲式激光照射细胞的某一区域,从而该区域荧光分子的光淬灭,该区域周围的未淬灭的荧光分子将以一定速率向受照区域扩散,而此扩散速率可通过低强度激光扫描探测。在研究细胞骨架构成、跨膜大分子迁移率、细胞膜流动性、胞间通讯等领域中有较大的意义。6. 在细胞凋亡研究中的应用细胞凋亡是由体内外因素触发细胞内预存的死亡程序而导致的细胞死亡过程,细胞凋亡作为生理性、主动性过程,能够确保正常发育、生长、维持内环境稳定,发挥积极的防御功能。用激光扫描共聚焦显微镜观察凋亡细胞,可见凋亡细胞体积变小,细胞质浓缩,细胞核变小,出现染色质沿核膜内侧排列的核边聚集现象。细胞凋亡的晚期,细胞核裂解为碎块,产生凋亡小体。细胞凋亡(Apoposis)是生物体内广泛存在的,由细胞特定基因控制,以细胞DNA 降解为特征的细胞自发过程,与机体中多种生理及病理过程密切相关。因而,对Apoposis 的研究现已成为研究细胞生物学研究的热点之一。而激光扫描共聚集显微镜结合众多荧光探针的应用,成为细胞Apoposis超微结构及分子水平变化的有力手段。二、在神经科学中的应用1. 定量荧光测定:对活细胞进行定量测定,具有很好的重复性,分析神经细胞和胶质细胞的某些物理及生物化学特性;监测抗原表达,细胞结合和杀伤等特征。在多发性硬化病人大脑活检标本上观察病变组织的微血管内皮细胞特异性地表达。2. 细胞内离子的测定:使用多种荧光探针,对神经细胞的Ca2+、PH及其它各种细胞内离子进行定量和动态分析。3. 神经细胞的形态学观察:激光扫描共聚焦显微镜使用模拟荧光处理,可将系列光学切片的数据合成三维图像,并可从任意角度观察。如Joshi等观察了细胞突触的骨架的三维图像。三维重建图像可使神经细胞及细胞器的形态学结构更加生动逼真。三、在耳鼻喉科学中的应用1. 在内耳毛细胞亚细胞结构研究上的应用:1993年Ikeda等应用激光扫描共聚焦显微镜研究内耳毛细胞的亚细胞结构,用Rhodamine 123染色,见线粒体分布于表皮板下和核下,加入1mmol/L三硝基酚使线粒体膜电位减小,荧光强度明显减弱。用DIOC6(3)染色,观察到内质网分布于表皮板下直至细胞核区域,呈网状、核下及侧膜下也有分布,胞质中则极少,探讨了蛋白激酶(PKC)在三磷酸肌醇/钙信号系统中的作用。2. 激光扫描共聚焦显微镜的荧光测钙技术在内耳毛细胞研究中的应用钙离子在细胞的生命活动中起着重要作用,它参与调节细胞功能,如肌肉收缩,细胞运动,递质合成与释放,信息传递,细胞换能等。激光扫描共聚焦显微镜的荧光测钙技术可探测到细胞内钙浓度的细微变化,当内耳毛细胞受到各种生理及病理因子刺激时,可用荧光测钙技术观察细胞内钙离子浓度的变化。为研究毛细胞的机能提供了新的手段。3. 激光扫描共聚焦显微镜在内耳毛细胞离子通道研究上的应用Issa等用膜片钳的全细胞记录法将Fluo-3已导入毛细胞,用激光扫描共聚焦显微镜观察,当毛细胞去极化时其底部侧膜上平均有18个亮点(钙内流所至),然后对同一毛细胞进行连续超薄切片电镜观察,证明这些亮点即为突触前活性区。4. 激光扫描共聚焦显微镜在嗅觉研究中的应用:Schild等用激光扫描共聚焦显微镜和钙荧光探针研究嗅觉感受器神经元的钙通道分布,以Fluo-3和Fura-red 染色后行双发射比例测量,测出其胞内游离钙呈不均匀分布,观察显示嗅觉感受器神经元的钙通道位于胞体部,与同一部位的钾通道一起构成适应性调节机制,而对树突尖端纤毛的钙依赖性换能过程无干扰。四、在肿瘤研究中的应用激光扫描共聚焦显微镜的出现,在一定程度上推动了肿瘤的研究进展。它为肿瘤细胞生物学、分子生物学、细胞通讯、细胞形态学研究、细胞的抗药物代谢、细胞膜及其受体等领域的研究,提供了有效手段。1. 定量免疫荧光测定:激光扫描共聚焦显微镜采用免疫荧光对肿瘤细胞的抗原表达、细胞结构特征、抗肿瘤药物的作用及机理等方面进行定量的观察和监测,为较理想的形态学观察方法。先采用荧光标记特异性抗原或抗体,使其与特异性抗体或抗原结合,再采用激光扫描共聚焦显微镜对其进行定性、定量和形态学分析。近年来报道较多的是P53肿瘤相关抗原等的定位、定性和定量分析。采用荧光标记某些蛋白分子,然后测定其平均荧光强度和积分荧光强度,从而对某些细胞结构蛋白分子进行定量分析。2. 细胞内离子分析激光扫描共聚焦显微镜可以准确地测定细胞内Ca2+ 、 K+ 、 Na+ 、 Mg2+ 、 pH等