[font=宋体]在现代生命科学研究中,[url=https://cn.sinobiological.com/resource/protein-review/protein-production][b]重组蛋白表达技术[/b][/url]扮演着至关重要的角色。通过将外源基因导入宿主细胞,并使其表达特定蛋白,我们能够获取大量高纯度的重组蛋白,为疾病治疗、药物研发和生物工程等领域提供了强有力的支持。本文将介绍重组蛋白表达的原理、表达系统、生产步骤以及应用前景。[/font][font=宋体][b]一、重组蛋白表达的原理[/b][/font][font=宋体][font=宋体]重组蛋白表达是利用[/font][font=Calibri]DNA[/font][font=宋体]重组技术,将目标基因(外源基因)导入宿主细胞中,并通过宿主细胞的生物机制使其表达出特定蛋白。其主要步骤包括:[/font][/font][font=宋体][font=宋体]基因克隆:将目标基因经过[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]扩增后,与表达载体连接,形成重组质粒。[/font][/font][font=宋体]转染或转化:将重组质粒导入宿主细胞中,可以使用化学方法、电穿孔或者嗜热菌等方式进行转染或转化。[/font][font=宋体]表达蛋白:重组质粒进入宿主细胞后,融合到宿主细胞的染色体中,随后遵循细胞的转录和翻译机制,表达出目标蛋白。[/font][font=宋体] [/font][b][font=宋体]二、常见的重组蛋白表达系统[/font][/b][font=宋体]大肠杆菌表达系统:大肠杆菌是常用的重组蛋白表达宿主细胞之一。其优点在于生长快速、易于培养,并且能够产生大量的蛋白。此外,大肠杆菌的遗传工具和代谢途径也被广泛研究,提供了便利。[/font][font=宋体]酵母表达系统:酵母表达系统包括酿酒酵母和毕赤酵母。这些酵母细胞具有真核细胞的特点,能够进行正确的蛋白折叠和修饰。同时,酵母细胞也可以进行大规模培养和高表达,适用于一些复杂蛋白的表达。[/font][font=宋体]昆虫细胞表达系统:昆虫细胞表达系统常用于大规模蛋白表达。昆虫细胞具有真核细胞的优势,能够对蛋白进行正确的折叠和修饰,适合于表达大量需求复杂结构的重组蛋白。[/font][font=宋体]哺乳动物细胞表达系统:哺乳动物细胞的表达系统可用于高效表达复杂蛋白和进行蛋白质研究。哺乳动物细胞具有真核细胞特点,能够进行正确的蛋白质修饰和折叠,并且在一些特殊情况下需要考虑到人类蛋白的免疫原性。[/font][font=宋体] [/font][font=宋体][b]三、重组蛋白生产步骤[/b][/font][font=宋体] [/font][font=宋体]细胞中有两个蛋白生产阶段:转录和翻译,被称为分子生物学的中心法则。换言之,转录和翻译步骤属于重组蛋白表达步骤。[/font][font=宋体] [/font][font=宋体]为了生产重组蛋白,基因被分离并克隆到表达载体中。重组蛋白的生产需要蛋白表达系统、蛋白纯化系统和蛋白识别系统。[/font][font=宋体] [/font][font=宋体][b]获取重组蛋白的基本步骤:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]目标基因的扩增。[/font][/font][font=宋体][font=Calibri]2.[/font][font=宋体]插入克隆载体。[/font][/font][font=宋体][font=Calibri]3.[/font][font=宋体]亚克隆到表达载体中。[/font][/font][font=宋体][font=Calibri]4.[/font][font=宋体]转化到蛋白表达宿主中[/font][font=Calibri]([/font][font=宋体]细菌[/font][font=Calibri]([/font][font=宋体]大肠杆菌[/font][font=Calibri])[/font][font=宋体]、酵母细胞、哺乳动物细胞或杆状病毒[/font][font=Calibri]-[/font][font=宋体]昆虫细胞系统[/font][font=Calibri])[/font][font=宋体]。[/font][/font][font=宋体][font=Calibri]5.[/font][font=宋体]重组蛋白鉴定试验[/font][font=Calibri](Western blot[/font][font=宋体]或荧光[/font][font=Calibri])[/font][/font][font=宋体][font=Calibri]6.[/font][font=宋体]大规模生产。[/font][font=Calibri]([/font][font=宋体]大规模发酵[/font][font=Calibri])[/font][/font][font=宋体][font=Calibri]7.[/font][font=宋体]分离和纯化。[/font][/font][font=宋体] [/font][font=宋体]需要考虑多种因素:[/font][font=宋体][font=Calibri]1.[/font][font=宋体]选择哪个宿主系统?[/font][/font][font=宋体][font=Calibri]2.[/font][font=宋体]如何分离和纯化重组蛋白?[/font][/font][font=宋体] [/font][font=宋体]选择适当的表达宿主或使用正确的纯化方法并不容易,应考虑目标重组蛋白的性质。下面列出了一些重要因素:[/font][font=宋体] [/font][font=宋体]? 膜结合[/font][font=宋体]? 溶解度[/font][font=宋体]? 单或多结构域[/font][font=宋体][font=宋体]? 大小[/font][font=Calibri]([/font][font=宋体]分子量[/font][font=Calibri])[/font][/font][font=宋体]? 表达位置[/font][font=宋体] [/font][font=宋体][font=宋体]对于大多数没有足够经验来表达和分离重组蛋白的人来说,重组蛋白的生产是非常耗时的。许多生物公司为各种不同规模的重组蛋白表达提供良好的服务:[/font][font=Calibri]https://cn.sinobiological.com/services/recombinant-protein-expression-service[/font][font=宋体],例如义翘神州[/font][/font][font=宋体] [/font][font=宋体][b]四、重组蛋白表达技术的应用前景[/b][/font][font=宋体]药物研发:重组蛋白表达技术被广泛应用于药物研发领域,用于生产重组蛋白药物。这些药物包括多肽类、蛋白类和抗体类药物,如生长因子、抗体药物和血液制剂等。通过重组蛋白表达技术,我们可以获得高效纯度的药物,满足临床上的需求。[/font][font=宋体]生物工程:重组蛋白表达技术被广泛应用于生物工程领域,用于生产特定的蛋白产品。这些产品可以应用于食品、化妆品、工业发酵等领域,如酶制剂、生物染料和生物材料等。[/font][font=宋体]疾病治疗:通过重组蛋白表达技术,我们能够合成特定的蛋白,用于疾病的治疗和诊断。例如,利用重组抗体技术,可以开发出用于癌症治疗和免疫治疗的抗体药物。[/font][font=宋体] [/font][font=宋体][font=宋体]详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-production[/font][/font]
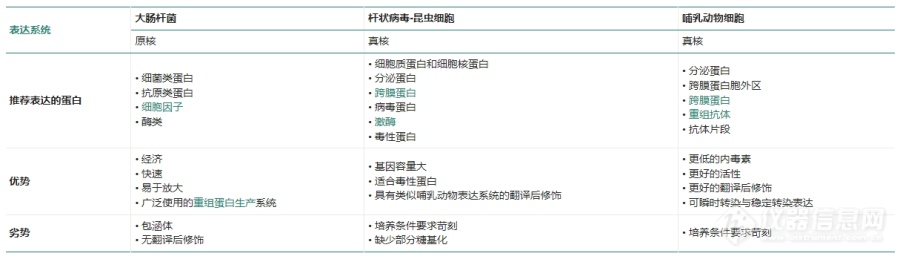
[font=宋体][font=宋体]重组蛋白是利用[/font][font=Calibri]DNA(RNA)[/font][font=宋体]重组技术表达的蛋白重组。蛋白表达是将目的基因通过电转化或者热激等手段转入合适的宿主中,利用宿主的特定生理、生化和遗传特点进行目标蛋白大量表达及纯化的生物技术。目前,较为主流的表达宿主有大肠杆菌([/font][font=Calibri]E.coli[/font][font=宋体])、毕赤酵母([/font][font=Calibri]P.pastoris[/font][font=宋体])、昆虫[/font][font=Calibri]-[/font][font=宋体]杆状病毒([/font][font=Calibri]Bac-to-Bac[/font][font=宋体]系统)以及哺乳动物细胞系([/font][font=Calibri]CHO[/font][font=宋体]、[/font][font=Calibri]HEK293[/font][font=宋体])等。鉴于目标蛋白的应用场景和自身理化性质的差异,选择合适的表达宿主尤为关键。[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]大肠杆菌([/font][font=Calibri]E.coli[/font][font=宋体]):[/font][/font][/b][font=宋体] [/font][font=宋体]表达系统:原核[/font][font=宋体]优势:经济、快速、高产量、应用广泛[/font][font=宋体]劣势:包涵体;无翻译后修饰;大分子蛋白表达困难[/font][font=宋体]推荐表达:细菌类蛋白;抗原类蛋白;细胞因子;酶类[/font][font=宋体] [/font][b][font=宋体]酵母细胞:[/font][/b][font=宋体]表达系统:真核[/font][font=宋体]优势:经济、快速、高产量;部分翻译修饰[/font][font=宋体]劣势:非人源糖基化;高甘露糖修饰[/font][font=宋体]推荐表达:细胞因子;少分子量蛋白;酶类[/font][font=宋体] [/font][b][font=宋体][font=宋体]杆状病毒[/font][font=Calibri]-[/font][font=宋体]昆虫细胞:[/font][/font][/b][font=宋体]表达系统:真核[/font][font=宋体]优势:基因容量大;可溶蛋白;适合毒性蛋白;类似哺乳动物系统;翻译后修饰[/font][font=宋体]劣势:周期长;成本高;缺少部分糖基化[/font][font=宋体]推荐表达:细胞质蛋白;毒性蛋白;跨膜蛋白;分泌蛋白;激酶;[/font][font=宋体] [/font][b][font=宋体]哺乳动物细胞[/font][font=宋体]表达[/font][font=宋体]:[/font][/b][font=宋体]表达系统:真核[/font][font=宋体]优势:可溶蛋白;更低内毒素;更好的活性;更好的翻译后修饰;可瞬时转染与稳定转染表达[/font][font=宋体]劣势:周期长;成本高;[/font][font=宋体]推荐表达:分泌蛋白;跨膜蛋白;重组抗体;抗体等[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州拥有原核细胞表达平台、哺乳动物瞬时表达平台、杆状病毒[/font][font=Calibri]-[/font][font=宋体]昆虫蛋白表达平台,同时提供[url=https://cn.sinobiological.com/services/e-coli-protein-expression-service][b]原核([/b][/url][/font][font=Calibri][url=https://cn.sinobiological.com/services/e-coli-protein-expression-service][b]E. coli[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/services/e-coli-protein-expression-service][b])蛋白表达服务[/b][/url]……可实现重组蛋白和重组抗体的高通量和高产量表达,可为客户提供[url=https://cn.sinobiological.com/services/recombinant-antibody-production-service][b]重组表达服务[/b][/url]及一站式定制需求。详情可以关注 大肠杆菌蛋白表达平台:[/font][font=Calibri]https://cn.sinobiological.com/services/platform/e-coli-protein-expression[/font][/font][font=宋体] [/font][font=宋体] [/font]
[font=宋体]蛋白表达系统指宿主、外源基因、载体和辅助成分组成的体系,通过这个体系可以实现外源基因顺利的实现在宿主中表达。[b]蛋白表达体系通常由以下几部分组成:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1. [/font][font=宋体]宿主:用来表达的生物体,可以为细菌(大肠杆菌、枯草芽孢杆菌)、酵母、植物细胞、动物细胞等。由于各种宿主生物本身的特性多种多样,因此采用的表达体系也不相同[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2. [/font][font=宋体]载体:载体的选择需要根据宿主而定,根据宿主不同,分为原核(大肠杆菌、枯草芽孢杆菌)表达载体、酵母表达载体、植物表达载体、哺乳动物表达载体、昆虫表达载体等。载体中还有外源基因片段,外源基因通过载体介导,可以在宿主中表达。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3. [/font][font=宋体]辅助成分:有的表达系统中还包括了协助载体进入宿主的辅助成分,比如:昆虫[/font][font=Calibri]-[/font][font=宋体]杆状病毒表达系统中的杆状病毒。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]重组蛋白表达的三个主要系统是细菌表达系统(例如乳酸乳球菌和大肠杆菌)、酵母和杆状病毒以及哺乳动物细胞介导的蛋白表达。[/font] [/font][font=宋体] [/font][b][font=宋体]应用:[/font][/b][font=宋体] [/font][font=宋体]表达后的蛋白常应用于:[/font][font=宋体][font=Calibri]1[/font][font=宋体])作为抗原制备抗体;[/font][/font][font=宋体][font=Calibri]2[/font][font=宋体])参与细胞实验与动物实验;[/font][/font][font=宋体][font=Calibri]3[/font][font=宋体])测定蛋白酶活;[/font][/font][font=宋体][font=Calibri]4[/font][font=宋体])研究蛋白相互作用;[/font][/font][font=宋体][font=Calibri]5[/font][font=宋体])研究蛋白结晶结构;[/font][/font][font=宋体][font=Calibri]6[/font][font=宋体])免疫组化实验;[/font][/font][font=宋体][font=Calibri]7[/font][font=宋体])药物蛋白研究、生产等。[/font][/font][font=宋体] [/font][b][font=宋体]影响蛋白表达的因素有:[/font][/b][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]蛋白本身的特性:蛋白分子量大小、蛋白来源[/font][font=Calibri]/[/font][font=宋体]物种、是否为毒性蛋白,蛋白翻译后修饰程度、蛋白自身结构的复杂程度[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2.[/font][font=宋体]宿主的选择:宿主本身的特性、蛋白表达需求等都影响着蛋白表达[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3.[/font][font=宋体]蛋白需求量:蛋白应用范围对应的需求量不同,所以要根据需求量确定表达系统[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4.[/font][font=宋体]质粒载体的选择:载体是携带外源基因的工具,要根据系统选择合适的载体才能使蛋白更好的表达[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5.[/font][font=宋体]融合标签的选择:蛋白重组表达过程中采用亲和标签融合表达有两方面的作用:一方面是为了使蛋白纯化过程变得更加容易;另一方面是为了促进某些不溶性蛋白可溶[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]6.[/font][font=宋体]蛋白表达系统的优化:重组蛋白的表达往往不像理论那样一帆风顺,在实际的表达过程中有可能产生各种各样的问题,因此表达系统的优化很重要。[/font][/font][font=宋体] [/font][b][font=宋体]如何选择合适的表达系统[/font][/b][font=宋体]没有一个表达系统是完美的,要针对每个重组蛋白来评估哪种系统最有效。每个蛋白表达系统的生产速度、成本、糖基化和折叠等特性都各不相同,且跨度很大。如下图:[/font][font=宋体] [/font][font=宋体][font=宋体]更多详情可以关注:义翘神州[url=https://cn.sinobiological.com/resource/protein-review/protein-production-systems][b]蛋白表达系统[/b][/url][/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-production-systems[/font][/font]
[font=宋体][font=宋体]无细胞蛋白表达系统([/font][font=Calibri]Cell-Free Protein Expression System[/font][font=宋体])是一种基于原核和真核细胞提取物构建的体外蛋白表达系统。它具有许多优点,例如可以在短时间内生产大量的蛋白质,同时避免了细胞内的复杂调控机制和翻译后修饰等繁琐过程。因此,无细胞蛋白表达系统在生物制药、生物材料、生物燃料等领域具有广泛的应用前景。本文将详细介绍无细胞蛋白表达系统的优缺点。[/font][/font][font=宋体][b]一、无细胞蛋白表达系统的优点[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]高效性:无细胞蛋白表达系统具有高表达效率的优点,这是由于体外体系中不存在靶蛋白累积所需的细胞分裂和细胞复杂代谢反应。此外,由于无细胞蛋白表达系统不受到细胞毒性和免疫反应的限制,可以实现大规模的蛋白质表达。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2.[/font][font=宋体]灵活性:无细胞蛋白表达系统可以使用一系列不同的原核和真核细胞提取物作为反应体系,例如[/font][font=Calibri]E.coli[/font][font=宋体]、小麦胚芽和人类细胞等。这意味着可以根据不同的实验目的和需求进行合理的选择,以适应多样化的研究需要。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3.[/font][font=宋体]易操作性:无细胞蛋白表达系统非常容易操作。与传统的细胞表达系统相比,无细胞蛋白表达系统不需要细胞培养、生长和繁殖。此外,无细胞蛋白表达系统可以快速进行,通常只需要数小时至几天即可完成目标蛋白的表达。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4.[/font][font=宋体]简单纯化:由于无细胞蛋白表达系统可以避免有机溶剂和离子交换剂等复杂的步骤,从而使目标蛋白的纯化工作更加简便和迅速。例如,可以使用亲和柱、凝胶过滤和电泳分析等方法来快速分离和纯化蛋白质。[/font][/font][font=宋体] [/font][font=宋体][b]二、无细胞蛋白表达系统的缺点[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]成本较高:尽管无细胞蛋白表达系统可以大规模进行蛋白质表达,但是所需的原核和真核细胞提取物通常需要较高的成本。此外,涉及到的一些试剂和设备也比较昂贵,使得无细胞蛋白表达系统在应用过程中存在一定的经济压力。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2.[/font][font=宋体]表达限制:由于无细胞蛋白表达系统缺乏复杂的代谢反应和细胞分化机制,因此它不适用于某些特定类型的蛋白。例如,它无法表达复杂的膜蛋白和困难的药物蛋白等。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3.[/font][font=宋体]不稳定性:无细胞蛋白表达系统通常具有一定的稳定性问题。由于缺乏细胞膜的保护,无细胞蛋白表达体系会更容易受到外部条件的影响,如温度、[/font][font=Calibri]pH[/font][font=宋体]、离子浓度等,从而导致蛋白质的不稳定性、聚集和降解等现象。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4.[/font][font=宋体]不适合复杂蛋白结构:无细胞蛋白表达系统对于复杂蛋白结构的模拟效果不佳。例如,膜蛋白、多肽和糖蛋白等复杂蛋白质可能会被无细胞蛋白表达系统无法很好地复制,从而限制了其应用范围。[/font][/font][font=宋体] [/font][font=宋体]无细胞蛋白表达系统具有高效、灵活、易操作、简单纯化等优点,但同时也存在着成本较高、表达限制、不稳定性和不适合复杂蛋白结构等缺点。在实际应用中,需要根据具体的研究目的和需求进行选择,并结合其他技术手段来弥补其不足之处。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/cell-free-protein-synthesis-service][b]无细胞蛋白表达服务[/b][/url],服务优势:[/font][font=宋体]①快速、高效 ②高成功率 ③一致性 ④高难度抗体表达[/font][/font][font=宋体] [/font][font=宋体][font=宋体]详情可以咨询,具体[/font][font=Calibri]https://cn.sinobiological.com/services/cell-free-protein-synthesis-service[/font][/font]
[font=宋体][font=宋体]真核蛋白表达系统是一种广泛应用的蛋白表达方式,通常利用酵母、昆虫或哺乳动物细胞作为宿主。这种表达系统所生成的蛋白与目标[/font][font=Calibri]DNA[/font][font=宋体]具有极高的相似性,能诱导高效蛋白表达。那么,在实施真核蛋白表达时,有哪些关键的纯化步骤呢?接下来,我们将详细解析这一过程。[/font][/font][font=宋体] [/font][font=宋体]首先,我们要明确真核蛋白表达的纯化步骤是至关重要的环节。这些步骤不仅关系到最终产品的纯度和产量,还直接影响其生物活性和应用价值。因此,选择合适的纯化方法对于整个实验的成功至关重要。[/font][font=宋体] [/font][b][font=宋体]真核蛋白表达及纯化步骤主要有以下几个方面:[/font][/b][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、重组质粒构建:将目的基因克隆进表达载体,常见的方法包括限制性切酶切割,基因合成等,根据连接酶说明,进行线性载体和目的基因片段的酶联,最后对质粒测序做好验证;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、蛋白诱导表达:普适条件下查看蛋白是否表达,若不表达,更换载体,表达菌株等方法查看是否表达,如果表达,继续实验;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、蛋白表达部位分析:分析蛋白是可溶性还是不溶性的表达,即在超声后上清表达还是沉淀表达;是否与你的目标蛋白表达部位相同,相同进行后续蛋白表达条件优化;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4[/font][font=宋体]、蛋白表达优化:优化诱导[/font][font=Calibri]IPTG[/font][font=宋体]浓度、诱导温度,进行放大培养;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5[/font][font=宋体]、蛋白纯化:根据目标蛋白的性质进行样本处理,然后进行亲和纯化,获取目的蛋白。[/font][/font][font=宋体] [/font][font=宋体][b]真核表达系统的选择与应用[/b][/font][font=宋体]酵母蛋白表达系统[/font][font=宋体]酵母真核蛋白表达系统有甲醇酵母表达系统,酿酒酵母表达系统,裂殖酵母表达系统以及克鲁维酸酵母表达系统等,其中最早应用于基因工程的酵母是酿酒酵母,但现在运用最广泛的酵母表达系统还是甲醇酵母表达系统中的毕赤酵母真核蛋白表达系统。[/font][font=宋体] [/font][font=宋体]哺乳动物细胞表达系统[/font][font=宋体][font=宋体]哺乳动物细胞表达系统是真核表达系统中唯一可以表达复杂蛋白的系统,它能够指导真核表达蛋白进行正确折叠,提供复杂的[/font][font=Calibri]N[/font][font=宋体]型糖基化和准确的[/font][font=Calibri]O[/font][font=宋体]型糖基化等多种翻译后加工功能,所以它和昆虫酵母系统比较更具有发展潜力,哺乳动物细胞真核表达的蛋白与天然真核表达蛋白的结构、糖基化类型和方式几乎相同且能正确组装成多亚基蛋白[/font][font=Calibri],[/font][font=宋体]但成本较高也一定程度上减缓了它的发展速度。哺乳动物细胞表达系统主要是通过改造宿主细胞来提高外源蛋白的表达效率,常用的宿主细胞有[/font][font=Calibri]CHO[/font][font=宋体]、[/font][font=Calibri]COS[/font][font=宋体]、[/font][font=Calibri]BHK[/font][font=宋体]、[/font][font=Calibri]SP2 /0N[/font][font=宋体]等,哺乳动物转染方法[/font][font=Calibri]*[/font][font=宋体]有脂质体转染法,电穿孔法以及病毒转染等。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州[url=https://cn.sinobiological.com/resource/protein-review/protein-purification-techniques][b]蛋白纯化技术[/b][/url]:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification-techniques[/font][/font][font=Calibri] [/font]
[font=宋体][font=Calibri]E. coli[/font][font=宋体]具有遗传背景清楚、细胞增殖快、表达量高、稳定性好和抗污染能力强等特点,适用于多种属蛋白的表达,尤其对小分子蛋白的生产具有极大的优势,但也存在一些问题,如易形成包涵体和含有内毒素等。义翘神州提供从密码子优化到重组蛋白表达[/font][font=Calibri]/[/font][font=宋体]纯化的一站式服务以及内毒素去除等附加服务,以满足不同的定制需求。我们拥有丰富的[/font][font=Calibri]E. coli [/font][font=宋体]可溶性蛋白表达[/font][font=Calibri]/[/font][font=宋体]纯化及蛋白复性经验,拥有多种[/font][font=Calibri]E. coli[/font][font=宋体]细胞株和表达载体,可为客户提供优质的[url=https://cn.sinobiological.com/services/e-coli-protein-expression-service][b]原核蛋白表达服务[/b][/url]。下面是在原核蛋白表达实验中常遇见的几大问题,为大家一一讲解:详情关注:[/font][font=Calibri]https://cn.sinobiological.com/services/e-coli-protein-expression-service[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、我不知道我的蛋白它有什么特性及其结构?[/font][/font][font=宋体] [/font][font=宋体]首先,你要确定一件事,那就是这几个蛋白质有人研究过没有?还是最新发现的蛋白质?如果没有人研究过,那就得用先测部分氨基酸,然后设计引物克隆了。如果有人研究过,那就好了可以根据软件来预测。[/font][font=宋体] [/font][font=宋体][font=宋体]如有[/font][font=Calibri]swiss[/font][font=宋体]—[/font][font=Calibri]pdb[/font][font=宋体]软件,但这个是要有氨基酸序列,知道基因序列,可以在[/font][font=Calibri]ncbi[/font][font=宋体]上进行[/font][font=Calibri]blastx[/font][font=宋体],得到蛋白。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、如何选择蛋白表达宿主菌?[/font][/font][font=宋体] [/font][font=宋体]原核系统和真核细胞偏爱的密码子有不同,因此,在用原核系统表达真核基因的时候,真核基因中的一些密码子对于原核细胞来说可能是稀有密码子,从而导致表达效率和表达水平很低。[/font][font=宋体] [/font][font=宋体]原核表达现象:[/font][font=宋体]一、蛋白不表达[/font][font=宋体]①蛋白为毒蛋白[/font][font=宋体]②序列含有稀有密码子[/font][font=宋体] [/font][font=宋体]二、蛋白表达不理想[/font][font=宋体]①蛋白明显降解[/font][font=宋体]②蛋白表达为包涵体[/font][font=宋体]③二硫键错误折叠[/font][font=宋体]④过高的本底表达[/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、质粒测序正确,蛋白无法表达怎么办?[/font][/font][font=宋体] [/font][font=宋体][font=宋体]①分析一下稀有密码子,如果比较多,可以尝试[/font][font=Calibri]rosetta[/font][font=宋体]([/font][font=Calibri]DE3[/font][font=宋体]);[/font][/font][font=宋体][font=宋体]②可能是基因本身的问题。[/font][font=Calibri]RNA3[/font][font=宋体]’的特殊结构可能导致转录出现问题,这种情况可以尝试融合表达,譬如[/font][font=Calibri]pET-32a[/font][font=宋体]。[/font][/font][font=宋体][font=宋体]③也许是表达量太低,也可以试一下[/font][font=Calibri]westernblot[/font][font=宋体],定性的检测一下。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4[/font][font=宋体]、如果[/font][font=Calibri]IPTG[/font][font=宋体]诱导后细胞停止了生长,是不是表示细胞死了?[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]T7RNA[/font][font=宋体]聚合酶非常活跃,[/font][font=Calibri]T7[/font][font=宋体]转录和翻译信号极强,因此,一旦诱导,细胞的主要生理活动都向着目的蛋白表达的方面转化。在通常情况下,细胞将停止生长,形成克隆的能力大大降低,但并未死亡。菌落形成试验可以用来检测表达系统的性能。也有一些例外情况,例如特别的目的基因以及一些极为严紧的载体[/font][font=Calibri]/[/font][font=宋体]宿主菌组合(比如含有[/font][font=Calibri]pLysE[/font][font=宋体]的宿主菌)等,这时在诱导后菌落还是会继续生长。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5[/font][font=宋体]、如何提高重组蛋白在原核细胞里的表达水平,特别是可溶性表达?[/font][/font][font=宋体] [/font][font=宋体]这个问题是最困扰做原核蛋白表达纯化的人的。比如大肠杆菌表达蛋白本身表达量就大,但是表达的大都是包涵体,想要获得可溶性蛋白,就需要做复性,或是再设计实验时就想办法让其在上清中表达。一般就要通过基因优化,载体宿主优化筛选,表达条件优化,诱导条件优化等等。[/font][font=宋体] [/font][font=宋体]①降低重组蛋白合成的速率[/font][font=宋体]可溶性蛋白的产率取决于蛋白的合成速率,蛋白的折叠速率,以及聚集的速率。高水平表达时,肽链聚集的速率一旦超过折叠速率,就会形成包涵体。因此,降低重组蛋白合成的速率有利于提高重组蛋白的可溶性表达。[/font][font=宋体] [/font][font=宋体]②密码子优化[/font][font=宋体][font=宋体]密码子优化就是根据表达系统对密码子的偏好性进行优化筛选。经过优化的基因序列往往能提高[/font][font=Calibri]mRNA[/font][font=宋体]二级结构的稳定性,有利于新生肽段的正确折叠,提高外源活性蛋白的表达。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]③表达温度的选择大肠杆菌的最适生长温度在[/font][font=Calibri]37[/font][font=宋体]~[/font][font=Calibri]39[/font][font=宋体]℃之间,但此温度下极易生成包涵体蛋白,降低可溶性蛋白的表达,而低温培养条件下表达外源蛋白能有效地增加可溶蛋白的比例。[/font][/font][font=宋体] [/font][font=宋体]④诱导条件优化[/font][font=宋体]摇瓶培养时,应选用低菌体浓度诱导,因为在低菌浓度下菌体处于对数生长期,生长活跃,有利于表达可溶性蛋白。然而,如果能保证合理的补料与充分的通气,在较高菌浓度下诱导也同样可能获得可溶蛋白的高效表达。在某些情况下,诱导剂的流加能显著提高可溶蛋白的表达水平。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=Calibri]6[/font][font=宋体]、义翘神州提供标签去除服务吗?[/font][/font][font=宋体] [/font][font=宋体]是的。我们构建载体时可以在标签蛋白和目的蛋白之间加上蛋白酶的酶切位点,这样纯化后就可以利用蛋白酶去除标签,得到完整的目的蛋白。蛋白酶的切割效率受目的蛋白的影响,具体由实验结果而定。[/font][font=Calibri] [/font]
[font=宋体][font=宋体]原核表达(这里是指[/font] [font=宋体]大肠杆菌表达系统[/font] [font=宋体])是目前常用的重组蛋白表达方式之一,操作相对简便,要求较低。相对哺乳动物表达系统更加经济节约。但是也常常遇到一些问题,比如原核表达蛋白表达量低?蛋白不表达?蛋白表达不在上清易形成包涵体等情况。本文主要根据实验经验总结[/font] [font=宋体]原核蛋白表达[/font] [font=宋体]的两个问题蛋白为什么不表达和蛋白表达为什么不在上清,并提出针对性的解决方案,帮助我们提高实验的成功率。原核表达[/font][font=Calibri]FAQ[/font][font=宋体]主要内容如下:[/font][/font][font=宋体] [/font][font=宋体]一、蛋白表达为什么不在上清?[/font][font=宋体] [/font][font=宋体][font=宋体]蛋白在大肠杆菌中的表达部位:细胞质中、细胞周质中、细胞外。[/font] [/font][font=宋体]蛋白在细胞周质中表达:细胞周质是指革兰氏阴性菌中、位于内膜和外膜之间的结构部分。周质中表达的蛋白质,分离纯化简单,而且周质中的氧化环境有利于蛋白质的正确折叠,但是蛋白产量很低。[/font][font=宋体]蛋白在胞外表达:胞外分泌是使大肠杆菌中的外源蛋白分泌到培养基中。[/font][font=宋体]途径:[/font][font=宋体]①用大肠杆菌细胞固有的途径,使真正属于分泌的蛋白直接分泌到胞外培养基中。大肠杆菌在正常情况下只有极少的蛋白可以分泌到胞外,且不是特别有效。[/font][font=宋体]②诱导大肠杆菌细胞的外膜发生有限的渗漏,从而使细胞内的蛋白向胞外培养基中分泌。[/font][font=宋体] [/font][font=宋体]二、蛋白的分泌表达优点[/font][font=宋体][font=Calibri]1[/font][font=宋体]、一些可被细胞内蛋白酶所降解的蛋白质分泌到周质或培养基中可增加其稳定性;[/font][/font][font=宋体][font=Calibri]2[/font][font=宋体]、有些在细胞内表达时无活性的蛋白分泌表达时能够按适当的方式进行准确折叠,增加到蛋白的活性;[/font][/font][font=宋体][font=Calibri]3[/font][font=宋体]、 由于蛋白质信号肽和编码序列间被切割,所以分泌蛋白产物不含氨基酸起始密码子[/font][font=Calibri]ATG[/font][font=宋体]所编码的甲硫氨酸,而甲硫氨酸会影响许多蛋白的活性。[/font][/font][font=宋体] [/font][font=宋体]三、如何提高蛋白的可溶性?[/font][font=宋体]重组蛋白在大肠杆菌中大量表达时,很容易在胞内形成不可溶的包涵体,为后期的纯化、复性带来麻烦,而且复性所得到的蛋白活性很低甚至没有活性。因此,提高重组蛋白在大肠杆菌中的可溶性表达是十分必要的。[/font][font=宋体] [/font][font=宋体]四、蛋白为什么不表达?[/font][font=宋体]真核基因在原核细胞中的的特点[/font][font=宋体]①使用原核启动子[/font][font=宋体][font=宋体]原核细胞[/font][font=Calibri]RNA[/font][font=宋体]聚合酶能识别真核基因启动子。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]②真核基因要置于原核载体[/font][font=Calibri]SD[/font][font=宋体]序列后[/font][/font][font=宋体][font=宋体]从真核[/font][font=Calibri]DNA[/font][font=宋体]转录的[/font][font=Calibri]mRNA[/font][font=宋体]缺乏结合原核核糖体的[/font][font=Calibri]SD[/font][font=宋体]序列,不能启动翻译过程。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]③使用[/font][font=Calibri]cDNA[/font][/font][font=宋体][font=宋体]真核基因中含有内含子,而原核细胞缺乏转录后加工体系,[/font][font=Calibri]mRNA[/font][font=宋体]中内含子不能切除,不能形成成熟的[/font][font=Calibri]mRNA[/font][font=宋体],也就不能表达真核蛋白。[/font][/font][font=宋体] [/font][font=宋体]④表达无需糖基化等修饰的蛋白[/font][font=宋体]原核细胞缺乏真核细胞所特有的蛋白翻译后的修饰系统,不利于表达需要糖基化、磷酸化修饰才有活性的真核蛋白。[/font][font=宋体] [/font][font=宋体]⑤真核基因必须切除信号肽序列[/font][font=宋体]蛋白具有信号肽序列的真核基因在真核细胞内先表达成蛋白前体,在其穿越细胞膜向外分泌时,会被细胞膜上信号肽识别序列切除而分泌到细胞外。但是在原核细胞内表达时,不但影响蛋白的表达,同时由于大肠杆菌缺乏加工处理体系,不能正确切除信号肽,而表达的分泌蛋白的前体没有实物活性,常聚集在胞内。[/font][font=宋体] [/font][font=宋体]五、影响原核表达的因素[/font][font=宋体][font=Calibri]1[/font][font=宋体]、翻译起始位点[/font][/font][font=宋体]现在大部分的表达载体都提供起始位点,所以它已经把起始密码子与核糖体结合位点的距离进行了优化,一般情况下不需要自己再添加,不过还是要留意载体图谱上是否注明有起始密码子和终止密码子。[/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、[/font][font=Calibri]GC[/font][font=宋体]含量[/font][/font][font=宋体][font=宋体]表达序列中的[/font][font=Calibri]GC[/font][font=宋体]含量超过[/font][font=Calibri]70%[/font][font=宋体]的时候可能会降低蛋白在大肠杆菌中的表达水平。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、[/font][font=Calibri]mRNA[/font][font=宋体]二级结构[/font][/font][font=宋体][font=宋体]在起始密码子附近的[/font][font=Calibri]mRNA[/font][font=宋体]二级结构可能会抑制翻译的起始或者造成翻译暂停从而产生不完全的蛋白。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4[/font][font=宋体]、密码子的偏爱性[/font][/font][font=宋体]如果外源基因密码子的使用频率和宿主菌高效表达的基因密码子的使用频率差异较大,翻译时核糖体在稀有密码子处就会产生停顿,这不仅降低蛋白质的合成效率,导致新生肽链的错误折叠而影响延伸,甚至会停止翻译。[/font][font=宋体] [/font][font=宋体][font=Calibri]5[/font][font=宋体]、质粒载体的选择[/font][/font][font=宋体]构建质粒载体时,要考虑质粒上的元件包括启动子,多克隆位点,终止密码子,融合标签,复制子,筛选标记基因等因素。[/font][font=宋体] [/font][font=宋体][font=Calibri]6[/font][font=宋体]、基因或者蛋白的大小[/font][/font][font=宋体][font=宋体]一般来说小于[/font][font=Calibri]10kd[/font][font=宋体]和大于[/font][font=Calibri]100kd[/font][font=宋体]的蛋白都是难以表达的。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]7[/font][font=宋体]、外源基因对宿主有毒性[/font][/font][font=宋体]外源基因在宿主内会抑制宿主菌的生长甚至导致宿主死亡,表观的现象:宿主菌在诱导后菌体量上升缓慢或不在生长。[/font][font=宋体] [/font][font=宋体][font=Calibri]8[/font][font=宋体]、基因突变(移筐突变)[/font][/font][font=宋体]碱基的突变、插入或缺失对阅读框的影响,可能会导致表达的蛋白质结构改变,或蛋白质合成过早终止。[/font][font=宋体] [/font][font=宋体][font=Calibri]9[/font][font=宋体]、培养诱导条件[/font][/font][font=宋体][font=宋体]培养基成分([/font][font=Calibri]C/N[/font][font=宋体])及培养条件(温度、诱导时机、诱导剂,浓度、诱导时间)也是影响蛋白表达的。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多关于[url=https://cn.sinobiological.com/resource/protein-review/protein-expression][b]蛋白表达[/b][/url]详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-expression[/font][/font][font=Calibri] [/font]
[font=宋体][font=宋体]无细胞蛋白表达是一种体外重组蛋白质表达技术也称为无细胞蛋白质合成技术([/font][font=Calibri]CFPS[/font][font=宋体]:[/font][font=Calibri]Cell-free protein synthesis[/font][font=宋体]),是指用含有蛋白合成必需的组分(核糖体,转运[/font][font=Calibri]RNA[/font][font=宋体],氨酰合成酶,启动[/font][font=Calibri]/[/font][font=宋体]延伸[/font][font=Calibri]/[/font][font=宋体]终止因子,三磷酸鸟苷,[/font][font=Calibri]ATP[/font][font=宋体],[/font][font=Calibri]Mg2+[/font][font=宋体]和[/font][font=Calibri]K+[/font][font=宋体])的细胞裂解物在体外进行蛋白合成。无细胞蛋白表达技术适用于制备各种类型的蛋白质,包括难表达蛋白质、毒性蛋白质、复杂蛋白质等。在药物研究、生物制造和生命科学等领域中得到广泛关注和应用,无论是研究、开发还是商业化应用过程。目前无细胞蛋白表达主要应用于药物研发领域,例如抗体制备和生物药物生产等。随着人工智能技术的不断发展,无细胞蛋白表达技术可以与人工智能算法结合,构建计算机辅助的高通量生产系统,实现个性化、精准的生物医学治疗。除此之外,还能够应用于其他领域,例如基因工程、环境保护和农业生产等。随着无细胞蛋白表达技术的不断发展和人工智能技术的不断进步,我们可以看到更多的新领域和新应用出现,给生物科技行业带来更多的机遇和挑战。[/font][/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体]相较于传统的活细胞蛋白表达技术,无细胞蛋白表达技术具有以下几个显著的优势:[/font][/b][font=宋体] [/font][font=宋体][font=Calibri]1. [/font][font=宋体]更高的蛋白质表达量:传统的活细胞蛋白表达技术受限于细胞本身的多方面因素,其表达的蛋白质数量往往受到限制。而无细胞蛋白表达技术通过在体外底物浓度高的环境中进行合成反应,不但避免了传统活细胞表达所面临的方方面面的限制,还能够很好地控制反应体系,从而获得表达量更高的蛋白质。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2. [/font][font=宋体]更快的表达速度:传统活细胞蛋白表达需要细胞生长并达到最佳密度才能进行蛋白质表达,这个过程往往需要数天时间。而无细胞蛋白表达技术通常只需要数小时就能够完成蛋白质的表达,这个速度明显快于传统活细胞表达技术。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3. [/font][font=宋体]更精准的蛋白质合成:无细胞蛋白表达技术在体外进行蛋白质合成,能够精确控制底物浓度、反应温度、反应剂比例等参数,因此可以更加精准地合成定制的蛋白质,这对于研究和应用来讲具有重要意义。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4. [/font][font=宋体]更灵活控制:在无细胞蛋白表达技术中,可以使用分离的组分体系进行蛋白质的合成,可以控制底物和反应剂的比例,也可以在适当的反应条件下进行自定义的修饰,如蛋白质标记、药效分析等。这些优点使得无细胞蛋白表达技术更加灵活、可控,适用于更广泛的应用领域。[/font][/font][font=宋体] [/font][b][font=宋体] [/font][font=宋体]无细胞蛋白表达应用[/font][/b][font=宋体] [/font][font=宋体]无细胞蛋白表达技术是一种飞速发展的新型生物技术,具有广阔的应用前景和潜力。该技术可以快速、高效、经济地合成蛋白质,可广泛应用于医疗、制药、农业、生物材料等多个领域。[/font][font=宋体] [/font][font=宋体][font=Calibri]1. [/font][font=宋体]医疗领域:无细胞蛋白表达技术在医疗领域应用广泛,可以用于生产多种蛋白质药品,如单克隆抗体等。其中,单克隆抗体是一种重要的治疗药物,具有高度特异性和亲和力,可用于肿瘤、心血管疾病、自身免疫性疾病等疾病的治疗。传统单克隆抗体生产方法需要花费大量时间和成本,而无细胞蛋白表达技术则可以在短时间内大规模合成单克隆抗体,从而大大缩短生产周期,并且可以降低成本。此外,无细胞蛋白表达技术也可以用于疫苗研发。比如疟疾疫苗研究开发昂贵又耗时,目前利用[/font][font=Calibri]WGE[/font][font=宋体]系统可加速疫苗研发,并建立高通量疟原虫抗体筛查系统。[/font][font=Calibri]Stark[/font][font=宋体]等利用大肠杆菌的便携式冻干裂解物再水化,[/font][font=Calibri]1h[/font][font=宋体]内合成高致病性病原体土拉弗朗西斯菌亚种的生物偶联疫苗,与工程菌生产的疫苗相比,其可引发更高水平的病原体特异性抗体。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2. [/font][font=宋体]制药领域:是无细胞蛋白表达技术的一个重要应用领域。药物开发的成功率取决于药物分子对目标蛋白的亲和力,而目标蛋白对于专一的细胞表达系统和分类的组织或器官非常敏感。通过无细胞蛋白表达技术,研究人员可以在不依赖于细胞的情况下直接生产大量需要的蛋白质,为药物研发提供了更快更便捷的方法。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3. [/font][font=宋体]基础研究领域:利用无细胞蛋白质合成系统可以直接对表达产物进行核磁共振分析,目前已确定了数千个蛋白质的结构。可以通过合成蛋白质建立蛋白质阵列,解开基因产物的功能;应用核糖体展示和 [/font][font=Calibri]mRNA [/font][font=宋体]展示技术,更有利于实现高通量筛选,全面深入研究基因特征和功能。通过无细胞蛋白表达技术可以实现对大型蛋白质的生产和分析,同时也为基础研究打开了新的研究领域。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]目前义翘神州无细胞合成服务正在活动中,活动时间[/font][font=Calibri]2023[/font][font=宋体]年[/font][font=Calibri]10[/font][font=宋体]月[/font][font=Calibri]23[/font][font=宋体]日[/font][font=Calibri]-12[/font][font=宋体]月[/font][font=Calibri]31[/font][font=宋体]日。有需求的可以咨询或者进入义翘神州网进行查看。更多详情可以关注[/font][font=Calibri]https://cn.sinobiological.com/services/cell-free-protein-synthesis-service[/font][/font]
在原核蛋白表达体系中,如E.coli(大肠埃希菌)系统,外源基因通常需要诱导剂的诱导才能进行表达,本文详细讲述了常用诱导剂IPTG 对外源蛋白诱导表达的原理以及实验步骤。
本文引用自发酵《在发酵工艺角度看蛋白表达》引用发酵 的 在发酵工艺角度看蛋白表达在分子生物学角度讲,找到或合成外源蛋白基因,构建质粒,并导入细胞以表达具有生物活性的折叠正确的蛋白,是一种成熟的常规技术。目前,包括酶,抗原,抗体,激素,其他小分子调节蛋白在内的很多蛋白,都已经用这种技术实现了工业化生产。在具体的工艺选择上,历史沿袭习惯和表达体系的选择,对工艺稳定性,成本,有巨大的影响。 目前,常用的蛋白表达系,有3个类别:1,大肠杆菌表达系。大肠杆菌的遗传背景十分清楚,代谢相对简单,发酵副产物少,在不是很严格的情况下,是表达蛋白的首选。通过按经验选择合适的菌株及合适的质粒,既可以以包涵体的形式得到大量的目标蛋白,又可以在细胞外得到可溶性蛋白,是常见的一种表达系。2,酵母菌表达系。用酵母做表达系,理由之一,也是遗传背景清楚,而且,当蛋白分子量过小,不能形成包涵体时,或蛋白的二硫键过多,不易体外复性时,酵母菌就成了合适的选择。另外,酵母对蛋白也会有一个简单的修饰,近似于高等动物的蛋白糖基化过程。这样,在合成在体液中发挥作用的蛋白,而且,又不能(技术水平限制)用动物细胞时,就可以退而求其次的选用酵母菌表达。一般是用信号肽把蛋白导出细胞,在发酵液中以可溶性蛋白的形式存在。这也是一个常见的表达系。3,动物(或说,人的)细胞表达系。这种情况,在纯度或毒性方面有较高要求的产品应用。一般国外产品应用较多,国内还没有用动物细胞表达蛋白实现商业化生产的报道。由于技术限制,国内工业化生产用这个方法目前还有较大难度。这3种表达系,各自有自己的优缺点。首先,在潜在的毒性影像方面讲,由于和真核生物亲缘关系太远,大肠杆菌就最不合适。其次是酵母菌。而在表达量和代谢控制成本上来讲,酵母菌和动物细胞又是差强人意的。现在,很多蛋白习惯性的选用酵母菌做表达系,就是因为早期提取蛋白技术低下,而动物细胞培养技术又不过关的原因所致。目前,虽然提取工艺提高了,但作为蛋白这种高附加值产品,运作成本集中在销售而不是生产,所以,降低生产成本的诉求很低。站在降低开发难度的角度讲,一方面,质粒构建和质粒与菌株的匹配方面依赖大量经验,另一方面,发酵工艺策略选择与发酵工艺优化又需要很大的投入,所以,技术开发部门沿用自己熟悉的,已经积累了大量经验的表达系,是合理的。不过,随着分子技术进一步的发展,分子技术进入低附加值的产品领域又是必然的,降低生产成本就变的越来越必要了。 大肠杆菌表达系有两种得到外源蛋白的方法:1,缓慢的表达,得到可溶性蛋白,这种方法产量和酵母菌表达类似,与酵母菌比,不具有明显的优势,一般是有做大肠杆菌传统的研究机构生产小分子蛋白的一种沿袭性做法。2,使用T7启动子表达蛋白,这样,高速的蛋白表达速率使蛋白来不及折叠,在细胞内形成非水溶性的包涵体。最后目标蛋白可以达到总细胞质量的15%-25%,这样,就为降低成本提供了一种可能。不过,在使用T7启动子表达时,也存在两个难点:1,蛋白的复性技术,如果形成可溶性蛋白,那利用(使用分子技术加载在目标蛋白上)信号肽,只要过一遍柱子就能分离得到纯度非常高的,具有生物活性的产品,而形成包涵体,对提取,复性就有较高的要求,特别是二硫键的存在,会对复性产生很大的影响。在目前国内和国际流行技术看,并不是所有的蛋白都能在预定成本下复性的。2,任何情况下,高产都是代谢网络互相依赖与作用的结果。在如此高的表达量下,甚至细胞的形态都已经发生很大变化,正常代谢受到严重干扰,以至于放大时,摇瓶工艺对发酵工艺几乎没有任何参考价值。发酵工艺策略的选择将直接依赖于工程人员在生化,生理水平对菌株的理解,而匮乏可资参考的数据资料。发酵工艺的优化要离开摇瓶经验在发酵罐上逐步进行,这样,整个发酵工艺的确立就需要比想象中要大得多的人员与时间的投入。另外,再说一下糖基化的问题。在动物细胞内合成的折叠正确的蛋白,在分泌入体液前会有一个糖基化的过程,加上一个糖链就不会很快被蛋白酶当做折叠错误的蛋白水解掉。但是以微生物为表达系表达的蛋白,不具有动物细胞的修饰过程,用大肠杆菌表达的目标蛋白,很快会在血液中被降解。解决或回避这个问题,有两种方法:1,用动物细胞表达,一般,是用癌化的人类细胞。由于动物细胞培养技术要求过高,在国外比较昂贵的医药中有应用,国内不常见。2,由于酵母菌也有一个对蛋白的粗略的修饰过程,可以用酵母菌表达目标蛋白。这个技术,国内国外都在用,可以是一个权宜之计。主要难点集中在对合适菌株的分子水平的改造,以达到尽可能接近满意的修饰效果。这样,就可以在不同目标蛋白上表达系和发酵工艺上做出选择。如果是小分子,无糖基化修饰或不在体液中发挥作用的蛋白,可以选择大肠杆菌和酵母菌表达系,得到可溶性蛋白,然后提取。如果分子量合适,并对生产成本有诉求,而且可以比较方便的复性,则选用大肠杆菌表达系,得到包涵体,然后复性。如果是需要在体液中发挥活性并有糖基化要求的 蛋白,则选用经过分子生物学改造的酵母菌表达系。当然,并不是任何一个实验室都同时拥有或擅长所有的方向的。而难点,往往集中在以下3个方面:1,大肠杆菌蛋白包涵体复性。2,糖基化修饰。3,发酵工艺(工程菌株的工业水平)的确定。做工程一般是理科实验室的弱项,而工科实验室做基础又很少,在把工科和理科结合方面,我们实验室还是有经验和成功先例的。下面,以溶菌酶为例,阐述一下蛋白表达系的选择和工艺的确定。溶菌酶是一类具有种属差异的非特异性免疫物质,在动物界中普遍存在,种类繁多,其实,在植物和微生物中也有发现。但研究最多的还是动物。开发兽用溶菌酶,主要是想作为抗生素的替代物,作为添加剂使用。因此是一个低附加值的产品。下面一切的工作,都会围绕“兽用”和“低附加值”展开。首先,比较几种常见和认为有效的溶菌酶,杀菌效果最好的是人的溶菌酶,但考虑到潜在的危险(具有对人溶菌酶产生抗性,并使抗性基因扩散),舍尔求其次,用了鸟类蛋清溶菌酶,作为表达对象。然后,在得到溶菌酶蛋白的一级结构后,对此进行了分析。此蛋白不会用于体液内,故没有糖链修饰的问题。分子量不是很大,但也不太小,130左右的氨基酸构成,足以形成包涵体,这就为用大肠杆菌表达系高效表达提供了可能。讨厌的是有4个二硫键,其中有两个在结构复杂区域,折叠正确有一定的困难。但是,如果用酵母菌做,可能没法解决成本问题,即便优化工艺现在过去了,也不会是最终版本----肯定会有人用大肠杆菌做。所以,结论就是必须知难而进,拿下复性工艺。另外,由于是低附加值产品,发酵吨位就不能太小。以往分子生物学流行的50升,100升小罐发酵,肯定是不行的。发酵罐的放大,除了溶氧,剪切力发生变化,更重要的是搅拌线速度改变了胞外酶以及包括细胞本身的代谢方式和速度。在胞内体现就是氧化还原电势的改变,这在工艺上会带来很多麻烦。虽然说,一般是放大后产量往往提高,但放大过程中,小罐的经验就不能照搬了。同时,也因为是低附加值产品,发酵过程中诸如质粒丢失等稳定性要求,就很高了,应为只有稳定,才能控制成本。这样,工艺就成了第二个难点。明白这些之后,按照大肠杆菌的喜好,合成了溶菌酶的基因。然后构建质粒,导入细胞。在摇瓶水平表达溶菌酶。在筛选复性条件的同时,就同时在发酵罐水平对工艺稳定性进行了优化。首先,为了进一步提高质粒稳定性,对初始培养基进行了重新设计。并改动发酵工艺策略,由于是胞内产物,我们应用高细胞密度发酵控制法延长限制性生长时间(不能用经典发酵的延长对数期生长时间的办法,对工程菌不适合,会造成质粒丢失,代谢紊乱等一系列问题),提高细胞量,并改变了诱导时机,得到了稳定的高产,具体数据比较枯燥,就不在此展开了。提取方面,经过不懈的努力,我们也掌握了比较成功的复性条件(具体由另外人员负责,也不做详细介绍了)。这样,工艺才基本拼凑好。进一步优化,在试生产多次重复时在进行。以上,是外源蛋白表达的粗略的技术和工艺的过程。
大肠杆菌表达蛋白以可溶和不溶两种形式存在,需要不同的纯化策略。现在,许多蛋白质正在被发现而事先并不知道它们的功能,这些自然需要将蛋白质纯化出来后,进行进一步的研究来获得。分析蛋白质的方法学现已极大的简化和改进。必须承认,表达蛋白纯化比起DNA克隆和操作来是更具有艺术性的,尽管DNA序列具有异乎寻常的多样性(因而它是唯一适合遗传物质的),但它却有标准的物理化学性质,而每一种蛋白质则有它自己的由氨基酸序列决定的物理化学性质(因而它具有执行众多生物学功能的用途)。正是蛋白质间的这些物理性质上的差异使它们得以能进行纯化但这也意味着需要对每一种待纯化的蛋白质研发一套新的方法。所幸的是,尽管存在这种固有的困难,但现已有多种方法可以利用,蛋白质纯化策略也已实际可行。目前,待研究蛋白或酶的基因的获得已是相当普遍的事。可诱导表达系统特别是Studier等发展的以噬菌体T7RNA聚合酶为基础的表达系统的出现使人们能近乎常规地获得过表达(overexpression),表达水平可达细胞蛋白的2%以上,有些甚至高达50%.(一)试剂准备采用T7· Tag Affinity Purification Kit1. T7·Tag抗体琼脂。2. B/W缓冲液:4.29mM Na2HPO4,1.47 mM KH2PO4,2.7 mM KCl,3. 0.137mM NaCl,1%吐温-20,pH7.3。4. 洗脱缓冲液: 0.1M柠檬酸,pH2.2。5. 中和缓冲液:2M Tris,pH10.4.6. PEG 20000.(二)操作步骤1.100ml 含重组表达质粒的菌体诱导后,离心5000g×5min,弃上清,收获菌体,用10ml预冷的B/W缓冲液重悬。2. 重悬液于冰上超声处理,直至样品不再粘稠,4℃离心 14000g×30min,取上清液,0.45μm膜抽滤后作为样品液。3. 将结合T7·Tag抗体的琼脂充分悬起,平衡至室温,装入层析柱中。4. B/W缓冲液平衡后样品液过柱。5. 10ml B/W缓冲液过柱,洗去未结合蛋白。6. 用5ml洗脱缓冲液过柱,每次1ml,洗脱液用含150μl中和缓冲液的离心管收集,混匀后置于冰上,直接SDS-PAGE分析。7. 将洗脱下来的蛋白放入透析袋中,双蒸水透析24hr,中间换液数次。8. 用PEG 20000浓缩蛋白。(三)注意事项蛋白在过层析柱前,要0.45μm膜抽滤,否则几次纯化后,柱子中会有不溶物。
[font=宋体]在分子生物学和生物工程领域,蛋白表达载体构建是至关重要的技术之一,它涉及到将目的基因插入到适当的表达载体中,以便在宿主细胞内进行蛋白表达。这一过程不仅有助于研究基因的功能和蛋白质的结构,还为药物开发、基因治疗等领域提供了有力支持。本文将详细介绍蛋白表达载体构建的整个流程,包括目的基因的选择、载体的选择与改造、基因插入、转化、筛选与鉴定等关键步骤。[/font][font=宋体] [/font][b][font=宋体]蛋白表达载体构建流程:[/font][/b][font=宋体] [/font][font=宋体][font=宋体]①[/font][font=Calibri]NCBI[/font][font=宋体]查找目的基因的[/font][font=Calibri]CDS[/font][font=宋体]序列[/font][/font][font=宋体][font=宋体]进入[/font][font=Calibri]NCBI[/font][font=宋体](美国国家生物技术信息中心)的网站。[/font][/font][font=宋体]在搜索框中输入目的基因的名称或关键词。[/font][font=宋体][font=宋体]在搜索结果中找到[/font][font=Calibri]CDS[/font][font=宋体]([/font][font=Calibri]Coding Sequence[/font][font=宋体])序列,通常会显示基因的[/font][font=Calibri]DNA[/font][font=宋体]序列。[/font][/font][font=宋体][font=宋体]记录或复制所需的[/font][font=Calibri]CDS[/font][font=宋体]序列信息。[/font][/font][font=宋体] [/font][font=宋体]②选择合适的表达载体[/font][font=宋体]根据目的基因的性质和所需的表达水平,选择适合的表达载体。[/font][font=宋体]考虑载体的克隆容量、复制子类型、筛选标记等。[/font][font=宋体] [/font][font=宋体]③确定双酶切位点[/font][font=宋体]根据目的基因和载体,选择合适的双酶切位点。[/font][font=宋体][font=宋体]确保酶切位点在[/font][font=Calibri]CDS[/font][font=宋体]序列和载体上都是独特的,避免切割其他部位。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]④[/font][font=Calibri]Primer 5[/font][font=宋体]预测目的序列酶切位点[/font][/font][font=宋体][font=宋体]使用[/font][font=Calibri]Primer 5[/font][font=宋体]或其他相关软件,根据已知的[/font][font=Calibri]CDS[/font][font=宋体]序列设计酶切位点的引物。[/font][/font][font=宋体]通过软件预测引物的特异性,确保它们仅与目的基因结合。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]⑤双酶切[/font][font=Calibri]buffer[/font][/font][font=宋体][font=宋体]根据选择的酶,准备相应的酶切[/font][font=Calibri]buffer[/font][font=宋体]。[/font][/font][font=宋体][font=宋体]注意[/font][font=Calibri]buffer[/font][font=宋体]的[/font][font=Calibri]pH[/font][font=宋体]值和离子浓度,确保酶的活性。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]⑥目的基因[/font][font=Calibri]CDS[/font][font=宋体]序列引物设计[/font][/font][font=宋体][font=宋体]根据[/font][font=Calibri]CDS[/font][font=宋体]序列,设计一对引物用于[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]扩增目的基因。[/font][/font][font=宋体]确保引物的特异性,避免与其他基因序列发生非特异性结合。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体]⑦转化[/font][font=宋体][font=宋体]制备感受态细胞,使其处于易于接受外源[/font][font=Calibri]DNA[/font][font=宋体]的状态。[/font][/font][font=宋体][font=宋体]将[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]扩增得到的目的基因与载体混合,进行转化反应。[/font][/font][font=宋体]将转化后的细菌在选择培养基上培养,筛选含有重组载体的阳性克隆。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体]⑧双酶切及鉴定[/font][font=宋体][font=宋体]提取阳性克隆的质粒[/font][font=Calibri]DNA[/font][font=宋体]。[/font][/font][font=宋体]使用设计的引物进行双酶切反应。[/font][font=宋体]对酶切产物进行电泳分析,观察是否获得预期的片段,并进行凝胶回收。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体]⑨测序[/font][font=宋体]将回收的酶切产物进行序列测定。[/font][font=宋体][font=宋体]对比测序结果与目的基因的[/font][font=Calibri]CDS[/font][font=宋体]序列,确保没有突变或错误。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体]⑩阳性菌落扩大培养,用于后期蛋白纯化研究[/font][font=宋体] [/font][font=宋体]选择测序正确的阳性菌落进行扩大培养。[/font][font=宋体]在摇瓶或发酵罐中进行高密度培养,为后续的蛋白表达提供充足的原料。[/font][font=宋体]在确定目的基因在载体上正确表达后,可以进行蛋白纯化研究。[/font][font=宋体]通过适当的纯化技术,如亲和层析、离子交换等,分离和纯化目的蛋白。[/font][font=宋体]对纯化的蛋白进行质量分析和功能研究。[/font][font=宋体] [/font][font=宋体][font=宋体]综上所述,蛋白表达载体构建是一个系统性的过程,涉及到多个关键步骤和复杂的技术操作。通过遵循这一流程,研究人员能够成功地在宿主细胞内表达所需蛋白,并进一步对其进行分析和功能研究。随着生物技术的不断发展,蛋白表达载体构建的应用领域将越来越广泛,为人类对生命现象的深入理解和疾病的防治提供更多可能性。因此,不断优化和完善这一技术对于生命科学领域的发展至关重要。更多[url=https://cn.sinobiological.com/resource/protein-review/protein-production][b]蛋白表达生产[/b][/url]详情可以关注[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-production[/font][/font]
pET系统是有史以来在 E.coli中克隆表达重组蛋白的功能最强大的系统。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=113071]pET系统[/url]
很多朋友问这样一个问题:为什么毕赤酵母表达困难?他们自己也很纳闷,重组酵母pcr检测也证明目的基因重组了,但是诱导之后就是在表达上清中检测不到目的蛋白,仔细研究操作手册后仍然不知道原因。本人,根据自己的经验,采用倒推的方法,按实验过程从后向前分析,供大家参考:1、诱导之后表达上清中检测不到目的蛋白:分析1:检测的方法是否有问题,要考虑是不是蛋白表达量低而没有检测到? 如果是蛋白表达低,可以选择浓缩蛋白,具体的方法很多,有TCA、丙酮、浓缩柱等等方法,之前在本版已经发过帖,在此不赘述。 2、如果蛋白浓缩N倍之后仍然检测不到,那基本可以确证蛋白并不在上清中。那么蛋白到哪里去了,考虑是否没有分泌出来,而是在胞内,那就需要通过裂解酵母来检 测胞内蛋白,具体的方法很多,在此也不赘述,曾整理过相关破碎的帖子。 3、如果胞内也没有目的蛋白表达,那么基本可以确定蛋白并没有表达。 4、为什么没有表达呢?倒推回来就是诱导的过程了,诱导体系是什么?甲醇浓度是多少?培养问题是多少,转速是多少?这些都要注意。甲醇一般是0.5%-1.0%,本人用的 是0.5%,也有很多人也用1.0%,曾见过一个帖子,说超过1.5%反而会抑制表达,没有验证过,供大家参考。培养问题28-30度比较合适,转速250rpm比较合适,诱导 体系没有固定的体系,说明书上推荐的是BMGY到OD600 2~6,换到BMMY中OD600 为1左右。 5、如果诱导的过程也没有问题,那问题就复杂了,特别是重组酵母PCR检测证明目的基因确实已经发生了重组。这个时候是最郁闷的了,但是郁闷怎么办,还是要找原 因,在此我给的建议是先做RT-PCR证明mRNA水平的情况,也就是说有没有转录。如果转录了,后续的操作也没有问题(本帖的1、2、3、4项),那么只有重新设计实 验,比如换酵母株,有文章上说:用GS115表达不出蛋白,换KM71H后,大部分克隆能表达。 6、有个帖子说的很好,在此和大家分享一下。 1、 菌株:用GS115表达不出蛋白,换KM71H后,大部分克隆能表达。 2、温度: 在28度和室温下诱导表达,表达水平可能都不低。 3、pH:手册上用6.0,pH提高到6.8,不表达的蛋白可能就表达出来。BMMY的pH7.0-7.5比较合适。国内外做的最好的rHSA,最适pH大概5-6左右。pH3的时 候yeast和peptone好像会沉淀的,可以用磷酸和磷酸二氢钾调,具体比例自己去试试。 4、偏爱密码子: codon bias一般不是主要的问题,你要表达的蛋白特性才是主要问题,酵母对分子量大(30KD以上),结构复杂(如一些蛋白酶),二硫键含量多的 蛋白往往不能有效表达,尤其是分泌表达。密码子改造对一些较小的而且结构简单的蛋白表达量的提高可能有一些作用。比如一位战友用Pichia酵母表达一个单链 抗体,29KD,含有2对二硫键,表达量约几毫克每升,选用酵母偏好密码子全基因合成后,表达量没有什么提高。 5、表达时间与空质粒转化对照:诱导时间长了以后,是会有很多蛋白分泌出来的,时间越长杂蛋白就越多,且分子量都比较大。最好做一个空质粒转化的对照, 这样就会比较肯定到底是不是自身的蛋白分泌的结果。 6、污染:每个样品从G418板上挑10个左右单克隆于2ml BMGY摇菌(30ml玻璃管,比LB管大一点),纱布一般用8层,一天左右看着比较浑离心,留样1ml,余 1ml换2ml BMMY诱导表达,3,4层纱布足够了。 污染一般都是跟瓶口覆盖有关的原因造成的,只盖纱布肯定会污染。加盖报纸后,就再没遇到过污染。如果只用6层纱布,污染的可能当然很大,100ml三角瓶, 装量10ml培养液,用橡筋把8层纱布和2层报纸拴紧封口,空气浴摇床。 7、不表达:蛋白有没有表达就要看你的运气了,一般重复2-3次实验都没有表达菌株,这个蛋白就放弃表达了。 8、表达量: 30KD,10mg/L表达量已经很高,最直接的方法是发酵,一般提高5-10倍。大肠杆菌一样出现大团的超表达蛋白。 9、糖基化:酵母分泌表达的N糖基化是可以预测的,有如下序列:N X S/T就是潜在的糖基化位点,X为任意氨基酸,1个糖基化位点会加上1-3KD左右的糖基。另外可 能还有O糖基化话,但是无法预测其位点,不过很少听说表达蛋白有O糖基化的。如果胞内表达,不存在糖基化的问题。 10、表型与表达:重组SalI和BglII酶切产生单交换和双交换,结果就是产生Mut+和Muts表型的菌株;前者在甲醇诱导表达时生长快,消耗的甲醇多,后者生长慢,消耗 的甲醇少,所以诱导表达时Muts表型要求更高的菌体浓度。一般用Mut+表型的较多,但是对某些蛋白Muts菌株可能表达的更好,只有试试才知道你的蛋白用那种菌 株表达较好。 11、培养基 YPD:最基本的培养用;BMGY:诱导表达前培养用;BMMY:诱导表达用;MD:电转化后筛选his+用。 YEPD是不能代替BMGY的,因为有葡萄糖,这样残留的葡萄糖会影响下一步的诱导表达。不过有一种方法是可行的,就是用YPG培养基代替,只是把YEPD中的葡萄糖 用3%的甘油代替,也可以降低成本。摇瓶毕竟不能和发酵罐比,甘油残余会抑制甲醇利用。 BMGY、BMMY灭菌后才能加甲醇、磷酸钾、生物素。配制BMMY时也没必要用5%过滤除菌的甲醇,在灭菌后使用前加100%甲醇至你要的浓度。 YNB可以高压灭菌,没问题的,也可以0.22um过滤处理,天冬氨酸和苏氨酸要待培养基高压灭菌后加入;配YPD时可以加入YPD一起灭菌,但时间不能太长,温度不能 太高,一般121-125度12-15分钟足够了。若时间过长,温度过高,可能导致YPD焦化。glucose和含氮化合物在一起容易产生美拉德反应,这是配制培养基中的禁忌。 颜色很深的话,基本不能使用了。或者含有葡萄糖和/或YNB的培养基108度35min高压灭菌。 小量发酵其实可以把培养基成分中的YNB和生物素去除,培养基价格便宜,操作又方便,可以直接灭菌,效果也很好(效果不比含YNB的差)。 如果是用自己配置的培养基,如玉米浸提液、麦芽浸提液、麦麸浸提液等等,可以不用换液,采取添料来维持酵母对培养基的营养需要。 用无机盐进行大规模发酵,更省钱。更多有关蛋白表达纯化的相关资料,请点击:资料专区
70kDa)中的七个得到了可溶性表达,而其它的融合标签(GST,MBP和hexahistidine)系统则只得到了四个可溶性表达的蛋白。表1. 用大量的目标蛋白评估NusA标签对提高融合蛋白可溶性的作用参考文献a目的蛋白数目目的插入序列种属目标蛋白大小范围NusA融合蛋白可溶性比例Shih等(2002)40酵母,哺乳动物,植物,昆虫9-10060Korf等(2005)75人6-12760bKohl等(2008)96人1-11844ca. Korf等和Kohl等的研究中包含了六组氨酸标签。b. 可溶性蛋白量大于等于10%即认为该融合蛋白可溶。c. 纯化后的融合蛋白如果在SDS-PAGE后考染在合适位置出现条带即认为可溶。Korf等的还发现对于定位于真核细胞细胞器,质膜或者骨架的蛋白,相对于其它标签系统来讲,NusA标签是最好的可溶性表达的选择。Kohl等(2008)也发现只要在20-25℃诱导表达,NusA标签能够大大提高难表达的蛋白比如膜蛋白的可溶性。与Korf等的研究结果一致,Kohl等也发现25℃诱导表达比30℃或37℃诱导表达可以纯化得到更多的NusA融合蛋白。切除NusA标签获得后保持活性且正确折叠的蛋白表2总结了16个采用NusA标签成功获得可溶性蛋白,在切除标签后这些蛋白仍有正确折叠结构和活性。大部分这种研究是是关于分子量小于或接近20kDa的目标蛋白。纯化后的目标蛋白产量范围在1.5-100mg/L。趋化因子和细胞因子可以得到高达30-100mg/L的产量。其它关于这些蛋白表达和纯化的有参考价值信息包括:■ 植物磷酸烯醇式丙酮酸—羧化酶激酶(Ermolova 2003)——目标蛋白切除标签后用BDA(蓝色葡聚糖)亲和层析树脂纯化。纯化后蛋白的催化活性比未切除标签的融合蛋白高50倍。■ Xklp3a,Tep3Ag和E8R(De Marco 2004)——用蛋白酶切割后,His-融合的TEV和NusA被Ni2+离子亲和色谱选择性去除。与Ni2+亲和结合的标签被紧密地结合在树脂上,在流出液中则可以得到纯化的目的蛋白。所有这三种蛋白在纯化后都正确折叠且均一分散在溶液中。纯化的膜结合蛋白E8R牛痘病毒蛋白在Tris缓冲液中除去NusA后出现了沉淀,然而加入0.02%的月桂酰基麦芽糖苷和150mM的氯化钠后,蛋白又重新变得可溶。■ 环麦芽糖糊精酶(Turner 2005)——这个蛋白属于α-淀粉酶家族。这个家族的蛋白通常在大肠杆菌中很难以活性形式表达出来。将其与肠激酶混合孵育24小时以上会使其活性逐渐增强,直到达到未经肠激酶处理过的融合蛋白的2倍以上,这也说明标签的存在降低了该酶的活性。可以用固化了Cu2+的亲和层析柱去除切除的融合标签。■ 八种人趋化因子(Magis-trelli 2005)——所有的蛋白都在OrigamiTM B菌株中表达提高它们在胞质中的二硫键形成率。在趋化因子编码序列的C端引入了AviTMTag(亲和素)生物素化序列。切割后的细胞趋化因子可以用单体的亲和素树脂亲和层析与切割下的NusA标签和蛋白酶混合物分离开。所有切割纯化后的蛋白在细胞趋化实验中都显示了活性,而没有一个融合蛋白有这样的活性。■ 蚯蚓血红蛋白(Karlsen 2005)——酶切后,用分子筛分离纯化蚯蚓血红蛋白,纯化后的蛋白通过圆二色谱检测得到的α-螺旋结构与模型预期结果一致,且纯化后的蛋白可以以单体的形式稳定保存。■ 人白介素-29(Li 2006)——用S-蛋白亲和层析比Ni2+亲和层析可以得到更纯的目的蛋白。将融合蛋白N端的NusA/His•Tag®/S•Tag™标签切掉后,用链亲和素琼脂去除生物素标记的凝血酶。用水疱性口膜炎病毒(VSV)处理固定的人羊膜上皮细胞(WISH 细胞)后,通过检测纯化的IL-29对细胞的保护效应来检测其抗病毒活性。■ 人干扰素-λ2(Li 2007)——酶切后,用Novagen提供的EKaptureTM琼脂除去重组的肠激酶。先用纯化后的干扰素-λ2处理WISH细胞,24小时后加入VSV病毒,可以观察到干扰素-λ2可以有效地保护细胞免于病毒介导的病变。表2. 切除NusA标签获得后保持活性且正确折叠的蛋白参考文献目的蛋白目的蛋白分子量(kDa)切割用蛋白酶融合蛋白亲和层析固定介质纯化后目的蛋白产量(mg/L)Ermolova等(2003)植物磷酸烯醇式丙酮酸羧化酶激酶32凝血酶Ni2+1.5De Marco等(2004)Xklp3ATep3AgE8R15NRa32bTEV酶TEV酶TEV酶Ni2+5.02.54.0Turner等(2005)环麦芽糖糊精酶69肠激酶Cu2+1.6Magistrelli等(2005)八种人趋化因子8-21Xa因子Ni2+30-100Karlsen等(2005)蚯蚓血红蛋白15TEV酶Ni2+NRaLi和He(2006)人白介素-2920凝血酶S-蛋白60Li和Huang(2007)人干扰素-λ220肠激酶Ni2+65a. 未报道b. 根据NCBI报道预测的全长蛋白分子量与NusA标签融合且具有活性的蛋白 与这些切除NusA标签后保持活性且正确折叠的蛋白不同,还有很多报道指出目的蛋白在“NusA-目的蛋白”的融合形式时具有很好的活性。比如单链(ScFv)催化活性抗体14D9(Zheng 2003),来自Aequorea victoria的绿色荧光蛋白(Nallamsetty 2006),人二氢叶酸还原酶(Nallamsetty 2006),来自Ensis directus蛏子的精氨酸酶激酶(Compaan 2003),来自B. thuringiensis的修饰δ-内毒素(Kumar 2005),人BCMA跨膜受体(Guan 2006),植物α-双加氧酶1(Liu 2006),以及来自Plasmodium falciparum的b-ketoacyl-acyl载体蛋白合成酶(Lack 2006)等,反映了各种不同背景的蛋白都显示出了与NusA标签融合后的活性。NusA标签提高蛋白可溶性的可能机制 Houry(1999)等揭示NusA蛋白是分子伴侣GroEL在体内的必须底物。而GroEL与其共作用因子GroES是大肠杆菌唯一的在所有生长条件下必需的分子伴侣系统。Douette等(2005)研究了融合蛋白NusA-UCP1(uncoupling protein 1)的可溶产量。UCP1是一种线粒体膜蛋白。这些作者发现16℃培养时,当GroEL共过表达的情况下,融合蛋白的可溶性有更大的提高。这个结果也表明NusA与分子伴侣途径相作用,从而阻止参与蛋白的聚集。总结 已有充分的证据证明NusA标签系统能显著提高多种不同来源蛋白的可溶性表达,而这些蛋白在单独表达时往往形成不可溶的包涵体。在一些研究报告中,用蛋白酶切除NusA标签能使目的蛋白仍保持正确折叠和生物学活性;相反,在另外许多报道中也指出当目的蛋白与NusA融合而非切除时,融合蛋白也同样具有活性。NusA标签系统的成功至少部分地是由于其与大肠杆菌分子伴侣系统相互作用的结果。
[font=宋体][font=宋体]义翘神州具有每年[/font][font=Calibri]1,000[/font][font=宋体]多种新蛋白的研发能力,依托先进的蛋白表达技术,在重组蛋白生产如跨膜蛋白、酶、激酶、病毒抗原等积累了丰富的经验。我们拥有多种重组蛋白表达系统,包括昆虫细胞、哺乳动物细胞和原核蛋白表达系统,为客户提供高品质、低成本的活性重组蛋白,满足您的不同需求。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供从基因合成、载体构建到蛋白质表达、纯化的一站式服务,可以根据客户需求,选用不同表达[/font][font=Calibri]/[/font][font=宋体]纯化标签、表达宿主等,真正为客户实现深度私人定制。多种纯化体系,为蛋白表达、纯化提供多种选择,帮助客户最大限度提高研究项目的成功率。‘’[/font][/font][font=宋体] [/font][font=宋体][b]重组蛋白表达服务的类型:[/b][/font][font=宋体] [/font][font=宋体][font=宋体]一、[/font][font=Calibri]VLP[/font][font=宋体]形式的膜蛋白表达服务[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州利用[/font][font=Calibri]HEK293[/font][font=宋体]表达系统构建了[/font][font=Calibri]VLP[/font][font=宋体]技术平台,为客户提供膜蛋白定制服务,助力药物研发。[/font][/font][font=宋体] [/font][font=宋体]优势:[/font][font=宋体]? 活性优,哺乳动物细胞表达,更接近真实构象[/font][font=宋体][font=宋体]? 多应用,免疫、[/font][font=Calibri]ELISA[/font][font=宋体]、[/font][font=Calibri]SPR/BLI[/font][font=宋体]、[/font][font=Calibri]PK/PD[/font][font=宋体]等[/font][/font][font=宋体] [/font][font=宋体]二、哺乳动物细胞瞬时表达服务[/font][font=宋体]义翘神州的哺乳动物瞬时表达系统提供灵活的定制服务,满足多样化需求。[/font][font=宋体] [/font][font=宋体]优势:[/font][font=宋体]? 高效表达载体[/font][font=宋体]? 高密度细胞培养[/font][font=宋体] [/font][font=宋体][font=宋体]三、杆状病毒[/font][font=Calibri]-[/font][font=宋体]昆虫细胞蛋白表达服务[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州在杆状病毒[/font][font=Calibri]-[/font][font=宋体]昆虫细胞蛋白表达方面具有丰富的经验,特别是病毒类蛋白、激酶等。[/font][/font][font=宋体] [/font][font=宋体]优势:[/font][font=宋体]? 高效表达胞内和胞外蛋白[/font][font=宋体]? 大规模蛋白表达生产能力[/font][font=宋体] [/font][font=宋体][font=宋体]四、原核([/font][font=Calibri]E.coil[/font][font=宋体])蛋白表达服务[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州[/font][font=宋体]“一站式”服务以及内毒素去除等附加服务,以满足不同的定制需求。[/font][/font][font=宋体] [/font][font=宋体]优势:[/font][font=宋体]? 多种表达载体和菌株[/font][font=宋体]? 丰富的包涵体纯化经验[/font][font=宋体] [/font][font=宋体]五、生产用稳定株构建服务[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供优质稳定细胞株构建服务,满足客户蛋白[/font][font=Calibri]/[/font][font=宋体]抗体生产、免疫治疗药物开发等诸多需求。[/font][/font][font=宋体] [/font][font=宋体]优势:[/font][font=宋体][font=宋体]? 稳定细胞株抗体产量可达[/font][font=Calibri]2-4 g/L[/font][/font][font=宋体][font=宋体]? 团队重组表达经验[/font][font=Calibri]15[/font][font=宋体]年以上[/font][/font][font=宋体] [/font][font=宋体]六、检测用细胞系构建服务[/font][font=宋体] [/font][font=宋体]义翘神州提供稳定表达特定基因的细胞株构建服务,可应用于多种研究领域。[/font][font=宋体] [/font][font=宋体]优势:[/font][font=宋体]? 快速交付,经验丰富[/font][font=宋体]? 应用场景广泛,满足多样化实验需求[/font][font=宋体] [/font][font=宋体]选择哪种[url=https://cn.sinobiological.com/services/recombinant-protein-expression-service][b]蛋白表达服务[/b][/url]取决于目的蛋白的来源、蛋白功能、产率、成本和纯化蛋白的用途等诸多因素,每个系统都有其优缺点,根据不同应用选择合适的表达系统对重组蛋白非常重要。下面是重组蛋白表达服务选择指南:[img=重组蛋白表达服务选择指南,690,198]https://ng1.17img.cn/bbsfiles/images/2023/11/202311031655095289_8336_5907840_3.png!w690x198.jpg[/img][/font][font=宋体][font=宋体]更多关于重组蛋白表达服务详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/recombinant-protein-expression-service[/font][/font][font=Calibri] [/font]
[font=宋体][b][font=宋体]抗绿色荧光蛋白[/font][font=Calibri](GFP)[/font][font=宋体]抗体,小鼠单克隆[/font][/b][/font][font=宋体] [/font][font=宋体][font=Calibri]GFP[/font][font=宋体]([/font][font=Calibri]Green fluorescent protein[/font][font=宋体],绿色荧光蛋白)标签含有 [/font][font=Calibri]238 [/font][font=宋体]个氨基酸,分子量约为 [/font][font=Calibri]26.9 KDa[/font][font=宋体],最先是 [/font][font=Calibri]1962 [/font][font=宋体]年下村修等在维多利亚多管发光水母([/font][font=Calibri]Aequorea victoria[/font][font=宋体])中发现的。[/font][font=Calibri]GFP [/font][font=宋体]标签在紫外线的照射下会发出绿色的荧光,而且与靶蛋白融合后不会显著地影响天然蛋白质的组装和功能。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]凭借[/font] [font=Calibri]10 [/font][font=宋体]多年在蛋白表达和抗体制备领域的技术积淀,义翘神州自主研发了多款抗 [/font][font=Calibri]GFP [/font][font=宋体]标签抗体。高品质的抗 [/font][font=Calibri]GFP [/font][font=宋体]标签抗体可用于检测 [/font][font=Calibri]GFP[/font][font=宋体](绿色荧光蛋白),满足多种应用的需求,包括蛋白印迹([/font][font=Calibri]WB[/font][font=宋体])、[/font][font=Calibri]ELISA [/font][font=宋体]或免疫沉淀([/font][font=Calibri]IP[/font][font=宋体])。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]特异性:单克隆抗绿色荧光蛋白([/font][font=Calibri]GFP[/font][font=宋体])识别[/font][font=Calibri]N[/font][font=宋体]末端和[/font][font=Calibri]C[/font][font=宋体]末端[/font][font=Calibri]GFP[/font][font=宋体]([/font][font=Calibri]27 kDa[/font][font=宋体])标记的融合蛋白。抗体与原核表达载体表达的融合蛋白反应。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]免疫原:[/font][font=Calibri]GFP[/font][font=宋体]标记的融合蛋白[/font][/font][font=宋体] [/font][font=宋体][font=宋体]生化[/font][font=Calibri]/[/font][font=宋体]生理作用:[/font][font=Calibri]GFP ([/font][font=宋体]绿色荧光蛋白[/font][font=Calibri])[/font][font=宋体]是一种用于检查基因表达和蛋白定位的报告分子。[/font][font=Calibri]GFP [/font][font=宋体]用紫外线[/font][font=Calibri]/[/font][font=宋体]蓝光激发时会发出绿光。[/font][font=Calibri]GFP [/font][font=宋体]荧光保持稳定,可在活细胞中进行无创检测。[/font][font=Calibri]GFP [/font][font=宋体]被认为是监测几种活细胞或生物体动态过程的工具。当在真核细胞或原核细胞中表达并被蓝光或紫外光照射时,[/font][font=Calibri]GFP [/font][font=宋体]产生明亮的绿色荧光。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]外形:[/font][font=Calibri]0.01 M [/font][font=宋体]磷酸盐缓冲液 [/font][font=Calibri](pH 7.4)[/font][font=宋体],含 [/font][font=Calibri]15 mM [/font][font=宋体]叠氮化钠[/font][/font][font=宋体] [/font][font=宋体][font=宋体]储存及稳定性:如需连续使用,请在[/font][font=Calibri]2-8[/font][font=宋体]°[/font][font=Calibri]C[/font][font=宋体]下储存,最长一个月。若需延长储存时间,可将溶液分装并冷冻。不建议反复冻融。如果长期储存时出现轻微浑浊,请在使用前通过离心澄清溶液。若工作稀释样品在[/font][font=Calibri]12[/font][font=宋体]小时内未使用完,则应丢弃。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]该如何选择表达克隆的标签[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、首先,需要确定融合标签的目的[/font][/font][font=宋体] [/font][font=宋体][font=宋体]蛋白纯化[/font] [font=宋体]:标签的普遍用途是蛋白纯化。小分子[/font][font=Calibri]6XHis Tag[/font][font=宋体]常被用于细胞内源蛋白的纯化。[/font][font=Calibri]6XHis Tag[/font][font=宋体]也广泛应用于大肠杆菌的蛋白纯化。可是哺乳动物细胞中因非分泌蛋白自身存在高组氨酸背景,因此极少使用[/font][font=Calibri]6XHis Tag[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Western Blot[/font][font=宋体]检测:若需要做[/font][font=Calibri]Western Blot[/font][font=宋体]实验来检测细胞裂解物中蛋白的表达,你可以选择有匹配的抗体的小分子标签。[/font][font=Calibri]FLAG Tag[/font][font=宋体]以其分子量小以及拥有许多与之匹配的商业化的抗体等优势,成为[/font][font=Calibri]Western Blot[/font][font=宋体]实验中常用的[/font][font=Calibri]Tag[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]免疫沉淀反应:[/font][font=Calibri]FLAG Tag[/font][font=宋体]其分子量小以及拥有大量相匹配的商业用抗体等优势成为免疫沉淀反应中最常用的[/font][font=Calibri]Tag. [/font][font=宋体]其他常用的标签有:[/font][font=Calibri]HA[/font][font=宋体]和[/font][font=Calibri]cMyc.[/font][/font][font=宋体] [/font][font=宋体][font=宋体]免疫共沉淀。首先,裂解您的样本,以释放蛋白。向试管中添加裂解液的同时,加入靶向融合标签的抗体,抗体会识别融合标签。然后抗体与蛋白[/font] [font=Calibri]A [/font][font=宋体]或 [/font][font=Calibri]G [/font][font=宋体]偶联微珠结合,后者拉出您的目标蛋白,以及与之复合的其他蛋白。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]活细胞成像:荧光蛋白([/font][font=Calibri]Fluorescent Proteins, FPs[/font][font=宋体])是活细胞成像常用的标记蛋白。其中最常用的是绿色荧光蛋白([/font][font=Calibri]GFP[/font][font=宋体])和它的衍生物([/font][font=Calibri]CFP, YFP, etc.[/font][font=宋体]),以及一些红色变体,如[/font][font=Calibri]dTomato[/font][font=宋体]和[/font][font=Calibri]mCherry.[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、考虑融合标签的影响[/font][/font][font=宋体] [/font][font=宋体]任何一类标签处于氨基酸序列的任一位置,都具有影响目的蛋白表达或功能的可能性。最主要原因是标签可能会干扰蛋白的正确折叠,致使目的蛋白失活或形成包涵体。其次,标签可能会中断亚细胞定位信号,这种情况下,蛋白能够正确翻译和折叠,但在细胞内所处的位置是错误的。因此,您需要知道添加的标签对目的蛋白的表达是否有影响。[/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、考虑是在[/font][font=Calibri]N-[/font][font=宋体]端还是[/font][font=Calibri]C-[/font][font=宋体]端标记[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]N-[/font][font=宋体]端或[/font][font=Calibri]C-[/font][font=宋体]端标记的选择还需要根据蛋白结构、定位等特性。然而,倘若你没有确切的蛋白结构,或蛋白功能域图谱,建议分别构建[/font][font=Calibri]N-[/font][font=宋体]端标记和[/font][font=Calibri]C-[/font][font=宋体]端标记的表达克隆,以检测哪个更有效。[/font][/font][font=宋体] [/font][font=宋体][url=https://cn.sinobiological.com/services/recombinant-protein-expression-service][b]重组蛋白表达技术[/b][/url]现已在生物学各个具体领域应用广泛,尤其是蛋白质的大规模生产和体内功能研究都需要应用重组蛋白表达载体。[/font][font=宋体] [/font][font=宋体][font=宋体]更多[url=https://cn.sinobiological.com/resource/protein-review/protein-tag][b]蛋白标签[/b][/url]详情可以关注义翘神州:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-tag[/font][/font]
[b][font=宋体]前言[/font][/b][font=宋体]在当今的生物技术领域,高通量重组蛋白表达技术在基础研究和商业应用中扮演着非常重要的角色。随着后基因组时代的到来,研究人员对大规模蛋白表达和纯化的需求日益增长,大肠杆菌因其易于遗传操作、低成本、生长迅速成为生产重组蛋白的首选微生物宿主。本文将综述大肠杆菌中高通量重组蛋白表达的现状和未来展望,探讨从目的基因获取到蛋白表达和纯化的先进技术,并讨论如何克服[/font][url=https://cn.sinobiological.com/resource/protein-review/protein-expression][u][font=宋体][color=#0000ff]重组蛋白表达[/color][/font][/u][/url][font=宋体]过程中的挑战。[/font][font=Calibri] [/font][b][font=宋体]高通量重组蛋白表达技术[/font][/b][font=宋体][font=宋体]高通量研究是一种能够同时检测数千个生物分子,使大规模重复成为可能的研究。[/font][font=Calibri]20[/font][font=宋体]世纪[/font][font=Calibri]90[/font][font=宋体]年代初,第一台[/font][font=Calibri]DNA[/font][font=宋体]测序仪被开发出来,人类基因组计划随之开启,高通量技术在[/font][font=Calibri]DNA[/font][font=宋体]、[/font][font=Calibri]RNA[/font][font=宋体]、蛋白质、脂质和代谢物检测的需求也急剧增加。自该技术提出以来,大肠杆菌中高通量重组蛋白表达和纯化已经得到了广泛的应用。[/font][/font][font=Calibri] [/font][font=Calibri]1. [/font][b][font=宋体]目的基因的制备[/font][/b][font=宋体][font=宋体]获取目的基因是重组蛋白表达的第一步。传统的方法是从[/font][font=Calibri]cDNA[/font][font=宋体]文库中直接克隆基因,但这种方法存在局限性,如从库中筛选基因较为费时以及难以添加融合标签等。高通量[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]技术是目前获取目的基因最常用的技术,设计引物并调整好参数后,即可在[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]仪中自动完成目的基因的制备。[/font][/font][font=Calibri] [/font][font=Calibri] [/font][font=Calibri]2. [/font][b][font=宋体]表达载体的高通量构建[/font][/b][font=宋体][font=宋体]研究人员开发了多种构建表达载体的克隆方法,包括基于限制性内切酶的克隆、重组克隆和不依赖于连接反应的克隆等。这些方法各有优势和局限性,但在近年来都有显著改进。例如,基于限制性内切酶的克隆因其简单、高效、通用和成本效益而备受关注。一个理想的大肠杆菌表达载体应具备选择标记、复制起点、转录启动子、[/font][font=Calibri]5'[/font][font=宋体]非翻译区([/font][font=Calibri]5'UTR[/font][font=宋体])和翻译起始位点。此外,融合标签的添加对于目的基因的转录和蛋白表达同样至关重要。[/font][/font][b][font=Calibri] [/font][/b][font=Calibri]3. [/font][b][font=宋体]大肠杆菌表达菌株的选择和细胞培养[/font][/b][font=宋体][font=宋体]为保证蛋白质表达成功及其表达质量,应选择合适的大肠杆菌菌株,如[/font][font=Calibri]BL21[/font][font=宋体]及其衍生菌株是较常用的重组蛋白生产菌株。培养大肠杆菌比较简单的方法是分批培养,但此方法对生长的控制比较有限。近年来,高通量培养技术使研究人员能够在一系列发酵条件下处理大量样品,大大加快了生产时间。[/font][/font][b][font=Calibri] [/font][/b][font=Calibri]4. [/font][b][font=宋体]高通量蛋白表达和纯化[/font][/b][font=宋体][font=宋体]高通量平台可以快速克隆基因、挑选菌落、分离质粒[/font][font=Calibri]DNA[/font][font=宋体]、转化细菌、表达和纯化蛋白质。这些平台虽然成本高昂,但为复杂的分子生物学实验操作提供了极大的便利。[/font][/font][font=Calibri] [/font][b][font=宋体]结论与展望[/font][/b][font=宋体]大肠杆菌中的[/font][url=https://cn.sinobiological.com/services/high-throughput-antibody-production-service][u][font=宋体][color=#0000ff]高通量重组蛋白表达技术[/color][/font][/u][/url][font=宋体][font=宋体]极大的推进了重组蛋白的表达进程。尽管存在挑战,但通过不断优化和创新,研究人员正在朝着更高效可靠的蛋白质生产系统改进。未来的发展方向包括进一步优化克隆方法、开发新的融合标签、改进表达载体和菌株,以及利用高通量技术实现从[/font][font=Calibri]DNA[/font][font=宋体]到大规模蛋白质生产的快速转变等。[/font][/font][font=Calibri] [/font][font=宋体]参考文献:[/font][font=Calibri]Jia B, Jeon CO. High-throughput recombinant protein expression in Escherichia coli: current status and future perspectives. Open Biol. 2016 6(8):160196. doi:10.1098/rsob.160196[/font]
远志系陕西道地药材,是“秦药”大宗道地药材品种之一[1]。《中国药典》2020年版所收载的远志为远志科(Polygalaceae)植物远志Polygala tenuifolia Willd.或卵叶远志P. sbirica L.的干燥根[2],具有镇静安神、祛痰开窍、解毒消肿等功效[3]。现代研究表明,远志的主要活性成分有皂苷类、寡糖酯类、酮类等,具有抗记忆障碍、保护中枢神经系统、抗抑郁、抗心肌缺血和抗肿瘤等作用[4]。目前,关于远志的研究多集中于含量研究[5]、活性测定[6]、遗传多样性分析等[7]。随着分子生药学的发展,对药用植物相关活性成分生物合成途径相关调控基因、转录因子的挖掘已成为研究热点,基因组学、转录组学等技术在远志上的成功应用,也为远志基因家族的筛选、鉴定与分析提供了技术支撑和数据基础[8]。 碱性亮氨酸拉链(bZIP)基因家族作为真核生物中转录网络的重要开关,是植物中最大的转录因子家族之一。bZIP结构域由两个区域组成,即DNA结合基本区和亮氨酸拉链区[9]。bZIP基因家族成员通过差异基因网络或生物过程,在调节植物发育、生长以及盐胁迫响应等方面发挥着重要作用[10]。研究表明,拟南芥Arabidopsis thaliana L.、番茄Solanum lycopersicum L.、黄瓜Cucumis sativus L.、李子Prunus salicina L.和蓖麻Ricinus communisL.等多种植物中的bZIP参与调控组织分化、细胞生长、糖代谢、生物和非生物胁迫等多个生物学过程[11-12]。bZIP基因家族成员还参与多种药用植物次生代谢产物合成调控,如丹参Salvia miltiorrhiza Bunge.的SmbZIP1基因可抑制丹参酮的积累,大豆Glycine max (Linn.) Merr.的GmbZIP123基因则参与大豆种子脂质积累的调控[13]。同时,bZIP表达受外源激素和胁迫诱导,壳聚糖处理葡萄Vitis vinifera L.12 h下,其VvLysM8和VvLysM9基因表达量显著提高[14],糜子Panicum miliaceum L.中的PmbZIP97不仅受到脱落酸(abscisic acid,ABA)、盐和干旱胁迫强烈诱导且参与调控萌发后的根系生长[15]。 本实验利用远志三代转录组数据,以bZIP基因家族为研究对象,对其基因家族进行成员鉴定和生物信息学分析,并确定其在远志中的结构特点与进化特征,进一步通过实时荧光定量分析其在不同组织、不同处理条件下的表达模式,为后续深入研究bZIP的生物学功能奠定基础,同时为bZIP家族可能参与远志次生代谢成分生物合成途径研究提供思路。 1 材料及仪器1.1 材料2021年10月于陕西中医药大学药用植物园(陕西咸阳)采集3年生远志Polygala tenuifolia Willd.及其成熟种子,经陕西中医药大学杨新杰副教授鉴定。选取5株三年生长势均匀的远志植株,将根、茎、叶等量混合后进行全长转录组测序分析。1.2 试剂及仪器ABA、壳聚糖(chitosan,CHT)均购自上海源叶生物科技有限公司,Trizol总RNA提取试剂盒、dd H2O均购自生工生物工程(上海)股份有限公司,TB Green® Premix ExTaqTM Ⅱ (TliRNaseH Plus)、PrimeScriptTM Ⅱ 1st strand cDNA Synthesis Kit购自TaKaRa公司(日本),所用引物由武汉金开瑞生物公司合成。StepOnePlusTM Real-Time PCR(qPCR)仪(美国Applied Biosystems公司),NanoDropTM 2000分光光度计(美国Thermo-fisher公司),K5800自动检测超微量分光光度计(凯奥公司),?80 ℃超低温冰箱(中科美菱公司)。 2 方法2.1 样品的处理选择大小均一,颗粒饱满的远志种子,用自来水冲洗1 d,10%双氧水消毒,播种于装有泥炭土的花盆中,在光周期16/8 h,光照强度9 000 Lx条件培养[16]。选取长势均一的2月幼苗,喷200 μmol/L ABA、200 μmol/L CTS,干旱(10% PEG 6000)、盐(100 mmol/L NaCl)20 mL,以无菌水作为对照组;以0 h为空白对照,重复3次,6、12、24和48 h取样处理(3株),于?80 ℃冰箱储存,采用PacBio Seque Ⅲ进行上机测序,获得远志全长转录组学文库[17]。2.2 远志bZIP家族基因鉴定及理化性质分析基于远志转录组数据库,筛选出注释结果为bZIP的序列,将序列gene id对应的fasta结果输入editseq软件,进一步获得具有完整开放阅读框(open reading frame,ORF)的基因,通过NCBI中的BlastX进行比对与鉴定。Protparam分析目标蛋白的理化性质,ProtScale预测不同氨基酸中的蛋白亲疏水性[18]。2.3 远志bZIP家族基因二级结构、信号肽、跨膜结构及亚细胞定位分析用ExPASy分析基因编码蛋白质的结构域,CDD验证;ProtParam和SOPMA分析远志bZIP转录因子的二级结构;SignalP-5.0和TMHMM预测信号肽和跨膜区域;WoLF PSORT预测亚细胞定位[19]。2.4 远志bZIP家族基因进化树构建从Tair网站下载拟南芥蛋白序列,通过MEGA软件对远志、拟南芥bZIP氨基酸序列进行多序列比对,利用MEGA的最大自然法构建系统发育树,重复次数设置为1 000次[20]。2.5 远志bZIP家族基因密码子偏好性分析及蛋白互作预测分析采用CodonW、CUSP和Chips分析密码子偏好性。蛋白互作预测分析利用STRING进行,并以拟南芥筛选其同源基因后,通过Cytoscape 3.9.0软件作图。2.6 远志bZIP家族基因蛋白特征、保守基序分析及不同组织表达量热图通过chiplot分析bZIP蛋白的结构域,MEME获得bZIP蛋白的保守氨基酸基序,并用TBtools进行可视化,Weblogo分析蛋白序列位点。利用诺禾云平台将转录组数据库中27个PtbZIP基因在远志根、茎、叶3个部位的差异表达数据进行层级聚类分析。2.7 远志bZIP家族基因表达模式验证与分析Trizol法提取各样品总RNA,凝胶电泳检测后测定总RNA浓度。使用Prime Script TM II 1st strand cDNA Synthesis Kit合成cDNA,检测浓度后于?20 ℃保存备用。设计荧光定量引物,并送生工生物工程(上海)股份有限公司合成。以甘油醛-3-磷酸脱氢酶(F:5’-ACAGCAACGTGCTTCTCACC-3’,R:5’-CCCTTCATCCACCACCGACTA-3’)为内参基因,验证PtbZIP26(F:5’-GCACTGATGG- GAAGGCTGAA-3’,R:5’-GATTGCCCAACAC- TTGAGGG-3’)、PtbZIP27(F:5’-GTCGGATGGT- AGTGAACGGG-3’,R:5’-CACCATTTCCCGAAC- CCTGA-3’)在不同部位样本中的表达量。选择表达量较高的PtbZIP26进行不同激素、胁迫处理下的表达量分析。qRT-PCR反应体系为TB Green Premix Ex Taq Ⅱ(2×)5.0 μL;上下游引物各0.4 μL;50×ROX Reference Dye 0.2 μL,cDNA 1.0 μL;ddH2O 3.0 μL。PCR反应程序参照TB Green Premix Ex Taq Ⅱ试剂说明书进行,每个反应重复3次。基因相对表达量采用2?ΔΔCt法计算,SPSS 27.0统计分析。 3 结果与分析3.1 远志bZIP基因家族成员的鉴定和蛋白理化性质分析基于远志全长转录组数据库,共筛选得到63个注释为bZIP基因的序列ID,进一步分析后获得39个包含完整ORF的序列。整理ORF差异位点并合并重复,最终得到27个全长bZIP转录因子,编号PtbZIP1~PtbZIP27(表1)。该转录因子的氨基酸个数143~846,相对分子质量介于16 201.52~92 932.3,等电点4.59~9.69。除PtbZIP1和PtbZIP22的不稳定指数小于40,系稳定蛋白质外,其余PtbZIP均为不稳定蛋白。bZIP基因家族脂肪系数介于48.31~92.66,所有bZIP蛋白的平均亲水性数值是负值,为亲水性蛋白。图片3.2 远志bZIP基因家族成员的二级结构、信号肽、跨膜结构及亚细胞定位分析二级结构分析结果(表2)表明,远志bZIP家族蛋白均具有α螺旋、延伸链、β转角和无规卷曲,主要由α螺旋和无规卷曲构成,延伸链和β-折叠所占比例较小,散布于整个蛋白中。SignalP-5.0和TMHMM在线分析结果一致,所有远志bZIP蛋白信号肽分值都低于0.5,说明其均无信号肽,不属于分泌蛋白。跨膜结构域分析则显示,仅PtbZIP9和PtbZIP13有跨膜结构域。亚细胞定位结果表明,远志bZIP家族成员主要定位在细胞核。图片3.3 远志bZIP基因家族成员系统进化分析利用MEGA7.0构建远志与拟南芥bZIP转录因子家族系统进化树。结果表明,27个PtbZIP蛋白分为A、B、C、D、F、G、I、S 8个组,没有bZIP蛋白分到E和K组中。其中G是最大的1个亚组,含有PtbZIP家族成员共8个,占总数的29.63%;A、F、I和S组均含3个PtbZIP家族成员,B组含2个PtbZIP家族成员,C组含1个PtbZIP家族成员,D组含4个PtbZIP家族成员(图1)。图片3.4 远志bZIP基因家族成员蛋白结构域分析BRLZ、MFMR和DOG1为bZIP蛋白中的常见结构域,BRLZ参与调控果生炭疽菌的营养生长,MFMR涉及蛋白与蛋白之间的相互作用,DOG1则与种子休眠相关[21-22]。远志bZIP的结构域分析结果表明:10个蛋白存在BRLZ结构域,9个蛋白存在MFMR结构,6个蛋白存在DOG1结构域(图2)。PtbZIP3和PtbZIP13含有大小相近的CCDC 158 superfamily,PtbZIP26、PtbZIP21和PtbZIP5则均含有BRLZ、MFMR及homeobox结构,结合进化树结果可知PtbZIP3和PtbZIP13聚在一起,PtbZIP26、PtbZIP21和PtbZIP5三者亲缘关系较近。图片3.5 远志bZIP基因家族成员保守基序分析利用MEME对远志27个bZIP蛋白序列进行保守基序分析的结果显示,不同bZIP转录因子基因包含的保守元件数量及种类存在差异,其中bZIP14基因包含的保守元件数量最少(2个),bZIP18/25基因包含的保守元件数量最多(11个),说明bZIP成员具有功能冗余现象,也具有功能差异性(图3)。图片bZIP蛋白结合位点序列分析结果表明,bZIP转录因子的每个重复结构域约为65 aa,均含有1个保守的bZIP结构域,其中N端一般具有高度保守的N-X7-R蛋白基序和碱性亮氨酸区域(图4)。图片3.6 远志bZIP基因家族成员密码子偏好性分析密码子可用来推断基因组内部或基因组之间的进化关系,而不同种类或同一种类的基因对密码子使用有不同的偏好模式[23]。由bZIP基因家族中的27条核苷酸序列中密码子GC的总含量(GC)以及同义密码子第1位(GC1s)、第2位(GC2s)、第3位的(GC3s)的GC含量分析结果可知:27条PtbZIP基因序列的GC1s、GC2s和GC3s的均值分别为52.24%、44.90%和40.93%,不同位置的GC含量存在差异;它们的GC平均值为46.11%,小于50%,表明其更偏向于A或U结尾的密码子[24](表3)。图片有效密码子(effective number of codon,ENC)反映了密码子偏离随机选择的结果,它是对同义密码子非均衡使用偏好程度的一个重要指标[25],ENC数值一般在20~61范围内,当ENC>35则表示密码子偏好性较弱。密码子适应指数(codon adaption index,CAI)是指编码该蛋白的所有密码子相对于这条基因都使用最优密码子的情况下的适应系数[24]。由表3可知,远志bZIP家族成员的ENC数值为43.088~57.195个,平均值为51.13个,密码子偏好性较弱。CBI值较低说明其外源基因在目的宿主中表达较弱。CAI值较低,则说明其适应性较弱。3.7 远志bZIP基因家族成员蛋白互作网络分析为深入了解远志bZIP蛋白的潜在功能和家族成员之间的相互作用,利用STRING软件,基于拟南芥数据库,对远志的27个bZIPs蛋白进行了互作网络分析。由图5可知,调控网络中共有27个节点(代表bZIPs蛋白),104条边(代表蛋白质之间的相互作用),表明远志的bZIPs蛋白存在多种互作现象,且26个bZIPs成员之间存在潜在的互作关系,为进一步验证远志bZIP的功能提供了重要依据。图片3.8 远志bZIP基因家族成员不同组织表达量热图和验证根据远志转录组数据,对27个PtbZIP基因在远志根、茎、叶中的FPKM差异表达数据进行了双向聚类分析。通过表达量热图分析可知,绝大部分基因的表达不恒定,在不同组织具有相对较高的表达量,根、茎和叶中表达量较高的基因数分别为23、2和2。PtbZIP4/15在叶中的表达量最高,茎和根次之;PtbZIP8/24在茎中的表达量最高,叶和根次之;剩下23个除PtbZIP1/17的表达量为根>叶>茎,其余表达模式为根>茎>叶(图6-A)。基于RT-qPCR验证转录组数据结果显示,PtbZIP26、PtbZIP27在根中的表达量最高,茎、叶次之,与转录组结果一致(图6-B)。图片3.9 PtbZIP26不同处理下的表达模式为了探究bZIP家族基因在远志不同处理条件下的表达模式,以PtbZIP26为代表,对其进行了激素和干旱、盐胁迫处理条件下的表达模式分析。结果发现,以0 h为空白对照(CK),PtbZIP26的表达量在ABA处理6 h内迅速上升,在24 h达到峰值;CTS处理分别持续上调至峰值为CK的5.3倍(24 h)后逐渐下调(图7-A)。PEG处理6 h迅速下降后又随着处理时间增加缓慢恢复上调,NaCl处理6 h后上调明显(图7-B)。 图片4 讨论bZIP基因家族在植物中广泛分布,参与植物的多个生长过程,如生长发育、应激反应以及次生代谢物的生物合成[26]。现阶段,bZIP基因家族已在多个物种有过相关的鉴定和研究,使得对bZIP的生物功能了解更透彻。本实验基于远志三代全长转录组数据库,找到39个bZIP isoforms,通过完整开放阅读框与BlastX分析找出具有完整ORF的基因,去除重复的isoforms,筛选并鉴定得到27个PtbZIP基因家族成员。理化性质分析显示,27个成员均为亲水性蛋白,且除PtbZIP1和PtbZIP22外均为不稳定蛋白;理论等电点小于7的蛋白有16个,属酸性蛋白,其余均为碱性蛋白。PtbZIP蛋白信号肽分值都低于0.5,说明其均无信号肽,信号肽是分泌蛋白的决定因子,推测PtbZIP蛋白不属于分泌蛋白。亚细胞定位结果显示,远志bZIP蛋白主要定位于细胞核,这与转录因子主要在细胞核中发挥作用一致。PtbZIP家族成员的蛋白二级结构也有明显的特点,主要有α-螺旋、无规卷曲。系统进化分析显示,27个PtbZIP蛋白分为A、B、C、D、F、G、I、S 8个组,其中含有8个PtbZIP家族成员的G亚组系最大亚组。PtbZIP11/18/25与拟南芥At1g32150.1、At2g35530.1高度同源,且包含的保守元件数量最多,推测PtbZIP11/18/25可能在远志干旱应答的分子机制中起重要作用[27]。研究表明,A类别的大多数功能信息提示在ABA或应激信号中的作用,PtbZIP6/12/16被分在A组,推测该基因可能参与到远志ABA信号转导途径[28]。S类别是拟南芥最大的bZIP类别之一,在胁迫处理后也被转录激活或在花的特定部分特异表达。研究证实,拟南芥bZIP家族中的S类别的基因在响应干旱有重要作用,本研究中共有3个PtbZIP基因被分到S类别下,其中PtbZIP15在叶中表达量高,PtbZIP24在茎中表达量高,可能参与调控远志对干旱的响应。同时,27个PtbZIP基因家族成员的蛋白二级结构预测结果十分相似,但序列间同源性相对较低,表明PtbZIP基因可能在远志生长发育方面发挥广泛的生物功能。表达模式分析发现,大部分PtbZIP在根中表达最高,qPCR结果验证与转录组数据一致,推测它们主要在远志地下部分发挥作用。植物中转录因子的表达与激素密切相关,研究发现葡萄VvLysM8和VvLysM9在壳聚糖处理12 h、脱落酸处理3 h时相对表达量最高[14]。马铃薯StHXK家族基因在ABA诱导下表达均显著上调,且在10%PEG胁迫处理下也呈不同程度的上调表达[29]。陆地棉GhKIN基因家族的鉴定和分析发现,干旱和盐胁迫处理后GhKIN14和GhKIN27表达出现下调,而GhKIN18等在一定时间点表现为表达上调[30]。本研究选择一个在根中高表达的PtbZIP26基因,通过不同激素、胁迫处理探讨了其是否受到相关激素和胁迫调控,结表明激素处理(ABA和CTS)远志幼苗后,PtbZIP26表达水平显著提高;同时,盐胁迫和干旱胁迫处理也可诱导PtbZIP26基因的表达发生改变且随胁迫时间的变化呈现出差异性,说明PtbZIP26可能通过不同信号通路参与远志应对逆境胁迫的表达,具体作用机制有待深入研究。本实验基于远志三代转录组数据,以远志bZIP基因家族为研究对象,对其家族成员进行鉴定和生物信息学预测分析,明确了相关结构特点与进化特征,进一步通过qPCR分析其在不同组织、不同处理下的表达模式,为探究PtbZIP参与生长发育、代谢过程及非生物胁迫的调控机制提供参考依据,为后期的基因功能研究奠定了基础。
[font=宋体]膜蛋白表达是生物学和医学领域中一个重要的研究课题,但很多人对此并不十分了解。本文将为大家解答关于膜蛋白表达的常见问题,帮助大家更好地理解这一领域的基本概念、研究方法和应用前景。[/font][font=宋体] [/font][font=宋体][font=Calibri]Q1:[/font][font=宋体]义翘神州膜蛋白[/font][font=Calibri]VLP[/font][font=宋体]平台是利用什么系统表达的?[/font][/font][font=宋体][font=Calibri]A1:VLP[/font][font=宋体]平台我们采用的是[/font][font=Calibri]HEK293[/font][font=宋体]细胞表达的,获得的蛋白更接近天然构象,更有利于客户进行后续的研究和应用。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Q2:[/font][font=宋体]膜蛋白[/font][font=Calibri]VLP[/font][font=宋体]产品可以做体内生物素标记吗?[/font][/font][font=宋体][font=Calibri]A2:[/font][font=宋体]可以的,可以选择在蛋白上加[/font][font=Calibri]AVI[/font][font=宋体]标签或者选择对[/font][font=Calibri]VLP[/font][font=宋体]本身生物素化,体内定点生物素标记,具体根据您的需求选择。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Q3:[/font][font=宋体]抗体与抗原结合在胞外,全长的多次跨膜蛋白意义大吗?[/font][/font][font=宋体][font=Calibri]A3:[/font][font=宋体]多次跨膜蛋白在细胞膜上多次跨越,在胞外形成多个胞外区,比如[/font][font=Calibri]Claudin18.2[/font][font=宋体]、[/font][font=Calibri]CD20[/font][font=宋体]、[/font][font=Calibri]CD133[/font][font=宋体]都有两个[/font][font=Calibri]ECL[/font][font=宋体]([/font][font=Calibri]extracellular loops[/font][font=宋体]),每个[/font][font=Calibri]ECL[/font][font=宋体]都有特定功能甚至会相互影响。全长可以保证蛋白构象天然完整,而且[/font][font=Calibri]ECL[/font][font=宋体]展现完全,帮助筛选靶向多次跨膜蛋白抗原的理想抗体。给大家看下面两张图,全长的意义就显而易见了,结构完整,功能上也有保证。这么看,全长也不是我们[/font][font=Calibri]ACRO[/font][font=宋体]一直在强调全长,而是客户需要全长的多次跨膜蛋白,满足客户需要的产品是[/font][font=Calibri]ACRO[/font][font=宋体]的初衷。我们也比较过,单独的胞外[/font][font=Calibri]ECL[/font][font=宋体]区蛋白活性确实比全长蛋白差。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Q4:[/font][font=宋体]相比其他非[/font][font=Calibri]Nanodisc[/font][font=宋体]产品,[/font][font=Calibri]Nanodisc[/font][font=宋体]有什么好处吗?[/font][/font][font=宋体][font=Calibri]A4:Nanodisc-[/font][font=宋体]膜蛋白与去垢剂[/font][font=Calibri]-[/font][font=宋体]膜蛋白相比,的确有不同。首先,原理上,[/font][font=Calibri]Nanodisc[/font][font=宋体]膜蛋白是将膜蛋白除去去垢剂之后组装在类细胞膜的[/font][font=Calibri]Nanodisc[/font][font=宋体]上。其次,应用上,我们都知道,去垢剂会溶膜从而对细胞产生损伤,[/font][font=Calibri]Nanodisc[/font][font=宋体]版本的膜蛋白因不含去垢剂,可以进一步扩展到用于细胞试验、[/font][font=Calibri]CAR[/font][font=宋体]阳性率检测,应用范围是更广的。另外,我们[/font][font=Calibri]ACRO[/font][font=宋体]使用的[/font][font=Calibri]Nanodisc[/font][font=宋体]技术已经获得专利持有方的授权,在研发过程中是可以放心使用的。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Q5:VLP[/font][font=宋体]和[/font][font=Calibri]Nanodisc[/font][font=宋体]平台下的多次跨膜蛋白怎么去除非特异抗体?[/font][/font][font=宋体][font=Calibri]A5:[/font][font=宋体]非特异抗体的影响不容忽视,使用[/font][font=Calibri]VLP[/font][font=宋体]和[/font][font=Calibri]Nanodisc[/font][font=宋体]平台下的膜蛋白的确可能产生非特异抗体,我们这两个平台均有对应的用于反筛去除非特异抗体的空白对照:[/font][font=Calibri]VLP-[/font][font=宋体]膜蛋白有同型对照产品空白[/font][font=Calibri]VLP[/font][font=宋体];[/font][font=Calibri]Nanodisc[/font][font=宋体]有两款[/font][font=Calibri]MSP1D1[/font][font=宋体]空白产品,其中一款[/font][font=Calibri]MSP1D1[/font][font=宋体]作为[/font][font=Calibri]tag free [/font][font=宋体]膜蛋白的同型对照,如果使用生物素化的[/font][font=Calibri]Nanodisc-[/font][font=宋体]膜蛋白,另一款[/font][font=Calibri]MSP1D1[/font][font=宋体]可以作为同型对照。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Q6:VLP[/font][font=宋体]相关蛋白能适合冻干保存吗?[/font][font=Calibri]VLP[/font][font=宋体]的用于免疫有什么注意事项?比如能否乳化,对佐剂类型有没有要求?[/font][/font][font=宋体][font=Calibri]A6:[/font][font=宋体]包膜[/font][font=Calibri]VLP[/font][font=宋体]产品我们目前都是液体[/font][font=Calibri]-70[/font][font=宋体]°[/font][font=Calibri]C[/font][font=宋体]保存,干冰发货;非包膜[/font][font=Calibri]VLP[/font][font=宋体]我们是冻干保存的。[/font][font=Calibri]VLP[/font][font=宋体]免疫主要是需要注意佐剂量的选择,因为[/font][font=Calibri]VLP[/font][font=宋体]本身是可以增强免疫原性的,跟常规蛋白不同。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Q7:VLP[/font][font=宋体]和[/font][font=Calibri]Nanodisc[/font][font=宋体]产品稳定性如何。冷冻长时间保存可以吗?[/font][/font][font=宋体][font=Calibri]A7:VLP[/font][font=宋体]和[/font][font=Calibri]Nanodisc[/font][font=宋体]本身的稳定性是很好的,是可以在[/font][font=Calibri]-70[/font][font=宋体]°[/font][font=Calibri]C[/font][font=宋体]长期保存的。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Q8:[/font][font=宋体]如何确认[/font][font=Calibri]VLP-Claudin18.2[/font][font=宋体]表达的是该目标蛋白,纯度如何评估?产品上的电镜图片,怎么确认颗粒上有该蛋白[/font][font=Calibri]?[/font][/font][font=宋体][font=Calibri]A8:Claudin18.2-VLP [/font][font=宋体]我们会通过[/font][font=Calibri]anti-Claudin18.2[/font][font=宋体]特异性的抗体进行检测验证。纯度我们通过电泳[/font][font=Calibri]/HPLC/DLS[/font][font=宋体]电镜进行评估。常规负染电镜因分辨率低是没办法看到[/font][font=Calibri]VLP[/font][font=宋体]上是否有[/font][font=Calibri]Claudin18.2[/font][font=宋体]的。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州搭建了基于[/font][font=Calibri]HEK293[/font][font=宋体]表达系统的[/font][font=Calibri]VLP[/font][font=宋体]([/font][font=Calibri]virus-like particle[/font][font=宋体])技术平台,能够将目的膜蛋白完整展示在[/font][font=Calibri]VLP[/font][font=宋体]表面,使其能够像普通蛋白一样进行检测,已上线的[/font][font=Calibri]Claudin 18.2[/font][font=宋体]、[/font][font=Calibri]GPRC5D[/font][font=宋体]、[/font][font=Calibri]Claudin 6[/font][font=宋体]等产品均展示出良好活性。义翘神州目前可以为客户提供[url=https://cn.sinobiological.com/services/membrane-protein-expression-service][b]膜蛋白定制服务[/b][/url],助力药物研发进程。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]多次跨膜蛋白开发技术平台:[/font][font=Calibri]https://cn.sinobiological.com/services/platform/multi-pass-transmembrane-protein[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]VLP[/font][font=宋体]形式的膜蛋白表达服务:[/font][font=Calibri]https://cn.sinobiological.com/services/membrane-protein-expression-service[/font][/font]
蛋白分析系统在我们选择蛋白分析工具的时候,通常是根据不同的蛋白来选择不同的分析手段,如凝胶电泳、化学荧光染色、质谱等等。但是目前已经研制出的蛋白分析工具的种类繁多,从这一方面也在一定程度上反映了蛋白分析的复杂性。以下是一些近期推出的蛋白分析系统,希望能帮助您轻松完成研究工作。
[b][font=宋体]前言[/font][/b][font=宋体][color=#060607][font=宋体]随着基因组学、蛋白质组学和生物信息学的发展,重组[/font][font=Calibri]DNA[/font][font=宋体]技术的使用已经可以不需要预先了解蛋白质的细胞位置或功能,就能评估任何感兴趣的蛋白质。同时使用亲和标签和重组[/font][font=Calibri]DNA[/font][font=宋体]技术可以简便地修改蛋白质,从而高效地识别、生产和从宿主系统中分离出来。[/font][/color][/font][font=Calibri][color=#060607][font=Helvetica]为提高表达效率和纯化产量,研究者们开发了多种[/font][/color][/font][font=宋体][color=#060607]亲和[/color][/font][font=Calibri][color=#060607][font=Helvetica]标签,这些标签可以增加[/font][/color][/font][font=宋体][color=#060607]蛋白[/color][/font][font=Calibri][color=#060607][font=Helvetica]表达产量、影响溶解度和天然折叠,并通过结合亲和技术提高纯化产量。[/font][/color][/font][b][font=Calibri] [/font][font=Calibri][font=宋体]亲和标签的选择与应用[/font][/font][/b][font=宋体][color=#060607][font=宋体]亲和标签是指在重组蛋白的[/font][font=Calibri]N[/font][font=宋体]端或[/font][font=Calibri]C[/font][font=宋体]端添加的一段短肽,可以促进[/font][/color][/font][font=Calibri][color=#060607][font=Helvetica]蛋白质检测、表征和纯化。例如,[/font]c-myc[font=Helvetica]、[/font][/color][/font][url=https://cn.sinobiological.com/resource/protein-review/ha-tag-protein-production][u][font=Calibri][color=#0000ff]HA[/color][/font][/u][/url][font=Calibri][color=#060607][font=Helvetica]和[/font][/color][/font][url=https://cn.sinobiological.com/resource/protein-review/flag-tag-protein-expression][u][font=Calibri][color=#0000ff]FLAG[/color][/font][/u][/url][font=Calibri][color=#060607][font=Helvetica]等标签主要用于蛋白质检测,而[/font]polyArg[font=Helvetica]和[/font][font=Calibri]polyHis[/font][font=Helvetica]等亲和标签则主要用于蛋白质的纯化。亲和层析技术(如[/font][font=Calibri]IMAC[/font][font=Helvetica])和[/font][font=Calibri]Strep-tag[/font][font=Helvetica]系统等,都是基于亲和标签的纯化技术,它们能够从宿主系统中[/font][/color][/font][font=宋体][color=#060607]高效地[/color][/font][font=Calibri][color=#060607][font=Helvetica]纯化目标蛋白。[/font][/color][/font][b][font=Calibri] [/font][font=宋体]亲和[/font][font=Calibri][font=宋体]标签的创新与优化[/font][/font][/b][font=Calibri][color=#060607][font=Helvetica]为了克服单一亲和标签的局限性,研究者们开发了串联亲和纯化([/font]TAP[font=Helvetica])和双标签方法。这些方法通过结合不同的亲和标签,提供了多种纯化策略,从而增加了标签的多功能性和下游应用的灵活性。[/font][/color][/font][font=宋体][color=#060607]如[/color][/font][font=宋体][color=#060607]双标签构建体[/color][/font][font=Helvetica][color=#060607][font=Calibri]GFP-His[/font][/color][/font][sub][font=Helvetica][color=#060607][font=Calibri]6[/font][/color][/font][/sub][font=宋体][color=#060607],提供了使用体内荧光显微镜或体外技术的额外检测方法。除了使用[/color][/font][font=Helvetica][color=#060607] [font=Calibri]GFP [/font][/color][/font][font=宋体][color=#060607]荧光标准品和既定方案允许估计重组体外,[/color][/font][font=Helvetica][color=#060607][font=Calibri]GFP[/font][/color][/font][font=宋体][color=#060607]及其变体的内在荧光已被用于通过凝胶内荧光技术快速评估阳性克隆。[/color][/font][b][font=Calibri] [/font][font=宋体]亲和标签的去除[/font][/b][font=宋体][color=#060607]亲和标签的存在可能影响蛋白质的结构或生物功能,因此[/color][/font][font=Calibri][color=#060607][font=Helvetica]为了保持蛋白质的天然结构,需要去除[/font][/color][/font][font=宋体][color=#060607]亲和[/color][/font][font=Calibri][color=#060607][font=Helvetica]标签。特定的蛋白酶如肠激酶、[/font]SUMO[font=Helvetica]蛋白酶、烟草蚀纹病毒([/font][font=Calibri]TEV[/font][font=Helvetica])蛋白酶和凝血酶等,可以用于在特定序列处切割并去除[/font][/color][/font][font=宋体][color=#060607]亲和[/color][/font][font=Calibri][color=#060607][font=Helvetica]标签。[/font][/color][/font][b][font=Calibri] [/font][font=Calibri][font=宋体]结论[/font][/font][/b][font=Calibri][font=宋体]除了[/font][/font][font=宋体]对[/font][url=https://cn.sinobiological.com/resource/protein-review/affinity-tag][u][font=Calibri][color=#0000ff][font=宋体]亲和标签[/font][/color][/font][/u][/url][font=宋体]自身进行优化[/font][font=Calibri][font=宋体]以外,标签组合使用、简化纯化步骤、降低纯化成本、扩大纯化规模等,都[/font][/font][font=宋体]需要再[/font][font=Calibri][font=宋体]使用亲和标签融合技术时不断[/font][/font][font=宋体]的[/font][font=Calibri][font=宋体]改进与优化[/font][/font][font=宋体][font=宋体]。亲和标签和亲和纯化技术的发展不仅加速了高产量优质蛋白的获取,而且促进了新药物靶点和治疗方法的发现,方便我们更深入地了解蛋白质结构[/font][font=Calibri]-[/font][font=宋体]功能关系。[/font][/font][font=宋体][color=#060607] [/color][/font][font=Calibri][color=#060607] [/color][/font][font=Calibri][color=#060607][font=宋体]参考文献:[/font][/color][/font][font=Calibri][color=#212121]Young CL, Britton ZT, Robinson AS. Recombinant protein expression and purification: a comprehensive review of affinity tags and microbial applications. [/color][/font][i][font=Calibri][color=#212121]Biotechnol J[/color][/font][/i][font=Calibri][color=#212121]. 2012 7(5):620-634. doi:10.1002/biot.201100155[/color][/font][font=Calibri] [/font]
我的蛋白为RNases,表达在包涵体中,理论上有4对二硫键,8个游离巯基。我把包涵体溶在8M脲中,然后加入5mMDTT,还原过夜。然后用 AEMTS终浓度100mM烷化1h做MALDI-TOF。结果显示烷化上了6个游离巯基。请问是烷化条件不够还是DTT没有将包涵体的二硫键全部还原?还是蛋白本身构象问题使一个二硫键埋在内部,DTT作用不到?急,求救!
[font='times new roman'][size=18px]常规蛋白组学分析方法[/size][/font][font='times new roman'][size=16px][color=#000000]蛋白质组学是中心法则的下游,因此它要比基因组学更加复杂。和以相对稳定的方式存在的基因组比较,蛋白质组会由于蛋白质和基因的多种生化反应以及环境的影响而发生多种改变。首先计算并比较两组中三种样品之间蛋白质的差异表达状况,然后计算每组样品中蛋白质差异表达的显著性[/color][/size][/font][font='times new roman'][size=16px][color=#000000]P[/color][/size][/font][font='times new roman'][size=16px][color=#000000]值,选定表达差异倍数大于[/color][/size][/font][font='times new roman'][size=16px][color=#000000]1.5[/color][/size][/font][font='times new roman'][size=16px][color=#000000]倍或小于[/color][/size][/font][font='times new roman'][size=16px][color=#000000]0.67[/color][/size][/font][font='times new roman'][size=16px][color=#000000]倍且[/color][/size][/font][font='times new roman'][size=16px][color=#000000]P-value[/color][/size][/font][font='times new roman'][size=16px][color=#000000]([/color][/size][/font][font='times new roman'][size=16px][color=#000000]significance A[/color][/size][/font][font='times new roman'][size=16px][color=#000000])小于[/color][/size][/font][font='times new roman'][size=16px][color=#000000]0.05[/color][/size][/font][font='times new roman'][size=16px][color=#000000]的蛋白质界定为差异表达蛋白质。通过基因本体数据库([/color][/size][/font][font='times new roman'][size=16px][color=#000000]Gene Ontology[/color][/size][/font][font='times new roman'][size=16px][color=#000000],[/color][/size][/font][font='times new roman'][size=16px][color=#000000]GO[/color][/size][/font][font='times new roman'][size=16px][color=#000000])分析和京都基因与基因组百科全书([/color][/size][/font][font='times new roman'][size=16px][color=#000000]Kyoto encyclopedia of genes and genomes[/color][/size][/font][font='times new roman'][size=16px][color=#000000],[/color][/size][/font][font='times new roman'][size=16px][color=#000000]KEGG[/color][/size][/font][font='times new roman'][size=16px][color=#000000])通路富集分析进行相关生物信息学分析[/color][/size][/font][font='宋体'][size=16px][color=#000000]。[/color][/size][/font][font='宋体'][size=16px][color=#000000]1 火山图[/color][/size][/font][font='times new roman'][size=16px][color=#000000]火山图可查看蛋白在两组样品中表达水平的差异以及差异的统计学显著性。图中每一个点表示一个蛋白,横坐标表示某一个蛋白在两样品中表达量差异倍数的对数值[/color][/size][/font][font='times new roman'][size=16px][color=#000000] [/color][/size][/font][font='times new roman'][size=16px][color=#000000]纵坐标表示[/color][/size][/font][font='times new roman'][size=16px][color=#000000]P-value[/color][/size][/font][font='times new roman'][size=16px][color=#000000]的负对数值。横坐标绝对值越大,说明表达量在两样品间的表达量倍数差异越大[/color][/size][/font][font='times new roman'][size=16px][color=#000000] [/color][/size][/font][font='times new roman'][size=16px][color=#000000]纵坐标值越大,表明差异表达越显著,筛选得到的差异表达蛋白越可靠。[/color][/size][/font][font='times new roman'][size=16px][color=#000000] [/color][/size][/font][font='times new roman'][size=16px][color=#000000]2 [/color][/size][/font][font='times new roman'][size=16px][color=#000000]热图[/color][/size][/font][font='times new roman'][size=16px][color=#000000]差异表达蛋白层次聚类分析热图:前三列代表对照组样品,后三列代表实验组样品。红色代表与对照组相比表达上调的蛋白,蓝色代表下调的蛋白。颜色亮度的深浅代表差异表达蛋白表达上调或下调的程度。[/color][/size][/font][font='times new roman'][size=16px][color=#000000]3[/color][/size][/font][font='times new roman'][size=16px][color=#000000] [/color][/size][/font][font='times new roman'][size=16px][color=#000000]在对目标蛋白质集合进行[/color][/size][/font][font='times new roman'][size=16px][color=#000000]GO[/color][/size][/font][font='times new roman'][size=16px][color=#000000]注释或[/color][/size][/font][font='times new roman'][size=16px][color=#000000]KEGG[/color][/size][/font][font='times new roman'][size=16px][color=#000000]通路注释的富集分析时,使用[/color][/size][/font][font='times new roman'][size=16px][color=#000000] [/color][/size][/font][font='times new roman'][size=16px][color=#000000]Fisher[/color][/size][/font][font='times new roman'][size=16px][color=#000000]精确检验来比较每个[/color][/size][/font][font='times new roman'][size=16px][color=#000000]GO[/color][/size][/font][font='times new roman'][size=16px][color=#000000]分类或[/color][/size][/font][font='times new roman'][size=16px][color=#000000]KEGG[/color][/size][/font][font='times new roman'][size=16px][color=#000000]通路在目标蛋白质集合和总体蛋白质集合中的分布情况,然后再评价某个[/color][/size][/font][font='times new roman'][size=16px][color=#000000]GO term[/color][/size][/font][font='times new roman'][size=16px][color=#000000]或[/color][/size][/font][font='times new roman'][size=16px][color=#000000]KEGG[/color][/size][/font][font='times new roman'][size=16px][color=#000000]通路蛋白质富集度的显著性水平。[/color][/size][/font]
在大肠杆菌中高效表达外源蛋白的策略非常详细地说明了表达载体的构建,转录调控,中止子以及翻译过程中的一些选择。理论性很强,也很详细。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=111861]在大肠杆菌中高效表达外源蛋白的策略[/url]
[font=宋体]蛋白表达是指用模式生物如细菌、酵母、动物细胞或者植物细胞表达外源基因蛋白的一种分子生物学技术。蛋白表达系统是指由宿主、外源基因、载体和辅助成分组成的体系,通过这个体系可以实现外源基因在宿主中表达的目的。[/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、宿主。表达蛋白的生物体。可以为细菌、酵母、植物细胞、动物细胞等。由于各种生物的特性不同,适合表达蛋白的种类也不相同。[/font][/font][font=宋体][font=Calibri]2[/font][font=宋体]、载体。载体的种类与宿主相匹配。根据宿主不同,分为原核(细菌)表达载体、酵母表达载体、植物表达载体、哺乳动物表达载体、昆虫表达载体等。载体中含有外源基因片段。通过载体介导,外源基因可以在宿主中表达。[/font][/font][font=宋体][font=Calibri]3[/font][font=宋体]、辅助成分。有的表达系统中还包括了协助载体进入宿主的辅助成分。比如昆虫[/font][font=Calibri]-[/font][font=宋体]杆状病毒表达体系中的杆状病毒。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]一、大肠杆菌表达系统[/b][/font][font=宋体] [/font][font=宋体][font=宋体]在各种表达系统中,最早被采用进行研究的是大肠杆菌表达系统,也是目前掌握最为成熟的表达系统。大肠杆菌表达系统以其细胞繁殖快速产量高、[/font][font=Calibri]IPTG[/font][font=宋体]诱导表达相对简便等优点成为生产重组蛋白的最常用的系统。目前最常用的大肠杆菌表达系统为[/font][font=Calibri]BL21-PET[/font][font=宋体]表达系统,此系统目前已经商业化,并且普遍应用于各大实验室和生物技术公司。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]对于表达不同的蛋白,需要采用不同的载体。目前已知的大肠杆菌的表达载体可分为非融合型表达载体和融合型表达载体两种。非融合表达是将外源基因插到表达载体强启动子和有效核糖体结合位点序列下游,以外源基因[/font][font=Calibri]mRNA[/font][font=宋体]的[/font][font=Calibri]AUG[/font][font=宋体]为起始翻译,表达产物在序列上与天然的目的蛋白一致。融合表达是将目的蛋白或多肽与另一个蛋白质或多肽片段的[/font][font=Calibri]DNA[/font][font=宋体]序列融合并在菌体内表达。融合型表达的载体包括分泌表达载体、带纯化标签的表达载体、表面呈现表达载体、带伴侣的表达载体。[/font][/font][font=宋体] [/font][font=宋体]优点:遗传背景清楚;繁殖快、成本低、抗污染能力强;表达量高、表达产物分离纯化相对简单、稳定性好;商品化的载体和菌株种类非常齐全、适用范围广等。[/font][font=宋体] [/font][font=宋体]缺点:[/font][font=宋体][font=宋体]① 没有真核转录后加工的功能,不能进行[/font][font=Calibri]mRNA[/font][font=宋体]的剪接,所以只能表达[/font][font=Calibri]cDNA[/font][font=宋体]而不能表达真核的基因组基因;[/font][/font][font=宋体]② 没有真核翻译后加工的功能,表达产生的蛋白质,不能进行糖基化、磷酸化等修饰,难以形成正确的二硫键配对和空间构像折叠,因而产生的蛋白质常没有足够的生物学活性;[/font][font=宋体][font=宋体]③ 表达的蛋白质经常是不溶的,会在细菌内聚集成包涵体,尤其当表达目的蛋白量超过细菌体总蛋白量[/font][font=Calibri]10%[/font][font=宋体]时,就很容易形成包涵体。生成包涵体的原因可能有是蛋白质合成快速太快,多肽链相互缠绕,缺乏使多肽链正确折叠的因素,导致疏水基因外露等。细菌裂解后,包涵体的离心后的沉淀中,虽然有利于目的蛋白的初步纯化,但无生物活性的不溶性蛋白,要经过复性,使其重新散开、重新折叠成具有天然蛋白构象和良好生物活性的蛋白质,常常是一件很困难的事情。也可以设计载体使大肠杆菌分泌表达出可溶性目的蛋白,但表达量往往不高。[/font][/font][font=宋体][font=宋体]④ 可能会产生一些致热源[/font][font=Calibri]([/font][font=宋体]内毒素[/font][font=Calibri])[/font][font=宋体],并且大肠杆菌本身含有内毒素和有毒蛋白,可能混杂在终产物里。[/font][/font][font=宋体] [/font][font=宋体][b]二、酵母表达系统[/b][/font][font=宋体] [/font][font=宋体]酵母表达系统作为一种后起的外源蛋白表达系统,由于兼具原核以及真核表达系统的优点,正在基因工程领域中得到日益广泛的应用,应用此系统可高水平表达蛋白,且具有翻译后修饰功能,故被认可为一种表达大规模蛋白的强有力的工具。[/font][font=宋体] [/font][font=宋体][font=宋体]常用的酵母表达系统有酿酒酵母表达系统和甲醇营养型酵母表达系统。甲醇酵母表达系统是目前应用最广泛的酵母表达系统。目前甲醇酵母主要有汉森酵母属[/font][font=Calibri](Hansenula)[/font][font=宋体],毕赤酵母属[/font][font=Calibri](Pichia)[/font][font=宋体],球拟酵母属[/font][font=Calibri](Torulopsis)[/font][font=宋体]等,并以毕赤酵母属应用最多。[/font][/font][font=宋体] [/font][font=宋体]优点[/font][font=宋体][font=Calibri]1. [/font][font=宋体]生长方面:酵母是一种单细胞低等真核生物,培养条件普通,生长繁殖快速,能够耐受较高的流体静压,用于表达基因工程产品时有效降低了生产成本。毕赤酵母具有强烈的好氧生长偏爱性,可进行细胞高密度培养,利于大规模工业化生产。[/font][/font][font=宋体][font=Calibri]2. [/font][font=宋体]安全性方面:酿酒酵母被认为是安全无毒的,有着数十年的大规模发酵研究基础。[/font][/font][font=宋体][font=Calibri]3. [/font][font=宋体]分子生物学操作方面:酿酒酵母在重组[/font][font=Calibri]DNA[/font][font=宋体]中的广泛研究也是基于其己被人们掌握的大量分子生物学及生理学信息。外源基因一般和表达载体一起整合到了酵母染色体上,随染色体一起复制和遗传,不会发生外源基因的丢失现象。[/font][/font][font=宋体][font=Calibri]4. [/font][font=宋体]蛋白表达方面:可以进行蛋白的糖基化,而且还能分泌重组蛋白。[/font][/font][font=宋体][font=Calibri]5. [/font][font=宋体]蛋白分泌方面:由于毕赤酵母自身分泌到培养基中的蛋白很少,因此纯化方便。[/font][/font][font=宋体] [/font][font=宋体]缺点[/font][font=宋体][font=Calibri]1. [/font][font=宋体]克隆基因的表达量低,发酵时间长,不正确的蛋白糖基化及抗细胞分裂。[/font][/font][font=宋体][font=Calibri]2. [/font][font=宋体]培养上清多糖浓度高,不利于纯化。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]目前大肠杆菌蛋白表达系统是用最广泛,也是最经济实惠的蛋白表达系统。[/font][font=Calibri]E. coli[/font][font=宋体]具有遗传背景清楚、细胞增殖快、表达量高、稳定性好和抗污染能力强等特点,适用于多种属蛋白的表达,尤其对小分子蛋白的生产具有极大的优势,但也存在一些问题,如易形成包涵体和含有内毒素等。义翘神州提供从密码子优化到重组蛋白表达[/font][font=Calibri]/[/font][font=宋体]纯化的一站式服务以及内毒素去除等附加服务,以满足不同的定制需求。我们拥有丰富的[/font][font=Calibri]E. coli [/font][font=宋体]可溶性蛋白表达[/font][font=Calibri]/[/font][font=宋体]纯化及蛋白复性经验,拥有多种[/font][font=Calibri]E. coli[/font][font=宋体]细胞株和表达载体,可为客户提供优质的[url=https://cn.sinobiological.com/services/e-coli-protein-expression-service][b]原核蛋白表达服务[/b][/url]。更多关于[/font][font=宋体]大肠杆菌蛋白表达平台[/font][font=宋体]详情可以关注:[/font][/font][url=https://cn.sinobiological.com/services/platform/e-coli-protein-expression][u][font=宋体][color=#0000ff][font=Calibri]https://cn.sinobiological.com/services/platform/e-coli-protein-expression[/font][/color][/font][/u][/url][font=宋体] [/font]
[font=宋体]无细胞表达系统是一种在生物制药和基因疗法领域广泛应用的生物技术。尽管它带来了许多优势,如高表达水平和翻译后修饰,但无细胞表达系统也存在一些常见问题和挑战。本文将详细解答这些问题,并提供相应的解决方案。[/font][font=宋体] [/font][font=宋体][font=Calibri]Q1:[/font][font=宋体]无细胞合成([/font][font=Calibri]CFPS[/font][font=宋体])体系相对于细胞体系有哪些优势?[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]A1: [/font][font=宋体]无细胞表达系统的优势主要体现在:[/font][/font][font=宋体][font=宋体]? 可自动化操作简便、快捷——成本低(无需培养细胞和细菌相关的场地设施)、表达时间短([/font][font=Calibri]3h[/font][font=宋体])、单位表达量高。[/font][/font][font=宋体][font=宋体]? 蛋白表达工程化([/font][font=Calibri]Cell-free protein engineering[/font][font=宋体])——无细胞合成系统作为一个开放式的系统,可以向体系中自由添加所需的成分以调控蛋白的正确合成。例如可以向系统中加入[/font][font=Calibri]Fe2+[/font][font=宋体]、[/font][font=Calibri]Mn2+[/font][font=宋体]和[/font][font=Calibri]Cu2+[/font][font=宋体]等金属离子促进含有对应离子蛋白的正确合成;可以有效表达抗菌肽等毒性蛋白并实现规模化目的蛋白的生产。[/font][/font][font=宋体][font=宋体]? 适合原型研究([/font][font=Calibri]cell-free prototyping[/font][font=宋体]),整体原料均为外加,活性物质之间发生的化学酶促反应使整个过程相对可控。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Q2:[/font][font=宋体]真核来源的蛋白是否必须用真核表达系统?[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]A2:[/font][font=宋体]并非如此,真核来源的蛋白除了传统的哺乳动物表达系统,还可以利用无细胞蛋白合成。无细胞系统是一套酶促级联反应,可以添加很多其他组分甚至是真核来源的提取物来实现真核蛋白的表达。如果某些目标蛋白(比如抗体功能性片段[/font][font=Calibri]scFv[/font][font=宋体]和[/font][font=Calibri]VHH[/font][font=宋体])的功能不依赖翻译后修饰,在这种情况下,不管是无细胞系统还是[/font][font=Calibri]HEK293[/font][font=宋体]系统,两者表达的活性无明显差异。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Q3:[/font][font=宋体]无细胞合成系统是否适用于高通量,表达量如何?少量蛋白的检测是否也适用?[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]A3:[/font][font=宋体]无细胞表达系统非常适合高通量表达,其产量最高可到 [/font][font=Calibri]mg/mL [/font][font=宋体]级别,抗体和抗体功能性片段是 [/font][font=Calibri]100 [/font][font=宋体]μ[/font][font=Calibri]g/mL [/font][font=宋体]级别。对于少量蛋白的检测需要建立相应的检测方法,如您想进一步了解,我们可以协助进行方法学的设计。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Q4:[/font][font=宋体]对于原核体系难以表达的真核来源蛋白,无细胞表达体系有什么优势吗?[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]A4:[/font][font=宋体]因为其开放式系统可以添加很多其他组分甚至是真核来源的提取物来实现真核蛋白的正确合成。例如我们聚焦的[/font][font=Calibri]VHH[/font][font=宋体]、[/font][font=Calibri]VHH-Fc[/font][font=宋体]等都可以实现无细胞系统中上清表达,但是这些蛋白在原核表达中往往以错误的形式存在。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Q5: [/font][font=宋体]我在无细胞表达系统中进行表达,但蛋白总是以低表达水平出现,如何解决?[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]A5: [/font][font=宋体]低表达可能是由于反应条件不当或蛋白的折叠不完整。您可以尝试优化反应条件,如调整温度、[/font][font=Calibri]pH[/font][font=宋体]值和反应时间,以提高蛋白的表达水平。同时,添加适当的蛋白辅助因子或分子伴侣,有助于促进蛋白的正确折叠和表达。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Q6: [/font][font=宋体]以不溶性形式表达,该怎么解决?[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]A6: [/font][font=宋体]蛋白不溶性表达可能是由于蛋白的折叠不正确或缺乏正确的蛋白折叠因子。您可以尝试添加蛋白折叠辅助因子,如小麦胚芽提取物,有助于促进蛋白的正确折叠和溶解性。此外,优化反应条件和表达条件,如调整温度和反应时间,也可能有助于提高蛋白的溶解性。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Q7: [/font][font=宋体]形成夹杂物,导致纯化困难,有什么解决办法?[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]A7: [/font][font=宋体]夹杂物的产生可能是由于蛋白的折叠不正确或反应条件不适合。您可以尝试添加蛋白辅助因子或分子伴侣,如[/font][font=Calibri]chaperonin[/font][font=宋体],来帮助蛋白的正确折叠和防止夹杂物的形成。同时,优化反应条件和表达条件,如调整温度和反应时间,也可能有助于减少夹杂物的产生。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Q8: [/font][font=宋体]出现部分降解,如何解决?[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]A8: [/font][font=宋体]蛋白降解可能是由于蛋白的不稳定性或存在蛋白酶的活性。您可以尝试添加蛋白酶抑制剂,如苯甲酸,来减少蛋白的降解。同时,优化反应条件和表达条件,如调整温度和反应时间,也可能有助于提高蛋白的稳定性。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Q9: [/font][font=宋体]出现异常修饰,如何解决这个问题?[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]A9: [/font][font=宋体]蛋白异常修饰可能是由于无细胞表达系统中存在的特定修饰酶。您可以尝试选择不同的表达系统或添加特定的修饰酶抑制剂,来减少蛋白的异常修饰。同时,优化反应条件和表达条件,如调整温度和反应时间,也可能有助于减少蛋白的异常修饰。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Q10: [/font][font=宋体]形成聚集体,导致纯化困难,如何解决?[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]A10: [/font][font=宋体]蛋白聚集体的形成可能是由于蛋白的折叠不正确或反应条件不合适。您可以尝试添加蛋白折叠辅助因子或分子伴侣,如小麦胚芽提取物,有助于促进蛋白的正确折叠和防止聚集体的形成。同时,优化反应条件和表达条件,如调整温度和反应时间,也可能有助于减少聚集体的产生。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]A10: [/font][font=宋体]高背景信号可能是由于蛋白的非特异性结合或存在夹杂物。您可以尝试优化反应条件和表达条件,如调整温度和反应时间,来减少非特异性结合。同时,使用适当的纯化方法,如亲和层析或凝胶过滤,可以帮助减少背景信号。另外,您还可以使用合适的对照实验来验证蛋白的特异性结合,以确保蛋白表达的准确性和可靠性。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州自主研发的[url=https://cn.sinobiological.com/services/cell-free-protein-synthesis-service][b]无细胞表达系统[/b][/url],经过充分验证,可为您提供优质的[/font][font=Calibri]VHH[/font][font=宋体]及[/font][font=Calibri]scFv[/font][font=宋体]快速表达服务,加速您的研发进程。有需求可以来义翘神州网咨询详情[/font][font=Calibri]https://cn.sinobiological.com/services/cell-free-protein-synthesis-service[/font][/font]
[font=宋体][font=宋体]原核表达系统作为现代生物技术中的关键工具,广泛应用于蛋白质工程、药物研发等多个领域。然而,在实际应用中,科研工作者常会遇到诸多疑问和挑战。本文旨在解析原核表达系统中最常见的[/font][font=Calibri]10[/font][font=宋体]个问题,帮助读者更全面地理解其工作原理,掌握关键技术要点,从而在实际操作中更加得心应手。通过探索这些问题,我们将共同迈向更深入的科学探索之旅。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、如何选择蛋白表达宿主菌?[/font][/font][font=宋体]原核系统和真核细胞偏爱的密码子有不同,因此,在用原核系统表达真核基因的时候,真核基因中的一些密码子对于原核细胞来说可能是稀有密码子,从而导致表达效率和表达水平很低。[/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、质粒测序正确,蛋白无法表达[/font][/font][font=宋体][font=宋体]①分析一下稀有密码子,如果比较多,可以尝试[/font][font=Calibri]rosetta[/font][font=宋体]([/font][font=Calibri]DE3[/font][font=宋体])[/font][/font][font=宋体][font=宋体]②可能是基因本身的问题。[/font][font=Calibri]RNA3[/font][font=宋体]’的特殊结构可能导致转录出现问题,这种情况可以尝试融合表达,譬如[/font][font=Calibri]pET-32a[/font][font=宋体]。[/font][/font][font=宋体][font=宋体]③也许是表达量太低,也可以试一下[/font][font=Calibri]western blot[/font][font=宋体],定性的检测一下。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、如果[/font][font=Calibri]IPTG[/font][font=宋体]诱导后细胞停止了生长,是不是表示细胞死了?[/font][/font][font=宋体][font=Calibri]T7 RNA[/font][font=宋体]聚合酶非常活跃,[/font][font=Calibri]T7[/font][font=宋体]转录和翻译信号极强,因此,一旦诱导,细胞的主要生理活动都向着目的蛋白表达的方面转化。在通常情况下,细胞将停止生长,形成克隆的能力大大降低,但并未死亡。菌落形成试验可以用来检测表达系统的性能。也有一些例外情况,例如特别的目的基因以及一些极为严紧的载体[/font][font=Calibri]/[/font][font=宋体]宿主菌组合 (比如含有[/font][font=Calibri]pLysE[/font][font=宋体]的宿主菌)等,这时在诱导后菌落还是会继续生长。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4[/font][font=宋体]、如何提高重组蛋白在原核细胞里的表达水平,特别是可溶性表达?[/font][/font][font=宋体]这个问题是最困扰做原核蛋白表达纯化的人的。比如大肠杆菌表达蛋白本身表达量就大,但是表达的大都是包涵体,想要获得可溶性蛋白,就需要做复性,或是再设计实验时就想办法让其在上清中表达。一般就要通过基因优化,载体宿主优化筛选,表达条件优化,诱导条件优化等等。[/font][font=宋体] [/font][font=宋体]①降低重组蛋白合成的速率[/font][font=宋体]可溶性蛋白的产率取决于蛋白的合成速率,蛋白的折叠速率,以及聚集的速率。高水平表达时,肽链聚集的速率一旦超过折叠速率,就会形成包涵体。因此,降低重组蛋白合成的速率有利于提高重组蛋白的可溶性表达。[/font][font=宋体]②密码子优化[/font][font=宋体][font=宋体]密码子优化就是根据表达系统对密码子的偏好性进行优化筛选。经过优化的基因序列往往能提高[/font][font=Calibri]mRNA[/font][font=宋体]二级结构的稳定性,有利于新生肽段的正确折叠,提高外源活性蛋白的表达。。[/font][/font][font=宋体]③表达温度的选择[/font][font=宋体][font=宋体]大肠杆菌的最适生长温度在[/font][font=Calibri]37[/font][font=宋体]~[/font][font=Calibri]39[/font][font=宋体]℃之间,但此温度下极易生成包涵体蛋白,降低可溶性蛋白的表达,而低温培养条件下表达外源蛋白能有效地增加可溶蛋白的比例。[/font][/font][font=宋体]④诱导条件优化[/font][font=宋体]摇瓶培养时,应选用低菌体浓度诱导,因为在低菌浓度下菌体处于对数生长期,生长活跃,有利于表达可溶性蛋白。然而,如果能保证合理的补料与充分的通气,在较高菌浓度下诱导也同样可能获得可溶蛋白的高效表达。在某些情况下,诱导剂的流加能显著提高可溶蛋白的表达水平。[/font][font=宋体] [/font][font=宋体][font=Calibri]5[/font][font=宋体]、目的蛋白总是以不可溶的形式出现[/font][/font][font=宋体][font=宋体]在原核蛋白表达纯化中目的蛋白经常发生错误的折叠,并聚集成为包涵体。经过诱导,目的蛋白通常可达细胞总蛋白的[/font][font=Calibri]50%[/font][font=宋体]以上。虽然有一定比例的蛋白以可溶的单体形式存在,而多达[/font][font=Calibri]95%[/font][font=宋体](甚至更多)的蛋白则在包涵体中。实践中,有很多实验室采取降低诱导温度,例如[/font][font=Calibri]25[/font][font=宋体]–[/font][font=Calibri]30[/font][font=宋体]°[/font][font=Calibri]C[/font][font=宋体],或降低[/font][font=Calibri]IPTG[/font][font=宋体]浓度[/font][font=Calibri](0.01[/font][font=宋体]–[/font][font=Calibri]0.1mM)[/font][font=宋体]并延长诱导时间,还有采用特别的培养基等方法获得更多的可溶蛋白。然而,让目的蛋白以包涵体形式聚集也并非总是坏事。不溶态在某些情况下非常有利:[/font][/font][font=宋体] [/font][font=宋体]①形成包涵体是目的蛋白表达量很高的表现。[/font][font=宋体][font=宋体]②作为初步分离,将目的蛋白的包涵体纯化出来非常简便。用核酸酶处理,并经简单洗涤,通常可以获得纯度达[/font][font=Calibri]75[/font][font=宋体]–[/font][font=Calibri]95%[/font][font=宋体]的目的蛋白。[/font][/font][font=宋体]③存在于包涵体中的目的蛋白通常可以免于蛋白酶的水解破坏作用。[/font][font=宋体] [/font][font=宋体][font=宋体]研究者采用下述方法加强蛋白重折叠的效果,并在很多蛋白上取得了好结果,可以尝试以下:当蛋白还结合在树脂上时,使用[/font][font=Calibri]6M[/font][font=宋体]–[/font][font=Calibri]8M[/font][font=宋体]梯度盐酸胍、[/font][font=Calibri]1mM[/font][font=宋体]还原型及[/font][font=Calibri]0.2mM[/font][font=宋体]氧化型谷胱甘肽处理,继而用咪唑正常洗脱。有些实验室在透析去除变性剂的过程中加入底物或类似物,也有帮助酶折叠的效果。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]6[/font][font=宋体]、我要的是全长蛋白,怎么还有截短的产物,这是怎么回事?[/font][/font][font=宋体]①一个最直接原因就是蛋白水解了。[/font][font=宋体][font=宋体]②然而第二点翻译起始也非常有可能。起始密码子[/font][font=Calibri]AUG (Met) [/font][font=宋体]的上游在[/font][font=Calibri]RNA[/font][font=宋体]编码区有类似于核糖体结合位点序列[/font][font=Calibri](AAGGAGG)[/font][font=宋体]的间隔序列[/font][font=Calibri]([/font][font=宋体]通常是[/font][font=Calibri]5[/font][font=宋体]–[/font][font=Calibri]13[/font][font=宋体]个核苷酸[/font][font=Calibri])[/font][font=宋体]时,容易出现这种问题。截短蛋白在纯化全长蛋白的操作时往往造成麻烦。解决途径之一即是选用两端都带有融合标签的[/font][font=Calibri]pET[/font][font=宋体]载体,例如[/font][font=Calibri]pET-28[/font][font=宋体]和[/font][font=Calibri]pET-30[/font][font=宋体]系列载体在[/font][font=Calibri]N-[/font][font=宋体]端和[/font][font=Calibri]C-[/font][font=宋体]端都有[/font][font=Calibri]His-Tag[/font][font=宋体]。这样,全长蛋白就可以通过提高咪唑浓度,在洗脱时将截短蛋白与全长蛋白区分开。[/font][font=Calibri]pET-29[/font][font=宋体]和[/font][font=Calibri]pET-30[/font][font=宋体]系列载体在[/font][font=Calibri]N-[/font][font=宋体]端融合有[/font][font=Calibri]HiS-Tag[/font][font=宋体]序列而[/font][font=Calibri]C-[/font][font=宋体]有[/font][font=Calibri]His-Tag[/font][font=宋体],因此可以先后用固定化[/font][font=Calibri]S-[/font][font=宋体]蛋白和[/font][font=Calibri]His- Bind[/font][font=宋体]树脂亲和纯化以获取全长蛋白。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]7[/font][font=宋体]、[/font][font=Calibri]His[/font][font=宋体]标签包在蛋白质结构内部还能用蛋白酶切除吗?[/font][/font][font=宋体][font=宋体]一般重组蛋白纯化标签被包在内部,可以增加所提的蛋白质样品的溶解度,比如适量增加变性试剂浓度或类型使得蛋白质的肽链松散开暴露出(组氨酸)[/font][font=Calibri]6[/font][font=宋体]标签。另外,还可以加大离子型、非离子型或两性离子表面活性剂的浓度或类型,加大[/font][font=Calibri]DTT[/font][font=宋体]浓度([/font][font=Calibri]DTT[/font][font=宋体]浓度[/font][font=Calibri]1mmol/L[/font][font=宋体],否则[/font][font=Calibri]DTT[/font][font=宋体]会与[/font][font=Calibri]Ni2+[/font][font=宋体]结合),适当调整调高盐浓度(氯化钠溶液低于[/font][font=Calibri]2mol/L[/font][font=宋体],从低浓度到高浓度逐渐分梯度上升),总之,作用就是增加蛋白质的可溶性,因为[/font][font=Calibri]his6[/font][font=宋体]的亲水性较强,增加可溶性之后[/font][font=Calibri]his6[/font][font=宋体]容易暴露在水相。加大[/font][font=Calibri]DTT[/font][font=宋体]浓度也可以切断二硫键使得蛋白质的肽链松散,进而使[/font][font=Calibri]his6[/font][font=宋体]容易暴露在水相,从而方便纯化和酶切。再者重新构建,不加[/font][font=Calibri]His-tag[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]8[/font][font=宋体]、目的蛋白大于[/font][font=Calibri]100kd[/font][font=宋体]或含有多个亚基,是否可以用原核表达系统?[/font][/font][font=宋体]在细菌中已经非常成功底表达了很多大蛋白。多亚基复合物则可以通过分别表达各亚基,然后在有尿素的溶液中,将各组分以适当比例混和,再透析除去变性剂。[/font][font=宋体] [/font][font=宋体][font=Calibri]9[/font][font=宋体]、是否所有的位点特异性蛋白酶都有一样的酶切特性,只是识别位点不同?[/font][/font][font=宋体][font=宋体]位点特异性蛋白酶[/font][font=Calibri]([/font][font=宋体]例如凝血酶、肠激酶和[/font][font=Calibri]Xa[/font][font=宋体]因子[/font][font=Calibri])[/font][font=宋体]通常被用来切割融合蛋白。这些酶的活性和第二点酶切倾向性很不相同。凝血酶在这三种中是特异性活性最高的,能够有效切质量比仅为[/font][font=Calibri]1:2000[/font][font=宋体]的蛋白。[/font][font=Calibri]Xa[/font][font=宋体]因子似乎对于切点周围的序列很敏感,经常会出现特异性位点切割不理想却发生别的位点被切割的情况。肠激酶的专一性是上述三种中最好的,但由于切割效率低(通常要求质量比达到[/font][font=Calibri]1:10[/font][font=宋体])而显得比较昂贵。另一个需要考虑的问题是:切割完成之后,是否需要去除蛋白酶。在质量比比较高的酶切反应进行完后,通常要通过色谱法处理。比较方便可行的方法是采用生物素化凝血酶结合链亲和素琼脂糖一起使用。尽管没有一种蛋白酶完美无缺,凝血酶还算的上是活性高、专一性好的典型。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]10[/font][font=宋体]、如果去除信号肽,会不会影响蛋白本身的表达?[/font][/font][font=宋体]蛋白表达强度不受信号肽调控,所以去除信号肽不会影响蛋白质表达。但是信号肽一方面参与蛋白质折叠成特定空间结构,另一方面其还决定蛋白最终被定位到特定的亚细胞区,一般蛋白只有在特定亚细胞区才能发挥其功能,所以信号肽对蛋白最终活性还是有很大影响的。[/font][font=宋体] [/font][font=宋体][font=宋体]更多[url=https://cn.sinobiological.com/resource/protein-review/protein-expression][b]蛋白表达[/b][/url]详情可以查看义翘神州网:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-expression[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b][font=宋体] [/font][font=宋体] [/font]
区别呢 原核表达载体 在原核生物表达 ,真核的在真核表达 很像废话 呵呵呵呵。。。。 就是 原核载体可以将真核基因表达,但是表达出来的蛋白是没有活性的,因为缺少翻译后修饰系统。。。真核的表达载体呢 由于比较大 不适合大量快速扩增,所以要在其载体上构建可以在原核生物 如大肠杆菌中复制的所需的复制原件 。。。。综上 在应用的时候 要构建 穿梭质粒 可以穿梭于 原核和 真核 呵呵 还有就是 原核表达载体的基本元件和真核的有不同的地方 。。。。。总觉得不够正确答案 。。。。。有些人缘的蛋白在原核里没有蛋白翻译后修饰,表达后没有活性,这时候就得在真核里表达了原核表达做抗体,真核表达做功能研究。(1)原核载体,将克隆化基因插入合适载体后导入大肠杆菌用于表达大量蛋白质的方法一般称为原核表达。这种方法在蛋白纯化、定位及功能分析等方面都有应用。大肠杆菌用于表达重组蛋白有以下特点:易于生长和控制;用于细菌培养的材料不及哺乳动物细胞系统的材料昂贵;有各种各样的大肠杆菌菌株及与之匹配的具各种特性的质粒可供选择。但是,在大肠杆菌中表达的蛋白由于缺少修饰和糖基化、磷酸化等翻译后加工,常形成包涵体而影响表达蛋白的生物学活性及构象。 你可以就其在蛋白纯化等方面的作用进一步进行说明。(2)真核载体,要表达真核生物的蛋白质,采用真核表达系统自然应比原核系统优越,常用的酵母、昆虫、动物和哺乳类细胞等表达系统。真核表达载体的应用比较广,通过真核表达,可以研究某一基因的功能,比如把载有目标基因的载体导入到特定的哺乳动物细胞中以后,如果该基因发挥着某种功能,则可以通过其引起细胞的变化来说明问题等等。你可以搜索一下,这方面还是很多的。
基因组(genome)包含的遗传信息经转录产生mRNA,一个细胞在特定生理或病理状态下表达的所有种类的mRNA称为转录子组(transcriptome)。很显然,不同细胞在不同生理或病理状态下转录子组包含的mRNA的种类不尽相同。mRNA经翻译产生蛋白质,一个细胞在特定生理或病理状态下表达的所有种类的蛋白质称为蛋白质组(proteome)。同理,不同细胞在不同生理或病理状态下所表达的蛋白质的种类也不尽相同。蛋白质是基因功能的实施者,因此对蛋白质结构,定位和蛋白质-蛋白质相互作用的研究将为阐明生命现象的本质提供直接的基础。生命科学是实验科学,因此生命科学的发展极大地依赖于实验技术的发展。以DNA序列分析技术为核心的基因组研究技术推动了基因组研究的日新月异,而以基因芯片技术为代表的基因表达研究技术为科学家了解基因表达规律立下汗马功劳。在蛋白质组研究中,二维电泳和质谱技术的黄金组合又为科学家掌握蛋白质表达规律再铸辉煌。蛋白质组学(proteomics)就是指研究蛋白质组的技术及这些研究得到的结果。蛋白质组学的研究试图比较细胞在不同生理或病理条件下蛋白质表达的异同,对相关蛋白质进行分类和鉴定。更重要的是蛋白质组学的研究要分析蛋白质间相互作用和蛋白质的功能。蛋白质组学的研究内容包括:1.蛋白质鉴定:可以利用一维电泳和二维电泳并结合Western等技术,利用蛋白质芯片和抗体芯片及免疫共沉淀等技术对蛋白质进行鉴定研究。2.翻译后修饰:很多mRNA表达产生的蛋白质要经历翻译后修饰如磷酸化,糖基化,酶原激活等。翻译后修饰是蛋白质调节功能的重要方式,因此对蛋白质翻译后修饰的研究对阐明蛋白质的功能具有重要作用。3.蛋白质功能确定:如分析酶活性和确定酶底物,细胞因子的生物分析/配基-受体结合分析。可以利用基因敲除和反义技术分析基因表达产物-蛋白质的功能。另外对蛋白质表达出来后在细胞内的定位研究也在一定程度上有助于蛋白质功能的了解。Clontech的荧光蛋白表达系统就是研究蛋白质在细胞内定位的一个很好的工具。4.对人类而言,蛋白质组学的研究最终要服务于人类的健康,主要指促进分子医学的发展。如寻找药物的靶分子。很多药物本身就是蛋白质,而很多药物的靶分子也是蛋白质。药物也可以干预蛋白质-蛋白质相互作用。在基础医学和疾病机理研究中,了解人不同发育、生长期和不同生理、病理条件下及不同细胞类型的基因表达的特点具有特别重要的意义。这些研究可能找到直接与特定生理或病理状态相关的分子,进一步为设计作用于特定靶分子的药物奠定基础。不同发育、生长期和不同生理、病理条件下不同的细胞类型的基因表达是不一致的,因此对蛋白质表达的研究应该精确到细胞甚至亚细胞水平。可以利用免疫组织化学技术达到这个目的,但该技术的致命缺点是通量低。LCM技术可以精确地从组织切片中取出研究者感兴趣的细胞类型,因此LCM技术实际上是一种原位技术。取出的细胞用于蛋白质样品的制备,结合抗体芯片或二维电泳-质谱的技术路线,可以对蛋白质的表达进行原位的高通量的研究。很多研究采用匀浆组织制备蛋白质样品的技术路线,其研究结论值得怀疑,因为组织匀浆后不同细胞类型的蛋白质混杂在一起,最后得到的研究数据根本无法解释蛋白质在每类细胞中的表达情况。虽然培养细胞可以得到单一类型细胞,但体外培养的细胞很难模拟体内细胞的环境,因此这样研究得出的结论也很难用于解释在体实际情况。因此在研究中首先应该将不同细胞类型分离,分离出来的不同类型细胞可以用于基因表达研究,包括mRNA和蛋白质的表达。LCM技术获得的细胞可以用于蛋白质样品的制备。可以根据需要制备总蛋白,或膜蛋白,或核蛋白等,也可以富集糖蛋白,或通过去除白蛋白来减少蛋白质类型的复杂程度。相关试剂盒均有厂商提供。蛋白质样品中的不同类型的蛋白质可以通过二维电泳进行分离。二维电泳可以将不同种类的蛋白质按照等电点和分子量差异进行高分辨率的分离。成功的二维电泳可以将2000到3000种蛋白质进行分离。电泳后对胶进行高灵敏度的染色如银染和荧光染色。如果是比较两种样品之间蛋白质表达的异同,可以在同样条件下分别制备二者的蛋白质样品,然后在同样条件下进行二维电泳,染色后比较两块胶。也可以将二者的蛋白质样品分别用不同的荧光染料标记,然后两种蛋白质样品在一块胶上进行二维电泳的分离,最后通过荧光扫描技术分析结果。胶染色后可以利用凝胶图象分析系统成像,然后通过分析软件对蛋白质点进行定量分析,并且对感兴趣的蛋白质点进行定位。通过专门的蛋白质点切割系统,可以将蛋白质点所在的胶区域进行精确切割。接着对胶中蛋白质进行酶切消化,酶切后的消化物经脱盐/浓缩处理后就可以通过点样系统将蛋白质点样到特定的材料的表面(MALDI-TOF)。最后这些蛋白质就可以在质谱系统中进行分析,从而得到蛋白质的定性数据;这些数据可以用于构建数据库或和已有的数据库进行比较分析。实际上像人类的血浆,尿液,脑脊液,乳腺,心脏,膀胱癌和磷状细胞癌及多种病原微生物的蛋白质样品的二维电泳数据库已经建立起来,研究者可以登录www.expasy.ch/www/tools.html等网站进行查询,并和自己的同类研究进行对比分析。Genomic Solution可以为研究者提供除质谱外的所有蛋白质组学研究工具,包括二维电泳系统,成像系统及分析软件,胶切割系统,蛋白质消化浓缩工作站,点样工作站等;同时还可以提供相关试剂和消耗品。LCM-二维电泳-质谱的技术路线是典型的一条蛋白质组学研究的技术路线,除此以外,LCM-抗体芯片也是一条重要的蛋白质组学研究的技术路线。即通过LCM技术获得感兴趣的细胞类型,制备细胞蛋白质样品,蛋白质经荧光染料标记后和抗体芯片杂交,从而可以比较两种样品蛋白质表达的异同。Clontech最近开发了一张抗体芯片,可以对378种膜蛋白和胞浆蛋白进行分析。该芯片同时配合了抗体芯片的全部操作过程的重要试剂,包括蛋白质制备试剂,蛋白质的荧光染料标记试剂,标记体系的纯化试剂,杂交试剂等。对于蛋白质相互作用的研究,酵母双杂交和噬菌体展示技术无疑是很好的研究方法。Clontech开发的酵母双杂交系统和NEB公司开发的噬菌体展示技术可供研究者选用。关于蛋白质组的研究,也可以将蛋白质组的部分或全部种类的蛋白质制作成蛋白质芯片,这样的蛋白质芯片可以用于蛋白质相互作用研究,蛋白表达研究和小分子蛋白结合研究。Science,Vol.293,Issue 5537,2101-2105,September 14,2001发表了一篇关于酵母蛋白质组芯片的论文。该文主要研究内容为:将酵母的5800个ORF表达成蛋白质并进行纯化点样制作芯片,然后用该芯片筛选钙调素和磷脂分子的相互作用分子。最后有必要指出的是,传统的蛋白质研究注重研究单一蛋白质,而蛋白质组学注重研究参与特定生理或病理状态的所有的蛋白质种类及其与周围环境(分子)的关系。因此蛋白质组学的研究通常是高通量的。适应这个要求,蛋白质组学相关研究工具通常都是高度自动化的系统,通量高而速度快,配合相应分析软件和数据库,研究者可以在最短的时间内处理最多的数据。