拟购买新柏氏液基细胞学制备及电脑辅助检测系统,请问型号、配置及参数
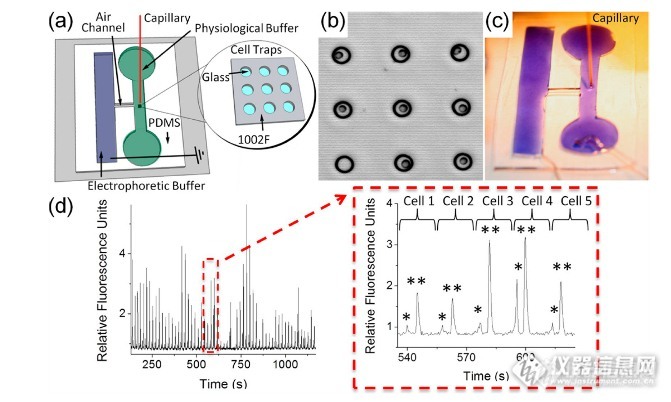
题名:自动化毛细管电泳的快速单细胞分析(Automated Capillary Electrophoresis System for Fast Single-Cell Analysis)作者:Alexandra J. Dickinson , Paul M. Armistead , andNancy L. Allbritton (一群美国滴家伙)杂志:Analytical Chemistry年卷页: 2013, 85 (9), pp 4797–4804 正文:毛细管电泳在单细胞分析上显示了其独特而强有力的优势,这是HPLC和UPLC等难望其项背的优势之一。以下就给大家介绍一个该项技术在单细胞分析上的应用,很牛很强大~ 为了介绍全面一点,我把整段摘要给翻译了。毛细管电泳用于单细胞分析是一种非常有前景的技术,但是在生物研究上其具有低通量的局限性。本文提出了一个微型细胞捕获器和三通道体系的自动化分析平台,在该系统上可进行快速缓冲液交换以进行快速单细胞分析。导入的细胞跟荧光素和俄勒冈绿一起被分离分析,通量为3.5 细胞/分,荧光素和俄勒冈绿的分离度为2.3±0.6。细胞蛋白激酶B(PKB)的活性是通过检测免疫荧光染色后的二氧膦基-PKB来检测的。结果显示,PKB在并没有变化,说明在CE分析过程中应激活化蛋白酶没有被上调,而且在细胞溶膜之前基底细胞的生理机能也没有被扰乱。在癌细胞中鞘氨醇激酶(SK)通常情况下是会被上调的。在此实验中,通过将神经胺-荧光黄(SF)基底引入细胞中而对SK进行检测。SF、神经胺-1-磷酸荧光黄(S1PF)和1/3荧光种类在单细胞中得到分析。219个细胞中,单细胞通量为2.1细胞/分钟。虽然这些亚种群细胞(此类细胞SK活性差异很大,这些差异跟种群均值有关)很容易被测定到,但88%的细胞具有上调SK的活性。该系统稳定,重现性好,可用于上百个贴壁和非贴壁细胞的生物组分的分离分析;还可用于检测非表征的生物学现象。生物方面的知识翻译起来颇费功夫,有些地方翻译得不一定地道。不过生物知识在这里不是重点,亮点在仪器上。比如微型细胞捕获器,这个装置至于毛细管入口端上面50微米处,那个三通道系统也一副牛掰哄哄的样子。如下图: http://ng1.17img.cn/bbsfiles/images/2014/01/201401202053_488354_1624715_3.png其他参数:溶膜方式:激光脉冲生理盐水和分离缓冲液的控制方式:接地电位进样方式:电动进样(-5kV,1s),此时横跨毛细管的电压设为0,1s,毛细管被从air gap移动到分离缓冲溶液中。结语:如果没有多年的科研积累和强大的平台是做不出这样的实验的。纵观这两年发到AC上的文章,动则CE-MS,剩下的就是类似这种:需要很多电化和物化知识外加搞技术难度的仪器创新。革命尚未成功,同志们需多努力啊~~~~~~~
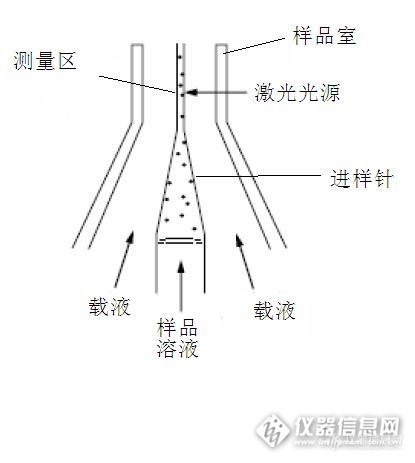
液流系统的作用是依次传送待测样本中的细胞到激光照射区,其理想状态是把细胞传送到激光束的中心。而且在特定时间内,应该只有一个细胞或粒子通过激光束。 因此,必须在样品室内把细胞注入鞘液流。样品室是液流系统的核心部件,在样品室内细胞液柱聚焦于鞘液中心,细胞在此与激光相交。样品室内充满鞘液,根据层流原理,在鞘液的约束下,细胞排成单列出样品室喷嘴口,并被鞘液包绕形成细胞液柱。这种同轴流动的设计,使得样品流和鞘液流形成的流束始终保持着一种分层鞘流的状态,这个过程称为流体聚焦。http://ng1.17img.cn/bbsfiles/images/2014/12/201412251405_528922_2648817_3.jpg图1 液流系统 单个细胞悬液在液流压力作用下从样品管射出,粒子或细胞在流动室内与激光相交,此交点为测量区。 流动室是仪器核心部件,被测样品在此与激光相交。流动室由石英玻璃钢制成,并在石英玻璃中央开一个孔径为430μm×180μm的长方形孔,供细胞单个流过,检测区在该孔的中心,这种流动室的光学特性良好,流速较慢,因而细胞受照时间长,可收集的细胞信号光通量大,配上广角收集透镜,可获得很高的检测灵敏度和测量精度。 流动室内充满了鞘液,鞘液的作用是将样品流环包,鞘液流是一种稳定的液体流动,鞘液以匀速运动流过流动室,在整个系统运行中流速是不变的,样品流在鞘液的环包下形成流体力学聚焦,使样品流不会脱离液流的轴线方向,并且保证每个细胞通过激光照射区的时间相等,从而得到准确的细胞荧光信息。
关键词:单细胞凝胶电泳目的:为便于各室单细胞凝胶电泳试验结果的可比性背景知识:略原理:在细胞核中,DNA是环状附着在核基质上,细胞裂解过程中,核基质被溶解、抽提,DNA的结构则未发生变化。如果DNA链上存在缺口,则使DNA超螺旋变的松弛,DNA环向外展,同时由于暴露了阴电荷,在电场力的作用下,松动的DNA环向阳极迁移,但是由于这种松动的DNA环一端仍附着于核DNA,其迁移距离受到限制,因此尾长并不总是真实反映链缺口的多少。实际应当依靠尾长与尾部的荧光强度同时来进行分析。主体内容:操作步骤见下文主要参考文献:略操作步骤:1. 分离制备单细胞悬液:(1) 体外培养的细胞株:用胰酶消化,吹打成单细胞悬液(2) 体内脏器细胞:处死动物,取出脏器,于Hanks’液中制备成单个细胞悬液。2. 胶板制备:(1) 取20~50μl于56℃水浴中保温的0.5%普通熔点琼脂糖,铺于磨沙载玻片上,形成底胶。(2) 取100~150μl 0.5%普通熔点琼脂糖加在底胶上,再于其上加盖玻片,4℃冷凝10分钟。(3) 取下盖片,取50~100μl于37℃水浴中保温的1.0%的低熔点琼脂糖与50~100μl细胞悬液(105个细胞/ml)混匀,立即铺片,加上盖玻片,4℃冷凝10分钟。(4) 去掉盖玻片,取70~100μl于37℃水浴中保温的0.5%的低熔点琼脂糖铺片,加盖玻片,4℃冷凝。3. 细胞裂解与电泳:(1) 将制备好的胶板去掉盖玻片后,浸于4℃预冷的细胞裂解液中,4℃裂解1小时。(2) 取出胶板,放入电泳槽中,浸泡在电泳液中解旋20分钟。(3) 4℃电泳20分钟(25V,300mA)。4. 中和与染色:(1) 电泳结束,将胶板浸泡于中和液中,每次15分钟,共中和两次,注意更换中和液。(2) 取出胶板,置于染色架上,滴加5μg/ml的PI,暗处染色20分钟。(3) 蒸馏水脱色15分钟。5. 镜检和分析:(1) 在荧光显微镜下观察,绿光激发吸收滤片590nm。必要时照相记录。(2) 记数观察的细胞,记录彗星细胞出现的频率,用目镜测微尺测头长与全长,计算核DNA迁移距离。* * * * *使用两层凝胶法,经裂解、DNA解旋、电泳和中和得到湿琼脂糖凝胶片。将湿琼脂糖凝胶片置于冰冷无水乙醇中脱水10分钟,后置于空气中自发干燥。每人制备2张琼脂糖凝胶片。全部操作在采血后8小时内完成,操作过程中注意避光。脱水干燥的琼脂糖凝胶片装于含有干燥剂的载片盒中运回实验室。使用50μl 30μM的溴乙锭溶液染色、照相。使用单细胞凝胶电泳软件分析所有照片,每人随机测量100个以上细胞的尾长和olive尾矩,以尾长和olive尾矩的算术均数代表个体DNA损伤情况。
[b][url=http://www.f-lab.cn/cell-analyzers/puncher.html][b]单细胞转移分离系统[/b][/url]是可用于单细胞转移,单细胞分离和单细胞隔离,单细胞成像应用的多功能单细胞分离操作仪器,它可以实现从微孔芯片转移单细胞到细胞收集管中。单细胞转移分离系统[/b][color=#666666]集单细胞成像,单细胞隔离,单细胞选择功能于一体,自动聚焦成像。[/color][b]单细胞转移分离系统转移单细胞到Eppendorf微管,PCR微孔板或其它反应微管中,[/b][color=#666666]在隔离单细胞后,它可以对选定收集的细胞进行扫描并成像。[/color][b]单细胞转移分离系统[/b][color=#666666]采用Nikon Ti-2倒置荧光显微镜,配备自动扫描显微镜载物台,自动聚焦器件,高灵敏度荧光CCD相机和LED激发光源组建而成。[/color][img=单细胞转移分离系统]http://www.f-lab.cn/Upload/single-cell-isolation.JPG[/img][b]单细胞转移分离系统[/b]特点完全自动化,步进系统高质量单细胞荧光成像单细胞分离的效率超过90% 超过70%分离的细胞增殖 分离后兼容所有的单细胞的WGA工具包(放大器的‐1,picoplex,复制‐G)实惠微Wells基于硅微孔微腔。由薄膜封闭70µ m,井底直径(1µ m),包含一个单孔。样品流体进入威尔斯并从底部的孔隙中流出。单个细胞被拖着走。一旦单个细胞降落到孔隙上,流动停止,其他细胞就不会进入井内。有用的细胞被识别出来。选定的细胞穿孔从微孔到384孔PCR板或离心管等等。单细胞转移分离系统:[url]http://www.f-lab.cn/cell-analyzers/puncher.html[/url]
细胞液量很少,几乎澄清,稀释50倍后直接进样分析。菜鸟求助:不知道前处理需不需要蛋白沉淀呢?细胞液中的蛋白质是否会干扰元素测定。另外,想求合适的前处理方法。谢谢。
各位朋友: 您们好! 我最近在使用Renishaw公司的拉曼光谱仪,是共聚焦的,来测试单细胞的拉曼光谱,采用785nm光源,但每次测试的效果都非常不好! 我是将细胞种在盖波片上,或者直接将细胞溶液滴在载波片上,直接用显微镜看到细胞之后,再打光测试,但每次总是打在载物台上,而且基本上测不到细胞的拉曼光谱... 请问有哪位朋友能为在下指点迷津啊,我这也试了许多次了,但总是没有效果...
将在药物开发进程中发挥重要作用2011年03月26日 来源: 科技日报 作者: 常丽君 本报讯 据每日科学网近日报道,美国范德堡大学研究人员开发出一种新型激光技术,可检测细胞膜上的蛋白质和其它多种生物分子之间的相互反应。这种检测将在药物开发进程中发挥重要作用。 人类细胞中约有7000种蛋白质,其中30%在细胞膜上,控制细胞分子运作机制的信号有60%—70%由这些膜蛋白产生,因此当前市场上约一半的药物都是瞄准细胞膜蛋白。但因为膜蛋白很难提纯,科学家在研究它们的结构时面临很多困难。现有的检测膜手段大多是将膜蛋白从其所处环境中分离,或用不同方式如荧光标签加以修改,以分析它们的活性。这些方法不仅昂贵耗时,还可能会影响目标膜蛋白的功能。 范德堡大学化学生物研究院化学教授达里尔·波恩霍普领导的研究小组和斯克里普斯研究院合作,开发了一种名为“后向散射干涉仪”(BSI)的新型激光技术,能精确检测出膜蛋白和自然界中各种分子之间的结合力。 BSI操作起来很简单,只要把两种分子混合装入一个充满液体的显微镜小盒中,用一束类似于条形码扫描仪的红色激光照射,就能测出它们之间的结合力。小盒的几何形状调整合适后,激光就会产生干涉图案,而这种干涉图案对分子之间的反应非常敏感。如果分子开始互相作用,图案就开始变换。 为了检验BSI的准确性,研究人员制造了一种含有GM1小蛋白质的合成膜,霍乱毒素要进入细胞,主要结合对象就是这种小蛋白质。他们把霍乱毒素B和这些膜混合,检测出的结合力结果与用其他方法所得到的结果一致。为了进一步确认,他们还用了一种和胸腺癌相关的天然分离膜和3种分别与疼痛、发炎和神经传导素GABA(用于放松、睡眠和调节紧张)相关的蛋白质膜进行检验,把包含这些蛋白质的膜和对应结合分子相混合,用BSI技术测得的值也和用其他方法得到的结果一样。 此外,该技术进入商业化也前景广阔,范德堡大学对新型激光检测技术已申请了专利,并已获得3项批准。他们还专门成立了一家分子传感公司对新技术进行独家开发。
近日,美国麻省理工学院利用造价低廉的激光开发出一种从样品中分离某些细胞的新系统。该系统能在普通的玻璃载玻片上分离出1万多种细胞,这将有助于研究人员轻松完成许多在以前看来不可能的生物实验。而且,与其他细胞分离方法相比,该系统分离速度快、操作简单且价格便宜。这一研究结果刊登在12月15日的《分析化学》(Analytical Chemistry)上。 此前,细胞分离系统都是将样品与可跟特定蛋白质或其他成分反应的标记物混合,然后根据样品是否发出荧光来分离细胞。新系统将根据细胞中某些特定部分的反应来进行更加细致的细胞分离。另外,系统还能根据反应速度的快慢以及持续时间的长短来分离细胞,而用传统分离办法完成这些工作是不可能的。 新系统仅利用一个固定在普通玻璃载玻片上的透明有机硅薄层。硅层中分布了很多小空穴,使样品溶液中的细胞能沉淀在其中。经过如此改装的载玻片就能帮助研究人员分离出上万个细胞。 通过显微镜,研究人员或计算机系统能仔细察看细胞是否在特定区域或时间发出荧光。一旦发现发出荧光的细胞,计算机将自动记录其位置。然后,所有被记录下来的细胞将在激光束的作用下从空穴中浮出,最后这些细胞经液体冲刷后就可收集到容器中。 该系统的研发人员称,用激光束使细胞从空穴中浮出来,就像用消防管的水推动一个充气球。但激光的作用非常轻柔,不会使细胞受到损伤。 与光镊等昂贵的分离技术不同,这个系统的成本仅为几千美元,因此可广泛应用于生物实验室和临床研究机构。研究人员预计,该系统将在临床试验与诊断、基因筛选以及克隆研究等方面发挥重要作用。(来源:科技日报 徐玢) (《分析化学》(Analytical Chemistry),79 (24), 9321 -9330, 2007. 10.1021/ac071366y S0003-2700(07)01366-2,J. R. Kovac and J. Voldman)
单细胞凝胶电泳步骤:1. 分离制备单细胞悬液:(1) 体外培养的细胞株:用胰酶消化,最后用PBS悬浮吹打成单细胞悬液,细胞要计数,具体的量我前边已经说过。(2) 体内脏器细胞:处死动物,取出脏器,于Hanks’液中制备成单个细胞悬液。2. 胶板制备:(1) 取100μl于45℃水浴中保温的0.5%NMA,铺于磨沙载玻片上,形成底胶。盖玻片推匀,不能有气泡,4度凝固5至8分钟。(2) 水平取下盖片,取100μl于37℃水浴中保温的0.5%LMA与20μl细胞悬液(约400个细胞)混匀,立即铺片,加上盖玻片,4度凝固5至8分钟。3. 细胞裂解与电泳:(1) 将制备好的胶板去掉盖玻片后,浸于4℃预冷的细胞裂解液中,在4℃下裂解2.5到3小时。(2) 取出胶板,用双蒸水浸没漂洗后放入电泳槽中,浸泡在4℃预冷的电泳液中解旋20分钟。(3) 玻片水平放置阳极端附近,4℃电泳20到25分钟(25V,300mA)。可在电泳槽周围加冰块以保持低温。4. 中和与染色:(1) 电泳结束,将胶板浸泡于中和液中,每次10分钟,共中和3次,每次要更换中和液。最后晾干。(2) 取出胶板,置于染色缸中,在2μg/ml的EB染色液中,暗处染色5到10分钟。(3) 蒸馏水漂洗2次,每次5分钟。稍晾干,滤纸吸去多余水分,尽快在荧光显微镜下观察。从胶板制备开始到最后都应该在暗光下操作。先讲这些,你们可以先开始摸索,真正做了才能发现具体的问题,到时我们再探讨。
摘要激光扫描共聚焦显微镜作为80年代发展起来的一种高精度分子细胞生物学分析仪器,具有组织细胞断层扫描、活细胞动态荧光监测、三维图像重建、共聚焦图像定量分析等先进功能,在近年的细胞凋亡这一研究热点中得到了大量创造性的应用。本文拟就对激光扫描共聚焦显微镜在凋亡的形态学、分子水平变化及重要生理过程三方面研究中的应用及其成果做一综述。细胞凋亡(apoptosis)是不同于细胞坏死的一种细胞主动死亡方式,并由特定的基因控制。凋亡细胞在形态上出现变圆皱缩、染色质浓缩边集、核碎裂、凋亡小体形成等变化,并最终由非炎症过程清除。由于细胞凋亡独特地影响着机体的细胞发育和代谢,在监测和清除肿瘤细胞与突变细胞等方面也可能发挥重要的作用,近年来受到了细胞生物学、分子生物学、免疫学等多学科的广泛关注。激光扫描共聚焦显微镜(laser scaing confocal microscopy, LSCM)是80年代发展起来的一种高精度分子细胞生物学分析仪器,辅以各类免疫荧光探针或荧光染料与被测物质特异性结合,不仅可观察固定的细胞组织切片,还可对活细胞的结构、分子和离子进行实时动态地观察和检测。在细胞凋亡的研究中,激光扫描共聚焦显微镜已被广泛地应用于形态学、分子水平监测及重要生理改变等各方面,其中不乏新颖之处,并获得了大量成果,以下将就此做一简单的介绍。激光扫描共聚焦显微镜与凋亡的形态学激光扫描共聚焦显微镜用点光源扫描标本的光学横断面,以代替普通光学显微镜所使用的场光源,并用探测针孔滤去离焦光线,所以消除了来自焦平面以外的衍射或散射光的干扰,可实现高清晰、高分辨率的组织细胞断层扫描。并且由于激光扫描共聚焦显微镜采用数字化成像,因而辅以一定的软件就能对图像进行定量分析及三维重建等操作。过去对细胞凋亡的形态学研究方法局限于活性细胞和组织切片染色、荧光镜观察,或者石蜡切片原位末端标记法。由于普通光镜的分辨率和清晰度有限,而电镜又显然不适合对凋亡这一复杂动态过程的监测,激光扫描共聚焦显微镜的应用使人们对细胞凋亡的形态学观察分析提高到了一个前所未有的新水平。细胞核核膜的破坏对于染色质聚集并形成凋亡小体起重要作用。lamin是构成核片层的蛋白质,位于核膜的内表面,由caase-6介导的lamin裂解可影响核膜的完整性。在McCall等的研究中,对果蝇卵子发生晚期的细胞凋亡现象进行了动态观察。以单抗mAb101标记其哺育细胞核内膜的laminDm0(哺乳类laminB的同源体),用激光扫描共聚焦显微镜加以观察。正常哺育细胞到11期时,染色的lamin呈弥散的雾状分布并围绕核周,而dcp-1GLC哺育细胞即使到了较晚的14期时,仍然显示界线明确的染色。可见dcp-1突变体在核lamin蛋白的酶切或解聚方面存在缺陷。细胞器Li 等在对C(6)-酰基鞘氨醇诱导胞内囊泡产生的研究中,在不产生中毒效应的情况下,加入10microM C(6)-酰基鞘氨醇以诱导鼠纤维母细胞(3T3-L1和3T3-F442A)凋亡。观察到囊泡的形成与C(6)-酰基鞘氨醇的诱导呈时间依从和剂量依从关系。大量小泡在其加入后8小时内出现,并且随时间而增大;大泡最终分布在核周,而小泡分布在细胞边缘。用抗-溶酶体膜蛋白抗体和共聚焦免疫荧光显微分析,证明增大的囊泡为晚期内吞体/溶酶体。另外,胞内的细胞器都有其适用的荧光探针,如高尔基复合体常用的探针有Dceramide、BODIPY ceramide等,内质网常用的有Dil、DiOC6等,经标记均可进行精细的观察。当然,激光扫描共聚焦显微镜在形态学中的优势更在于其对图像的三维重建功能,从而揭示过去只能在平面上显现的凋亡细胞在三维空间中的结构;而对细胞凋亡的动态过程,它可以用三维加时间的四维方式进行观察,来获取最逼真的形态学资料。凋亡过程中一些特征性的三维形态变化正期待着进一步具体的工作去发现。激光扫描共聚焦显微镜对凋亡细胞的分子水平监测随着分子生物学突飞猛进的发展,关于细胞凋亡分子机制的研究已有了很大的突破。细胞凋亡的信号传递途径及其调控涉及到大量的酶级联反应、生物大分子的空间转移等。而激光扫描共聚焦显微镜以其定性、定量、定时的优点,结合众多荧光探针的应用,成为了研究细胞凋亡分子水平变化的有力手段。DNA大分子DNA断裂以及染色质的异常凝聚,是细胞凋亡的关键,同时也是细胞核在细胞凋亡中具有标志性的变化。Columbara等报道将激光扫描共聚焦显微镜与原位TdT和Poll免疫荧光技术相结合,进而确定双链和单链DNA的断裂点。而在对细胞凋亡和细胞坏死区别的研究中,Kreel等在培养的K562细胞中加入放线菌素D以诱导凋亡,并对细胞的DNA片段进行了3’-末端标记。经激光扫描共聚焦显微镜观察发现K562细胞凋亡早期有大量DNA片段出现,且DNA片段弥散分布于除核仁外的细胞核区。伴随着凋亡的进展,细胞核内出现大量高标记密度的圆形小体。而采用NaN3或快速冻融法使细胞坏死,经激光扫描共聚焦显微镜观察证实,在坏死开始阶段并无DNA片段的出现,至少在坏死发生24小时后才有DNA片段产生。Caase家族Caases是一组高度保守的半胱氨酸蛋白酶,目前发现有11个成员。多数细胞凋亡是以Caase家族蛋白的激活并作用于其关键底物而实现的,而caases激活的关键又在于该家族蛋白间的级联反应,因此caases被认为是细胞凋亡的中心环节和执行者,成为研究的热点。Mandal等用激光扫描共聚焦显微镜对细胞凋亡中激活的caase-3的重分布进行了研究。用丁酸处理细胞后,观察到DNA-PKcs的裂解与caase-3的激活成正相关,而Bcl-2的过度表达则可抑制上述两个过程。同时还证明(1)激活后的caase-3重分布到核区,(2)裂解局部的DNA-PKcs和PARP(polyADP-ribosepolymerase,聚腺苷二磷酸核糖多聚酶),(3)裂解产物又被释放到核外的细胞液。caase-3的抑制物四肽DEVD-CHO又可抑制上述的三个连续的步骤。该研究提示:激活的caase-3在核内的重分布构成了丁酸所诱导的细胞凋亡中的一个重要凋亡信号。另外,在用激光扫描共聚焦显微镜对Q79诱导大鼠神经元凋亡的研究中,Sanchez等发现了Q79对caase-8的聚集和激活,而对caase-8的抑制则阻止了被诱导的细胞凋亡;加以Westernblot分析,还建立了caase-8的激活和某些神经退行性疾病(如舞蹈病)的联系。Grazyme丝氨酸蛋白酶grazyme为另一种重要的凋亡信号分子,对某些caase家族蛋白也有激活作用。Trapani等就证明了杀伤淋巴细胞利用穿孔素和grazymeB的协同作用来诱导靶细胞的凋亡,在其研究中通过激光扫描共聚焦显微镜观察到(1)50%细胞的胞核内快速聚集了以FITC荧光标记的grazymeB(最长7分钟,t1/2为2分钟),然后发生凋亡;(2)其它的细胞只有细胞液内有FITC-grazyme B的摄取,避免了凋亡。此间至少在13分钟后才有DNA碎片的出现,说明核内的grazyme B聚集出现在凋亡的执行阶段之前。并且通过对核内液的处理(加入70KDa FITC-dextran),间接观察到grazyme B的转移并非是因为核膜受caases的作用而破损,而是由于穿孔素的协同。其它以上的介绍显示,激光扫描共聚焦显微镜在检测活细胞酶活性动态变化方面有着突出的优势。实际上,对于细胞凋亡的分子机制这样一个极其复杂的课题,激光扫描共聚焦显微镜的应用远不只限于上述的几种离子和大分子,而是渗透到了大量的分枝课题中去。如在对重要的凋亡负调控蛋白Bcl-2的研究中,Beham等利用基因毒性损害(genotoxic damage)诱导细胞凋亡,并以Bcl-2蛋白抑制其凋亡过程。用激光扫描共聚焦显微镜和Immunoblotting观察显示,Bcl-2的作用在于阻止了诱导产生的p53蛋白向核内的转运。而Ohsawa等对独立于caase家族的另一种重要蛋白酶—组织蛋白酶进行了研究,用血清剥夺法诱导PC12细胞凋亡,并用激光扫描共聚焦显微镜监测了其精细超微结构改变过程和细胞内组织蛋白酶B和D的免疫活度的对比变化。又如,在人胰岛淀粉样多肽(hIA)的研究中,Hiddinga等用表达hIA的质粒转染COS-1细胞诱导凋亡,辅以免疫组化染色,用激光扫描共聚焦显微镜证明了hIA在细胞的内质网和高尔基复合体内呈簇状沉积,并与细胞
中国科技网讯 从一个受精卵发育成多种功能的胚胎,细胞要经过上千次分裂和复杂的排列重组。据物理学家组织网6月3日报道,霍华德·休斯医学研究院珍妮莉娅法姆研究学院开发出一种最新的成像技术,能以前所未有的速度和精确度看到这一过程,让人们能追踪胚胎成形时每个细胞在几天甚至几小时内的变化。相关论文发表在6月3日出版的《自然·方法学》上。 研究人员演示了一段约20小时的果蝇胚胎发育视频。在视频中,生物结构逐渐出现,从一小团简单的细胞簇慢慢变长,变成上万个细胞紧紧挤在一起的拉长的小胚胎,然后在新形成的肌肉收缩舒张下开始颤动,此时胚胎仅有半毫米长。此外,论文中还有一段果蝇胚胎中枢神经系统完整的发育视频,跟踪了单个细胞发育出感觉器官、脑叶及其他结构的过程,由于分辨率足够高,还能看到神经轴突尖端迅速变化。 发明该技术的珍妮莉娅法姆研究学院的菲利普·凯勒说,要理解一个单细胞怎样变成了复杂的组织,真实看到这一过程非常重要。传统光学显微镜速度太慢,无法跟踪细胞在生命初期的迅速变化,也容易破坏一个活胚胎,只能通过把多阶段、多组织的照片拼在一起,才能推测发生的变化,但“细胞分裂重组每次都不一样,这种观察方法可能会产生误导”。 新技术基于一种高速非侵入式光学显微镜,称为SiMView光层显微镜,能从4个角度同时拍摄图像,不仅能跟踪细胞运动,还能对发展过程进行数量分析。该显微镜由凯勒小组和德国的欧洲分子生物实验室合作开发,攻克了传统光学显微镜的两个难题:一是光源对样本造成的伤害,二是对海量数据进行处理分析。 大部分光源都会伤害细胞,使其中的荧光标记消失。研究小组设计的照明技术是一种激光扫描层,一次照射样本极薄的一层以减少伤害,由探测仪记录下被照亮的部分。光层来自两个相反方向,并用两个探测仪来探测荧光,照明与探测相结合,提供了4个不同的观察角度。不仅能避免由于光散射而造成的模糊,还将图像采集速度提高了50倍。 要让照亮样本和探测荧光在时间、位置上协调一致,时机吻合极为重要,光层交叉通过会造成图像模糊,发光间隔仅几毫秒。为了保持精度,SiMView还安装了实时调节的电子系统。 显微镜每秒会收集350Mb的数据,一个样本一天要产生海量数据,而不同条件或不同基因的发育对比实验,所要求的数据比这还要多好多倍。为此,研究人员开发出一种新的计算方法,能识别并跟踪显微镜视频中单个细胞并自动分析。这些都构成了拍摄活样本这一完整技术框架的必要组成部分。 凯勒表示,他们还将继续改进显微镜使计算过程更加有效。今后不仅能追踪胚胎中细胞的一代代世系,还可能控制发育以探索发育机制,并研究其他更大更复杂样本的发育过程。(常丽君) 《科技日报》(2012-06-05 二版)
[quote]项目概况中国科学院动物研究所单细胞建库试剂盒采购项目 采购项目的潜在供应商应在北京市海淀区西直门北大街甲43号金运大厦B座1103室(西直门文慧桥西南角)。获取采购文件,并于2022年11月16日 14点00分(北京时间)前提交响应文件。[/quote][font=inherit]一、项目基本情况[/font]项目编号:HSZT2022HC/186项目名称:中国科学院动物研究所单细胞建库试剂盒采购项目采购方式:竞争性磋商预算金额:96.9193000 万元(人民币)最高限价(如有):96.9193000 万元(人民币)采购需求:1.1.4 采购内容:遴选1家供应商为采购人提供如下试剂采购[table][tr][td][align=center][font=inherit]包号[/font][/align][/td][td][align=center][font=inherit]采购试剂名称[/font][/align][/td][td][align=center][font=inherit]数量[/font][/align][align=center][font=inherit](台/套)[/font][/align][/td][td][align=center][font=inherit]最高投标限价[/font][/align][align=center][font=inherit](人民币:万元)[/font][/align][/td][td][align=center][font=inherit]是否允许采购进口产品[/font][/align][/td][td][align=center][font=inherit]项目用途[/font][/align][/td][/tr][tr][td][align=center]1[/align][/td][td][align=center]单细胞建库试剂盒[/align][/td][td][align=center]可做80个样本,含80次单细胞基因表达的全部试剂[/align][/td][td][align=center]96.9193[/align][/td][td][align=center]是[/align][/td][td][align=center]科研[/align][/td][/tr][/table][b][font=inherit]附件:采购内容及要求[/font][/b][align=center][font=inherit]单细胞建库试剂盒采购内容及要求[/font][/align][b][font=inherit]1.工作条件:参照中国科学院动物所实验室相关要求。[/font][font=inherit]2.试剂功能:[/font][/b]试剂盒可以完成80个反应的单细胞基因表达测序文库构建,提供从悬浮细胞到构建完成的测序文库的全部相关试剂。[b][font=inherit]3.技术指标:[/font][/b]#3.1 每份凝胶微珠反应试剂可以通过10x Genomics仪器在微流控芯片中为每个样本提供不少于200万个独立的液滴反应体系,凝胶微珠含有75万个独特的序列标签(每个标签由14个碱基构成);3.2 一张芯片实验可处理样本数量不少于8个。[font=inherit]#[/font]3.3 试剂捕获细胞的效率:在每份样本的细胞群体中捕获大于50%的细胞,每1000个捕获细胞中含有双细胞的比例低于0.8%;[font=inherit]#[/font]3.4 反应时间及通量:在30分钟内完成独立样本的细胞包裹裂解等过程,针对单个样本可同时完成1000-10000个细胞的制备;[font=inherit]#[/font]3.5 提供单细胞建库全部应用试剂;3.6 系统提供Illumina兼容测序文库;[font=inherit]#[/font]3.7 在100k reads/cell测序深度下,检测293T细胞的基因数量不少于3000个[font=inherit]*3.8[/font]试剂到货验收后,有效期不少于3个月。[b][font=inherit]4.产品配置要求[/font][/b]单细胞建库试剂盒:数量要求——可做80个样本,含80次单细胞基因表达的全部试剂[b][font=inherit]5.技术文件:[/font][/b]5.1 试剂详细配置清单、各项技术参数及技术证明文件。5.2 技术服务条款、技术培训条款及售后服务承诺。[b][font=inherit]6.报价方式:[/font][/b]以免税单价报价,对原产于美国的产品,进口时在正常的科创免税之外,中国政府加征的特殊关税由中标人承担。[b][font=inherit]7.延误到货处罚:[/font][/b]超过约定的时间到货或发货(非免税试剂在合同签订后1个月内到货,免税试剂在拿到免表通知后2周内发货),罚金为当批次货款的5%,之后每延后5个工作日,增加1%的当批次货款罚金,罚金不超过当批次货款的15% 。[font=inherit]8. [/font][font=inherit]订货数量:可做80个样本,含80次单细胞基因表达的全部试剂[/font][font=inherit]9.交货地点:[/font][font=inherit]中国科学院动物研究所用户指定地点[/font][font=inherit]。[/font][font=inherit]10.交货日期:非免税试剂在合同签订后1个月内到货,免税试剂在拿到免表通知后2周内发货。[/font]合同履行期限:非免税试剂在合同签订后1个月内到货,免税试剂在拿到免表通知后2周内发货。本项目( 不接受 )联合体投标。
急需高端二手基因检测和干细胞制备设备!!!可以联系王15373992769
流式细胞术是一项基于激光和免疫荧光的单细胞检测技术。当带有荧光标记的细胞或其它颗粒流动通过检测点时,激光与荧光素分子相互作用,产生的光信号可以定性或定量的表征细胞中被标记的成分。由于细胞的特异性主要由
求助各位大侠,有没有测过细胞的拉曼光谱。我们用的雷尼绍的仪器,785nm激发光,背景信号太强,一点细胞的信号都测不出,怀疑激光没有聚焦在细胞上。1. 细胞测量前要怎么处理?2. 细胞放在什么样的载玻片上测量,怎样减小背景影响?3. 仪器参数设置上有什么需要注意的么?怎样确定把光聚焦到细胞上?老板逼得紧,谢谢各位啊!
原标题 “纳米生物间谍”技术能进入活细胞取样 可用于深入揭示线粒体基因组变异的重要性 科技日报讯 据物理学家组织网近日报道,美国加利福尼亚大学圣克鲁兹分校(UCSC)研究人员开发出一种机器人式的“纳米生物间谍”系统,能从单个活细胞内提取出微量样本,进行RNA或DNA测序,而不会杀死细胞。研究人员表示,这种单细胞“纳米生物间谍”技术是一种了解活细胞内部动态过程的有力工具。相关论文发表在最近出版的美国化学协会《纳米》杂志上。 “我们能从活细胞中拿走一个‘生物间谍’,再把它送回该细胞,在几天内这样重复多次而不会杀死细胞。如果用其他技术,你不得不牺牲这个细胞才能分析它。”该生物传感与生物电技术小组负责人、UCSC巴斯金工程学院生物分子工程教授内德·波曼德说。 “纳米生物间谍”平台是研究小组用纳米吸液管开发的最新设备。纳米吸液管是一种小玻璃管,取液端越来越细,至尖端直径仅50到100纳米。波曼德说:“我能在实验室造出纳米吸液管,这不需要昂贵的纳米制造设备。但要进入一个细胞,问题是即使在高倍显微镜下,你也看不见吸液管尖端,不知道它偏离了细胞有多远。” 实验室博士后研究员亚当·赛格尔解决了这一问题。他基于在一台改造过的扫描离子电导显微镜(SICM),开发出一种反馈控制系统。该系统能利用通过纳米吸液管尖端的离子流作为反馈信号,在尖端接近细胞表面时探测其中的液滴。在尖端进入细胞之前,一种自动控制系统能定位它在细胞上面的位置,然后尖端很快插入穿透细胞膜,通过操控电压有控制地提取一小点细胞内物质。由于吸液管尖端极精细,对细胞造成的损害极微小。 研究小组用这种系统从活细胞中提取的微量细胞物质,估计只有50毫微微升(千万亿分之一升),约一个人体细胞百分之一的量。他们从单个人体癌细胞中提取物质并进行RNA测序,还从人类成纤维细胞中提取了线粒体并对其进行了DNA测序。“人们已经知道,线粒体和多种神经退化疾病有关。该技术可用于深入揭示线粒体基因组变异的重要性。”波曼德说。 该技术应用前景广阔。波曼德希望能与其他研究人员合作,探索其更多用途。“对于癌症生物学家、干细胞生物学家等想要了解细胞内部情况的科学家来说,这是一种多功能的平台。”(常丽君)来源:中国科技网-科技日报 2014年01月20日
定义:单细胞研究,就是针对单个细胞的研究,这是相对于群体细胞的研究。研究意义:细胞是生命活动的基本单位,研究细胞的结构功能及行为,有利于揭示复杂生命体的生命活动规律,探究生理生化现象,获得统计平均结果。然而,现代研究表明,单个细胞内的成分存在巨大差异,平均分析结果不能反映单个细胞内成分的真实情况,会带来误导信息。癌症等疾病总是从个别细胞的变异开始,极少量异常细胞信号会被群体信号所掩盖,不能及时获得有关病变的信息。另外,细胞间的信号传导,应激反应等活动在细胞内迅速发生,传统方法无法做到实时监测。对于数量较少且较为珍贵的细胞样本,如干细胞、元祖细胞及患者样本,传统分析方法需要大量的细胞样本,并不适宜。关于物质在细胞内的空间分布,亚细胞结构如细胞器的分析,传统方法也不能满足。这些都要求我们在一定范围内从单细胞水平研究细胞的生命活动。单细胞分析方法:毛细管电泳、微流控芯片、图像分析、动力学分析及纳米技术等。目前单细胞分析存在的难点:首先无论是针对一个特异性大分子,还是在OMIC水平上进行分子分析,都存在单细胞提取物数量少,难以分析的困难,这甚至可以说是不可能完成的,因此增加灵敏度势在必行。除此之外高通量分析也是一个瓶颈,要想获得单细胞分析确切的分析结果,研究人员必须快速而准确的分析多个细胞,这并不容易。另外单细胞分析也常常需要进行多种方式分析,这不仅是由于细胞存在于一种异质性环境汇总,而且也在同一时间,也需要测量多个参数。
激光扫描共聚焦显微镜是近十年发展起来的医学图像分析仪器,与传统的光学显微镜相比,大大地提高了分辨率,能得到真正具有三维清晰度的原色图像。并可探测某些低对比度或弱荧光样品,通过目镜直接观察各种生物样品的弱自发荧光。能动态测量Ca2+ 、pH值,Na+、Mg2+等影响细胞代谢的各种生理指标,对细胞动力学研究有着重要的意义。同时激光扫描共聚显微镜可以处理活的标本,不会对标本造成物理化学特性的破坏,更接近细胞生活状态参数测定。可见激光扫描共聚焦显微镜是普遍显微镜上的质的飞跃,是电子显微镜的一个补充,现已广泛用于荧光定量测量,共焦图像分析,三维图像重建、活细胞动力学参数分析和胞间通讯研究等方面,在整个细胞生物学研究领域有着广阔的应用前景。1. 定量荧光测量ACAS可进行重复性极佳的低光探测及活细胞荧光定量分析。利用这一功能既可对单个细胞或细胞群的溶酶体,线粒体、DNA、RNA和受体分子含量、成份及分布进行定性及定量测定,还可测定诸如膜电位和配体结合等生化反应程度。此外,还适用于高灵敏度快速的免疫荧光测定,这种定量可以准确监测抗原表达,细胞结合和杀伤及定量的形态学特性,以揭示诸如肿瘤相关抗原表达的准确定位及定量信息。2. 定量共聚焦图像分析借助于ACAS激光共焦系统,可以获得生物样品高反差、高分辨率、高灵敏度的二维图像。可得到完整活的或固定的细胞及组织的系列及光切片,从而得到各层面的信息,三维重建后可以揭示亚细胞结构的空间关系。能测定细胞光学切片的物理、生物化学特性的变化,如DNA含量、RNA含量、分子扩散、胞内离子等,亦可以对这些动态变化进行准确的定性、定量、定时及定位分析。3. 三维重组分析生物结构ACAS使用SFP进行三维图像重组,SFP将各光学切片的数据组合成一个真实的三维图像,并可从任意角度观察,也可以借助改变照明角度来突出其特征,产生更生动逼真的三维效果。4. 动态荧光测定Ca2+、pH 及其它细胞内离子测定,利用ACAS能迅速对样品的点,线或二维图像扫描,测量单次、多次单色、双发射和三发射光比率,使用诸如Indo-1、BCECF 、Fluo-3等多种荧光探针对各种离子作定量分析。可以直接得到大分子的扩散速率,能定量测定细胞溶液中Ca2+对肿瘤启动因子、生长因子及各种激素等刺激的反应,以及使用双荧光探针Fluo-3和CNARF进行Ca2+和pH的同时测定。5. 荧光光漂白恢复(FRAP)——活细胞的动力学参数荧光光漂白恢复技术借助高强度脉冲式激光照射细胞某一区域,从而造成该区域荧光分子的光淬灭,该区域周围的非淬灭荧光分子将以一定速率向受照区域扩散,可通过低强度激光扫描探测此扩散速率。通过ACAS可直接测量分子扩散率、恢复速度,并由此而揭示细胞结构及相关的机制。6. 胞间通讯研究动物细胞中由缝隙连接介导的胞间通讯被认为在细胞增殖和分化中起非常重要的作用。ACAS可用于测定相邻植物和动物细胞之间细胞间通讯,测量由细胞缝隙连接介导的分子转移,研究肿瘤启动因子和生长因子对缝隙连接介导的胞间通讯的抑制作用,以及胞内Ca2+、PH和cAMP水平对缝隙连接的调节作用。7. 细胞膜流动性测定ACAS设计了专用的软件用于对细胞膜流动性进行定量和定性分析。荧光膜探针受到极化光线激发后,其发射光极性依赖于荧光分子的旋转,而这种有序的运动自由度依赖于荧光分子周围的膜流动性,因此极性测量间接反映细胞膜流动性。这种膜流动性测定在膜的磷脂酸组成分析、药物效应和作用位点,温度反应测定和物种比较等方面有重要作用。8. 笼锁-解笼锁测定许多重要的生活物质都有其笼锁化合物,在处于笼锁状态时,其功能被封闭,而一旦被特异波长的瞬间光照射后,光活化解笼锁,使其恢复原有活性和功能,在细胞的增值、分化等生物代谢过程中发挥功能。利用ACAS可以人为控制这种瞬间光的照射波长和时间,从而达到人为控制多种生物活性产物和其它化合物在生物代谢中发挥功能的时间和空间作用。9. 粘附细胞分选ACAS是目前唯一能对粘附细胞进行分离筛选的分析细胞学仪器,它对培养皿底的粘附细胞有两种分选方法: ① Coolie-CutterTM法,它是Meidian公司专利技术,首先将细胞贴壁培养在特制培养皿上,然后用高能量激光的欲选细胞四周切割成八角形几何形状,而非选择细胞则因在八角形之外而被去除,该分选方式特别适用于选择数量较少诸如突变细胞、转移细胞和杂交瘤细胞,即使百万分之一机率的也非常理想。 ② 激光消除法,该方法亦基于细胞形态及荧光特性,用高能量激光自动杀灭不需要的细胞,留下完整活细胞亚群继续培养,此方法特别适于对数量较多细胞的选择。10. 细胞激光显微外科及光陷阱技术借助ACAS可将激光当作“光子刀”使用,借此来完成诸如细胞膜瞬间穿孔、切除线粒体、溶酶体等细胞器、染色体切割、神经元突起切除等一系列细胞外科手术。通过ACAS光陷阱操作来移动细胞的微小颗粒和结构,该新技术广泛用于染色体、细胞器及细胞骨架的移动。
[font=宋体]流式细胞术,作为一种先进的生物技术,已经在生物医学研究中占据了举足轻重的地位。这种技术以其高精度、高速度以及多参数同时检测的能力,广泛应用于细胞生物学、免疫学、肿瘤学等多个领域。流式细胞术不仅可以对单个细胞进行多参数定量分析和分选,还能够对细胞内部的蛋白质、核酸、细胞受体以及细胞表面抗原等进行检测。因此,它在疾病诊断、药物筛选、细胞功能研究等方面具有广泛的应用前景。本文将对流式细胞术的检测原理、应用领域以及发展前景进行详细介绍,旨在为读者提供对这一技术全面而深入的了解。流式细胞术可以检测什么?下面是具体检测信息及应用:[/font][font=宋体] [/font][b][font=宋体][font=Calibri]1.[/font][font=宋体]细胞表型检测[/font][/font][/b][font=宋体]免疫细胞表型是流式细胞术最突出应用。[/font][font=宋体][font=宋体]通过检测免疫细胞群的表面或细胞内标志物,对其进行鉴定和表征。流式细胞术能够精确鉴定和分类免疫细胞群,例如[/font] [font=Calibri]T [/font][font=宋体]细胞、[/font][font=Calibri]B [/font][font=宋体]细胞、[/font][font=Calibri]NK [/font][font=宋体]细胞、树突状细胞、单核细胞、巨噬细胞、血小板和粒细胞等。[/font][/font][font=宋体] [/font][font=宋体]研究人员可以识别和量化异质群体中的各种免疫细胞亚群。[/font][font=宋体] [/font][font=宋体][font=宋体]临床医生可以诊断和监测各种血液系统疾病、进行免疫免疫评估([/font][font=Calibri]8[/font][font=宋体]大类免疫细胞构成与肿瘤预后)。[/font][/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体][font=Calibri]2.[/font][font=宋体]细胞活力检测[/font][/font][/b][font=宋体] [/font][font=宋体]流式细胞术能够定量测量群体内和体外培养的活细胞和非活细胞。[/font][font=宋体] [/font][font=宋体]通过使用选择性标记活细胞或死细胞的荧光染料,流式细胞术可以提供精确可靠的活力测定,有助于确定细胞活力百分比。[/font][font=宋体] [/font][font=宋体]流式细胞术可以根据特定的标志物或染料区分活细胞、凋亡细胞和坏死细胞,从而更详细地了解细胞的健康和状态。通过将活力染料与细胞表面抗原、细胞内蛋白或功能测定的标记物相结合,研究人员可以在特定细胞类型或实验条件下获得有关细胞活力及其发生机制的全面信息。[/font][font=宋体] [/font][font=宋体]最常用的活性检测染料[/font][font=宋体] [/font][font=宋体][font=宋体]死细胞:碘化丙啶([/font] [font=Calibri]propidium iodide[/font][font=宋体],[/font][font=Calibri]PI[/font][font=宋体])和[/font][font=Calibri]7-AAD[/font][font=宋体],与[/font][font=Calibri]DNA[/font][font=宋体]结合,但只能进入膜受损的细胞,使死细胞发出荧光。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]凋亡细胞:[/font][font=Calibri]annexin V[/font][font=宋体]:对磷脂酰丝氨酸具有强结合亲和力的蛋白质,在细胞凋亡的早期阶段暴露在质膜的外表面[/font][font=Calibri]annexin V+PI[/font][font=宋体]是常用区分凋亡细胞和坏死细胞的组合。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]活细胞:[/font][font=Calibri]calcein AM[/font][font=宋体]、[/font][font=Calibri]CFDA[/font][font=宋体]([/font][font=Calibri]carboxyfluorescein diacetate[/font][font=宋体])、[/font][font=Calibri]FDA [/font][font=宋体]([/font][font=Calibri]fluorescein diacetate[/font][font=宋体]) :进入活细胞,但只有在与细胞内酶相互作用时才会发出荧光[/font][/font][font=宋体] [/font][font=宋体][font=宋体]细胞体内增殖:[/font][font=Calibri]CFSE(CFDA-SE)[/font][font=宋体]穿透细胞膜,在活细胞内与胞内蛋白共价结合,水解后释放出绿色荧光。在细胞分裂增殖过程中,它的荧光强度会随着细胞的分裂而逐级递减,标记荧光可平均分配至两个子代细胞中,因此其荧光强度是亲代细胞的一半,根据这一特性,它可被用于检测细胞增殖,细胞周期的估算及细胞分裂等方面。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]3.[/font][font=宋体]细胞周期分析[/font][/font][/b][font=宋体] [/font][font=宋体]从流式细胞术的早期开始,细胞周期分析就成为有价值的应用。[/font][font=宋体] [/font][font=宋体]原理是基于荧光和核酸的量之间的关系。[/font][font=宋体] [/font][font=宋体][font=宋体]常用核酸结合染料:碘化丙啶([/font][font=Calibri]PI[/font][font=宋体]),[/font][font=Calibri]Hoechst[/font][font=宋体],[/font][font=Calibri]DAPI[/font][font=宋体],[/font][font=Calibri]7-AAD[/font][font=宋体],溴化乙锭等。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]流式细胞术细胞周期分可以有很多方面的应用,例如,[/font][font=Calibri]DNA/Ki67[/font][font=宋体]测定可以将表型选择与细胞周期分析相结合,用于监测[/font][font=Calibri]p53[/font][font=宋体]细胞周期停滞,评估抗癌活,多药耐药性等。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]4.[/font][font=宋体]离子通道测定[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]钙作为关键的第二信使,在许多细胞信号通路中起着至关重要的作用。它在免疫细胞活化中尤为重要,包括[/font][font=Calibri]T[/font][font=宋体]细胞、[/font][font=Calibri]B[/font][font=宋体]细胞和[/font][font=Calibri]NK[/font][font=宋体]细胞。[/font][/font][font=宋体]此外,钙信号传导还参与肥大细胞脱颗粒、神经元兴奋性、突触传递和神经递质释放至关重要。[/font][font=宋体] [/font][font=宋体][font=宋体]细胞脱颗粒的早期测量值是通过使用钙离子载体[/font][font=Calibri]A23187[/font][font=宋体]的流式细胞术确定的。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]常用荧光染料:[/font][font=Calibri]fluo-3 [/font][font=宋体]和[/font][font=Calibri]indo-1[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]虽然[/font][font=Calibri]Ca2+[/font][font=宋体]通道测量是最常见的应用之一,但其他离子如镁、钾、钠和氢也可以使用流式细胞术进行监测。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]5.[/font][font=宋体]细胞功能检测[/font][/font][/b][font=宋体]最早的检测是细胞酯酶。[/font][font=宋体] [/font][font=宋体][font=宋体]使用响应氧化态变化的活性染料检测粒细胞的氧化电位。例如,氢乙啶([/font][font=Calibri]hydroethidine[/font][font=宋体])用于中性粒细胞呼吸爆发。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]二乙酸二氯荧光素([/font][font=Calibri]dichlorofluorescein diacetate[/font][font=宋体]),已被用于吞噬细胞功能研究。[/font][/font][font=宋体] [/font][font=宋体]效应细胞杀伤功能,是流式细胞术的另外一个重要应用。[/font][font=宋体] [/font][font=宋体]细胞因子是免疫细胞功能的重要执行分子,对科学研究,免疫细胞治疗,临床诊疗都及其关键。基于流式细胞术开发的多重细胞因子检测,已经有广泛应用。[/font][font=宋体] [/font][b][font=宋体][font=Calibri]6.[/font][font=宋体]蛋白质工程[/font][/font][/b][font=宋体] [/font][font=宋体]流式细胞术和分选传统上不是蛋白质工程中最常用的技术之一。然而,近年来,在该领域的应用越来越多。[/font][font=宋体] [/font][font=宋体][font=宋体]流式细胞术被用于酶学蛋白质研究,包括细胞色素[/font][font=Calibri]P450[/font][font=宋体]、葡萄糖氧化酶、几丁质酶、纤维素酶、过氧化物酶、酯酶、转移酶、β半乳糖苷酶、硫代内酯酶等。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]蛋白质工程,包括在基因水平上引入突变(随机或特异性),以创建由数千到数百万个单个蛋白质变体组成的文库(如上图),使用流式细胞术[/font] [font=宋体]每天能够分析多达[/font] [font=Calibri]10^8[/font][font=宋体]–[/font][font=Calibri]10^9 [/font][font=宋体]个克隆,并对具有所需特性的克隆进行分类。[/font][/font][b][font=宋体] [/font][font=宋体][font=Calibri]7.[/font][font=宋体]哺乳动物细胞和细菌细胞分选[/font][/font][/b][font=宋体] [/font][font=宋体]细胞分选是流式细胞的重要应用之一,哺乳动物细胞相对成熟,不做赘述。细菌细胞方面的应用,也逐渐开始建立。[/font][font=宋体] [/font][font=宋体]与耗时的传统琼脂铺板检测方法相比,流式分选可以快速检测和分选悬浮液中的单个细菌细胞。[/font][font=宋体] [/font][font=宋体]尽管细胞分选仪具有高性能,但它们在微生物学中的应用一直受到限制。[/font][font=宋体] [/font][font=宋体]这主要是由于微生物体积小,因此很难将它们与培养基中的细胞碎片或背景颗粒区分开来。另一个潜在的问题是,通常没有细菌菌株特有的抗体。[/font][font=宋体] [/font][font=宋体][font=宋体]限制细胞分选仪在细菌检测和分选中的适用性的其他因素主要与分选仪硬件功能本身有关,在流式细胞术仪器的早期,数量有限的激光器和检测器,限制一次只能使用一种或两种荧光染料。随着最新仪器的发展,多激光器和检测起的仪器被开发:包括赛默飞世尔的[/font][font=Calibri]Bigfoot[/font][font=宋体]光谱细胞分选仪,[/font][font=Calibri]BD FACSAria III[/font][font=宋体]分选仪,索尼[/font][font=Calibri]MA900[/font][font=宋体]细胞分选仪和贝克曼库尔特的[/font][font=Calibri]MoFlo Astrios EQ[/font][font=宋体]等。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]此外,部分致病性细菌,需要在[/font][font=Calibri]BSL2[/font][font=宋体]以上的实验环境下进行,现在部分流式细胞术带有[/font][font=Calibri]BSL 2 hood[/font][font=宋体]。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]8.[/font][font=宋体]液滴微流体[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]液滴微流体是一个相对较新的领域,专注于皮升体积中含有细胞或[/font][font=Calibri]DNA[/font][font=宋体]的离散液滴的形成,操作和分析,应用于生物学、化学、材料科学和医学。[/font][/font][font=宋体] [/font][font=宋体]在生物学中,液滴微流体可实现单细胞分析、生物分子的高通量筛选、细胞异质性研究和药物发现。[/font][font=宋体] [/font][font=宋体][font=宋体]流式细胞术分析是研究单细胞的强大技术,可提供有关各种参数的宝贵信息。然而,它的测量仅限于直接连接到细胞的分子,例如表面或细胞内标记物,限制研究由细胞分泌或由[/font][font=Calibri]DNA[/font][font=宋体]分子产生但不物理附的分子。液滴微流体提供了一种克服这一限制的新方法。将细胞或[/font][font=Calibri]DNA[/font][font=宋体]封装在单个液滴中会产生离散的区室,从而能够分析由封装实体释放或产生的化合物。[/font][/font][b][font=宋体] [/font][font=宋体][font=Calibri]9.[/font][font=宋体]下一代生物制剂[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]生物制药已经占据了药物市场的重要份额,包括治疗性蛋白质([/font][font=Calibri]65%[/font][font=宋体]),疫苗([/font][font=Calibri]20%[/font][font=宋体])等。通过测序([/font][font=Calibri]NGS[/font][font=宋体])进行单[/font][font=Calibri]B[/font][font=宋体]细胞库分析和克隆扩增鉴定,直接从人类幸存者克隆免疫球蛋白基因,分离出高亲和力中和抗体,加快了单克隆抗体药物的研发,然而,这种方法比较昂贵,且依旧需要后续的功能验证等。新策略可使用流式细胞术、[/font][font=Calibri]MACS[/font][font=宋体]或微流体将单细胞分离与功能筛选相结合,降低开发成本并消除失败的候选药物,是流式细胞术新的应用开发方向。[/font][/font][font=宋体] [/font][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/flow-cytometry-service][b]流式细胞检测技术服务[/b][/url],拥有[/font][font=宋体][font=宋体]①具有 [/font][font=Calibri]20,000 [/font][font=宋体]次以上流式抗体筛选鉴定经验及多年流式诊断抗体研发经验,在实验方案设计、样品制备、数据分析等方面确保科学性、准确性和可靠性[/font][font=Calibri] [/font][/font][font=宋体][font=宋体]②拥有 [/font][font=Calibri]1,000 [/font][font=宋体]余株自产精品流式抗体,覆盖细胞膜、胞内、核内及分泌抗原;[/font][/font][font=宋体][font=宋体]③自产 [/font][font=Calibri]Annexin V/7-AAD [/font][font=宋体]凋亡检测试剂盒,并储备多种流式检测常用试剂,大大节约购买试剂的等待时间和实际费用;[/font][/font][font=宋体][font=宋体]④可以提供近 [/font][font=Calibri]200 [/font][font=宋体]种细胞系选择,省去细胞样本寄送过程中的风险,并可以免费提供健康人外周血细胞对照品。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/flow-cytometry-service[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b][font=宋体] [/font][font=Calibri] [/font]
[size=15px][color=#333333]细胞的机械特性对其生物学功能(如增殖、分化和凋亡)和形态状态(如迁移、附着和病理状态)至关重要。目前常用的细胞弹性模量测量技术包括原子力显微镜、微管吮吸、光镊和磁镊等。这些技术可以有效测量单个细胞的机械性质,但是通量低,限制了其实际应用。[/color][/size][size=15px][color=#333333]近年来,微流控芯片因其在小体积液体操控方面的独特优势,也被用于测量细胞弹性模量。现有的微流控芯片主要侧重于平台开发,虽然通量大幅提高,但很少将测量后的细胞进一步收集以实现后续分析。[/color][/size][size=15px][color=#333333]单细胞分析技术的发展要求能够准确地打印单个细胞。传统单细胞打印技术包括荧光激活细胞分选、有限稀释和手动细胞挑选,这些方法打印效率较低且难以实现自动化。[/color][/size][font=mp-quote, -apple-system-font, BlinkMacSystemFont, &][size=15px][color=#333333]近年来,各种微流控技术被开发用于高通量精确打印单个细胞,如喷墨打印、精确分配、双阀门筛选和移液管式单细胞分离等。这些技术可以根据目标细胞的荧光、形态等特征进行识别并打印,但是大多技术难以获得单细胞的机械信息。[/color][/size][/font][font=mp-quote, -apple-system-font, BlinkMacSystemFont, &][size=15px][color=#333333]因此,本研究报道了一款基于 U 型阵列的微流控系统,集成了单细胞连续捕获,弹性测量和可寻址打印。该装置在研究细胞力学与其他生物学特性的关系方面具有强大的应用潜力。[/color][/size][/font][b]研究内容[/b][size=15px]近日,哈尔滨工业大学(深圳)[color=#004976][b]陈华英课题组[/b][/color]在英国皇家化学会(RSC)期刊[color=#004976][b] Lab on a chip[/b][/color] 上发表题为“Continuous trapping, elasticity measuring and deterministic printing of single cells using arrayed microfluidic traps” ([color=#007aaa]《单细胞连续捕获、弹性模量测量和可寻址分选打印》[/color])的研究论文,报道了一款创新的微流控芯片,实现了基于精确调节的压力对微球/细胞进行捕获和逐个打印,并将已知弹性模量的单细胞确定性地打印到孔板中(图 1)。[/size][size=15px]该论文第一作者是哈工大(深圳)在读硕士研究生[color=#004976][b]蔡逸珂[/b][/color]和硕士毕业生[color=#004976][b]余恩[/b][/color]。[color=#004976][b]陈华英副教授[/b][/color]为通讯作者。[/size][img=图片]https://img1.17img.cn/17img/images/202403/uepic/b3ebc9a4-6d42-4ef1-bfd0-c7cf1f5c3a15.jpg[/img]微流控芯片(图 1A)由冲洗入口、样品入口、打印入口、压力维持口和两个平行的主通道组成,下游有打印出口。在所有入口通道中设计了宽度从 200μm 减小到 25μm 的微通道阵列,以过滤介质中较大的颗粒/细胞碎片。如图 1A 和 B 所示,在每个主通道的一侧有 16 个 U 型捕获陷阱,且吮吸通道的高度比分流通道的高度低 15 μm,以保证细胞停留在 U 型陷阱中并诱导其微小变形。[img=图片]https://img1.17img.cn/17img/images/202403/uepic/b3ee5e4c-b99c-4b5e-8904-b5a6d2817633.jpg[/img][table=677][tr][td=1,1,5]▲[/td][td=1,1,549][b]图1[/b] 单细胞连续捕获、弹性测量和可寻址打印系统。(A)微流控芯片连接到压力泵,将单细胞精确分配到孔板中;(B)通过调节打印压力(Po)捕获(Pi-Po0)和释放(Pi-Po0)单个细胞的机制;(C)用于捕获和分离细胞的吮吸通道;(D)用于捕获和分离微球的分流通道。[/td][/tr][/table][来源:陈华英团队 RSC英国皇家化学会][align=right][/align]
【背景】CIK是“Cytokine-Induced Killer Cells”的缩写,中文全称为“细胞因子诱导的杀伤细胞”。 CIK是单个核细胞在CD3单抗和多种细胞因子(包括IFN-g, IL-2等)的作用下培养获得的一群以CD3+CD56+细胞为主要效应细胞的异质细胞群, 其既具有T淋巴细胞强大的抗肿瘤活性,又具有NK细胞(自然杀伤细胞)的非MHC(主要组织相容性抗原)限制性肿瘤杀伤能力。CIK细胞具有杀瘤活性高、杀瘤谱广,对正常组织毒性低,体外可高度扩增等特点,是目前临床上广泛使用的过继性免疫治疗细胞。【培养原理】CIK培养用细胞因子和抗体:nCD3激发型单抗:T细胞活化的第一信号来自于T细胞表面的受体,即T细胞抗原受体(T cell antigen receptor, TCR)与APC提呈的抗原的特异性结合,也就是T细胞对抗原的特异性识别。TCR是由2条不同肽链构成的异二聚体,在T细胞表面,其与CD3分子通过非共价键结合,形成TCR/CD3复合体。TCR识别特异性抗原后会引起CD3和T细胞表面的辅助受体CD4或CD8分子的胞浆尾部聚集,进而激活与胞浆尾部相连的酪氨酸激酶(Lck, Fyn和ZAP-70等),促使CD3分子胞浆区的免疫受体酪氨酸活化基序(immunoreceptor tyrosine-based activation motif, ITAM)中的酪氨酸(Y)磷酸化。磷酸化的酪氨酸(pY)进一步磷酸化下游含酪氨酸的蛋白,从而引起激酶活化的级联反应(磷脂酰肌醇途径或MAP激酶途径等),最终通过激活转录因子,使其进入细胞核内,结合于调控T细胞增殖和活化的靶基因(如IL-2和IFN-g等),引起基因的表达和转录,T细胞因而由静止状态转为增殖和活化状态。由上可见,CD3分子在T细胞活化信号的转导中起着极其关键的作用。CD3激发型单抗与T细胞表面CD3分子特异性结合后,可引起CD3分子胞浆区ITAM基序中酪氨酸的磷酸化,进而导致T细胞增殖和活化的下游信号的激活,从而使T细胞增殖和活化。也就是说,CD3激发型单抗能够模拟抗原与TCR/CD3复合物的识别和激活过程,从而引起T细胞的增殖与活化,因此是CIK细胞培养中不可或缺的刺激因素。此外,CD3激发型单抗在选用时一定要注意克隆号。研究表明,仅克隆号为OKT-3的CD3激发型单抗可以刺激所有人的T细胞的增殖,而其它克隆号的CD3激发型单抗仅能刺激一部分人的T细胞。因此,在进行CIK培养时,最好选用OKT-3克隆,以保证每个患者的T细胞均能被激活。nIL-2 (白细胞介素-2)IL-2最初发现时被称为T细胞生长因子(T cell growth factor, TCGF),是引起T细胞增殖最重要的细胞因子。IL-2既是自分泌细胞因子,也是旁分泌细胞因子,其通过与T细胞表面的IL-2受体(IL-2R)的特异性结合而促使T细胞活化,并进入细胞分裂状态。此外,IL-2还可刺激NK细胞的生长并增强其杀伤能力。因此CIK细胞培养中须添加IL-2,以促进T细胞的增殖与活化。nIFN-g (干扰素-g)IFN-g 具有上调外周血淋巴细胞表面IL-2R表达的作用,因此会增强T细胞对IL-2促增殖反应的敏感度和强度。在诱导CIK细胞形成的过程中加入IFN- g ,可降低IL-2的用量。研究发现,IFN-g加入的顺序与CIK的细胞毒活性密切相关。先加入IFN- g,培养24后再加入IL-2,可明显提高CIK的细胞毒活性。nIL-1a(白细胞介素-1a)IL-1a也可以介导外周血淋巴细胞表面上调表达IL-2R。当IL-1a与IFN-g和激发型CD3单抗合用时,可以明显提高CIK 的细胞毒作用。【细胞制备】1.外周血单个核细胞的采集1.1用血细胞分离机采集患者自身的外周血单个核细胞50-100mL;1.2淋巴细胞分离液密度梯度离心法进一步纯化单个核细胞(PBMC);1.3无血清培养液洗涤2次,获得纯度在90%以上的PBMC。2.CIK细胞的培养及鉴定2.1将PBMC按1-2 x 106/ml的浓度悬浮于无血清培养液中,加入1,000 U/ml 的重组人IFN-g,37oC,5%CO2培养箱中培养;2.224h 后加入50ng/ml 的CD3 单克隆抗体和300 U/ml 的重组人IL-2,刺激CIK 细胞的生长和增殖;注:此时也可同时加入100 U/ml的重组人IL-1a。2.3每3天半量换液或扩瓶一次,并补加重组人IL-2 300 U/ml;2.4在培养的第14d,收获CIK细胞。2.5CIK细胞质控:2.9.1台盼蓝染色检测:活细胞应在80%以上;2.9.2流式细胞仪检测细胞表面CD3、CD8、CD56等分子的表达:CD3+CD56+细胞的比例应在20%以上。2.9.3细胞杀伤实验:以CIK细胞为效应细胞,以肿瘤细胞(可为原代肿瘤细胞或肿瘤细胞株)为靶细胞,将效应细胞与靶细胞按10 : 1(数目比) 的比例加入96 孔U 型板中,每孔含靶细胞1 x 104个,终体积为200 ml,设3个复孔。培养4h,然后取培养上清,用乳酸脱氢酶(LDH) 试剂盒检测效应细胞对靶细胞的杀伤率。2.9.4收获细胞前,取少量培养物进行细菌、真菌培养,并检测支原体、衣原体,及内毒素(标准:病原学检测阴性,内毒素5 Eu)。【步骤简图】http://img.dxycdn.com/trademd/upload/userfiles/image/2013/04/B1366873006_small.jpg 【推荐试剂】http://img.dxycdn.com/trademd/upload/userfiles/image/2013/04/B1366873008_small.jpg 注:Animal Free意为无动物成分。无动物成分的重组细胞因子在生产过程中不会有任何动物源性物质,尤其是牛蛋白的混入,使得最终获得的重组人蛋白中不含任何动物成分。这样可避免动物病原体(如疯牛病,克雅氏病等)的污染及外源蛋白引起的机体异种排斥和过敏反应,因此细胞治疗的体外细胞培养过程中最好使用无动物成分的重组细胞因子。【其它相关试剂】 http://img.dxycdn.com/trademd/upload/userfiles/image/2013/04/B1366873009_small.jpg【参考文献】 Li R, Wang C, et al. Autologous cytokine-induced killer cell immunotherapy in lung cancer: a phase II clinical study. Cancer Immunol Immunother. 2012; 61:2125-2133
记者5月26日从南开大学获悉,该校物理科学学院田建国、刘智波研究组利用全内反射下石墨烯对介质折射率异常敏感的光学现象,实现了超灵敏单细胞实时流动传感。这一成果可以使癌细胞在形成之初即被精确“光测”出来,将为癌症预防提供一条新途径。 石墨烯是一种呈蜂巢状排列的单层碳原子结构,是目前已知的最薄、最坚硬的纳米材料。在全内反射这种特殊的结构下,对于介质折射率异常灵敏是石墨烯材料的重要特性之一。田建国、刘智波领导的研究组发现,折射率的灵敏度与石墨烯的层数有极大关系,并且层数有一个最优值。他们通过与南开大学化学学院陈永胜课题组合作,不断控制石墨烯的层数,最终制出厚度为8个纳米的石墨烯材料,其折射率的灵敏度和分辨率达到目前国际上最高水平。 在此基础上,课题组结合微流体技术和病变细胞的折射率差异,将这一超高的折射率灵敏度成功应用于单细胞传感。记者在实验室看到,实验人员将制备出的8纳米厚石墨烯均匀铺于一块三棱镜的一面,紧贴石墨烯上方建有一条细胞通道。实验时,一束光从棱镜一面射入,穿透石墨烯照射在细胞通道上,反射光从棱镜另一面射出。实验人员通过光电转化,即可得到一份波形图。如果细胞通道中存在癌细胞,则波形图上将会呈现出明显的波峰。即使数千个正常细胞中有一个发生了病变,这种“光测”方法都可以将其准确识别出来。 该课题组论文已在国际纳米科学技术领域权威刊物《Nano Letters》上发表,美国著名的纳米技术与纳米科学网进行了同步报道。
[font=宋体]目前有多种方法可用于开发单克隆抗体。杂交瘤技术是经典的抗体开发技术,但效率相对较低,而且容易丢失抗体的多样性。噬菌体展示技术广泛用于单抗开发,但容易丢失抗体的天然配对信息。[/font][font=宋体][font=宋体]一般认为,在抗体开发中,保留[/font][font=Calibri]B[/font][font=宋体]细胞的天然[/font][font=Calibri]VH[/font][font=宋体]和[/font][font=Calibri]VL[/font][font=宋体]配对是十分重要的。近年来兴起的单个[/font][font=Calibri]B[/font][font=宋体]细胞技术保留了轻重链可变区的天然配对,具有简单快捷、所需细胞数量较少、效率高等优势。该技术通过直接扩增单[/font][font=Calibri]B[/font][font=宋体]细胞的[/font][font=Calibri]VH[/font][font=宋体]和[/font][font=Calibri]VL[/font][font=宋体]编码基因,是一种从人和免疫动物中制备单克隆抗体的有力技术。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]利用单[/font][font=Calibri]B[/font][font=宋体]细胞分选平台,义翘神州可向全球客户提供单[/font][font=Calibri]B[/font][font=宋体]细胞抗体制备服务,整个过程涉及单[/font][font=Calibri]B[/font][font=宋体]细胞分离、测序、克隆和单[/font][font=Calibri]B[/font][font=宋体]细胞抗体筛选等步骤。[/font][/font][font=宋体] [/font][font=宋体][b][font=宋体]单[/font][font=Calibri]B[/font][font=宋体]细胞抗体发现的工作流程[/font][/b][/font][font=宋体] [font=Calibri]1[/font][font=宋体])单个[/font][font=Calibri]B[/font][font=宋体]细胞的分离[/font][/font][font=宋体] [/font][font=宋体][font=宋体]从外周血或淋巴组织中分离单[/font][font=Calibri]B[/font][font=宋体]细胞,有随机分离和抗原特异性分离两种方式。随机[/font][font=Calibri]B[/font][font=宋体]细胞分离,可通过显微操作、激光捕获显微切割和荧光激活细胞分选([/font][font=Calibri]FACS[/font][font=宋体])等进行细胞挑选。抗原特异性分离可通过抗原包被磁珠、多参数[/font][font=Calibri]FACS[/font][font=宋体]的荧光素标记抗原、溶血斑块实验和荧光焦点法等方法进行抗原特异性[/font][font=Calibri]B[/font][font=宋体]细胞的筛选。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]利用[/font][font=Calibri]FACS[/font][font=宋体]技术,可以根据特定细胞表面标志物的表达模式,明确区分待分选[/font][font=Calibri]B[/font][font=宋体]细胞的发育和分化阶段,几乎任何阶段的[/font][font=Calibri]B[/font][font=宋体]细胞都可以分选。为了有效获得特异性抗体,必须评估供体的免疫应答,例如,在单细胞分离之前,使用酶联免疫斑点技术([/font][font=Calibri]ELISPOT[/font][font=宋体])测定外周血中抗体特异性细胞([/font][font=Calibri]ASC[/font][font=宋体])的丰度,从而选择含抗原特异性抗体浓度较高的血样进行后续抗体制备。[/font][/font][font=宋体] [/font][font=宋体] [font=Calibri]2[/font][font=宋体])单[/font][font=Calibri]B[/font][font=宋体]细胞抗体的测序和克隆[/font][/font][font=宋体] [/font][font=宋体][font=宋体]通常在[/font][font=Calibri]96[/font][font=宋体]孔板上进行单细胞的[/font][font=Calibri]cDNA[/font][font=宋体]合成。全长[/font][font=Calibri]Ig[/font][font=宋体]基因转录产物通过巢式或半巢式[/font][font=Calibri]RT-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]进行扩增。通常情况下,对抗体重链轻链可变区不同前导序列设计前向引物的混合物,反向引物特异性互补于抗体恒定区。某些情况下,如果分离和扩增不同同种型的抗体,反向引物则是特异性互补于各种同种型抗体恒定区的混合物。表达载体可直接转染至哺乳动物细胞中,用于单克隆抗体的体外表达。[/font][/font][font=宋体] [/font][font=宋体] [font=Calibri]3[/font][font=宋体])抗体的表达和筛选[/font][/font][font=宋体] [/font][font=宋体][font=宋体]鉴定抗体或片段的抗原特异性和生物活性之前,需将携带有抗体基因的表达载体在相应系统中表达。最简单和最常见表达系统是原核系统(例如大肠杆菌),而哺乳动物细胞系统(例如[/font][font=Calibri]HEK 293[/font][font=宋体]、[/font][font=Calibri]CHO[/font][font=宋体]细胞)更有利于抗体的翻译后修饰,主要是瞬时表达或稳定表达。在[/font][font=Calibri]E. coli[/font][font=宋体]中,通常抗体基因表达为抗原结合片段([/font][font=Calibri]Fab[/font][font=宋体])的形式,而在哺乳动物细胞中,以完整的[/font][font=Calibri]IgG[/font][font=宋体]形式表达。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/single-b-cell-antibody-service][b]单个[/b][/url][/font][font=Calibri][url=https://cn.sinobiological.com/services/single-b-cell-antibody-service][b]B[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/services/single-b-cell-antibody-service][b]细胞抗体服务[/b][/url],包含:流式单[/font][font=Calibri]B[/font][font=宋体]细胞服务和基于[/font][font=Calibri]Beacon[/font][font=宋体]平台的单[/font][font=Calibri]B[/font][font=宋体]细胞抗体开发,更多详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/single-b-cell-antibody-service[/font][/font][font=宋体] [/font][font=宋体][font=宋体]文章来源:[url=https://cn.sinobiological.com/resource/antibody-technical/single-b-cell-technology][b]单[/b][/url][/font][font=Calibri][url=https://cn.sinobiological.com/resource/antibody-technical/single-b-cell-technology][b]B[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/resource/antibody-technical/single-b-cell-technology][b]细胞抗体技术[/b][/url]:[/font][font=Calibri]https://cn.sinobiological.com/resource/antibody-technical/single-b-cell-technology[/font][/font][font=Calibri] [/font]
新浪科技讯 据国外媒体13日报道,英国兰卡斯特大学的科学家研发出一种非侵入式激光检测手段,可预测一个人的死亡时间。这种检测设备将采用腕表形设计,利用激光束分析毛细血管衬里细胞,旨在鼓励用户选择和保持健康的生活方式。http://i1.sinaimg.cn/IT/2013/0814/U2550P2DT20130814102920.jpg英国兰卡斯特大学的科学家研发出一种非侵入式激光检测手段,可预测一个人的死亡时间 发明人表示血管衬里细胞是一种内皮细胞,同时也是一个人健康状况的关键指示器。通过对这些细胞进行监测,便可以确定哪些人的衰老速度超过正常水平。检测之后,用户便可了解自己还有多长寿命。例如,这种检测设备会告诉用户,如果不改变当前的生活方式,他们将在20年内死亡。此外,这种内皮检测还能判断用户是否存在癌症或者痴呆症风险。内皮是毛细血管内的内皮细胞层。 兰卡斯特大学的物理学家希望这项技术能够帮助人们增进健康。对于这项技术的效用,一些人也提出质疑。一些用户可能因此改变他们的生活方式,进而让自己的身体处于最佳状况,其他一些用户则可能相信宿命,不会做出改变。此外,保险公司与退休基金也可能利用这些信息调整保险金和退休金。 目前,兰卡斯特大学的物理学家已经研制出一个笨重的实验用原型。他们正利用这个原型进行小型化设计,最终让激光检测设备可以像手表一样戴在手腕上。他们表示如果能够获得充足的资金,他们能够在一年内将迷你版推向市场。http://i1.sinaimg.cn/IT/2013/0814/U2550P2DT20130814102951.jpg英国科学家研制的激光检测手段能够对血管内皮细胞的血量进行测量,进而判断一个人健康状况 这种激光检测装置的造价为几百英镑,用户可以在家中使用,监测他们的健康,此外也可以应用于全科医生诊所和医院。医生可以借助这种装置比较患者的生物学年龄和实际年龄,以了解他们的衰老速度。在对220名身体健康的参与者进行的测试中,一些参与者的衰老速度明显超过或者低于预计。 项目负责人安奈塔-斯特凡维斯卡教授表示:“在不久的将来,一款售价200英镑到300英镑(约合300美元到460美元)的检测设备便可走进千家万户。我希望我们研发的技术能够鼓励人们更加关注自身的健康。”激光检测装置由斯特凡维斯卡与同事彼得-麦克克林托克教授共同研制,目前已经申请专利。 斯特凡维斯卡指出:“我们希望这种装置能够应用于所有全科医生诊所。它们能够成为全科医生的一件价值不可估量的医疗设备。借助于这款装置,医生可以了解患者的心血管系统,判断他们是否存在中风或者心脏病风险,同时了解内皮是否出问题。内皮会分泌各种能够影响组织的化学物质。它也是一个重要器官,但并没有得到人们的重视。” 麦克克林托克教授承认并非所有人都会因为这种检测装置提供的信息改变自己的生活方式。他说:“你可能认为自己的衰老速度太快,应该采取措施加以遏制。你可能因此改变自己的生活方式,少吃油炸火星棒和经常跑步。当然,你也可能对这些信息置之不理。”(孝文)
目前血细胞分析仪检测原理包括电学和光学两种,电学包括电阻抗法和射频电导法,光法包括激光散射法和分光光度法。电阻抗法根据Coulter原理及血细胞非传导的性质,以电解质溶液中悬浮的血细胞在通过计数小孔时引起的电阻变化进行检测为基础,进行血细胞计数和体积测定。当有细胞通过小孔时,由于电阻增加,于瞬间引起电压变化及通过脉冲。细胞体积越大,脉冲振幅越高,细胞数量越多,脉冲数量也越多。脉冲信号经过:放大、阈值调节、甄别、整形、计数而得出细胞技术结果。电阻抗法可准确量出细胞(或类似颗粒)的大小,是三分类血液分析仪的主要应用原理,并与光学检测原理组合应用于五分类血液分析仪中。激光散射法应用了流式细胞术检测原理及细胞通过激光束被照射时,产生与细胞特征相应的各种角度的散射光。对经信号检测器接受的散射光信息进行综合分析,即可准确区分正常类型的细胞。激光散射法在区别体积相同而类型不同的细胞特征时,比电阻抗法分群更加准确。故激光散射法已成为现代五分类血液分析仪的主要检测原理之一。射频电导法是用高频电磁探针渗入细胞膜脂质可测定细胞的导电性,提供细胞内部化学成分、细胞核和细胞质、颗粒成分等特征信息。射频电流是每秒变化大于10000次的高频交流电磁波,能够通过细胞壁。分光光度法是所有类型的血细胞分析仪检测血红蛋白的原理,它利用血红蛋白与溶血剂在特定波长下比色,吸光度的变化与液体中血红蛋白含量成比例。
植物细胞原生质体制制备与融合2006-11-20 17:14植物细胞原生质体制制备与融合1、原生质体常现的杂交育种由于物种间难以逾越的天然屏障而举步维艰。科学家们受细胞全能性理论及组织培养成功的启示,逐渐将眼光转向细胞融合,试图用这种崭 图3-2新的手段冲破自然界的禁钢。1937年michel率先实施植物细胞融合的试验。如何去除坚韧的细胞'接成了牛物学工作者必须解决的首要难题。196O年该领域终于出现了重大突破。由英国诺丁汉大学Cocking教授领导的小组率先利用真菌纤维素酶,成功地制备出了大量具有高度活性可再生的番茄幼根细胞原生质体,开辟了原生质体融合研究的新阶段。植物细胞原生质体是指那些已去除全部细胞壁的细胞。2、原生质体制备(1)取材与除菌 为了让制得的原生质体一般都生活力较强,再生与分生比例较高。常用的外植体包括:种子根。子叶、下胚轴、胚细胞、花粉母细胞、悬浮培养细胞和嫩叶。对外植体的除菌要因材而异。悬浮培养细胞一般无需除菌。对较脏的外植体往往要先用肥皂水清洗再以清水洗2~3次,然后浸人 70%酒精消毒后,再放进 3%次氯酸钠处理。最后用无菌水漂洗数次,并用无菌滤纸吸干。(2)酶解 现以叶片为例说明如何制备植物原生质体。①配制酶解反应液:反应液应是一种PH值在5·5~5·8的缓冲液,内合纤维素酶0.3%~3.0%以及渗透压稳定剂、细胞膜保护剂和表面活性剂等,②酶解:除菌后的叶片 撕去下表皮 切块放人反应液 不时轻摇 (条件25℃~30℃,2~4h)反应液转绿。反应液转绿是酶解成功的一项重要指标,说明已有不少原生质体游离在反应液中。经镜检确认后应及时终止反应,避免脆弱的原生质体受到更多的损害。(3) 分离 在反应液中除了大量的原生质体外,尚有一些残留的组织块和破碎的细胞。为了取得高纯度的原生质体就必需进行原生质体的分离。可选取200~400目的不锈钢网或尼龙布j叭i过滤除渣,也可采用低速离心法或比重漂浮法直接获取原生质体。(4) 洗涤刚分离得到的原生质体往往还含有酶及其他不利于原生质体培养。再生的试剂,应以新的渗透压稳定剂或原生质体培养液离心洗涤2~4次。 (5) 鉴定 只有经过鉴定确认已获得原生质体后才能进行下阶段的细胞融合工作。由于已去除全部或大部分细胞壁,此时植物细胞呈圆形。如果把它放人低渗溶液中,则很容易胀破。也。'厂月荧光增白剂染色后置紫外显微镜下观察,残留的细胞壁呈现明显荧光。通过以上观测,基本上可判别是否原生质体及其百分中 此外,尚可借助台盼蓝活细胞染色、胞质环流观察以及测定人、作用、呼吸作用等参数定量检测原生质体的活力。4、 原生质体的融合(1)化学法诱导融合 化学法诱导融合无需贵重仪器,试剂易于得到,因此一直是细胞融合的主要方法。尤其是聚乙二醇(PEG)纳合成钙高pH诱导融合法已成为化学法诱导细胞融合的主流。以下简介此方法(在无菌条件下进行):按比例混合双亲原生质体-----滴加 PEG溶液,摇匀,静置----滴加高钙高pH值溶液,摇匀,静置-----滴加原生质体培养液洗涤数次-----离心获得原生质体细胞团一筛选、再生杂合细胞。(2)物理法诱导融合 1979年Senda等发明了微电极法诱导细胞融合。1981年Zi。。mann等提出了改进的平行电极法,现简介如下:将双亲本原生质体以适当的溶液悬浮混合后,插入微电极,接通一定的交变电场。原生质体极化后顺着电场排列成紧密接触的珍珠串状。此时瞬间施以适当强度的电脉冲,则使原生质体质膜被击穿而发生融合。电激融合不使用有毒害作用的试剂,作用条件比较温和,而且基本上是同步发生融合。只要条件摸索适当,亦可获得较高的融合率。上述操作实际上是供体与受体原生质体对等融合的方法。由于双方各具几万对基因,要筛选得到符合需要且能稳定传代的杂合细胞是相当困难的。最近,有人提出以X射线、伽玛射线。纺锤体毒素或染色体浓缩剂等对供体原生质体进行前处理。轻剂量处理可造成染色体不同程度的丢失、失活、断裂和损伤,融合后实现仅有少数染色体甚至是DNA片段的转移;致死量处理后合u可能产生没再仅体万染色体w划她旋余种。利用这种价值不对称融合方法,大大提高了融合体的生存率和可利用率。经过上述融合处理后再生的细胞株将可能出现以下几种类型.2) 亲本双方的细胞核和细胞质能融洽地合为一体,发育成为完全的杂合植株。这种例子不多。3) 融合细胞由一方细胞核与另一方细胞质构成,可能发育为核质异源的植株。亲缘关系越远的物种,某个亲本的染色体被丢失的现象就越严重。 4) 融合细胞由双方胞质及一方核或再附加少量他方染色体或DNA片段构成。④原生质体融合后两个细胞核尚未融合时就过早地被新出现的细胞壁分开。以后它们各自分生长成嵌合植株。5、 杂合体的鉴别与筛选双亲本原生质体经融合处理后产生的杂合细胞,一般要经含有渗透压稳定剂的原生质体培养基培养(液体或固体),再生出细胞壁后转移到合适的培养基中。待长出愈伤组织后按常规方法诱导其长芽、生根、成苗。在此过程中可对是否杂合细胞或植株进行鉴别与筛选。 (1) 杂合细胞的显微镜鉴别 根据以下特征可以在显微镜下直接识别杂合细胞:若一方细胞大,另一方细胞小,则大。小细胞融合的就是杂合细胞;若~方细胞基本无色,另一方为绿色,则自绿色结合的细胞是杂合细胞;如果双方原生质体在特殊显微镜下或双方经不同染料着色后可见不同的特征,则可作为识别杂合的标志;发现h述杂合细胞后可借助显微操作仪在显微镜下直接取出,移置再牛培养基培养。(2)以互补法筛选杂合细胞 显微鉴别法虽然比较可信,但实验者有时会受到仪器的限制,工作进度慢且未知其能否存活与个长 遗传互补法则可弥补以上不足。 遗传互补法的前提是获得各种遗传突变细胞株系。白化互补:不同基山叨的白化突变株出aBxAh,可互补为绿色细胞株AaBb。生长互补:甲细胞株缺外源激素A不能生长,乙细胞株需要提供外源激素B才能生长,则甲株与乙株融合,杂合细胞在不含激素A、B的选择培养基上可能生长。抗性互补筛选:假如某个细胞株具某种抗性(抗青霉素)另一个细胞株具另一种抗性(如抗卡那霉素),则它们的杂合株将可在含上述两种抗生素的培养基上再生与分裂。这种筛选方式即所谓的抗性互补筛选。代谢互补筛选:根据碘代乙酚胺能抑制细胞代谢的特点,用它处理受体原生质体,只有融合后的供体细胞质才能使细胞活性得到恢复,等等。 (3)采用细胞与分子生物学的方法鉴别杂合体 经细胞融合后长出的愈伤组织或植株,可进行染色体核型分析、染色体显带分析、同功酶分析以及更为精细的核酸分子杂交、限制性内切酶片段长度多态性(RFLP,见8.2.2.2)和随机扩增多态性DNA(RAPD)分析,以确定其是否结合了双亲本的遗传素质。(4)根据融合处理后再生长出的植株的形态特征进行鉴别质。
六. 流式细胞仪主要构造和工作原理 信号检测系统 当测定标本在鞘流液约束下细胞成单行排列依次通过激光检测区时产生散射光和荧光信号,散射光分为前向角散射(Forward Scatter, FS)和侧向角散射或900散射(Side Scatter, SS),散射光是细胞的物理参数与细胞样本的制备(如染色)无关;荧光信号也有两种,一种是细胞自发荧光它一般很微弱,一种是细胞样本经标有特异荧光素的单克隆抗体染色后经激光激发发出的荧光,它是我们要测定的荧光,荧光信号较强,这两种荧光信号的同时存在是我们测定时需要设定阴性对照的理由,以便从测出的荧光信号中减去细胞自发荧光和抗体非特异结合产生的荧光。前向角散射(FS)反映被测细胞的大小,它由正对着流动室的光电二极管装置接收并转变为电信号;侧向角散射或900散射(SS)反映被测细胞的细胞膜、细胞质、核膜的折射率和细胞内颗粒的性状, 它由一个光电倍增管(PMT) 接收并转变为电信号,这些电信号存储在流式细胞仪的计算机硬盘或软盘内。流式细胞仪测定常用的荧光染料有多种,他们分子结构不同,激发光谱和发射光谱也各异,选择荧光染料时必须依据流式细胞仪所配备的激光光源的发射光波长(如氩离子气体激光管,它的发射光波488ηm,氦氖离子气体激光管发射光波长633ηm)。488ηm激光光源常用的荧光染料有FITC(异硫氰酸荧光素)、PE(藻红蛋白)、PI(碘化丙啶)、CY5(化青素)、preCP(叶绿素蛋白)、ECD(藻红蛋白-得克萨斯红)等。他们的激发光和发射光波长分别是: [/col
植物细胞原生质体制制备与融合1、原生质体常现的杂交育种由于物种间难以逾越的天然屏障而举步维艰。科学家们受细胞全能性理论及组织培养成功的启示,逐渐将眼光转向细胞融合,试图用这种崭 图3-2新的手段冲破自然界的禁钢。1937年michel率先实施植物细胞融合的试验。如何去除坚韧的细胞'接成了牛物学工作者必须解决的首要难题。196O年该领域终于出现了重大突破。由英国诺丁汉大学Cocking教授领导的小组率先利用真菌纤维素酶,成功地制备出了大量具有高度活性可再生的番茄幼根细胞原生质体,开辟了原生质体融合研究的新阶段。植物细胞原生质体是指那些已去除全部细胞壁的细胞。2、原生质体制备(1)取材与除菌 为了让制得的原生质体一般都生活力较强,再生与分生比例较高。常用的外植体包括:种子根。子叶、下胚轴、胚细胞、花粉母细胞、悬浮培养细胞和嫩叶。对外植体的除菌要因材而异。悬浮培养细胞一般无需除菌。对较脏的外植体往往要先用肥皂水清洗再以清水洗2~3次,然后浸人 70%酒精消毒后,再放进 3%次氯酸钠处理。最后用无菌水漂洗数次,并用无菌滤纸吸干。(2)酶解 现以叶片为例说明如何制备植物原生质体。①配制酶解反应液:反应液应是一种PH值在5·5~5·8的缓冲液,内合纤维素酶0.3%~3.0%以及渗透压稳定剂、细胞膜保护剂和表面活性剂等,②酶解:除菌后的叶片 撕去下表皮 切块放人反应液 不时轻摇 (条件25℃~30℃,2~4h)反应液转绿。反应液转绿是酶解成功的一项重要指标,说明已有不少原生质体游离在反应液中。经镜检确认后应及时终止反应,避免脆弱的原生质体受到更多的损害。(3) 分离 在反应液中除了大量的原生质体外,尚有一些残留的组织块和破碎的细胞。为了取得高纯度的原生质体就必需进行原生质体的分离。可选取200~400目的不锈钢网或尼龙布j叭i过滤除渣,也可采用低速离心法或比重漂浮法直接获取原生质体。(4) 洗涤刚分离得到的原生质体往往还含有酶及其他不利于原生质体培养。再生的试剂,应以新的渗透压稳定剂或原生质体培养液离心洗涤2~4次。 (5) 鉴定 只有经过鉴定确认已获得原生质体后才能进行下阶段的细胞融合工作。由于已去除全部或大部分细胞壁,此时植物细胞呈圆形。如果把它放人低渗溶液中,则很容易胀破。也。'厂月荧光增白剂染色后置紫外显微镜下观察,残留的细胞壁呈现明显荧光。通过以上观测,基本上可判别是否原生质体及其百分中 此外,尚可借助台盼蓝活细胞染色、胞质环流观察以及测定人、作用、呼吸作用等参数定量检测原生质体的活力。4、 原生质体的融合(1)化学法诱导融合 化学法诱导融合无需贵重仪器,试剂易于得到,因此一直是细胞融合的主要方法。尤其是聚乙二醇(PEG)纳合成钙高pH诱导融合法已成为化学法诱导细胞融合的主流。以下简介此方法(在无菌条件下进行):按比例混合双亲原生质体-----滴加 PEG溶液,摇匀,静置----滴加高钙高pH值溶液,摇匀,静置-----滴加原生质体培养液洗涤数次-----离心获得原生质体细胞团一筛选、再生杂合细胞。(2)物理法诱导融合 1979年Senda等发明了微电极法诱导细胞融合。1981年Zi。。mann等提出了改进的平行电极法,现简介如下:将双亲本原生质体以适当的溶液悬浮混合后,插入微电极,接通一定的交变电场。原生质体极化后顺着电场排列成紧密接触的珍珠串状。此时瞬间施以适当强度的电脉冲,则使原生质体质膜被击穿而发生融合。电激融合不使用有毒害作用的试剂,作用条件比较温和,而且基本上是同步发生融合。只要条件摸索适当,亦可获得较高的融合率。上述操作实际上是供体与受体原生质体对等融合的方法。由于双方各具几万对基因,要筛选得到符合需要且能稳定传代的杂合细胞是相当困难的。最近,有人提出以X射线、伽玛射线。纺锤体毒素或染色体浓缩剂等对供体原生质体进行前处理。轻剂量处理可造成染色体不同程度的丢失、失活、断裂和损伤,融合后实现仅有少数染色体甚至是DNA片段的转移;致死量处理后合u可能产生没再仅体万染色体w划她旋余种。利用这种价值不对称融合方法,大大提高了融合体的生存率和可利用率。经过上述融合处理后再生的细胞株将可能出现以下几种类型.2) 亲本双方的细胞核和细胞质能融洽地合为一体,发育成为完全的杂合植株。这种例子不多。3) 融合细胞由一方细胞核与另一方细胞质构成,可能发育为核质异源的植株。亲缘关系越远的物种,某个亲本的染色体被丢失的现象就越严重。 4) 融合细胞由双方胞质及一方核或再附加少量他方染色体或DNA片段构成。④原生质体融合后两个细胞核尚未融合时就过早地被新出现的细胞壁分开。以后它们各自分生长成嵌合植株。5、 杂合体的鉴别与筛选双亲本原生质体经融合处理后产生的杂合细胞,一般要经含有渗透压稳定剂的原生质体培养基培养(液体或固体),再生出细胞壁后转移到合适的培养基中。待长出愈伤组织后按常规方法诱导其长芽、生根、成苗。在此过程中可对是否杂合细胞或植株进行鉴别与筛选。 (1) 杂合细胞的显微镜鉴别 根据以下特征可以在显微镜下直接识别杂合细胞:若一方细胞大,另一方细胞小,则大。小细胞融合的就是杂合细胞;若~方细胞基本无色,另一方为绿色,则自绿色结合的细胞是杂合细胞;如果双方原生质体在特殊显微镜下或双方经不同染料着色后可见不同的特征,则可作为识别杂合的标志;发现h述杂合细胞后可借助显微操作仪在显微镜下直接取出,移置再牛培养基培养。(2)以互补法筛选杂合细胞 显微鉴别法虽然比较可信,但实验者有时会受到仪器的限制,工作进度慢且未知其能否存活与个长 遗传互补法则可弥补以上不足。 遗传互补法的前提是获得各种遗传突变细胞株系。白化互补:不同基山叨的白化突变株出aBxAh,可互补为绿色细胞株AaBb。生长互补:甲细胞株缺外源激素A不能生长,乙细胞株需要提供外源激素B才能生长,则甲株与乙株融合,杂合细胞在不含激素A、B的选择培养基上可能生长。抗性互补筛选:假如某个细胞株具某种抗性(抗青霉素)另一个细胞株具另一种抗性(如抗卡那霉素),则它们的杂合株将可在含上述两种抗生素的培养基上再生与分裂。这种筛选方式即所谓的抗性互补筛选。代谢互补筛选:根据碘代乙酚胺能抑制细胞代谢的特点,用它处理受体原生质体,只有融合后的供体细胞质才能使细胞活性得到恢复,等等。 (3)采用细胞与分子生物学的方法鉴别杂合体 经细胞融合后长出的愈伤组织或植株,可进行染色体核型分析、染色体显带分析、同功酶分析以及更为精细的核酸分子杂交、限制性内切酶片段长度多态性(RFLP,见8.2.2.2)和随机扩增多态性DNA(RAPD)分析,以确定其是否结合了双亲本的遗传素质。(4)根据融合处理后再生长出的植株的形态特征进行鉴别质。
激光共聚焦显微镜系统的原理和应用激光扫描共聚焦显微镜是二十世纪80年代发展起来的一项具有划时代的高科技产品,它是在荧光显微镜成像基础上加装了激光扫描装置,利用计算机进行图像处理,把光学成像的分辨率提高了30%--40%,使用紫外或可见光激发荧光探针,从而得到细胞或组织内部微细结构的荧光图像,在亚细胞水平上观察诸如Ca2+ 、PH值,膜电位等生理信号及细胞形态的变化,成为形态学,分子生物学,神经科学,药理学,遗传学等领域中新一代强有力的研究工具。激光共聚焦成像系统能够用于观察各种染色、非染色和荧光标记的组织和细胞等,观察研究组织切片,细胞活体的生长发育特征,研究测定细胞内物质运输和能量转换。能够进行活体细胞中离子和PH值变化研究(RATIO),神经递质研究,微分干涉及荧光的断层扫描,多重荧光的断层扫描及重叠,荧光光谱分析荧光各项指标定量分析荧光样品的时间延迟扫描及动态构件组织与细胞的三维动态结构构件,荧光共振能量的转移的分析,荧光原位杂交研究(FISH),细胞骨架研究,基因定位研究,原位实时PCR产物分析,荧光漂白恢复研究(FRAP),胞间通讯研究,蛋白质间研究,膜电位与膜流动性等研究,完成图像分析和三维重建等分析。一.激光共聚焦显微镜系统应用领域:涉及医学、动植物科研、生物化学、细菌学、细胞生物学、组织胚胎、食品科学、遗传、药理、生理、光学、病理、植物学、神经科学、海洋生物学、材料学、电子科学、力学、石油地质学、矿产学。二.基本原理传统的光学显微镜使用的是场光源,标本上每一点的图像都会受到邻近点的衍射或散射光的干扰;激光扫描共聚焦显微镜利用激光束经照明针孔形成点光源对标本内焦平面的每一点扫描,标本上的被照射点,在探测针孔处成像,由探测针孔后的光点倍增管(PMT)或冷电耦器件(cCCD)逐点或逐线接收,迅速在计算机监视器屏幕上形成荧光图像。照明针孔与探测针孔相对于物镜焦平面是共轭的,焦平面上的点同时聚焦于照明针孔和发射针孔,焦平面以外的点不会在探测针孔处成像,这样得到的共聚焦图像是标本的光学横断面,克服了普通显微镜图像模糊的缺点。三.应用范围:细胞形态学分析(观察细胞或组织内部微细结构,如:细胞内线粒体、内质网、高尔基体、微管、微丝、细胞桥、染色体等亚细胞结构的形态特征;半定量免疫荧光分析);荧光原位杂交研究;基因定位研究及三维重建分析。1.细胞生物学:细胞结构、细胞骨架、细胞膜结构、流动性、受体、细胞器结构和分布变化2.生物化学:酶、核酸、FISH(荧光原位杂交)、受体分析3.药理学:药物对细胞的作用及其动力学4.生理学:膜受体、离子通道、细胞内离子含量、分布、动态5.神经生物学:神经细胞结构、神经递质的成分、运输和传递、递质受体、离子内外流、神经组织结构、细胞分布6.微生物学和寄生虫学:细菌、寄生虫形态结构7.病理学及临床应用:活检标本诊断、肿瘤诊断、自身免疫性疾病诊断、HIV等8.遗传学和组胚学:细胞生长、分化、成熟变化、细胞的三维结构、染色体分析、基因表达、基因诊断四.激光共聚焦显微镜在医学领域中的应用A.在细胞及分子生物学中的应用1. 细胞、组织的三维观察和定量测量2. 活细胞生理信号的动态监测3. 粘附细胞的分选4. 细胞激光显微外科和光陷阱功能5. 光漂白后的荧光恢复6. 在细胞凋亡研究中的应用B.在神经科学中的应用1. 定量荧光测定2. 细胞内离子的测定3. 神经细胞的形态观察C.在耳鼻喉科学中的应用1. 在内耳毛细胞亚细胞结构研究上的应用2. 激光扫描共聚焦显微镜的荧光测钙技术在内耳毛细胞研究中的应用3. 激光扫描共聚焦显微镜在内耳毛细胞离子通道研究上的应用4. 激光扫描共聚焦显微镜在嗅觉研究中的应用D.在肿瘤研究中的应用1. 定量免疫荧光测定2. 细胞内离子分析3. 图像分析:肿瘤细胞的二维图像分析4. 三维重建 E.激光扫描共聚焦显微镜在内分泌领域的应用1. 细胞内钙离子的测定2. 免疫荧光定位及免疫细胞化学研究3. 细胞形态学研究:利用激光扫描共聚焦显微镜 F.在血液病研究中的应用1. 在血细胞形态及功能研究方面的应用2. 在细胞凋亡研究中的应用 G.在眼科研究中的应用1. 利用激光扫描共聚焦显微镜观察组织、细胞结构2. 集合特殊的荧光染色在活体上观察角膜外伤修复中细胞移行及成纤维细胞的出现3. 利用激光扫描共聚焦显微镜观察视网膜中视神经细胞的分布以及神经原的树枝状形态4. 三维重建H. 激光扫描共聚焦显微镜在肾脏病中的应用可以系统观察正常人肾小球系膜细胞的断层扫描影像及三维立体影像水平,使图像更加清晰,从计算机分析系统可从外观到内在结构,从平面到立体,从静态到动态,从形态到功能几个方面对系膜细胞的认识得到提高。北京中科研域科技有限公司(蔡司显微镜代理商)地址:北京市朝阳区建国路15号院甲1号北岸1292,一号楼406室联系人:张辉13911188977 邮编:100024电话:010-57126588 传真:010-85376588E-mail:[email=zhs_8000@126.com][color=#0365bf]zhs_8000@126.com[/color][/email]