不清楚是不是消解仪可以用于微波提取。谢谢。
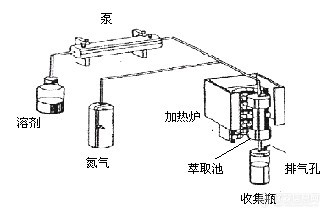
加速溶剂提取的工作流程如图所示,先将固体或半固体的样品放入不锈钢萃取池中,若未加满则填入适量的硅藻土,然后萃取池被转入加热炉内,溶剂被输液泵(或依靠氮气的压力)输送到萃取池内。此时,加热炉开始加热升温,在达到设定的温度和压力后进行静态萃取。萃取结束后,萃取池中的溶剂经由滤膜进入到收集瓶中,并用溶剂清洗管路,再用氮气将其一并吹入收集瓶中。加速溶剂提取主要利用了有机溶剂在高温、高压下,其粘度降低,能更好的浸润样品基体从而能提高溶剂提取的效果。加速溶剂提取很容易实现自动化,因此其应用非常广泛。[img]http://ng1.17img.cn/bbsfiles/images/2006/04/200604081423_16448_1613333_3.jpg[/img]微波辅助提取是利用溶剂的极性分子(如甲醇、丙酮等)在微波电磁场中快速旋转和离子在微波场中的快速迁移,相互摩擦而发热,从而加热与固态样品接触的极性溶剂,使所需要的化合物从样品中分配到溶剂里。微波辅助提取一般是在密闭或敞开的微波-透明容器中进行,萃取时将提取溶剂和样品混合在提取器中。目前国内外使用最多的是密闭的萃取罐,在较高的温度和较高的压力下进行提取的,而敞开式的微波萃取系统应用的却很少。用微波萃取时,将样品和溶剂都放入特制的密闭的聚四氟乙烯萃取罐中,在设定的条件下进行微波萃取。
以猕猴桃根为原料,研究其多糖的微波辅助提取工艺条件。采用单因素试验和正交试验,探讨料液比(猕猴桃根粉:蒸馏水)、提取温度、提取时间、微波功率等对猕猴桃根多糖提取率的影响,并以提取率为评价指标,优化提取工艺。实验结果表明:微波辅助提取猕猴桃根多糖的最佳工艺条件为料液比1:20(g/mL)、提取温度60℃、提取时间15min、微波功率600W,在此条件下猕猴桃根多糖的提取率为11.34%。
以前没用微波提过东西,现在须用微波提取,但没有专门的微波提取仪,再文献上看别人用家用微波炉提取,有用乙醇做溶剂的,但是我害怕出现安全问题,所以想请教大家可用直接用有机溶剂吗,会不会爆炸或出现其他安全事故?
有人用微波消解仪做纺织品,玩具材料等样品中的有机锡的提取的吗?可以分享下经验吗
主要介绍微波辐射技术在提取新型灭鼠剂-非甾体高效抗生育药物棉酚方面的应用。采用正交实验法对影响收率的萃取时间、微波功率及不同萃取液等诸因素进行了讨论,确定了微波萃取的最佳条件。结果显示微波可明显加速萃取的速度,所用时间仅为索氏提取法的4%
[i]化学与生物工程:2003(6):4-6[/i] [b]微波萃取技术在天然产物活性成分提取中的研究进展[/b][i]石国荣,饶力群[/i]摘 要:叙述了微波萃取技术的原理,并对近年来微波萃取技术在天然产物活性成分提取中的研究进行了综述。关键词:微波萃取 天然产物 活性成分 在天然活性成分的提取中,超临界流体萃取已在香料、食品、药物、环境等很多方面得到了广泛的应用,但由于对象是非极性或低极性物质,且需要专门的仪器设备,使其应用受到一些限制。而微波萃取法不仅能保持分析对象本来的化合物状态,而且具有萃取时间短、溶剂用量少、提取效率高和投资少等优点。1 原理 微波萃取的基本原理:由于不同物质的结构不同,吸收微波能的能力各异,因此,在微波的作用下,某些待测组分被选择性地加热,从而与基体分离,进入到微波吸收能力较差的萃取剂中。萃取的温度、溶剂的极性对萃取效率有很大的影响。 从细胞破碎的微观角度看,微波加热导致细胞内的极性物质尤其是水分子吸收微波能产生大量的热量,使胞内温度迅速上升,液态水汽化产生的压力将细胞膜和细胞壁冲破,形成微小的孔洞 进一步加热又导致细胞内部和胞壁水分减少,细胞收缩,表面出现裂纹。孔洞或裂纹的存在使胞外溶剂容易进入细胞内,溶解并释放出胞内产物。2 微波萃取在天然产物提取中的应用 微波萃取不仅萃取效率高、产品纯度高、能耗小操作费用少,而且符合环境保护要求,可广泛用于中草药、香料、食品和化妆品等领域。在天然产物的提取方面,自 Ganzler 等最早利用微波萃取法从羽扇豆中提取了鹰爪豆生物碱后,该技术成为天然产物提取的有力工具。2. 1 微波萃取西番莲籽油 王平艳等用家用 850 W 微波炉,以正己烷为溶剂,证明微波萃取西番莲籽油是可行的。郝金玉等也证明微波萃取法适用于提取西番莲籽,并且证明非极性溶剂适用于微波萃取含水物料,实验前用水浸泡24 h 使种子吸水的方法提取率最高。结果都表明 :与传统的提取方法相比,微波萃取法具有萃取时间短、溶剂用量少且溶剂回收率高、产品提取率高、所得油色泽清亮、气味清雅等优点。2. 2 微波法萃取辣椒素 陈猛等以乙醇为萃取剂,对微波法萃取干辣椒中的辣椒素进行了研究,并与萃取产率较高的乙醇室温浸取法和丙酮温浸法作了比较。结果表明:萃取功率过高、萃取时间过长或者萃取压力过大都可能导致萃取产率的降低。辣椒素的萃取产率随着乙醇浓度的提高而逐渐升高,并在 50 %~80 %时达到最高 湿度较大的辣椒样品在乙醇浓度较高(如 95 %的乙醇) 时才能获得最高的萃取产率。微波法所耗的时间从室温浸取法的 18 h 和丙酮温浸法的 3 h 减少到 320 s,大大提高了萃取效率。

利用微波无溶剂萃取快速提取精油精油 精油是通过各种方法从植物的根、茎、叶、花、果皮等中提取的一种具有挥发性的油状烃类物质,主要有萜烯烃类、芳香烃类、醇类、醛类、酮类、醚类、酯类和酚类等组成。精油又称香精油、挥发油和芳香油。精油的挥发性较强,一般需要密封保存。精油可分为三大类:单方精油、复方精油以及基础油,通常复方精油是由单方精油和基础油按一定的配比和工艺精确调和而成。 植物精油是一类天然植物次生代谢物,由于其具有增香、杀菌、抗病毒和抗氧化等生物活性,在香料、化妆品、食品工业、制药、医疗及农业害虫等方面得到了广泛应用。目前最流行的水疗法(SPA),其精髓就是天然植物香精油,也是受欢迎之处。精油提取方法1 传统方法 1.1 溶剂浸提:是用挥发性有机溶剂将植物原料中某些成分浸提出来,主要特点是有机溶剂残留、有毒、萃取时间长效率低并且不能自动操作。 1.2 水 萃 取:常温常压下利用睡进行提取植物精油,主要特点就是过于慢,不能自动操作并且不能定量。 1.3 压 榨 法:将原料粉碎压榨,从植物组织中将挥发油挤压出来,然后静置分层或离心出油分,即得粗品。此方法所得产物不纯,可能含有水分、叶绿素、粘液质以及细 胞组分等杂质呈浑浊状态,同时很难将挥发油完全压榨出来。 1.4 水蒸气蒸馏:目前为止应用最广泛的一种方法,适用于挥发性的、水中溶解度不大的成分提取。设备简单,容易操作,成本低,一套加热装置,一套蒸馏装置即可。此 方法提纯率高,但传统加热时间长,效率低。 1.5 同时蒸馏萃取:同时蒸馏萃取(SDE)的工作原理是样品蒸气和萃取溶剂的蒸气在密闭的装置中充分混合,反复萃取。操作简单,只需要几十克样品,适用于色谱分 析 ,但不适合提取工艺的放大,另外此方法萃取率低,并不能成比例的萃取,不适合定量分析。2 新技术 2.1 微波辅助萃取:微博辅助萃取(MAE)是近几年发展的从天然物中提取香料的一种方法,利用微波辅助加热有机溶剂提取,该法最大的特点是萃取时间短,产物收率高,节省时间和所用溶剂,广泛用于有机化学和分析化学制备样品。但利用了有机溶剂,毒性较大。 2.2 超临界二氧化碳萃取(SC-CO2):超临界流体萃取(SFE)是利用流体在临界点以上某区域(超临界区)所具有的高渗透性、高扩散性和高溶解能力选择萃取目标组分。由于SFE所提取的植物精油往往还需要进一步分离提纯,所以不少研究者尝试将SFE技术与其他分离技术相耦合,来提高分离效率,另外,SFE需要高压,设备投资和维护费用较大。 2.3 微波无溶剂萃取:利用微波加热原理和水蒸气蒸馏原理相结合的一种最新技术,无需有毒溶剂微波直接作用于待提取物,数十分钟内可提取结束,操作简单,整个过程自动完成,精油得率高,时间快,无需其他成本,费用低。微波无溶剂萃取应用实例 微波无溶剂萃取装置: http://ng1.17img.cn/bbsfiles/images/2017/10/2015072208584909_01_3024284_3.png http://ng1.17img.cn/bbsfiles/images/2015/07/201507220858_556571_3024284_3.png 微波无溶剂萃取系统 http://ng1.17img.cn/bbsfiles/images/2015/07/201507220858_556572_3024284_3.png http://ng1.17img.cn/bbsfiles/images/2015/07/201507220859_556573_3024284_3.png 精油提取中精油提取中 http://ng1.17img.cn/bbsfiles/images/2015/07/201507220859_556574_3024284_3.png 收集器中精油和水明显分层 1 薰衣草精油的提取 取器: 200ml萃取器装入样品之最大刻度线(大约150g) 蒸馏水: 300g,与样品搅拌均匀 收集器: 将收集器中装好蒸馏水至刻度线下方 水循环冷却器: -15℃采用以下功率程序微波萃取样品: 消解程序: Step TIME E (max) Step1 20min 400W Step2 20min 250W 提取精油量:1.5ml2 薄荷精油的提取 取器: 200ml萃取器装入样品之最大刻度线(大约200g) 蒸馏水: 无需添加 收集器: 将收集器中装好蒸馏水至刻度线下方 水循环冷却器: -15℃采用以下功率程序微波萃取样品: 消解程序: Step TIME E (max) Step1 20min 400W Step2 20min 250W 提取精油量:2.5ml 3 橙皮精油的提取 取器: 200ml萃取器装入样品之最大刻度线(大约600g) 蒸馏水: 无需添加 收集器: 将收集器中装好蒸馏水至刻度线下方 水循环冷却器: -15℃ 采用以下功率程序微波萃取样品: 消解程序: Step TIME E (max) Step1 20min 400W Step2 40min 250W 提取精油量:2.0ml 4 烟草花(半开、全开、花蕾)精油的提取 样品处理:将样品用1mol/l的氢氧化钠溶液浸泡30min 萃取器: 200ml萃取器装入样品之最大刻度线 蒸馏水:浸泡后无需蒸馏水 收集器: 将收集器中装好蒸馏水至刻度线下方 水循环冷却器: -15℃采用以下功率程序微波萃取样品: 消解程序: Step TIME E (max) Step1 20min 400W Step2 40min 250W 提取精油量:0.01ml以上方法均比传统方法精油得率高10%以上,但时间仅是传统方法的几分之一甚至几十分之一。微波无溶剂萃取特点: w无需有机溶剂,精油直接提取 w利用微波加热,提取效率高 w采用水蒸气冷凝原理,提取纯度高 w一键式操作,解放人力微波无溶剂萃取应用领域: http://ng1.17img.cn/bbsfiles/images/2015/07/201507220859_556576_3024284_3.pnghttp://ng1.17img.cn/bbsfiles/images/2015/07/201507220859_556577_3024284_3.pnghttp://ng1.17img.cn/bbsfiles/images/2015/07/201507220859_556578_3024284_3.pnghttp://ng1.17img.cn/bbsfiles/images/2015/07/201507220859_556579_3024284_3.pnghttp://ng1.17img.cn/bbsfiles/images/2015/07/201507220859_556580_3024284_3.png[img=,106,85
请问各位:大家有做微波提取的吗?共同交流切磋一下!
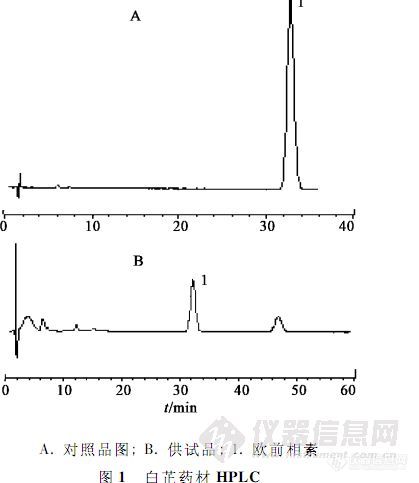
【作者】 方婧; 付梅红; 杨洪军; 张贝贝; 王祝举; 杨岚; 张东;【机构】 中国中医科学院中药研究所;【摘要】 目的:比较微波协助提取法与药典法提取欧前胡素优势。方法:采用Dikma Diamonsil C18色谱柱(4.6 mm×150mm,5μm),流动相为甲醇-水(55∶45),检测波长300 nm,柱温30℃,流速1 mL.min-1。结果:微波提取时间10 min,提取温度80℃,提取溶剂乙醇。欧前胡素在0.01~0.2μg呈良好线性关系(r=0.999 9)。平均回收率97.48%(n=6)。结论:微波提取法较药典法提取欧前胡素更简便快速、结果准确,为一种符合环保绿色理念的含量测定方法,可用于检测白芷药材中有效成分欧前胡素含量。 http://ng1.17img.cn/bbsfiles/images/2012/07/201207231545_379223_2379123_3.jpg
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=103222]微波萃取在菊花黄酮提取工艺中的应用研究[/url]
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=104243]盐角草红色素的微波提取工艺及其特性研究[/url]
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=103226]微波法提取雨生红球藻中虾青素的工艺研究[/url]
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=103223]微波萃取-正交优化设计沙棘黄酮提取工艺[/url]

【作者】 方婧; 付梅红; 杨洪军; 张贝贝; 王祝举; 杨岚; 杨雪燕; 张梦阳; 张康丁; 张东;【Author】 FANG Jing1,FU Mei-hong1,YANG Hong-jun1,ZHANG Bei-bei1,WANG Zhu-ju1, YANG Lan1,YANG Xue-yan2,ZHANG Meng-yang2,ZHANG Kang-ding3,ZHANG Dong1(1.Institute of Chinses Materia Medica,China Academy of Traditional Chinese Medicine, Beijing 100700,China;2.Shenyang Pharmaceutical University,Shenyang 110016,China; 3.Xingtai Medical College,Xingtai 054000,China)【机构】 中国中医科学院中药研究所; 沈阳药科大学; 邢台医学高等专科学校;【摘要】 目的:建立微波协助提取法提取土茯苓中有效成分落新妇苷含量测定方法,比较微波协助提取法与药典法提取落新妇苷优势。方法:采用Dikma Diamonsil C18色谱柱(4.6 mm×150 mm,5μm),流动相为甲醇-0.1%冰醋酸水溶液(39∶61),检测波长291 nm,柱温30℃,流速1 mL.min-1。结果:微波提取时间10 min,提取温度60℃,提取溶剂60%乙醇。落新妇苷在0.04~0.8μg呈良好线性关系(r=0.999 9)。平均回收率99.80%(n=6)。结论:微波提取法较药典法提取落新妇苷更简便快速、结果准确,为一种符合环保绿色理念的含量测定方法,可用于检测土茯苓饮片中有效成分落新妇苷含量。 http://ng1.17img.cn/bbsfiles/images/2012/07/201207241422_379392_2379123_3.jpg
以湘西野葛根为原料,经高速剪切破坏其组织细胞,偶联微波辅助提取其葛根素。实验探讨剪切时间、剪切速度、微波平均辐射功率、辐射时间对葛根素提取率的影响。并采用响应面法试验设计,确定其最佳提取工艺。实验结果表明最佳工艺参数为剪切时间6min,剪切速度6000r/min,微波辐射时间20s,微波功率467.27W,获取葛根素含量2.05mg/g。
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=104063]微波提取苦丁茶中的黄酮类物质的研究[/url]
[align=left] [/align][align=left] 微波浸提提取猴头菇粗多糖的研究[/align][align=left]微波法是通过微波辐射的热效应及产生的电磁波效应,使细胞内的温度升高压力增大,细胞壁破裂,使细胞内部的有效成分从细胞中释放出来的一种方法。微波提取操作简单高效,溶剂消耗少、节能安全、有效成分得率高、不产生噪音等特点,适合于热不稳定成分的提取,应用前景广阔。提取时应注意控制微波火力,避免液体溅出。赖谱富等人采用微波法提取大杯蕈菇柄多糖,得出优化工艺条件为:料液比1:25、微波时间8min、微波功率540w,该条件下大杯蕈菇柄多糖提取率和纯度相比传统热水浸提分别提高了57.7%和30.8%。[/align][align=left]1 料液比对猴头菇多糖提取效果的影响[/align][align=left]猴头菇子实体粉碎成过20目筛,按重量的20倍、30倍、40倍加入蒸馏水,分别在微波功率为140W的条件下提取10分钟,用3号玻璃坩埚过滤并洗涤残渣得清液,合并清液并定容至250mL,清液用超纯水再稀释10倍后,取1mL滤液测定多糖浓度,每个处理3个重复。[/align][align=left]2 浸提时间对猴头菇多糖提取效果的影响[/align][align=left]称取等量的子实体粉末(2.00克),按重量的40倍加入蒸馏水,于微波功率为140W的条件下分别提取10、15、20分钟,用3号玻璃坩埚过滤并洗涤残渣得清液,合并清液并定容至250mL,清液用超纯水再稀释10倍后取1mL滤液测定多糖浓度,每个处理3个重复。[/align][align=left]3 浸提次数对猴头菇多糖提取效果的影响[/align][align=left]称取同等量的子实体粉末(2.00克)三份,按重量的20倍加入蒸馏水,于微波功率为140W的条件下提取10分钟,并分别提取1、2、3次,用3号玻璃坩埚过滤并洗涤残渣得清液,合并清液并定容至250mL,清液用超纯水再稀释10倍后,取1mL滤液测定多糖浓度,每个处理3个重复。[/align][align=left]4 正交试验[/align][align=left] 为进一步探讨浸提参数中的料液比、时间和浸提次数对子实体多糖的影响,进行3因素3水平的正交试验。[/align][align=left][/align][align=left][/align]单因素试验[align=left][/align]1 浸提时间对猴头菇多糖提取效果的影响[align=left][/align][align=left]以猴头菇粉末为实验材料,在预实验的基础上,确定料液比为1:40(料液比1:20时,微波浸提易使液体变干)、浸提次数为2次的条件下,研究浸提时间对猴头菇粗多糖浸提效果的影响,实验结果如图1。由图1可知,当浸提时间为10min时,猴头菇多糖浸出量较大;随着浸提时间的延长,粗多糖提取液易脱水焦化,故选择浸提时间为10min作为微波浸提的最佳条件。[/align][align=left][/align][align=left][/align] [table][tr][td=1,1,56] [/td][/tr][tr][td] [/td][td][img=,478,298]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181709449783_6130_2903169_3.png[/img][/td][/tr][/table][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left] 图1 微波浸提时间对猴头菇粗多糖浸提的影响[/align][align=left][/align] Fig1 Theeffect of wave time on the extraction yield of [i]Hericium erinaceus[/i] polysaccharide[align=left][/align][align=left]2、料液比对猴头菇多糖提取效果的影响[/align][align=left][/align][align=left] 以猴头菇粉末为实验材料,微波功率为140W,在浸提次数为2次、微波提取时间为10 min的条件下,研究料液比对猴头菇粗多糖浸提效果的影响,实验结果如图2。由图2可知,当料液比为1:40时,猴头菇多糖浸出量较大;随着料液比加大,粗多糖提取率提高不显著,为了节约成本及提高效率,故选择料液比为1:40作为微波浸提的最佳条件。[/align][align=left][/align][img=,512,309]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181709451218_402_2903169_3.png[/img] [align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align]图2料液比对猴头菇粗多糖浸提的影响[align=left]Fig2 The effect of solid-liquid ratio onthe extraction yield of [i]H. erinaceus [/i]polysaccharide[/align][align=left] [/align][align=left]3 、浸提次数对猴头菇多糖提取效果的影响[/align][align=left][/align][align=left] 以剪碎后的猴头菇子实体为实验材料,微波功率为140W,料液比为1:40、微波提取时间为10 min的条件下,研究浸提次数对猴头菇粗多糖浸提效果的影响,实验结果如图3。由图3可知, 随着浸提次数的增大,猴头菇多糖的提取率并没有增大,因此为了节约成本及提高提取效率,故采用浸提次数为2次作为微波浸提的最佳条件。[/align][align=left][img=,472,273]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181709455498_206_2903169_3.png[/img] [/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left] [/align]图3 浸提次数对猴头菇粗多糖浸提的影响[align=left][/align] Fig3 Theeffect of extracting times on the extraction yield of [i]H. erinaceus[/i] polysaccharide[align=left][/align][align=left] 4、 单因素最佳条件下微波提取法的多糖提取率[/align][align=left] [/align] 表1 微波提取最优条件下多糖提取率[align=left][/align] Table1 Theextraction rate of polysaccharide under the optimum condition by wave[align=left][/align][align=center] [table=537][tr][td=1,1,124] 实验次数[/td][td=2,1,101] [align=center]多糖提取率(%)[/align] [/td][td=2,1,173] [align=center]平均提取率[/align] [align=center](%)[/align] [/td][td=2,1,132] [align=center] RSD(%)[/align] [/td][td=1,1,7] [/td][/tr][tr][td=2,1,131] [align=center]1[/align] [/td][td=2,1,101] [align=center][color=black]5.51[/color][/align] [/td][td=2,3,173] [align=center]5.51[/align] [/td][td=2,3,132] [align=center]1.3[/align] [/td][/tr][tr][td=2,1,131] [align=center]2[/align] [/td][td=2,1,101] [align=center][color=black]5.44[/color][/align] [/td][/tr][tr][td=2,1,131] [align=center]3[/align] [/td][td=2,1,101] [align=center][color=black]5.58[/color][/align] [/td][/tr][tr][td=1,1,124] [/td][td=1,1,7] [/td][td=1,1,93] [/td][td=1,1,7] [/td][td=1,1,166] [/td][td=1,1,7] [/td][td=1,1,125] [/td][td=1,1,7] [/td][/tr][/table][/align][align=left][/align][align=left][color=red] [/color]在最佳微波提取条件下:浸提时间:10分钟、料液比为1:40、浸提次数:2次的条件下,进行三次平行实验,得到平均粗多糖提取率为5.51%,RSD符合要求。[/align][align=left]2、 正交试验优化猴头菇粗多糖的提取条件[/align][align=left][/align][align=left] 为进一步探讨微波浸提工艺参数中的浸提时间(A)、料液比(B)、浸提次数(C)对猴头菇多糖得率的影响,分别选取浸提时间(A)、料液比(B)、浸提次数(C)的三个因子不同水平作为试验水平(见表2-10),以猴头菇粗多糖提取率为评价指标,选用L9(3[sup]3[/sup])正交表安排试验。试验结果如表2-11所示。[/align][align=left][/align]表2 正交试验因素水平表[align=left][/align]Table2 Factorsand levels of orthogonal experiment[align=left][/align][align=center] [table=532][tr][td=1,1,180] 因子[/td][td=1,1,101] [align=center]水平1[/align] [/td][td=1,1,119] [align=center]水平2[/align] [/td][td=1,1,132] [align=center]水平3[/align] [/td][/tr][tr][td=1,1,180] [align=center]浸提时间A[/align] [/td][td=1,1,101] [align=center]10min[/align] [/td][td=1,1,119] [align=center]15 min[/align] [/td][td=1,1,132] [align=center]20 min[/align] [/td][/tr][tr][td=1,1,180] [align=center]料液比B[/align] [/td][td=1,1,101] [align=center]1:20[/align] [/td][td=1,1,119] [align=center]1:30[/align] [/td][td=1,1,132] [align=center]1:40[/align] [/td][/tr][tr][td=1,1,180] [align=center]浸提次数C[/align] [/td][td=1,1,101] [align=center]1[/align] [/td][td=1,1,119] [align=center]2[/align] [/td][td=1,1,132] [align=center]3[/align] [/td][/tr][/table][/align][align=left][/align]表3 正交试验结果及分析[align=left][/align]Table3 Resultsof the orthogonal experiment[align=left][/align][align=center] [table=640][tr][td=2,2,88] 实验号[/td][td=4,1,414] 因素[/td][td=1,1,138] 实验指标[/td][/tr][tr][td=1,1,91] A(浸提时间)[/td][td=1,1,119] B(料液比)[/td][td=1,1,120] C(浸提次数)[/td][td=1,1,84] 误差[/td][td=1,1,138] [align=center][color=black]提取率[/color][color=black]%[/color][/align] [/td][/tr][tr][td=2,1,88] [align=center]1[/align] [/td][td=1,1,91] [align=center]1(10)[/align] [/td][td=1,1,119] [align=center]1(1:20)[/align] [/td][td=1,1,120] [align=center]1(1)[/align] [/td][td=1,1,84] [align=center]1[/align] [/td][td=1,1,138] [align=center]42.0[/align] [/td][/tr][tr][td=2,1,88] [align=center]2[/align] [/td][td=1,1,91] [align=center]1(10)[/align] [/td][td=1,1,119] [align=center]2(1:30)[/align] [/td][td=1,1,120] [align=center]2(2)[/align] [/td][td=1,1,84] [align=center]2[/align] [/td][td=1,1,138] [align=center]48.4[/align] [/td][/tr][tr][td=2,1,88] [align=center]3[/align] [/td][td=1,1,91] [align=center]1(10)[/align] [/td][td=1,1,119] [align=center]3(1:40)[/align] [/td][td=1,1,120] [align=center]3(3)[/align] [/td][td=1,1,84] [align=center]3[/align] [/td][td=1,1,138] [align=center]47.2[/align] [/td][/tr][tr][td=2,1,88] [align=center]4[/align] [/td][td=1,1,91] [align=center]2(15)[/align] [/td][td=1,1,119] [align=center]1(1:20)[/align] [/td][td=1,1,120] [align=center]2(2)[/align] [/td][td=1,1,84] [align=center]3[/align] [/td][td=1,1,138] [align=center]32.5[/align] [/td][/tr][tr][td=2,1,88] [align=center]5[/align] [/td][td=1,1,91] [align=center]2(15)[/align] [/td][td=1,1,119] [align=center]2(1:30)[/align] [/td][td=1,1,120] [align=center]3(3)[/align] [/td][td=1,1,84] [align=center]1[/align] [/td][td=1,1,138] [align=center]31.4[/align] [/td][/tr][tr][td=2,1,88] [align=center]6[/align] [/td][td=1,1,91] [align=center]2(15)[/align] [/td][td=1,1,119] [align=center]3(1:40)[/align] [/td][td=1,1,120] [align=center]1(1)[/align] [/td][td=1,1,84] [align=center]2[/align] [/td][td=1,1,138] [align=center]31.8[/align] [/td][/tr][tr][td=2,1,88] [align=center]7[/align] [/td][td=1,1,91] [align=center]3(20)[/align] [/td][td=1,1,119] [align=center]1(1:20)[/align] [/td][td=1,1,120] [align=center]3(3)[/align] [/td][td=1,1,84] [align=center]2[/align] [/td][td=1,1,138] [align=center]36.9[/align] [/td][/tr][tr][td=2,1,88] [align=center]8[/align] [/td][td=1,1,91] [align=center]3(20)[/align] [/td][td=1,1,119] [align=center]2(1:30)[/align] [/td][td=1,1,120] [align=center]1(1)[/align] [/td][td=1,1,84] [align=center]3[/align] [/td][td=1,1,138] [align=center]34.0[/align] [/td][/tr][tr][td=2,1,88] [align=center]9[/align] [/td][td=1,1,91] [align=center]3(20)[/align] [/td][td=1,1,119] [align=center]3(1:40)[/align] [/td][td=1,1,120] [align=center]2(2)[/align] [/td][td=1,1,84] [align=center]1[/align] [/td][td=1,1,138] [align=center]39.1[/align] [/td][/tr][tr][td=1,9,36] 总 糖[/td][td=1,1,51] K[sub]11[/sub][/td][td=1,1,91] [align=center]137.6[/align] [/td][td=1,1,119] [align=center]111.4[/align] [/td][td=1,1,120] [align=center]107.8[/align] [/td][td=1,1,84] [align=center]112.5[/align] [/td][td=1,9,138] [/td][/tr][tr][td=1,1,51] K[sub]12[/sub][/td][td=1,1,91] [align=center]95.7[/align] [/td][td=1,1,119] [align=center]113.8[/align] [/td][td=1,1,120] [align=center]120[/align] [/td][td=1,1,84] [align=center]117.1[/align] [/td][/tr][tr][td=1,1,51] K[sub]13[/sub][/td][td=1,1,91] [align=center]110[/align] [/td][td=1,1,119] [align=center]118.1[/align] [/td][td=1,1,120] [align=center]115.5[/align] [/td][td=1,1,84] [align=center]113.7[/align] [/td][/tr][tr][td=1,1,51] R[/td][td=1,1,91] [align=center]14.0[/align] [/td][td=1,1,119] [align=center]2.2[/align] [/td][td=1,1,120] [align=center]4.1[/align] [/td][td=1,1,84] [align=center]1.5[/align] [/td][/tr][tr][td=1,1,51] K[sub]21[/sub][sup]2[/sup][/td][td=1,1,91] [align=center]18933.76[/align] [/td][td=1,1,119] [align=center]12409.96[/align] [/td][td=1,1,120] [align=center]11620.84[/align] [/td][td=1,1,84] [align=center]12656.25[/align] [/td][/tr][tr][td=1,1,51] K[sub]22[/sub][sup]2[/sup][/td][td=1,1,91] [align=center]9158.49[/align] [/td][td=1,1,119] [align=center]12950.44[/align] [/td][td=1,1,120] [align=center]14400[/align] [/td][td=1,1,84] [align=center]13712.41[/align] [/td][/tr][tr][td=1,1,51] K[sub]23[/sub][sup]2[/sup][/td][td=1,1,91] [align=center]12100[/align] [/td][td=1,1,119] [align=center]13947.61[/align] [/td][td=1,1,120] [align=center]13340.25[/align] [/td][td=1,1,84] [align=center]12927.69[/align] [/td][/tr][tr][td=1,1,51] [align=center]Q[/align] [/td][td=1,1,91] [align=center]13397.41667[/align] [/td][td=1,1,119] [align=center]13102.67[/align] [/td][td=1,1,120] [align=center]13120.36333[/align] [/td][td=1,1,84] [align=center]13098.78[/align] [/td][/tr][tr][td=1,1,51] [align=center]S[/align] [/td][td=1,1,91] [align=center]302.4[/align] [/td][td=1,1,119] [align=center]7.7[/align] [/td][td=1,1,120] [align=center]25.4[/align] [/td][td=1,1,84] [align=center]3.8[/align] [/td][/tr][/table][/align][align=left][/align] 表4 正交试验方差分析表[align=left][/align]Table4 Analysisof variance table of orthogonal experiment[align=left][/align][align=center] [table=651][tr][td=1,1,133] 变异来源[/td][td=1,1,74] [align=center]平方和[/align] [/td][td=1,1,88] [align=center]自由度[/align] [/td][td=1,1,97] [align=center]均方[/align] [/td][td=1,1,88] [align=center]F值[/align] [/td][td=1,1,172] [align=center]显著水平[/align] [/td][/tr][tr][td=1,1,133] [align=center]浸提时间A[/align] [/td][td=1,1,74] [align=center]302.4[/align] [/td][td=1,1,88] [align=center]2[/align] [/td][td=1,1,97] [align=center]151.2[/align] [/td][td=1,1,88] [align=center]79.68[/align] [/td][td=1,4,172] [align=center] [/align] [align=center]F[sub]0.05[/sub](2,2)=19.0[/align] [/td][/tr][tr][td=1,1,133] [align=center]料液比B[/align] [/td][td=1,1,74] [align=center]7.7[/align] [/td][td=1,1,88] [align=center]2[/align] [/td][td=1,1,97] [align=center]3.8[/align] [/td][td=1,1,88] [align=center]2.02[/align] [/td][/tr][tr][td=1,1,133] [align=center]浸提次数C[/align] [/td][td=1,1,74] [align=center]25.4[/align] [/td][td=1,1,88] [align=center]2[/align] [/td][td=1,1,97] [align=center]12.7[/align] [/td][td=1,1,88] [align=center]6.69[/align] [/td][/tr][tr][td=1,1,133] [align=center]误差[/align] [/td][td=1,1,74] [align=center]3.8[/align] [/td][td=1,1,88] [align=center]2[/align] [/td][td=1,1,97] [align=center]1.9[/align] [/td][td=1,1,88] [align=center] [/align] [/td][/tr][tr][td=1,1,133] [align=center]总和[/align] [/td][td=1,1,74] [align=center]339.3[/align] [/td][td=1,1,88] [align=center]8[/align] [/td][td=1,1,97] [align=center] [/align] [/td][td=1,1,88] [align=center] [/align] [/td][td=1,1,172] [/td][/tr][/table][/align][align=left][/align][align=left] 从微波浸提试验的方差分析表4 可知,A因素浸提时间对猴头菇粗多糖的提取有显著影响。料液比及浸提次数为对猴头菇多糖提取的影响不显著,本着节约成本及节省时间的原则,对猴头菇子实体粗多糖微波浸提的最佳工艺条件为:A1B1C2,即在微波功率140W,浸提时间为10min、料液比为1:40、浸提次数为2时,粗多糖浸出量最高,提取率可达5.51%左右。[/align][align=left][/align][align=left][/align]
我有看过用微波消解有机溶剂来提取鱼肉中的菊酯类农药,他说鱼肉微波消解主要是为了除去鱼肉中的蛋白质,而茶叶是植物性的,没有蛋白质,用微波消解来处理是不可行的,这种说法正确吗,为什么
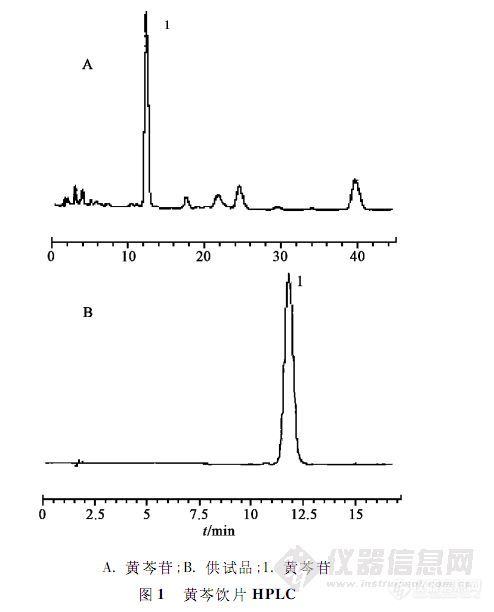
【作者】 方婧; 付梅红; 杨洪军; 张贝贝; 王祝举; 杨岚; 张东;【机构】 中国中医科学院中药研究所;【摘要】 目的:建立微波协助提取法提取黄芩中有效成分黄芩苷,比较微波协助提取法与药典法提取黄芩苷优势。方法:采用Dikma Diamonsil C18色谱柱(4.6 mm×150 mm,5μm),流动相为甲醇-水-磷酸(47∶53∶0.2),检测波长280nm,柱温30℃,流速1 mL.min-1。结果:微波提取时间15 min,提取温度120℃,提取溶剂30%乙醇。黄芩苷在0.059~0.59μg呈良好线性关系,r=0.999 9。平均回收率99.36%(n=6)。结论:微波提取法较药典法提取黄芩苷更简便快速、结果准确,为一种符合环保绿色理念的含量测定方法,可用于检测黄芩饮片中有效成分黄芩苷含量。 http://ng1.17img.cn/bbsfiles/images/2012/07/201207231738_379276_2379123_3.jpg
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=103228]微波辅助萃取在天然植物有效成分提取的应用进展[/url]
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=103227]微波辐射法提取桔皮中香精油的研究[/url]
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=103229]微波辅助提取黄酮和多糖类成分的新进展[/url]
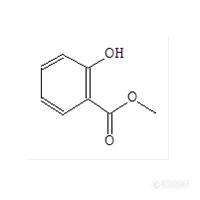
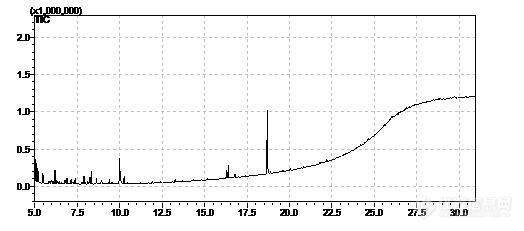
冬青系常绿乔木,广泛种植于长江流域以南各省。冬青油是一种无色或浅黄色油状液体,具有冬青香味,由冬青树叶经蒸馏而得,含有与阿司匹林类似的镇痛消炎成分---水杨酸。冬青油除用于合香精外,还可以用于牙齿防腐、消毒、消炎、镇痛等,这主要归功于它的主要成分-甲基水杨酸。因此,开发快速、简单、高效的提取冬青油的方法,对于有效地利用这一资源具有十分重要的意义。目前,提取植物精油的方法主要有水蒸气蒸馏法和同时蒸馏萃取法等,这些方法都需要比较长的提取时间,能耗高,效率低。本文介绍一种微波辅助水蒸气蒸馏法克服了上缺点,适用于冬青油和其它植物精油的提取。萃取装置如下图:http://ng1.17img.cn/bbsfiles/images/2011/12/201112292149_342553_1609970_3.jpg提取过程:称取冬青叶50g于500 mL圆底烧瓶中,加入200 mL水和数粒玻璃珠,置于微波炉内,连接挥发油测定器和回流冷凝管,自冷凝管上端加水使充满挥发油测定器的刻度部分,并溢流入烧瓶时为止。将微波炉功率调到高火档,进行微波辐射提取挥发油。微波加热2分钟后,观察到有挥发油馏出并油量不断增加。15 min后,油量不再增加。收集挥发油(约7 mL),用无水硫酸钠干燥,于冰箱中保存。主成分GC/MS分析:色谱柱:HP-17MS(30m×0.25mm×0.5μm)柱温:50℃(1min) 4℃/min 150℃30℃/min 250℃(5min)进样口:250℃,分流,分流比:50:1进样量:1μL扫描方式:Scan,范围:40-500 amu。TIC图如下:http://ng1.17img.cn/bbsfiles/images/2011/12/201112292210_342556_1609970_3.jpg主成分(保留时间19.134min)百分含量接近100%,其质谱图如下:http://ng1.17img.cn/bbsfiles/images/2011/12/201112292211_342557_1609970_3.jpg谱库检索结果为:水杨酸甲酯。http://ng1.17img.cn/bbsfiles/images/2011/12/201112292212_342558_1609970_3.jpg相似度为96%。本方法耗时短,能耗低,效率高,各位可以试试。
柑桔是我国常见的水果之一。柑桔不但肉甜,其果皮也有很高的利用价值。果皮晒干后可以入药,即中药陈皮。果皮中还含有很高含量的精油,可用作食品、日化的赋香剂。用桔皮油制成粉剂,不仅可配制成调味粉,用于汤料、沙司粉和粉末饮料中,可使这类食品具有柑桔香味,而且可以改善香料、香辣粉和着色剂的风味,并提高其质量。香精油和果胶对胆固醇有极强的抑制作用,可以作为降血脂和减肥食品。常用的提取桔皮油的方法有压榨法、水蒸气蒸馏法。压榨法,效率较低,水蒸气蒸馏法耗时较长。微波加热因具有高效、快速、易控制、清洁和节能等优点,在分析化学方面有着广泛的应用。然而,微波加热用于加速植物挥发油的提取,国内外鲜有文献报道。本实验设计了一种微波辅助水蒸馏方法用于提取桔皮中的精油,并用GC/MS对精油成分进行分析。萃取装置如下图:http://ng1.17img.cn/bbsfiles/images/2011/12/201112292248_342562_1609970_3.jpg提取过程:称取桔皮50g-100g于500 mL圆底烧瓶中,加入200 mL水和数粒玻璃珠,置于微波炉内,连接挥发油测定器和回流冷凝管,自冷凝管上端加水使充满挥发油测定器的刻度部分,并溢流入烧瓶时为止。将微波炉功率调到高火档,进行微波辐射提取挥发油。油量不再增加时停止。收集挥发油,用无水硫酸钠干燥,于冰箱中保存。主成分GC/MS分析:色谱柱:HP-17MS(30m×0.25mm×0.5μm)柱温:50℃(1min) 4℃/min 150℃30℃/min 250℃(5min)进样口:250℃,分流,分流比:50:1进样量:1μL(用正己烷稀释进样)扫描方式:Scan,范围:40-500 amu。TIC图如下:http://ng1.17img.cn/bbsfiles/images/2011/12/201112292249_342563_1609970_3.jpg检索结果显示桔皮油成分大多为萜类化合物。含量相对较高的成分(保留时间为18.693min)为:9-Octadecenoic acid, methyl ester。
做海藻提取液的砷汞,加入8ml硝酸,2ml双氧水,浸泡过夜,然后用微波消解,赶酸后加入硫脲就产生白色沉淀,并伴有黄烟冒出,请大家帮我分析下原因!
附件中主要包括(均为PDF格式):微波萃取技术在天然食用色素提取上的应用微波萃取技术在天然产物活性成分提取中的研究进展微波萃取技术的应用微波萃取技术及其在食品化学中的应用微波技术在化学萃取中的应用微波萃取技术在中药有效成分提取中的应用微波萃取技术在茶叶加工等领域的应用综述微波萃取在中药提取和分析中的应用微波萃取技术及其在中草药方面的应用微波萃取技术在中药有效成分提取中的应用微波萃取技术微波萃取技术在中药成分提取中的应用[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=23673]微波萃取[/url]
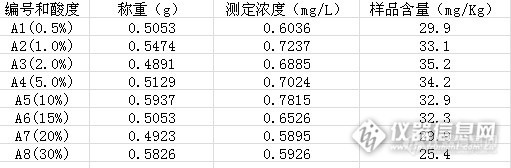
这个实验其实早做完了,还是上次那个奶粉盲样,当时进行了微波消解、湿法消解和干法消解的比较,最后发现干法消解结果偏低,微波消解和奶粉消解效果一致,而且同时做了质控样,证实了这个结论。但是不管怎么说这个过程对于比较懒散的我来说还是有点繁琐,微波消解要装罐,还要赶酸,湿法消解要一直守着很害怕不小心就碳化了。想偷懒的人总会想到偷懒的办法。 先来分析下,奶粉的主要成分是什么呢,碳水化合物、脂肪、蛋白质等等,但是奶粉有个特点那就是在水里可以形成乳液。而婴幼儿奶粉中很多矿物质基本上都是人为添加的化合物,比如碳酸钙、硫酸锌什么的等等,如果把奶粉溶在水里再加点酸这些盐应该是可以游离在水里的,那么通过离心和沉淀蛋白是不是就能把这些矿物质分离出来进行分析呢?答案是肯定的,但是关键点是如果能保证其游离度(即是不是所有的矿物质都能游离出来)呢?影响游离度的因素有哪些呢?酸度肯定是非常关键的因素,同时要把被蛋白质和脂肪包裹的矿物质游离出来至少它们要接触一定量的酸溶液,问题就转变成如何增加它们接触的概率呢?此时我想到了超声波的“空化”作用,既然超声波能增加提取有机物的能力,为什么不能增加矿物质的释放能力呢? 确定了这两个影响因素后,我再来查文献,看看有没有人这么做过,通过“知网”(请原谅我无法查到外文文献)的检索发现还真有人这么做过,而且应用还挺广泛,但是奶粉的做法却不多,所以我决定试一试,刚好手边有质控样,还有盲样,借着这个机会还能与湿法、微波的结果进行一番比较。同样分三步走,称样,前处理,上机分析。一、微波、湿法、干法消解还是延续上次的分析过程1,称样。http://ng1.17img.cn/bbsfiles/images/2013/12/201312311430_485994_1615758_3.jpg2,消解,微波消解条件如下图。http://ng1.17img.cn/bbsfiles/images/2013/12/201312311430_485993_1615758_3.jpg湿法:加入12ml混酸(高氯酸+硝酸=1+4),过夜。第二天于电热板上180度消解至澄清透明。干法:加入2ml硝酸,电路上小火碳化,然后转至大火至无烟,放入陶瓷马弗炉中550度保持5.0hhttp://ng1.17img.cn/bbsfiles/images/2013/12/201312311432_485998_1615758_3.jpg3,仪器条件。http://ng1.17img.cn/bbsfiles/images/2013/12/201312311430_485995_1615758_3.jpg4,结果。http://ng1.17img.cn/bbsfiles/images/2013/12/201312311431_485996_1615758_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/12/201312311431_485997_1615758_3.jpg二、超声波酸提取的过程。1,称样同前。称样0.5g,加入塑料离心管中。2,酸溶液溶解。我们设定了的酸度有以下水平,0.5%、1.0%、2%、5%、10%、15%、20%、30%。分别用以上酸度的硝酸溶液25.0ml溶解离心管中的奶粉并在漩涡混匀器上充分混匀。如下图http://ng1.17img.cn/bbsfiles/images/2013/12/201312311442_486003_1615758_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/12/201312311443_486004_1615758_3.jpg混匀完毕后,通过肉眼观察,发现30%酸度的离心管内出现了部分结块,未能充分混匀。4,超声波提取。超声设定时间为分别为5、10、20、30、40、50min。http://ng1.17img.cn/bbsfiles/images/2013/12/201312311449_486005_1615758_3.jpg5,沉淀蛋白,离心。每个离心管中再加入1.0ml高氯酸沉淀蛋白,然后6000r/min离心5.0min。离心后脂肪层浮在表面。http://ng1.17img.cn/bbsfiles/images/2013/12/201312311453_486006_1615758_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/12/201312311454_486008_1615758_3.jpg离心完毕后取下层清液,并稀释2倍后待测。如有必要科过滤后再上机测定。5,上机分析及结果。仪器条件同上。分析结果见下表。http://ng1.17img.cn/bbsfiles/images/2013/12/201312311516_486016_1615758_3.jpg三、结果的比较。将以上结果跟湿法和微波消解的结果比较发现,在酸度为1.0%至15%之间其结果均在质控样的范围(34±2mg/Kg)之内,均符合要求,而酸度在0.5%和20%及30%时均在质控范围之外。但是考虑到酸度越高对仪器的损害及稳定性越差,可以选择1%至5%酸度的硝酸溶液进行提取。本实验还进行超身波提取时间的研究,但是限于篇幅再次不在叙述,另外本文正在形成论文,请各位不吝赐教,多多给予建议,先行谢过了!
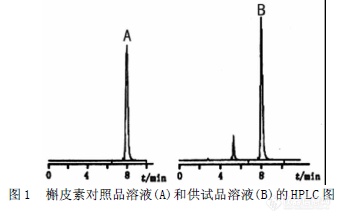
【作者中文名】 郭利民; 钟世华; 王招弟; 【作者单位】 湖南省益阳市中心医院; 湖南师大化学化工学院; 湖南师大化学化工学院 湖南益阳; 湖南长沙; 【摘要】 目的建立高效液相色谱法测定槐米中槲皮素的含量。方法用正交试验法确定微波辅助提取的最优条件,采用DiamonsilC18柱(200mm×4.6mm,5μm),以甲醇-0.4%磷酸溶液(70:30)为流动相,流速0.8mL·min-1,检测波长370nm。结果线性范围(8.92~89.2)μg·mL-1,r=0.9991,加样回收率98.59%(RSD为2.26%)。结论本方法简便、准确,所得结果稳定、重复性好,可作为槐米药材质量控制的定量方法。http://ng1.17img.cn/bbsfiles/images/2012/08/201208011233_381009_1761902_3.jpg
本公司的高纯石英产品杂质含量较低,除了铝为10ppm外,其余均小于1ppm,为此要求样品溶样后定容体积小,称样品重量大(>1.0g);而且样品溶解完全后,为了驱赶完全F离子,须将溶液蒸干后,再用盐酸提取后定容做检测溶液.不知现在哪家微波消解仪能达到我们公司的要求. 国内(上海屹尧、上海新仪)的微波消解仪质量如何?