氢氘交换质谱定位多克隆抗体识别的抗原表位
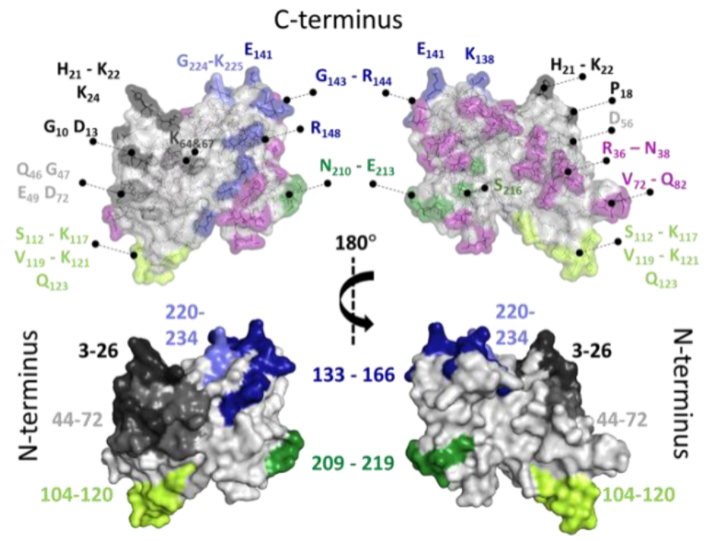
大家好,本周为大家介绍的是一篇发表在Analytical chemistry上的文章Epitope Mapping of Polyclonal Antibodies by Hydrogen–Deuterium Exchange Mass Spectrometry (HDX-MS)1,文章通讯作者是意大利锡耶纳葛兰素史克公司实验室主任Nathalie Norais和丹麦哥本哈根大学药学系教授Kasper Rand。抗体表位定位对理解适应性免疫、研究治疗性抗体和疫苗的作用方式至关重要。对疫苗接种后产生的多克隆抗体群(pAb)的结合特性的深入了解将为疫苗开发提供重要价值,但很少有表位定位方法能耐受pAb样品的复杂性。本文使用氢氘交换质谱(HDX-MS),通过检测存在不同量的pAb时抗原的HDX值变化,绘制了pAb样品识别的表位,并提供了表位与抗体的相互作用信息。因子H结合蛋白(fHbp)是被广泛研究的脑膜炎奈瑟菌抗原之一,在人体中能引发强大的保护性免疫反应。fHbp是27kDa的脂蛋白,N端为一个饼状的β-sheet,C端为一个8股β桶,两端由linker连接。本文的研究对象是fHbp和用fHbp免疫的兔pAb。首先作者进行了被pAb识别的fHbp抗原表位的鉴定。重组fHbp在不孵育和孵育两倍量的pAb下进行了30秒到20分钟的HDX实验,在抗原的多个区域检测到了抗体导致的HDX降低,标记10min后HDX的变化最为显著,因此接下来的HDX-MS实验选择了10 min时间点。随后作者进行了孵育比例的考察以判断结合亲和力,考察了Ag:pAb从1:2、1:5、1:10到1:15,氘代时间为10分钟(图1),可以观察到抗原的3-26、44-72、104-120三个区域的氘代被抗体显著的保护住了,从1:5时开始看出差异,从1:2到1:15,所有肽的平均氘代降低率从3%增加到了16%,104-120的氘代降低率最高。之前的研究表明,fHbp的兔抗中存在与抗原亲和力在1nM及以下的抗体,故氘代保护率随抗体用量增加的原因可能是,在低比例的多克隆抗体中,每种抗体的占比有限,高亲和力的抗体还没达到能与抗原形成1:1复合物的浓度。作者将实验结果与前人研究的fHbp的单克隆抗体结果进行比对,多个氘代减少的区域得到了印证,尤其是104-120区域,残基S112、G116和K117可被认定为抗原表位。同时,抗体之间也存在组合功能,即单个抗体无法发挥的功能会由两到三个抗体协同产生,本实验中使用多克隆抗体研究的优势在于,通过与单克隆抗体研究中氘代降低的区域对照,判断表位抗体间的组合功能和起到免疫效果所需的交叉区域。图1. 不同比例的Ag:pAb对抗原fHbp氘代率的影响。A.颜色由浅到深依次是1:2、1:5、1:10、1:15,正值代表加入抗体后氘代率降低。B.映射到晶体结构上的氘代变化(PDB:3kvd)。C. 15-31、44-71、102-120、209-234区域随抗体加入比例的变化,灰色线为不加抗体时的氘代值,所有氘代是最大氘代值(MX)的相对值,最大氘代值为1:15比例下氘代24h的结果。接着,作者使用VADAR分析研究fHbp的主要表位区。VADAR v1.8算法基于蛋白的X射线结构原子坐标测量fHbp单个残基的表面可及性,将其与HDX结果相结合可进一步描述fHbp的表位区域。可及表面积分数(ASA)超过50%的残基为暴露残基,图2总结了映射到fHbp晶体上的所有暴露的残基,每个识别的表位区域的范围为1992-2509 Å2,作者强调位于表位区的暴露残基不一定都参与表位组成,也可能是间接稳定抗体的结合引起的HDX保护。图2. 结合VADAR和HDX数据的抗原表位区。两个在N端结构域(黑灰、浅绿),两个在C端结构域(浅蓝深蓝、深绿),紫色代表不在HDX鉴定的表位区域内的暴露残基。最后,作者使用了变性剂和盐来评估结合特异性和非特异性相互作用。由于亲和力低的抗体在变性剂存在时可与抗原解离,作者将此策略应用到了HDX实验中,选择1:10结合比例进行HDX,标记缓冲液使用含有或不含有盐(0.5M NaCl)或变性剂(硫氰酸铵AT或尿素),探究这些情况对HDX结果的影响(图3)。在存在0.5M、2M和4M AT的情况下,fHbp的多个区域获得了更多的氘代,N端区域3-26和44-71,以及C端区域176-184显示出氘代增加(相对于不加AT结果),因此作者推断即便在0.5M的浓度水平下AT也能影响fHbp与抗体的结合,2M尿素存在下也是如此。但0.5M尿素和0.5M NaCl的存在没有明显影响fHbp与抗体的结合。因为非结构肽中酰胺氢的交换速率会受到溶剂离子强度、pH值、温度、以及相邻残基侧链的诱导和空间效应的影响,作者额外考察了0.5M尿素和0.5M NaCl是否会影响fHbp酰胺氢自身的交换速率,即在对照条件(PBS缓冲液)和实验条件(加入0.5M尿素或 NaCl)下分别标记5秒和30秒,控制缓冲液的pH相同且控温(在冰浴进行标记)。结果表明实验组序列覆盖率没有降低,相比于对照组,肽的回收率也高达91.8%,三次重复实验可表明0.5M尿素或 NaCl的加入不会对fHbp自身的氘代特性产生任何显著性影响,也不影响fHbp的构象。将0.5M尿素或 NaCl添加到抗原抗体孵育后的氘代实验中,发现fHbp上的所有表位在抗体结合后仍被显著保护,排除了抗体非特异性结合的可能。值得注意的是,在存在尿素或NaCl的情况下,fHbp的表位区域氘代降低变化幅度不同,尤其是在标记30秒时,这说明了不同表位在与抗体互作时的特性不同,例如残基3-26和104-120可能为静电相互作用(被NaCl破坏),残基133-166和209-234可能为氢键作用(被尿素破坏)。图3. 添加剂对抗原结构和抗原-抗体结合的影响。A.在0.5M AT存在下,30秒氘代后fHbp结构中氘代增加的区域(蓝色)。B.抗原-抗体1:10孵育对fHbp氘代的影响。C.49条鉴定肽在30秒氘代时的变化,蓝色为添加0.5 M AT,紫色为添加0.5 M尿素。D. 抗原-抗体1:10孵育后,49条鉴定肽在30秒氘代时的变化,橙色为对照组,蓝色为添加0.5 M NaCl,紫色为添加0.5 M尿素。总结:本文通过监测fHbp与多克隆抗体群pAb孵育后的HDX-MS变化,绘制了fHbp的抗原表位,并使用尿素和NaCl深入了解了抗体群的相对丰度和亲和力,以及潜在的非特异性结合,这种方法可以广泛应用于其他抗原和pAb样品,为免疫学和疫苗设计提供有价值的信息。参考文献:1. Ständer, S. R. Grauslund, L. Scarselli, M. Norais, N. Rand, K., Epitope Mapping of Polyclonal Antibodies by Hydrogen–Deuterium Exchange Mass Spectrometry (HDX-MS). Analytical Chemistry 2021, 93 (34), 11669-11678.