版友问题:想用气质联通测尿中草酸、肌酐酸、尿酸等,请问有没有做过的牛人或文献?先谢谢啦
钼兰比色法测定磷 磷钨酸比色法测定尿酸 变色酸比色法测定草酸 五溴丙酮2硫脲比色法测定枸橼酸
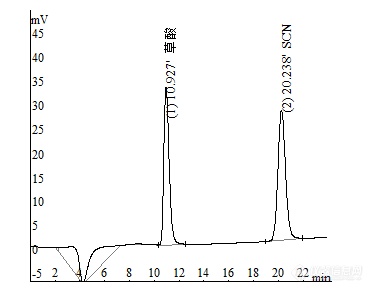
[font=宋体][size=13px]中[/size][/font][font=宋体][size=13px][color=#444444][url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定尿液中草酸和硫氰酸盐[/color][/size][/font][align=center]黄选忠[/align][align=center](湖北兴山县疾病预防控制中心,湖北兴山,443711)[/align]摘要:【目的】建立以SH-AC-3型阴离子交换柱为分离柱,[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url][font=times new roman][size=18px]-[/size][/font]抑制电导检测法同时测定尿样中草酸和硫氰酸盐的新方法。【方法】研究用[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定尿液中草酸和硫氰酸盐的可能性,通过试验优化确定了各项色谱条件。【结果】以SH-AC-3型阴离子交换柱为分离柱,以10.0mmol/LNa2CO3为淋洗液,流量为1.0mL/min,等度洗脱可将草酸和硫氰酸盐与尿液中大量共存的氯化物、磷酸盐和硫酸盐等常见阴离子完全分离,通过抑制电导检测,草酸和硫氰酸盐的峰面积、峰高均与其浓度在0.20~30.0mg/L范围内呈良好的线性关系,相关系数[size=13px][i]r[/i][/size]在0.9991~0.9999,方法应用于尿液中草酸和硫氰酸盐的同时测定,加标回收率在93.2%~105.2%[size=13px]和95.3%~99.8%,[/size], 5次平行测定的相对标准偏差(RSD)小于5%(n=5)。【结论】本方法可用于尿液中草酸和硫氰酸盐的同时测定。关键词:[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法;[font=times new roman][color=#444444]尿液[/color][/font];硫氰酸盐;草酸;中图分类号:O652.63 文献标识码: 文章编号:尿中硫氰酸盐(SCN-)含量是人体接触氰化物的一项生物接触指标[1],而SCN-又是致甲状腺肿物质,可阻滞甲状腺激素合成,尤其对胎儿和婴儿的智力和神经系统发育存在较大的风险[2],因此监测人血、尿等生物标本中的SCN-含量具有重要意义。目前,测定尿中微量SCN-的方法主要有分光光度法[3-5]、衍生-顶空[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法[6-7]等,其中分光光度法和[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法都存在氰化物的干扰问题。尿结石约70%为草酸钙结石,草酸代谢异常所引起的高含量草酸尿是泌尿系结石形成的主要原因[8]。因此准确测定尿中草酸含量对研究结石形成机理、结石的鉴别等均具有重要意义。目前测定尿中草酸的方法主要有光度法包括络合物褪色比色法[9]和催化光度法[10-11]、催化荧光法[12-13]、高效液相色谱法[14-15]和毛细管电泳法[16]等,而比色法、光度法、荧光法等光谱分析方法因特异性差样品要进行前处理,操作繁杂,高效液相色谱法和毛细管电泳法均需要专用仪器使其应用受限。[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法以其操作简便、试剂消耗少、可自动化和多组分同时测定的优势现已成为阴离子分析的首选方法[17],并成功应用于尿液中草酸[17-18]和SCN- [19-20]的分别测定,用[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定尿液中草酸和SCN-似未见报道。本工作拟定的以SH-AC-3型阴离子交换柱为分离柱,10.0mmol/LNa2CO3溶液为淋洗液, 1.0mL/min的流量等度洗脱,[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]-抑制电导检测法同时测定尿液中草酸和硫氰酸盐的新方法,草酸和SCN-的含量均在0.20~30.0mg/L范围内与其峰高和峰面积呈良好的线性关系(相关系数r在0.9991~0.9999),方法应用于尿液中草酸和SCN-的同时测定,加标回收率分别为:95.0%~101.1%和95.5~100.5%,5次平行测定的相对标准偏差(RSD)小于3%,以3倍信噪比(3N/b)计算草酸和SCN-最低检出限分别为0.04mg/L和0.03mg/L。1、试验部分1.1主要仪器CIC-100型[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱仪[/color][/url](青岛盛瀚色谱公司,编号15601),抑制器:自再生抑制器,检测器:电导检测器,定量环体积为25μL;SHA—15自动进样器(青岛盛瀚色谱公司,编号AS1518050);SH-AC-3型阴离子交换柱(250×4.0mm i.d,青岛盛瀚色谱公司,批号:1602037);SH-AC-3型保护柱(50×4.0mm i.d,青岛盛瀚色谱公司,批号:1602037)。1.2 仪器工作条件及参数设置色谱仪:柱箱温度35℃,电流:75mA,量程:1档。自动进样器:全定量环取样,取样后清洗(每针之间),置换量70μL,取样量25μL,扎针深度4mm。1.3主要试剂草酸标准溶液:1000 mg/L,称取优级纯草酸(H2C2O42H2O)0.1401g用超纯水溶解定容至100mL;SCN-标准溶液:1000 mg/L,称取烘干的优级纯硫氰酸钾0.1673g用超纯水溶解定容至100mL。Cl-标准溶液:GBW(E)080268,1000 mg/L;SO4-2标准溶液:GBW(E)080266,1000 mg/L;H2PO4-标准溶液:1000 mg/L,称取分析纯磷酸二氢钾0.1402g用超纯水溶解定容至100mL。用前将各种标准溶液用纯水分别稀释成含草酸和SCN-10.0mg/L(A液)、100.0mg/L(B液)混合标准应用液备用。无水碳酸钠(分析纯,国药集团化学试剂有限公司),草酸(优级纯,国药集团化学试剂有限公司),硫氰酸钾(优级纯,国药集团化学试剂有限公司)。试验所用其他试剂均为AR级,试验用水为超纯水(18.2ΜΩcm)。1.4 试验方法1.4.1 标准曲线的绘制 取混合标准应用液(A液)0.20、0.50和1.00mL及B液0.50、1.0、1.50、2.00和3.00 mL于10mL容量瓶中加纯水至刻度,混匀,配制成含草酸和SCN-均为0.20~30.0 mg/L的标准系列,各管取1.5mL于样品瓶中,启动自动进样器进样分别测定各组分的峰面积(S)和峰高(H),以S及H对各组分浓度(C)绘制工作曲线。1.4.2尿样的采集 用清洗干净并干燥的聚乙烯瓶采集尿样50mL储存于4℃冰箱待测定。1.4.3 尿样测定 取新鲜尿样经8000转/min离心10min,取上清液用高纯水稀释10倍后分别用C18柱净化、用0.22μm滤膜过滤后取1.5mL于样品瓶中,启动自动进样器进样测定各组分的S和H,以标准曲线法定量,同时进行加标回收试验。2、结果与讨论2.1 色谱条件的选择2.1.1 淋洗液的选择 试验结果表明,当以SH-AC-3型阴离子交换柱为分离柱,以Na2CO3+NaHCO3溶液为淋洗液,其浓度配比在6 mmol/L+1 mmol/L~6 mmol/L+3 mmol/L时,均可将草酸和硫氰酸盐与尿液中的氯化物、磷酸盐和硫酸盐等常见阴离子完全分离,各组分的分离度R(相对于后续组分,如磷酸盐的R是相对于硫酸盐的,下同)可达1.5及以上,但硫氰酸盐的保留时间(T)长达24min以上,分析效率低下。为缩短硫氰酸盐的T提高分析工作效率,以洗脱能力较强的Na2CO3溶液进行了淋洗试验,结果显示当Na2CO3溶液浓度分别为8.0、10.0和12.0 mmol/L时,硫氰酸盐的T分别缩短至21、20和19分多钟,且草酸和硫氰酸盐与尿液中的磷酸盐和硫酸盐等阴离子完全分离,试验结果见表1。考虑到Na2CO3溶液浓度大,相应的抑制电流也高,不利于抑制器的使用[17],在保证适宜的R和较短的T的情况下,试验选择10.0mmol/LNa2CO3溶液为淋洗液。[align=center]表1 Na2CO3溶液浓度选择试验结果(流量1.0 ml/min)[/align][table][tr][td=1,2][align=center]组分[/align][/td][td=2,1][align=center]8.0mmol/L[/align][/td][td=2,1][align=center]10.mmol/L[/align][/td][td=2,1][align=center]12.0mmol/L[/align][/td][/tr][tr][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][/tr][tr][td][align=center]SO4-2[/align][/td][td][align=center]10.245[/align][/td][td][align=center]3.07[/align][/td][td][align=center]8.606[/align][/td][td][align=center]2.60 [/align][/td][td][align=center]7.868 [/align][/td][td][align=center]2.34[/align][/td][/tr][tr][td][align=center]草酸[/align][/td][td][align=center]13.121[/align][/td][td][align=center]8.15[/align][/td][td][align=center]10.891[/align][/td][td][align=center]9.45[/align][/td][td][align=center]9.828[/align][/td][td][align=center]10.18 [/align][/td][/tr][tr][td][align=center]SCN- [/align][/td][td][align=center]21.665[/align][/td][td][align=center]/[/align][/td][td][align=center]20.151[/align][/td][td][align=center]/[/align][/td][td][align=center]19.177 [/align][/td][td][align=center]/[/align][/td][/tr][/table]2.1.2 色谱柱的选择 以10.0mmol/LNa2CO3溶液为淋洗液、流量1.0mL/min等度洗脱,考察了青岛盛翰色谱公司生产的SH-AC-1型和SH-AC-3型阴离子交换柱对草酸和硫氰酸盐与氯化物、磷酸盐和硫酸盐等常见阴离子的分离情况,结果表明,在此条件下SH-AC-1型柱虽能将草酸与常见阴离子完全分离,但硫氰酸盐至少在90min内未出峰,而SH-AC-3型柱不但可将草酸和硫氰酸盐与氯化物、磷酸盐和硫酸盐等常见阴离子完全分离,且硫氰酸盐的T在21min以内,故本试验选择SH-AC-3型阴离子交换柱为分离柱。2.1.3淋洗液流量的选择 对于相同浓度的淋洗液,不同的流量组分的T和R的将发生改变。试验结果表明,当淋洗液流量从0.8mL/min增加至1.2mL/min时,硫酸盐、草酸和硫氰酸盐的T逐渐变短,R逐渐变小,但硫酸盐和草酸的R远大于1.5达到完全分离的标准,见表2。在保证待测组分与干扰离子完全分离的前提下尽量使用较低的流量,以使系统有较低的压力,淋洗液流量选定为1.0mL/min。[align=center]表2 不同淋洗液流量试验结果(10.0mmol/LNa2CO3)[/align][table][tr][td=1,2][align=center]组分[/align][/td][td=2,1][align=center]0.8ml/min[/align][/td][td=2,1][align=center]1.0ml/min[/align][/td][td=2,1][align=center]1.2ml/min[/align][/td][/tr][tr][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][/tr][tr][td][align=center]SO4-2[/align][/td][td][align=center]10.471[/align][/td][td][align=center]2.65[/align][/td][td][align=center]8.726[/align][/td][td][align=center]2.54 [/align][/td][td][align=center]7.331 [/align][/td][td][align=center]2.46 [/align][/td][/tr][tr][td][align=center]草酸[/align][/td][td][align=center]13.856[/align][/td][td][align=center]9.34[/align][/td][td][align=center]11.097[/align][/td][td][align=center]9.24 [/align][/td][td][align=center]9.540 [/align][/td][td][align=center]8.95 [/align][/td][/tr][tr][td][align=center]SCN- [/align][/td][td][align=center]24.793[/align][/td][td][align=center]/[/align][/td][td][align=center]20.383[/align][/td][td][align=center]/[/align][/td][td][align=center]17.350 [/align][/td][td][align=center]/[/align][/td][/tr][/table]2.1.4 柱箱温度的确定 考察了柱温在30℃、35℃和40℃时各组分的分离效果,结果显示,在30℃~40℃范围内,草酸和硫氰酸盐均能与氯化物、磷酸盐和硫酸盐等常见阴离子完全的分离,且随着柱温的升高组分的T稍微缩短,R逐渐下降,草酸的S和H均随着柱温的升高而增长,从30℃上升35℃,增长10%左右,35℃上升40℃,增长6%左右;硫氰酸盐的S随着柱温的升高基本保持不变,而其H随着柱温的升高而增长,从30℃上升35℃,增长7%左右,35℃上升40℃,增长9%左右;在保证适宜的T和较高的R的情况下,尽量采用较低的柱温,本试验确定柱箱温度为35℃,这也是产品说明书推荐的柱箱温度。2.2标准曲线按照1.4.1配制标准系列,测定各管的峰面积(S)和峰高(H),以S、H对浓度(C)绘制标准曲线,其标准曲线的线性范围、回归方程、相关系数r(回归曲线的截距、斜率和r由仪器软件给出)列于表3。从表3可见,以峰面积计算的草酸标准曲线的线性优于峰高,硫氰酸盐则反之,同时分段计算的标准曲线的线性较好,故在计算结果时草酸和硫氰酸盐可分别用峰面积和峰高计,并根据样品浓度范围采用分段计算的回归方程来计算,以减少测量误差,尤其对低含量的样品。其中,含10.0mg/L的草酸和硫氰酸盐标准溶液色谱图见图1。[align=center]表3 标准曲线试验结果[/align][table][tr][td=1,2][align=center]组分[/align][/td][td=3,1][align=center]以峰面积计[/align][/td][td=2,1][align=center]以峰高计[/align][/td][/tr][tr][td][align=center]线性范围/mg/L[/align][/td][td][align=center]回归方程[/align][/td][td][align=center]相关系数/r[/align][/td][td][align=center]回归方程[/align][/td][td][align=center]相关系数/r[/align][/td][/tr][tr][td=1,3][align=center]草酸[/align][/td][td][align=center]0.20~10.0[/align][/td][td][align=center]S=96700C-17000[/align][/td][td][align=center]0.99957[/align][/td][td][align=center]H=3320C-770[/align][/td][td][align=center]0.99930 [/align][/td][/tr][tr][td][align=center]10.0~30.0[/align][/td][td][align=center]S=112800C-177600[/align][/td][td][align=center]0.99996[/align][/td][td][align=center]H=3862C-6116[/align][/td][td][align=center]0.99993[/align][/td][/tr][tr][td][align=center]0.20~30.0[/align][/td][td][align=center]S=107100C-53210[/align][/td][td][align=center]0.99929[/align][/td][td][align=center]H=3671C-1995[/align][/td][td][align=center]0.99928[/align][/td][/tr][tr][td=1,3][align=center]SCN- [/align][/td][td][align=center]0.20~10.0[/align][/td][td][align=center]S=114600C+621.7[/align][/td][td][align=center]0.99913[/align][/td][td][align=center]H=2718C-108.6[/align][/td][td][align=center]0.99999[/align][/td][/tr][tr][td][align=center]10.0~30.0[/align][/td][td][align=center]S=124700C-141500[/align][/td][td][align=center]0.99971[/align][/td][td][align=center]H=2934C-2787[/align][/td][td][align=center]0.99984[/align][/td][/tr][tr][td][align=center]0.20~30.0[/align][/td][td][align=center]S=119200C-22340[/align][/td][td][align=center]0.99949[/align][/td][td][align=center]H=2835C-609.3[/align][/td][td][align=center]0.99972[/align][/td][/tr][/table]2.3 方法的精密度和检出限对2种浓度的标准溶液各平行测定5次,计算各成分峰面积的RSD,同时测定仪器30min的基线噪声,以3倍基线噪声除以标准曲线(峰面积计)的斜率(3N/b)计算草酸和硫氰酸[align=center][img=,374,293]https://ng1.17img.cn/bbsfiles/images/2020/09/202009021441333779_9714_3389662_3.png!w374x293.jpg[/img][/align][align=center]图1 标准溶液色谱法图[/align]盐的检出限,5次平行测定的RSD在0.86%~2.26%,方法的重复性良好,方法的检出限分别为0.04 mg/L和0.03 mg/L,见表4。[align=center]表4 方法的精密度和检出限[/align][table][tr][td=1,2][align=center]组分[/align][/td][td=3,1][align=center]标液1[/align][/td][td=3,1][align=center]标液2[/align][/td][td][align=center]检出限/mg/L[/align][/td][/tr][tr][td]浓度/mg/L[/td][td]平均峰面积[/td][td][align=center]RSD/%[/align][/td][td][align=center]浓度/mg/L[/align][/td][td]平均峰面积[/td][td][align=center]RSD/%[/align][/td][/tr][tr][td][align=center]草酸[/align][/td][td][align=center]1.00 [/align][/td][td][align=center]78077.3[/align][/td][td][align=center]2.10[/align][/td][td][align=center]10.00 [/align][/td][td][align=center]955086.6[/align][/td][td][align=center]0.86 [/align][/td][td][align=center]0.04[/align][/td][/tr][tr][td][align=center]SCN- [/align][/td][td][align=center]1.00 [/align][/td][td][align=center]116110.4[/align][/td][td][align=center]2.26[/align][/td][td][align=center]10.00 [/align][/td][td][align=center]1146968.6[/align][/td][td][align=center]1.16 [/align][/td][td][align=center]0.03 [/align][/td][/tr][/table]2.4 [size=12px] [/size]共存阴离子及抗坏血酸的影响由于尿液中含有大量的有机物和氯化物、磷酸盐和硫酸盐等阴离子,尿样通过C18柱的净化可以消除有机物的影响,尿液经10倍稀释以降低氯化物、磷酸盐和硫酸盐的影响。考察了氯化物等3种阴离子对草酸和硫氰酸盐测定结果的影响,结果表明,氯化物、磷酸盐和硫酸盐的保留时间远小于草酸和硫氰酸盐,且500mg/L Cl-、300mg/L H2PO4-、SO4-2(H2PO4-、SO4-2完全分不开合并为一个峰)不影响50mg/L的草酸、3mg/L的测定,分离色谱图见图2。[align=center][img=,379,281]https://ng1.17img.cn/bbsfiles/images/2020/09/202009021441474631_778_3389662_3.png!w379x281.jpg[/img][/align][align=center]图2 常见阴离子与草酸和硫氰酸盐分离色谱图[/align]尿液中可能含有抗坏血酸,在碱性条件下,抗坏血酸易发生降解反应,而草酸是抗坏血酸的降解产物之一,影响草酸的准确测定,有研究显示在15.0mmol/LNaHCO3溶液(pH=8.3)中40mg/L的抗坏血酸在80min内未降解为草酸[17],本试验使用10.0mmol/LNa2CO3溶液(pH≈11.1)为淋洗液,pH值远大于8.3,样品从进样到草酸出峰需要11min多钟,这段时间尿液中的抗坏血酸可能降解生成草酸而影响其测定。试验用纯水配制30mg/L的抗坏血酸观察其降解情况,结果表明,本试验条件下30mg/L的抗坏血酸降解产生约0.3mg/L的草酸,试验采用亚硫酸盐(SO3-2)抑制抗坏血酸的降解,这与在易氧化药物制剂中加入亚硫酸盐以提高药物稳定性的方法有相似原理。[align=center][img=,517,262]https://ng1.17img.cn/bbsfiles/images/2020/09/202009021442032319_2305_3389662_3.png!w517x262.jpg[/img][/align][align=center]图3 抗坏血酸降解抑制试验结果[/align][align=center]曲线1、30mg/L抗坏血酸(黑色)2、1+50 mg/L的SO3-2(粉红色)[/align][align=center] 3、[size=12px]30mg/L抗坏血酸+10mg/L草酸(蓝色)4、3+50 mg/L的SO[/size][size=12px]3[/size][size=12px]-2[/size][size=12px](桔红色)[/size][/align]试验结果显示,50mg/L的SO3-2可抑制30mg/L抗坏血酸的降解,见图3,且至少在120min内30mg/L抗坏血酸对10.0mg/L的草酸的峰面积与峰高无明显影响(增加值5%)。同时50mg/L的SO3-2对草酸和硫氰酸盐的测定结果无明显影响(误差5%),见图4。[align=center][img=,565,254]https://ng1.17img.cn/bbsfiles/images/2020/09/202009021442164802_4125_3389662_3.png!w565x254.jpg[/img][/align][align=center]图4 50mg/L的SO3-2对草酸和硫氰酸盐测定结果的影响[/align][align=center]曲线1、10mg/L草酸和硫氰酸盐(蓝色)[/align][align=center] 2、1+50 mg/L的SO3-2(粉红色)[/align]2.5尿液测定及回收率试验结果按试验方法1.4.3的步骤操作取1.5mL样液于样品瓶中,启动自动进样器进样测定各组分的峰面积(S)和峰高(H),以标准曲线法定量,同时进行加标回收试验。3份尿液草酸和[align=center]表5 尿液测定及回收率试验结果(以峰面积计)[/align][table][tr][td=1,2][align=center]组分[/align][/td][td=3,1][align=center]尿液1[/align][/td][td=3,1][align=center]尿液2[/align][/td][td=3,1][align=center]尿液3[/align][/td][/tr][tr][td][align=center]本底/mg/L[/align][/td][td][align=center]加入量[/align][align=center]/mg/L[/align][/td][td][align=center]回收率/%[/align][/td][td][align=center]本底/mg/L[/align][/td][td][align=center]加入量/mg/L[/align][/td][td][align=center]回收率[/align][align=center]/%[/align][/td][td][align=center]本底[/align][align=center]/mg/L[/align][/td][td]加入量/mg/L[/td][td]回收率/%[/td][/tr][tr][td][align=center]草酸[/align][/td][td][align=center]4.71[/align][/td][td][align=center]10.0[/align][/td][td][align=center]101.1[/align][/td][td][align=center]6.21[/align][/td][td][align=center]5.0[/align][/td][td][align=center]97.0[/align][/td][td][align=center]14.83[/align][/td][td][align=center]2.0[/align][/td][td][align=center]95.0[/align][/td][/tr][tr][td][align=center]SCN-[/align][/td][td][align=center]0.21[/align][/td][td][align=center]10.0[/align][/td][td][align=center]100.5[/align][/td][td][align=center]0.45[/align][/td][td][align=center]5.0[/align][/td][td][align=center]97.2[/align][/td][td][align=center]0.72[/align][/td][td][align=center]2.0[/align][/td][td][align=center]95.5[/align][/td][/tr][/table]硫氰酸盐的测定结果分别在4.71mg/L~14.83mg/L和0.21mg/L~0.72mg/L,加标回收率分别为:95.0%~101.1%和95.5~100.5%,结果见表5。其中尿液2的加标色谱图见图5.[align=center][img=,574,253]https://ng1.17img.cn/bbsfiles/images/2020/09/202009021442298329_66_3389662_3.png!w574x253.jpg[/img][/align][align=center]图5 尿液2及其加标色谱图[/align]曲线1、尿液[align=center] 2、尿液加5mg/L草酸和硫氰酸盐[/align]3 小结本工作采用国产[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]设备,建立了以青岛盛翰色谱公司生产的SH-AC-3型阴离子交换柱为分离柱,10.0mmol/LNa2CO3为淋洗液、流量1.0mL/min等度洗脱,抑制电导检测-[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定尿液中草酸和硫氰酸盐的分析方法。方法具有良好的重现性和准确性,操作简便快速,尿样通过C18柱的净化可以消除有机物的影响,尿液稀释10倍后可降低氯化物、磷酸盐和硫酸盐的影响。方法以自动进样器进样,降低检验人员的工作强度,提高了工作效率,适用尿液中草酸和硫氰酸盐的同时测定。参考文献1)中华人民共和国卫生部.GBZ209-2008职业性急性氰化物中毒诊断标准.北京:人民卫生出版社,20082)顾 欣,黄士新,李丹妮,等.乳中硫氰酸盐对人类健康的风险评估[J],中国兽药杂志,2010,44(9):45-523)WS/T39-1996.尿中硫氰酸盐的吡啶-巴比妥酸分光光度测定方法.北京:中国标准出版社,19974)冯翠霞,林丽玲,黄辉涛.分光光度法测定尿中硫氰酸盐的异烟酸-吡唑酮[J],中国职业医学,2009,36(6):501,5045)黄选忠,汪 波,舒开继等.异烟酸-巴比妥酸分光光度法测定尿硫氰酸盐[J],山东化工,2019,48(20):106-107,1126)钟良康,方波. 超短柱顶空[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法测定尿中硫氰酸盐[J],中国卫生检验杂志,2005,15(5):568,6287)武和平,武景福.尿中硫氰酸盐的[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]测定法[J],职业与健康,2005,21(1):40-418)马腾骧,孙 光. 现代泌尿外科学[M].天津:天津科学技术出版社,2000:587-5889)李桂兰.锆-偶氮胂Ⅲ络合物比色法测定尿草酸[J].临床检验杂志,1997,15(2):86-8710)张爱梅,贾丽萍,牛学丽.表面活性剂增敏阻抑动力学光度法测定痕量草酸[J].分析化学,2003,31(9):1115-111811)麻全生,杨文初.铬酸钾氧化甲基红催化光度法测定微量草酸[J].理化检验化学分册,1998,37(7):309-31012)冯素玲,陈小兰,樊 静,等.抑制动力学荧光法测定草酸[J].分析化学,2000,28(5):621-62313)陈兰化,赵丹华.催化荧光法测定痕量草酸[J].光谱学与光谱分析,2003,23(1):203-20414)廖贤平,宋光庆.HPLC法同时测定尿液中草酸和枸橼酸含量的方法学评价及临床应用[J].武警医学院学报,2010,19(1):47-5015)彭 婕,郭卫红,谈恒山,等.高效液相色谱法测定人尿液中草酸的含量[J].中国医院药学杂志,2006,26(3):299-30116)谈绮文,郭 玮,顾梅秀,等.高效毛细管电泳法测定尿液中微量草酸和柠檬酸[J].中华检验医学杂志,2014,37(4):281-28417)杭义萍,卢祝靓子,杨春英.抗坏血酸存在下[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法直接测定尿液中草酸含量的研究[J].分析科学学报,2014,33(11):1307-131118)颜金良,高 杰,颜勇卿,等.[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法快速测定人尿液中草酸含量研究[J],中国卫生检验杂志,2009,19(3):554-55519)郭爱华,袁 佗,王 玮.[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法快速测定人尿中的硫氰酸盐[J],环境与职业医学,2015,32(6):593-59620)何 漪,王 钟,刘月月,等.抑制电导检测-[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法测定人尿中硫氰酸盐[J].现代预防医学,2017,44(22):4165-4167
高草酸蔬菜有菠菜、茭白、韭菜、苋菜、竹笋等。摄入过多草酸,会和尿酸争夺排泄机会,甚至和体内的钙结合,产生草酸钙,使得结石进一步加重。建议先焯水,而后再烹饪。
最近有个项目,用[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]质谱检测尿液中的草酸。用什么样的色谱柱,和流动相能提高草酸的保留呀
请求帮助,急!昨天做实验,用EDTA滴定草酸合铜酸钾溶液中的铜离子,具体的做法是准确称取0.17~0.19g的产物,用15mL氨-氯化铵缓冲溶液(pH=10)溶解,再稀释至100mL.以紫脲酸胺为指示剂,用EDTA标准液滴定至溶液由亮黄至紫色.但我做的却没有亮黄色.不知道是什么原因哪儿出错了.请专家们能给我指导,谢谢!
请求帮助,急!昨天做实验,用EDTA滴定草酸合铜酸钾溶液中的铜离子,具体的做法是准确称取0.17~0.19g的产物,用15mL氨-氯化铵缓冲溶液(pH=10)溶解,再稀释至100mL.以紫脲酸胺为指示剂,用EDTA标准液滴定至溶液由亮黄至紫色.但我做的却没有亮黄色.不知道是什么原因哪儿出错了.请专家们能给我指导,谢谢!
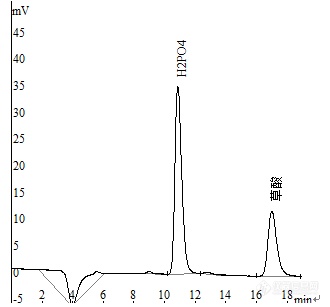
[align=center][font=宋体][color=#444444][back=#F9F9F9][url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定尿液中磷酸盐和草酸[/back][/color][/font][/align][align=center][font=楷体_GB2312]黄选忠[/font][/align][align=center][font=宋体](湖北兴山县疾病预防控制中心,湖北兴山,443711)[/font][/align][b][font=宋体]摘要:[/font][/b][font=宋体]【目的】建立以SH-AC-3型阴离子交换柱为分离柱,[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定尿样中磷酸盐和草酸的新方法。【方法】研究用[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定尿液中磷酸盐和草酸的色谱条件,通过试验优化确定了各项色谱条件。【结果】以SH-AC-3型阴离子交换柱为分离柱,以6.0mmol/LNa[sub]2[/sub]CO[sub]3[/sub]-2.0mmol/LNaHCO[sub]3[/sub]为淋洗液,流量为1.0mL/min,等度洗脱可将磷酸盐和草酸与尿液中大量共存的氯化物、硝酸盐和硫酸盐等常见阴离子完全分离,通过抑制电导检测,磷酸盐含量分别在0.20~20.0mg/L、20.0~100.0mg/L,草酸的含量分别在0.05~5.0mg/L、5.0~25.0mg/L范围内与其峰高和峰面积呈良好的线性关系(相关系数r在0.9995~0.9998),方法应用于尿液中磷酸盐和草酸的同时测定,加标回收率分别为94.5%[/font][font=宋体]~104.7%和96.0~104.2%,[/font][font=宋体] 5[/font][font=宋体]次平行测定的相对标准偏差(RSD)小于3%(n=5)。【结论】本方法可用于尿液中磷酸盐和草酸的同时测定。[/font][b][font=宋体]关键词:[/font][/b][font=宋体][url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法;[/font][font=宋体][color=#444444][back=#F9F9F9]尿液[/back][/color][/font][font=宋体];硫氰酸盐;草酸;[/font][b][font=宋体]中图分类号:[/font][/b][font=宋体]O652.63[b] [/b][/font][b][font=宋体]文献标识码: 文章编号:[/font][/b][font=宋体] [/font][font=宋体]泌尿系结石是临床上的常见病和多发病。其中纯草酸钙结石占85%以上,草酸钙+磷酸钙结石占10%以上[sup][1][/sup]。草酸代谢异常所引起的高含量草酸尿是泌尿系结石形成的主要原因[sup][2][/sup]。因此准确测定尿液中磷酸盐和草酸含量对研究结石形成机理、结石的鉴别等均具有重要意义。目前尿液中的磷酸盐(无机磷)的测定在《全国临床检验操作规程》中推荐的方法包括磷钼杂多酸紫外光度法和以硫酸亚铁或对甲氨基酚硫酸盐为还原剂的钼兰光度法[sup][3][/sup],文献用氨基奈酚磺酸为还原剂的钼兰光度法[sup][4][/sup]测定尿磷,这些方法中紫外光度法存在干扰因素多,选择性差,而钼兰光度法则存在稳定性较差操作繁杂之缺憾。尿液中草酸的测定方法主要有光度法包括络合物褪色比色法[sup][5][/sup]和催化光度法[sup][6][/sup]、催化荧光法[sup][7][/sup]、高效液相色谱法[sup][8][/sup]和毛细管电泳法[sup][9][/sup]等,而比色法、光度法、荧光法等方法特异性差,样品前处理繁杂,高效液相色谱法和毛细管电泳法因需要专用仪器而使其应用受到限制。[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法以其操作简便、样品无须特殊处理、易实现自动化和可多组分同时测定的优势现已成为无机阴离子和有机酸测定的首选方法,并成功应用于尿液中草酸[sup][10][/sup]的测定和草酸、磷酸根及枸橼酸的同时测定[sup][11][/sup],但这类方法大多使用的是进口仪器并采用梯度洗脱的方式进行使其应用受限。本工作利用国产盛瀚CIC-100型[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱仪[/color][/url]和SH-AC-3型阴离子交换柱,以6.0mmol/LNa[sub]2[/sub]CO[sub]3[/sub]-2.0mmol/L NaHCO[sub]3[/sub]溶液为淋洗液, 1.0mL/min的流量等度洗脱,[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]-抑制电导检测法同时测定尿液中磷酸盐和草酸的新方法,磷酸盐含量分别在0.20~20.0mg/L、20.0~100.0mg/L,草酸的含量分别在0.05~5.0mg/L、5.0~25.0mg/L范围内与其峰高和峰面积呈良好的线性关系(相关系数r在0.9995~0.9998),方法应用于尿液中磷酸盐和草酸的同时测定,加标回收率分别为:[/font][font=宋体]94.5%[/font][font=宋体]~104.7%和96.0~104.2%,[/font][font=宋体]5[/font][font=宋体]次平行测定的相对标准偏差(RSD)[/font][font=宋体]在0.85%[/font][font=宋体]~2.07%[/font][font=宋体],以3倍信噪比(3N/b)计,磷酸盐和草酸最低检出浓度分别为0.10mg/L和0.04mg/L。[/font][b][font=宋体]1[/font][font=宋体]、试验部分[/font][font=宋体]1.1[/font][/b][font=宋体]主要仪器[/font][font=宋体]CIC-100[/font][font=宋体]型[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱仪[/color][/url](青岛盛瀚色谱公司,编号15601),抑制器:自再生抑制器,检测器:电导检测器,定量环体积为25μL;SHA—15自动进样器(青岛盛瀚色谱公司,编号AS1518050);SH-AC-3型阴离子交换柱(250×4.0mm i.d,青岛盛瀚色谱公司,批号:1602037);SH-AC-3型保护柱(50×4.0mm i.d,青岛盛瀚色谱公司,批号:1602037)。[/font][b][font=宋体]1.2[/font][/b][font=宋体]仪器工作条件及参数设置[/font][font=宋体]色谱仪:柱箱温度35℃,电流:75mA,量程:1档。[/font][font=宋体]自动进样器:全定量环取样,取样后清洗(每针之间),置换量70μL,取样量25μL,扎针深度4mm。[/font][b][font=宋体]1.3[/font][/b][font=宋体]主要试剂[/font][font=宋体]草酸标准溶液:1000 mg/L,称取优级纯草酸(H[sub]2[/sub]C[sub]2[/sub]O[sub]4[/sub]2H[sub]2[/sub]O)0.1401g用超纯水溶解,转入100mL容量瓶加水至刻度;H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup]标准溶液:1000mg/L,称取分析纯磷酸二氢钾0.1402g用超纯水溶解,转入100mL容量瓶加水至刻度。[/font][font=宋体]用前将各种标准溶液用纯水分别稀释成含H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup]和草酸分别为20.0mg/L和5.0mg/L(A液)、H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup]和草酸分别为200.0mg/L和50.0mg/L(B液)混合标准应用液备用。[/font][font=宋体]无水碳酸钠(分析纯,国药集团化学试剂有限公司),草酸(优级纯,国药集团化学试剂有限公司),磷酸二氢钾(分析纯,国药集团化学试剂有限公司)。[/font][font=宋体]试验所用其他试剂均为AR级,试验用水为超纯水[/font][font=宋体]([/font][font=宋体]18.2[/font][font=宋体]ΜΩcm[/font][font=宋体])[/font][font=宋体]。[/font][b][font=宋体]1.4[/font][/b][font=宋体]试验方法[/font][align=left][b][font=宋体]1.4.1[/font][/b][font=宋体]标准曲线的绘制 取混合标准应用液(A液)0.10、0.20、0.40、1.0和2.00mL及B液1.0、2.0、4.0和5.00mL于10mL容量瓶中加纯水至刻度,混匀,配制成含H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup]0.20[/font][font=宋体]~[/font][font=宋体]100.0 mg/L[/font][font=宋体]、草酸为0.05[/font][font=宋体]~[/font][font=宋体]25.0 mg/L[/font][font=宋体]的标准系列,各管取1.5mL于样品瓶中,启动自动进样器进样分别测定各组分的峰面积(S)和峰高(H),以S及H对各组分浓度(C)绘制工作曲线。[/font][/align][align=left][b][font=宋体]1.4.2[/font][/b][font=宋体]尿样的采集 用清洗干净并干燥的聚乙烯瓶采集尿样50mL储存于4℃冰箱待测定。[/font][/align][b][font=宋体]1.4.3[/font][/b][font=宋体]尿样测定 取新鲜尿样经8000转/[/font][font=宋体]min[/font][font=宋体]离心10min,取上清液[/font][font=宋体]用高纯水稀释50或100倍后分别用C18柱净化、用0.22μm滤膜过滤后取1.5mL于样品瓶中,启动自动进样器进样测定各组分的S和H,以标准曲线法定量,同时进行加标回收试验。[/font][b][font=宋体]2[/font][font=宋体]、结果与讨论[/font][font=宋体]2.1[/font][/b][font=宋体]色谱条件的选择[/font][b][font=宋体]2.1.1[/font][/b][font=宋体]淋洗液浓度的选择 试验结果表明,当以Na[sub]2[/sub]CO[sub]3[/sub]+NaHCO[sub]3[/sub]溶液为淋洗液,其浓度在6 mmol/L+1 mmol/L[/font][font=宋体]~[/font][font=宋体]6 mmol/L+3 mmol/L[/font][font=宋体]范围内,SH-AC-3型阴离子交换柱均可将磷酸盐(以[/font][font=宋体]H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup][/font][font=宋体]计,在本试验条件下,H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup]和HPO[sub]4[/sub][/font][sup][font=宋体]2-[/font][/sup][font=宋体]和并为一个峰,实际上H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup]已转化成HPO[sub]4[/sub][/font][sup][font=宋体]2-[/font][/sup][font=宋体])[/font][font=宋体]与硝酸盐和硫酸盐、草酸与硫酸盐和硫氰酸盐等常见阴离子完全分离,各组分的分离度(R,相对于后续组分,如磷酸盐的R是相对于硫酸盐的,下同)在1.50[/font][font=宋体]~6.49,[/font][font=宋体]满足相邻两峰完全分离(R=1.5)的标准[sup][12][/sup],[/font][font=宋体]试验[/font][font=宋体]选择6.0mmol/LNa[sub]2[/sub]CO[sub]3[/sub]-2.0mmol/L NaHCO[sub]3[/sub]溶液为淋洗液,试验结果见表1。[/font][font=宋体] [/font][align=center][font=宋体]表1 Na[sub]2[/sub]CO[sub]3[/sub]+NaHCO[sub]3[/sub]溶液浓度(mmol/L)选择试验结果(流量1.0 ml/min)[/font][/align] [table=472][tr][td=1,2] [align=center][font=宋体]组分[/font][/align] [/td][td=2,1] [align=center][font=宋体]6.0mmol/L+1.0mmol/L[/font][/align] [/td][td=2,1] [align=center][font=宋体]6.0mmol/L+2.0mmol/L[/font][/align] [/td][td=2,1] [align=center][font=宋体]6.0mmol/L+3.0mmol/L[/font][/align] [/td][/tr][tr][td] [align=center][font=宋体]T/min[/font][/align] [/td][td] [align=center][font=宋体]R[/font][/align] [/td][td] [align=center][font=宋体]T/min[/font][/align] [/td][td] [align=center][font=宋体]R[/font][/align] [/td][td] [align=center][font=宋体]T/min[/font][/align] [/td][td] [align=center][font=宋体]R[/font][/align] [/td][/tr][tr][td] [align=center][font=宋体]H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup][/font][/align] [/td][td] [align=center][font=宋体]11.561[/font][/align] [/td][td] [align=center][font=宋体]1.50[/font][/align] [/td][td] [align=center][font=宋体]10.991[/font][/align] [/td][td] [align=center][font=宋体]2.59[/font][/align] [/td][td] [align=center][font=宋体]10.688[/font][/align] [/td][td] [align=center][font=宋体]2.83[/font][/align] [/td][/tr][tr][td] [align=center][font=宋体]SO[sub]4[/sub][sup]2-[/sup][/font][/align] [/td][td] [align=center][font=宋体]12.778[/font][/align] [/td][td] [align=center][font=宋体]4.13[/font][/align] [/td][td] [align=center][font=宋体]13.144[/font][/align] [/td][td] [align=center][font=宋体]4.29 [/font][/align] [/td][td] [align=center][font=宋体]13.054[/font][/align] [/td][td] [align=center][font=宋体]4.28[/font][/align] [/td][/tr][tr][td] [align=center][font=宋体]草酸[/font][/align] [/td][td] [align=center][font=宋体]16.797[/font][/align] [/td][td] [align=center][font=宋体]6.14[/font][/align] [/td][td] [align=center][font=宋体]17.271[/font][/align] [/td][td] [align=center][font=宋体]6.49[/font][/align] [/td][td] [align=center][font=宋体]17.098[/font][/align] [/td][td] [align=center][font=宋体]6.46 [/font][/align] [/td][/tr][tr][td] [align=center][font=宋体]SCN[sup]-[/sup] [/font][/align] [/td][td] [align=center][font=宋体]24.891[/font][/align] [/td][td] [align=center][font=宋体]/[/font][/align] [/td][td] [align=center][font=宋体]24.927[/font][/align] [/td][td] [align=center][font=宋体]/[/font][/align] [/td][td] [align=center][font=宋体]25.337 [/font][/align] [/td][td] [align=center][font=宋体]/[/font][/align] [/td][/tr][/table][b][font=宋体]2.1.2[/font][/b][font=宋体]淋洗液流量的选择 对于一定的淋洗液,不同的流量将使组分的保留时间(T)和分离度将发生变化。试验结果表明,当淋洗液流量从0.8mL/min增加至1.2mL/min时,各组分的保留时间逐渐缩短,分离度逐渐变小,但磷酸盐和草酸的分离度远大于1.5,表明相邻两组分已[/font][font=宋体]完全分离,见表2。[/font][font=宋体]在保证待测组分与干扰离子完全分离的前提下尽量使用较低的流量,以降低系统压力延长泵的使用寿命,故淋洗液[/font][font=宋体]流量选定为[/font][font=宋体]1.0mL/min[/font][font=宋体]。[/font][align=center][font=宋体]表2 淋洗液流量选择试验结果(6.0mmol/LNa[sub]2[/sub]CO[sub]3[/sub]-2.0mmol/LNaHCO[sub]3[/sub])[/font][/align] [table=528][tr][td=1,2] [align=center][font=宋体]组分[/font][/align] [/td][td=2,1] [align=center][font=宋体]0.8ml/min[/font][/align] [/td][td=2,1] [align=center][font=宋体]1.0ml/min[/font][/align] [/td][td=2,1] [align=center][font=宋体]1.2ml/min[/font][/align] [/td][/tr][tr][td] [align=center][font=宋体]T[/font][font=宋体]/min[/font][/align] [/td][td] [align=center][font=宋体]R[/font][/align] [/td][td] [align=center][font=宋体]T[/font][font=宋体]/min[/font][/align] [/td][td] [align=center][font=宋体]R[/font][/align] [/td][td] [align=center][font=宋体]T[/font][font=宋体]/min[/font][/align] [/td][td] [align=center][font=宋体]R[/font][/align] [/td][/tr][tr][td] [align=center][font=宋体]H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup][/font][/align] [/td][td] [align=center][font=宋体]13.543[/font][/align] [/td][td] [align=center][font=宋体]2.75[/font][/align] [/td][td] [align=center][font=宋体]10.969[/font][/align] [/td][td] [align=center][font=宋体]2.63 [/font][/align] [/td][td] [align=center][font=宋体]9.151 [/font][/align] [/td][td] [align=center][font=宋体]2.57 [/font][/align] [/td][/tr][tr][td] [align=center][font=宋体]SO[sub]4[/sub][sup]2-[/sup][/font][/align] [/td][td] [align=center][font=宋体]16.282[/font][/align] [/td][td] [align=center][font=宋体]4.50[/font][/align] [/td][td] [align=center][font=宋体]13.178[/font][/align] [/td][td] [align=center][font=宋体]4.30[/font][/align] [/td][td] [align=center][font=宋体]10.995[/font][/align] [/td][td] [align=center][font=宋体]4.24[/font][/align] [/td][/tr][tr][td] [align=center][font=宋体]草酸[/font][/align] [/td][td] [align=center][font=宋体]21.338[/font][/align] [/td][td] [align=center][font=宋体]6.64[/font][/align] [/td][td] [align=center][font=宋体]17.320[/font][/align] [/td][td] [align=center][font=宋体]6.52 [/font][/align] [/td][td] [align=center][font=宋体]14.480[/font][/align] [/td][td] [align=center][font=宋体]6.48 [/font][/align] [/td][/tr][tr][td] [align=center][font=宋体]SCN[sup]-[/sup] [/font][/align] [/td][td] [align=center][font=宋体]30.636[/font][/align] [/td][td] [align=center][font=宋体]/[/font][/align] [/td][td] [align=center][font=宋体]25.047[/font][/align] [/td][td] [align=center][font=宋体]/[/font][/align] [/td][td] [align=center][font=宋体]21.175 [/font][/align] [/td][td] [align=center][font=宋体]/[/font][/align] [/td][/tr][/table][b][font=宋体]2.1.3[/font][/b][font=宋体]色谱柱的选择 在[/font][font=宋体]6.0mmol/LNa[sub]2[/sub]CO[sub]3[/sub]-2.0mmol/LNaHCO[sub]3[/sub][/font][font=宋体]溶液流量1.0mL/min洗脱条件下[/font][font=宋体],考察了青岛盛翰色谱公司生产的SH-AC-1型和SH-AC-3型阴离子交换柱对磷酸盐与硝酸盐和硫酸盐、草酸与硫酸盐和硫氰酸盐等常见[/font][font=宋体]阴离子[/font][font=宋体]的分离情况,结果表明,在此条件下SH-AC-1型柱对磷酸盐与硝酸盐和硫酸盐、草酸与硫酸盐的分离效果比SH-AC-3型柱要差,各组分分离度明显偏低,故本试验选择SH-AC-3型阴离子交换柱为分离柱。[/font][b][font=宋体]2.1.4[/font][/b][font=宋体]柱箱温度的确定 考察了柱温在30℃、35℃和40℃时各组分的分离效果,结果显示,在30℃[/font][font=宋体]~[/font][font=宋体]40[/font][font=宋体]℃范围内,磷酸盐与硝酸盐、硫酸盐,草酸与硫酸盐、硫氰酸盐等[/font][font=宋体]阴离子[/font][font=宋体]完全分离,且随着柱温的升高组分的保留时间稍微缩短,分离度逐渐下降,但均在1.5以上,在保证适宜的保留时间和较高的分离度的前提下,尽量采用较低的柱温,本试验确定柱箱温度为35℃。[/font][b][font=宋体]2.2[/font][/b][font=宋体]标准曲线[/font][font=宋体]按照1.4.1配制标准系列,测定各管的峰面积(S)和峰高(H),以S、H对浓度(C)绘制标准曲线,其标准曲线的试验结果列于表3。从表3可见,H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup]分别在0.20~20.0mg/L[/font][font=宋体]和[/font][font=宋体]20.0[/font][font=宋体]~100.0mg/L范围内与峰面积和峰高均呈良好的线性关系,相关系数r在0.9995[/font][font=宋体]~0.9997[/font][font=宋体],但在[/font][font=宋体]0.20[/font][font=宋体]~100.0mg/L范围内则线性较差,以峰面积和峰高计相关系数r仅为0.9990和0.9983。[/font][font=宋体]草酸则分别在0.05~5.0mg/L[/font][font=宋体]和[/font][font=宋体]5.0[/font][font=宋体]~25.0mg/L [/font][font=宋体]范围内与峰面积和峰高均呈良好的线性关系,相关系数r在0.9994[/font][font=宋体]~0.9998[/font][font=宋体],在[/font][font=宋体]0.05[/font][font=宋体]~25.0mg/L [/font][font=宋体]范围内时[/font][font=宋体]则[/font][font=宋体]线性较差,但[/font][font=宋体]相关系数r仍达0.9995和0.9991,能满足分析方法的相关要求[/font][font=宋体]。同时在计算测定结果时均可分别用峰面积和峰高计,并应根据样品浓度范围采用分段计算的方式计算结果,以减少测量误差,尤其对低含量的样品。其中,含20.0mg/L的H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup]和5.0mg/L的草酸标准溶液色谱图见图1。[/font][align=center][font=宋体]表3 标准曲线试验结果[/font][/align] [table=589][tr][td=1,2] [align=center][font=宋体]组分[/font][/align] [/td][td=3,1] [align=center][font=宋体]以峰面积计[/font][/align] [/td][td=2,1] [align=center][font=宋体]以峰高计[/font][/align] [/td][/tr][tr][td] [align=center][font=宋体]线性范围/mg/L[/font][/align] [/td][td] [align=center][font=宋体]回归方程[/font][/align] [/td][td] [align=center][font=宋体]相关系数/[i]r[/i][/font][/align] [/td][td] [align=center][font=宋体]回归方程[/font][/align] [/td][td] [align=center][font=宋体]相关系数/[i]r[/i][/font][/align] [/td][/tr][tr][td=1,3] [align=center][font=宋体]H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup][/font][/align] [/td][td] [align=center][font=宋体]0.20[/font][font=宋体]~20.0[/font][/align] [/td][td] [align=center][font=宋体]S=54739.17C-13358.36[/font][/align] [/td][td] [align=center][font=宋体]0.99973[/font][/align] [/td][td] [align=center][font=宋体]H=1778.29C-410.68[/font][/align] [/td][td] [align=center][font=宋体]0.99959 [/font][/align] [/td][/tr][tr][td] [align=center][font=宋体]20.0[/font][font=宋体]~100.0[/font][/align] [/td][td] [align=center][font=宋体]S=70195.33C-375912.30[/font][/align] [/td][td] [align=center][font=宋体]0.99975[/font][/align] [/td][td] [align=center][font=宋体]H=2457.32C-16524.20[/font][/align] [/td][td] [align=center][font=宋体]0.99951[/font][/align] [/td][/tr][tr][td] [align=center][font=宋体]0.20[/font][font=宋体]~100.0[/font][/align] [/td][td] [align=center][font=宋体]S=66382.29C-82677.80[/font][/align] [/td][td] [align=center][font=宋体]0.99902[/font][/align] [/td][td] [align=center][font=宋体]H=2287.74C-3482.42[/font][/align] [/td][td] [align=center][font=宋体]0.99833[/font][/align] [/td][/tr][tr][td=1,3] [align=center][font=宋体]草酸[/font][/align] [/td][td] [align=center][font=宋体]0.05[/font][font=宋体]~5.0[/font][/align] [/td][td] [align=center][font=宋体]S=100896.10C-4446.88[/font][/align] [/td][td] [align=center][font=宋体]0.99952[/font][/align] [/td][td] [align=center][font=宋体]H=2475.41C-94.43[/font][/align] [/td][td] [align=center][font=宋体]0.99947[/font][/align] [/td][/tr][tr][td] [align=center][font=宋体]5.0[/font][font=宋体]~25.0[/font][/align] [/td][td] [align=center][font=宋体]S=115321.78C-25752.87[/font][/align] [/td][td] [align=center][font=宋体]0.99951[/font][/align] [/td][td] [align=center][font=宋体]H=3130.88C-3837.95[/font][/align] [/td][td] [align=center][font=宋体]0.99982[/font][/align] [/td][/tr][tr][td] [align=center][font=宋体]0.05[/font][font=宋体]~25.0[/font][/align] [/td][td] [align=center][font=宋体]S=116032.36C-39070.40[/font][/align] [/td][td] [align=center][font=宋体]0.99953[/font][/align] [/td][td] [align=center][font=宋体]H=2973.73C-818.44[/font][/align] [/td][td] [align=center][font=宋体]0.99917[/font][/align] [/td][/tr][/table][b][font=宋体]2.3[/font][/b][font=宋体]方法的精密度和检出限[/font][font=宋体]对高、低浓度的标准溶液各平行测定5次,计算[/font][font=宋体]磷酸盐和草酸[/font][font=宋体]峰面积的RSD,[/font][font=宋体]同时测定[/font][font=宋体]仪器30min的基线噪声,以3倍基线噪声除以标准曲线(峰面积计)的斜率[/font][font=宋体](3N/b)[/font][font=宋体]计算[/font][font=宋体]磷[/font][align=center][font='Times New Roman','serif'][img=,330,307]https://ng1.17img.cn/bbsfiles/images/2020/09/202009110906325399_3004_3389662_3.png!w330x307.jpg[/img][/font][/align][align=center][font=宋体]图1 标准溶液色谱法图[/font][/align][align=left][font=宋体]酸盐和草酸[/font][font=宋体]的检出限,[/font][font=宋体]5[/font][font=宋体]次平行测定的[/font][font=宋体]RSD[/font][font=宋体]在0.85%[/font][font=宋体]~2.07%[/font][font=宋体],方法的重复性良好,磷酸盐和草酸的最低检出浓度分别为0.10mg/L和0.04 mg/L,若以尿样稀释50倍计,则磷酸盐和草酸的检出限分别为5.0mg/L和2.0 mg/L,见表4。[/font][/align][align=center][font=宋体]表4 [/font][font=宋体]方法的精密度和检出限[/font][/align] [table=520][tr][td=1,2] [align=center][font=宋体]组分[/font][/align] [/td][td=3,1] [align=center][font=宋体]标液1[/font][/align] [/td][td=3,1] [align=center][font=宋体]标液2[/font][/align] [/td][td=1,2] [align=center][font=宋体]检出限/mg/L[/font][/align] [/td][/tr][tr][td] [font=宋体]浓度/mg/L[/font] [/td][td] [align=left][font=宋体]平均峰面积[/font][/align] [/td][td] [align=center][font=宋体]RSD/%[/font][/align] [/td][td] [align=center][font=宋体]浓度/mg/L[/font][/align] [/td][td] [align=left][font=宋体]平均峰面积[/font][/align] [/td][td] [align=center][font=宋体]RSD/%[/font][/align] [/td][/tr][tr][td] [align=center][font=宋体]H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup][/font][/align] [/td][td] [align=center][font=宋体]4.0[/font][/align] [/td][td] [align=center][font=宋体]201934.4[/font][/align] [/td][td] [align=center][font=宋体]2.07[/font][/align] [/td][td] [align=center][font=宋体]20.0[/font][/align] [/td][td] [align=center][font=宋体]1083821.5[/font][/align] [/td][td] [align=center][font=宋体]1.38[/font][/align] [/td][td] [align=center][font=宋体]0.10[/font][/align] [/td][/tr][tr][td] [align=center][font=宋体]草酸[/font][/align] [/td][td] [align=center][font=宋体]1.0 [/font][/align] [/td][td] [align=center][font=宋体]98277.4[/font][/align] [/td][td] [align=center][font=宋体]1.45[/font][/align] [/td][td] [align=center][font=宋体]5.0 [/font][/align] [/td][td] [align=center][font=宋体]500710.4[/font][/align] [/td][td] [align=center][font=宋体]0.85 [/font][/align] [/td][td] [align=center][font=宋体]0.04[/font][/align] [/td][/tr][/table][b][font=宋体]2.4[/font][/b][font=宋体] [/font][font=宋体]共存阴离子[/font][font=宋体]的影响[/font][font=宋体]在本试验条件下,磷酸盐[/font][font=宋体]和草酸与常见阴离子的色谱图见图2,从图2可见,目标组分与常见阴离子能完全分离。但[/font][font=宋体]尿液中含有大量的有机物和氯化物、硝酸盐和硫酸盐等阴离子,[/font][align=center][img=,411,318]https://ng1.17img.cn/bbsfiles/images/2020/09/202009110906424636_6899_3389662_3.png!w411x318.jpg[/img][/align][align=center][font=宋体]图[/font][font=宋体]2 [/font][font=宋体]磷酸盐、草酸与常见阴离子分离色谱图[/font][/align][font=宋体]当尿样经50或100倍稀释后可降低氯化物、硝酸盐和硫酸盐等阴离子的影响,经过C18柱的净化可以消除有机物的干扰。试验特别考察了氯化物、硝酸盐和硫酸盐对磷酸盐[/font][font=宋体]和草酸[/font][font=宋体]测定结果的影响,结果表明,[/font][font=宋体]500mg/L[/font][font=宋体] Cl[sup]-[/sup][/font][font=宋体]、300mg/L[/font][font=宋体] NO[sub]3[/sub][/font][sup][font=宋体]-[/font][/sup][font=宋体]、200mg/L[/font][font=宋体] SO[sub]4[/sub][sup]-2[/sup][/font][font=宋体]对[/font][font=宋体]4.0mg/L[/font][font=宋体]磷酸盐[/font][font=宋体]和1.0mg/L草酸[/font][font=宋体]的[/font][font=宋体]测定结果无明显影响(测量误差在±5%范围内),[/font][font=宋体]分离色谱图[/font][font=宋体]见[/font][font=宋体]图3,说明方法有较好抗干扰能力。[/font][font=宋体] [/font][align=center][img=,380,341]https://ng1.17img.cn/bbsfiles/images/2020/09/202009110906503039_3767_3389662_3.png!w380x341.jpg[/img][/align][align=center][font=宋体]图[/font][font=宋体]3 [/font][font=宋体]磷酸盐、草酸与[/font][font=宋体]500mg/L[/font][font=宋体] Cl[sup]-[/sup][/font][font=宋体]、300mg/L[/font][font=宋体] NO[sub]3[/sub][/font][sup][font=宋体]-[/font][/sup][font=宋体]、200mg/L[/font][font=宋体] SO[sub]4[/sub][sup]-2[/sup][/font][font=宋体]分离色谱图[/font][/align][b][font=宋体]2.5[/font][/b][font=宋体]尿样测定及回收率试验结果[/font][font=宋体]按试验方法1.4.3的步骤对尿样进行处理后取1.5mL样液于样品瓶中,启动自动进样器进样测定各组分的峰面积(S)和峰高(H),以标准曲线法定量,同时进行加标回收试验。3[/font][align=center][font=宋体]表5 尿样(稀释50倍)测定及回收率试验结果(以峰面积计)[/font][/align] [table=569][tr][td=1,2] [align=center][font=宋体]组分[/font][/align] [/td][td=3,1] [align=center][font=宋体]尿样1[/font][/align] [/td][td=3,1] [align=center][font=宋体]尿样2[/font][/align] [/td][td=3,1] [align=center][font=宋体]尿样3[/font][/align] [/td][/tr][tr][td] [align=center][font=宋体]本底/mg/L[/font][/align] [/td][td] [align=center][font=宋体]加入量[/font][/align] [align=center][font=宋体]/mg/L[/font][/align] [/td][td] [align=center][font=宋体]回收率[/font][/align] [align=center][font=宋体]/%[/font][/align] [/td][td] [align=center][font=宋体]本底[/font][/align] [align=center][font=宋体]/mg/L[/font][/align] [/td][td] [align=center][font=宋体]加入量[/font][/align] [align=center][font=宋体]/mg/L[/font][/align] [/td][td] [align=left][font=宋体]回收率[/font][/align] [font=宋体]/%[/font] [/td][td] [align=center][font=宋体]本底[/font][/align] [align=center][font=宋体]/mg/L[/font][/align] [/td][td] [align=left][font=宋体]加入量[/font][/align] [font=宋体]/mg/L[/font] [/td][td] [font=宋体]回收率[/font][font=宋体]/%[/font] [/td][/tr][tr][td] [align=center][font=宋体]H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup][/font][/align] [/td][td] [align=center][font=宋体]18.11[/font][/align] [/td][td] [align=center][font=宋体]20.0[/font][/align] [/td][td] [align=center][font=宋体]104.7[/font][/align] [/td][td] [align=center][font=宋体]14.72[/font][/align] [/td][td] [align=center][font=宋体]10.0[/font][/align] [/td][td] [align=center][font=宋体]99.3[/font][/align] [/td][td] [align=center][font=宋体]19.83[/font][/align] [/td][td] [align=center][font=宋体]4.0[/font][/align] [/td][td] [align=center][font=宋体]94.5[/font][/align] [/td][/tr][tr][td] [align=center][font=宋体]草酸[/font][/align] [/td][td] [align=center][font=宋体]0.74[/font][/align] [/td][td] [align=center][font=宋体]5.0[/font][/align] [/td][td] [align=center][font=宋体]104.2[/font][/align] [/td][td] [align=center][font=宋体]0.44[/font][/align] [/td][td] [align=center][font=宋体]2.50[/font][/align] [/td][td] [align=center][font=宋体]98.4[/font][/align] [/td][td] [align=center][font=宋体]0.62[/font][/align] [/td][td] [align=center][font=宋体]1.0[/font][/align] [/td][td] [align=center][font=宋体]96.0[/font][/align] [/td][/tr][/table][font=宋体]份尿样(稀释50倍)磷酸盐和草酸的测定结果分别在14.72mg/L[/font][font=宋体]~18.11[/font][font=宋体]mg/L[/font][font=宋体]和0.44mg/L[/font][font=宋体]~[/font][img=,593,257]https://ng1.17img.cn/bbsfiles/images/2020/09/202009110906594847_9216_3389662_3.png!w593x257.jpg[/img][align=center][font=宋体]图4 尿样及其加标色谱图[/font][/align][font=宋体]曲线1、尿样[/font][align=center][font=宋体] 2[/font][font=宋体]、尿样加20mg/L[/font][font=宋体]的H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup]和[/font][font=宋体]5mg/L[/font][font=宋体]草酸[/font][/align][font=宋体]0.74[/font][font=宋体]mg/L[/font][font=宋体],加标回收率分别为:94.5%[/font][font=宋体]~104.7%和96.0~104.2%,[/font][font=宋体]结果见表5。其中尿样1本[/font][font=宋体]底及加标样色谱图见图4.[/font][b][font=宋体]3 [/font][font=宋体]小结[/font][/b][font=宋体]本工作采用国产[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]设备,建立了以SH-AC-3型阴离子交换柱为分离柱,[/font][font=宋体]6.0mmol/LNa[sub]2[/sub]CO[sub]3[/sub]-2.0mmol/LNaHCO[sub]3[/sub][/font][font=宋体]溶液[/font][font=宋体]为淋洗液、流量1.0mL/min等度洗脱,抑制电导检测-[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定尿液中磷酸盐和草酸的分析方法。方法具有良好的重现性和准确性,操作简便快速,[/font][font=宋体]尿样通过C18柱的净化可以消除有机物的影响,尿液稀释50或100倍后可降低氯化物、硝酸酸盐和硫酸盐的影响。[/font][font=宋体]方法采用自动进样器进样,降低了人为误差和检验人员的工作强度,在[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱仪[/color][/url]工作时不需要人员值守,检验人员可同时进行其他项目的检测工作,提高了工作效率,本法适用尿液中磷酸盐和草酸的同时测定。[/font][font=宋体]参考文献[/font][font=宋体]1[/font][font=宋体])苏海龙,郑 煜.草酸钙结石形成的代谢性变化研究[J],[/font][font=宋体]现代泌尿外科杂志,2012,17(6):610-612[/font][font=宋体]2[/font][font=宋体])[/font][font=宋体]马腾骧,孙 光. 现代泌尿外科学[M].天津:天津科学技术出版社,2000:587-588[/font][font=宋体]3[/font][font=宋体])尚 红,王毓三,申子瑜[/font][font=宋体]. [/font][font=宋体]全国临床检验操作规程(第4版)[M].北京:人民卫生出版社,[/font][font=宋体]2015[/font][font=宋体]:259-262[/font][font=宋体]4[/font][font=宋体])陈世惠[/font][font=宋体].[/font][font=宋体]尿磷测定方法的研究[/font][font=宋体][J][/font][font=宋体].[/font][font=宋体]中国工业医学杂志,1999,12(3):191-192[/font][font=宋体]5[/font][font=宋体])李桂兰.[/font][font=宋体]锆-偶氮胂Ⅲ络合物比色法[/font][font=宋体][url=http://www.docin.com/p-832791022.html?docfrom=rrela][color=#3C3C3C][back=#F9F9F9]测定[/back][/color][color=#3C3C3C][back=#F9F9F9]尿草酸[/back][/color][/url][J][/font][font=宋体].[/font][font=宋体]临床检验杂志,1997,15(2):86-87[/font][font=宋体]6[/font][font=宋体])张爱梅,贾丽萍,牛学丽[/font][font=宋体].[/font][font=宋体]表面活性剂增敏阻抑动力学光度法测定痕量草酸[/font][font=宋体][J][/font][font=宋体].[/font][font=宋体]分析化学,2003,31(9):1115-1118[/font][font=宋体]7[/font][font=宋体])陈兰化,赵丹华[/font][font=宋体].[/font][font=宋体]催化荧光法测定痕量草酸[/font][font=宋体][J][/font][font=宋体].[/font][font=宋体]光谱学与光谱分析,2003,23(1):203-204[/font][font=宋体]8[/font][font=宋体])彭 婕,郭卫红,谈恒山[/font][font=宋体],等.[/font][font=宋体]高效液相色谱法[/font][font=宋体]测定人尿液中草酸的含量[J][/font][font=宋体].[/font][font=宋体]中国医院药学杂志,2006,26(3):299-301[/font][font=宋体]9[/font][font=宋体])[/font][font=宋体][color=#444444]谈绮文,郭 玮,顾梅秀,等.高效毛细管电泳法测定尿液中微量草酸和柠檬酸[J].中华检验医学杂志,2014,37(4):281-284[/color][/font][font=宋体]10[/font][font=宋体])颜金良,高 杰,颜勇卿,等.[url=http://www.docin.com/p-832791022.html?docfrom=rrela][color=#3C3C3C][back=#F9F9F9][url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法[/back][/color][color=#3C3C3C][back=#F9F9F9]快速[/back][/color][color=#3C3C3C][back=#F9F9F9]测定[/back][/color][color=#3C3C3C][back=#F9F9F9]人尿液[/back][/color][color=#3C3C3C][back=#F9F9F9]中[/back][/color][color=#3C3C3C][back=#F9F9F9]草酸含量研究[/back][/color][/url][J],中国卫生检验杂志,2009,19(3):554-555[/font][align=left][font=宋体]11[/font][font=宋体])陈梅兰,叶明立,范云场,等.[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]抑制电导测定尿液中草酸根、磷酸根及枸橼酸根离子[J],药物分析杂志,2009,,29(9):1466-1469 [/font][/align][font=宋体]12[/font][font=宋体])[/font][font=宋体]许春向,邹学贤.现代卫生化学[M].北京:人民卫生出版社,2000:491-492[/font][align=left] [/align]
我最近在做草酸酯体系的化学发光,有没有做相关的体系的,可以交流一下,我是菜鸟,希望多指点!
草酸,即乙二酸,最简单的二元酸。结构简式HOOCCOOH。它一般是无色透明结晶,对人体有害,会使人体内的酸碱度失去平衡,影响儿童的发育,草酸在工业中有重要作用,草酸可以除锈。草酸遍布于自然界,常以草酸盐形式存在于植物如伏牛花、羊蹄草、酢浆草和酸模草的细胞膜,几乎所有的植物都含有草酸钙。 [img]http://ng1.17img.cn/bbsfiles/images/2010/04/201004221543_214006_1604460_3.jpg[/img]
草酸测水分选用卡尔费休水分仪的时候草酸会干扰并且附着在电极上方,在测定过程吸水导致测定结果偏大;选用快速水分仪105℃测定时间5min草酸会升华。请教下各位这个草酸的水分测定是不是可以用快去水分仪降低温度去测定,又或者是使用减压干燥80℃消失的重量就是水分这种方式去测定?
各位大侠,小弟想请教一下,如何测定草酸二甲酯中草酸的含量。望知道的兄弟告知。谢谢
有哪位老师有用HPLC成功检测样品中草酸残留的案例么?我目前在草酸检测过程中,采用通用的纯水柱时空白死体积处的未知峰对草酸有干扰,采用RP18时草酸的保留得到了改善,但是草酸峰拖尾,且调节方法无改善。谢谢
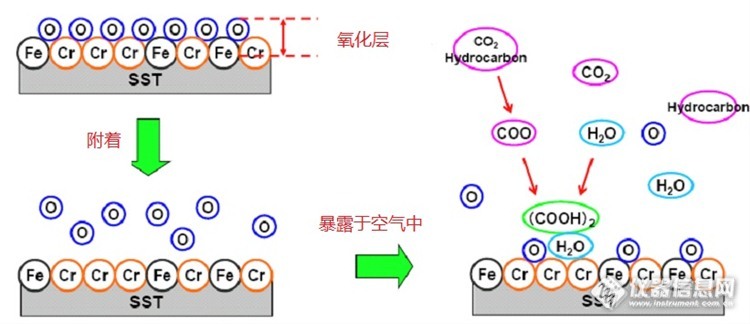
最近在某一产品的来料的离子色谱(IC型号:Dionex DX-500) 监控中发现阴离子的总数值有不断上升的趋势,且不断逼近规格线(spec)。按相关的文件规定,一旦这些监控数据超过规格线,这些来料是不能接收。当我们将这些异常情况反馈给供应商后,供应商查找了他们出货之前同一批的IC监控数据,没有发现异常。但是我们把这些样品返回给他们,他们测试的IC结果跟我们的测试结果很类似,都偏高。这些样品出了什么问题呢?难道是这批样品在转运或者保存时被污染了?我们决定努力去找这出其中的根源。 http://ng1.17img.cn/bbsfiles/images/2014/12/201412232237_528586_2942222_3.jpg 首先,我们对原始数据进行了分析。通过分析,发现这批样品中有个未知的离子的趋势跟总离子的趋势很类似,最近的走势也是不断往上扬。所以初步判断这个未知离子的增加可能是这批产品的总阴离子不断上升的原因。 http://ng1.17img.cn/bbsfiles/images/2014/12/201412232237_528587_2942222_3.jpg 那这个未知离子是什么呢?查阅相关的文献和结合这个未知离子的保留时间,怀疑这个未知离子可能是草酸(草酸盐)。我们找来草酸钠试剂,用UDI水溶解它,配成100ug/L的草酸钠溶液。当把配好的草酸钠溶液注射到离子色谱中,发现草酸根保留时间(10.237min)跟平时样品中未知离子保留时间(10.317min)很相近。所以基本确认这个未知离子就是草酸盐。 http://ng1.17img.cn/bbsfiles/images/2014/12/201412232238_528588_2942222_3.jpg 为了进一步确认这个未知离子就是草酸盐,我们还进行了加标实验。加标实验结果得到的重复回收率是103%。这就进一步证明了这个未知离子就是草酸(草酸盐)。 http://ng1.17img.cn/bbsfiles/images/2014/12/201412232238_528589_2942222_3.jpg 那这些草酸(盐草酸)是怎么来的呢?这些样品从供应商转运到我们的工厂,整个过程是用保鲜膜密封好的。整个运转过程没有拆包过程,所以这些样品是不会跟外界有任何的接触。按常理来说,这些样品应该不会受到污染的。通过与供应商的交流,了解到这些样品是在供应商那边储存了一段时间(~3个月),才运转到我们的公司。难道是供应商的存储地方有草酸盐,渗透到样品里而污染了样品?经过供应商的再三确认,他们存储样品的仓库是绝对没有草酸盐。那草酸盐是产品在自己存储的时候,自己产生的草酸盐? 我们测试了不同存储时间的产品,得到一个令人诧异的结果:这些样品的草酸值和总阴离子的值跟存储之间有着很好的关联。在前6个月里,草酸和总阴离子的值随着存储时间的增加而增加,但过了6个月之后基本趋于稳定。 http://ng1.17img.cn/bbsfiles/images/2014/12/201412232240_528590_2942222_3.jpg 产品在存储时是已经密封的,跟它接触的可能也就是从保鲜膜外面渗透进去的空气和水分,难道空气和水分会和这些产品发生反应而产生出草酸(草酸盐)吗?从上面的数据可以知道草酸(草酸盐)产生的过程应该是非常缓慢的。那怎么去验证这个猜测呢? 我们选了两个不同存储时间的2批(#1:存储时间不到一个月,#2存储时间~3个月)样品,放到恒温恒湿烘箱中进行测试(测试条件:温度85℃,湿度85%,持续时间100小时)。我们分别用离子色谱测量这2批样品的阴离子(经过恒温恒湿测试和没有测试各测试一组)的值。最后的结果显示:经过恒温恒湿测试后,草酸跟明显增加,但是其他离子却减少了。 http://ng1.17img.cn/bbsfiles/images/2014/12/201412232242_528591_2942222_3.jpg 这说明了在恒温恒湿测试过程中,其他离子因为水汽的冲洗而不断减少;但因为整个测试过程中因为发生了某些反应而产生了草酸(草酸盐),故草酸(草酸盐)没有减少反而增加了。 产品主要是有三个部件组合而成(#1:FX;#2:LB;#3:Baseplate);那草酸(草酸盐)是由哪个部件产生的呢?通过研究和实验,我们发现草酸跟增加主要是这个部件(#3:Base Plate)。 http://ng1.17img.cn/bbsfiles/images/2014/12/201412232243_528592_2942222_3.jpg 我们知道部件(Base Plate )的成份主要是不锈钢(Fe,Cr,Ni)。所以我们对草酸(草酸盐)产生的原理做了下面的推断:草酸(草酸盐)增加是由于在部件(Base Plate )的表面发生水解反应。整个化学反应过程是因为大气中的CO2和水汽在部件(Base Plate )的Fe,Cr的催化作用下发生了化学反应,不断产生草酸并附着在部件(Base Plate )的表面。 http://ng1.17img.cn/bbsfiles/images/2014/12/201412232243_528593_2942222_3.jpg

在一次失效分析的过程中,发现别的实验室在分析我们自己的日常样品中,有比较明显的草酸的结果显示,但是自己内部的测试结果没有很好地显示出来。因为之前没有需要报告草酸这个项目,所以也没有买过草酸的标准溶液。为了研究内部是否可以测试草酸,需要另外购买草酸的标准液(Fig-1)。[align=center] [img=,435,422]https://ng1.17img.cn/bbsfiles/images/2023/09/202309011031011657_3849_2942222_3.jpg!w435x422.jpg[/img][/align] 等草酸标液到了之后,开始配置不同浓度的标液,从低到高开始尝试进样,但是都没有在谱图上发现明显的出峰。到了150ppm仍然没有检测到很明显的峰,这是比较不正常的。在观察谱图时,发现在22分钟左右有一个翘起来的部分,有点像峰(Fig-2)。但是因为之前的程序设定了运行时间都是22分钟,是不是因为运行时间太短,导致草酸的峰还没有出来呢。[align=center] [img=,690,357]https://ng1.17img.cn/bbsfiles/images/2023/09/202309011031471109_959_2942222_3.jpg!w690x357.jpg[/img][/align] 经过更改程序文件,把出峰时间改到26分钟,在22-23分钟左右看到一个非常明显的草酸出峰(Fig-3),果然是之前的运行时间太短了,导致草酸不能够显示出来。[align=center][img=,690,213]https://ng1.17img.cn/bbsfiles/images/2023/09/202309011032034570_2099_2942222_3.jpg!w690x213.jpg[/img][/align] 为了进一步,进行了草酸的标准曲线验证。在新程序条件运行下,草酸在不同浓度都可以显示出来,可以得到一个非常好标准曲线,R2的值达到0.99以上(Fig-4)。[align=center][img=,690,468]https://ng1.17img.cn/bbsfiles/images/2023/09/202309011032193998_3826_2942222_3.jpg!w690x468.jpg[/img][/align][align=center]另外,有继续进行了草酸的回收率实验。把草酸标准溶液加入到正常的7个阴离子溶液中,草酸能够明显检测出来(Fig-5),回收率大概是107%。[/align][align=center][img=,690,328]https://ng1.17img.cn/bbsfiles/images/2023/09/202309011032369340_1786_2942222_3.jpg!w690x328.jpg[/img][/align] [font=等线]在新程序下运行,发现在日常的产品中也可以明显检测出草酸(Fig-6)。这证明了的确是之前的运行时间太短,导致草酸检测不出来.[/font][align=center][img=,690,502]https://ng1.17img.cn/bbsfiles/images/2023/09/202309011032564960_9557_2942222_3.jpg!w690x502.jpg[/img][/align] 经过这次的草酸寻峰计,还得出了一个教训。在以后研究新的物质时,要提前好好查下相关的文献,因为不同的柱子和淋洗方法都会影响到物质的出峰。如果没有资料可查,需要尝试在尽可能的运行时间去检测,以免有峰遗漏。
我最近按中国药典2010版方法测定复方甘草口服溶液中甘草酸突然含量测定不上来,原来测定结果能与原料甘草流浸膏中甘草酸基本对应一致,现在会差很大,从柱效、拖尾因子看现在与原先无太大差异,且符合中国药典2010版要求,请教各位同仁,在测定复方甘草口服溶液中甘草酸有什么特别注意点吗?
[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定尿液中草酸和硫氰酸盐,预压4000积分,色谱赛区,8月
目前我们分析草酸钴的杂质先将草酸钴在400度氧化,再加盐酸硝酸溶解试样,程序比较麻烦,而且易污染,有谁知道更简洁的处理样品的方法?
在做高锰酸钾法COD时,要标定高锰酸钾,实验室只有草酸钾,没有草酸钠,可不可以用草酸钾标定呢?
菠菜含有较多草酸,草酸不但在肠道抑制钙、铁等矿物质吸收,进入血液后还增加患肾结石的风险。所以菠菜烹调前应先焯水,草酸水溶性很强,焯水能去除大部分草酸。菠菜焯水后适合素炒、蒜炒、炒肉、炒鸡蛋、做汤、做馅、凉拌或蘸酱等各种吃法。
我公司使用的原料是钕铁硼原料,我想从酸洗废水中重新回收稀土金属钕,设计是加入草酸,生成草酸钕沉淀,从而分离。知道草酸钕的溶度积常数我们就可以计算出钕沉淀完全时的pH是多少了,草酸的量也可以控制了。我想知道草酸钕的溶度积常数是多少?在百度上也没查到。希望得到大家的帮助与回应。
ICP-MS,无有机进样设备,想测试样品中的金属元素,但是样品液中含有草酸,请问可以通过消解等处理方法把样品中的草酸去掉么?直接测的话机器能承受多大的草酸浓度?
最近有一小伙伴在用液相做草酸,其实液相做草酸的效果,也不是很理想,跑一针要10min+,而且基质干扰较多。 然后他和我提起用钙沉淀法去做,然后上原子吸收,具体做法大概:往含有草酸的溶液中加入过量的钙(定量加),形成草酸钙沉淀,然后过滤沉淀,测定剩下的钙,来达到定量的目的。注:被测液体中的草酸浓度在10ppm以上。不知道有木有人做过这方面的工作,希望大家提供点意见,这样我即便要试试,也可少走弯路。
各位大虾:请教个问题,草酸与乙醛酸含量大概在1-4%之间的水溶液,怎么分析草酸与乙醛酸的含量?新建项目,用原来的色谱条件分不开,向各位讨教讨教。
很多蔬菜里面都会含有草酸,吃起来比较苦,不知道草酸危害大不大
为什么草酸会结块啊?知道的能说一下吗?
瑞士罗氏制药公司昨天向外界简单介绍了抗禽流感药物“达菲”的成分和生产工艺。出人意料的是,“达菲”成分中竟包含一种可爆炸物质、一种中国调味料以及一种无害的大肠杆菌。 “达菲”共有12道生产工序,最初是从八角茴香中提取莽草酸。 由于30公斤八角茴香只能加工出1公斤莽草酸,而八角茴香只在中国4个省份生长,通常在5月和3月收获,因此有人担心一旦收成欠佳或价格过高,罗氏公司将无法获得足够原料。 罗氏公司为此开发了不用八角茴香制造莽草酸的方法,并在去年与德国一家生物技术中心合作。目前,罗氏公司三分之二的莽草酸取自八角茴香,余下三分之一由大肠杆菌提供。 莽草酸经过反应器、过滤器和干燥器这三道工序后,转变为一种中间化学物质环氧化物。随后,环氧化物的结构必须被打开,通过原子转换,变成另外一种中间化学物叠氮化物。接着,叠氮化物被制成活性成分,再与其他添加成分混合加工,最后经过真空干燥制成“达菲”颗粒。 [img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=38952]莽草酸的hplc图谱[/url]
今天拿草酸来做红外都得不到红外谱图,好像光透不来。用模具直接压和用KBr压片都不行。不知道是为什么。有谁做过草酸的红外啊,告诉要怎么 做。晕了。谢谢。
求草酸钴产品标准
那位大侠知道草酸甲乙酯的物化性质啊?谢谢