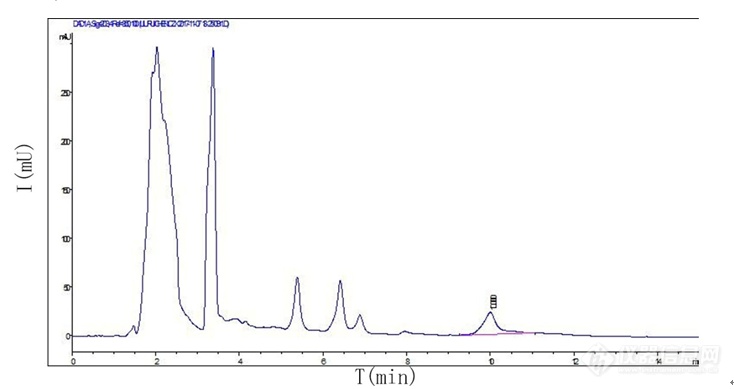
[align=center][b]HP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS法测定黄芪醇提物中的黄芪甲苷的含量[/b][/align][b]黄芪甲苷是黄芪皂苷提取物中的特征性成分,也是具有代表性的主要成分,黄芪甲苷可以促进患者心肌细胞的供氧能力,使冠状动脉供血区供血充足,避免因缺血导致的大范围心肌坏死,继而缓解患者心绞痛症状,平稳心跳速率[sup][/sup]。药典中有关于黄芪药材中黄芪甲苷含量的测定方法,但此方法并不完全适用于黄芪醇提物中的黄芪甲苷的含量测定,而且黄芪水提物与黄芪醇提物中化学成分有差异,预实验中发现测定黄芪水提物中黄芪甲苷含量建立的方法也不适应于黄芪醇提物中中黄芪甲苷含量的测定。本章实验利用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用仪[/color][/url]建立黄芪醇提物中黄芪甲苷含量测定方法,并利用该方法测定其含量,计算出黄芪甲苷的转移率,用于黄芪醇提最佳提取工艺的优选。同时,本章实验系统地验证所建立的方法的可行性,为选择黄芪甲苷的含量测定方法提供参考。[b]1 材料和仪器1.1 样品 [/b] 收集9组黄芪醇提物样品,所有黄芪药材均由济宁华能制药厂提供。[b]1.2 试剂 [/b]黄芪甲苷对照品(成都瑞芬思生物科技有限公司批号H-013-170117);乙腈为色谱纯(赛默飞世尔科技有限公司);D101大孔吸附树脂(廊坊淼阳化工有限公司生产20160310);盐酸溶液(国药集团化学试剂有限公司生产);氢氧化钠溶液(国药集团化学试剂有限公司生产20160824);超纯水。[b]1.3 仪器 [/b]液相色谱仪系统(美国Agligent Technology 公司1260型液相色谱仪,包括G1312B二元泵,G1322A在线脱气机,G1316A柱温箱);NASCA F5100型自动进样器(日本SHISEIDO公司);资生堂CAPCELL PAC CN 色谱柱(2.0*150 mm,5 mm,日本SHISEIDO公司);API 4000型三重四级杆串联离子肼质谱仪(美国Applicated Biosystem Scuex公司)。[b]2 方法学考察2.1 色谱条件[/b]色谱柱为 Synergi C18 80A(250 mm×4.6 mm,4 μm),以十八烷基硅烷键合硅胶为填充剂,以乙腈-水(35 : 65)进行等度洗脱;进样量10 μL;检测波长为203 nm;柱温30 ℃,流速为1 mL/min。黄芪甲苷保留时间约为10 min。黄芪醇提物和黄芪甲苷标准品HPLC色谱图见表5-1,表5-2。[/b][align=center][img=,690,365]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131711071808_2711_3237657_3.png!w690x365.jpg[/img][/align][align=center]图5-1 黄芪醇提物HPLC色谱图[/align][align=center][img=,690,373]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131711240945_4181_3237657_3.png!w690x373.jpg[/img][/align][align=center]图5-2 黄芪甲苷标准品HPLC色谱图[/align][b]2.2 质谱条件 [/b]电喷雾电离,正离子模式(喷雾电压:4.5 kV);鞘气压力:30 arb;辅助气压力:10 arb;离子传输管温度:550 ℃;扫描模式:全扫描;扫描范围:m/z 100-1000。按“2.1.3”项下色谱条件进样,进样量10 μL。为进一步验证10 min出峰的物质是黄芪甲苷,利用LC/MS技术对黄芪皂苷提取物的化学成分进行研究,采用正离子源ESI检测。黄芪甲苷分子量784.97 Da,由于仪器差异,黄芪甲苷出峰时间后移至12.5 min,此峰的鉴定结果质谱图显示含大量黄芪甲苷。图5-3为黄芪皂苷提取物的正离子模式HP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]总离子流图、分离子流图和质谱图。[align=center][img=,690,426]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131711415732_2681_3237657_3.png!w690x426.jpg[/img][/align][align=center]图5-3 黄芪甲苷正离子模式HP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url] 总离子流图、分离子流图和质谱图[/align][b]2.3 供试品溶液的制备[/b]对D101大孔吸附树脂预处理:第一步用乙醇或甲醇清洗吸附柱内壁,向柱内加入称量好的树脂体积0.4-0.5倍的乙醇或甲醇,然后将新的D101大孔吸附树脂投入吸附柱中,使乙醇液面高于D101大孔吸附树脂层0.5 m,浸泡过夜。用2 个柱体积的乙醇或甲醇通过D101大孔吸附树脂层,用乙醇缓慢浸泡D101大孔吸附4-5 h,观察洗脱液加水后不呈白色浑浊为止。再用蒸馏水以2 BV洗柱,洗至洗脱液呈中性。用2 BV的5 %盐酸溶液以4-6 BV/h过柱,浸泡2-4 h。用蒸馏水以2 BV/h洗至洗脱液呈中性。用2 BV的2 %氢氧化钠溶液以4-6 BV/h过柱,浸泡2-4 h。最后用蒸馏水洗D101大孔吸附树脂,洗至洗脱液显中性即可。上样:取黄芪醇提物加水溶解至15 mL得黄芪提取液,以1 mL/min过树脂,先以4 BV蒸馏水洗脱,弃去水液,再用4 BV的70 %乙醇溶液洗脱,用烧杯收集吸附柱内的洗脱液,转入蒸发皿,水浴蒸干后,用甲醇溶解并转移至10 mL容量瓶定容。[b]2.4 对照品溶液的制备[/b]用万分之一天平精密称取10.1 mg黄芪甲苷对照品至10 mL容量瓶,加甲醇定容,得1.01mg/mL的对照品溶液,用0.22μm的微孔滤膜过滤,备用。[b]3 结果3.1 线性关系考察[/b]精密量取黄芪甲苷标准品10.1 mg黄芪甲苷,用甲醇10 mL制备成1.01 mg/mL黄芪甲苷储备液,然后吸取相应体积稀释成浓度梯度为150 μg/mL、250 μg/mL、300 μg/mL、400 μg/mL 、500 μg/mL的对照品溶液,上述对照品溶液按“2.3”项下色谱条件分别进样10 μL,利用自动积分功能测定峰面积积分值,以黄芪皂苷提取物中黄芪甲苷的峰面积积分值对标准品浓度进行线性回归,所得回归方程为y = 2821.6x + 12.438(回归系数[i]R[sup]2[/sup][/i]= 0.9989),证明蒙古黄芪中黄芪甲苷在150~500 μg/mL范围内线性关系良好,黄芪甲苷对照品标准曲线如图5-4所示。[align=center][img=,542,346]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131711574358_4557_3237657_3.png!w542x346.jpg[/img][/align][align=center]图5-4 黄芪甲苷标准曲线[/align][b]3.2 精密度试验[/b]在拟定分析条件下,精密吸取供试品溶液10 μL,连续进样 6 次,记录提取离子流图峰面积,测定黄芪甲苷量,计算得相对标准偏差RSD为1.9% ,提示该方法具有较好的精密度。[b]3.3 重复性实验[/b]取同一黄芪样品 6份,按2. 2 项下方法制备供试品溶液,在拟定分析条件下,准确吸取10 μl 进样分析,测定黄芪甲苷量,计算得 RSD为2.0%,提示该方法重复性良好。[b]3.4 稳定性试验[/b]取黄芪药材供试品溶液,分别在0 h、3 h、6 h、9 h、24 h、48 h后,在拟定分析条件下,准确吸取10 μl 进样分析,测定黄芪甲苷量,计算得RSD为 4.4% ,提示黄芪供试品溶液稳定性较差。[b]3.5 加样回收率试验[/b]精密称取 6 份黄芪甲苷量已知的黄芪水提物样品,每份折合黄芪药材 0. 5 g,分别准确加入浓度为 0. 0 342 mg /ml 黄芪甲苷溶液1 ml,1 ml,2ml,2ml,3ml,3ml,按 2. 2 项下方法制备供试品溶液,准确吸取 1. 0 μl 进样分析,测定黄芪甲苷量,计算回收率,结果见表3-1。由表3-1可见,方法平均回收率为 97.92%,表明该方法具有较好的回收率。[align=center]表5-1 黄芪甲苷加样回收率测定结果[/align] [table][tr][td] [align=center]样号[/align] [/td][td] [align=center]样品中的量/mg[/align] [/td][td] [align=center]加入量/mg[/align] [/td][td] [align=center]测得量/mg[/align] [/td][td] [align=center]回收率/%[/align] [/td][td] [align=center]平均值/%[/align] [/td][td] [align=center]RSD/%[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]1.94 [/align] [/td][td] [align=center]0.96 [/align] [/td][td] [align=center]2.88 [/align] [/td][td] [align=center]97.92 [/align] [/td][td=1,6] [align=center]97.92 [/align] [/td][td=1,6] [align=center]0.7 [/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]1.94 [/align] [/td][td] [align=center]0.96 [/align] [/td][td] [align=center]2.89 [/align] [/td][td] [align=center]98.96 [/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]1.94 [/align] [/td][td] [align=center]1.92 [/align] [/td][td] [align=center]3.83 [/align] [/td][td] [align=center]98.44 [/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]1.94 [/align] [/td][td] [align=center]1.92 [/align] [/td][td] [align=center]3.81 [/align] [/td][td] [align=center]97.40 [/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]1.94 [/align] [/td][td] [align=center]2.88 [/align] [/td][td] [align=center]4.76 [/align] [/td][td] [align=center]97.92 [/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]1.94 [/align] [/td][td] [align=center]2.88 [/align] [/td][td] [align=center]4.73 [/align] [/td][td] [align=center]96.88 [/align] [/td][/tr][/table][b]3.6 黄芪甲苷的含量测定结果[/b]取9组黄芪水提物按照“2.3”项下操作,制备供试品溶液,准确吸取 1 0 μL 进样分析,在拟定的分析条件下,测定黄芪甲苷峰面积积分值,计算相应的黄芪甲苷含量。9组蒙古黄芪中黄芪甲苷含量测定结果如表5-2所示。[align=center]表5-2 9组蒙古黄芪中黄芪甲苷含量测定结果[/align] [table][tr][td] [align=center]试验号[/align] [/td][td] [align=center]峰面积[/align] [/td][td] [align=center]含量(mg/g)[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]560.07 [/align] [/td][td] [align=center]0.13 [/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]501.70 [/align] [/td][td] [align=center]0.12 [/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]564.61 [/align] [/td][td] [align=center]0.13 [/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]507.19 [/align] [/td][td] [align=center]0.12 [/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]524.05 [/align] [/td][td] [align=center]0.12 [/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]477.02 [/align] [/td][td] [align=center]0.11 [/align] [/td][/tr][tr][td] [align=center]7[/align] [/td][td] [align=center]921.07 [/align] [/td][td] [align=center]0.21 [/align] [/td][/tr][tr][td] [align=center]8[/align] [/td][td] [align=center]783.88 [/align] [/td][td] [align=center]0.18 [/align] [/td][/tr][tr][td] [align=center]9[/align] [/td][td] [align=center]924.71 [/align] [/td][td] [align=center]0.22 [/align] [/td][/tr][/table][b]3.7 黄芪甲苷转移率正交试验设计及结果[/b]醇提的黄芪甲苷转移率考察正交试验与醇提的出膏率考察正交试验设计相同,首先以乙醇作为提取溶剂,把影响药材提取效果的提取溶剂乙醇用量(A)、提取次数(B)、提取时间(C)确定为考察因素,以上三个考查因素各分3个水平考察,见表5-3。[align=center]表5-3 实验因素水平表[/align] [table][tr][td=1,2] [align=center]水平[/align] [/td][td=3,1] [align=center]因素[/align] [/td][/tr][tr][td] [align=center]A(乙醇用量/倍)[/align] [/td][td] [align=center]B(提取次数/次)[/align] [/td][td] [align=center]C(提取时间/h)[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]4[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]8[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]10[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][/tr][/table]黄芪甲苷转移率=各实验组黄芪提取物中黄芪甲苷含量/原黄芪药材中黄芪甲苷含量×100%。原药材中毛蕊异黄酮苷的含量按照药典的方法测得的结果为0.4042mg/g。跟据实验数据,得到水提实验中设定的不同工艺条件下的毛蕊异黄酮苷的转移率,其中因素D为误差项,作直观分析表和方差分析表,见表5-4,5-5。[align=center]表5-4 黄芪甲苷转移率考察 L[sub]9[/sub](3[sup]4[/sup])正交试验表[/align] [table][tr][td] [align=center]试验号[/align] [/td][td] [align=center]A[/align] [/td][td] [align=center]B[/align] [/td][td] [align=center]C[/align] [/td][td] [align=center]D[/align] [/td][td] [align=center]黄芪甲苷 转移率/%[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]32.01 [/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]28.60 [/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]32.28 [/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]28.92 [/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]29.91 [/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]27.16 [/align] [/td][/tr][tr][td] [align=center]试验号[/align] [/td][td] [align=center]A[/align] [/td][td] [align=center]B[/align] [/td][td] [align=center]C[/align] [/td][td] [align=center]D[/align] [/td][td] [align=center]黄芪甲苷 转移率/%[/align] [/td][/tr][tr][td] [align=center]7[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]53.11 [/align] [/td][/tr][tr][td] [align=center]8[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]45.09 [/align] [/td][/tr][tr][td] [align=center]9[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]53.33 [/align] [/td][/tr][tr][td] [align=center]K1[/align] [/td][td] [align=center]92.89[/align] [/td][td] [align=center]114.04[/align] [/td][td] [align=center]104.26[/align] [/td][td] [align=center]115.25[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]K2[/align] [/td][td] [align=center]85.99[/align] [/td][td] [align=center]103.60[/align] [/td][td] [align=center]110.85[/align] [/td][td] [align=center]108.87[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]K3[/align] [/td][td] [align=center]151.53[/align] [/td][td] [align=center]112.77[/align] [/td][td] [align=center]115.30[/align] [/td][td] [align=center]106.29[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]优水平[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]R[/align] [/td][td] [align=center]65.54[/align] [/td][td] [align=center]9.17[/align] [/td][td] [align=center]11.04[/align] [/td][td] [align=center]8.96[/align] [/td][td] [align=center] [/align] [/td][/tr][/table][align=center]表5-5 黄芪甲苷转移率考察方差分析结果[/align] [table][tr][td] [align=center]方差来源[/align] [/td][td] [align=center]离差平方和[/align] [/td][td] [align=center]自由度[/align] [/td][td] [align=center]F[/align] [/td][td] [align=center]显著性[/align] [/td][/tr][tr][td] [align=center]A[/align] [/td][td] [align=center]864.64[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]46.01[/align] [/td][td] [align=center]*[/align] [/td][/tr][tr][td] [align=center]B[/align] [/td][td] [align=center]21.63[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]0.07[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]C[/align] [/td][td] [align=center]20.57[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]0.07[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]D [/align] [/td][td] [align=center]14.18[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]-[/align] [/td][/tr][/table]注:F[sub]0.1[/sub](2,2)=9,F[sub]0.05[/sub](2,2)=19,*为有显著性,-为无显著性。从正交试验结果可知:醇提实验中,各因素对黄芪甲苷转移率的影响大小顺序为:A(乙醇用量)B(提取次数)C(提取时间);每个因素3水平之间的趋势为A[sub]3[/sub]A[sub]1[/sub]A[sub]2[/sub],B[sub]1[/sub]B[sub]3[/sub]B[sub]2[/sub],C[sub]3[/sub]C[sub]2[/sub]C[sub]1[/sub],直观分析得最佳提取工艺为A[sub]3[/sub]B[sub]1[/sub]C[sub]3[/sub],即加醇10倍量,提取1次,每次3h。表5-5的方差分析结果表明: A因素的影响具有统计学差异(PB(提取次数)C(提取时间);每个因素3水平之间的趋势为A[sub]3[/sub]A[sub]1[/sub]A[sub]2[/sub],B[sub]1[/sub]B[sub]3[/sub]B[sub]2[/sub],C[sub]3[/sub]C[sub]2[/sub]C[sub]1[/sub],直观分析得最佳提取工艺为A[sub]3[/sub]B[sub]1[/sub]C[sub]3[/sub],即加醇10倍量,提取1次,每次3h。表5-7的方差分析结果表明: A因素的影响具有统计学差异(P0.05),即乙醇用量对黄芪甲苷转移率具有显著影响。[b]4 讨论[/b]本章实验利用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]技术,测定了黄芪醇提物中黄芪甲苷的含量,并系统地验证所建立的方法的可行性,经过试验条件的摸索,黄芪甲苷的色谱条件为35 %乙腈洗脱,所建立的方法能够较好的将黄芪甲苷与其他成分分开,可用于黄芪皂苷中黄芪甲苷含量测定,黄芪甲苷稳定性试验结果RSD值高于2 %,可能是由于黄芪皂苷Ⅰ或黄芪皂苷Ⅱ在酸性水解的条件下易转化成黄芪皂苷Ⅳ,即黄芪甲苷,使黄芪水提物中黄芪甲苷在48h内的稳定性不好。根据三个因素水平趋势可知,随着乙醇的用量增加,黄芪甲苷的提取效率越来越高,实验设置中每次10倍量是最大乙醇用量,这是从大工业生产和节能降耗等方面考虑的结果。根据煎煮次数水平趋势,提取1次的黄芪甲苷转移率最大,这有可能是因为黄芪皂苷Ⅰ或黄芪皂苷Ⅱ在酸性水解的条件下易转化成黄芪皂苷Ⅳ,即黄芪甲苷,而黄芪皂苷Ⅰ或黄芪皂苷Ⅱ在第一次就较完全的被提取出来,随着时间增加,转换成黄芪皂苷Ⅳ,即黄芪甲苷,第二次时黄芪皂苷Ⅰ或黄芪皂苷Ⅱ的结构可能被破坏,影响其转化成黄芪甲苷。第三次时可能黄芪甲苷被提取的更彻底,转移率又开始小幅增大。在3h内,当提取时间增加,黄芪甲苷会逐渐增大,原因可能是黄芪甲苷的提取更加彻底,黄芪皂苷Ⅰ或黄芪皂苷Ⅱ转化成黄芪甲苷最多。实验设置中每次3h是最大提取时间,这也是从综合成本与效率的角度考虑的结果。因此,综合考虑,将加醇10倍量,提取1次,共3h作为最佳醇提实验工艺。由黄芪甲苷转移率结合出膏率的到的综合评分的结果可以看出,不同提取工艺对黄芪醇提物中黄芪甲苷的含量和出膏率的影响不同,其中7、8、9组评分较高,三个组的黄芪甲苷转移率相较于其他组也是最高,但第8组出膏率却相对较低,另外出膏率高低的顺序也不与黄芪醇提物中黄芪甲苷的转移率高低的顺序项一致,这说明出膏率与黄芪醇提物中黄芪甲苷的转移率并无明显的对应关系。[align=center]参考文献[/align] 朱燕辉, 严奉祥. 黄芪甲苷及其生物学活性.现代生物医学进展,2008, 8 ( 4 ) : 781-783.
黄芪静脉输液中黄芪甲苷和黄芪多糖的含量测定摘要:建立黄芪静脉输液中黄芪甲苷和黄芪多糖的含量测定方法。方法:用高效液相色谱法测定黄芪甲苷的含量,用碘量法测定黄芪多糖的含量。结果:黄芪甲苷和黄芪多糖的平均回收率分别为9751%、9918%,相对标准差分别为248%、191%。结论:本文建立的方法准确可靠、灵敏度高、重现性好,可作为黄芪静脉输[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]量控制的有效方法。关键词:黄芪甲苷;黄芪多糖;高效液相色谱法;碘量法; 英文摘要:ToestablishthemethodfordeterminationofastragalosideIVandastragaluspolysaccharidesinRadixAstragaliinjectionMETHODS:AstragalosidewasdeterminedbyHPLCandastragaluspolysaccharidesbyiodometryRESULTS:Therecoveriesofastragalosideandastragaluspolysaccharideswere9751%RSD=248%and9918%(RSD=191%)respectivelyCONCLUSION:Thismethodisaccurate,sensitiveandrepeatable,andcanbeusedforqualitycontrolofthepreparation英文关键词:astragaloside;astragaluspolysaccharide;HPLC;iodometry;contentdetermination黄芪为补气药,性甘温,归肺、脾经,具有补气固表、利尿托毒、排脓、敛疮生肌之功效。医疗实践证明,黄芪注射液对心气虚损、血脉瘀阻、病毒性心肌炎、心功能不全、脾虚困湿之肝炎有较好的疗效,也是肿瘤、免疫功能低下等较理想的辅助治疗药物。目前临床所使用的黄芪注射液为小容量针剂,需稀释后滴注,且不含黄芪多糖,所以疗效不够理想。为此,武警四川总队乐山医院和四川省乐山市三民药物研究所共同研制了含黄芪多糖、黄酮、苷类等有效成分的黄芪静脉输液。黄芪注射液的含量检测尽管WS3-β-3335-98执行标准仅要求采用薄层色谱法,但因高效液相色谱法操作更简便,精密度更高,故笔者参照文献以蒸发光散色高效液相色谱法[1]测定黄芪静脉输液中的黄芪甲苷含量;至于黄芪多糖含量的检测则选择采用碘量法。1仪器与试药11仪器美国奥泰公司高效液相色谱仪,包括蒸发光散射(ELSD)500检测器、Alltech426主机泵;电动离心机(江苏金坛公司);TP-150超声波清洗机(北京天鹏公司)。12试药黄芪甲苷对照品(中国药品生物制品检定所,批号:0781-9908);甲醇、乙醇、正丁醇、氢氧化钠、硫酸、葡萄糖均为分析纯;乙腈为色谱纯;水为重蒸馏水。2方法和结果21黄芪甲苷含量的测定211色谱条件:色谱柱为ODS柱(250mm×40mm),柱温为40℃,流动相为乙腈-水(36∶64),流速为06ml/min,进样量为20μl。212漂移管温度选择:根据ELDS检测使用手册推荐,设置气体流速为300slpm,漂移管温度为75℃,观察流动相(不进样)进入检测器的基线噪音,不断改变漂移管温度(步长为5℃),根据基线随温度的变化情况,选择95℃为试验最优温度。213载气流速选择:设定漂移管温度为95℃,取黄芪甲苷对照液恒量,得相应峰面积,不断改变气体流速(步长为025slpm)观察峰面积和基线的变化情况,最终选择270slpm为试验最优载气流速。214最低检测限试验:精密称取黄芪甲苷对照品适量,加甲醇溶解并稀释成浓度为1mg/ml的溶液作为贮备液,精密量取适量,逐步稀释测定,直到黄芪甲苷主峰信号为检测器噪声水平的3倍为止。得黄芪甲苷最低检测限为153ng。215线性试验:取“214”项黄芪甲苷对照品贮备液适量,精密量取10、20、30、40、50、60分别置于10ml容量瓶中,加甲醇稀释至刻度(约相当于黄芪甲苷01、02、03、04、05、06mg)。以对照品峰面积的常用对数值为横坐标(X),以进样量的常用对数值(Y)为纵坐标进行线性回归,得回归方程为Y=06001X—34896(r=09991),黄芪甲苷进样量在20μg~120μg范围内线性关系良好。216精密度试验:精密称取黄芪甲苷对照品适量,加甲醇溶解并稀释至浓度为025mg/ml的溶液作为对照溶液,注入液相色谱仪,连续重复进样6次,测得黄芪甲苷的相对标准差为179%,精密度符合规定。217重现性试验:精密量取黄芪注射液适量(相当于黄芪甲苷约20mg)5份,按“2110”项下方法制备,测定黄芪甲苷含量。结果黄芪注射液中黄芪甲苷为2390mg,RSD=201%,表明方法重现性良好。218稳定性试验:取“217”项下样品溶液,分别于0、1、2、3、5、8h取样测定峰面积,结果RSD=107%,表明黄芪甲苷溶液在8h内基本稳定。219回收率试验:分别精密量取黄芪注射液适量(约相当于黄芪甲苷10、12、14mg)共3份,每份各精密加入对照溶液(0404mg/ml)25、30、35ml,按“2110”项下方法制备,测定黄芪甲苷含量,结果详见表1。由表1可见,平均回收率为9751%,RSD=248%,符合规定,说明方法具有可行性。2110样品中黄芪甲苷的含量测定:精密量取黄芪注射液100ml,置于烧杯中浓缩至10ml,加无水乙醇40ml沉淀,放置20min,离心,沉淀用80%的乙醇溶液洗涤2次,每次10ml,合并离心液与洗涤液,置水浴上蒸干。残渣加1%NaOH溶液10ml溶解,用饱和的正丁醇水溶液提取3次,每次20ml,合并正丁醇的水溶液,蒸干,残渣再加1%NaOH溶液5ml溶解,通过已处理的D101大孔吸附树脂柱(Φ15×20cm,内装树脂高约10cm)吸附,以1%NaOH溶液50ml洗脱,弃去,用蒸馏水洗至中性,再用30%乙醇溶液50ml洗脱,弃去洗脱液,继续用70%乙醇液50ml洗脱,收集洗脱液并蒸干,残渣加甲醇溶解并定容至10ml,得供试品溶液。精密称取黄芪甲苷对照品适量,加甲醇溶解并稀释成浓度为01、03mg/ml的溶液作为对照溶液。分别精密量取上述溶液各20μl注入液相色谱仪,记录色谱图,并以峰面积和进样量的对数值按二点法计算,详见图1;3批样品按上述方法制备测定,结果详见表2。22黄芪多糖含量的测定[2,3]221线性试验:精密称取105℃干燥至恒重的葡萄糖适量,加水溶解并稀释成浓度为10mg/ml的标准溶液,分别精密量取此标准溶液100、90、80、70、60ml,置于250ml碘量瓶中,分别加水0、10、20、30、40ml,然后精密加入01mol/L碘滴定液25ml,在不断振摇的情况下缓缓滴加01mol/LNaOH40ml,密塞,在暗处放置10min,然后加入05mol/LH2SO4液6ml,摇匀,立即用01mol/LNa2S2O3滴定液滴定,近终点时,加淀粉指示液2ml,继续滴定至蓝色消失,并同时作空白试验校正。以取样量(X)与Na2S2O3的消耗量(Y)进行线性回归,得回归方程为Y=009766X—000244,(r=09999),表明葡萄糖在60mg~100mg的范围内线性关系良好。222重现性试验:精密量取黄芪注射液100ml,按“224”项下方法制备5份,测定黄芪多糖含量,结果为10423mg,RSD=099%,表明方法重现性良好。223回收率试验:分别精密量取黄芪注射液(多糖含量为10423mg/100ml)120、150、180ml,每份各加入葡萄糖标准液(25002mg/ml)50、60、70ml制成80%、100%、120%浓度的溶液。分别浓缩至10ml,加无水乙醇40ml,放置20min,离心。沉淀用80%乙醇洗涤2次,每次10ml,弃去离心液与洗涤液,沉淀加热蒸馏水10ml溶解,并转移至25ml容量瓶中,定容,摇匀。分别精密量取3种不同浓度的溶液80、70、60ml置于250ml碘量瓶中,分别精密加水2、3、4ml,按“224”项方法测定,每个浓度测定3次,共9次,计算得到回收率为9918%,RSD=191%,详见表3。224样品中黄芪多糖的含量测定:精密量取黄芪注射液100ml,浓缩至10ml,加无水乙醇40ml,放置20min,离心。沉淀用80%乙醇洗涤2次,每次10ml,加热蒸馏水3ml使沉淀溶解并定容至10ml,摇匀。移置于250ml碘量瓶中,加入1mol/LH2SO420ml,置于水浴中水解2h,取出,放冷,加入2mol/LNaOH溶液调节pH值=7,冷却至室温。精密加入碘滴定液(01mol/L)25ml,在不断振摇的情况下缓缓滴加01mol/LNaOH40ml,密塞,置暗处放置10min。然后加入05mol/LH2SO46ml,摇匀,立即用Na2S2O3滴定液(01mol/L)滴定,至近终点时,加淀粉指示液2ml,继续滴定至蓝色消失,并同时作空白试验校正,计算即得(每1ml上述碘滴定液相当于9008mg的C6H12O6)。3批黄芪注射液样品,按上述方法测定多糖含量均符合规定,结果详见表4。3讨论测定黄芪甲苷含量时,如将精密量取的黄芪注射液浓缩后仅采用正丁醇的水饱合液提取制得供试品溶液,则所得的样品杂质峰多,基线略有漂移,因此不宜采用。黄芪多糖主要为葡萄糖,因此,可采用以葡萄糖或葡聚糖作对照品的苯酚-浓硫酸法[4]、蒽酮-浓硫酸法[5]或水解后用碘量法等测定其含量,但一般多采用后两种方法。采用蒽酮-浓硫酸法时,由于其线性试验回归方程为C=98481A+08314(r=09663),浓度线性范围为35~165μg/ml,线性关系不好,故不宜采用。
黄芪有促雌激素样作用,可使小鼠动情期(通常为一日)延续达10日之久。黄芪对小鼠的发育亦有良好影响。另有报告谓黄芪浸膏、黄芪内酯和黄芪固醇对大鼠和小鼠体重、提肛肌或肾脏等重量均无明显影响,表明无同化激素或雄激素样作用。红芪(多序岩黄芪)为黄芪的同科不同属植物,其多糖可明显升高老年大鼠血清睾酮含量。注:摘自《医学中央杂志》、《新医药学杂志》、《北京生理科学会1964年学术年会论文摘要》、《甘肃中医学院学报》
黄芪多糖提取用水提,还是醇提出膏率跟纯度哪个好一点
大茴香酸-硫酸荧光体系测定黄芪甲苷刘养清 杜鸣 徐秉玖关键词: 黄芪甲苷; 大茴香酸; 黄芪; 中药复方补阳还五汤; 荧光分光光度法中图分类号: R927.2 R284.1 文献标识码: A 文章编号: 0513-4870(2000)07-0544-03黄芪甲苷(astragaloside)是中药膜荚黄芪Astragalus membranaceus (Fisch.) Bge.和蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao的主要活性成分,有抗炎、降压、镇痛、镇静、升高血浆中cAMP水平、促进小鼠再生肝DNA的含量[1,2]以及促进免疫功能等生理活性。黄芪甲苷的测定方法主要有:紫外分光光度法[3,4]、薄层扫描法[5,6]和HPLC法[7,8]。光度法常用香草醛在浓硫酸作用下与甲苷显色反应,空白值较高,干扰严重;薄层扫描法操作繁琐,准确度相对较差。黄芪甲苷仅在200 nm处有末端吸收,对HPLC法不利。黄芪甲苷的荧光分析尚未见报道。本文首次根据在浓硫酸条件下黄芪甲苷与大茴香酸反应产物具有荧光的特性建立了荧光分光光度法测定黄芪甲苷,方法灵敏度高、选择性好、线性范围宽、检出限低、操作简便。可直接用于黄芪生药、中药复方、黄芪制剂以及含药血清等多种样品的测定,无干扰。材料与方法 仪器 日本岛津RF-540型荧光分光光度计。 试剂 黄芪甲苷对照品(中国药品生物制品检定所提供)配成1.0 mg.mL-1的甲醇溶液。2%大茴香酸的无水乙醇溶液,72%硫酸溶液,85%磷酸溶液。所用试剂均为分析纯。 样品及处理 黄芪口服液(上海福达制药有限公司生产,批号980502)。取口服液1.00 mL,加入无水乙醇2.00 mL,离心分离沉淀,上清液蒸干,用甲醇1 mL溶解,备用。补阳还五汤复方汤剂煎煮3次,合并水煎液,分别用石油醚、氯仿、正丁醇萃取4次,每次萃取剂用量为水煎液体积的一半。合并正丁醇相,总体积为800 mL。取正丁醇萃取液2 mL,蒸干,用甲醇2 mL溶解,备用。含药猪血清样品(北京医科大学药学院生药研究室提供):用补阳还五汤复方浸膏连续3 d喂猪,3 d后取血,分离猪血清,取猪血清50 mL,用正丁醇萃取4次,每次萃取剂用量为原血清体积的一半。得含药血清样品100 mL,取正丁醇萃取液4 mL,蒸干,用甲醇2 mL溶解,备用。黄芪生药样品:按文献[3]方法提取分离,甲醇溶样,备用。结果与讨论1 黄芪甲苷反应产物的激发光谱和发射光谱 取1.0 mg.mL-1黄芪甲苷对照品0.1 mL,于5 mL量瓶中,加入2%大茴香酸溶液0.6 mL、72% H2SO4溶液0.8 mL,于60℃水浴中反应20 min,迅速冷却后,用无水乙醇定容至刻度,摇匀,在荧光分光光度计测荧光光谱黄芪甲苷反应产物最大激发波长Ex=320 nm,最大发射波长Em=387 nm。2 大茴香酸用量的影响 取大茴香酸0.1,0.3,0.5,0.6,0.7,0.9 mL按照分析方法操作,选择大茴香酸最佳用量。结果表明大茴香酸用量0.6 mL较合适(图1)。3 稀释液的选择 准确移取1.0 mg.mL-1黄芪甲苷0.1 mL,按照分析方法操作,体积定容时选无水乙醇、甲醇、冰醋酸和水作稀释液,测得其荧光强度(If)分别为77.6,48.4,35.0,1.3。可见无水乙醇对荧光强度影响最小。本文采用无水乙醇作为稀释液。 Fig 1 Effect of amount of anisic acid4 酸的种类和用量的影响 选72% H2SO4, 85% H3PO4及浓HClO4进行实验,结果发现选用72% H2SO4时反应产物的荧光强度最大。对72%硫酸的用量进行选择,结果表明72% H2SO4取0.8 mL为最佳(图2)。 Fig 2 Effect of amount of sulphuric acid5 反应温度的影响 准确移取1.0 mg.mL-1黄芪甲苷对照品0.1 mL,按分析方法内容操作,分别在40,50,60,70,80,90℃和沸水浴中反应20 min,同时做空白。考察荧光强度随温度的变化,结果表明:60℃时反应空白小,荧光强度较高。故实验选择60℃为反应温度较适宜。6 加热时间的影响 将温度控制在60℃,改变加热时间,考察加热时间对反应的影响。结果表明加热时间选20 min为宜。7 反应产物的稳定性 准确移取1.0 mg.mL-1黄芪甲苷对照品0.1 mL,按照分析方法操作,测定荧光强度值,每间隔5 min测定1次,对产物稳定性进行考察。结果表明反应产物在90 min内均稳定。8 工作曲线及检出限 分别准确移取1.0 mg.mL-1黄芪甲苷对照品0.010,0.025,0.050,0.100,0.150和0.200 mL,在最佳实验条件下,测定工作曲线,得回归方程为:Y=-0.4201+1.575X,γ=0.9993。黄芪甲苷浓度在2.0~40 μg.mL-1与荧光强度呈良好的线性关系。检出限为0.02 μg.mL-1。9 干扰考察 为解决基体太浓或基体不一致所造成的影响,在适当稀释溶液后,采用标准加入法测定样品。为考察此反应选择性,利用薄层分离黄芪甲苷[6]后测定样品中其他物质的荧光强度,证明杂质荧光强度与样品总荧光强度的比1.2%。10 样品的测定与回收率实验 取被测样品6份各0.1 mL,依次加入1.0 mg.mL-1黄芪甲苷对照品0.0,0.01,0.02,0.03,0.04和0.05 mL,按照分析方法操作,分别测定了黄芪、复方补阳还五汤、黄芪口服液及猪血清样品中黄芪甲苷的含量,测定结果及回收率实验见表1。SampleContent/%Recovery/%RSD/%HQOL0.210±0.00298.5~101.91.8BYHWT0.280±0.02098.8~102.12.1AMB0.420±0.00498.6~102.02.0PS0.063±0.00198.8~102.41.9黄芪是补阳还五汤的君药,黄芪甲苷定量分析是黄芪中药制剂质量控制的重要指标,本方法灵敏度高,选择性好,操作简便且无干扰,可作为黄芪甲苷的质控方法。基金项目: 九五攀登计划项目杜鸣(北京医科大学药学院分析化学与药物分析研究室,北京 100083 )徐秉玖(北京医科大学药学院分析化学与药物分析研究室,北京 100083 )刘养清(山西师范大学化学系,山西 临汾 041004)收稿日期: 1999-08-03
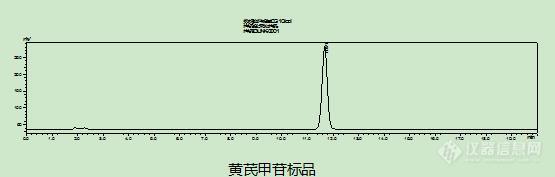
[align=center][color=#333333]黄芪含量测定[/color][/align]1 材料与试剂 乙腈(色谱级)、正丁醇、氨水、甲醇(分析纯)、黄芪甲苷(购自中检院)、血竭样品(送检样品)。2 色谱条件 LC-20AT液相色谱仪(日本岛津),色谱柱:Zorbax SB C18(250mm*4.6μm*5μm)(安捷伦),流动相:以乙腈-水(30:70);蒸发光检测器(奥泰);柱温35℃。3 样品制备(参照2015年版药典) 3.1 标准品溶液的制备 取黄芪甲苷对照品适量,精密称定,加甲醇溶解,即得。[align=center][img=,555,177]https://ng1.17img.cn/bbsfiles/images/2019/09/201909121553061421_926_1858223_3.jpg!w555x177.jpg[/img][/align]3.2 样品溶液的制备 取本品中粉约4g,精密称定,置索氏提取器中,加甲醇40ml,冷浸过夜,再加甲醇适量,加热回流4小时,提取液回收溶剂并浓缩至干,残渣加水10ml,微热使溶解,用水饱和的正丁醇振摇提取4次,每次40ml,合并正丁醇液,用氨试液充分洗涤2次,每次40ml,弃去氨液,正丁醇液蒸干,残渣加水5ml使溶解,放冷,通过D101型大孔吸附树脂柱(内径为1.5cm,柱高为12cm),以水50ml洗脱,弃去水液,再用40%乙醇30ml洗脱,弃去洗脱液,继用70%乙醇80ml洗脱,收集洗脱液,蒸干,残渣加甲醇溶解,转移至5ml量瓶中,加甲醇至刻度,摇匀,即得。[align=center][img=,583,180]https://ng1.17img.cn/bbsfiles/images/2019/09/201909121553295651_9515_1858223_3.jpg!w583x180.jpg[/img][/align]3.3 计算方法 分别精密吸取对照品溶液10μl、20μl,供试品溶液20μl,注入液相色谱仪,测定,用外标两点法对数方程计算,即得。小结:每次接到黄芪样品大家都会来一句怎么又有黄芪,大概黄芪是比较受嫌弃的中药材之一了,药典上的方法过程比较繁琐,一般需要2-3天才能把前处理处理完。检测简述流程:浸泡过夜——索氏提取4h——旋干——萃取 (4次+2次)——蒸干(这个正丁醇不太好旋干比较耗时)——过大孔树脂柱(上样之前要洗至无醇味,然后上样后用3种溶剂洗脱)——旋干——定容待测。为了减少误差及节省时间,我们考察了正丁醇的萃取次数对含量的影响,我们用2次80ml和4次40ml进行对比发现结果相当,实验操作过程中萃取次数越多反而容易引起操作误差,值得大家注意的是大孔树脂上样前要洗至无醇味,这个对结果影响还是有的,保证数据的平行性,用同体积的水进行洗至无醇味。
黄芪饮片按照中国药典2015年版方法测定黄芪甲苷液相图谱为2个峰,用含黄芪的超微粉制成的颗粒,测定其黄芪甲苷,液相图谱为1个峰,为什么?颗粒不只含有黄芪,含有其他成分,求解答,谢谢
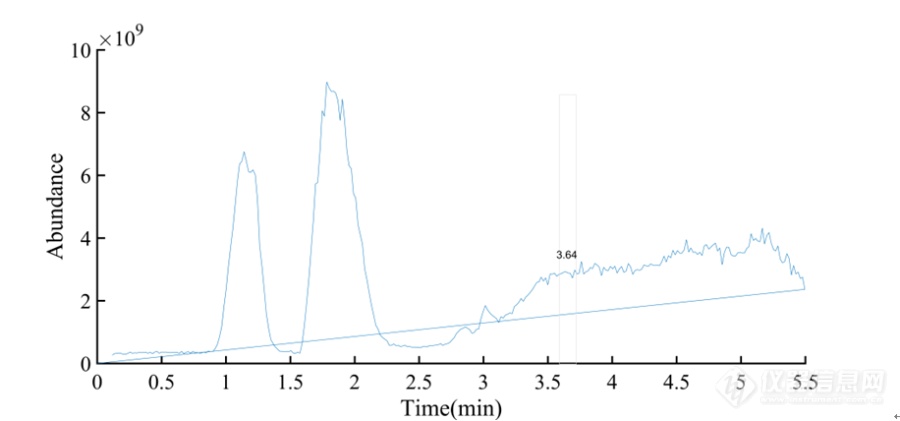
[align=center][b]UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS法测定黄芪水提物中的黄芪甲苷含量[/b][/align][b] 传统中药的煎煮,大多是用水作为溶剂,因此研究药材的水提物中有效成分的含量对药材的工业生产和实际应用具有不可忽视的指导意义。据文献报道[sup][/sup],黄芪水提物中主要为糖类和皂苷类成分,而水提物药渣中则是提取后剩余的淀粉、纤维素、木质素等原药材的基体成分和一些不易溶于水的酯类、酮类和芳香类成分。黄芪甲苷作为黄芪皂苷中一类重要的物质,已被药典收录为黄芪含量测定的指标成分。为了保证临床应用制剂的质量和进一步开发利用中药黄芪,研究黄芪水提物中黄芪甲苷的含量显得格外重要。在预实验中,笔者发现药典中测定黄芪中黄芪甲苷含量的方法并不完全适用于黄芪水提物中黄芪甲苷含量的测定,预处理时出现乳化现象导致萃取不完全,另外利用药典中规定的蒸发光检测器液相色谱仪测定无法得到理想的线性方程。因此,笔者结合黄芪水提物的性质和仪器灵敏性等特点,利用UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS法考察黄芪水提物中的黄芪甲苷含量测定的方法学和并利用该方法测定黄芪水提物中黄芪甲苷的含量。[b]1 材料和仪器1.1 样品 [/b] 收集9组黄芪水提取物样品,黄芪饮片为济南济成堂中药饮片有限公司提供(批号18033101)。[b]1.2 试剂 [/b]黄芪甲苷对照品(成都瑞芬思生物科技有限公司批号H-013-170117),乙腈为色谱纯(天津市科密欧化学试剂有限公司);超纯水。[b]1.3 仪器 [/b]Waters XevoTQ-S三重四级杆质谱仪(美国Waters公司)。ACQUITY UPLC H-CLass超高效液相色谱仪(美国Waters公司);超声波清洗机KS-300E(宁波科生仪器厂);电子天平MS205DU(梅特勒/瑞士)。[b]2 方法学考察2.1 色谱与质谱条件[/b]色谱条件:色谱柱为ACQUITY UPLC BEH C18柱(2.1*50 mm,1.7 mm)。流动相为乙腈-水(A∶B)系统。梯度洗脱,A相:0→1 min A保持30%;1→2 min A为30→60%;2→3 min A为60→70%;3→4 min A保持70%;4→4.5 min A为70→30%;A相:4.5→5.5 min A保持30%。流速 0. 2 mL/min,柱温为40 ℃,进样体积 1. 0 μL。质谱条件:电喷雾正离子检测模式,毛细管电压;3.0 kV;脱溶剂气流:N2,流速800 L h[sup]-1[/sup],脱溶剂温度400 ℃;锥孔电压:40 V,锥孔气流:N2,流速150 Lh[sup]-1[/sup];离子源温度: 400 ℃;雾化气压力为7.0 bar碰撞气体: 氩气。采用MRM 定量模式,质量扫描范围为100~1 000 amu。该条件下,获得黄芪甲苷的分子离子峰 m /z 785. 42,子离子峰m /z 143.08。黄芪甲苷提取总离子流图和一级质谱图分别见图3-1和图3-2。[/b][align=center][img=,690,322]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131701299261_9069_3237657_3.png!w690x322.jpg[/img][/align][align=center]图3-1 黄芪甲苷的总离子流图[/align][align=center][img=,690,331]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131701493040_8991_3237657_3.png!w690x331.jpg[/img][/align][align=center]图3-2 黄芪甲苷的一级质谱图[/align][b]2.2 供试品溶液的制备[/b]精密称定1/200重量的黄芪水提物样品(折合黄芪药材0.5g)置于锥形瓶中,精密加入4%氨水溶液100 mL,称定重量,超声30 min,取出放至室温,用4%氨水溶液补足减失的重量,摇匀,过滤,精密吸取续滤液10 mL过Dikma ProElut C18-U-SPE柱(先以甲醇20 mL活化,再以水20 mL平衡),上样后用10 mL水淋洗,弃去,再用适量甲醇洗脱,收集洗脱液,定容至10 mL容量瓶中,摇匀,用0.22 μm的微孔滤膜过滤,即得。[b]2.3 对照品储备溶液的制备[/b]精密称取黄芪甲苷标品1.01mg至10 mL容量瓶中,用甲醇溶解后定容,吸取1 mL至100 mL容量瓶中,用甲醇定容,制成浓度为1.01 μg/mL的对照品储备溶液。[b]3 结果3.1 线性关系考察[/b]精密吸取 2. 3 项下对照品储备溶液 1,3,5 mL,用甲醇稀释并定容到 10mL 容量瓶中,制备0.1,0.3,0.5 mgmL[sup]-1[/sup]质量浓度对照品溶液。另吸取0.1,0.3 mg/mL质量浓度对照品溶液5 mL至10 mL容量瓶,用甲醇定容,得到0.05,0.15 mg/mL质量浓度对照品溶液。在拟定分析条件下,准确吸取 10. 0 μL 进样分析。黄芪甲苷离子选择 m/z 785. 42 为母离子,143.08 为子离子,准确吸取1 0 μL 进样分析。以质量浓度为横坐标,以提取离子流图峰面积为纵坐标进行线性回归,如图3,得回归方程为:Y=46.135X + 1938.8(r[sup]2[/sup]= 0. 9984),提示黄芪甲苷在0. 05~0.5 mg/m L 范围内线性关系良好。黄芪甲苷对照品标准曲线如图3-3所示。[align=center][img=,690,423]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131702057366_9110_3237657_3.png!w690x423.jpg[/img][/align][align=center]图3-3 黄芪甲苷标准曲线[/align][b]3.2 精密度实验[/b]在拟定分析条件下,精密吸取供试品溶液1.0 μL,连续进样 6 次,记录提取离子流图峰面积,测定黄芪甲苷量,计算得相对标准偏差RSD为1.1% ,提示该方法具有较好的精密度。[b]3.3 重复性实验[/b]取同一黄芪样品 6份,按2. 2 项下方法制备供试品溶液,在拟定分析条件下,准确吸取 1. 0 μL 进样分析,测定黄芪甲苷量,计算得 RSD为2.0%,提示该方法重复性良好。[b]3.4 稳定性实验[/b]取黄芪药材供试品溶液,分别在0 h、3 h、6 h、9 h、24 h、48 h后,在拟定分析条件下,准确吸取 1. 0 μL 进样分析,测定黄芪甲苷量,计算得 RSD 为 4.7% ,提示黄芪供试品溶液稳定性较差。[b]3.5 加样回收率实验[/b]精密称取 6 份黄芪甲苷量已知的黄芪水提物样品,每份折合黄芪药材 0. 5 g,分别准确加入浓度为 0. 0 342 mg /mL 黄芪甲苷溶液1 ml,1 ml,2 ml,2 ml,3 ml,3 ml,按 “2. 2 ”项下方法制备供试品溶液,准确吸取 1. 0 μL 进样分析,测定黄芪甲苷量,计算回收率,结果见表3-1。由表3-1可见,方法平均回收率为 102.35% ,表明该方法具有较好的回收率。[align=center] [/align][align=center]表3-1 黄芪甲苷加样回收率测定结果[/align] [table][tr][td] [align=center]样号[/align] [/td][td] [align=center]样品中的量/mg[/align] [/td][td] [align=center]加入量/mg[/align] [/td][td] [align=center]测得量/mg[/align] [/td][td] [align=center]回收率/%[/align] [/td][td] [align=center]平均值/%[/align] [/td][td] [align=center]RSD/%[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]0.069[/align] [/td][td] [align=center]0.034[/align] [/td][td] [align=center]0.1[/align] [/td][td] [align=center]101.68[/align] [/td][td=1,6] [align=center]102.35[/align] [/td][td=1,6] [align=center]2.8[/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]0.069[/align] [/td][td] [align=center]0.034[/align] [/td][td] [align=center]0.11[/align] [/td][td] [align=center]104.44[/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]0.069[/align] [/td][td] [align=center]0.068[/align] [/td][td] [align=center]0.14[/align] [/td][td] [align=center]104.17[/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]0.069[/align] [/td][td] [align=center]0.068[/align] [/td][td] [align=center]0.13[/align] [/td][td] [align=center]96.42[/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]0.069[/align] [/td][td] [align=center]0.10 [/align] [/td][td] [align=center]0.17[/align] [/td][td] [align=center]102.78[/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]0.069[/align] [/td][td] [align=center]0.10 [/align] [/td][td] [align=center]0.18[/align] [/td][td] [align=center]104.63[/align] [/td][/tr][/table][align=center] [/align][b]3.6 黄芪甲苷的含量测定结果[/b]取9组黄芪水提物按照“2.2”项下操作,制备供试品溶液,准确吸取 1. 0 μL 进样分析,测定黄芪甲苷的含量。黄芪甲苷对照品和黄芪水提物样品的MRM 离子流图见图3-4、图3-5。供试品黄芪甲苷含量测定结果见表3-2。[align=center][img=,690,348]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131702286759_7988_3237657_3.png!w690x348.jpg[/img][/align][align=center]图3-4 黄芪甲苷对照品的 MRM 离子流图[/align][align=center][img=,690,344]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131702391650_7279_3237657_3.png!w690x344.jpg[/img][/align][align=center]图3-5 黄芪水提物样品的 MRM 离子流图[/align][align=center] [/align][align=center]表3-2 9组黄芪水提物中黄芪甲苷含量测定结果[/align] [table][tr][td] [align=center]试验号[/align] [/td][td] [align=center]峰面积[/align] [/td][td] [align=center]含量(mg/g)[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]5120.00 [/align] [/td][td] [align=center]0.14 [/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]6744.00 [/align] [/td][td] [align=center]0.21 [/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]10275.67 [/align] [/td][td] [align=center]0.36 [/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]26955.00 [/align] [/td][td] [align=center]1.08 [/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]10599.00 [/align] [/td][td] [align=center]0.38 [/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]7212.33 [/align] [/td][td] [align=center]0.23 [/align] [/td][/tr][tr][td] [align=center]7[/align] [/td][td] [align=center]11247.33 [/align] [/td][td] [align=center]0.40 [/align] [/td][/tr][tr][td] [align=center]8[/align] [/td][td] [align=center]8008.33 [/align] [/td][td] [align=center]0.26 [/align] [/td][/tr][tr][td] [align=center]9[/align] [/td][td] [align=center]9171.00 [/align] [/td][td] [align=center]0.31 [/align] [/td][/tr][/table][align=center] [/align][b]3.7 正交试验设计及结果[/b]水提的黄芪甲苷转移率考察正交试验与水提的出膏率考察正交试验设计相同,即以水作为提取溶剂,把影响药材提取效果的用水量(A)、提取时间(B)、提取次数(C)确定为考察因素,以上三个考查因素各分3个水平考察,见表3-3。[align=center]表3-3水提实验因素水平表[/align] [table][tr][td=1,2] [align=center]水平[/align] [/td][td=3,1] [align=center]因素[/align] [/td][/tr][tr][td] [align=center]A(用水量/倍)[/align] [/td][td] [align=center]B(提取时间/h)[/align] [/td][td] [align=center]C(提取次数/次)[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]4[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]8[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]10[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][/tr][/table][b] [/b]黄芪甲苷转移率=各实验组黄芪提取物中黄芪甲苷含量/原黄芪药材中黄芪甲苷含量×100%。原药材中毛蕊异黄酮苷的含量按照药典的方法测得的结果为0.4042mg/g。跟据实验数据,得到水提实验中设定的不同工艺条件下的毛蕊异黄酮苷的转移率,其中因素D为误差项,作直观分析表和方差分析表,见表3-4,表3-5。[align=center]表3-4 黄芪甲苷转移率考察L[sub]9[/sub](3[sup]4[/sup])正交试验表[/align] [table][tr][td] [align=center]试验号[/align] [/td][td] [align=center]A[/align] [/td][td] [align=center]B[/align] [/td][td] [align=center]C[/align] [/td][td] [align=center]D[/align] [/td][td] [align=center]黄芪甲苷 转移率/%[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]34.12 [/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]51.54 [/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]89.41 [/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]268.30 [/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]92.88 [/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]56.56 [/align] [/td][/tr][tr][td] [align=center]7[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]99.83 [/align] [/td][/tr][tr][td] [align=center]试验号[/align] [/td][td] [align=center]A[/align] [/td][td] [align=center]B[/align] [/td][td] [align=center]C[/align] [/td][td] [align=center]D[/align] [/td][td] [align=center]黄芪甲苷 转移率/%[/align] [/td][/tr][tr][td] [align=center]8[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]65.10 [/align] [/td][/tr][tr][td] [align=center]9[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]77.56 [/align] [/td][/tr][tr][td] [align=center]K1[/align] [/td][td] [align=center]175.07 [/align] [/td][td] [align=center]402.25 [/align] [/td][td] [align=center]155.78 [/align] [/td][td] [align=center]204.56 [/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]K2[/align] [/td][td] [align=center]417.74 [/align] [/td][td] [align=center]144.42 [/align] [/td][td] [align=center]397.40 [/align] [/td][td] [align=center]207.93 [/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]K3[/align] [/td][td] [align=center]242.49 [/align] [/td][td] [align=center]223.53 [/align] [/td][td] [align=center]282.12 [/align] [/td][td] [align=center]422.81 [/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]优水平[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]R[/align] [/td][td] [align=center]242.67 [/align] [/td][td] [align=center]257.83 [/align] [/td][td] [align=center]241.62 [/align] [/td][td] [align=center]218.25 [/align] [/td][td] [align=center] [/align] [/td][/tr][/table][align=center] [/align][align=center]表3-5 黄芪甲苷转移率考察方差分析结果[/align] [table][tr][td] [align=center]方差来源[/align] [/td][td] [align=center]离差平方和[/align] [/td][td] [align=center]自由度[/align] [/td][td] [align=center]F[/align] [/td][td] [align=center]显著性[/align] [/td][/tr][tr][td] [align=center]A[/align] [/td][td] [align=center]10460.75[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1.13[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]B[/align] [/td][td] [align=center]7698.00[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]0.75[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]C[/align] [/td][td] [align=center]9736.83[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1.02[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]D[/align] [/td][td] [align=center]10424.20[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]-[/align] [/td][/tr][/table]注:F[sub]0.1[/sub](2,2)=9,F[sub]0.05[/sub](2,2)=19,*为有显著性,-为无显著性。从正交试验结果可知,水提实验中,各因素对黄芪甲苷转移率的影响大小顺序为:A(用水量)C(提取次数)B(提取时间);每个因素3水平之间的趋势为A[sub]2[/sub]A[sub]3[/sub]A[sub]1[/sub],B[sub]1[/sub]B[sub]3[/sub]B[sub]2[/sub],C[sub]2[/sub]C[sub]3[/sub]C[sub]1[/sub],直观分析得最佳提取工艺为A[sub]2[/sub]B[sub]1[/sub]C[sub]2[/sub],即加水8倍量,提取2次,每次1h。表3-5的方差分析结果表明: A、B、C三因素对黄芪甲苷转移率的影响都无统计学差异(P0.05)。[b]4 讨论[/b]本章实验利用超高效液相串联三重四级杆质谱仪测定黄芪水提物中黄芪甲苷的含量,相比药典中测定黄芪药材中黄芪甲苷的方法,此方法预处理步骤更少,用时更短,目标峰与其他相邻峰的分离度也更大,适合于黄芪水提物中黄芪甲苷含量的测定。但美中不足的是,供试品的预处理需要过SPE柱,仪器的使用和维护费用更高,实验者在测定样品的含量前需要综合考虑。从测定结果来看,设置的三个因素中,用水量对黄芪甲苷的转移率影响最大,但仍无统计学差异(P0.05),说明用水量、提取次数、提取时间三种工艺的改变对黄芪水提物中黄芪甲苷的含量无显著性影响。第4、5、7组的黄芪甲苷转移率相比其他组的更高,尤其是第4组测得的黄芪甲苷的含量远高于用药典方法测得的药材中黄芪甲苷的含量,正交实验分析结果也说明加水8倍量,提取2次,每次1h是最佳提取工艺。这一结果与水提实验中第3、4、7组测得的出膏率较高有些差异,第4组实验的出膏率也不算低,但不是最高,而出膏率最高的第3组黄芪甲苷的转移率却不高,这说明出膏率与黄芪水提物中黄芪甲苷的转移率并无明显的对应关系。合乎标准要求的有效成分含量是保证药物疗效稳定可靠的硬性指标,实现有效成分提取的最大化是优化工艺条件的重要目标。本章关于不同提取工艺条件下黄芪甲苷转移率的考察研究,对芪龙胶囊和黄芪配方颗粒工艺的优化具有指导性意义。[align=center]参考文献[/align] 黄冬兰,徐永群,陈小康. 黄芪药材及其水提物的红外光谱分析. 光谱实验室,2012,29(5):2823-2826.
有没有哪位大神用紫外或者示差测过黄芪甲苷啊,我们这边没有蒸发光散射,只能用紫外和示差,但是跟着文献上搜出来的资料完全没有走出来的迹象啊。仪器条件如下:1:紫外:流动相30%乙腈水,色谱柱150mm的C18柱子走,检测波长203。2:示差 流动相:67%甲醇水,色谱柱:150mm C18。以上,标都是用甲醇配的,最大浓度是500ppm。
食疗方--【黄芪补气茶】【食材】黄芪10克、西洋参10克、枸杞子10克。【做法】煎水服用。【效果】益气滋阴、清热降火、消除疲劳、增强大脑记忆力。
[color=#06948c][size=18px][b]伏天为何易气血不足[/b][/size][/color][b]1.高温消耗:[/b]高温环境下,人体为了散热会大量出汗,汗液排出过多不仅带走了水分,也带走了体内的电解质和一部分营养物质,从而加剧了气血的消耗。[b]2.饮食不节:[/b]夏季人们往往偏好冷饮、生冷食物,这些食物容易损伤脾胃,影响消化吸收功能,进而导致营养吸收不足,气血生成减少。[b]3.作息不规律[/b]:伏天炎热,人们容易晚睡早起,睡眠质量下降,作息不规律进一步影响了气血的恢复和生成。[b]4.过度劳累:[/b]夏季人体代谢加快,加上工作或生活压力大,容易导致身体过度劳累,进一步消耗气血。[b]当归黄芪蛋有什么功效?[/b]当归黄芪蛋,作为中医里一道著名的滋补药膳,融合了药与食的精髓,既具有药物的治疗作用,又保留了食物的温和与营养。[back=url(&]这道药膳的配方简单却精妙,主要包括[/back][b][back=url(&]当归、黄芪、红枣、红糖和鸡蛋[/back][/b][back=url(&]。[/back]当归,被誉为“血中圣药”,具有补血活血、调经止痛、润肠通便等多种功效,对于血虚萎黄、月经不调等症状有显著疗效。黄芪,则被誉为“补气之长”,擅长补气升阳、固表止汗、利水消肿,是治疗气虚乏力的良药。两者结合,既能补血又能补气,相得益彰,共同作用于人体,达到气血双补的效果。[b]1.补气养血:[/b]当归和黄芪的组合,既能补血又能补气,对于气血不足的人群尤为适宜。当归补血活血,黄芪补气升阳,两者协同作用,能够显著改善[color=var(--weui-LINK)]气血两虚的症状[i][/i][/color]。[b]2.活血调经:[/b]当归具有活血调经的功效,对于月经不调、经闭痛经的女性尤为有益。在月经前两天食用当归黄芪蛋,有助于缓解经期不适症状,促进月经恢复正常。[b]3.健脾益胃:[/b]红枣和红糖的加入,不仅增加了药膳的口感,还起到了健脾益胃的作用。红枣能益气补血,入脾胃经,有助于提升脾胃的运化功能;红糖则能温中散寒,暖胃止痛。[b]4.增强免疫力:[/b]长期食用当归黄芪蛋,还能增强人体的免疫力,提高身体抵抗疾病的能力。当归中的多糖成分和黄芪中的皂苷成分都具有增强免疫功能的作用。[color=#06948c][size=18px][b]当归黄芪蛋怎么做?[/b][/size][/color][b]原料:[/b]当归6克,黄芪6克(传统比例为5:1,但药膳中可适当调整),红枣5颗,红糖适量,鸡蛋1个。[b]做法:[/b]鸡蛋清水煮5~10分钟,捞出过凉水,剥去蛋壳,用竹签在蛋壳上戳几个小孔,以便药性渗透。红枣切片备用。将处理好的鸡蛋、红枣、当归、黄芪一同放入砂锅中,加水适量,大火煮开后转小火慢炖。炖煮约15分钟后,加入红糖调味,继续煮至红糖完全融化即可。食用建议:每日食用1~2个当归黄芪蛋,连续食用一个月。可根据个人体质和需求适当调整食用量。[size=18px][b][color=#06948c][/color][/b][/size][color=#06948c][size=18px][b]食用当归黄芪蛋时需注意以下3点[/b][/size][/color][b]1.适量食用:[/b]药膳虽好,但也不宜过量食用。应根据个人体质和需求适量调整食用量,避免补益过度。[b]2.避免与药物同服:[/b]当归、黄芪等中药材不宜与降血压、降血脂、扩张血管类药物同服,以免发生[color=var(--weui-LINK)]药物相互作用[i][/i][/color]。在食用前最好咨询医生或药师的[back=url(&]建议[/back]。[b]3.禁忌人群:[/b]实证及阴虚阳盛者、大便泄泻湿盛中满者忌服当归黄芪蛋。此外,孕妇在食用前也应咨询医生意见。
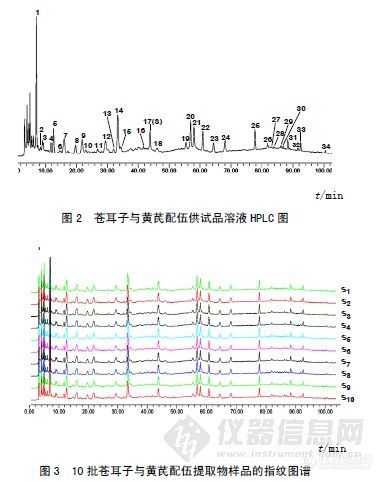
作者:曹敏; 武斌; 刘树民;(黑龙江中医药大学中医药研究院;)摘要:目的建立苍耳子配伍黄芪的高效液相色谱(HPLC)指纹图谱分析方法,研究配伍对各单味药主要特征峰的影响。方法采用HPLC分析苍耳子、黄芪单煎及苍耳子配伍黄芪合煎样品,选用Diamonsil C18色谱柱(5μm,250 mm×4.6 mm),以甲醇-0.2%甲酸水为流动相进行线性梯度洗脱,流量为0.8 mL/min,检测波长为260 nm。结果建立了苍耳子配伍黄芪的HPLC指纹图谱,基本为两单味药特征峰的加和,无明显新特征峰的增加,但配伍合煎对某些成分的溶出有明显的相互抑制作用。结论本方法简便、快捷,为临床类方的配伍应用以及制定复方质量标准提供了参考。谱图:http://ng1.17img.cn/bbsfiles/images/2012/08/201208061420_381877_1606903_3.jpg
想问问各位你们都是用什么测黄芪甲苷的,用什么牌子的仪器,感觉怎么样?国家对测黄芪甲苷的仪器有什么灵敏度或者是其他方面的规定吗?我们公司想买蒸发光散射检测器来测黄芪甲苷,大家觉得哪个好些?老板的心理价位就8-10万吧,谢谢各位[em58]
检测黄芪药材中的黄芪甲苷,用elsd检测器,c18柱,雾化管30 漂移管70 药典方法乙腈比水32比68 对照品塔板数11000,但是样品塔板数才2800,含量合格,要求塔板数是4000这是怎么回事,重做了好多次塔板数就是上不去
利用[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收光谱[/color][/url]法(AAS)测定中药黄芪中微量重金属的含量,具有精确、灵敏、选择性好、结果可靠,操作简单等优点而成为测定重金属微量元素最常见的方法之一。[b]方法依据及限量要求[/b]2020版《中国药典》:通则(0406[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]法):通则2321铅、镉、砷、汞、铜的测定[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]分光光度法。限量标准:铅为≤5mg/kg,镉为≤1.0mg/kg。[b]实验准备工作[/b][i][b]01[/b][/i][b]仪器及试剂[/b][url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]分光光度计:SP-3887ZAA。分析天平:万分之一的电子天平;微波消解仪,石墨赶酸器。普通实验室玻璃器皿:100mL、25mL、刻度容量瓶等若干(玻璃器皿均用酸泡制过夜)。[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液器[/color][/url]:100-1000μL,5000μL及相应的[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url]头若干。化学试剂:硝酸、过氧化氢等(除另有说明,化学试剂均为优级纯或BV-Ⅲ)实验用水:所有实验用水均为18.2MΩ的纯水。国家标准物质黄芪:GBW10028(GSB-19)。[i][b]02[/b][/i][b]中标液及中间液的制备[/b]标准溶液:铅100μg/mL,镉1000μg/mL的标准溶液。铅中间溶液的制备:用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液器[/color][/url]取1mL铅标准储备溶液(100μg/mL)用2%的硝酸溶液定容至100mL,此溶液为1000ng/mL铅中间溶液。镉中间溶液的制备:用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液器[/color][/url]取1mL镉标准储备溶液(1000μg/mL)用2%的硝酸溶液定容至100mL,此溶液为10μg/mL镉中间溶液。再用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液器[/color][/url]移取1mL10μg/mL镉溶液1mL用2%硝酸溶液定容至100mL容量瓶中,此溶液为100ng/mL镉中间储备液。[b]实验方法[/b]标准物质黄芪制备:准确称取黄芪0.5g三组(精确至0.0001g)置聚四氟乙烯消解罐内,加硝酸5mL和过氧化氢1mL混合置于微波消解仪消解(按仪器规定的消解程序操作)。消解完全后,取消解内罐置石墨赶酸器中缓缓加热至红棕色蒸气挥尽,并继续缓缓浓缩至2-3mL,放冷。同法同时制备试剂空白溶液。用纯水洗涤转移。以少量多次的原则(至少3次)定容到25mL容量瓶中。[b]测定方法铅、镉的测定(石墨炉法)?[/b][i][b]01[/b][/i][b]测定参考条件[/b]表1 铅、镉石墨炉条件参数[img=,690,82]https://ng1.17img.cn/bbsfiles/images/2024/08/202408051224404106_8045_6541583_3.jpg!w690x82.jpg[/img][i][b]02[/b][/i][b]铅标准曲线[/b]用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液器[/color][/url]分别精密量取(5.2)中间液:0.0、0.25、0.5、1.0、2.0、3.0、4.0mL置于100mL容量瓶中用2%硝酸溶液定容,此溶液中含铅分别为0.0、2.50、5.0、10.0、20.0、30.0、40.0ng/mL,自动进样器精密移取标准溶液20μL和5μL基体改进剂(含1%磷酸二氢铵和0.2%硝酸镁的混合溶液),注入石墨炉原子化器,测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线见表2。表2 铅的升温参数、标准曲线、回归方程[img=,588,434]https://ng1.17img.cn/bbsfiles/images/2024/08/202408051225133892_55_6541583_3.jpg!w588x434.jpg[/img][i][b]03[/b][/i][b]镉标准曲线[/b]用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液器[/color][/url]分别精密量取(5.3)中间储备溶液:0.0、0.5、1.0、2.0、3.0、4.0mL置于100mL容量瓶中用2%硝酸溶液定容。制成每lmL分别含镉0.0、0.5、1.0、2.0、3.0、4.0ng/mL的溶液,自动进样器精密移取标准溶液10μL和5μL基体改进剂(含1%磷酸二氢铵和0.2%硝酸镁的混合溶液)注入石墨炉原子化器,测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线见表3。表3 镉的升温参数、标准曲线、回归方程[img=,593,453]https://ng1.17img.cn/bbsfiles/images/2024/08/202408051225400182_8075_6541583_3.jpg!w593x453.jpg[/img][i][b]04[/b][/i][b]黄芪标准物质测定[/b]在最佳条件下对消解好的三组国家标准物质黄芪进行分析验证(每个样品重复测试三次),测试结果、准确率及精密度测定结果列于表4中。表4 国家标准物质黄芪:GBW10028(GSB-19)样品成分分析结果[img=,690,273]https://ng1.17img.cn/bbsfiles/images/2024/08/202408051226173373_8667_6541583_3.jpg!w690x273.jpg[/img][b] 总结 [/b]本次实验使用标准曲线法并采用塞曼背景校正,测定黄芪标准物质。实验结果中铅、镉准确率均达到94%-109%,得到标准曲线相关系数R值均大于0.999。石墨炉[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]法良好的重现性、精密度在1.0%-2.1%;[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]法检出限低,选择性好,灵敏度和准确率高,分析速度快,完全满足对中药材黄芪检测中铅、镉的测定,并适合于常规重金属的分析。
活血通络颗粒是由黄芪、丹参、当归、赤芍、地龙、川芎等多味中药组成的复方制剂,具有益气活血、抗凝、降脂等功效。主要用于中风后遗症、脑血栓、脑动脉硬化及高血压、高血脂、心绞痛等心脑血管疾病。黄芪为方中君药,黄芪甲苷为其指标成分,中药复方中黄芪甲苷含量测定已有文献报道。本研究参考文献方法,建立测定活血通络颗粒中黄芪甲苷含量的方法,为控制本品质量打下基础。 1 仪器与试药 薄层扫描仪(日本岛津CS一9000),硅胶G薄层板(青岛海洋化工厂,10cm×10cm),定样毛细管(美国Drumond公司),电子分析天平(梅特勒一托利多仪器上海有限公司),黄芪、丹参、当归等原料药(医药公司),黄芪甲苷对照品(中国药品生物制品检定所),活血通络颗粒剂(本院自制,批号20020326,20020410,20020419)。所用试剂均为分析纯。
咳嗽喝黄芪陈皮饮。取黄芪15克、陈皮5克、红枣(去核)2—4枚,将所有原料放入锅中,加适量清水煎煮30分钟即可。该茶饮有助补肺、固表、健脾,适用于疲倦乏力、咳嗽不止者。??皮饮。取黄芪15克、陈皮5克、红枣(去核)2—4枚,将所有原料放入锅中,加适量清水煎煮30分钟即可。该茶饮有助补肺、固表、健脾,适用于疲倦乏力、咳嗽不止者。??
建立高效液相色谱-蒸发光散射检测器测定黄芪甲苷含量的方法。方法:采用一种新的检测器-蒸发光散射检测器(ELSD)以黄芪甲苷为对照品对黄芪中的黄芪甲苷进行HPLC分析,色谱柱:Phenomenex-ODS;流动相:乙腈-水(37∶63);流速:0.85mL/min;ELSD参数;漂移管温度:100℃;载气流速:2.7L/min。结果:黄芪甲苷在0.396~3.564μg范围内呈线性,回收率为97~94%(RSD=0.68%)。结论:本法具有良好的精密度和重现性,结果准确可靠,可作为原料的质量控制方法。
[align=center][font=宋体][color=black]黄芪配方颗粒的研究现状[/color][/font][/align][align=left][font=宋体][color=black]传统中药饮片在煎煮时大多以水为溶剂,在应用上存在一定的缺陷,例如用量不好掌控、携带不便、煎煮也略显繁琐等,这些都与现代生活的快节奏难以相适应。中药配方颗粒剂又名中药颗粒饮片,它还有免煎饮片、单味中药浓缩颗粒等美称。中药配方颗粒剂是依据传统中医药理论和现代临床应用的需要,利用现代先进的生产工艺设备和技术,对中药材饮片进行单味药材的批量生产而成的一种新的颗粒剂型。中药配方颗粒剂作为替代传统中药饮片的一种新剂型,它具有服用方便、携带快捷、食用安全、质量卫生、方法科学等特点[/color][/font][sup][color=black][13][/color][/sup][font=宋体][color=black]。中药配方颗粒剂为中药国际化发展提供了机会,对中药配方颗粒进行相关研究也日益广泛和深入,必将推动中药事业的良好发展[/color][/font][sup][color=black][1][/color][/sup][font=宋体][color=black]。[/color][/font][/align][font=宋体][color=black]传统中药汤剂在煎煮时存在耗费时间、煎煮后汤剂口感苦、携带困难等问题,这些问题使中药传统剂型在现代社会的传播中受到限制。而中药配方颗粒剂却获得越来越多人的认可。将中药配方颗粒以调查问卷的形式发放到社会中,结果表明大多数调查对象赞同研究中药配方颗粒[/color][/font][sup][color=black][2][/color][/sup][font=宋体][color=black]。[/color][/font][font=宋体][color=black]中药配方颗粒剂在我国中药的发展中仍存在的弊端:药物的基原不同,一味中药由多种产地混合组成,如中药黄连就有三种来源,分别为为毛食黄连、三角叶黄连或云连,其有效成分及含量不同,应当在颗粒剂说明书中备注多基原的中药并标明药材的基原。药材的炮制品种多样,中药有多种炮制方法,包括蜜炙、酒炙等,不同的炮制方法造成药材的有效成分及含量不同。应当在颗粒剂说明书中备注药材炮制方法。颗粒剂的说明书至关重要,若未能详细的列出各药材的基原和炮制方法,将不利于中药配方颗粒在市场上的应用和推广[/color][/font][sup][color=black][3][/color][/sup][font=宋体][color=black]。当前中药配方颗粒已有大量科研成果,为保证其向市场稳定转化,应制定法律法规提高其质量标准[/color][/font][sup][color=black][4][/color][/sup][font=宋体][color=black]。[/color][/font][font=宋体][color=black]配方颗粒是将中药提取物作为一种新型的饮片进行配伍组合后制备而成的中药制剂。黄芪在配方颗粒中的工艺多为醇提后回收药渣再进行水提,将水提液醇沉得到多糖类化合物后,澄清溶液于醇提液混合,分别得到皂苷类部分和多糖类部分。中药中[/color][/font][color=black]“[/color][font=宋体][color=black]辨证论治[/color][/font][color=black]”[/color][font=宋体][color=black]是根据机体在病变时表现的性质、部位,以及邪正之间的关系,概括病症的[/color][/font][color=black]“[/color][font=宋体][color=black]证[/color][/font][color=black]”[/color][font=宋体][color=black]。根据辩证的结果,对不同情况决定治疗的手段、方法。中医中药讲究辨证施治,对于不同体质的患者,如阴阳不同、体质不同等,药物服用量都有严格的控制。对药材进行不同的炮制方法,其相同的药材可表现出不同的药理作用,炮制方法主要包括蒸制、熬制、醋炒制、盐水制、蜜水制、黄连制、红花制等,不同的炮制方法,功效与临床应用都有所区别。如现代配方颗粒对药材的炮制方法做了研究,对不同症状的患者选用不同炮制方法得到的药材进行治疗,例如生地黄具有清热凉血,养阴,生津等功效,而熟地黄具有滋阴补血,益精填髓的功效,生地炭则以凉血止血为主。而现代配方颗粒尚不能达到中医辨证论治的思维,无法按照中医阴阳学说辩证施治,区别对待阴虚、阳盛的体质,从而配伍同种药材不同处理方法得到的配方颗粒。因此配方颗粒具有一定的局限性,同时也表明其仍有较大的发展空间。黄芪配方颗粒作为常用药,其有效成分含量没有研究证明与其他药方中黄芪皂苷含量进行对比,应借鉴其他药方的提取工艺进一步优化黄芪皂苷的提取工艺,传统提取方法应结合现代生产工艺技术,摸索最佳方法,因此找到最有效的提取工艺亟待解决。[/color][/font][font=宋体]参考文献[/font][color=black][1] [/color][font=宋体][color=black]李建会[/color][/font][color=black],[/color][font=宋体][color=black]张霄潇[/color][/font][color=black], [/color][font=宋体][color=black]荆志伟[/color][/font][color=black]. [/color][font=宋体][color=black]中药配方颗粒合理放开竞争发展的思考[/color][/font][color=black][J]. [/color][font=宋体][color=black]中医药管理杂志[/color][/font][color=black], 2016, 24 ( 13):7-10.[/color][color=black][2] [/color][font=宋体][color=black]汪杰[/color][/font][color=black]. [/color][font=宋体][color=black]黄芪配方颗粒提取与纯化工艺研究[/color][/font][color=black][D]. [/color][font=宋体][color=black]广州中医药大学[/color][/font][color=black], 2009.[/color][color=black][3] [/color][font=宋体][color=black]孙源源[/color][/font][color=black],[/color][font=宋体][color=black]施萍[/color][/font][color=black]. [/color][font=宋体][color=black]借助中药配方颗粒推进中药国际化的对策研究[/color][/font][color=black][J]. [/color][font=宋体][color=black]中草药[/color][/font][color=black], 2013, 44 ( 08 ):929-934.[/color][color=black][4] [/color][font=宋体][color=black]张红梅[/color][/font][color=black],[/color][font=宋体][color=black]宋景政[/color][/font][color=black], [/color][font=宋体][color=black]谭红胜[/color][/font][color=black], [/color][font=宋体][color=black]等[/color][/font][color=black]. [/color][font=宋体][color=black]从汤剂到颗粒剂[/color][/font][color=black]:[/color][font=宋体][color=black]中药配方颗粒[/color][/font][color=black]20[/color][font=宋体][color=black]年回顾与展望[/color][/font][color=black][J]. [/color][font=宋体][color=black]世界科学技术[/color][/font][color=black] ( [/color][font=宋体][color=black]中医药现代化[/color][/font][color=black]) , 2012, 14 ( 04 ):1740-1753.[/color]
高效液相色谱法测定黄芪中黄芪甲苷含量的计算方法
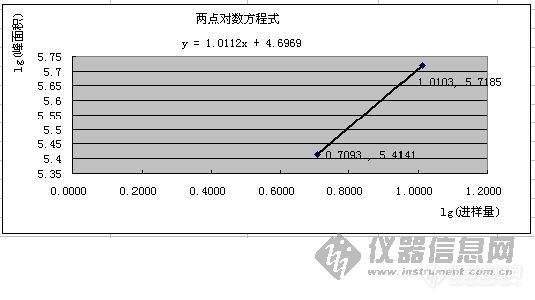
[color=#00008b]前言:本篇是以黄芪含量测定的方法为例来介绍两点对数方程的应用,有关安捷伦1100的操作方法和蒸发光检测器的知识大家可以在本网和回帖中找到,如有疑问我们共同探讨。并在此感谢大家对文章的建议,也使我学到了很多知识,谢谢大家![/color][size=4][b] 解析外标两点对数方程计算黄芪药材含量[/b][/size][b]方 法[/b]: 照高效液相色谱法,ODS柱,以乙腈-水(32:68)为流动相,流速1ml/min,经蒸发光检测器检测,用外标两点对数方程计算黄芪药材中黄芪甲苷的含量。[b]仪 器[/b]: 安捷伦1100型液相色谱仪、蒸发光检测器(ELSD)、ODS柱(4.6um*5mm*200mm)[b]供试品[/b]: 黄芪药材(检测成分:黄芪甲苷)[b]关键词[/b]: 高效液相法、蒸发光检测器、黄芪甲苷、粉碎、提取物、外标两点对数方程[b]正 文[/b]:[color=#dc143c]前处理:[/color]取约20g的黄芪药材放置于小型粉碎机内,粉碎后,盛装在密闭的容器中待用。[color=#dc143c]供试品制备:[/color]取黄芪药材粉末两份,Ⅰ.4.0037g;Ⅱ.4.0022g。分别置索氏提取器中,加甲醇40ml,浸泡过夜(大于8小时)。第二天,加甲醇适量,加热回流4小时,提取液浓缩至干,残渣加水10ml,微热使溶解,用水饱和的正丁醇(制法:把水加入正丁醇中至饱和)振摇提取4次,每次40ml,合并正丁醇液;用氨试液充分洗涤2次,每次40ml,弃去氨液,正丁醇液蒸干,残渣加水5ml使溶解,放冷;通过D101型大孔吸附树脂柱(备注:自己装填),并以水50ml洗脱,弃去水液;再用40%乙醇30ml洗脱,弃去洗脱液;继用70%乙醇80ml洗脱,收集洗脱液,蒸干;用甲醇溶解并转移至5ml量瓶中,加甲醇至刻度,摇匀,即得供试品溶液。简单讲,即把黄芪药材最后提取物(黄芪甲苷)溶解到5ml甲醇中。[color=#dc143c]对照品制备:[/color]称取黄芪甲苷对照品(中检所购入)0.0512g至100ml容量瓶中,用甲醇溶解至刻度,摇匀,即得。[color=#dc143c]测定:[/color]系统平衡后,精密吸取对照品溶液10ul进样,得色谱峰面积Ⅰ.259457 ;进样20ul,得色谱峰面积Ⅱ.523039。供试品溶液进样20ul,两针,色谱峰面积为:Ⅰ.909836,Ⅱ. 902925 。根据对照品峰面积和进样量,以外标两点对数方程计算供试品含量。[color=#dc143c]两点对数方程定义:[/color]是利用两点的对数值呈线性关系求解二元一次方程y=ax+b。本题是利用对照品溶液两针进样量的对数值和所得峰面积的对数值呈线性的关系,把两组数据带入方程y=ax+b中,求得a和b,即求解了该方程式。然后带入供试品峰面积的对数值,求得供试品进样量的对数值,对其求反对数得供试品进样量(黄芪甲苷的量)。方程中x、y值均为进样量和峰面积取对数(lg)后的数值。简单讲,就是通过对照品溶液两针的进样量和峰面积(均取对数lg)求解方程式后,把供试品峰面积(取对数lg)带入方程式求得供试品的进样量。[color=#dc143c]数据处理:[/color]根据外标两点对数方程,应先计算得到方程式中的x、y值,才能求解此方程式。即取对照品进样量的对数值为x,取对照品峰面积对数值为y,计算结果如下:---------对照品-----------Ⅰ--------------------------Ⅱ---------进样量:---0.0512g×10ul(5.12ug)-----0.0512g×20ul(10.24ug)进样量取lg,得x:--------0.7093 --------------------1.0103 -----色谱峰面积:--------259457---------------------523039峰面积取lg,得y:--------5.4141---------------------5.7185 [color=#dc143c]方程式求解:[/color]根据“数据处理”中求得的x、y值,通过Excel图表中的XY散点图,以(0.7093,5.4141)、(1.0103, 5.7185)两点,求得方程如下:[img]http://ng1.17img.cn/bbsfiles/images/2009/09/200909021104_169264_1622024_3.jpg[/img][color=#dc143c]供试品进样量求解:[/color]取供试品色谱峰面积的对数值,得y,带入已求得的方程式y=1.0112x+4.6969,求得x,如下:---------供试品------------Ⅰ----------------------Ⅱ ---------称样量:--------4.0037g -----------------4.0022g -----色谱峰面积:--------909836-------------------902925峰面积取lg,得y:--------5.9590-------------------5.9557 通过方程,求得x:--------1.2481-------------------1.2448根据lg(进样量)=x,求x(1.2481、1.2448)的反对数,得供试品进样量:Ⅰ.17.7052ug 、Ⅱ.17.5711ug(黄芪甲苷)[color=#dc143c]含量计算:[/color]根据供试品称样量、样品的稀释倍数5ml及20ul进样量中黄芪甲苷的量,求得:供试品Ⅰ含量:(17.7052ug×5ml/4.0037g/20ul)×100%=0.1106%供试品Ⅱ含量:(17.5711ug×5ml/4.0022g/20ul)×100%=0.1098%平均值为:(0.1106%+0.1098%)/ 2 = 0.11%[color=#dc143c]结 果:[/color]该批黄芪药材中含黄芪甲苷的量为0.11%。[color=#dc143c]数据处理Excel表:[/color]见附件:[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=169305]黄芪含量测定数据处理全过程[/url][b]参考文献[/b]:1.《中国药典》2005版一部2.《高效液相色谱法及其在药物分析中的应用》(中华康网)3.《你了解蒸发光检测器吗?》(仪器信息网)(全文完,请大家指导!)===============================================================================================蒸发光检测器知识:一.[b]ELSD检测步骤[/b]:1)雾化:在雾化器中,洗脱液通过1个针孔与氮气(也可以用空气)混合,形成均匀的雾状液滴。2)流动相蒸发:液滴通过加热的漂移管时,流动相被蒸发,样品组分形成气溶胶,进人检测室。3)检测:在检测室内,用激光来照射气溶胶,产生散射,测定散射光强,记录散射光强度随时间的变化关系,就得到了色谱图。二.[b]ELSD检测原理[/b]:气溶胶受固定光强的激光照射后,待测组分的质量(m)和散射光强度(I)有以下的关系:I=Kmb lgI=blgm+lgK式中K和b为与蒸发室温度和流动相性质有关的常数。上式说明散射光的对数响应值与组分的质量的对数成线性关系。
使用蒸发光检测器做黄芪甲苷含量不出峰怎么办?使用的液相是伍丰手动的
随着人口老龄化,糖尿病患病率持续上升,最新数据显示全球大约有5.366亿人患有糖尿病(患病率10.5%),预计到2045年患病人数将达到7.832亿(患病率12.2%)[1]。随着时间的推移,大约50%的糖尿病患者会发展为糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)[2]。DPN是一种以感觉神经病变为主,并累及自主神经系统的神经退行性疾病,表现为远端肢体对疼痛、温度、振动和本体感觉的丧失[3],是下肢截肢和致残性神经病理性疼痛的主要原因[4]。高血糖、血脂异常、微血管损伤、氧化应激、炎症、线粒体功能障碍、晚期糖基化终末产物(advanced glycosylation end products,AGEs)、神经营养因子缺失等在DPN中具有重要作用。目前,治疗DPN的主要目的是缓解症状和疼痛管理[5],针对DPN的疼痛管理,主要应用抗抑郁药物、抗惊厥药物和阿片类镇痛药物,通过抗氧化应激、改善微循环、纠正代谢紊乱、营养神经、缓解疼痛等机制减轻DPN症状。临床上大多数被批准用于治疗DPN的药物如硫辛酸、依帕司他、阿米替林、丙米嗪、加巴喷丁等,虽能有效减轻疼痛,但存在作用途径单一、耐药性差,容易出现头晕、嗜睡、恶心、失眠、视力模糊等不良反应。此外,目前没有新的治疗疼痛性DPN的疗法被批准,临床最有效的一线药物或联合用药尚不清楚[6]。因此,寻找新的治疗DPN的药物刻不容缓。黄芪桂枝五物汤(Huangqi Guizhi Wuwu Decoction,HGD)作为经典名方之一,由黄芪、桂枝、芍药、生姜、大枣组成,具有益气活血、和营通脉的疗效[7],对缓解DPN引起的疼痛、麻木等症状疗效显著,被广泛用于DPN的治疗,具有良好的研究价值和发展前景。本文就DPN的发病机制、HGD治疗DPN的药效基础、临床研究及作用机制进行综述,为HGD治疗DPN的临床应用提供科学依据和理论基础。 1 DPN的发病机制DPN是糖尿病患者常见的严重并发症之一,目前其发病机制尚未完全明确,是由多种病理因素相互作用的结果。以高血糖参与的异常代谢通路为基础,包括多元醇通路、AGEs堆积、己糖胺通路、蛋白激酶C(protein kinase C,PKC)信号通路、内质网应激等[8],这些异常的代谢通路可引起炎症反应、血管内皮增生、神经纤维损伤、破坏线粒体稳态,产生大量活性氧和活性氮自由基,导致氧化应激反应,造成组织损伤。此外活性氧的增加还会激活聚腺苷二磷酸-核糖聚合酶(poly ADP-ribose polymerase,PARP)信号通路,导致神经血管损伤,诱发氧化应激,而氧化应激又会对通路形成正反馈,造成恶性循环。除了高血糖引起的异常代谢通路外,脂代谢异常、神经生长因子(nerve growth factor,NGF)及神经营养不足、胰岛素抵抗等[9]也与DPN的发生发展密切相关。研究发现,糖尿病患者血浆游离饱和脂肪酸的浓度通常会升高,而长链饱和脂肪酸,如棕榈酸酯和硬脂酸酯,会阻碍线粒体的功能及其运输,导致感觉背根神经节的神经元凋亡[10]。脂代谢异常会生成二酰甘油,刺激多元醇通路和PKC通路,细胞内的游离脂肪酸还能够激活核因子-κB(nuclear factor-κB,NF-κB),诱发炎症反应,刺激产生活性氧,破坏线粒体,加剧氧化应激反应[11]。NGF能促进中枢和外周神经元的生长、发育、分化、成熟,维持神经系统的正常功能,加快神经系统损伤后的修复[12]。有研究发现,在糖尿病动物皮肤中,NGF的产生受到抑制[13]。胰岛素信号传导也可能是引起DPN的原因之一,胰岛素不仅是一种激素,同时也是一种具有神经营养作用的神经保护因子[14]。炎症反应主要通过释放炎症因子参与DPN的发生和发展,细胞间黏附因子促进白细胞的迁移和活化,在趋化因子的影响下,单核细胞和巨噬细胞等吞噬细胞到达DPN受损组织并激活,然后分泌包括白细胞介素(interleukin,IL)在内的多种炎性因子,如IL-1β、IL-6和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等[15]。这3种炎症因子可以影响DPN神经损伤,破坏雪旺细胞与轴突之间的沟通[16-17],DPN的发生和严重程度与TNF-α在内的炎症因子相关联,炎症因子参与疼痛和痛觉过敏的产生,并增加血神经屏障的渗透性,将TNF-α注射到坐骨神经可诱导炎症性脱髓鞘或轴索变性[18]。氧化应激被认为是导致DPN多种代谢途径受损的共同引发因素,大量研究表明高血糖可导致氧化应激的产生,并对周围神经中的神经元和雪旺细胞产生损伤[19]。引发氧化应激的原因是活性氧的过量产生,氧化还原平衡被打破导致抗氧化系统失调[20],最终造成组织损伤。高血糖引起的异常代谢通路:多元醇通路、AGEs通路、PARP通路等最终都会引起细胞内氧化应激反应,多元醇通路和PARP通路中消耗了大量的还原性辅酶,导致胞内活性氧清除能力不足,AGEs代谢过程中产生大量活性氧,导致氧化应激反应。综上,DPN的发病机制十分复杂,其病理生理学的核心是神经代谢受损和生物能衰竭[9],高血糖及异常代谢通路、胰岛素抵抗、脂代谢异常、NGF缺失、炎症反应、氧化应激等机制相互影响,造成恶性循环,损伤周围神经组织,最终导致DPN的发生。 2 HGD治疗DPN的方证基础和药效基础2.1 方证基础在中医理论中并未记载DPN病名,但根据其肢体麻木、疼痛等症状可归属于中医“痹证”“痛证”“痿痹”等范畴[21]。《素问奇病论》中提出“此肥美之所发也,此人必数食甘美而多肥也。肥者令人内热,甘者令人中满,故其气上溢,转为消渴。”消渴患者病因多为饮食不节、情志失调等,燥热内盛,煎熬阴液,气血滞而不行。《黄帝内经素问痹论》[22]曰:“病久入深,荣卫之行涩,经络时疏,故不痛,皮肤不营,故为不仁。”消渴日久,但见手足麻木,肢体如冰。DPN病机多因消渴日久,气阴损耗,阴虚邪热内生,精华内涸,导致血气凝滞,络脉不通,不能外输四肢而发病,属本虚标实,瘀血贯穿了疾病的始终。倪青教授认为,该病主要病机可总结为虚、瘀,虚即气阴亏虚,瘀为瘀血阻络,因虚致瘀,虚瘀相兼,虚为本,瘀为标,贯穿DPN的始终[23]。仝小林院士认为DPN属于糖尿病“郁、热、虚、损”4大阶段中的虚、损阶段,脏腑热、经络寒,总以脾虚为本,通补兼施、寒热并用是仝院士辨治DPN的治疗大法[24]。《素问逆调论》[22]云:“营气虚则不仁,卫气虚则不用。”肌肉筋骨失于濡养,故见手足麻木、感觉减退,犹如风痹之状;气阴两虚迁延不愈,阴损及阳,阳虚失煦,故四肢厥冷;气血阴阳俱虚,血行缓滞因热成瘀,痹阻脉络,不通则痛,故见皮肤肌肉刺痛,入夜尤甚;久病肝肾脾胃虚弱,聚湿成痰,痰瘀互结,肢体脉络失荣,故见肌肉日渐萎缩、软弱无力。张仲景在《金匮要略》中对血痹虚劳进行了论述,认为血痹、虚劳都是由于气血不足引起的慢性虚损性疾病,因此,DPN与血痹虚劳具有相关性[25]。HGD出自《金匮要略血痹虚劳病脉证治篇》,是治疗素体营卫不足,外受风邪所致血痹的常用方。方中黄芪补气,为君药。桂枝既能扶助卫阳以祛风邪,又能温通血脉以行血滞,与黄芪相伍,共奏益气扶阳,和血通痹之效。芍药养血,与桂枝相伍,共奏调和营卫,和血通痹之效,2药共为臣药。生姜、大枣养血益气,助芪、芍之力,又能调和营卫,扶阳祛风,共为佐使。诸药相伍,共奏补气温阳,和血通痹之功。2.2 药效基础现代药理实验证明,HGD的主要活性成分为黄酮类和苷类,如毛蕊异黄酮葡萄糖苷、毛蕊异黄酮和刺芒柄花素,可促进胰岛素释放而发挥降糖作用[26]。网络药理学预测HGD可以通过抗氧化应激、抗炎、阻止胆碱能神经信号传递、降低内质网应激水平等[27],直接或间接地发挥保护神经纤维、减轻疼痛、促进能量代谢及神经修复的作用。黄芪性甘,微温,有敛疮生肌、益卫固表、补气升阳的作用[28]。药理实验和临床研究表明,黄芪在抗炎、抗氧化、改善微循环、降血糖、增强免疫等方面疗效显著[29-31]。黄芪皂苷IV是黄芪的主要活性成分之一,《中国药典》2020年版将黄芪皂苷IV确定为黄芪质量控制的重要指标。研究发现,黄芪皂苷IV 24 mg/kg可有效提高DPN大鼠腓总神经运动传导速度,降低血糖浓度和糖化血红蛋白(glycosylated hemoglobin,GHb)水平,减少神经细胞中AGEs的积累,从而有效抑制DPN大鼠有髓纤维面积的减少和节段性脱髓鞘的增加[32]。Yin等[33]通过构建DPN大鼠模型和DPN雪旺细胞损伤模型发现,黄芪皂苷IV 80 mg/kg能够通过增强自噬,减轻雪旺细胞凋亡引起的DPN髓鞘损伤,改善神经功能。Ben等[34]应用黄芪皂苷IV 60 mg/kg连续12周干预DPN大鼠模型,发现黄芪皂苷IV能够改善DPN大鼠背根神经节中线粒体的损伤,显著减少DPN大鼠的机械性异常疼痛,提示黄芪皂苷IV在治疗DPN中有着巨大潜力。桂枝具有散寒解表、温通经脉的功效,临床常用于镇痛、抑菌、抗过敏及促进血管舒张、抗血小板聚集等[35-36]。目前DPN的发病机制被认为与胰岛素缺乏或胰岛素抵抗、高血糖和血脂异常有关[6],桂枝提取物不仅具有降血糖的作用[37-38],还可以减少肠道对胆固醇和脂肪酸的吸收[39]。现代药理研究发现,桂枝主要含有挥发油类和有机酸类化合物成分[40],其中挥发油中的主要药效成分为肉桂醛。Chun等[41]通过构建肉桂醛调控的编码基因对周围神经变性影响的生物信息学分析发现,肉桂醛能够通过影响雪旺细胞氧化应激反应而抑制周围神经变性。背根神经节神经元对高葡萄糖浓度应激的易感性与DPN的发生发展有关,是DPN损伤的靶细胞[42]。Shi等[43]通过构建高糖诱导的背根神经节神经元细胞模型发现,肉桂醛100 nmol/L能够通过抑制NF-κB通路,从而起到保护背根神经节神经元作用,减少细胞凋亡。另有研究发现,肉桂醛20、40 mg/kg可显著降低糖尿病大鼠的血糖水平,逆转糖尿病大鼠的神经炎症反应和神经递质水平的变化,提示肉桂醛在防治DPN方面具有巨大潜力[44]。现代药理研究发现,白芍化学成分主要有单萜及其苷类、三萜类、黄酮类等,具有抗炎、镇痛、抗血栓、抗氧化、降血糖等作用[45-46]。Huang等[47]通过大鼠坐骨神经受损实验发现,白芍提取物能显著增强神经突起的生长及其生长相关蛋白和突触素的表达,有助于促进周围神经再生,提示白芍提取物可能是一种潜在的神经生长促进因子。《中国药典》2020年版中将芍药苷定量控制作为对白芍的含量测定项,表明芍药苷是白芍的重要质量标志物。研究发现,芍药苷100 μmol/L具有显著的抗氧化应激作用,可以通过激活核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)/抗氧化反应元件(antioxidant response element,ARE)信号通路保护雪旺细胞免受高糖诱导的氧化损伤[48]。朱晏伯等[49]通过观察芍药苷对高糖环境下雪旺细胞线粒体动力学的影响,发现芍药苷100 μmol/L能促进高糖环境下雪旺细胞线粒体融合,降低分裂,维持线粒体动力学平衡,改善线粒体形态与功能,降低雪旺细胞凋亡。邢琪昌等[50]构建了芍药苷-疾病-靶点网络分析,结果得出芍药苷具有降血糖、抗氧化、减轻神经炎症和疼痛等功效,在治疗DPN中具有潜在的应用价值。生姜是一种广泛使用的药食同源类中药,具有辛温解表、温里散寒的功效[51],现代药理研究表明生姜具有抗炎镇痛、抗糖尿病、增强免疫力等作用[52]。生姜可通过促进外周血葡萄糖的利用,纠正受损的肝肾糖酵解,限制糖异生物质的形成,从而有效地控制组织糖原含量[53]。此外,炎症反应与DPN的发生发展密切相关[54],生姜提取物还能够显著抑制炎性因子IL-6和TNF-α的表达,减轻白细胞浸润或水肿的形成,起到保护神经的作用[55]。Shen等[56]通过构建DPN大鼠模型,并用生姜提取物进行治疗,发现生姜提取物不仅可以减轻疼痛,还可以调节DPN大鼠肠道菌群微生物的组成,表明生姜提取物靶向肠道微生物群可能是治疗DPN的一种新治疗策略。6-姜烯酚是生姜中的重要生物活性化合物之一[57],已广泛用于治疗多种疾病。Nurrochmad等[58]研究发现,6-姜烯酚15 mg/kg和生姜提取物400 mg/kg能够降低血糖,减轻糖尿病神经疼痛小鼠模型的热痛和机械疼痛,减轻坐骨神经微结构受损程度,提示6-姜烯酚和生姜提取物对糖尿病神经疼痛小鼠具有抗痛觉过敏和神经保护作用。大枣具有增强免疫、抗氧化的功效[59]。小胶质细胞激活介导的神经炎症在DPN神经病理性疼痛中起着重要作用[60]。大枣提取物对小胶质细胞的激活有抑制作用,可减轻小胶质细胞一氧化氮释放的增加,同时降低促炎因子IL-6、IL-1β和TNF-α的表达,改善神经性疼痛[61]。另有研究证实,大枣提取物还能促进神经末梢乙酰胆碱释放,刺激胰腺细胞促进胰岛素释放,起到降低血糖的作用[62]。Kaeidi等[63]将大鼠肾上腺嗜铬细胞瘤PC12细胞作为DPN体外模型,研究大枣提取物对PC12细胞中葡萄糖诱导的神经毒性的神经保护作用,发现大枣提取物300 μg/mL可降低高葡萄糖诱导的细胞毒性,并阻止活性氧的生成,抑制神经细胞凋亡,表明大枣提取物具有减轻DPN的治疗潜力。上述研究为阐明HGD是治疗DPN的标准方剂提供了有力证据。药效基础研究发现,5味中药能够通过降血糖、抗炎、抗氧化、修复受损神经、调节肠道微生物群、改善线粒体形态与功能等多种途径防治DPN的发生发展。然而关于HGD全方治疗DPN的研究尚缺乏相关模型的入血成分、药动学分析,因此利用现有中药分析技术明确其药效物质基础,特别是HGD体内外化学成分分析及量效关系研究,在治疗DPN方面具有重要意义。3 HGD治疗DPN的临床研究近年来,临床研究证明使用HGD可有效治疗DPN,通过增减药味,或联合化学药、其他方剂及外用疗法,达到治疗疾病,改善患者生活质量的目标。3.1 原方应用在临床治疗治疗中,因为患者年龄、病程、症状严重程度等不同,所以直接采用原方剂量治疗的案例比较少。胡宗华[64]将90例DPN患者分为对照组和观察组,对照组给予甲钴胺片治疗,观察组给予HGD治疗,结果显示观察组空腹血糖、餐后血糖、血液流变学指标均低于对照组。雷琳丽[65]应用HGD治疗DPN患者发现,HGD组空腹血糖、感觉神经传导速度、下肢振动感觉阈值均优于甲钴胺组,总有效率达93.33%。这2项临床研究表明HGD对于缓解DPN患者的血糖及症状方面效果显著。3.2 复方加减联合化学药HGD加减和甲钴胺联合应用,可明显改善患者四肢麻木、烧灼、疼痛、针刺感等临床症状[66],降低血清TNF-α炎性因子,提高超氧化物歧化酶水平[67]。HGD加减与盐酸法舒地尔注射液组合可以降低DPN患者空腹血糖、餐后2 h血糖、HbA1c、总胆固醇等指标,显著改善感觉神经传导速度和运动神经传导速度[68]。在一项为期12周治疗DPN的研究中[69],HGD、依帕司他、长春西汀注射液三者联合治疗,周围神经传导速度显著提高,中医证候积分较治疗前显著降低且优于对照组,血糖得到明显改善。根据以上临床研究,发现HGD加减联合化学药可有效降低患者血糖水平,抑制炎症反应发生及发展,改善氧化应激,减轻麻木、疼痛等临床症状,进而提升了患者的生活质量。可总结以下用药加减规律:若舌脉以血瘀为主,临床症状以刺痛为主,则加用当归、川芎、桃仁、三七等活血类药物;若患者肢体疼痛以刺痛且有定处为主,则加用鸡血藤、红花、牛膝、丹参等活血祛瘀止痛类药物;若患者肢体疼痛加重,出现入夜痛甚,则加用全蝎、地龙、没药、乳香等以痛经活络消痹止痛;若患者肢体出现水肿,则加用苍术、薏苡仁、木瓜等利水除湿、通络除痹。目前常用的化学药有甲钴胺、依帕司他、阿司匹林肠溶片、盐酸法舒地尔等药物。见表1。图片3.3 复方加减联合其他方剂相比于单独应用和联合化学药应用,HGD联合当归四逆汤、补阳还五汤、桃红四物汤等方剂治疗DPN,也取得良好的疗效。HGD联合当归四逆汤治疗DPN患者后,患者肢体冰冷、疼痛和麻木等临床症状大幅减轻,神经系统反射基本恢复正常[79],患者肢体血流速度得到改善[80]。HGD和补阳还五汤组合治疗总有效率达92%,临床症状明显缓解,神经传导速度增幅较高,密歇根糖尿病审计病变积分明显低于对照组[81]。连珍珍等[82]应用HGD合桃红四物汤加减治疗DPN研究显示,患者治疗前后血糖、HbA1c、中医证候积分、密歇根糖尿病审计病变积分、神经传导速度均有好转。当归四逆汤温经散寒、养血通脉,主治血虚寒厥证。补阳还五汤具有补气、助阳、通络化瘀的功效,主治气虚血瘀之证。桃红四物汤养血活血,主治血虚兼血瘀证。HGD联合补阳还五汤、当归四逆汤、桃红四物汤等方剂治疗DPN,能够有效减轻患者肢体冰冷、疼痛麻木等临床症状,改善神经传导速度,降低血糖。DPN的病因病机复杂多样,但以虚为本、瘀为标,肌肉筋骨失于濡养,致使手足麻木、厥冷、痹阻脉络、不通则痛。因此在临床治疗中,应补气补血补阳、活血化瘀通络。3.4 复方加减联合针灸在临床中,HGD还可以联合针灸治疗DPN。在孟凡冰等[83]的临床研究中,服用HGD,同时联合针灸治疗,血液黏度、多伦多临床评分均下降,神经传导速度也显著提升。赵荣等[84]研究发现,经HGD联合针灸治疗DPN后,患者肢体麻木、疼痛、无力的症状明显好转,中医证候积分量表较治疗前下降,对比患者治疗前后血常规、肝肾功能、心电图指标,差异无统计学意义,表明HGD联合针灸治疗DPN临床疗效确切且安全性较高。相较于单用HGD加减治疗,联用针灸后,临床症状缓解方面疗效更佳。部分穴位如三阴交、太溪和内关穴下有神经走行,针灸针对神经直接刺激后,可明显提高对神经功能的良性调节作用。四肢关节以下的腧穴,如足三里、三阴交、曲池、内关等,能够起到疏通局部经络气血的作用。针对DPN的关键病机,辅以关元穴、肾俞穴、胰俞穴、脾俞穴等,能达到补虚培元、调和脏腑的功效。见表2。图片3.5 复方加减联合其他疗法此外,HGD还可以联合中药足浴、穴位敷贴、高压氧等疗法共同治疗DPN。一项临床实验显示[91],口服HGD联合中药足浴(丹参、艾叶、红花、凤仙透骨草、皂角刺各20 g,肉桂、川椒各10 g),临床疗效优于对照组。HGD配合涌泉穴穴位贴敷治疗DPN后,患者全血高切比黏度、全血低切比黏度、血浆黏度水平均明显下降,有效改善了患者的血糖水平[92]。以上临床实验表明,HGD治疗DPN效果显著,有单独应用、联合化学药、针灸、中药足浴和穴位贴敷等用法,有效改善DPN患者糖脂代谢、血液流变学,降低患者血糖水平、氧化应激指标,抑制炎症反应,降低中医证候积分,提高神经传导速度,减轻DPN患者疼痛、麻木、四肢厥冷等临床症状。4 HGD治疗DPN的机制研究4.1 降低血糖,改善糖脂代谢高血糖是糖尿病前期、糖尿病前期神经病变、DPN的主要危险因素[93],不仅会直接损伤神经,其介导的多种异常代谢途径,如多元醇通路、AGEs通路、己糖胺通路,会通过激活炎症反应、氧化应激、线粒体功能障碍等造成神经屏障破坏、周围微血管损伤,最终累及神经。除高血糖激活的异常代谢途径,最近的研究表明血脂异常也在DPN发生发展中起着重要作用[11]。刘曼曼等[94]研究发现HGD可有效降低DPN患者空腹血糖、餐后2 h血糖、HbA1c,患者肢体神经传导速度、麻、凉、痛等症状得到改善。林云梅等[95]采用HGD治疗DPN患者,检测患者血糖、血脂水平发现,治疗组空腹血糖、餐后2 h血糖、总胆固醇、三酰甘油、低密度脂蛋白胆固醇均显著下降。这2项研究表明HGD能够有效调节DPN患者机体血糖、血脂水平,改善受损神经组织。4.2 抑制异常代谢通路4.2.1 抑制AGEs通路 在糖尿病患者中,神经组织被过度糖化,导致蛋白质、脂质、核酸等与还原糖类发生非酶促反应生成AGEs[96]。糖尿病患者皮肤和周围神经存在大量AGEs,特别是神经元、雪旺细胞、神经内膜和神经外膜微血管中[97]。AGEs与晚期糖基化终产物受体(receptor for advanced glycationend products,RAGE)结合后引起内皮功能障碍、氧化应激和促炎信号的传导[98]。方颖等[99]通过高脂饲养联合ip链脲佐菌素建立DPN大鼠模型,经HGD干预后,发现DPN大鼠血清IL-1β、TNF-α炎症因子的含量显著降低,其作用机制可能与减少AGEs蓄积,阻断AGEs/RAGE/NF-κB信号有关。4.2.2 调节内质网应激,抑制细胞凋亡 高血糖能够扰乱蛋白质稳态并上调未折叠的坐骨神经蛋白[100],而内质网腔内未折叠或错误折叠蛋白的积累会诱导内质网应激[101],最终激活环磷酸腺苷反应元件结合转录因子同源蛋白(C/EBP-homologous protein,Chop)导致细胞凋亡[102]。张岩等[103-104]通过构建DPN大鼠模型发现,经HGD组干预后,DPN大鼠Chop蛋白表达显著降低,HGD可以通过调节内质网应激途径抑制细胞凋亡。此外,HGD还能够显著降低坐骨神经细胞凋亡相关B细胞淋巴瘤-2相关X蛋白和半胱氨酸天冬氨酸蛋白酶-12蛋白的表达,抑制坐骨神经细胞凋亡并改善和修复糖尿病大鼠坐骨神经损伤。内质网应激介导Chop凋亡蛋白的同时,也激活了c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)[105],JNK可以抑制髓鞘蛋白的产生,诱导雪旺细胞去分化,从而导致脱髓鞘和神经损伤的发生[106]。肖凡等[107]研究发现,HGD给药组DPN小鼠神经纤维和髓鞘出现再生,空腹血糖、鼠尾热痛觉敏感程度、坐骨神经传导速度、坐骨神经组织病理状态均显著优于模型组,JNK蛋白表达也显著减少,推测HGD可能通过抑制内质网应激水平来改善DPN大鼠坐骨神经功能、减轻坐骨神经组织损伤。4.3 抗炎镇痛DPN与炎症反应密切相关,炎症标志物的水平可以预测DPN的发生和发展[108]。多项临床研究证明,HGD可以有效降低IL-6、TNF-α等炎症因子水平,改善神经传导速度[109-110]。miR-146a是一种短链非编码RNA分子,miR-146a与糖尿病慢性并发症间存在独立的负相关关系[111],在长期高血糖的情况下,miR-146a的表达下降,NF-κB的抑制减弱,导致IL-1β和TNF-α炎性因子表达水平升高[112]。郭咏梅等[113]研究发现,HGD可以上调DPN大鼠模型miR-146a基因表达,降低DPN大鼠血清中炎症因子IL-1β和TNF-α水平,以及机械痛阈值,提高神经传导速度,推断HGD治疗DPN的机制与抑制炎症反应有关。周雯等[114]研究发现,HGD能够呈剂量相关性降低DPN大鼠血清IL-1β、TNF-α水平,减轻周围神经组织炎症损伤。4.4 抗氧化应激氧化应激被认为是导致DPN多种代谢途径受损的共同引发因素,过多的活性氧除造成轴突变性外,还会导致神经纤维的功能减退,与DPN的发生发展密切相关[115]。经HGD干预后DPN大鼠血糖、丙二醛水平显著下降,血清谷胱甘肽水平升高,提示HGD具有抗氧化作用[116]。硫氧还蛋白(thioredoxin,Trx)是一种广泛存在于生物体内的氧化还原调节蛋白,不仅可以通过清除活性氧来抵抗细胞内的氧化应激,还可以作为一种生长因子促进细胞的生长[117],而硫氧还蛋白互作蛋白(thioredoxin-interacting protein,TXNIP)是Trx的生理抑制剂,能下调Trx表达。张文娓等[118]通过研究HGD对DPN大鼠周围神经组织Trx及TXNIP表达的影响,发现HGD可明显提高Trx的表达,降低TXNIP的表达,进一步表明HGD可通过抗氧化应激来治疗DPN。4.5 营养神经修复NGF在外周神经纤维重建和中枢神经系统的营养维持中具有重要作用[119],有研究发现NGF可明显缩短神经再生长和髓鞘再生时间[120]。多项实验研究表明HGD可有效改善DPN大鼠坐

HPLC法测定防己黄芪方中粉防己碱的含量摘 要目的 建立HPLC法测定防己黄芪方中粉防己碱的含量的方法。方法 采用Hypersil BDS C18色谱柱(4.6mm×200mm,5µm)。流动相为甲醇:水(含0.03%二乙胺)=80:20,柱温30℃,流速1.0mL/min,检测波长282nm。结果 粉防己碱在6.25µg·mL-1~200µg·mL-1呈良好的线性关系(r = 0.9993),平均回收率为94.4%,RSD = 1.6%,三种方法测定防己黄芪方中粉防己碱的含量分别为0.506mg·mL-1 ,0.424mg·mL-1 和0.541 mg·mL-1 。结论 本法简便,准确,重现性好,可作为防己黄芪方中粉防己碱的含量测定方法。关键词:防己黄芪汤;粉防己碱;HPLC ;含量测定Determination of Tetrandrine in Stephania andAstragalus Combination by HPLCABSTRACTObjective: To establish a HPLC method for the determination oftetrandrine in Stephania and Astragalus Combination Method : A Hypersil BDS C18 chromatographic column (4.6mm×200mm,5µm)served as the solid phase;methanol-water(80:20)(0.03% diethylamine) was used as the mobile phase;the column temperature was at 30℃;the flow rate,1.0ml/min;UV detection wavelength[fo
黄芪中重金属的来源有内源和外源两个方面。内源如黄芪的生长环境条件(大气、土壤、水、化肥和农药的施用等)和黄芪对重金属的吸收富集能力;外源如黄芪后期仓储污染和加工污染。内源中药材黄芪在种植期间会富集土壤、环境中的重金属。重金属作为地壳的构成物质,在不同地域土壤中有不同种类和含量。研究表明,不同地域的黄芪中重金属的含量存在较大差异,并且黄芪中的重金属含量与其在土壤中含量呈现较强的正相关。因此,种植土壤中的重金属类别和含量对黄芪中重金属有直接的关系。随着工业的发展,工业“三废”(废水、废气、废渣)对中药材有着直接和间接的污染。含有重金属元素的工业废水、废渣通过灌溉农田,使重金属元素沉积和富集在土壤中,间接地加重了药材的污染。工业的废气中含有多种有害物质,如钢铁厂的烟尘中含有铅、镉、汞、砷等重金属,废气排放后沉降到植物叶面,被植物茎叶吸收从而造成污染。为防治药材病虫害喷晒的农药中含有砷、汞、铜、铅等重金属元素,这些重金属通过农药喷洒到药材植物叶面,经过药物代谢运转到植物内部,导致药材污染。药用植物栽培过程中往往需要施用化肥,但是化肥生产过程中可能混入重金属元素。施肥后重金属在土壤中积累,通过黄芪根茎吸收从而造成重金属污染。此外,与黄芪的本身对重金属的吸收和富集能力有关,影响因素包括黄芪的种类、栽培方式、生长周期、重金属的种类和重金属的作用部位等。外源中药材仓储过程中,为防治霉变、虫害和鼠害,通常使用硫磺熏蒸黄芪,也会引入As、Pb等有毒重金属。在黄芪加工炮制过程(清洗、打粉或切片、加工、包装等工序生产环节)中由于器具含有重金属元素可能会造成重金属二次污染。

【作者】 刘近荣;【机构】 山西泰盛制药有限公司;【摘要】 目的建立以高效液相色谱法测定黄芪总皂苷氯化钠注射液中黄芪甲苷含量的方法。方法色谱柱为DiamonsilC18(5μm,4.6×250mm),流动相为乙腈-水(36:64),流速为0.8ml/min,柱温为室温。结果黄芪甲苷进样量在5μg~40μg范围内与峰面积积分值线性关系良好(r=0.9993,n=5),平均加样回收率为99.75%(RSD=0.57%)。结论本方法测定结果准确、操作简便、灵敏度高、重复性好,可用于本品的质量控制。 更多还原http://ng1.17img.cn/bbsfiles/images/2012/08/201208131255_383443_2379123_3.jpg
维权声明:本文为yhc2004原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现均属侵权违法行为,我们将追究法律责任。有机氯农药是一类高效广谱杀虫剂,曾在世界各国广泛使用。我国虽已在1983年停止使用这类农药,但由于它具有化学性质稳定、不易分解,并通过生物链富集在动植物体内,造成了对自然环境的严重污染及对人体健康的极大危害。中药材种植期一般较长,尤其是多年生根类药材,更易受到有机氯农药的污染。我国中药材中的农药残留的污染,是造成中药材质量下降的重要原因,已成为制约我国中药材走向国际市场的主要障碍。因此,中药材中农药残留问题已经引起了国内外的普遍关注,建立和完善中药材中有机氯农药残留量的检测方法十分必要。 黄芪药材为豆科植物蒙古黄芪或膜荚黄芪的干燥根。呈圆柱形,表面淡棕黄色或淡棕褐色,有不整齐的纵皱纹或纵沟。质硬而韧,不易折断,断面纤维性强,并显粉性,皮部黄白色,木部淡黄色,具放射状纹理及裂隙,呈“菊花心状”。气微,味微甜。嚼之有豆腥味。性温,味甘。具有补气固表,利尿,托毒,排脓,敛创生肌之功效。主产于山西、黑龙江、内蒙古等省区。以栽培的蒙古黄芪质量为佳。至今为止,对其中有机氯农药六六六、滴滴涕残留测定的研究未见报道。本文建立了黄芪药材中9种有机氯农药超声提取,毛细管气相色谱检测的方法,为提高传统中药的质量、建立和完善中药产品中有机氯类农药残留量的测定的方法提供依据。 1 仪器与试剂1.1 仪器 THGC-2001气相色谱仪,电子捕获检测器,弹性石英毛细管柱 30m×0.32mm×0.25μm。800型离心机。1.2 试剂 丙酮(分析纯),石油醚(沸程60~90℃,分析纯),二氯甲烷(分析纯)无水硫酸钠(分析纯)硫酸(分析纯)有机氯农药六六六(BHC)(α-BHC,β-BHC,γ-BHC,δ-BHC)、滴滴涕(DDT)(PP΄-DDE, PP΄-DDD ,OP΄ -DDT,PP΄-DDT)及五氯硝基苯(PCNB)标准品(农业部农药检定所)2 方法与结果2.1 对照品的制备2.1.1 对照品储备液的制备精密称取六六六(BHC)(α-BHC,β-BHC,γ-BHC,δ-BHC)、滴滴涕(DDT)(PP΄-DDE, PP΄-DDD ,OP΄ -DDT,PP΄-DDT)及五氯硝基苯(PCNB)农药对照品适量,用石油醚(60~90℃)分别制成每1ml约含4~5µg的溶液,即得2.1.2 混合对照品储备液的制备 精密量取上述各对照品储备液0.5ml,置10ml量瓶中,用石油醚(60~90℃)稀释至刻度,摇匀,即得。2.1.3 混合对照品溶液的制备 精密量取上述混合对照品储备液,用石油醚(60~90℃)制成每1L分别含0µg、1µg、5µg、10µg、50µg、100µg、250µg的溶液,即得。 2.2 色谱条件 弹性石英毛细管柱 30m×0.32mm×0.25μm;进样口温度230℃,检测器温度300℃,不分流进样;流速为28ml/min;程序
[b]1.[font=宋体]黄芪多糖的精制[/font][/b][font=宋体]取黄芪药材粉末约[/font]30.0 g[font=宋体],精密称定,加入石油醚([/font]60[font=宋体]~[/font]90 [font=宋体]℃[/font][font=宋体])[/font]100 mL[font=宋体]回流提取[/font]3[font=宋体]次,每次[/font]1 h[font=宋体],弃去提取液(除去脂溶性成分),药渣烘干,用[/font]70 %[font=宋体]乙醇[/font]150 mL[font=宋体]回流提取[/font]3[font=宋体]次,每次[/font]2 h[font=宋体]。弃去提取液(除单糖、低聚糖和苷类等小分子物质),药渣烘干,加蒸馏水[/font]200 mL[font=宋体]回流提取[/font]3[font=宋体]次,每次[/font]2 h[font=宋体]。合并提取液,减压浓缩至[/font]100 mL[font=宋体],即得粗多糖的水溶液。在粗多糖水溶液中加入[/font]Sevage[font=宋体]试剂(氯仿[/font][font=宋体]:[/font][font=宋体]正丁醇[/font] = 4[font=宋体]:[/font]l[font=宋体])[/font]10 mL[font=宋体],剧烈震荡[/font]20 min[font=宋体],使其充分混合,在[/font]4000 rpm[font=宋体]转速下离心[/font]5 min[font=宋体],弃去中间变性蛋白层和下层有机层,水相继续重复上述操作[/font]10[font=宋体]次,直至水相与有机相中间无变性蛋白出现为止,即得脱蛋白多糖水溶液。[/font][font=宋体]向脱蛋白多糖水溶液中加入[/font]5[font=宋体]倍量无水乙醇[/font]80mL[font=宋体](使溶液含醇量达[/font]80 %[font=宋体]以上),充分搅拌,静置过夜。在[/font]4000rpm[font=宋体]转速下离心[/font]5 min[font=宋体],弃去上清液,所得沉淀依次用无水乙醇、丙酮、无水乙醚[/font]20mL[font=宋体]各洗涤[/font]3[font=宋体]次,弃去有机溶剂后挥干沉淀,并用真空干燥机抽真空,[/font]60 [font=宋体]℃[/font][font=宋体]干燥[/font]12h[font=宋体],得到灰白色颗粒状多糖样品。[/font] [font=宋体]黄芪多糖精制的工艺流程图见图[/font]1[font=宋体]。[/font][align=center][img=,627,567]https://ng1.17img.cn/bbsfiles/images/2021/11/202111161201593536_221_3528941_3.gif!w627x567.jpg[/img][/align][align=center][b]Fig.1 The isolationprocedure of the polysaccharide in [i]Radix Astragali.[/i][/b][/align][b]2.[font=宋体]黄芪多糖的纯度检查[/font]2.1 Molish [font=宋体]试验[/font][/b][font=宋体]([/font]1[font=宋体])供试品溶液:取黄芪多糖[/font]2mg[font=宋体],加[/font]10mL [font=宋体]蒸馏水,微热使溶解,再加入[/font]α-[font=宋体]萘酚;[/font][font=宋体]([/font]2[font=宋体])[/font][font=宋体]阳性对照品溶液:取淀粉[/font]2 mg[font=宋体],加[/font]10 mL [font=宋体]蒸馏水,加热溶解,再加入[/font]α-[font=宋体]萘酚;[/font][font=宋体]([/font]3[font=宋体])[/font][font=宋体]阴性对照品溶液:[/font]10 mL [font=宋体]蒸馏水,加[/font]α-[font=宋体]萘酚。[/font][font=宋体]分别摇匀,将试管倾斜,沿试管壁慢慢加入浓硫酸,竖直试管观察。供试品溶液与阳性对照品溶液试管中呈紫堇色环,阴性对照品溶液试管界面无变化。结果表明供试品溶液为糖类。[/font][b]2.2 Fehling [font=宋体]试验[/font][/b] Fehling[font=宋体]试剂的配置:称取[/font]CuSO[sub]4[/sub][sup].[/sup]5H[sub]2[/sub]O7.28 g[font=宋体],[/font][font=宋体]加水至[/font]40 mL[font=宋体],[/font]0.1 mL [font=宋体]浓硫酸酸化,再加水至[/font]100 mL[font=宋体]作为甲液;称取酒石酸钾钠[/font]34.6 g[font=宋体],氢氧化钠[/font]14.2 g[font=宋体],加水至[/font]100mL [font=宋体]作为乙液。临用时将甲、乙液按[/font]1:1[font=宋体]混匀即可。[/font][font=宋体]([/font]1[font=宋体])[/font][font=宋体]供试品溶液:取黄芪多糖[/font]2 mg[font=宋体],加[/font]10 mL [font=宋体]蒸馏水,微热使溶解;[/font][font=宋体]([/font]2[font=宋体])[/font][font=宋体]阳性对照品溶液:取葡萄糖[/font]2mg[font=宋体],加[/font]10mL [font=宋体]蒸馏水,微热使溶解;[/font][font=宋体]([/font]3[font=宋体])[/font][font=宋体]阴性对照品溶液:[/font]10 mL [font=宋体]蒸馏水。[/font][font=宋体]分别加入[/font]Fehling[font=宋体]试剂,在[/font]70℃[font=宋体]水浴中加热[/font]10 min[font=宋体]。供试品溶液与阳性对照品溶液为蓝色,阴性对照品溶液变为砖红色。单糖与[/font]Fehling[font=宋体]试剂反应变为砖红色,而多糖为非还原性糖,不与[/font]Fehling[font=宋体]试剂反应,结果表明供试品中不含单糖。[/font][b]2.3[font=宋体]显色条件[/font][/b][font=宋体]总多糖的测定:精密量取对照品溶液或供试品溶液[/font]0.5mL[font=宋体]于具刻度试管中,加水补至[/font]1.0mL[font=宋体],再加入[/font]8%[font=宋体]苯酚溶液[/font]1.0mL[font=宋体],充分混匀后,加入浓硫酸[/font]5.0mL[font=宋体],[/font]60 ℃[font=宋体]水浴加热[/font]15 min[font=宋体],取出,冷却至室温后,于[/font]487nm[font=宋体]下测定吸光度,外标一点法测定多糖含量。[/font]
[align=center][b]HPLC法测定黄芪水提物中的毛蕊异黄酮苷含量[/b][/align][b]黄芪中的主要有效成分除皂苷外就是异黄酮类化合物。异黄酮类成分具有调节免疫、抗肿瘤、抗突变、抗氧化、抗炎、抗突变抗辐射、抗心肌缺血、抗心律失常、抗病毒、抗细胞凋亡、保肝、防止动脉粥样硬化等作用[sup][/sup],其代表成分就是毛蕊异黄酮 7-O-β-D 吡喃葡萄糖苷(即毛蕊异黄酮苷)。2010版药典才开始将毛蕊异黄酮苷收录为黄芪中有效成分含量测定项。本章实验借鉴药典中的测定方法,对不同工艺条件下获得的黄芪水提物中的毛蕊异黄酮苷含量进行考察,以期为优化芪龙胶囊和黄芪配方颗粒中黄芪的提取工艺参数提供科学基础和理论依据。[b]1 材料和仪器1.1 样品 [/b] 收集9组黄芪水提取物样品,黄芪饮片为济南济成堂中药饮片有限公司提供(批号18033101)。[b]1.2 试剂 [/b]毛蕊异黄酮苷对照品(成都瑞芬思生物科技有限公司批号M-020-170926),乙腈为色谱纯(天津市科密欧化学试剂有限公司);甲酸(天津市科密欧化学试剂有限公司);超纯水。[b]1.3 仪器 [/b]液相色谱系统,包括日本岛津公司LC-20AT型液相色谱仪,LC-20AT岛津输液泵,CTO-20A柱温箱,SIL-20A自动进样器,SPD-20A紫外-可见光检测器;超声波清洗机KS-300E(宁波科生仪器厂);电子天平MS205DU(梅特勒/瑞士)。[b]2 方法学考察2.1 色谱条件及系统适应性试验[/b]DiamonsiL(钻石)C18柱(250*4.6 mm,5 mm)。以乙腈为流动相A,0.2%甲酸溶液为流动相B,梯度洗脱,A相:0→20 min A为20→40%;20→30 min A保持40%;30→40 min A保持20%。检测波长260 nm;流速为1 mL/min;柱温35 ℃进样量为10 μL。毛蕊异黄酮苷对照品溶液以及黄芪水提物样品色谱图见图4-1与图4-2。[/b][align=center][img=,690,365]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131706005051_4964_3237657_3.png!w690x365.jpg[/img][/align][align=center]图4-1 毛蕊异黄酮苷对照品色谱图[/align][align=center][img=,690,384]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131706118782_6652_3237657_3.png!w690x384.jpg[/img][/align][align=center]图4-2 黄芪水提物样品色谱图[/align][b]2.2 供试品溶液的制备[/b]精密称定1/50重量的黄芪水提物样品(折合黄芪药材2 g)置于锥形瓶中,精密加入50 mL甲醇,超声30 min,过滤,将滤液放至水浴锅上蒸干,残渣用甲醇溶解,并定容至25 mL,用0.22 μm的微孔滤膜过滤,即得。[b]2.3 对照品储备溶液的制备[/b]精密称取黄芪甲苷标品5.10mg至10 mL容量瓶中,用甲醇溶解后定容,摇匀,即得浓度为0.51 mg/mL的对照品储备溶液。[b]3 结果3.1 线性关系考察[/b]精密吸取 2. 3 项下对照品储备溶液 4,2,1,0.5,0.25 mL至10 mL容量瓶中,用甲醇定容,得到浓度为204.00,102.00,51.00,25.50,12.75 μg/mL的对照品溶液。按“2.3”项下色谱条件分别进样10 μL,利用自动积分功能测定峰面积积分值,并以峰面积积分值与浓度进行线性回归。如图3,得回归方程为:Y =25445X + 44225(r[sup]2[/sup]= 0.9994)提示毛蕊异黄酮苷在12.75~204.00 μg/mL范围内线性关系良好。毛蕊异黄酮苷对照品标准曲线如图4-3所示。[align=center][img=,690,406]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131706302801_395_3237657_3.png!w690x406.jpg[/img][/align][align=center]图4-3 毛蕊异黄酮苷标准曲线[/align][b]3.2 精密度实验[/b]按2. 2 项下方法制备供试品溶液,精密吸取供试品溶液10 μL,重复进样 6 次,记录色谱图峰面积,测定毛蕊异黄酮苷含量,计算得相对标准偏差RSD为1.6% ,提示该方法精密度良好。[b]3.3 重复性实验[/b]取同一黄芪样品 6份,按“2. 2”项下方法制备供试品溶液,在拟定分析条件下,精密吸取供试品溶液10 μL,测定毛蕊异黄酮苷含量,计算得RSD为1.1%,提示该方法重复性良好。[b]3.4 稳定性实验 [/b]按2. 2 项下方法制备供试品溶液,分别在0 h、3 h、6 h、9 h、24 h、48 h后,准确吸取 10 μL 进样分析,测定毛蕊异黄酮苷含量,计算得 RSD 为 0.6%,提示黄芪供试品溶液在48h内稳定性良好。[b]3.5 加样回收率实验[/b]精密称取 6 份毛蕊异黄酮苷含量已知的黄芪水提物样品,每份折合黄芪药材 0. 5 g,分别准确加入样品中毛蕊异黄酮苷含量的50%,50%,100%,100%,150%,150%重量的毛蕊异黄酮苷标品,按2. 2 项下方法制备供试品溶液,准确吸取 10 μL 进样分析,测定毛蕊异黄酮苷含量,计算回收率,结果见表4-1。方法平均回收率为108.48%,表明该方法具有较好的回收率。[align=center]表4-1 毛蕊异黄酮苷加样回收率测定结果[/align] [table][tr][td] [align=center]样号[/align] [/td][td] [align=center]样品中的量/mg[/align] [/td][td] [align=center]加入量[/align] [align=center]/mg[/align] [/td][td] [align=center]测得量/mg[/align] [/td][td] [align=center]回收率[/align] [align=center]/%[/align] [/td][td] [align=center]平均值/%[/align] [/td][td] [align=center]RSD[/align] [align=center]/%[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]0.52 [/align] [/td][td] [align=center]1.64 [/align] [/td][td] [align=center]111.54 [/align] [/td][td=1,6] [align=center]108.85 [/align] [/td][td=1,6] [align=center]2.9 [/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]0.52 [/align] [/td][td] [align=center]1.64 [/align] [/td][td] [align=center]112.08 [/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]2.22 [/align] [/td][td] [align=center]109.20 [/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]2.24 [/align] [/td][td] [align=center]111.02 [/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]1.59 [/align] [/td][td] [align=center]2.72 [/align] [/td][td] [align=center]104.57 [/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]1.59 [/align] [/td][td] [align=center]2.72 [/align] [/td][td] [align=center]104.67 [/align] [/td][/tr][/table][b]3.6 毛蕊异黄酮苷的含量测定结果[/b]取9组黄芪水提物按照“2.2”项下操作,制备供试品溶液,准确吸取 10 μL 进样分析,测定毛蕊异黄酮苷的含量。结果见表2。[align=center]表4-2 9组黄芪水提物中毛蕊异黄酮苷含量测定结果[/align] [table][tr][td] [align=center]批号[/align] [/td][td] [align=center]峰面积[/align] [/td][td] [align=center]含量(mg/g)[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]1123989.50 [/align] [/td][td] [align=center]0.53 [/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]2707047.50 [/align] [/td][td] [align=center]1.31 [/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]1947171.50 [/align] [/td][td] [align=center]0.93 [/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]3573103.75 [/align] [/td][td] [align=center]1.73 [/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]1824562.00 [/align] [/td][td] [align=center]0.87 [/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]2767419.00 [/align] [/td][td] [align=center]1.34 [/align] [/td][/tr][tr][td] [align=center]7[/align] [/td][td] [align=center]2077551.50 [/align] [/td][td] [align=center]1.00 [/align] [/td][/tr][tr][td] [align=center]8[/align] [/td][td] [align=center]1677225.50 [/align] [/td][td] [align=center]0.80 [/align] [/td][/tr][tr][td] [align=center]9[/align] [/td][td] [align=center]1725416.00 [/align] [/td][td] [align=center]0.83 [/align] [/td][/tr][/table][b]3.7 毛蕊异黄酮苷转移率测定正交试验结果[/b]水提的毛蕊异黄酮苷转移率考察正交试验与水提的出膏率考察正交试验设计相同,即以水作为提取溶剂,把影响药材提取效果的用水量(A)、提取时间(B)、提取次数(C)确定为考察因素,以上三个考查因素各分3个水平考察,见表4-3。[align=center]表4-3水提实验因素水平表[/align] [table][tr][td=1,2] [align=center]水平[/align] [/td][td=3,1] [align=center]因素[/align] [/td][/tr][tr][td] [align=center]A(用水量/倍)[/align] [/td][td] [align=center]B(提取时间/h)[/align] [/td][td] [align=center]C(提取次数/次)[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]4[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]8[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]10[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][/tr][/table][b] [/b]毛蕊异黄酮苷转移率=各实验组黄芪提取物中毛蕊异黄酮苷含量/原黄芪药材中毛蕊异黄酮苷含量×100%。原药材中毛蕊异黄酮苷的含量按照药典的方法测得的结果为0.1425mg/g。跟据实验数据,得到水提实验中设定的不同工艺条件下的毛蕊异黄酮苷的转移率,其中因素D为误差项,作直观分析表和方差分析表,见表4-4,4-5。[align=center]表4-4 毛蕊异黄酮苷转移率考察L[sub]9[/sub](3[sup]4[/sup])正交试验表[/align] [table][tr][td] [align=center]批号[/align] [/td][td] [align=center]A[/align] [/td][td] [align=center]B[/align] [/td][td] [align=center]C[/align] [/td][td] [align=center]D[/align] [/td][td] [align=center]毛蕊异黄酮苷[/align] [align=center]转移率/%[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]37.21[/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]91.77[/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]65.58[/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]121.62[/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]61.36[/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]93.85[/align] [/td][/tr][tr][td] [align=center]7[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]70.08[/align] [/td][/tr][tr][td] [align=center]8[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]56.28[/align] [/td][/tr][tr][td] [align=center]9[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]57.94[/align] [/td][/tr][tr][td] [align=center]K1[/align] [/td][td] [align=center]194.56[/align] [/td][td] [align=center]228.91[/align] [/td][td] [align=center]187.34[/align] [/td][td] [align=center]156.51[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]K2[/align] [/td][td] [align=center]276.83[/align] [/td][td] [align=center]209.41[/align] [/td][td] [align=center]271.33[/align] [/td][td] [align=center]255.70[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]K3[/align] [/td][td] [align=center]184.30[/align] [/td][td] [align=center]217.37[/align] [/td][td] [align=center]197.02[/align] [/td][td] [align=center]243.48[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]优水平[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]R[/align] [/td][td] [align=center]92.53[/align] [/td][td] [align=center]19.50[/align] [/td][td] [align=center]83.99[/align] [/td][td] [align=center]99.19[/align] [/td][td] [align=center] [/align] [/td][/tr][/table][b] [/b][align=center]表4-5 毛蕊异黄酮苷转移率考察方差分析表[/align] [table][tr][td] [align=center]方差来源[/align] [/td][td] [align=center]离差平方和[/align] [/td][td] [align=center]自由度[/align] [/td][td] [align=center]F[/align] [/td][td] [align=center]显著性[/align] [/td][/tr][tr][td] [align=center]A[/align] [/td][td] [align=center]1715.05[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1.50[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]B[/align] [/td][td] [align=center]64.09[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]0.04[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]C[/align] [/td][td] [align=center]1407.78[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1.13[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]方差来源[/align] [/td][td] [align=center]离差平方和[/align] [/td][td] [align=center]自由度[/align] [/td][td] [align=center]F[/align] [/td][td] [align=center]显著性[/align] [/td][/tr][tr][td] [align=center]D [/align] [/td][td] [align=center]1950.20[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]-[/align] [/td][/tr][/table]注:F[sub]0.1[/sub](2,2)=9,F[sub]0.05[/sub](2,2)=19,*为有显著性,-为无显著性。从正交试验结果可知:水提实验中,各因素对毛蕊异黄酮苷转移率的影响大小顺序为:A(用水量)C(提取次数)B(提取时间);每个因素3水平之间的趋势为A[sub]2[/sub]A[sub]1[/sub]A[sub]3[/sub],B[sub]1[/sub]B[sub]3[/sub]B[sub]2[/sub],C[sub]2[/sub]C[sub]3[/sub]C[sub]1[/sub],直观分析得提取工艺为A[sub]2[/sub]B[sub]1[/sub]C[sub]2[/sub],即加水8倍量,提取2次,每次1h。表4-5的方差分析结果表明: A、B、C三因素的对毛蕊异黄酮的转移率影响都无统计学差异(PC(提取次数)B(提取时间);每个因素3水平之间的趋势为A[sub]2[/sub]A[sub]3[/sub]A[sub]1[/sub],B[sub]1[/sub]B[sub]3[/sub]B[sub]2[/sub],C[sub]2[/sub]C[sub]3[/sub]C[sub]1[/sub],直观分析得提取工艺为A[sub]2[/sub]B[sub]1[/sub]C2,即加水8倍量,提取2次,每次1h。表4-7的方差分析结果表明:A、B、C三因素对综合评分的影响都无统计学差异(P0.05)。[b]4 讨论[/b]本章实验借鉴药典中测定黄芪药材中毛蕊异黄酮苷含量的方法,利用紫外-可见光检测器的高效液相色谱仪测定黄芪水提物中毛蕊异黄酮苷的含量。与药典中方法测得的结果相比,本实验测得的结果除色谱峰分离度稍差外,其他方法学考察指标显示良好。从毛蕊异黄酮苷转移率测定正交试验结果来看,第4组实验毛蕊异黄酮苷转移率最高,这也是正交结果分析中最佳提取工艺,即加水8倍量,提取2次,每次1小时。本结果与上一章实验中第四组黄芪水提物中黄芪甲苷的转移率最高结果一致,但其他组别毛蕊异黄酮苷的转移率高低顺序与上一章黄芪甲苷的转移率高低顺序并不一致,这说明毛蕊异黄酮苷和黄芪甲苷对提取工艺的要求并不完全一致。同一种原药材,加工成不同功效的药物,那么发挥药效的物质也有可能不同,因此相应的提取工艺也是需要根据药效物质适时调整的。另外,用水量在设置的三个因素中对毛蕊异黄酮苷的转移率影响最大,但仍无统计学差异(P0.05),说明用水量、提取次数、提取时间三种工艺的改变对黄芪水提物中毛蕊异黄酮苷的含量无显著性影响。从综合评分计算正交试验结果来看,第4组实验综合评分最高,这也是正交结果分析中最佳提取工艺,即加水8倍量,提取2次,每次1小时。用水量在设置的三个因素中对综合评分影响最大,但仍无统计学差异(P0.05),说明用水量、提取次数、提取时间三种工艺的改变对黄芪水提工艺的综合评分无显著性影响。综合出膏率、黄芪甲苷和毛蕊异黄酮苷的含量得出综合评分来优选黄芪水提的最佳提取工艺,能够从化学成分的角度来客观全面地评价和研究黄芪水提的关键环节,这也为芪龙胶囊和黄芪配方颗粒水提环节工艺的优化提供借鉴和指导。[align=center] [/align][align=center]参考文献[/align] 陈建真,吕圭源, 叶磊, 等.黄芪黄酮的化学成分与药理作用研究进展. 医药导报, 2009, 28(10): 1314-1316. 赵四清,周日宝, 陈胜璜, 等.不同的产地加工方法对中药材金樱子质量的影响. 湖南中医学院学报, 2005, 25(3): 21-22.
液相质谱方法优化了很长时间,样品处理办法由开始的沉淀蛋白换成了液液萃取,还是在血浆中没有检测到。该化合物分子量为785.6,我的MRM是+,即807.6-627.5我看到文献有做成功的,可含量也很低Cmax=16ng,请问是黄芪甲苷在大鼠胃内被酸化了吗?还是有别的原因?灌胃液中含黄芪甲苷大于1mg/mL。[img=,555,239]https://ng1.17img.cn/bbsfiles/images/2019/03/201903211951256531_6859_3255306_3.jpg!w555x239.jpg[/img]